-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Aktuální pohled na udržovací terapii rituximabem („rituximab-maintenance“) u folikulárního lymfomu
Current view of the rituximab maintenance in follicular lymphoma
Rituximab, chimaeric anti-CD20 monoclonal antibody, improved significantly treatment results of CD20-positive non-Hodgkin’s lymphomas (NHLs) and has been rapidly incorporated in various combination chemotherapies as induction therapy for patients in the first-line and relapsed/refractory settings. Over the past few years it has been confirmed that rituximab maintenance is safe and effective in follicular lymphoma (FL) patients after induction with rituximab plus chemotherapy, chemotherapy alone, or rituximab monotherapy. The optimal dose, schedule and duration of rituximab maintenance therapy have not been defined yet. Recent data suggest rituximab maintenance can be safely administered for period of up to 2 years. All published maintenance schedules ranging from a single rituximab infusion 375 mg/m² every 3 months to 4x375 mg/m² weekly every 6 months have shown good and comparable effectiveness. Regarding treatment expenses, the important issue is rituximab maintenance versus retreatment upon relapse in the context of overall survival of follicular lymphoma patients.
Key words:
rituximab, maintenance, prognosis, follicular lymphoma
Autoři: A. Janíková; J. Mayer; Z. Král
Působiště autorů: Interní hematoonkologická klinika FN Brno a LF Masarykovy Univerzity, Brno
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 2, p. 79-85.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Rituximab, chimerická anti-CD20 monoklonální protilátka, přinesla velké zlepšení v léčbě CD20-pozitivních nehodgkinských lymfomů (NHL) a stala se standardní součástí léčby nově diagnostikovaných i relabovaných nemocných s B-NHL především v kombinaci s nejrůznějšími typy chemoterapie. V posledních letech byla ověřena účinnost a bezpečnost podání rituximabu u pacientů s folikulárním lymfomem (FL) i v udržovací léčbě po různých typech indukční terapie (rituximabem v monoterapii, chemoterapií nebo imunochemoterapií). Optimální dávkovací schéma stejně jako délka podávání udržovací léčby rituximabem nebyla dosud definována. V tuto chvíli lze říci, že poměrně bezpečné se jeví podání udržovací léčby rituximabem po dobu 2 let. Dobrý a srovnatelný klinický efekt vykazují různé dávkovací modely udržovací léčby v rozsahu od jedné infuze á 375 mg/m² opakované každé 3 měsíce až po dávku 4x375 mg/m² každých 6 měsíců. Vzhledem k nákladnosti léčby bude také důležité zhodnocení přínosu udržovací léčby rituximabem oproti opakované léčbě v době relapsu v kontextu celkového přežití pacientů s FL.
Klíčová slova:
rituximab, maintenance, prognóza, udržovací léčba, folikulární lymfomÚvod
Pokrok v terapii indolentních B-nehodgkinských lymfomů (NHL), z nichž jednoznačně nejčastěji zastoupeným je folikulární lymfom (FL), přinesl v posledních letech perspektivu lepšího a delšího přežití (1). Nicméně naprostá většina pacientů nadále zmírá v přímé souvislosti se základní diagnózou nebo nepřímo v důsledku toxicity léčby. Dosavadní údaje uvádějí obecný medián přežití u pacientů s FL kolem 6–9 let s tendencí mírného prodlužování za posledních 25 let (1–3). Navzdory tomu, že folikulární lymfom je onemocnění chemo - i radiosenzitivní s dosažením vysokého počtu léčebných odpovědí, pravidelně dochází k návratu choroby. Při relapsu se obvykle snižuje kvalita léčebné odpovědi, která ve svém důsledku znamená zkrácení mediánu přežití již v 1. relapsu na zhruba 4 roky (4). Asi 15–20 % pacientů podléhá transformaci do agresivního lymfomu s velmi špatnou prognózou. I když k transformaci folikulárního lymfomu může dojít kdykoli v průběhu trvání choroby, její pravděpodobnost vzrůstá v čase (5).
Pokud tedy dosud neexistuje spolehlivá kurativní terapie folikulárního lymfomu, je třeba obrátit pozornost k přístupům, které nejen prodlouží trvání remise a oddálí tak nutnost další léčby, ale také nebudou svoji vlastní toxicitou přispívat ke zkrácení celkového přežití pacientů.
Koncept udržovací terapie – „maintenance“
Udržovací léčba je termín obecně používaný pro pokračování protinádorové léčby po úspěšné indukční terapii s cílem udržet co nejdéle stav remise. Udržovací terapie je standardně využívána u řady onkologických onemocnění včetně hematologických malignit.
Myšlenka navodit delší remisi nebo dokonce vyléčit folikulární lymfom pomocí udržovací terapie se zrodila před desetiletími. Studie s udržovací léčbou cytotoxickými látkami u folikulárního lymfomu jsou publikovány od poloviny 80. let minulého století. V jedné randomizované studii byla srovnávána udržovací léčba polychemoterapií (BCVP= BCNU, cyklofosfamid, vinkristin, prednison) podaná každých 6 týdnů po dobu 18 měsíců oproti obser-vaci. Randomizováno bylo celkem 111 pacientů, kteří dosáhli po indukční terapii kompletní remise (CR). Udržovací léčba vedla k prodloužení doby bez progrese (PFS), avšak bez efektu na celkové přežití (6). V jiné studii byl srovnáván přínos udržovací léčby chlorambucilem oproti observaci u pacientů s různými indolentními NHL, kteří dosáhli remise po indukční léčbě CVP + radioterapii (cyklofosfamid, vinkristin, prednison). I v této práci byla prokázána lepší účinnost udržovací léčby v prodloužení PFS, avšak ani zde nebylo pozorováno prodloužení celkového přežití (7). Obecně lze konstatovat, že podání cytostatické udržovací léčby vedlo sice k oddálení relapsu, ale bez vlivu na celkové přežití nemocných. Jinými slovy zlepšení léčebných výsledků bylo dosaženo za cenu zvýšené toxicity, snížení kvality života a nárůstu rizika sekundárních malignit a myelodysplázií.
Několik klinických studií bylo zaměřeno také na využití interferonu -2α(IFN-2α) v udržovací léčbě indolentních NHL, výsledky však vedly k rozporuplným závěrům. Podle meta-analýzy nejvýznamnějších studií s udržovací terapií IFN-2α po intenzivní indukci byl prokázán lepší léčebný efekt udržovací léčby včetně prodloužení celkového přežití. Nicméně zisk z udržovací léčby byl signifikantní pouze v některých studiích, ale toxicita a špatná tolerance léčby byla pravidelně značná (8).
Rituximab
Rituximab (R) je první komerčně dostupnou mono - klonální protilátkou určenou k léčbě lymfomů. Jedná se o chimérický humanizovaný anti-CD20 imunoglobulin (IgG1) s myší komponentou ve variabilní oblasti. Mechanismus účinku rituximabu je mnohovrstevný a není v některých detailech ještě zcela objasněn. V současné době se za hlavní nositele účinnosti rituximabu pokládají v zásadě tři mechanismy: 1. komplementem zprostředkovaná cytolýza, 2. na protilátkách závislá cytotoxicita a 3. indukce apoptózy. Rituximab se díky své účinnosti v monoterapii a příznivému profilu nežádoucích účinků stal v posledním desetiletí průlomovým lékem v léčbě řady B-lymfoproliferací.
Původně byl rituximab podáván v monoterapii indolentních B-NHL, kde navodil léčebnou odpověď u zhruba 45–60 % pacientů avšak s relativně nízkým počtem kompletních remisí (9, 10). Rituximab projevil svoji účinnost zejména v kombinaci s chemoterapií, neboť s většinou cytostatických látek vykazuje synergismus (11). Několik prospektivních randomizovaných studií shodně prokazuje zlepšení léčebných výsledků, je-li rituximab podán současně s chemoterapií oproti samotné chemoterapii a sice u obou nejčastějších typů B-NHL – difuzního velkobuněčného lymfomu (DLBCL) a folikulárního lymfomu (FL) (12, 13). U FL bylo pozorováno významné zlepšení počtu i trvání léčebných odpovědí a prodloužení přežití po R-chemoterapii jak u nepředléčených tak u relabovaných pacientů (14–16).
Řada vlastností činí z rituximabu atraktivní lék pro dlouhodobou udržovací léčbu. Předně jeho podání je spojeno pouze s mírnými projevy akutní toxicity a velmi nízkou úrovní klinicky významné dlouhodobé toxicity. Ačkoli bylo v 90. letech minulého století publikováno několik zpráv o ztrátě CD20 antigenu po expozici rituximabem (17, 18), CD20 obvykle přetrvává na povrchu reziduálních buněk folikulárního lymfomu, což zaručuje účinnost rituximabu při opakovaném podání (19). Relativně dlouhý poločas rituximabu umožňuje málo časté podání udržovací léčby v ambulantním režimu, což je velmi příjemné pro pacienty. Navzdory nízké frekvenci podání je zajištěna dostatečná dlouhodobá koncentrace léku potřebná ke kontrole případné expanze reziduálních maligních buněk.
Cílem našeho přehledného článku je shrnout data klíčových studií zaměřených na udržovací léčbu rituximabem u folikulárního lymfomu. Ačkoliv některé z prací zahrnují i pacienty s jinými podtypy indolentních lymfomů, naprostá většina pacientů byla s FL. Tam, kde to bylo možné, jsme prezentovaná data omezili pouze na podskupinu pacientů s FL.
Rituximab v udržovací léčbě (= „rituximab-maintenance“) folikulárního lymfomu
Udržovací léčba rituximabem po indukční léčbě u pacientů s indolentními lymfomy byla hodnocena v několika větších randomizovaných studiích, jejichž přehled přináší tabulka 1, výsledky jsou podrobněji probrány v následujícím textu.
Tab. 1. Přehled nejvýznamnějších studií s udržovací léčbou rituximabem u folikulárního lymfomu. 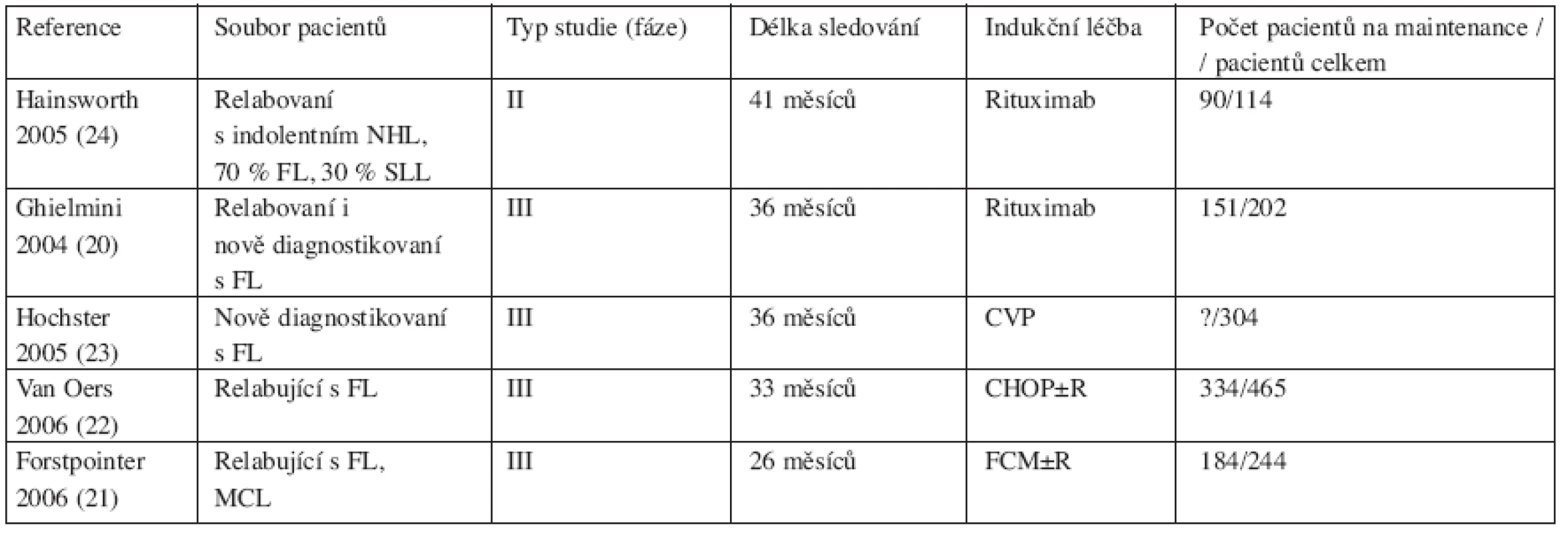
Vysvětlivky: CVP – cyklofosfamid, vinkristin, prednison FL – folikulární lymfom CHOP – cyklofosfamid, doxorubicin, vinkristin, prednison SLL – malobuněčný lymfom FCM – fludarabin, cyklofosfamid, mitoxantron MCL – mantle cell lymfom R – rituximab Účinnost prolongované terapie rituximabem oproti standardní léčbě samotné u pacientů s folikulárním lymfomem hodnotila studie autorů Ghielminiho a kol. Do studie bylo zařazeno 202 pacientů s FL (grade 1–3, relabovaných 130), kteří byli léčeni indukcí rituximabem 4x375 mg/m2. Hodnocení léčebné odpovědi bylo provedeno 12 týdnů po zahájení léčby a pacienti, kteří dosáhli alespoň stabilní choroby (SD, n = 151), byli dále randomizováni. Do ramene A (observace) bylo zařazeno 78 pacientů, do ramene B (udržovací léčba rituximabem 1x375 mg/m2á 2 měsíce, celkem 4 dávky) bylo randomizováno 73 nemocných. Celková léčebná odpověď (OR) po indukci dosáhla 52 % (z toho 8 % CR), u nepředléčených nemocných pak 67 % OR a 9 % CR (p = 0,0097). Medián sledování celé skupiny je 36 měsíců. Medián přežití bez události (EFS = event free survival) pro observační rameno (A) vs maintenance (B) je 11,8 vs 23,2 měsíce (p = 0,024), pro skupinu nepředléčených pacientů 19 vs 36 měsíců (p = 0,009). Efekt udržovací terapie rituximabem byl rovněž více vyjádřený u pacientů, kteří dosáhli po indukci parciální nebo celkové remise než u pacientů se stabilní chorobou. Celkové přežití nebylo v této studii srovnáváno. Akutní toxicita byla pouze mírného stupně spojená přímo s podáním infuze, pozdní toxicita s incidencí 7 % se projevila dominantně infekčními komplikacemi, méně často jako asyptomatická neutro - nebo leukopenie (stupně 3–4). Dále byla zejména v rameni s udržovací léčbou pozorována dlouhodobá B-lymfopenie. Za zmínku stojí pozorování, že pacienti obou ramen jevili tendenci k dalšímu zlepšování léčebné odpovědi i několik měsíců po podání poslední dávky rituximabu. Z výsledků se také zdá, že čím delší expozice rituximabu, tím větší léčebný efekt lze očekávat. Další identifikované prognostické faktory ve studii byly: množství cirkulujících t(14;18)-pozitivních buněk a míra exprese bcl-2 v CD20-pozitivních buňkách. (20).
Následující studie hodnotí přínos udržovací terapie rituximabem po indukci chemoterapií ± rituximab. Jednou z nich je dvojitě randomizovaná studie fáze III německé skupiny GLSG (German Low Grade Lymphoma Study Group) určená pro relabované nebo refrakterní pacienty s FL, mantle cell lymfomem (MCL) nebo lymfocytoplazmoidním lymfomem. Léčba byla zahájena indukcí 4xR±FCM v intervalu 28 dní (rituximab 375 mg/m2 den 0, fludarabin 25 mg/m2 den 1–3, cyklofosfamid 200 mg/m2 den 1–3, mitoxantron 8 mg/m2 den 1), přičemž první randomizace FCM vs RFCM byla zastavena po zhodnocení 147 nemocných pro jednoznačně lepší výsledky po RFCM. Do druhé randomizace vstoupilo 176 pacientů (z toho 81 FL), kteří dosáhli po indukci alespoň parciální odpovědi (PR). 85 pacientů bylo zařazeno do ramene udržovací léčby rituximabem ve schématu 4x375 mg/m2 3 a 9 měsíců od ukončení indukční léčby, 91 nemocných bylo randomizováno do ramene observace. Medián sledování celé skupiny je 26 měsíců. Trvání léčebné odpovědi po R-maintenance bylo delší bez ohledu na podanou indukční léčbu (medián nedosažen vs 17 měsíců v rameni observace, p < 0,001) a projevilo se významně ve všech podskupinách lymfomů. Pro FL i MCL je odhadované 3leté přežití 77 % vs 57 % ve prospěch R-maintenance, rozdíl však nedosáhl statistické významnosti (p = 0,1). Toxicita byla pozorována pouze mírného stupně s incidencí zhruba u 8 % cyklů rituximabu. Kromě akutních nežádoucích účinků spojených s podáním infuze, byla dále pozorována leukopenie, granulopenie a lymfopenie stupně 3 a 4 výraznější v rameni s udržovací léčbou, avšak bez rozdílu v počtu infekčních komplikací (21).
V roce 1998 byla zahájena další studie fáze III pro relabované respektive rezistentní pacienty s FL (grade 1–3) koordinovaná skupinou EORTC (European Organization for Research and Treatment of Cancer). Cíle studie byly definovány dva: 1. zhodnotit efekt rituximabu v induk-ční léčbě v randomizovaném modelu 6xCHOP vs 6xRCHOP, 2. zhodnotit přínos následné udržovací léčby rituximabem v jednotlivé dávce 375 mg/m2á 3 měsíce po dobu 2 let oproti observaci. Celkem bylo zařazeno 465 nemocných. RCHOP indukoval výrazně více léčebných odpovědí oproti CHOP (CR: 29,5 % vs 15,6 %, p < 0,0001), což se promítlo do signifikantně delšího PFS od první randomizace (33,1 vs. 20,2 měsíců, p < 0,0003). Do druhé randomizace (udržovací léčba nebo observace) vstoupilo pouze 334 pacientů, kteří dosáhli alespoň PR. Medián sledování od druhé randomizace je 33 měsíců, PFS pacientů na udržovací léčbě vs observace je 51,5 vs. 15 měsíců (p < 0,0001), s tím že více byl rozdíl vyjádřen u pacientů léčených pouze CHOP než RCHOP. Odhadované 3leté přežití skupiny na udržovací léčbě oproti observaci je 85 % vs 77 % (p = 0,011). Udržovací léčba rituximabem, byla spojena s minimální toxicitou. Nejčastěji byla pozorována neutropenie (11 % vs 5,4 % u obser-vace), infekční komplikace (9 % vs 2,4 % u observace) a hypogamaglobulinemie zejména ve třídě IgG. Pro infekční komplikace musela být udržovací léčba ukončena u 4 % pacientů (22).
Studie fáze III, organizovaná skupinou ECOG (Eastern Cooperative Oncology Group), byla zaměřená na nepředléčené pacienty s indolentními lymfomy. Do studie bylo zařazeno celkem 304 pacientů (z toho 78 % s FL klinického stadia III/IV). Pacienti, kteří dosáhli po indukci 6–8 cykly CVP (cyklofosfamid, vinkristin a prednison) alespoň stabilní choroby, byli dále randomizováni buď do ramene s udržovací léčbou rituximabem 4x375 mg/m2 á 6 měsíců po dobu 2 let, nebo do ramene observace. Medián sledování je 3 roky, v tomto horizontu lze konstatovat, že PFS i celkové přežití (OS) jsou signifikantně delší v rameni s udržovací léčbou (medián 4,2 vs 1,5 roku; p = 0,00003). Odhadovaný 4letý PFS 56 % vs 33 % je rovněž ve prospěch udržovací terapie stejně jako odhadovaný 4letý OS 88 % vs 72 % (p = 0,03) (23).
Na základě velmi povzbudivých výsledků studií s udržovací terapií rituximabem po indukční imunochemoterapií (20, 21) u pacientů s relabujícím folikulárním lymfomem, byla zahájena studie PRIMA (Primary RItuximab and MAintenance). Tento multicentrický projekt si klade za cíl zhodnotit efekt udržovací léčby rituximabem po různých indukčních režimech imunochemoterapie (RCHOP, RCVP, RFCM, RMCP) v rámci primární léčby u nepředléčených pacientů s folikulárním lymfomem. Dávkovací schéma udržovací léčby je 1x 375 mg/m2rituximabu á 2 měsíce po dobu 2 let.
Rituximab „maintenance“ versus rituximab „retreatment“
V jediné menší studii fáze II byl porovnáván efekt udržovací léčby rituximabem „maintenance“ oproti opětovné léčbě rituximabem v případě relapsu „retreatment“. Do studie bylo zařazeno 114 pacientů s relabovaným indolentním lymfomem (cca 70 % FL, 30 % SLL). Tito pacienti byli léčeni indukcí rituximabem 4x375 mg/m2, léčebná odpověď byla hodnocena 6. týden od startu léčby. Pacienti (n = 90), kteří dosáhli alespoň stabilní nemoci (SD) byli randomizováni do ramene udržovací léčby (44 pacientů) rituximabem 4x375 mg/m2 4 dávky á 6 měsíců nebo do ramene „retreatment“ (46 pacientů) rituximabem v dávce 4x375 mg/m2 při progresi respektive relapsu. Medián sledování je 41 měsíců, medián PFS pro maintenance vs retreatment byl 31,3 vs 7,4 měsíců (p = 0,007). Benefit podání rituximabu vyjádřený mediánem délky trvání odpovědi byl pro maintenance vs retreatment 31 vs 27 měsíců (ns = nesignifikantní), i když ve skupině maintenance bylo zaznamenáno více dlouhodobých a kompletních remisí (CR). V rameni maintenance bylo pozorováno zvýšení celkové léčebné odpovědi (OR) z 39 % na 52 % včetně zvýšení počtu CR z 9 % na 27 %. Naopak ve skupině retreatment byl pozorován po reindukci spíše pokles v parametrech léčebné odpovědi. Celkové přežití ve 3 letech je pro maintenance vs retreatment 72 % vs 68 % (ns). Léčba byla v obou ramenech dobře tolerována, bez nutnosti hospitalizace či přerušení léčby, avšak v rameni maintenance byla pozorována 2x reaktivace kožní infekce virem varicella-zoster (24).
Vzhledem k publikovaným výsledkům byla zahájena studie fáze III srovnávající „rituximab-maintenance“ oproti „rituximab-retreatment“ v relapsu u pacientů s nově diagnostikovaným indolentním lymfomem (RESORT = Rituximab Extended Schedule Or Retreatment Trial) (25).
Náklady na udržovací léčbu rituximabem
Na první pohled je zcela zřejmé, že náklady spojené s podáním jakékoli udržovací léčby rituximabem budou nezanedbatelné. Je třeba vzít v úvahu i tento aspekt, zvláště nevede-li léčba ve své podstatě k definitivnímu vyléčení.
Hodnocení reálného „ekonomického přínosu“ dané léčebné intervence je velmi obtížné. Provádějí se tedy určité odhady, které mají svá omezení. Poměrně standardním nástrojem využívaným k měření kvality a kvantity let „přidaných“ léčbou je parametr zvaný QALYs (quality - adjusted life-years = „roky kvalitního života“). Tento parametr je dán počtem let potenciálně získaných léčbou, přičemž za každý rok života plného zdraví je počítána hodnota 1, která klesá až k 0 pro bezvědomí respektive smrt. Pro porovnání přínosu léčebné intervence vyjádřeného penězi je užívána univerzální jednotka zvaná „cost per QALY“. Poněvadž výklad QALYs a souvisejících pojmů je obsáhlý a přesahuje rámec tohoto přehledu, odkazujeme zájemce o podrobnosti na příslušné prameny: http://en.wikipedia.org./wiki/quantity-adjusted_life_years, http://www.jr2.ox.ac.uk/bandolier/band24/b24-7.html, http://www.oheschools.org/ohech5pg4.html.
Aktuálně jsou k dispozici pouze ojedinělé práce ze zahraničí orientované na zhodnocení udržovací terapie rituximabem z farmakoekonomického hlediska.
Recentní studie amerických autorů analyzovala přímé medicínské náklady (náklady na lék a podání, nežádoucí účinky, náklady na léčbu relapsu a náklady spojené se zkrácením života) versus QALYs u pacientů s indolentním lymfomem léčených R-maintenance po CVP (26). Udržovací léčba rituximabem vedla k významnému prodloužení OS a QALYs, vynaložené přímé náklady byly průměrně 43 000 $, náklady na prodloužení života pacienta („cost per QALY“) dosáhly 58 000 $. Poměr nákladů a QALYs (incremental cost-effectiveness ratio = ICER) R-maintenance je příznivý a hluboce pod hranicí akceptovatelnou v onkologii ve Spojených státech.
Obdobně koncipované šetření provedené v evropských podmínkách provedla španělská skupina. Cílem studie bylo srovnání nákladů a benefitu udržovací léčby rituximabem oproti observaci. K analýze byly užity parametry QALYs, roky života (life-years = LY) a období do progrese (PFS = progression-free survival). Udržovací léčba rituximabem vedla k významnému zlepšení všech uvedených proměnných oproti observaci. Celkové náklady spojené s udržovací terapií byly vyšší o 8000 ? nežli u observace. Náklady vyjádřené relativně dosáhly zhruba pro „cost per QALY“ 9400 ?, pro „cost per LY“ 8500 ? a pro „cost per PFS“ 5500 ?. Analýza rentability ukázala, že udržovací terapie rituximabem je ekonomicky efektivní pro všechny hodnocené proměnné (27).
Je třeba však vzít v úvahu, že v obou případech na analýzách participovaly farmaceutické firmy a přímá aplikace výsledků na podmínky v ČR je taktéž limitována.
Rituximab „maintenance“ a kvalita života
V poměru ke klinickým datům z prospektivních randomizovaných studií je málo informací věnováno kvalitě života pacientů na udržovací léčbě rituximabem. Systematické hodnocení kvality života nebylo součástí žádné z těchto velkých studií. Prakticky jedinou publikovanou prací je analýza 106 pacientů zařazených do prospektivní randomizované studie maintenance vs observace u B-NHL, z níž vyplynulo, že mezi oběma rameny nebyl zaznamenán rozdíl v kvalitě života objektivizovaný standardními dotazníky kvality života (EORTC-QLQ-C30 a EuroQoL-5D) (28).
Rituximab „maintenance“: toxicita a rezistence
Podle meta-analýzy klíčových randomizovaných studií je udržovací léčba rituximabem spojena s významně vyšším počtem infekčních komplikací (29). Ojediněle jsou také v literatuře popsány: pozdní nástup neutropenie (30), pneumonie způsobená Pneumocystis carinii (31) a aktivace epidermálního skvamózního karcinomu (32).
Prakticky jediná studie zaměřená na srovnání toxicity a prediktivních parametrů odpovědi u pacientů na dlouhodobé udržovací terapii rituximabem však přináší pozitivnější závěry. Studie zahrnovala pacienty s diagnózou folikulárního a mantle cell lymfomu (n = 306), léčených indukcí rituximabem a po té randomizovaných do ramene maintenance vs observace. Při dlouhodobém monitorování (medián 4,5 roku) byly zjištěny následující laboratorní odchylky: B-lymfopenie hlubší a dlouhodobější v rameni maintenance, hypogamaglobulinemie IgG a IgM, rovněž významně vyjádřená v rameni maintenance. Tyto laboratorní nálezy se však nepromítly do klinicky významného rozdílu ani v počtu infekcí, ani v incidenci sekundárních malignit oproti observaci (33).
Přibližně 60 % pacientů iniciálně odpovídajících na léčbu rituximabem vyvíjí klinickou rezistenci, která je definována jako progrese respektive relaps lymfomu při léčbě nebo do 6 měsíců od podání poslední dávky (19, 20, 24). Příčina tohoto jevu není objasněna. Kromě obecně platných mechanismů rezistence: vymizení CD20 receptoru (34), přítomnost antagonistických molekul CD55 a CD59 (35) a polymorfismu Fcγ části receptoru IgG (36) se snad také uplatňují buňky mikroprostředí lymfomu (37). Výše uvedené faktory se však zpravidla projeví rezistencí již na primární terapii s rituximabem. V posledních letech byly publikovány zprávy CD20-negativních relapsů folikulárních lymfomů po terapii rituximabem (38, 39). Otázkou zůstává, zda dlouhodobá terapie rituximabem bude indukovat nárůst rezistence a množství CD20-negativních relapsů FL.
Rituximab „maintenance“: dávkování a délka léčby?
Výsledky z jednotlivých randomizovaných studií byly potvrzeny i recentní meta-analýzou, která prokázala nesporný přínos udržovací léčby rituximabem, nejen pokud jde o prodloužení doby bez progrese, ale i o prodloužení celkového přežití u pacientů s folikulárním lymfomem (27).
U folikulárního lymfomu se nezdá, na rozdíl od výsledků u DLBCL, že iniciální kombinace R+CHOP by eliminovala efekt následné udržovací léčby rituximabem (40). I když také u FL byla účinnost R-maintenance zřetelněji vyjádřena u pacientů po chemoterapii (CHT) samotné než po R+CHT (22).
Uvedené studie s různými dávkovacími modely udržovací léčby rituximabem zahrnují terapii jednou infuzí á 3 měsíce po dobu 2 let až 4 infuzemi každých 6 měsíců po dobu 2 let. Tato schémata jsou odvozena z dat farmakokinetických analýz úvodních studií fáze II, u pacientů s relabujícími indolentními lymfomy léčenými dávkou 375 mg/m21x týdně po dobu 4 týdnů a na pozorované B-lymfodepleci způsobené rituximabem v trvání 6–9 měsíců (41, 42). Byla pozorována závislost kvantity i kvality léčebné odpovědi na koncentraci rituximabu v krvi (43). Dle aktuálních studií se za minimální klinicky účinnou sérovou koncentraci rituximabu pokládá hranice 25 μg/ml, která odpovídá jednorázové dávce 375 mg/m2 při opakování v intervalu 2–3 měsíců (43, 44). Na druhou stranu předběžné výsledky jedné recentní práce studující farmakokinetiku rituximabu přímo v rámci udržovací léčby (rituximab 1x375 mg/m2 á 3 měsíce) ukazují, že necelá polovina pacientů s folikulárním lymfomem má po 3 měsících, tj. před podáním další udržovací dávky, hladinu rituximabu v séru pod uváděnou účinnou hranicí 25 μg/ml. Vzhledem ke krátkému sledování se nelze vyjádřit ke klinickému významu tohoto nálezu (25). Je třeba si také uvědomit, že minimální účinná hladina 25 μg/ml rituximabu v séru byla stanovena více méně arbitrárně a výsledky vztažené k této hodnotě je nutno brát s rezervou. Bez ohledu na dávkovací schéma a přesné hladiny rituximabu v séru lze konstatovat, že různé modely R-maintenance vykazovaly v podstatě stejnou klinickou účinnost. Z klinického pohledu se zdá být naléhavější otázka než „jak často“ spíše „jak dlouho“ podávat udržovací léčbu rituximabem? Prozatím se zdá, že po dobu 2 let lze rituximab podávat relativně bezpečně a bez zásadních závažných nežádoucích účinků. Lze však uvažovat i o prodloužení udržovací léčby až do následného relapsu FL.
Závěry
Předkládaný přehled přináší argumenty o dobré účinnosti udržovací léčby rituximabem u pacientů s relabujícím i nově diagnostikovaným folikulárním lymfomem. Efekt této terapie je patrný nejen na prodloužení doby bez progrese, ale i na prodloužení celkového přežití pacientů s FL a to bez ohledu na podanou indukční léčbu. Optimální dávkovací schéma nelze zatím na základě dostupných výsledků stanovit. Rovněž není jasné jak dlouho má být udržovací terapie rituximabem podávána. V současné době se jeví jako relativně bezpečné a účinné podání R-maintenance v délce 2 roky. Bude třeba vyčkat výsledků dalších studií, aby bylo možno určit význam rituximab maintenance v primární léčbě folikulárního lymfomu ale také u dalších NHL. Velmi důležité bude také pečlivé porovnání efektu rituximab-maintenance versus opakovaná léčba „retreatment“ při relapsu. Nutno také zdůraznit, že jakkoli je rituximab ve srovnání s chemoterapií netoxický, jeho dlouhodobý toxický potenciál není přesně zmapován, neboť délka sledování ve studiích s udržovací léčbou je dosud z tohoto pohledu příliš krátká. V neposlední řadě by měly být zhodnoceny v budoucích studiích systematicky i aspekty spojené s kvalitou života a s ekonomickým přínosem léčby.
Vysvětlivky:
CVP – cyklofosfamid, vinkristin, prednison FL – folikulární lymfom
CHOP – cyklofosfamid, doxorubicin, vinkristin, prednison SLL – malobuněčný lymfom
FCM – fludarabin, cyklofosfamid, mitoxantron MCL – mantle cell lymfom
R – rituximab
Došlo do redakce: 22. 2. 2008
Přijato: 24. 4. 2008
MUDr. Andrea Janíková, Ph.D.
Interní hematoonkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail: ajanikova@fnbrno.cz
Zdroje
1. Swenson WT, Wooldridge JE, Lynch CF, et al. Improved survival of follicular lymphoma in patients in the Unites States. J Clin Oncol 2005; 23 : 5019–5026.
2. Horning SJ, Rosenberg SA. The natural history of initial untreated low-grade non-Hodgkin’*s lymphomas. N Engl J Med 1984; 311 : 1471–75.
3. Horning SJ. Natural history of and therapy for the indolent non-Hodgkin’*s lymphomas. Semin Oncol 1993; 20 (suppl 5): 75–88.
4. Johnson PW, Rohatiner AZ, Whelan JS, et al. Patterns of survival in patients with reccurrent follicular lymphoma: a 20-year study from a single center. J Clin Oncol 1995; 13 : 140–147.
5. Yuen AR, Kamel OW, Halpern J, Horning S. Long-term survival after histologic transformation of low-grade follicular lymphoma. J Clin Oncol 1995; 13 : 1726–1733.
6. Ezdinli EZ, Harrington DP, Kucuk O, et al. The effect of intensive intermittent maintenance therapy in advanced low-grade non-Hodgkin’*s lymphoma. Cancer 1987; 60 : 156–160.
7. Steward WP, Crowther D, McWilliam LJ, et al. Maintenance chlorambucil after CVP in the management of advanced stage, low-grade histologic type non-Hodgkin’*s lymphoma. A randomized prospective study with an assessment of prognostic factors. Cancer 1988; 61 : 441–447.
8. Rohatiner AZS, Gregory WM, Peterson B, et al. Meta-analysis to evaluate the role of interferon in follicular lymphoma. J Clin Oncol 2005; 23 : 2215–2223.
9. Maloney DG, Grillo-López AJ, White CA, et al. IDEC-C2B8 (rituximab) anti-CD20 monoclonal antibody therapy in patients with relapsed low-grade non-Hodgkin’*s lymphoma. Blood 1997; 90 : 2188–2195.
10. McLaughlin P, Grillo-López AJ, Link BK, et al Rituximab chimaeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four-dose treatment program. J Clin Oncol 1998; 16 : 2825–2833.
11. Demidem A, Lam T, Alas S, et al. Chimeric anti-CD20 (IDEC-C2B8) monoclonal antibody sensitises a B cell lymphoma cell line to cell killing by cytotoxic drugs. Cancer Biother Radiopharmac. 1997; 12 : 177–86.
12. Coiffier B, Lepage E, Briére J, et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large B-cell lymphoma. N Engl Med 2002; 346 : 235–242.
13. Czuczman MS, Grillo-López AJ, White CA, et al. Treatment of patients with low-grade B-cell lymphoma with the combination of chimeric anti-CD20 monoclonal antibody and CHOP chemotherapy. J Clin Oncol 1999; 17 : 268–276.
14. Forstpointner R, Dreyling M, Repp R, et al. The addition of rituximab to a combination of fludarabine, cyclophosphamide, mitoxantrone (FCM) significantly increases the response rate and prolongs survival as compared with FCM alone in patients with relapsed and refractory follicular and mantle cell lymphomas: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 2004; 104 : 3064–3071.
15. Hiddemann W, Kneba M, Dreyling M, et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine and prednisone (CHOP) significantly improves the outcome of patients with advanced stage follicular lymphoma as compared to CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group (GLSG). Blood 2005; 106 : 3725–3732.
16. Marcus R, Imrie K, Belch A, et al. CVP chemotherapy plus rituximab compared with CVP as first-line treatment for advanced follicular lymphoma. Blood 2005; 105 : 1417–1423.
17. Schmitz K, Brugger W, Weiss B, et al. Clonal selection of CD20-negative non-Hodgkin’*s lymphoma cells after treatment with anti-CD20 antibody rituximab. Br J Haematol 1999; 106 : 571–572.
18. Davis TA, Czerwinski DK, Levy R. Therapy of B-cell lymphoma with anti-CD20 antibodies can result in loss of CD20 antigen expression. Clin Cancer Res 1999; 5 : 611–615.
19. Davis TA, Grillo-López AJ, White CA, et al. Rituximab anti-CD20 monoclonal antibody therapy in non-Hodgkin’*s lymphoma: safety and efficacy of re-treatment. J Clin Oncol 2000; 18 : 3135–3143.
20. Ghielmini M, Schmitz SF, Cogliatti SB, et al. Prolonged treatment with rituximab in patients with follicular lymphoma significantly increases event-free survival and response duration compared with the standard weekly x 4 schedule. Blood 2004; 103 : 4416–4423.
21. Forstpointner R, Unterhalt M, Dreyling M, et al. Maintenance therapy with rituximab leads to a significant prolongation of response duration after salvage therapy with a combination of rituximab, fludarabine, cyclophosphamide, and mitoxantrone (R-FCM) in patients with recurring and refractory follicular and mantle cell lymphomas: results of a prospective randomized study of the German Low Grade Lymphoma Study Group (GLSG). Blood 2006; 108 : 4003–4008.
22. Van Oers MH, Klasa R, Marcus RE, et al. Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non-Hodgkin lymphoma in patients both with and without rituximab during induction: results of a prospective randomized phase 3 intergroup trial. Blood 2006; 108 : 3295–3301.
23. Hochster HS, Weller E, Gascoyne RD, et al. Maintenance rituximab after CVP results in superior clinical outcome in advanced follicular lymphoma (FL): results of the E1496 phase III trial from the Eastern Cooperative Oncology Group and the Cancer and Leukemia Group B. Blood 2005; 106 : 106a (abstr No 349).
24. Hainsworth JD, Litchy S, Shaffer DW, et al. Maximizing Therapeutic Benefit of rituximab: Maintenance therapy versus re-treatment at progression in patients with indolent Non-Hodgkin’*s lymphoma – a randomized phase II trial of the Minnie Pearl Cancer Research Network. J Clin Oncol 2005; 23 : 1088–1095.
25. Kahl BS, Williams ME, Hong F, et al. Preliminary pharmacokinetic (PK) analysis of Eastern Cooperative Oncology Group Protocol E4402: Rituximab extended schedule or retreatment trial (RESORT). Blood 2007; 118 : 1002A (abstr No 3420).
26. Hornberger JC, Reyes C, Shewade A, et al. Cost-effectiveness of rituximab post CVP induction for the treatment of low-grade NHL. Blood 2007; 118 : 193B (abstr No 4486).
27. Francisco J, Conde E, Giraldo P, et al. Rituximab maintenance therapy for patients with follicular lymphoma a cost-effective strategy? Haematologica 2007; 92 (S1) 117 (abstr No 0303).
28. Witzens-Harig M, Heiss Ch, Benner A, et al. Quality of life in patients with B-cell lymphoma during maintenance therapy with the anti-CD20 antibody rituximab. Blood 2007; 118 : 189B (abstr No 4471).
29. Vidal L, Gafter-Gvili A, Dreyling M, et al. Meta analysis: rituximab as maintenance therapy for patients with follicular lymphoma. Blood 2007; 118 : 998A (abstr No 3408).
30. Kimby E. Tolerability and safety of rituximab (MabThera). Cancer Treat Rev 2005; 31 : 456–473.
31. Ghielmini M, Schmitz SF, Burki K, et al. The effect of rituximab on patients with follicular and mantle-cell lymphoma. Weiss Group for Clinical Cancer Research (SAKK). Ann Oncol 2000; 11 (suppl 1): 123–126.
32. Fogarty GB, Bayne M, Bedford P, et al. Three cases of activation of cutaneous squamous-cell carcinoma during treatment with prolonged administration of rituximab. Clin Oncol 2006; 18 : 155–156.
33. Ghielmini M, Rufibach K, Salles G, et al. Single agent rituximab in patients with follicular or mantle cell lymphoma: clinical and biological factors that are predictive of response and event-free survival as well as the effect of rituximab on the immune system: a study of the Swiss Group for Clinical Cancer Research (SAKK). Annals of Oncology 2005; 16 : 1675–1682.
34. Kennedy GA, Tey SK, Cobcroft R, et al. Incidence and nature of CD20-negative relapses following rituximab therapy in aggressive B-cell non-Hodgkin’*s lymphoma: a retrospective review. Br J Haematol 2002; 119 : 412–16.
35. Weng WK, Levy R. Expression of complement inhibitors CD46, CD55 and CD59 on tumor cells does not predict clinical outcome after rituximab treatment in follicular non-Hodgkin lymphoma. Blood 2001; 98 : 1352–1357.
36. Cartron G, Watier H, Golay J, et al. From the bench to the bedside: wals to improve rituximab efficacy. Blood 2004; 104 : 2635–2642.
37. Bohen SP, Troyanskaya OG, Alter O, et al. Variation in gene expression patterns in follicular lymphoma and the response to rituximab. Proc Natl Acad Sci USA 2003; 100 : 1926–1930.
38. Alvaro-Naranjo T, Jaen-Martinez J, Guma-Padro J, et al. CD20-negative DLBCL transformation after rituximab treatment in follicular lymphoma: a new case report and review of the literature. Ann Haematol 2003; 82 : 585-88.
39. Tomita A, Hiraga J, Kiyoi H, et al. Epigenetic regulation of CD20 protein expression in a novel B-cell lymphoma cell line, RRBL1, established from a patient treated repeatedly with rituximab-containing chemotherapy. Int J Hematom 2007; 86 : 49–57.
40. Coiffier B, Haioun C, Ketterer N, et al. Rituximab (anti-CD20 monoclonal antibody) for the treatment of patients with relapsing or refractory aggressive lymphoma: a multicenter phase II study. Blood 1998; 92 : 1927–1932.
41. Maloney DG, Liles TM, Czerwinski DK, et al. Phase I clinical trial using escalating single-dose infusion of chimeric anti-CD20 monoclonal antibody (IDEC-C2B8) in patients with recurrent B-cell lymphoma. Blood 1994; 84 : 2457–2466.
42. Maloney DG, Grillo-López AJ, Bodkin DJ, et al. IDEC-C2B8: results of a phase I multiple-dose trial in patients with relapsed non-Hodgkin’*s lymphoma. J Clin Oncol 1997; 15 : 3266–3274.
43. Berinstein NL, Grillo-López AJ, White CA, et al. Association of serum rituximab (IDEC-C2B8) concentration and anti-tumor response in the treatment of recurrent low-grade or follicular non-Hodgkin’*s lymphoma. Ann Oncol 1998; 9 : 995-1001.
44. Gordan L, Grow WB, Pusateri A, et al. A phase II trial of individualized pharmacokinetic dosing of rituximab maintenance for patients with CD-20 positive lymphoproliferative disorders. J Clin Oncol 2005; 23 : 1096–1102.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Gratulujeme
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2008 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Potenciál inhibitorů deacetyláz histonů (HDACi) v léčbě dětské TEL/AML1 pozitivní akutní lymfoblastické leukemie
- Pokroky v léčbě Ph pozitivní akutní lymfoblastické leukemie dospělých
- Esenciální trombocytemie v dětském věku
- Analýza záznamů Národního onkologického registru z období let 1977–2002 o akutních leukemiích ve světle dat klinického registru akutních leukemií (ALERT) Leukemické sekce ČHS ČLS JEP a literárních údajů
- Aktuální pohled na udržovací terapii rituximabem („rituximab-maintenance“) u folikulárního lymfomu
- Kontroly správné výrobní praxe v krevních bankách
- Transientní antigenemie HBsAg po očkování vakcínou proti hepatitidě B u dárkyně krve
- Doporučení České myelomové skupiny (CMG) pro zajištění časné diagnostiky mnohočetného myelomu v podmínkách ambulantní klinické praxe
- Výběr z tisku a zprávy o knihách
- Gratulujeme
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Esenciální trombocytemie v dětském věku
- Transientní antigenemie HBsAg po očkování vakcínou proti hepatitidě B u dárkyně krve
- Kontroly správné výrobní praxe v krevních bankách
- Pokroky v léčbě Ph pozitivní akutní lymfoblastické leukemie dospělých
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



