-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dva pohledy na vývoj nádorů
Two Approaches to Cancer Development
Background:
The somatic mutation theory explaining the process of carcinogenesis is generally accepted. The theory postulates that carcinogenesis begins in a first renegade cell that undergoes gradual transformation from a healthy to a fully malignant state through the accumulation of genetic and epigenetic “hits”. This theory focuses specifically on mutations and genetic aberrations, and their impact on cells. It considers tumors as populations of sick cells that lose control of their own proliferation. The theory was put forward by Robert Weinberg and Douglas Hanahan, and is the predominant view in current cancer biology. By contrast, the tissue organization field theory proposed by Carlos Sonnenschein and Ana Soto considers loss of physiological structure and function by a tissue as key events in tumor development. According to this theory, tumors arise at a tissue rather than at a cellular level. It is based on a presumption that proliferation status, rather than quiescence, is the default position of cells in multicellular organisms.Aim:
The article aims to provide answers to following questions: Are the views of proponents of the somatic mutation theory (the reductionists) and proponents of the tissue organization field theory (the organicists) incompatible and incommensurable, even when the mainstream of tumor biology has shifted its attention from tumor cells toward the tumor microenvironment? Where to find a third interconnecting systemic approach? Is it useful to be aware of the controversy between reductionists and organicists? What this awareness contributes to? How do these alternative views influence practical oncology and tumor biology in general?Conclusion:
Whether the true position is held by reductionists or organicists is unimportant. What is important is to be aware of the existence of these two concepts because this knowledge makes the way we think about tumor origin and development, and how we set up and interpret our experiments, more precise.Key words:
carcinogenesis – mutation – cell – tissues – cell proliferation – cell quiescence
This study was supported by grant of Internal Grant Agency of the Czech ministry of Health No. NT/13784-4/2012.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
29. 7. 2015Accepted:
27. 4. 2016
Autoři: J. Šmardová 1,2; J. Koptíková 3
Působiště autorů: Ústav patologie, LF MU a FN Brno 1; Ústav experimentální biologie, PřF MU, Brno 2; Institut biostatistiky a analýz, LF a PřF MU, Brno 3
Vyšlo v časopise: Klin Onkol 2016; 29(4): 259-266
Kategorie: Přehled
doi: https://doi.org/10.14735/amko2016259Souhrn
Východiska:
V současnosti je obecně přijímanou představou o kancerogenezi somatická mutační teorie. Podle ní celý proces začíná jednou „odrodilou“ buňkou, která se hromaděním genetických a epigenetických změn postupně proměňuje ze zdravé na plně maligní. Somatická mutační teorie se soustředí na mutace, genetické příčiny a buněčnou úroveň. Nádory považuje za onemocnění buněk, které ztratily kontrolu nad svou proliferací. Somatická mutační teorie, jejímiž protagonisty jsou Robert Weinberg a Douglas Hanahan, představuje převládající koncepci současné nádorové biologie. Naproti tomu teorie pole tkáňové organizace, kterou poprvé představili Carlos Sonnenschein a Ana Sotoová, považuje za klíčovou při vývoji nádorů ztrátu fyziologické struktury a organizace tkáně. Podle ní nádory vznikají na tkáňové úrovni. Vychází z představy, že stav proliferace je přednastaveným stavem buněk v mnohobuněčném organizmu.Cíl:
Text nabízí odpovědi na následující dotazy: Platí i v době, kdy hlavní proud nádorové biologie posunuje svou pozornost od nádorových buněk k nádorovému mikroprostředí, nekompatibilnost a neslučitelnost zastánců somatické mutační teorie, tzv. redukcionistů, a teorie pole tkáňové organizace, tzv. organicistů? Kde hledat třetí, spojující, systemickou teorii? Je přínosné uvědomovat si možný spor mezi redukcionisty a organicisty? V čem ten přínos spočívá? Jak ovlivňuje praktickou onkologii a biologii nádorů obecně?Závěr:
Není důležité rozhodnout, zda mají pravdu redukcionisté nebo organicisté. Ale je důležité být si vědom těchto dvou pojetí, protože to zpřesňuje způsob, jakým o celé problematice vzniku a vývoje nádorů přemýšlíme, jak experimentujeme a interpretujeme své výsledky.Klíčová slova:
karcinogeneze – mutace – buňka – tkáň – buněčná proliferace – klidový stav buněkRobert Alan Weinberg
V roce 1991 napsal Robert Weinberg příspěvek do knihy o původu nádorů (Origin of Human Cancer), který nazval Oncogenes, tumor suppressor genes, and cell transformation: trying to put it all together [1]. Uvedl jej slovy francouzského básníka a filozofa Paula Valéryho: „To, co je jednoduché, je vždy špatně: to, co je komplikované, je neužitečné“ (That which is simple is always wrong: That which is complicated is useless). Ve své práci shrnoval klíčové objevy předchozích 15 let. 1. Objev prvních onkogenů a protoonkogenů, jejich funkční rozmanitosti a objev modelu poškození přenosu buněčných signálů. 2. Poznání, že k nádorové transformaci nestačí aktivace jediného onkogenu, že vývoj nádoru je postupný proces zahrnující více kroků. 3. Třetí podrobně komentovanou oblastí byl objev genu RB-1, souvislost jeho inaktivace s vývojem retinoblastomu a význam jeho interakcí s virovými onkoproteiny. V proteinu p110RB viděl funkční prototyp proteinu, který by mohl regulovat expresi onkogenů a představovat tak jejich funkční protiváhu. A již tehdy, v roce 1991, si Weinberg kladl otázku, zda se na základě narůstajícího a značně chaotického kvanta nových dat a poznatků postupně podaří formulovat nějaké ústřední – i když třeba zjednodušující – principy, které umožní jasnější porozumění vývoji nádorových buněk, anebo si tato oblast zkoumání podrží podobu čím dál komplexnější, bezbřehé fenomenologie [1].
Jak Weinberg vzpomíná ve své recentní historické eseji [2], v průběhu 80. a 90. let 20. století se seznam rozpoznaných onkogenů a nádorových supresorů explozivně rozrůstal a bylo čím dál zřetelnější, že se komplexita a chaos v oboru nesnižují. Naopak se zdálo, že každý nádor představuje „unikátní experiment přírody“, při kterém postupně získává jedinečnou sestavu mutovaných genů, a to v nepředvídatelném chronologickém pořadí. Ani tehdy však nepřestával věřit, že v pozadí tohoto komplexního chaosu popisujícího genetické a biochemické změny nejrůznějších signálních drah musí existovat nějaký řád. Společně s kolegou Douglasem Hanahanem odhlédli od biochemicky a geneticky konkrétní roviny a zaměřili se na obecnou biologii nádorů – na fenotypy nádorových buněk a z nich vznikajících nádorů. Věřili, že právě tam najdou onen pod povrchem skrytý řád. Všechna konkrétní data se sbíhala, ústila do šesti typických znaků, které zahrnovaly téměř celou biologii všech nádorů: 1. získání soběstačnosti v produkci růstových signálů, 2. necitlivost k signálům zastavujícím buněčný cyklus, 3. poškození apoptózy, 4. získání neomezeného replikačního potenciálu, 5. indukci angiogeneze a 6. získání metastatického potenciálu. To vše na podkladě a) navýšené genetické nestability (obr. 1 A). V roce 2000 o tom napsali přehlednou práci s krátkým výstižným názvem Hallmarks of Cancer [3]. Weinberg vzpomíná, že si s Hanahanem byli téměř jisti, že jejich příliš zjednodušující pohled, jakkoliv objasňující jejich vlastní způsob uvažování, zapadne a nevyvolá nijak silnou odezvu. Nezapadl! Ukázalo se, že potřeba nalézt sjednocující klíčová témata vystihující vývoj nádorů byla hluboká, o čemž svědčily tisíce autorů a článků citujících jeho práci.
Hanahan s Weinbergem pak v roce 2011 napsali revizi a pokračování své tehdy již kultovní práce a nazvali ji Hallmarks of Cancer: The Next Generation. V ní rozšířili seznam obecných typických znaků nádorů o 7. přeprogramování energetického metabolizmu a 8. schopnost vyhnout se dohledu ze strany imunitního systému. K obecným okolnostem přispívajícím k vývoji nádorů pak přidali b) přítomnost chronického zánětu a také upozornili na význam c) nádorového mikroprostředí [4]. Jejich práce opět vzbudila ohromný ohlas, který tentokrát již nikoho nepřekvapil (obr. 1 A, B).
Obr. 1. Typické vlastnosti nádorů. 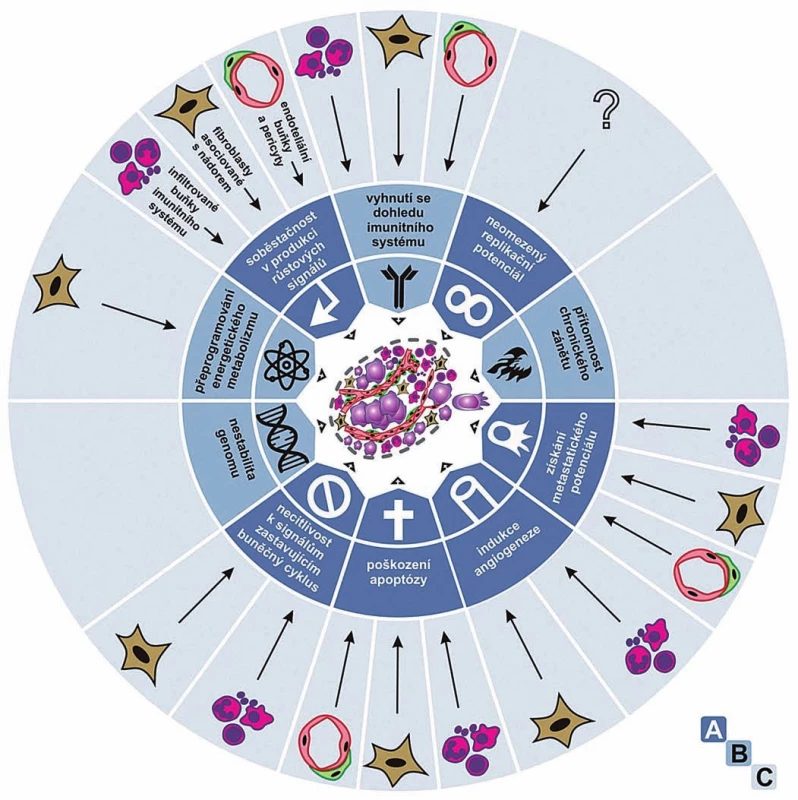
Jak byly popsány v roce 2000 (A) a 2011 (A, B); v roce 2012 byl dále popsán vliv nenádorových buněk, především infiltrujících buněk imunitního systému, fibroblastů asociovaných s nádorem a angiogenních vaskulárních buněk a pericytů (A, B, C). Upraveno podle [3,4,24]. Somatická mutační teorie
Weinbergova a Hanahanova koncepce je v současnosti obecně přijímanou představou o vzniku a vývoji nádorů, je „hlavním proudem“ současné nádorové biologie (biological mainstream). Kancerogenezi popisuje jako proces postupného hromadění mutací (a epigenetických změn), převážně somatických, v protoonkogenech a nádorových supresorech. Celý proces má monoklonální počátek, začíná první „odrodilou“ buňkou, která se postupným hromaděním genetických změn postupně proměňuje ze zdravé na plně maligní (obr. 2). Proto se toto pojetí vývoje nádorů někdy označuje jako somatická mutační teorie (somatic mutation theory – SMT). SMT se soustředí na rozplétání genetických a molekulárních souvislostí kancerogeneze, vysvětluje nádory poukazováním na mutace a genetické příčiny, expresi poškozených genů a tím také na (intra)buněčnou úroveň [5]. Vedle mnoha odborných článků Robert Weinberg napsal a v roce 1998 vydal popularizující knihu o vzniku rakoviny s příznačným názvem Jediná odrodilá buňka: jak vzniká rakovina (One Renegade cell: How cancer begins). Česky vyšla v roce 2003 v nakladatelství Academia, v edici s neméně příznačným názvem Mistři vědy [6].
Obr. 2. Somatická mutační teorie. 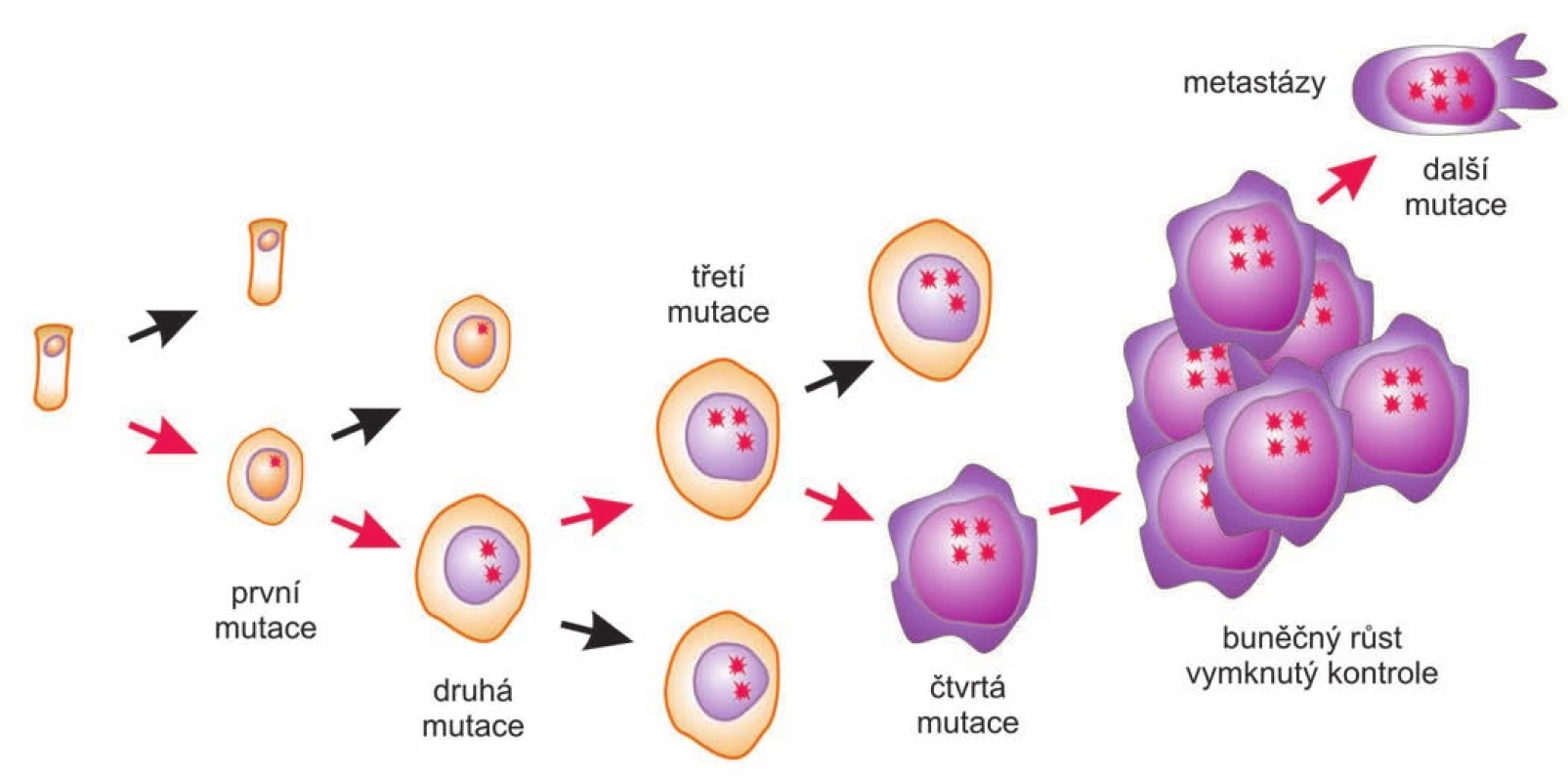
Kancerogeneze chápána jako proces postupné přeměny zdravé buňky v plně maligní na základě postupného hromadění genetických (a epigenetických) změn. Ve formulování SMT se do nějaké míry odrazil dominantní pohled moderní biologie, a to především biologie molekulární. V roce 1953 byla objevena struktura DNA a bylo formulováno tzv. centrální dogma molekulární biologie (CDMB). To popisuje cestu informace mezi DNA, RNA a proteiny. V principu dovoluje její přenos mezi nukleovými kyselinami (obvyklá cesta je replikace DNA, transkripce do RNA) a překlad (translace) z RNA do proteinů. To má za důsledek nemožnost toku informací z bílkovin do nukleových kyselin, a tedy „lamarckistické“ zanášení získaných změn v organizmu zpět do genetické informace. Pojem „centrální dogma“ zavedl jeden ze spoluobjevitelů struktury DNA Francis Crick a ten zvolil slovo „dogma“ jako odkaz na něco, co je zjevné, nikoliv na něco, co nelze zpochybnit. Ale označení dogma jako by bylo příznačné. Postupně našlo své naplnění až ve víře, že fenotyp je přímým a přesným zobrazením genotypu a analogicky vývoj organizmu je jen postupným rozkrytím genetického programu a vliv prostředí se při něm téměř neuplatňuje.
Nicméně SMT neodráží pouze „atmosféru doby“ a převažující způsob uvažování (genocentrizmus), nýbrž stojí na pevných základech řady nezpochybnitelných poznatků nádorové biologie. Tak např. bylo prokázáno, že a) řada karcinogenů způsobuje genetické mutace; b) schopnost některých onkogenních virů vyvolat rakovinu souvisí s tím, že nesou aktivní onkogeny; c) byla prokázána souvislost vývoje nádorů s navýšenou nestabilitou genomu. Toto vše byly poznatky, které našly své logické vyústění v SMT. Navíc molekulární biologie a molekulární genetika byly nejenom obecně nositelkami pokroku, které přinesly nové pohledy, hluboké vhledy a pochopení biologických procesů obecně, ale také přímo v onkologii podaly důkaz o své ohromné síle, účinnosti a produktivitě. Přinesly hmatatelné pokroky v prevenci, diagnostice a terapii nádorů, otevřely dveře k tzv. cílené léčbě v onkologii. V této souvislosti jsou zásluhy SMT jako produktivní myšlenkové koncepce jen těžko zpochybnitelné.
Teorie pole tkáňové organizace, Carlos Sonnenschein a Ana Sotoová
SMT představuje naprosto převládající koncepci v nádorové biologii, která navíc projevuje ohromnou schopnost sebe-udržování a sebe-podporování [7]. Ale není koncepcí jedinou a existuje k ní významná alternativa. Tu představuje tzv. teorie pole tkáňové organizace (tissue organization field theory – TOFT), kterou poprvé představili Carlos Sonnenschein a Ana Sotoová v roce 1999 ve své knize Společnost buněk: nádory a regulace proliferace (The society of cells: Cancer and control of cell proliferation) [8]. Ve své práci vycházejí ze dvou klíčových tvrzení, jimiž se vymezují vůči SMT. Tvrdí, že 1. obvyklým, přednastaveným stavem buněk, které jsou součástí mnohobuněčného organizmu, je stav proliferace. Ten je regulován – držen pod kontrolou – prostřednictvím inhibičních signálů, které přicházejí z vnějšího mimobuněčného mikroprostředí. Naproti tomu SMT vychází z představy, že buňky jsou ve stavu klidu (quiescence) a do stavu neregulované proliferace se dostávají v důsledku mutací. 2. Zatímco SMT postuluje, že karcinogeny vyvolávají v buňkách mutace, jejichž důsledkem je pak ztráta kontroly nad proliferací, TOFT vychází z toho, že prvotní dopad působení karcinogenů na tkáně spočívá v narušení normální organizace tkání, narušení fyziologických interakcí mezi parenchymálními a stromálními buňkami. A právě tato ztráta adekvátní struktury a v důsledku i adekvátní signalizace mezi buňkami uvnitř tkání potom vede k deregulaci, tj. ke ztrátě inhibice buněčné proliferace a stojí také jako klíčová příčina za vývojem nádorů. Z tohoto úhlu pohledu bývají zastánci SMT někdy označováni jako redukcionisté – v tom smyslu, že redukují pohled na příčinu a podstatu nádorů na úlohu genů – tedy že zastávají genocentrický pohled, zatímco zastánci TOFT jako organicisté [5].
Jak už bylo zmíněno, zastánci SMT vycházejí především z poznatků molekulární a buněčné biologie. TOFT mnohem spíše navazuje na poznatky vývojové biologie a embryologie. Vlastně již v 19. století byl vysloven názor, že existuje paralela mezi embryonálním vývojem a karcinogenezí a že podstatou vzniku nádorů je změněná organizace tkání. V té době již byly k dispozici poznatky o vývojové plasticitě lidských plodů, vědělo se o vlivu prostředí na vývoj plodu. A existuje řada novějších pozorování a experimentálních dat, která dávají organicistům za pravdu a potvrzují, že to, co je pro vývoj nádorů podstatné, je kontext, ve kterém se buňky nacházejí. a) Je-li např. rané embryo transplantováno na ektopické místo (ledvina, peritoneální dutina), chová se jako maligní nádor – teratokarcinom. Naopak buňky teratokarcinomu injikované do raného embrya (ve stadiu blastocysty) se stanou součástí normálních tkání a orgánů [9]. Takové experimenty naznačují, že vůbec neplatí, že nádorová buňka musí být nádorovou buňkou navždy a priori, ale spíše se zdá, jako by nádorový fenotyp byl plastický a epigeneticky řízený. Je přizpůsobivý a objevuje se na úrovni řízení tkání [7,10–12]. b) Sotoová a Sonnenschein např. provedli experimenty, ve kterých se pokusili vyvolat tvorbu karcinomu prsu u krys působením karcinogenu N-nitrosometyl močoviny (NMU). Účinku NMU vystavili buď epiteliální buňky, nebo stroma, nebo oba typy tkáňových kompartmentů. Zjistili, že k neoplastické transformaci epiteliálních buněk docházelo pouze v případě, kdy působení karcinogenu bylo vystaveno stroma, bez ohledu na to, zda epiteliální buňky samotné exponovány byly, či ne [13]. Tento výsledek ukázal, že klíčovým cílem karcinogenu a spouštěčem transformace je stroma, nikoli parenchymální buňky – nositelky mutačních změn [7,10–12].
Mina Bissellová
K významným a nepřehlédnutelným představitelům organicistického pohledu na vývoj nádorů patří Mina Bissellová. Zabývá se vlivem architektury tkání a mikroprostředí vč. extracelulární matrix na vznik a vývoj nádorů, především nádorů prsu. Je jí přisuzován radikální, ale stále více přijímaný názor, že jak během normálního vývoje, tak u některých patologických jevů fenotyp dominuje nad genotypem. V 70. letech 20. století, na počátku své kariéry, se Bissellová na přednášce Beatrice Mintzové seznámila s výsledky práce její laboratoře (viz výše, [9]) a ve své vlastní laboratoři je pak dále rozvinula. a) Použila virus Rousova sarkomu, který nesl aktivovaný onkogen ras. Když byl virus injikován do kuřat, vyvolával tvorbu sarkomů. Stejný virus injikovaný do kuřecího embrya žádné sarkomy nezpůsobil. Pokud však byly buňky tohoto embrya převedeny do tkáňové kultury, získaly opět transformovaný charakter. Závěr Bissellové byl jednoznačný: to, co rozhoduje o tom, zda se z buněk nesoucích aktivovaný onkogen vytvoří nádor, je kontext neboli mikroprostředí, které je vně infikované buňky [14]. b) K doslova „vhledovým“ výsledkům laboratoře Miny Bissellové patří nesčetné experimenty s buňkami karcinomu prsu, ve kterých ukázala, jak významný podíl na výsledném fenotypu buněk má způsob kultivace. Při obvyklé kultivaci buněk v tkáňových kulturách na plochém dně Petriho misek mění mamární epiteliální buňky výrazně svou morfologii, ztrácejí polaritu, přestávají produkovat mléko. Zcela „zapomenou“ svou formu i funkci, kterou mají uvnitř organizmu. Pokud jsou umístěny na povrchy, které simulují 3D prostředí reálné tkáně, buňky se reorganizují a vytvářejí struktury, které vypadají opět fyziologicky. A Bissellová ukázala, že ve 3D prostředí mohou nádorové buňky revertovat do normálního stavu, přestože i nadále nesou ve svých genech mutace. Tím prokázala klíčový vliv prostředí na buněčný fenotyp a také to, že adekvátní signalizace z mikroprostředí udržuje transformační proces pod kontrolou [15]. V dalších pracích pak dále podrobně studovala úlohu tkáňové architektury, stromálních buněk a extracelulární matrix během vývoje, při udržování homeostáze a také během vývoje nádorů (pro přehled [16–21]).
Svými pracemi tak Bissellová přispěla i k objasnění jevu, který byl zároveň jedním z myšlenkových východisek celé její práce. Tato pozorování se týkala výskytu okultních nádorů. Bissellová si kladla otázku, jak je vlastně možné, že lidé nemají nádory mnohem častěji. Vycházela z představy, že v lidském těle je asi 10 bilionů buněk, které vznikají opakovaným dělením jedné buňky – oplozeného vajíčka. Během lidského života jsou opakovaně vystaveny působení řady škodlivých látek, exogenních i endogenních, které v buňkách vyvolávají vznik mutací, vč. mutací v onkogenech a nádorových supresorech. Podle stávajícího dogmatu (tj. SMT) by v těchto mutovaných buňkách mělo dojít ke ztrátě kontroly nad jejich proliferací a měly by se stát počátkem nových nádorů. Ale realita je taková, že nádorů se u lidí vyskytuje podstatně méně než takto škodlivých mutací. Na základě mnoha svých výsledků se Bissellová domnívá, že v těchto případech je to právě mikroprostředí obklopující nádor, které poskytuje signály inhibující další vývoj nádoru. Dokud je zachována tkáňová architektura a homeostáze, je vývoj nádoru suprimován. Jinými slovy: iniciaci nádorů nelze zabránit, ale lze mít kontrolu nad jejich další progresí [22]. V této souvislosti je ještě třeba poznamenat, že Bissellová – na rozdíl od Sotoové a Sonnenscheina – nepopírá účast a podíl onkogenních mutací na vzniku a vývoji nádorů, i když ve shodě s nimi poukazuje na klíčový podíl mikroprostředí, tedy kontextu, při kontrole nádorové progrese. A to s tím, že mikroprostředí může další progresi nádorů inhibovat (obr. 3 A), ale také stimulovat (obr. 3 B) [22].
Obr. 3. Teorie pole tkáňové organizace. 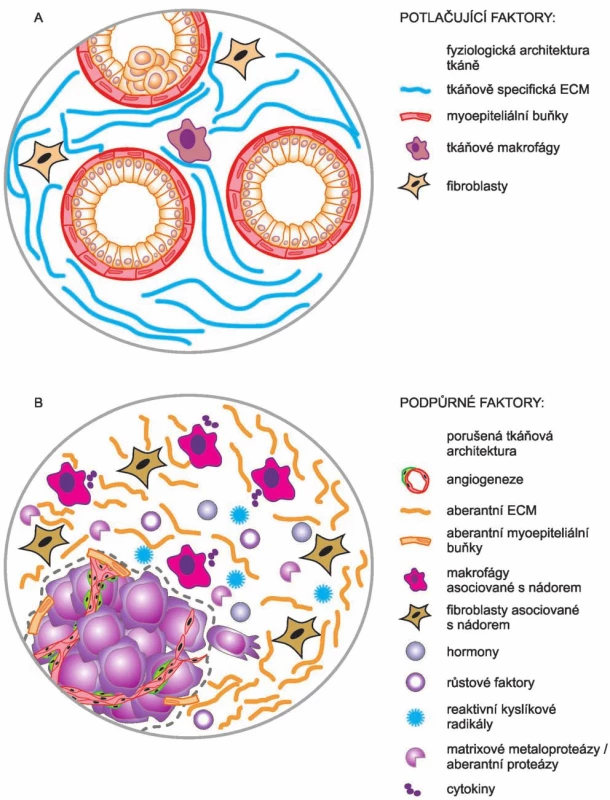
Normální struktura mikroprostředí tkáně funguje jako bariéra kancerogeneze, poškozené mikroprostředí může výrazně podporovat vývoj nádoru. Upraveno podle [22]. Sbližování pohledů SMT a TOFT? Hybridní teorie?
Jsou SMT a TOFT neslučitelné? Nebo je to jen otázka vývoje a postupného sbližování stanovisek? Existují hybridní koncepce?
Již na příkladu Miny Bissellové a jejího pojetí, podle kterého se na kancerogenezi podílejí vedle zásadního přispění mikroprostředí také onkogenní mutace [22], je vidět, že hranice mezi redukcionisty a organicisty není nijak neprostupná. Podobně na straně zastánců SMT není koncepce Weinberga a Hanahana jediná a některé se mohou jevit jako bližší TOFT. Například Richard Klausner se domnívá, že nádory vystihují tři klíčové vlastnosti: 1. genomová nestabilita, 2. změněné buněčné chování a 3. změněné tkáňové chování. Svým třetím bodem tedy zřetelně pojmenovává a vyzdvihuje význam vztahů a signalizací mezi buňkami uvnitř vysoce uspořádaných tkání [23]. Ovšem i samotní Hanahan s Weinbergem vždy zdůrazňovali, že pro pochopení vývoje nádorů se nelze omezovat pouze na studium nádorových buněk. Již ve své původní práci z roku 2000 zřetelně upozornili na to, že nádor je komplexní tkáň, uvnitř které je mnoho různých buněčných typů a nebuněčných struktur, které spolupracují a navzájem se ovlivňují a na vývoji nádoru se podílejí společně [3]. Upozorňovali, že takové procesy jako nádorovou angiogenezi nebo invazi a metastazování nádorů nelze pochopit bez toho, že by byly vzaty v úvahu komplexní vztahy mezi buňkami nádorovými a stromálními. Ve své návazné práci z roku 2011 potom rozšířili seznam typických znaků nádorů např. o přítomnost chronického zánětu, komunikaci s imunitním systémem a také vliv mikroprostředí, tedy právě o takové znaky, které dále podtrhují význam mikroprostředí při vývoji nádorů obr. 1 A, B) [4].
O další zdůraznění významu nádorového mikroprostředí pro vývoj nádorů se pak postaral Douglas Hanahan – dlouholetý souputník Roberta Weinberga a spoluautor jejich společných kultovních článků – když v roce 2012 publikoval společně s Lisou M. Coussensovou práci s emotivním názvem Spolupachatelé zločinu: funkce buněk naverbovaných do nádorového mikroprostředí (Accessories to the crime: Functions of cells recruited to the tumor microenvironment [24]). V této práci autoři ukázali, že téměř bez výjimky všechny základní typické vlastnosti nádorů jsou zásadním způsobem ovlivňovány nenádorovými buňkami, především infiltrujícími buňkami imunitního systému, s nádorem asociovanými fibroblasty a angiogenními vaskulárními buňkami a pericyty (obr. 1 A–C). Ačkoliv práce vyšla v přísně vědeckém časopise Cancer Cell (s impaktovým faktorem 25,9), najdeme v ní velmi literární, až emotivní vyjádření typu: „Nádorové buňky nevyvolávají nemoc samy, ale svádějí a korumpují ostatní buňky ve svém okolí, aby se postavily mimo zákon buněčné společnosti.“Podobně kdybychom sledovali recentní práce Roberta Weinberga, nedá se v nich přehlédnout důraz, který klade na součinnost mikroprostředí a nádorových buněk při vývoji nádorů. Především se to týká jeho výzkumu epiteliální mezenchymální tranzice a její účasti na nádorovém metastazování (např. [25,26]). Na druhou stranu nelze přehlédnout ani to, že pohled na kmenové buňky a jejich řídící a určující roli ve vývoji nádorů – další oblast výzkumu, v níž je Weinberg velmi aktivní – je spíše pohledem z pozice SMT [27–29].
Co plyne z vědomí „sporu“ SMT a TOFT?
Jak dalece jsou SMT a TOFT slučitelné? Je vůbec přínosné klást si otázku o dvojím pojetí vývoje nádorů? Není to jen historizující pohled, který se časem sám vyřeší? Pokud významnost a přínosnost připouštíme, tak v čem spočívá?
Pohled autorů TOFT – Ana Sotoová a Carlos Sonnenschein
Jsou to především Sotoová a Sonnenschein, autoři teorie pole tkáňové organizace [8], v níž se ostře vymezili vůči SMT, redukcionizmu a genocentrizmu, kteří se domnívají a opakovaně to zdůrazňují a vysvětlují, že SMT a TOFT jsou dvě nekompatibilní a nesmiřitelná pojetí kancerogeneze. Domnívají se, že buď věříte, že proces kancerogeneze začíná jedinou odrodilou buňkou a je to nemoc buněk s neregulovanou buněčnou proliferací, nebo se soustředíte na společenství buněk a vnímáte nádor jako problém organizace tkání a komunikace mezi buňkami. Nevedou spor o data a pozorování, nýbrž spor o jejich interpretaci, a v důsledku tedy i pochopení podstaty celého procesu. Například způsobují vrozené mutace některých genů (z hlediska SMT nádorových supresorů) primárně rozvrat regulace buněčné proliferace, nebo vyvolávají rozvrat struktury tkání, jehož následkem je potom neadekvátní signalizace, komunikace mezi buňkami projevující se mimo jiné změnou proliferace některých typů buněk? Zatímco TOFT bere v úvahu především kontext, tkáňové uspořádání, SMT vnímá buňky uvnitř tkání jako kvazi-autonomní jednotky řízené zevnitř svými geny [11].
Mohlo by se zdát, že neustálý posun v uvažování hlavního proudu nádorové biologie (SMT) směrem ke studiu mikroprostředí a komplexních vztahů uvnitř nádorů dává TOFT a jejím autorům za pravdu a že je také bude uspokojovat. Ale tak to zřetelně není. V jedné své starší práci autoři TOFT odmítli posuny v uvažování zastánců SMT jako pouhé korekce pojetí, které je špatné ve svém principu: „Pokud zastánci SMT narazí na nesrovnalosti, nakládají s nimi podobně jako astronomové v pre-koperníkovské éře, když naráželi na nesrovnalosti mezi teorií a svými daty o pohybu planet. Oběžným drahám planet neustále přidávali další a další korekce. Přitom řešením nesrovnalostí bylo odstranit Zemi ze středu ptolemaiovského vesmíru a zasadit na její místo Slunce. A tato metafora je pro současnou kancerogenezi plně platná.“ [30]. Sotoová a Sonnenschein trvají na tom, že to, co je nezbytné, je skutečně zásadní změna paradigmatu, kterým na procesy vývoje nádoru nahlížíme. Pro ně jsou SMT a TOFT neslučitelné [11,31].
Protinádorová terapie
Znalost a přijetí, vědomí si obou odlišných konceptů – ať už je vnímáme jako vyhroceně neslučitelné nebo konvergující – může v oblasti nádorové biologie významně ovlivnit řadu věcí. V teoretické rovině uspořádání experimentů (např. uvědomění si omezené vypovídací hodnoty 2D tkáňových kultur, nezbytnost kooperace různých buněčných typů…) a interpretaci jejich výsledků, obecně tedy naše porozumění kancerogenezi. V praktické rovině to pak může např. významně ovlivnit strategii protinádorové terapie [32]. Při pochopení významu kontextu, tj. struktury tkáně a především jejího funkčního příspěvku k vývoji nádorů nebude protinádorová terapie mířit pouze nebo především na nádorové buňky, ale také na fibroblasty, endoteliální buňky, leukocyty a další buňky imunitního systému a další buněčné typy i nebuněčné struktury (extracelulární matrix a její složky). Taková terapeutika již byla vyvinuta (např. bevacizumab/ Avastin) a další jistě budou následovat. Zde stojí za to připomenout a citovat jeden starší komentář klasika nádorové angiogeneze Judaha Folkmana. V roce 2000, když vysvětloval výhody anti-angiogenní terapie, se do značné míry vymezoval vůči převládajícímu, tj. somatickému mutačnímu paradigmatu, které opakovaně nazýval genocentrickým a vtipně označil svůj odlišný úhel pohledu jako „endoteliálně-centrické paradigma“ [33]. Mohlo by to vypadat jako vtipný bonmot respektovaného velikána nádorové biologie. Vtip, který odráží vědomí příliš těsného (tehdejšího?) úhlu pohledu na vývoj nádorů. Jen kdyby za tímto povzdechem nebyly dlouhé roky odmítání, až ostrakizace, kterého se mu ze strany zastánců SMT dostávalo. Ti nejenže na dlouhou dobu jeho práci ignorovali, nazývali ho šarlatánem, ale také mu na dlouho komplikovali možnosti, aby na svém objevu dále účinně pracoval [34].
Třetí teorie?
Jak bylo řečeno v předchozím odstavci, anti-angiogenní terapie nádorů nebyla výsledkem nějakého zásadního paradigmatického přehodnocení SMT, spíše výsledkem vývoje a celkem přirozeného posunu v chápání kancerogeneze směrem k vyšší komplexitě. To by také dávalo za pravdu filozofovi Christophu Malaterrovi, který v roce 2007 napsal podrobnou, zasvěcenou studii organicizmu a redukcionizmu ve výzkumu nádorů a došel k závěru, že pozice SMT a TOFT nejspíš nesmiřitelné nejsou. Jednak poukázal na určitou argumentační a důkazní nedůslednost nebo nedotaženost organicistů při jejich vymezování se vůči redukcionistům, a dále se domníval, že obě teorie jeví tendenci ke konvergenci. Malaterre předpověděl, nebo přinejmenším připustil vytvoření třetí teorie – tzv. systemického pohledu na karcinogenezi – která bude obě výchozí stanoviska spojovat [5].
Do nějaké míry představu o systemické teorii kancerogeneze naplňuje stochastický epigenetický model vývoje nádorů Andrewa Feinberga. Podle tohoto modelu stojí na počátku vývoje nádoru epigenetické změny, především změny imprintingu – metylace DNA spojená s kovalentními modifikacemi histonů. Na základě svých výsledků se Feinberg domnívá, že určitá míra spontánní stochastické heterogenity epigenomu je přirozená a vlastní všem, tedy i zdravým buňkám a je pravděpodobně zdrojem adaptability a evoluce. K jejímu výraznému navýšení může docházet v důsledku stresu, např. opakovanými cykly poškození a hojení. Tedy vlivem a působením mikroprostředí nebo i širšího okolí nádoru. Důsledkem takto navýšených epigenetických změn může být variabilita genové exprese, vč. změn v expresi genů, jejichž produkty se podílejí na regulaci klíčových buněčných vlastností a funkcí, které si spojujeme s vývojem nádorů [35,36].
A jaký je vztah epigenetického modelu vývoje nádorů k SMT? Feinberg doslova říká, že genetický model je v pořádku, jen je neúplný a představuje pouze 50 % příčiny a vysvětlení kancerogeneze. Podle Feinberga je srdcem evoluce nádoru právě epigenetika. Změnu epigenomu vidí jako první fázi vývoje nádorů, po které teprve následuje fáze vzniku a selekce mutací genů, následovaná eskalací genetické a epigenetické nestability [35]. Počátky výzkumu epigenetiky – spojené především se jménem Conrada Waddingtona – spadají již do první poloviny 20. století. V souvislosti s tématem tohoto sdělení není bez zajímavosti, že dveře k uznání podílu epigenetických mechanizmů na vývoji nádorů otevřely objevy mutací v genech kódujících složky epigenetického aparátu. Jinými slovy, byl to čistokrevný SMT přístup, který vedl k rozpoznání a uznání účasti epigenetických mechanizmů na vývoji nádorů [37].
Závěr
Je tedy otázka, zda má smysl se ještě dnes zabývat SMT a TOFT a jejich „střetem“ a k čemu je takové zkoumání dobré. Pokud jde o odpověď na bezprostřední otázku, kterou si obě teorie kladly – tedy jak vznikají nádory a na jaké úrovni leží klíčová příčina jejich vzniku – dá se na základě všech dosavadních zkušeností předpokládat, že dříve nebo později bude nalezena a její nalezení bude spíše otázkou času a experimentálního úsilí než teoretického zodpovězení otázky, zda pravdu mají redukcionisté, nebo organicisté. Na druhou stranu, pokud si budeme vědomi těchto dvou pojetí, bude to zpřesňovat způsob, jakým budeme o celé problematice přemýšlet, jak budeme experimentovat a interpretovat výsledky [38].
Tato práce byla podpořena grantem IGA MZ ČR č. NT/13784-4/2012.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. RNDr. Jana Šmardová, CSc.
Ústav patologie
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: janasmarda@seznam.cz
Obdrženo: 29. 7. 2015
Přijato: 27. 4. 2016
Zdroje
1. Weinberg RA. Oncogenes, tumor suppressor genes, and cell transformation: trying to put it all together. In: Brugge J, Curran T, Harlow E et al (eds). Origin of human cancer: a comprehensive review. New York: Cold Spring Harbor Laboratory Press 1991 : 1 – 13.
2. Weinberg RA. Coming full circle – from endless complexity to simplicity and back again. Cell 2014; 157(1): 267 – 271. doi: 10.1016/ j.cell.2014.03.004.
3. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100(1): 57 – 70.
4. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011; 144(5): 646 – 674. doi: 10.1016/ j.cell.2011.02.013
5. Malaterre C. Organicism and reductionism in cancer research: towards a systemic approach. Int Stud Philos Sci 2007; 21(1): 57 – 73.
6. Weinberg AR. Jediná odrodilá buňka. Jak vzniká rakovina. Praha: Academia 2003.
7. Sonnenschein C, Soto AM. Are times a ’changing’ in carcinogenesis? Endocrinology 2005; 146(1): 11 – 12.
8. Sonnenschein C, Soto AM. The society of cells: cancer and control of cell proliferation. New York: Springer-Verlag 1999.
9. Stewart TA, Mintz B. Successful generations of mice produced from an established culture line of euploid teratocarcinoma cells. Proc Natl Acad Sci U S A 1981; 78(10): 6314 – 6318.
10. Soto AM, Sonnenschein C. The somatic mutation theory of cancer: growing problems with the paradigm? Bioessays 2004; 26(10): 1097 – 1107.
11. Soto AM, Sonnenschein C. Emergentism as a default: cancer as a problem of tissue organization. J Biosci 2005; 30(1): 103 – 118.
12. Soto AM, Sonnenschein C. One hundred years of somatic mutation theory of carcinogenesis: is it time to switch? Bioessays 2014; 36(1): 118 – 120. doi: 10.1002/ bies.201300160.
13. Maffini MV, Soto AM, Calabro JM et al. The stroma as a crucial target in mammary gland carcinogenesis. J Cell Sci 2003; 117(8): 1495 – 1502.
14. Dolberg DS, Bissell MJ. Inability of Rous sarcoma virus to cause sarcomas in the avian embryo. Nature 1984; 309(5968): 552 – 556.
15. Weaver VM, Petersen OW, Wang F et al. Reversion of the malignant phenotype of human breast cells in three-dimensional culture and in vivo by integrin blocking antibodies. J Cell Biol 1997; 13(1): 231 – 245.
16. Nelson CM, Bissell MJ. Of extracellular matrix, scaffolds, and signaling: tissue architecture regulates development, homeostasis, and cancer. Annu Rev Cell Dev Biol 2006; 22 : 287 – 309.
17. LaBarge MA, Petersen OW, Bissell MJ. Of microenvironments and mammary stem cells. Stem Cell Rev 2007; 3(2): 137 – 146.
18. Ghajar CM, Bissell MJ. Extracellular matrix control of mammary gland morphogenesis and tumorigenesis: insights from imaging. Histochem Cell Biol 2008; 130(6): 1105 – 1118. doi: 10.1007/ s00418-008-0537-1.
19. Bissell MJ, Inman J. Reprogramming stem cell is microinvironmental task. Proc Natl Acad Sci U S A 2008; 105(41): 15637 – 15638. doi: 10.1073/ pnas.0808457105.
20. Weigelt B, Bissell MJ. Unraveling the microenvironmental influnces on the normal mammary gland and breast cancer. Semin Cancer Biol 2008; 18(5): 311 – 321. doi: 10.1016/ j.semcancer.2008.03.013.
21. Spencer VA, Xu R, Bissell MJ. Gene expression in the third dimension: ther ECM-nucleus connection. J Mammary Gland Biol Neoplasia 2010; 15(1): 65 – 71. doi: 10.1007/ s10911-010-9163-3.
22. Bissell MJ, Hines WC. Why don’t we get more cancer? A proposed role of the microinvorement in restraining cancer progression. Nat Med 2011; 17(3): 320 – 329. doi: 10.1038/ nm.2328.
23. Klausner RD. The fabric of cancer cell biology – weaving together the strands. Cancer Cell 2002; 1(1): 3 – 10.
24. Hanahan D, Coussens LM. Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell 2012; 21(3): 309 – 322. doi: 10.1016/ j.ccr.2012.02.022.
25. Polyak K, Weinberg RA. Transition between epithelial and mesenchymal states: acquisition of malignant and stem cell traits. Nat Rev Cancer 2009; 9(4): 265 – 272. doi: 10.1038/ nrc2620.
26. Tam WL, Weinberg RA. The epigenetics of epithelial-mesenchymal plasticity in cancer. Nat Med 2013; 19(11): 1438 – 1449.
27. Gupta PB, Chaffer CL, Weinberg RA. Cancer stem cells:mirage or reality? Nat Med 2009; 15(9): 1010 – 1012. doi: 10.1038/ nm0909-1010.
28. Pattabiraman DR, Weinberg RA. Tackling the cancer stem cells – what chalenges do they pose? Nat Rev Drug Discov 2014; 13(7): 497 – 512. doi: 10.1038/ nrd4253.
29. Chaffer CL, Weinberg RA. How does multistep tumori-genesis really proceed? Cancer Discov 2015; 5(1): 22 – 24. doi: 10.1158/ 2159-8290.CD-14-0788.
30. Sonnenschein C, Soto AM. Somatic mutation theory of carcinogenesis: why it should be dropped and replaced. Mol Carcinogenesis 2000; 29(4): 205 – 211.
31. Sonnenschein C, Soto AM. Theories of carcinogenesis: an emerging perspective. Semin Cancer Biol 2008; 18(5): 372 – 377. doi: 10.1016/ j.semcancer.2008.03.012.
32. Kenny PA, Lee GY, Bissell MJ. Targeting the tumor microenvironment. Front Biosci 2010; 12 : 3468 – 3474.
33. Folkman J, Hahnfeldt P, Hlatky L. Cancer: looking outside the genome. Nat Rev Mol Cell Biol 2000; 1(1): 76 – 79.
34. NOVA [homepage on the Internet]. Cancer warrior [cited 2015 June 1]. Available from: http://www.pbs.org/wgbh/nova/cancer/program.html .
35. Feinberg AP. Epigenetic stochasticity, nuclear structure and cancer: the implications for medicine. J Int Med 2014; 276(1): 5 – 11. doi: 10.1111/ joim.12224.
36. Timp W, Feinberg AP. Cancer as a dysregulated epigenome allowing cellular growth advanatge at the expense of the host. Nat Rev Cancer 2013; 13(7): 497 – 510. doi: 10.1038/ nrc3486.
37. Rodríguez-Paredes M, Esteller M. Cancer epigenetics reaches mainstream oncology. Nat Med 2011; 17(3): 330 – 339. doi: 10.1038/ nm.2305.
38. Chlapek P, Chovanová S, Sláviková V et al. Mikroprostředí nádoru – možnost výzkumu v podmínkách in vitro. Klin Onkol 2014; 27 (Suppl): S48 – S52.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek SOUTĚŽ O NEJLEPŠÍ PRÁCI
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2016 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Současné postavení systémové chemoterapie v léčbě karcinomu žaludku – přínos, či zhoršení kvality života?
- Antiproliferační účinek analog somatostatinu – analýza dat a klinické aplikace v kontextu výsledků studie CLARINET
- Dva pohledy na vývoj nádorů
- Vplyv liečby na kognitívne funkcie a kvalitu života u pacientov s karcinomom semenníkov
- Sentinelová uzlina u melanomu – studie provedená v jižní Brazílii
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Vliv paliativní chemoterapie na kvalitu života nemocných s karcinomem žaludku
- Vícenásobné nádorové onemocnění plic – kazuistika a přehled literatury
- Primární mukoepidermoidní karcinom slzného vaku – kazuistika a přehled literatury
- Hodnocení klinického stadia a léčebné odpovědi u maligních lymfomů – doporučení Kooperativní lymfomové skupiny na základě revidovaných kritérií z roku 2014 (Luganská klasifikace)
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
-
52nd Annual Meeting of ASCO
3.–7. června 2016, Chicago, USA
Výsledky léčby pembrolizumabem u maligního melanomu a nemalobuněčného plicního karcinomu - Klinické hodnocení fáze III posuzující regorafenib u pacientů s neresekovatelným karcinomem jater splnilo primární cíl – zlepšení celkového přežití
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 4 – Enterální a parenterální výživa. Chloridy. Kazuistika 4 - Indikace radioterapie u pacientů s hematologickými malignitami v průběhu pěti let provozu modernizovaného centra Onkologické a radioterapeutické kliniky v Plzni
-
Onkologie v obrazech
Echinokoková cysta primárně považovaná za sarkom
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv paliativní chemoterapie na kvalitu života nemocných s karcinomem žaludku
- Dva pohledy na vývoj nádorů
- Vplyv liečby na kognitívne funkcie a kvalitu života u pacientov s karcinomom semenníkov
- Primární mukoepidermoidní karcinom slzného vaku – kazuistika a přehled literatury
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



