-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Uzlinová metastáza karcinomu z Merkelových buněk bez kožního primárního ložiska – kazuistické sdělení
Lymph node metastasis of Merkel cell carcinoma without known cutaneous primary - case report
Merkel cell carcinoma is a rare cutaneous tumor with an aggressive clinical course. In most cases it is associated with Merkel cell polyomavirus infection. Exceptionally, the tumor can present as a lymph node metastasis without a discernible cutaneous primary.
In this report we present the case of a 42 year-old man with inguinal lymphadenopathy, histologically consistent with Merkel cell carcinoma. Tumor cells expressed immunohistochemically chromogranin-A, synaptophysin and displayed dot-like positivity for cytokeratin 20. The genome of MCPyV in neoplastic cells was detected using real-time PCR. A cutaneous primary has not been identified neither during the dermatologic examination, nor with PET CT scan.Keywords:
Merkel cell carcinoma – lymph node metastasis – tumor of unknown primary origin
Autoři: Arpád Szabó 1; Igor Richter 2,7; Dana Frydrychová 3; Martina Saláková 4,5; Tomáš Jirásek 1,6
Působiště autorů: Ústav patologie 3. LF UK a Fakultní nemocnice Královské Vinohrady, Praha 1; Komplexní onkologické centrum, Krajská nemocnice Liberec, a. s. 2; Kožní oddělení, Krajská nemocnice Liberec, a. s. 3; Národní referenční laboratoř pro papilomaviry a polyomaviry, Ústav hematologie a krevní transfuze, Praha. 4; Katedra genetiky a mikrobiologie, Přírodovědecká fakulta, Univerzita Karlova, Praha 5; Oddělení patologie, Krajská nemocnice Liberec, a. s. 6; Onkologická klinika 1. LF UK a Thomayerovy nemocnice, Praha 7
Vyšlo v časopise: Čes.-slov. Patol., 53, 2017, No. 3, p. 135-138
Kategorie: Původní práce
Souhrn
Karcinom z Merkelových buněk je vzácným maligním kožním nádorem s agresivním chováním, který ve většině případů bývá asociovaný s infekcí polyomavirem karcinomu z Merkelových buněk (MCPyV). Ve výjimečných případech se nádor manifestuje jako metastáza do lymfatické uzliny bez jednoznačného průkazu primárního kožního ložiska.
V této práci prezentujeme případ 42letého pacienta s tříselnou lymfadenopatií, s histologickým nálezem karcinomu z Merkelových buněk. Imunohistochemicky byla v nádoru prokázána exprese chromograninu-A, synaptofyzinu a tečkovitá pozitivita cytokeratinu 20. Molekulárně genetickým vyšetřením byla pomocí metody real-time PCR detekována přítomnost genomu MCPyV v nádorových buňkách. Dermatologické vyšetření ani staging pomocí PET CT ložisko primárního nádoru v jiné lokalizaci u pacienta neprokázalo.Klíčová slova:
Karcinom z Merkelových buněk – metastáza do lymfatické uzliny – nádor neznámého primárního původu
Karcinom z Merkelových buněk (MCC) patří mezi vzácné primární kožní malignity. Vyskytuje se přednostně v oblastech vystavených slunečnímu záření, průměrný věk pacientů je 69 let. K charakteristickým vlastnostem nádoru patří exprese znaků neuroendokrinní diferenciace a paranukleární tečkovitá pozitivita cytokeratinu 20 (1,2). V patogenezi MCC hraje důležitou roli infekce polyomavirem karcinomu z Merkelových buněk (MCPyV) (3). Karcinom z Merkelových buněk mívá agresivní klinický průběh, s častým výskytem uzlinových metastáz a s diseminací do vzdálených orgánů (1).
V naší práci prezentujeme případ pacienta s karcinomem z Merkelových buněk s postižením inguinální lymfatické uzliny (unknown primary Merkel cell carcinoma, UPMCC), kdy dermatologické vyšetření ani staging pomocí PET/CT původ nádoru v oblasti kůže neprokázalo.
KLINICKÝ NÁLEZ
Muž narozen v roce 1973, dosud zdráv, pozoroval od ledna 2015 v oblasti pravého třísla hmatnou nebolestivou rezistenci. Podle sonografického vyšetření se jednalo o zvětšenou lymfatickou uzlinu. V březnu 2015 byla provedena exstirpace této uzliny. Následné bioptické vyšetření odhalilo karcinom z Merkelových buněk. Parafinové řezy nádoru byly vyšetřeny v Národní referenční laboratoři pro papilomaviry a polyomaviry Ústavu hematologie a krevní transfuze (ÚHKT), kde byla nalezena přítomnost polyomaviru (MCPyV). Pacient v rámci stagingu onemocnění dále podstoupil CT vyšetření, celotělový PET/CT a octreoscan bez dalších známek tumorózního postižení. Klinické vyšetření dermatovenerologem neprokázalo možný primární zdroj nádoru v oblasti kůže, anoskopické vyšetření bylo též negativní. Na podkladě klinických vyšetření bylo stanoveno klinické stadium IIIB (T0 pN1b M0). U pacienta byla indikována radioterapie na oblast pravého třísla a zevních ilických lymfatických uzlin vpravo, plánovaná dávka 1.8/45 Gy v normofrakcionačním režimu. Pacient absolvoval léčbu do července 2015. Tolerance byla dobrá, pouze v pravém třísle se vyvinula akutní postradiační dermatitida druhého stupně, která do čtvrtého týdne od ukončení radioterapie odezněla. Při opakovaném vyšetření byla v prosinci 2015 provedena PET/CT bez patologie. Pacient je t. č. plně aktivní, bez obtíží. Poslední recentní sonografické vyšetření pravého třísla ze srpna 2016 neprokázalo recidivu onemocnění.
MATERIÁL A METODY
Chirurgicky odebraná tkáň byla fixována v 10% neutrálním formolu a zalita do parafínu. Histologické řezy byly barveny hematoxylinem a eosinem. Imunohistochemické vyšetření bylo provedeno v automatu Ventana Benchmark Ultra (Roche, Basilej, Švýcarsko), jako chromogen byl použit 3, 3 - diaminobenzidin tetrachlorid (DAB), k vizualizaci jader pak Mayerův hematoxylin. Pro imunohistochemický průkaz byly použity následující protilátky: chromogranin-A (DAK-A3, ředění 1 : 1200, Abcam, Cambridge, UK), synaptofyzin (SP11, předředěná, Roche), CD56 (123C3 předředěná, Roche), cytokeratin 20 (SP33, předředěná, Roche), cytokeratin (CAM 5.2, předředěná, Roche), Ki-67 (30-9, rědění 1 : 100, Dako, Glostrup, Dánsko), TTF1 (SP141, předředěný, Roche), LCA (RP2/18, předředěná, Roche) a S100 (králičí polyklonální, předředěná, Roche).
DNA byla izolována z jednoho parafínového řezu tloušťky 20 µm pomocí kitu Recover All Total Nucleic Acid Isolation Kit for FFPE (Termo Fisher Scientific, Waltham, Massachusetts, USA). Kvantifikace MCPyV DNA byla provedena pomocí real-time PCR s použitím primerů a TaqMan prób navržených pro oblast velkého T-antigenu, malého T-antigenu a pozdní oblasti VP1 genu (4,5). Pro normalizaci počtu kopií virového genomu byla použita real-time PCR s primery a próbou pro lidský RNáza P gen, který se v diploidní buňce vyskytuje ve dvou kopiích. Standardní křivky byly vytvořeny desítkovým ředěním standardů s odpovídající sekvencí pro MCPyV a RNázu P, které obsahovali známý počet kopií příslušné DNA. Počet virového genomu na buňku byl vypočten ze standardních křivek pro MCPyV a dělením polovinou počtu RNáza P genu ve vzorku. Detekce probíhala na přístroji RotorGene 3000 (Qiagen, Hilden, Spolková republika Německo). Jako standard pro MCPyV byl použit plazmid pCR.MCV350 (3), plazmid se sekvencí RNázy P genu byl připraven zaklonováním PCR produktu do pCR-BluntII-TOPO vektoru. Všechny PCR reakce byly prováděny v duplikátech v celkovém objemu 15 μl (6). cDNA byla připravena reversní transkripcí z 500ng izolované RNA, která byla nejprve ošetřena DNázou (Jena Bioscience, Jena, Spolková republika Německo), a následně byla provedena reverzní transkripce s M-MLV reverzní transkriptázou (Promega, Madison, Wisconsin, USA). Integrita cDNA byla ověřena amplifikaci beta-globinového genu (7). PCR s primery specifickými pro mRNA velkého T-antigenu (Forw 5‘TTC AAA AGA AGC TGC TTA AA 3’, v pozici na genomu MCPyV350 295-314, Rev 5‘ATA TAG GGG CCT CGT CAA CC 3’, v pozici 860-879) byla provedena pomocí Ampli Taq Gold polymerázy (Life Technologies (Termo Fisher Scientific), Waltham, Massachusetts, USA) (3).
VÝSLEDKY
Chirurgem exstirpovaná tkáň z pravého třísla byla tvořená lymfatickou uzlinou rozměrů 22x15x7 mm. Histologicky byla lymfatická uzlina téměř v celém rozsahu spotřebována maligním nádorem, který byl místy nekrotický, rostoucí ve formě solidních čepů. Nádorové buňky byly středně velké, s měchýřkovitým jádrem s chudší cytoplasmou, s přítomností hojných mitotických figur (obr. 1).
Obr. 1. Mikroskopicky je lymfatická uzlina infiltrována nádorem tvořeným středně velkými solidně uspořádanými elementy s hyperchromním jádrem. Jsou přítomny četné mitotické figury. 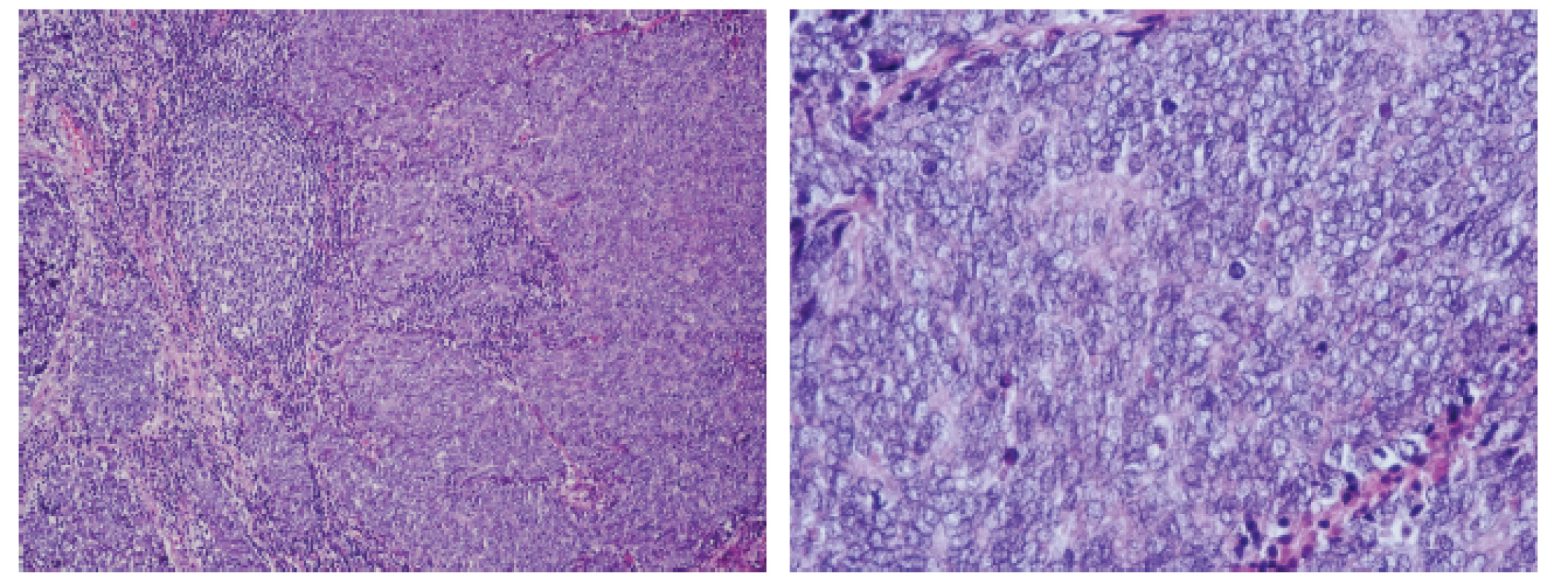
A - Hematoxylin-eosin, 100x. B - Hematoxylin-eosin, 400x. Imunohistochemicky vykazoval nádor expresi synaptofyzinu, chromograninu-A i CD56. Imunodetekce cytokeratinů CAM5.2 a CK 20 vykazovala paranukleární tečkovitou pozitivitu. Nádorové buňky neexprimovaly S-100, TTF-1 a LCA (obr. 2).
Obr. 2. Imunohistochemický nález. 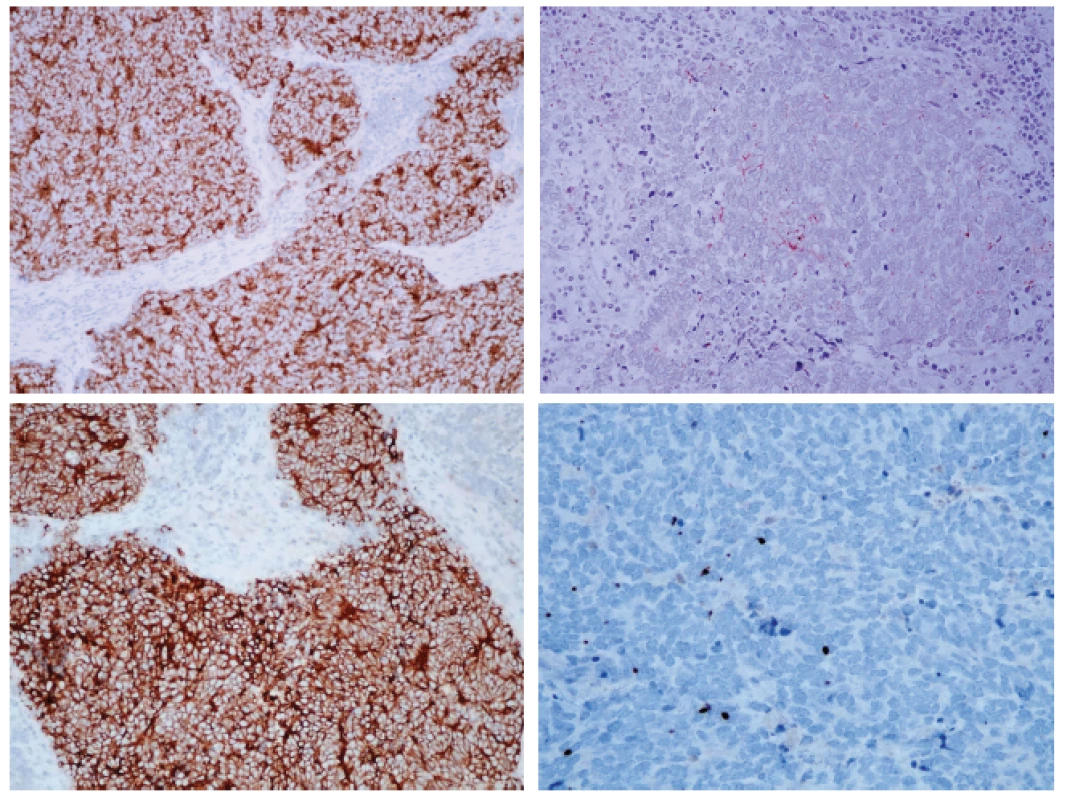
A - silná pozitivita synaptofysinu v nádoru. B - ložisková pozitivita chromograninu A. C - membránová pozitivita CD56. D - fokální paranukleární pozitivita cytokeratinu 20. E - Ki-67. (původní zvětšení 200x, 200x, 200x, 400x, 400x) Obr. 3. Reverzní transkripce a PCR s primery a próbami pro amplifikaci mRNA LT antigenu MCPyV: 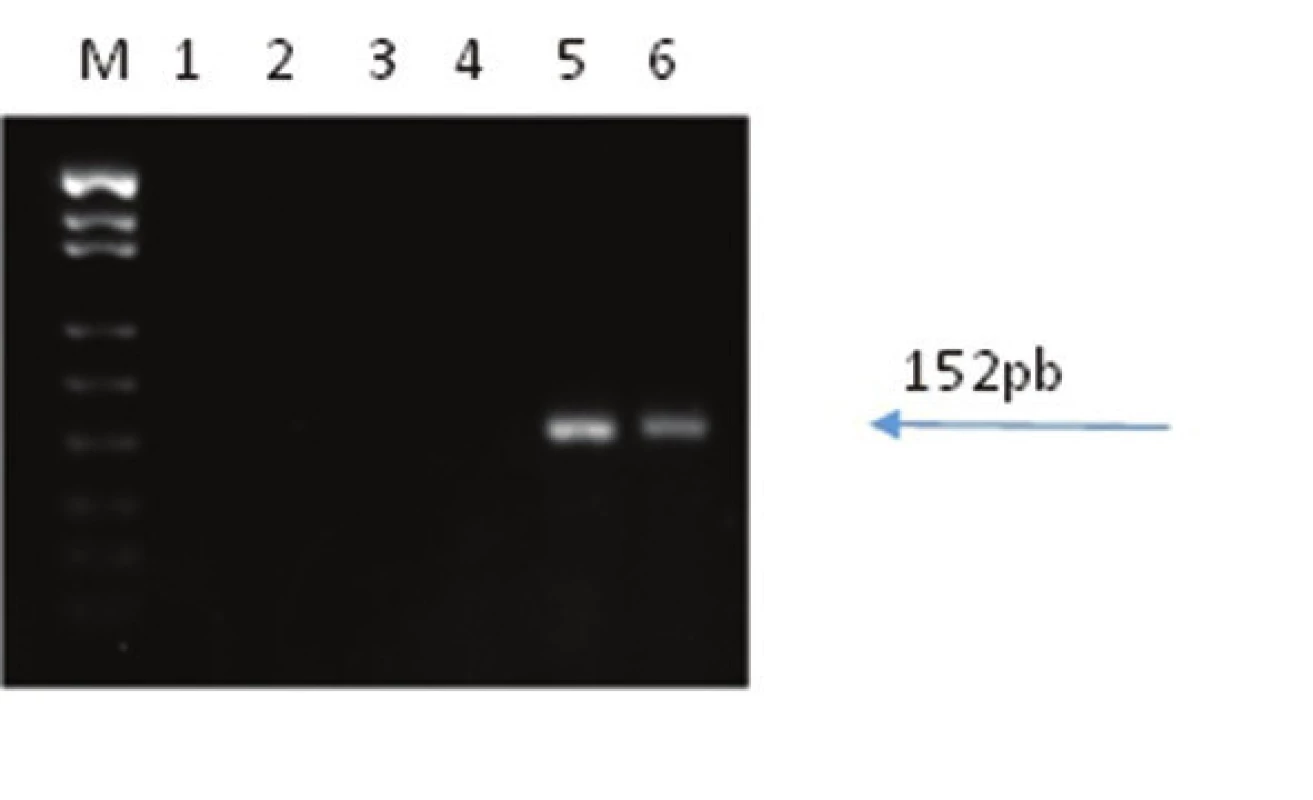
M hmotnostní marker pUC18/MspI, 1-4 představují negativní kontrolu krájení, kontrolu izolace, kontrolu DNázování a negativní kontrolu PCR, 5 testovaný vzorek, 6 pozitivní kontrola RNA z karcinomu z Merkelových buněk. Velikost RT-PCR produktu je 152pb. MCPyV DNA byla ve vzorku detekována pomocí všech tří použitých real-time PCR. Virová nálož byla 5 kopií MCPyV DNA na buňku. Všechny použité detekční systémy vykazovaly shodné výsledky. Virová mRNA velkého T antigenu byla ve vzorku přítomna.
DISKUZE
Karcinom z Merkelových buněk (MCC) představuje vzácný a vysoce agresivní kožní nádor. Případy prezentující se jako uzlinové postižení bez prokazatelného kožního nádoru (UPMCC), bývají ještě vzácnější a jsou popisovány v literatuře ve formě individuálních kazuistik, nebo malých souborů pacientů. Heath a spol. uvádějí 27 pacientů (14 %) s UPMCC v souboru 195 případů MCC (8). Deneve a spol. identifikovali 38 případů UPMCC (12 %) v souboru 321 nemocných s MCC (9).
Výskyt UPMCC není doposud objasněný. Nejčastěji bývají postiženy lymfatické uzliny inguinální, axilární a krční. Otázka, zda se jedná o primární tumor lymfatické uzliny, nebo o metastázu kožního MCC, který podlehl regresi, zůstává nezodpovězená. Spontánní a kompletní regrese kožního MCC je vzácným jevem a nejspíše nemůže být vysvětlením pro vznik všech případů UPMCC (10). Vzhledem k zásadním rozdílům v klinickém obrazu nelze vyloučit, že se jedná o nádorové onemocnění lišící se od kožního MCC. Překvapivá je též silná asociace UPMCC s jinými malignitami. Pan a spol. popisují například u 8 z 22 pacientů multisystémové nebo agresivní nádorového onemocnění před diagnózou UPMCC (11). Původní buňka, ze které kožní MCC vychází, je rovněž předmětem diskuze. Toker jako první popsal MCC kůže v roce 1972 pod názvem trabekulární karcinom kůže (12); na základě podobnosti v elektronmikroskopickém obraze byl o 6 let později postulován původ z Merkelových buněk (13). Merkelovy buňky exprimují znaky neuroendokrinní diferenciace a cytokeratin 20. Jedná se ale o postmitotické elementy, které nebývají infikovány MCPyV. MCC vzniká pravděpodobně z méně diferencovaných buněk, odpovídajících nejspíše epidermálním nebo dermálním kmenovým buňkám (14,15). Původ z prekurzorových elementů je též vysvětlením pro vysokou morfologickou heterogenitu MCC.
Diagnóza MCC vychází z mikroskopického obrazu a imunohistochemického průkazu znaků neuroendokrinní diferenciace. Ve většině případů bývá rovněž pozorována paranukleární tečkovitá pozitivita cytokeratinu 20. Pro diagnózu UPMCC je nezbytná klinicko-patologická korelace nálezu s vyloučením primárního kožního ložiska. Důležité je vyloučení metastatického postižení uzliny z jiné primární lokalizace, na prvním místě malobuněčným karcinomem plic, který vykazuje pozitivitu TTF-1 a bývá zpravidla cytokeratin 20 negativní (1,2).
Význam infekce MCPyV u pacientů s UPMCC je v různých publikacích interpretován různě. Pan a spol. (11) popisují polyomavirovou infekci v tumorech pouze u 4 z 13 pacientů, de Biase a spol. (16) ale prokázali infekci MCPyV u všech pěti UPMCC.
Pacienti s UPMCC v lymfatické uzlině spadají do stadia IIIB dle 7. vydání AJCC. U primárních kožních MCC je uzlinová metastáza asociována se špatnou prognózou, s pětiletým přežitím 42 % ve stadiu IIIA a 26 % ve stadiu IIIB (17). V rámci stagingu pacientů s MCC se začíná dostávat do popředí vyšetření sentinelové lymfatické uzliny, obraz histologického růstu nádorové metastázy může též ovlivňovat prognózu pacienta (18). Pozoruhodné je, že v porovnání s kožním MCC s uzlinovou metastázou mají pacienti s UPMCC patrně lepší prognózu, s mediánem přežití 18-104 měsíců (9,19,20). Vzhledem k malému dostupnému souboru pacientů je však vypovídající hodnota údajů o přežití omezená.
Vzhledem k tomu, že UPMCC se vyskytuje jen zřídka, nebyl prozatím dosažen konsenzus ohledně ideálního terapeutického postupu. Nemocní byli v různých souborech léčeni kombinací lokální excize, radikální lymfadenektomie, ozáření a adjuvantní chemoterapie. Kotteas a spol. v jejich souhrnu 90 případů z literatury identifikují nejpříznivější terapeutický účinek radikální lymfadenektomie s adjuvantní radioterapií (21). Význam chemoterapie na celkovou délku přežití u pacientů léčených radikální lymfadenektomií a radioterapií nebyl v důsledku malého rozsahu sledovaných souborů blíže hodnotitelný.
Cílem předloženého sdělení je poukázat na neobvyklou jednotku, jejíž diagnóza vyžaduje úzkou klinicko-patologickou a laboratorní spolupráci. Autoři by rádi upozornili i na možnost a dostupnost molekulární detekce polyomaviru karcinomu z Merkelových buněk v České republice, a to i z tkáně zpracované parafinovou technikou.
PODĚKOVÁNÍ
Práce byla podpořena projektem OPPK č. CZ.2.16/3.1.00/24024, financovaným z Evropského fondu pro regionální rozvoj (Praha & EU – Investujeme do vaší budoucnosti). Práce byla podpořena programem Ministerstva školství, mládeže a tělovýchovy „Národní programem udržitelnosti II (projekt BIOCEV-FAR) LQ1604“ a projektem ‘‘BIOCEV’’ (CZ.1.05/1.1.00/02.0109).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Arpád Szabó
Ústav patologie 3. LF UK
a FNKV
Šrobárova 50,
100 34 Praha 10
e-mail: arpad.szabomudr@yahoo.com
Zdroje
1. LeBoit P, Burg G, Weedon D, et al. Skin Tumours, World Health Organization Classification of Tumours (4th ed.). Lyon: IARCpress; 2006 : 272-273.
2. Jirásek T, Matěj R, Pock L, Knotková I, Mandys V. Karcinom z Merkelových buněk – imunohistochemická studie v souboru 11 pacientů. Cesk Patol 2009; 45(1): 9-13.
3. Feng H, Shuda M, Chang Y, Moore PS. Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 2008; 319(5866): 1096-1100.
4. Toracchio S, Foyle A, Sroller V, Reed JA, Wu J, Kozinetz CA, Butel JS. Lymphotropism of Merkel cell polyomavirus infection, Nova Scotia, Canada. Emerg Infect Dis 2010; 16 (11):1702-1709.
5. Rodig SJ, Cheng J, Wardzala J, et al. Improved detection suggests all Merkel cell carcinomas harbor Merkel polyomavirus. J Clin Invest 2012; 122(12): 4645-4653.
6. Saláková M, Košlabová E, Vojtěchová Z, Tachezy R, Šroller V. Detection of human polyomaviruses MCPyV, HPyV6, and HPyV7 in malignant and non-malignant tonsillar tissues. J Med Virol 2016; 88(4): 695-702.
7. Rotnáglová E, Tachezy R, Saláková M, et al. HPV involvement in tonsillar cancer: Prognostic significance and clinically relevant markers. International Journal of Cancer 2011; 129 : 101-110.
8. Heath M, Jaimes N, Lemos B, Mostaghimi A, Wang LC, Peñas PF, Nghiem P. Clinical characteristics of Merkel cell carcinoma at diagnosis in 195 patients: the AEIOU features. J Am Acad Dermatol 2008; 58(3): 375-381.
9. Deneve JL, Messina JL, Marzban SS, et al. Merkel cell carcinoma of unknown primary origin. Ann Surg Oncol 2012; 19(7): 2360-2366.
10. Cirillo F. Spontaneous Regression of Primitive Merkel Cell Carcinoma. Rare Tumors 2015; 7(4): 5961.
11. Pan Z, Chen Y, Wu X, et al. Merkel cell carcinoma of lymph node with unknown primary has a significantly lower association with Merkel cell polyomavirus than its cutaneous counterpart. Mod Pathol 2014; 27(9): 1182-1192.
12. Toker C. Trabecular carcinoma of the skin. Arch Dermatol 1972; 105(1): 107-110.
13. Tang CK, Toker C. Trabecular carcinoma of the skin: an ultrastructural study. Cancer 1978; 42(5): 2311-2321.
14. Erovic I, Erovic BM. Merkel cell carcinoma: the past, the present, and the future. J Skin Cancer 2013; Article ID 929364.
15. Tilling T, Moll I. Which are the cells of origin in Merkel cell carcinoma? J Skin Cancer 2012; Article ID 680410.
16. de Biase D, Ragazzi M, Asioli S, Eusebi V. Extracutaneous Merkel cell carcinomas harbor polyomavirus DNA. Hum Pathol 2012; 43(7): 980-985.
17. Wang TS, Byrne PJ, Jacobs LK, Taube JM. Merkel cell carcinoma: update and review. Semin Cutan Med Surg 2011; 30 : 48-56.
18. Ko JS, Prieto VG, Elson PJ, et al. Histological pattern of Merkel cell carcinoma sentinel lymph node metastasis improves stratification of Stage III patients. Mod Pathol 2016; 29(2): 122-130.
19. Chen KT, Papavasiliou P, Edwards K, et al. A better prognosis for Merkel cell carcinoma of unknown primary origin. Am J Surg 2013; 206(5): 752-757.
20. Tarantola TI, Vallow LA, Halyard MY, et al. Unknown primary Merkel cell carcinoma: 23 new cases and a review. J Am Acad Dermatol 2013; 68(3): 433-440.
21. Kotteas EA, Pavlidis N. Neuroendocrine Merkel cell nodal carcinoma of unknown primary site: management and outcomes of a rare entity. Crit Rev Oncol Hematol 2015; 94(1): 116-121.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2017 Číslo 3-
Všechny články tohoto čísla
- Novinky vo WHO klasifikácii hematologických malignít 2016
- Recenze knihy
- S laureátom Lamblovej ceny za rok 2016
- MONITOR aneb nemělo by Vám uniknout, že...
- Úvodné poznámky k tzv. revízii WHO klasifikácie nádorov krvotvorného a lymfatického tkaniva z r. 2016
- Zmeny WHO klasifikácie myeloidných neoplázií v kontexte revízie z roku 2016
- Zmeny WHO klasifikácie lymfoidných neoplázií v kontexte revízie z roku 2016
- Izolovaná infekční endokarditida pulmonální chlopně: kazuistika
- Jaká je Vaše diagnóza? (1)
- Uzlinová metastáza karcinomu z Merkelových buněk bez kožního primárního ložiska – kazuistické sdělení
-
Jaká je Vaše diagnóza? (1)
Odpověď - JAN JESENSKÝ - JESSENIUS (1566 - 1621)
- Jaká je Vaše diagnóza? (2)
- Alternativní kontrastování pro elektronovou mikroskopii
-
Jaká je Vaše diagnóza? (2)
Odpověď
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Uzlinová metastáza karcinomu z Merkelových buněk bez kožního primárního ložiska – kazuistické sdělení
- JAN JESENSKÝ - JESSENIUS (1566 - 1621)
- Zmeny WHO klasifikácie lymfoidných neoplázií v kontexte revízie z roku 2016
- Izolovaná infekční endokarditida pulmonální chlopně: kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



