-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Exprese mikroRNA jako nový potenciální diagnostický nástroj pro karcinom endometria
Differential expression of microRNAs as the novel potential diagnostic tool for the endometrial carcinoma
The most common gynecological malignancy, the endometrial carcinoma, is mostly diagnosed at early stages. However, diagnosis at advanced stages is accompanied by the high mortality rate. It is suggested that this cancer is one of the less studied female cancers. The necessity to establish novel diagnostic markers has led to investigations of small non-coding RNAs, particularly microRNAs, also in endometrial cancer. There have been found many microRNAs potentially associated with carcinogenesis and clinico-pathological data including prognosis for patients. Many microRNAs may also serve as diagnostic markers for non-invasive diagnostics using blood plasma. We reviewed extensively the published research focused on microRNAs that have been found deregulated particularly in tissue samples within the both major types of endometrial cancer (type 1 and type 2). They are presented in the view of their potential targets and mechanisms of action. Some microRNAs have been found deregulated also in blood plasma. There exists a high level of inconsistency across the studies as many microRNAs have been found only within one or a few studies so far. However, there are some microRNAs consistently deregulated as suggested several investigations. There remains the urgent need of more intensive research focused on the microRNAs and their regulatory role in endometrial cancer. Such a research should provide the basis for the introducing novel diagnostic tools into the clinical practice.
Keywords:
endometrial carcinoma – endometrioid –non-endometrioid – adenocarcinoma – diagnostics – prognosis – microRNA – exprese – marker – regulation
Autoři: L. Záveský 1; R. Turyna 2; M. Kohoutová 1
Působiště autorů: Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha, přednostka doc. MUDr. M. Kohoutová, CSc. 1; Ústav pro péči o matku a dítě, Praha, ředitel doc. MUDr. J. Feyereisl, CSc. 2
Vyšlo v časopise: Ceska Gynekol 2013; 78(5): 432-442
Kategorie: Původní práce
Souhrn
Nejběžnější gynekologické nádorové onemocnění, karcinom endometria, je diagnostikováno ve většině případů v časných stadiích. U pozdních stadií je onemocnění provázeno vysokou mortalitou. Uvádí se, že karcinom endometria je nejméně studovaným typem nádorových onemocnění u žen. Potřeba nových diagnostických postupů vedla v posledních letech ke studiu potenciálních diagnostických markerů v oblasti malých nekódujících RNA, tedy především mikroRNA, také u karcinomu endometria. Byla tak nalezena řada mikroRNA, které mohou mít souvislost s karcinogenezí, klinicko-patologickými daty včetně prognózy pro pacientky, a také takových, které by mohly sloužit jako diagnostické markery pro neinvazivní diagnostiku z krevní plazmy. V článku přinášíme souhrnný přehled mikroRNA, jejichž exprese byla nalezena deregulovaná především v tkáních u obou hlavních typů karcinomu endometria a také v krevní plazmě. Určité mikroRNA uvádíme ve spojitosti s jejich možnou rolí jako buněčných regulátorů s potenciálními cíli jejich působení. Některé mikroRNA se ukázaly jako relativně konzistentně deregulované napříč studiemi, nicméně většina identifikovaných mikroRNA byla nalezena pouze v jednom nebo několika málo výzkumech. Ukazuje se tak potřeba intenzivnějšího výzkumu těchto regulačních molekul u karcinomu endometria, vedoucího k možnému zavedení nových diagnostických postupů do klinické praxe.
Klíčová slova:
karcinom endometria – endometrioidní –non-endometrioidní – adenokarcinom – diagnostika – prognóza – mikroRNA – exprese – marker – regulaceÚVOD
Karcinom endometria je nejběžnější gynekologické nádorové onemocnění a současně v pořadí čtvrté nejběžnější nádorové onemocnění u žen [31], které v České republice postihuje asi 1900 pacientek ročně. Více než 60 % případů tvoří pacientky ve věku 50–70 let [9]. Většina pacientek s karcinomem endometria je diagnostikována v časném stadiu I (přibližně 68 % [9, 14]). Pravděpodobnost pětiletého přežití klesá s pokročilostí onemocnění a je 95 % u časných, lokalizovaných stadií I a II, 67 % u stadií zahrnujících postižení regionálních uzlin (stadium III) a 16 % u metastaticky rozšířeného onemocnění v nejpokročilejším stadiu IV [14]. Pokročilá stadia tohoto onemocnění spojená s vysokou mortalitou ukazují na potřebu najít nové diagnostické a terapeutické postupy pro toto nádorové onemocnění.
HETEROGENITA KARCINOMU ENDOMETRIA
Karcinom endometria je heterogenní malignitou s různými histologickými typy, lišícími se patogenezí, klinickým průběhem onemocnění i prognózou pro pacientky [34]. Převažuje sporadická forma (90 % případů), zatímco hereditární forma vysvětluje asi 10 % případů [1, 8]. Hereditární forma karcinomu endometria je indukována mutacemi DNA mismatch repair (MMR) genů u Lynchova syndromu [10].
Dále se rozlišuje typ 1 endometriálních karcinomů (70–80 % případů [2]), s převažujícími endometrioidními karcinomy. Tyto karcinomy souvisí s estrogenovou expozicí (exprimují estrogenové a progesteronové receptory). Rizikové faktory zde představují obezita, anovulace, nulliparita a exogenní estrogeny. Prekurzorem typu 1 je hyperplazie endometria. Většinou jde o low-grade tumory s příznivou prognózou pro pacientky [1]. Typické jsou zde mutace genů PTEN, AKT, mTOR, K-ras a β-kateninu (CTNNB1) a mikrosatelitová nestabilita, nicméně tyto alterace se nevyskytují uniformně u všech endometrioidních karcinomů [34]. Karcinomy endometria typu 2 jsou obvykle non-endometrioidní, high-grade, papilárně serózní nebo světlobuněčné histologie a nesouvisí s estrogenovou expozicí. Vychází z atrofického endometria, mají agresivní klinický průběh se zhoršenou prognózou přežití pro pacientky. Typická je zde aneuploidie a mutace p53 [8, 11].
DIAGNOSTIKA A LÉČBA KARCINOMU ENDOMETRIA
Diagnostika karcinomu endometria je založena na vyšetření symptomatických pacientek, tzn. pacientek s projevy nádorového onemocnění endometria (metroragie, bolesti, fluor) a na bioptické verifikaci asymptomatických pacientek s nadlimitní výškou endometria při sonografickém vyšetření. Celoplošný screening karcinomu endometria není dosud efektivní, a není tedy doporučován pro rutinní praxi. Pouze vysoce rizikové skupiny pacientek mají přínos z pravidelného vyšetření, nejčastěji transvaginální sonografií. Staging karcinomu endometria je založen na histologickém vyšetření po primární operaci. Chirurgický staging na doporučení FIGO (Federation of Gynecology and Obstetrics) nahradil od roku 1988 staging klinický. Chirurgická léčba karcinomu endometria spočívá v hysterektomii s oboustrannou adnexektomií, exploraci dutiny břišní a v systematické pánevní a paraaortální lymfadenektomii. Předpokládaný léčebný efekt lymfadenektomie nebyl v recentních studiích prokázán a z tohoto výkonu neprofitují pacientky zařazené do low-risk skupiny (IA, G1a2). Provedení lymfadenektomie je v časných stadiích u rizikových skupin založeno na vyhodnocení rizikových faktorů v děloze, které se stanovují z materiálu odebraného k frozen section. Významné riziko postižení lymfatických uzlin je úměrné hloubce invaze tumoru do endometria a stupni histologické dediferenciace tumoru. Nepřesnost v předoperační diagnostice hloubky invaze a upgrading finální histologie oproti peroperační frozen section jsou faktory, které mají vliv na provedení kompletního chirurgického stagingu. Pacientky s karcinomem endometria (typ 1) jsou velmi často polymorbidní a ve vyšším věku, což vede velmi často k vynechání systematické lymfadenektomie, a tedy k nekompletnímu stagingu s vlivem na rozhodování o adjuvantní radioterapii. I přes četná detailní doporučení v léčbě karcinomu endometria, vykazuje skupina těchto pacientek značnou nehomogennost v chirurgické léčbě a vysoký podíl nekompletního stagingu. Stanovení prognostických a prediktivních faktorů pomocí metod molekulární biologie by mohlo ovlivnit rozhodovací algoritmus v léčbě karcinomu endometria a zvýšit naději na celoplošný screening tohoto nejčastějšího karcinomu genitálního traktu u žen.
MIKRORNA – ROLE, MECHANISMY PŮSOBENÍ A PROBLÉMY S INTERPRETACÍ DAT
S objevem nových regulačních molekul, tzv. malých nekódujících RNA (především mikroRNA), došlo v posledním desetiletí k intenzivnímu výzkumu jejich role v mnoha buněčných procesech, od buněčného dělení až po programovanou buněčnou smrt (blíže viz např. [7, 20]). Velké množství studií ukázalo jejich významný potenciál pro budoucí zavedení nových diagnostických postupů pro různé patologické stavy.
Výjimečnou schopností mikroRNA je regulace exprese genů na posttranskripční úrovni. Výsledkem je snížení exprese regulovaného genu. Z hlediska role mikroRNA v karcinogenezi se rozeznávají dvě hlavní skupiny. Cílem tumor supresorových mikroRNA jsou často onkogeny, výsledkem je snížení exprese daného onkogenu (obr. 1). Onkogenní mikroRNA naopak mohou působit regulačně na tumor supresory a dochází k nadprodukci onkogenního proteinu (obr. 2). Diferenciální exprese mikroRNA, buď zvýšená (upregulovaná), nebo snížená (downregulovaná), detekovatelná v různých typech tkání a tělních tekutin se může stát základem pro novou diferenciální diagnostiku asociovanou s různými typy (nejen) nádorových onemocnění, ale také pro získání nových prognostických a terapeutických postupů [7, 20].
Obr. 1. Epigenetická kontrola exprese mikroRNA. V případě normální buňky je udržována hladina onkogenu v normě působením mikroRNA (vlevo). U nádorových buněk (vpravo) může být exprese mikroRNA snížena epigeneticky metylací a ztrátou acetylace u mikroRNA genu, vedoucí k nižší regulaci cílového onkogenu a příslušného onkoproteinu, který se tak v buňce akumuluje. Upraveno podle [7]. ![Epigenetická kontrola exprese mikroRNA. V případě normální buňky je udržována hladina onkogenu v normě působením mikroRNA (vlevo). U nádorových buněk (vpravo) může být exprese mikroRNA snížena epigeneticky metylací a ztrátou acetylace u mikroRNA genu, vedoucí k nižší regulaci cílového onkogenu a příslušného onkoproteinu, který se tak v buňce akumuluje. Upraveno podle [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d42029c3e8c3475f4d0afed12f00d925.jpg)
Použití upraveného obrázku se souhlasem vlastníka autorských práv, společnosti Elsevier (číslo licence 3153640572223). CH3 – metylcytosin; HMT – histon metyl-transferáza; HDAC – histon acetyl-transferáza; CpG – CpG ostrov; Ac – acetylová skupina; H3-Me – trimetylace histonu H3; ATG – translační start kodon; TGA – translační stop kodon. Obr. 2. Transkripční kontrola exprese mikroRNA. V normální buňce probíhá normální regulace transkripce mikroRNA genů pomocí transkripčních faktorů (vlevo). Zvýšená exprese a/nebo aktivace transkripčního faktoru v nevhodnou dobu nebo prostoru (vpravo) může vést ke zvýšení exprese mikroRNA regulujících tumor supresorový gen, a tím ke snížení jeho exprese u nádorových buněk. Upraveno podle [7]. ![Transkripční kontrola exprese mikroRNA. V normální buňce probíhá normální regulace transkripce mikroRNA genů pomocí transkripčních faktorů (vlevo). Zvýšená exprese a/nebo aktivace transkripčního faktoru v nevhodnou dobu nebo prostoru (vpravo) může vést ke zvýšení exprese mikroRNA regulujících tumor supresorový gen, a tím ke snížení jeho exprese u nádorových buněk. Upraveno podle [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/11cea965861caf566501e07d93f4fd63.jpg)
Použití upraveného obrázku se souhlasem vlastníka autorských práv, společnosti Elsevier (číslo licence 3153640572223). TF – transkripční faktor; ATG – translační start kodon; TGA – translační stop kodon. Hlavní výhodou studia mikroRNA ve srovnání např. s mRNA je jejich vyšší stabilita. Na druhou stranu, rozsáhlejšímu zavedení stanovení diferenciální exprese mikroRNA do klinické praxe v současnosti brání řada důvodů, v důsledku vedoucích k neporovnatelnosti studií. Zcela zásadní je pak mizivé zastoupení studií používajících vzorky s vyšším diagnostickým potenciálem (krev, plazma/sérum, moč, sliny), přestože bylo prokázáno, že mikroRNA se vyskytují v různých tělních tekutinách v podobě extracelulární RNA, deponované např. v exozomech nebo proteinových komplexech. Naprostá většina studií tak pracuje pouze se vzorky tkání nebo buněčných linií, kde je přímý diagnostický potenciál významně nižší.
EXPRESE MIKRORNA U KARCINOMU ENDOMETRIA
První studie zaměřená na expresi mikroRNA u endometrioidního typu karcinomu endometria byla publikována v roce 2008. Byla tak identifikována diferenciální exprese u 13 mikroRNA [3] (viz tab. 1 a 5). Následoval výzkum zaměřený na endometriózu, který identifikoval 14 upregulovaných a 8 downregulovaných mikroRNA u ektopických endometriálních tkání [33].
Tab. 1. Zvýšená exprese mikroRNA, primární karcinom endometria, typ 1 versus normální endometrium 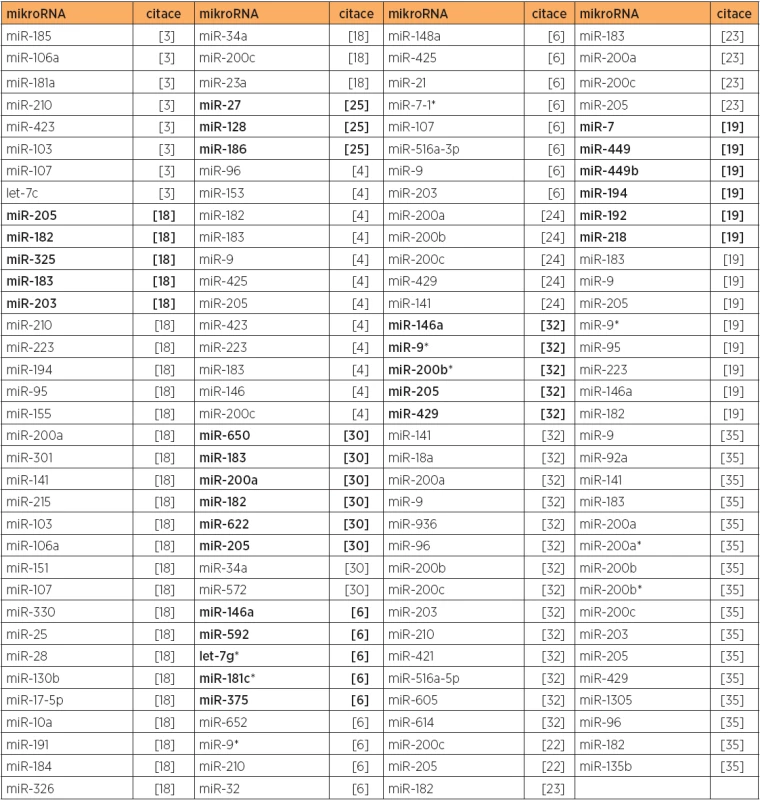
Poznámka. Tučně jsou uvedeny nejvíce dergulované mikroRNA v dané studii. U citace [6] jsou zahrnuty mikroRNA upregulované pouze u typu 1. V jiné studii [18] byla nalezena diferenciální exprese (upregulace) 30 mikroRNA u endometriodního typu karcinomu endometria (tab. 1). Zvýšená exprese miR-200a a miR-205 zde byla korelována s pokročilými stadii, zvýšená exprese miR-205 byla asociována s invazí myometria a recidivou, a zvýšená exprese miR-10a, miR-34a a miR-95 byla spojena s postižením lymfatických uzlin [18]. Vyšší exprese miR-205 byla též asociována s horší prognózou přežití v recentní studii [22]. Zvýšená exprese rodiny miR-200 (miR-141, miR-200a, miR-200b, miR-200c, a miR-429) byla potvrzena také v dalších studiích [5, 6, 22, 23, 24, 32, 35]. Ztráta exprese miR-129 u 27 z 31 primárních endometriálních tumorů endometrioidního typu byla asociována se zvýšenou expresí potenciálního onkogenu SOX4 a hypermetylací miR-129-2 CpG ostrovu [15]. Studie zaměřená na mikroRNA potenciálně zahrnuté v regulaci tumor supresorového genu FOXO1 (u karcinomu endometria je downregulován) ukázala, že za použití umělého zvýšení exprese miR-9, miR-27, miR-96, miR-153, miR-182, miR-183 nebo miR-186 u buněčné linie HEC-1B bylo dosaženo snížení exprese FOXO1. Naopak, při použití umělého snížení exprese miR-9,miR-27a, miR-96, miR-153, miR-183 nebo miR-186 došlo k indukci exprese FOXO1 u buněčné linie Ishikawa [25].
U endometriálních serózních adenokarcinomů byla nalezena diferenciální exprese u 120 mikroRNA, z toho 54 bylo downregulovaných a 66 upregulovaných [12] (tab. 10 a 11). V uvedené studii byla zjištěna korelace snížené exprese miR-10b*, miR-29b a miR-455-5p s vaskulární invazí. Také byla univariantní analýzou nalezena korelace nižší exprese miR-101, miR-10b*, miR-139-5p, miR-152, miR-29b a miR-455-5p se zhoršeným celkovým přežitím, a snížená exprese miR-152, miR-29b a miR-455-5p byla asociována se zhoršením přežití bez progrese onemocnění (disease-free survival). V multivariační analýze bylo zjištěno, že miR-152 (nižší exprese) je nezávislý rizikový faktor pro celkové přežití, a miR-101 a miR-152 byly při nižší expresi nezávislými rizikovými faktory pro zhoršené přežití bez progrese onemocnění [12].
Při porovnání estrogen-dependentní buněčné linie (Ishikawa) a estrogen-independentní buněčné linie (KLE) byla zjištěna diferenciální exprese 126 mikroRNA [39]. MikroRNA, predikované pro regulaci genu ESR1 (estrogen receptor α), byly miR-100 a miR-99a, a pro regulaci genu PGR (progesteron receptor) miR-378 a miR-768-3p [39].
Rozsáhlá profilační studie exprese mikroRNA [4] ukázala při porovnání stadia I endometrioidních karcinomů a normálních kontrol 7 mikroRNA se zvýšenou expresí a 8 mikroRNA se sníženou expresí [4] (viz tab. 1, 2 a 5). Ukázalo se také, že lze odlišit i nejméně maligní stadium IA, grade 1 endometrioidních karcinomů od referenčních vzorků. Byly rovněž definovány mikroRNA, které svou diferen-ciální expresí odlišily časná stadia I a pokročilá stadia III a IV (viz tab. 2). U pokročilých stadií se ukázala zvýšená exprese miR-199a jako prognostický faktor pro zlepšenou prognózu přežití [4].
Tab. 2. Zvýšená exprese mikroRNA, primární karcinom endometria, pokročilá stadia typ 1 + papilární serózní versus stadium I 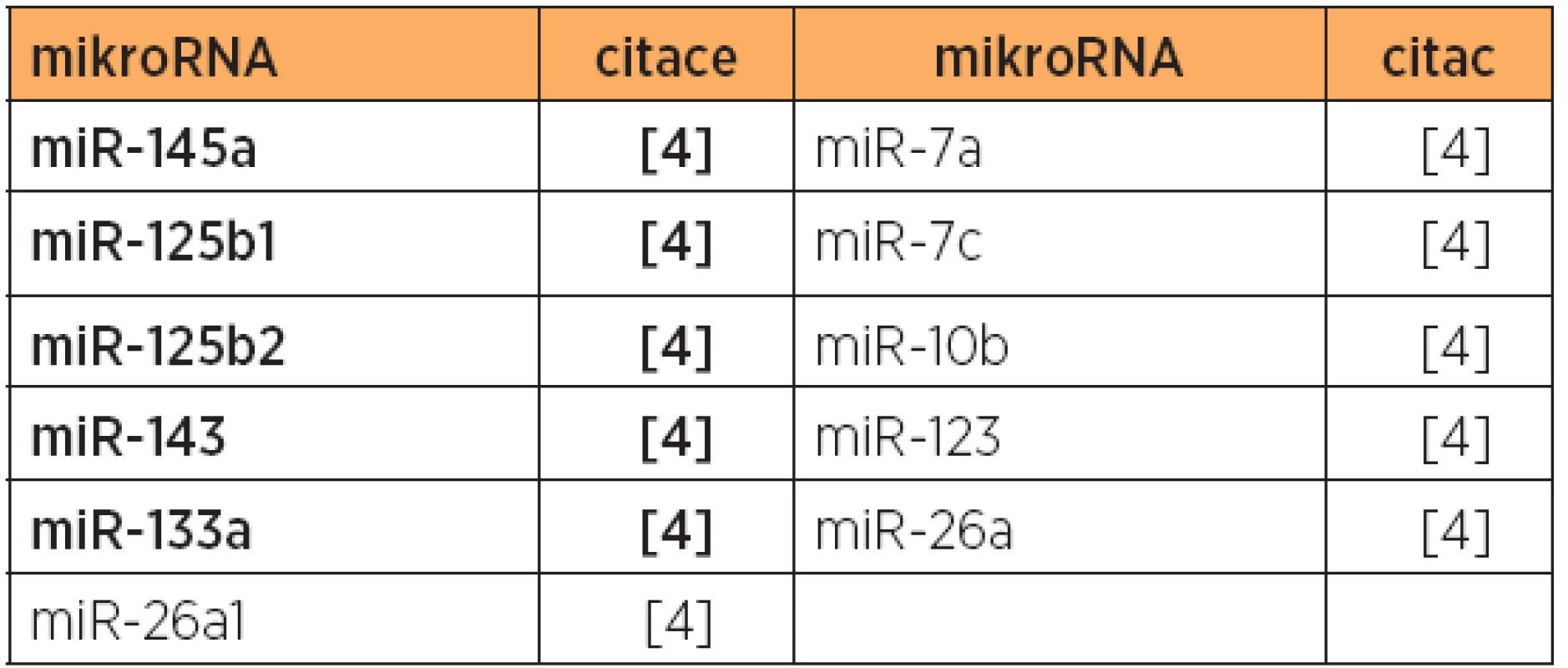
Poznámka: Tučně jsou uvedeny nejvíce deregulované mikroRNA v dané studii. V jiné studii [30] byla zjištěna diferenciální exprese 10 mikroRNA u endometrioidního typu, a to u 8 mikroRNA se zvýšenou expresí, a 2 mikroRNA se sníženou expresí [30] (viz tab. 1 a 5). V této studii byly dále zjištěny rozdíly v expresi mikroRNA, umožňující odlišit endometrioidní (typ 1) a papilární serózní karcinomy (typ 2) [30] (viz tab. 7), a také byl prokázán specifický expresní profil mikroRNA karcinosarkomů v porovnání s karcinomy endometria [30] (viz tab. 3, 8 a 9).
Tab. 3. Zvýšená exprese mikroRNA - endometrioidní a serózní typ versus karcinosarkom 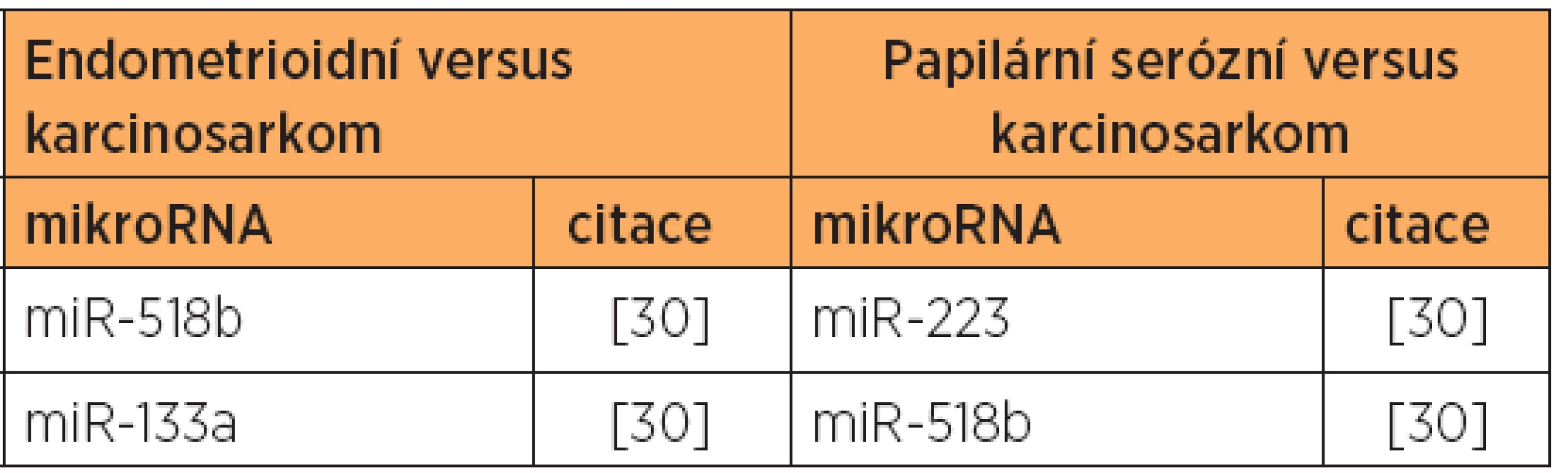
V jiné recentní studii bylo nalezeno 43 mikroRNA, které byly schopny rozdílnou expresí odlišit endometriální karcinomy od předpokládaných prekurzorových tkání (komplexní atypické hyperplazie) i referenčních normálních tkání (viz tab. 1 a 5).
Následovala řada experimentálně zaměřených prací. Výzkumu role miR-145 se věnovala studie [37], jež prokázala její tumor supresorovou funkci (regulace genu OCT4 – core pluripotency factor) a souvislost s diferenciací buněk v linii Ishikawa i tkání [37]. K potvrzení onkogenní role miR-125b došlo ve studii [21], kde umělé zvýšení exprese miR-125b vedlo ke zvýšení proliferace a migrace Ishikawa buněk (ER pozitivní) a také se tumor supresorový gen Tumor Protein 53 – Induced Nuclear Protein 1 (TP53INP1) ukázal jako přímý cíl jejího působení [21].
MikroRNA miR-152 je naopak tumor supresorová miRNA se sníženou expresí u karcinomu endometria. Cílem jejího působení je DNA methyl-transferase DNMT1. Experimentálně bylo prokázáno, že nastolení normální exprese miR-152 vede k potlačení růstu nádorů in vitro i in vivo [36]. Další tumor supresorovou mikroRNA je miR-206, u které byla nalezena negativní korelace s expresí estrogen receptoru α (ER-α, na úrovni mRNA i proteinu), a supresivní efekt miR-206 na expresi ER-α. Byla prokázána schopnost miR-206 in vitro inhibovat buněčný růst, blokovat buněčný cyklus a oslabovat invazivitu u ERalpha pozitivních EEC buněčných linií [16]. Jako další potenciálně tumor supresorová mikroRNA se ukázala miR-30c, která při své zvýšené expresi inhibuje proliferační, migrační a invazivní schopnosti buněčných linií karcinomu endometria [40].
Zvýšená exprese miR-200c u endometriálních karcinomů obou typů (1 i 2) byla předmětem další experimentální práce [27], ve které se ukázalo, že umělé snížení její exprese může vést k regulaci buněčného přežití, proliferace či apoptózy a může ovlivňovat cytotoxicitu u buněčných linií. Cílem jejího působení je BRD7 (potenciální tumor supresor) [27].
V jiné studii [19] byla kromě identifikace 16 mikroRNA deregulovaných u vzorků endometrioidního karcinomu endometria (viz tab. 1 a 5) zkoumána interakce mezi miR-204 a jejím cílem FOXC1 [19]. Umělé zvýšení její exprese stejně jako umělé snížení exprese miR-7, miR-194 a miR-449b vedlo k potlačení migrace a invaze u buněčné linie HEC1A [19].
Jako onkogenní miRNA se ukazuje miR-103, která down-reguluje tumor supresor TIMP-3 a stimuluje růst a invazi u buněčných linií endometriálního karcinomu [38]. Jiná onkogenní miRNA je miR-155, jejímž cílem je angiotenzin II type 1 receptor (AGTR1). U karcinomu endometria byla nalezena zvýšená exprese miR-155 a antiproliferativní efekt jejích inhibitorů, snižujících viabilitu buněk buněčných linií HEC-1A, Ishikawa a KLE [17]. Kombinovaná aplikace losartanu a anti-miR-155 vedla k výraznějšímu antiproliferativnímu účinku, než jaký byl zjištěn při samostatné aplikaci uvedených inhibitorů. Známá onkogenní mikroRNA, miR-21, se uplatňuje také u karcinomu endometria svou zvýšenou expresí. Jejím regulačním cílem je PTEN (phosphatase and tensin homolog, mající funkci tumor supresoru) [28]. Další dvě mikroRNA, jejichž zvýšená exprese byla asociována s přechodem od normální tkáně endometria k nádorové, jsou miR-98 a miR-181a, s potenciálními cíli svého regulačního působení PGRMC1, PGR, CYP19A1, TIMP3 a DDX3X [26].
V jiné profilační studii bylo objeveno 20 společně deregulovaných mikroRNA ve srovnání endome-triálních karcinomů (obou typů 1 a 2) a normální tkáně [6]. Zde bylo 7 mikroRNA downregulovaných (tab. 6) a 13 mikroRNA upregulovaných (tab. 4). Při porovnání typu 1 a referenčních vzorků bylo nalezeno 38 specificky deregulovaných mikroRNA (viz tab. 1 a 5), tedy třikrát více než u typu 2 vs. referenční tkáně(12 mikroRNA). Současně bylo nalezeno 17 mikroRNA, které svou expresí odlišily tumory typu 1 (endometriodní) a typu 2 (serózní) [6] (tab. 10, 11).
Tab. 4. Zvýšená exprese mikroRNA - společně upregulované mikroRNA pro typ 1 a typ 2, versus normální endometrium 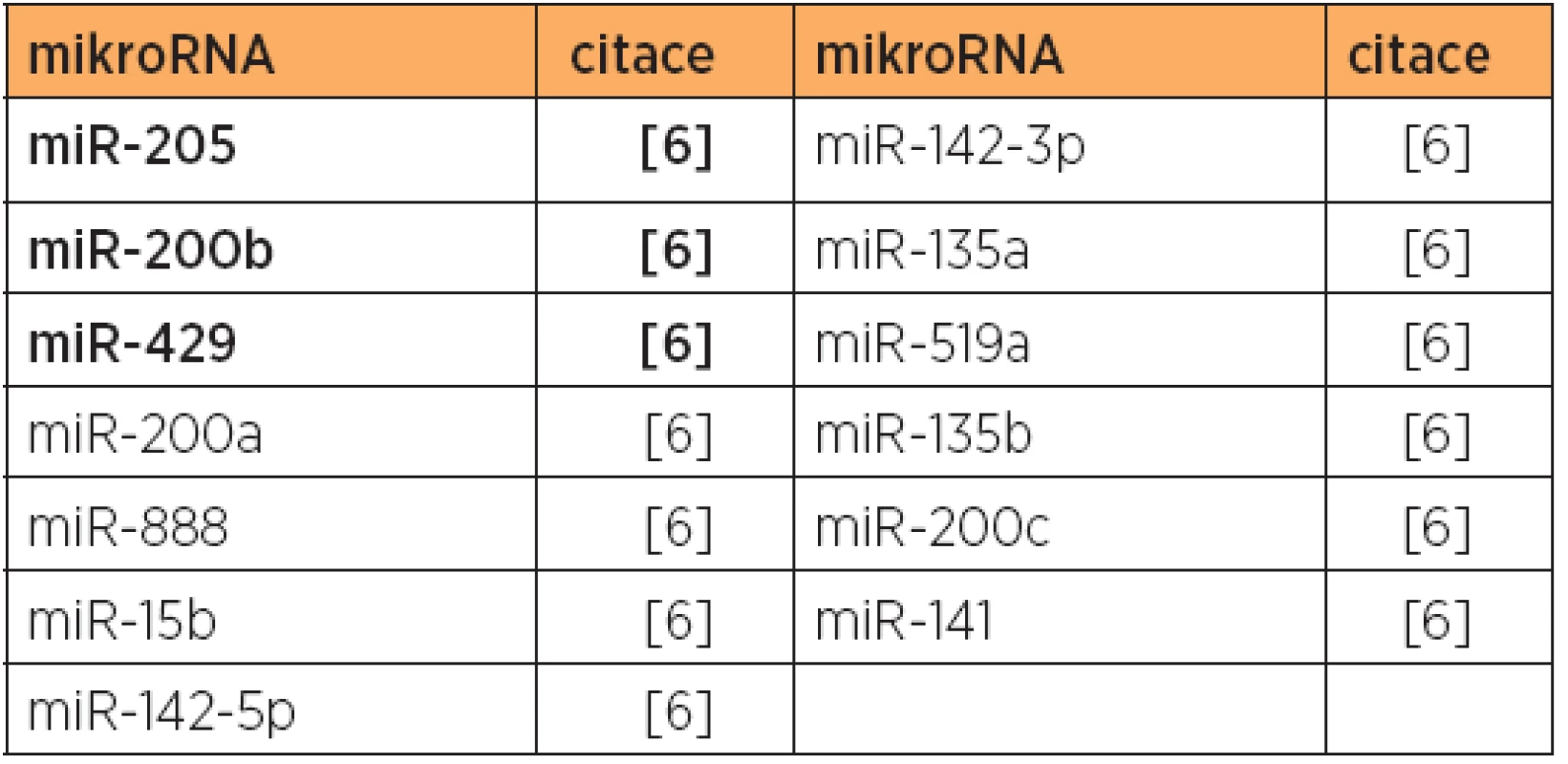
Poznámka: Tučně jsou uvedeny nejvíce deregulované mikroRNA v dané studii. Další studie [13] identifikovala 83 specificky downregulovaných mikroRNA u typu 1 (tab. 5) a 6 mikroRNA specificky downregulovaných u typu 2 (tab. 11). Bylo nalezeno 48 společně downregulovaných mikroRNA pro oba typy (tab. 6), kde největší snížení exprese (40násobné) bylo zaznamenáno u miR-34b. Po experimentální normalizaci exprese miR-34b došlo u linií SPAC-1-L a USPC-1 k inhibici růstu, migrace a invaze a zvýšené apoptóze [13].
Tab. 5. Snížená exprese mikroRNA, typ 1 versus normální endometrium 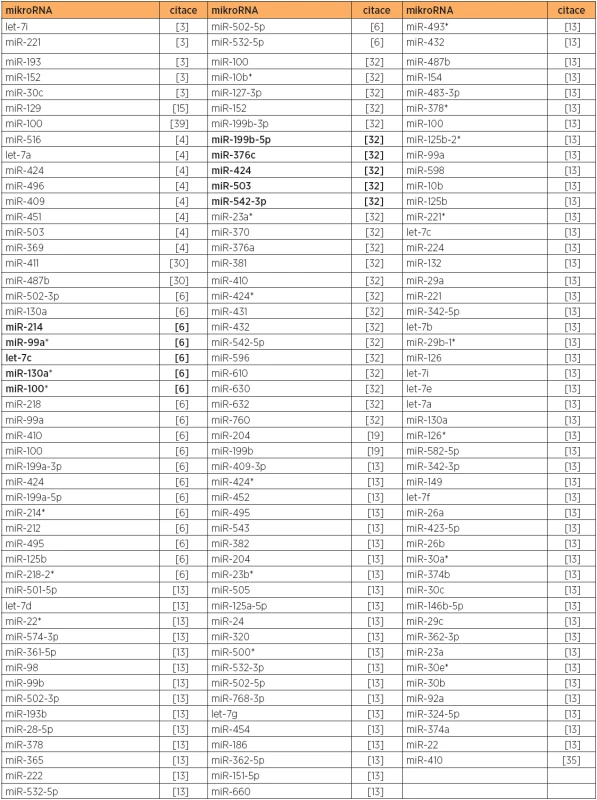
Poznámka: Tučně jsou uvedeny nejvíce deregulované mikroRNA v dané studii. Teprve v roce 2012 byla publikována práce, která analyzovala kromě tkání také vzorky plazmy u endometriodního typu karcinomu endometria [34]. Primární zaměření studie bylo na expresi mikroRNA regulujících mTOR kinázu (miR-99a, miR-100 a miR-199b). Zvýšená exprese mTOR kinázy u vzorků karcinomu i plazmy byla asociována se sníženou expresí všech tří uvedených mikroRNA. Testování diagnostického potenciálu ukázalo, že kombinovaná exprese miR-99a a miR-199b v plazmě je přesnější než použití jednotlivých mikroRNA a vede k 88% senzitivitě a 93% specificitě. Bylo také zjištěno, že pravděpodobnost celkového přežití je snížena u pacientek s nižší expresí miR-100 [34].
Jiná práce, zaměřená na endometriodní typ karcinomu endometria [29], identifikovala 8 mikroRNA (miR-15b, miR-17-5p, miR-20a, miR-125a, miR-214*, miR-221, miR-222 a miR-424) se sníženou expresí a 2 mikroRNA (miR-200b a miR-210) se zvýšenou expresí u karcinomů endometria. Byla zde identifikována signifikantní obrácená korelace exprese miR-20a, miR-125a, miR-214, miR-221, miR-222 a miR-424 s expresí proteinu VEGF-A (vascular endothelial growth factor, související s angiogenezí). Naopak, pozitivní korelace byla zjištěna mezi expresí proteinu VEGF-A, miR-200b a miR-210 [29].
Rozsáhlá recentní studie byla zaměřena na zjištění charakteristické exprese mikroRNA u tkání a plazmy u endometriálních karcinomů endometroidního typu [35]. Zvýšená exprese u tkání byla potvrzena u 16 mikroRNA, snížená exprese u 1 mikroRNA (tab. 1 a 5) a 9 mikroRNA (z 16 testovaných) bylo deregulovaných u vzorků plazmy. Zde byly identifikovány miR-9 a miR-301b jako downregulované, a miR-92a, miR-141, miR-200a, miR-203, miR-449a, miR-1228 a miR-1290 jako upregulované. Tato studie rovněž přinesla zásadní podporu pro tento typ výzkumů, neboť byly nalezeny „mikroRNA signatury“, jež byly schopny klasifikovat tumory, a to miR-92a/miR-410 a miR-92a/miR-205/miR-410. V plazmě byly objeveny 2 mikroRNA signatury, tj. miR-9/miR-1228 (AUC: 0,909) a miR-9/miR-92a (AUC: 0,913), které byly schopny odlišit EEC vzorky. Dále byly nalezeny korelace mezi expresí různých mikroRNA a stadiem, stupněm diferenciace, metastázami v lymfatických uzlinách nebo prognózou pro pacientky [35].
KANDIDÁTNÍ MIKRORNA PRO KARCINOM ENDOMETRIA
Studie exprese mikroRNA u karcinomu endometria se zjištěnými expresními profily příliš nepřekrývají; zjištěné výsledky tedy vykazují nízkou konzistenci. Přesto existuje několik mikroRNA, které byly opakovaně zjištěny jako upregulované nebo downregulované. V případě karcinomu endometria typu 1 (endometrioidní) jde o zvýšenou expresi rodiny miR-200 (miR-200a, miR-200b, miR-141, miR-200c a miR-429), a dále o miR-9, miR-9*, miR-96, miR-107, miR-146a, miR-182, miR-183, miR-203, miR-205, miR-210 a miR-223. Uvedené mikroRNA byly nalezeny se zvýšenou expresí minimálně ve třech nezávislých studiích (viz tab. 1). Většina mikroRNA uvedených v tabulce 1 však byla nalezena s upregulovanou expresí vždy pouze v jedné nebo maximálně dvou studiích. Zajímavý je překryv zvýšené exprese u rodiny miR-200 a miR-205 pro typ 1 a 2 (tab. 1, 4 a 10).
Ještě obtížnější je nalézt společně downregulované mikroRNA. Můžeme uvést pouze miR-100, miR-424 a miR-410, které byly downregulovány u typu 1 min. ve třech studiích (tab. 5). Ostatní downregulované mikroRNA uvedené v tabulce 5 byly downregulovány pouze v jedné studii (78 % mikroRNA ) či max. ve dvou studiích (22 % mikroRNA). Zde je z nejčastěji uváděných mikroRNA (tab. 5) patrný překryv u miR-410 a miR-424 pro typy 1 a 2 (tab. 6).
Tab. 6. Snížená exprese mikroRNA - společně downregulované pro typ 1 a typ 2, versus normální endometrium 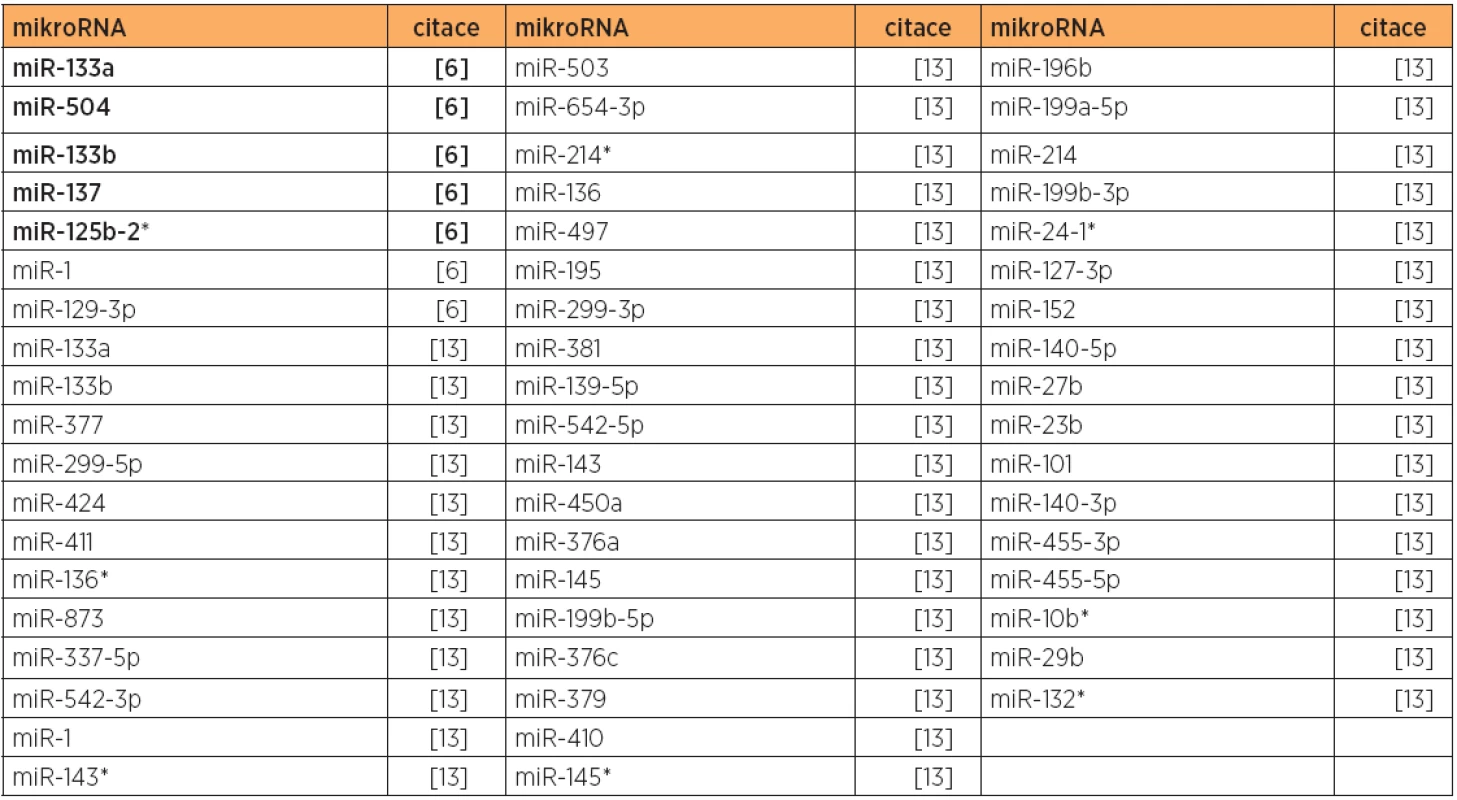
Poznámka: Tučně jsou uvedeny nejvíce deregulované mikroRNA v dané studii. V případě karcinomu endometria typu 2 existuje mnohem méně mikroRNA expresních studií. Opakovaně zvýšená exprese byla nalezena u miR-205 (2 studie, tab. 10), identifikovaná společně s typem 1 (viz výše). MikroRNA miR-135b a miR-200c byly opakovaně nalezeny upregulovány s překryvem u obou typů 1 a 2 (tab. 4 a 10). Snížená exprese byla konzistentní u miR-34b (bez překryvu s typem 1), a miR-1, miR-133a, miR-133b s překryvem mezi typy 1 a 2 (tab. 6 a 11).
Tab. 7. Snížená exprese mikroRNA, typ 1 versus typ 2, papilární serózní 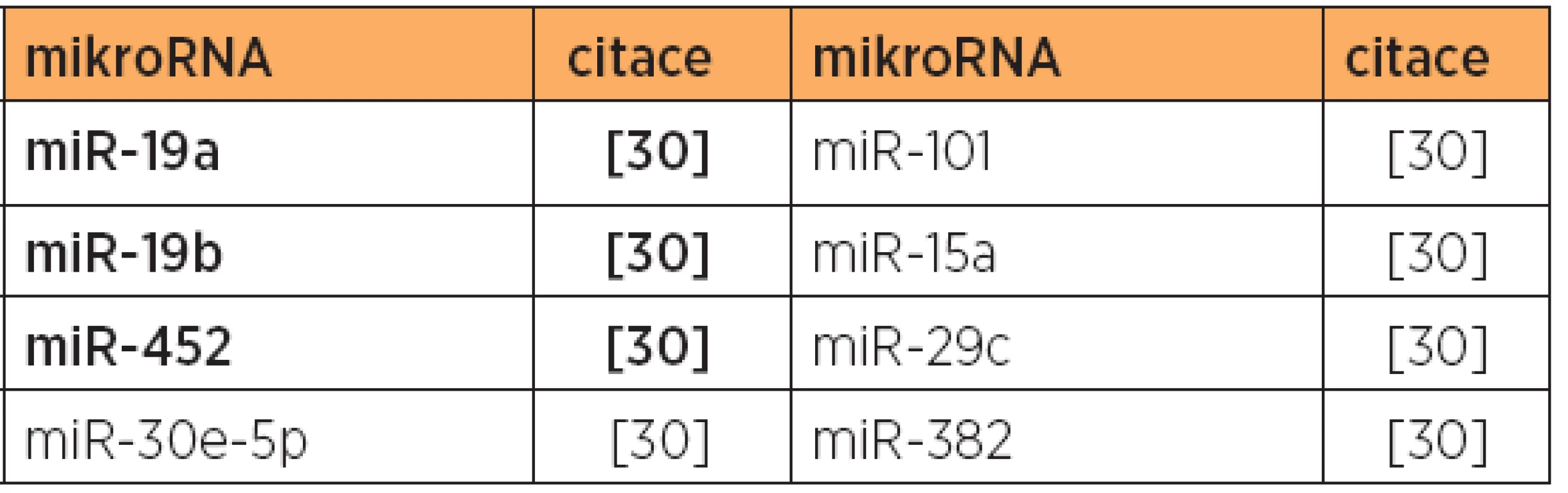
Poznámka: Tučně jsou uvedeny nejvíce deregulované mikroRNA v dané studii. Tab. 8. Snížená exprese mikroRNA, typ 1 versus karcinosarkom 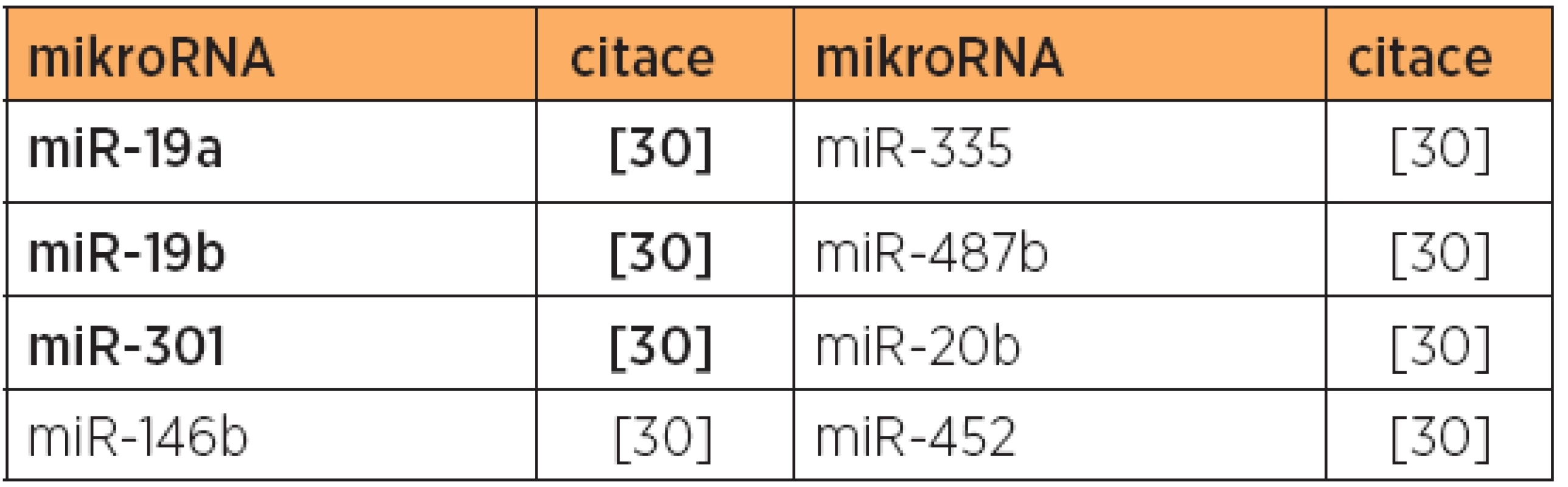
Poznámka: Tučně jsou uvedeny nejvíce deregulované mikroRNA v dané studii. Tab. 9. Snížená exprese mikroRNA, typ 2, papilární serózní versus karcinosarkom 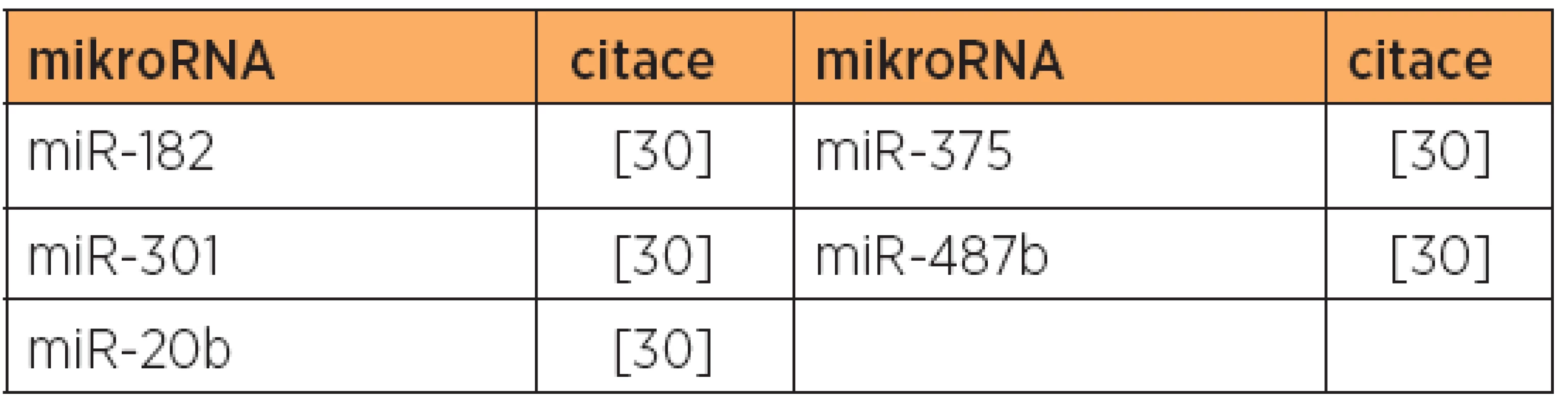
Tab. 10. Zvýšená exprese mikroRNA u typu 2 versus normální endometrium, případně versus typ 1 (citace [39, 6*]) ![Zvýšená exprese mikroRNA u typu 2 versus normální endometrium, případně versus typ 1 (citace [39, 6*])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/affc74ad8c4231ae2ee38057250e358d.png)
Poznámka: U citace [12] uvedeny pouze mikroRNA s více než 10násobnou upregulací v dané studii. Tučně jsou uvedeny nejvíce deregulované mikroRNA v dané studii. Tab. 11. Snížená exprese mikroRNA u typu 2 versus normální endometrium, případně versus typ 1 (citace [6]*) ![Snížená exprese mikroRNA u typu 2 versus normální endometrium, případně versus typ 1 (citace [6]*)](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/d22f450bc2f55cf163e4b915c3886fc9.png)
Poznámka: U citace [12] uvedeny mikroRNA s více než 10násobnou downregulací. Tučně jsou uvedeny nejvíce deregulované mikroRNA v dané studii. ZÁVĚR
Pro pochopení detailního působení mikroRNA nejen u karcinomu endometria bude třeba mnohých dalších studií. Pro zvýšení diagnostického potenciálu výzkumů mikroRNA však bude nezbytné více se zaměřit např. na krev/plazmu, moč či sliny, kde je ukryt významný zdroj extracelulární mikroRNA, deponované jak v různých vezikulech (především exozomech), tak případně ve vazbě s proteinovými (AGO2, NPM1) či lipoproteinovými (HDL) komplexy. Tato extracelulární RNA může být detekovatelná a kvantifikovatelná, jak ukazují nejnovější studie včetně našeho aktuálně probíhajícího výzkumu (spolupráce ÚBLG 1. LF UK a VFN v Praze, VFN v Praze, FN Brno a ÚPMD v Praze-Podolí), zaměřeného z tohoto hlediska na gynekologické malignity včetně karcinomu endometria a ovaria, a především na expresi extracelulární mikroRNA v moči. Naším cílem bylo tímto článkem především upřít větší pozornost onkogynekologů na tuto u nás poměrně opomíjenou skupinu regulačních molekul s velkým diagnostickým, prognostickým a terapeutickým potenciálem.
Vznik tohoto článku byl umožněn díky projektu PRVOUK-P27/LF1/1.
RNDr. Luděk Záveský, Ph.D.
Ústav biologie a lékařské genetiky
1. LF UK a VFN
Albertov 4
128 00 Praha 2
e-mail: ludek.zavesky@vfn.cz
Zdroje
1. Bansal, N., Yendluri, V., Wenham, RM. The molecular biology of endometrial cancers and the implications for pathogenesis, classification, and targeted therapies. Cancer Control, 2009, 16, p. 8–13.
2. Bokhman, JV. 2 pathogenetic types of endometrial carcinoma. Gynecol Oncol, 1983, 15, p. 10–17.
3. Boren, T., Xiong, Y., Hakam, A., et al. MicroRNAs and their target messenger RNAs associated with endometrial carcinogenesis. Gynecol Oncol, 2008, 110, p. 206–215.
4. Cohn, DE., Fabbri, M., Valeri, N., et al. Comprehensive miRNA profiling of surgically staged endometrial cancer. Am J Obstet Gynecol, 2010, 202, p. 656.e1.
5. Dai, YM., Xia, W., Song, T., et al. MicroRNa-200b is overexpressed in endometrial adenocarcinomas and enhances mmp2 activity by downregulating timp2 in human endometrial cancer cell line hec-1a cells. Nucleic Acid Ther, 2013, 23, p. 29–34.
6. Devor, EJ., Hovey, AM., Goodheart, MJ., et al. MicroRNA expression profiling of endometrial endometrioid adenocarcinomas and serous adenocarcinomas reveals profiles containing shared, unique and differentiating groups of microRNAs. Oncol Rep, 2011, 26, p. 995–1002.
7. Di Leva, G., Croce, CM. Roles of small RNAs in tumor formation. Trends Mol Med, 2010, 16, p. 257–267.
8. Doll, A., Abal, M., Rigau, M., et al. Novel molecular profiles of endometrial cancer – new light through old windows. J Steroid Biochem Mol Biol, 2008,108, p. 221–229.
9. Dušek, L., Mužík, J., Kubásek, M., et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, [2005], [cit. 2013-4-22]. Dostupný z WWW: http://www.svod.cz. Verze 7.0 [2007], ISSN 1802-8861.
10. Folkins, AK., Longacre, TA. Hereditary gynaecological malignancies: advances in screening and treatment. Histopathology, 2013, 62, p. 2–30.
11. Hecht, JL., Mutter, GL. Molecular and pathologic aspects of endometrial carcinogenesis. J Clin Oncol, 2006, 24, p. 4783–4791.
12. Hiroki, E., Akahira, J., Suzuki, F., et al. Changes in microRNA expression levels correlate with clinicopathological features and prognoses in endometrial serous adenocarcinomas. Cancer Sci, 2010, 101, p. 241–249.
13. Hiroki, E., Suzuki, F., Akahira, J., et al. MicroRNA-34b functions as a potential tumor suppressor in endometrial serous adenocarcinoma. Int J Cancer, 2012, 131, p. E395–E404.
14. Howlader, N., Noone, AM., Krapcho, M., et al. (eds). SEER Cancer Statistics Review, 1975–2009 (Vintage 2009 Populations), National Cancer Institute. Bethesda, MD, http://seer.cancer.gov/csr/1975_2009_pops09/, based on November 2011 SEER data submission, posted to the SEER web site, 2012.
15. Huang, YW., Liu, JC., Deatherage, DE., et al. Epigenetic repression of microRNA-129-2 leads to overexpression of SOX4 oncogene in endometrial cancer. Cancer Res, 2009, 69, p. 9038–9046.
16. Chen, XY., Yan, Q., Li, SD., et al. Expression of the tumor suppressor miR-206 is associated with cellular proliferative inhibition and impairs invasion in ER alpha-positive endometrioid adenocarcinoma. Cancer Lett, 2012, 314, p. 41–53.
17. Choi, CH., Park, YA., Choi, JJ., et al. Angiotensin II type I receptor and miR-155 in endometrial cancers: Synergistic antiproliferative effects of anti-miR-155 and losartan on endometrial cancer cells. Gynecol Oncol, 2012, 126, p. 124–131.
18. Chung, TKH., Cheung, TH., Huen, NY., et al. Dysregulated microRNAs and their predicted targets associated with endometrioid endometrial adenocarcinoma in Hong Kong women. Int J Cancer, 2009, 124, p. 1358–1365.
19. Chung, TKH., Lau, TS., Cheung, TH., et al. Dysregulation of microRNA-204 mediates migration and invasion of endometrial cancer by regulating FOXC1. Int J Cancer, 2012, 130, p. 1036–1045.
20. Iorio, MV., Croce, CM. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review. EMBO Mol Med, 2012, 4, p. 143–159.
21. Jiang, FZ., Liu, T., He, YY., et al. MiR-125b promotes proliferation and migration of type II endometrial carcinoma cells through targeting TP53INP1 tumor suppressor in vitro and in vivo. Bmc Cancer, 2011, 11, p. 425.
22. Karaayvaz, M., Zhang, C., Liang, SR., et al. Prognostic significance of miR-205 in endometrial cancer. Plos One, 2012, p. 7.
23. Lee, H., Choi, HJ., Kang, CS., et al. Expression of miRNAs and PTEN in endometrial specimens ranging from histologically normal to hyperplasia and endometrial adenocarcinoma. Mod Pathol, 2012, 25, p. 1508–1515.
24. Lee, JW., Park, YA., Choi, JJ., et al. The expression of the miRNA-200 family in endometrial endometrioid carcinoma. Gynecol Oncol, 2011, 120, p. 56–62.
25. Myatt, SS., Wang, J., Monteiro, LJ., et al. Definition of microRNAs that repress expression of the tumor suppressor gene FOXO1 in endometrial cancer. Cancer Re., 2010, 70, p. 367–377.
26. Panda, H., Chuang, TD., Luo, XP., Chegini, N. Endometrial miR-181a and miR-98 expression is altered during transition from normal into cancerous state and target PGR, PGRMC1, CYP19A1, DDX3X, and TIMP3. J Clin Endocrinol Metab, 2012, 97, p. E1316–E1326.
27. Park, YA., Lee, JW., Choi, JJ., et al. The interactions between MicroRNA-200c and BRD7 in endometrial carcinoma. Gynecol Oncol, 2012, 124, p. 125–133.
28. Qin, XY., Yan, L., Zhao, XB., et al. microRNA-21 overexpression contributes to cell proliferation by targeting PTEN in endometrioid endometrial cancer. Oncol Lett, 2012, 4, p. 1290–1296.
29. Ramon, LA., Braza-Boils, A., Gilabert, J., et al. MicroRNAs related to angiogenesis are dysregulated in endometrioid endometrial cancer. Hum Reprod, 2012, 27, p. 3036–3034.
30. Ratner, ES., Tuck, D., Richter, C., et al. MicroRNA signatures differentiate uterine cancer tumor subtypes. Gynecol Oncol, 2010, 118, p. 251–257.
31. Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2012. Cancer J Clin, 2012, 62, p. 10–29.
32. Snowdon, J., Zhang, X., Childs, T., et al. The microRNA-200 family is upregulated in endometrial carcinoma. Plos One, 2011, 6, e22828.
33. Teague, EMCO., Van der Hoek, KH., Van der Hoek, MB.,et al. MicroRNA-regulated pathways associated with endome-triosis. Mol Endocrinol, 2009, 23, p. 265–275.
34. Torres, A., Torres, K., Pesci, A., et al. Deregulation of miR-100, miR-99a and miR-199b in tissues and plasma coexists with increased expression of mTOR kinase in endometrioid endome-trial carcinoma. BMC Cancer, 2012, p. 369.
35. Torres, A., Torres, K., Pesci, A., et al. Diagnostic and prognostic significance of miRNA signatures in tissues and plasma of endometrioid endometrial carcinoma patients. Int J Cancer, 2013, 132, p. 1633–1645.
36. Tsuruta, T., Kozaki, K., Uesugi, A., et al. miR-152 Is a tumor suppressor microRNA that is silenced by DNA hypermethylation in endometrial cancer. Cancer Res, 2011, 71, p. 6450–6462.
37. Wu, YJ, Liu, SP., Xin, H., et al. Up-regulation of MicroRNA-145 Promotes differentiation by repressing OCT4 in human endometrial adenocarcinoma cells. Cancer, 2011, 117, p. 3989–3998.
38. Yu, DQ, Zhou, HJ., Xun, QY., et al. MicroRNA-103 regulates the growth and invasion of endometrial cancer cells through the downregulation of tissue inhibitor of metalloproteinase 3. Oncol Lett, 2012, 3, p. 1221–1226.
39. Zhou, J., Song, TR., Gong, M., et al. MicroRNA regulation of the expression of the estrogen receptor in endometrial cancer. Mol Med Rep, 2010, 3, p. 387–392.
40. Zhou, HJ., Xu, XF., Xun, QY., et al. MicroRNA-30c negatively regulates endometrial cancer cells by targeting metastasis-associated gene-1. Oncol Rep, 2012, 27, p. 807–812.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2013 Číslo 5- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Rakouské porodnictví. Dichtung und Wahrheit
- Změny lipidů a lipoproteinů provázející fyziologická a riziková těhotenství
- Vliv hormonální substituční terapie na kvalitu života žen v postmenopauze
- Inkarcerace dělohy v graviditě – úskalí diagnostiky, klinického průběhu a terapie: dvě kazuistiky
- Exprese mikroRNA jako nový potenciální diagnostický nástroj pro karcinom endometria
-
Těhotenství a porod u pacientky s čistým karyotypem 46,XY
Souhrn dosavadních poznatků o XY ženách - Rizikové faktory karcinomu endometria
- Fulminantní průběh HELLP syndromu s infaustním vyústěním – kazuistika
- Komentář k článku „Fulminantní průběh hellp syndromu s infaustním vyústěním – kazuistika“
- Preeklampsie a trombin generační test
- Lymfedémy po operacích karcinomu vulvy. Prospektivní studie
- Činnosti a odpovědnosti pracovníků embryologické a andrologické laboratoře v centrech asistované reprodukce
- Prof. MUDr. Ladislav Pilka, DrSc., oslavil životní jubileum
- Specializační vzdělávání v gynekologii a porodnictví na lékařských fakultách: 2012–2013
- Význam magnezia pro organismus ženy
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Inkarcerace dělohy v graviditě – úskalí diagnostiky, klinického průběhu a terapie: dvě kazuistiky
- Rizikové faktory karcinomu endometria
-
Těhotenství a porod u pacientky s čistým karyotypem 46,XY
Souhrn dosavadních poznatků o XY ženách - Specializační vzdělávání v gynekologii a porodnictví na lékařských fakultách: 2012–2013
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



