-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cévní nežádoucí účinky u pacientů s chronickou myeloidní leukemií při terapii inhibitory tyrozinkináz v každodenní klinické praxi – analýza z databáze INFINITY
Vascular adverse events in chronic myeloid leukaemia patients during tyrosine kinase inhibitor therapy in daily clinical practice – analysis from the INFINITY database
The introduction of the first tyrosine kinase inhibitor imatinib into clinical practice has been associated with dramatical change in chronic myeloid leukaemia treatment over the past 20 years. It represents one of the biggest achievements in haematology and oncology per se. Imatinib was followed by second - and third generation tyrosine kinase inhibitors (nilotinib, dasatinib, bosutinib and ponatinib) resulting in newly diagnosed chronic myeloid leukaemia patients having almost the same life expectancy as the general population. Nevertheless, this often-lifelong treatment can be associated with side effects, which in extraordinary cases may be life threatening. Vascular adverse events are also included among such serious adverse events and their incidence varies over a wide range from 0.32–47.8%, most frequently in association with nilotinib or ponatinib treatment. Their incidence in daily clinical practice in the Czech Republic was evaluated in a retrospective analysis of the INFINITY database. From January 2005 to August 2020, chronic myeloid leukaemia was diagnosed in 1029 patients, with 1007 having valid records for analysis. Of these, 964 patients were in chronic phase. At least one vascular adverse event occurred in 82 patients (8.5%) in chronic phase during tyrosine kinase inhibitors therapy, most frequently in patients receiving nilotinib (10.8%) and ponatinib (8.3%). During first-line tyrosine kinase inhibitor treatment, 60 patients (6.3%) experienced at least one vascular adverse event. In direct comparison of first line imatinib and nilotinib therapy, we found a significantly higher incidence of cardiovascular (2.6 vs. 7.2%; P = 0.013), cerebrovascular (1.4 vs. 4.8%; P = 0.019), and peripheral vascular adverse events (0.2 vs. 4.0%; P = 0.001) in nilotinib treated patients, respectively. This paper offers a more detailed overview of vascular adverse event incidence in patients with chronic myeloid leukaemia treated with tyrosine kinase inhibitors in clinical practice in the Czech Republic and its comparison with available literature.
Keywords:
chronic myeloid leukaemia – Tyrosine kinase inhibitors – nilotinib – ponatinib – vascular adverse events – INFINITY
Autoři: P. Čičátková 1; D. Žáčková 1; T. Horňák 1; H. Klamová 2; P. Bělohlávková 3; L. Stejskal 4; Z. Křístková 5; J. Baranová 5; A. Kvetková 1; L. Semerád 1; J. Procházková 1; J. Mayer 1,6
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Ústav hematologie a krevní transfuze Praha 2; IV. interní hematologická klinika LF UK a FN Hradec Králové 3; Klinika hematoonkologie LF OU a FN Ostrava 4; Institut bio statistiky a analýz, s. r. o., Brno 5; Středoevropský technologický institut – MU, Brno 6
Vyšlo v časopise: Transfuze Hematol. dnes,29, 2023, No. 1, p. 29-37.
Kategorie: Původní práce
doi: https://doi.org/10.48095/cctahd202329Souhrn
Léčba chronické myeloidní leukemie doznala v posledních 20 letech dramatických změn spojených s uvedením prvního inhibitoru tyrozinkináz imatinibu do klinické praxe, a představuje tak jeden z největších úspěchů nejen hematologické, ale i celé onkologie. Imatinib byl následován dalšími inhibitory tyrozinkináz druhé a třetí generace (nilotinib, dasatinib, bosutinib a ponatinib), díky nimž se délka života pacientů s nově diagnostikovanou chronickou myeloidní leukemií prakticky neliší od délky života zdravých vrstevníků. S touto často celoživotní léčbou mohou ale být spojeny nežádoucí účinky, které jsou v ojedinělých případech i život ohrožující. Do kategorie závažných nežádoucích účinků zahrnujeme i nežádoucí účinky cévní, jejichž výskyt v klinických studiích variuje v širokém rozmezí 0,32–47,8 % pacientů, nejčastěji při terapii nilotinibem a ponatinibem. Jejich výskyt v rutinní klinické praxi v České republice byl hodnocen v retrospektivní analýze dat z databáze INFINITY. Ve sledovaném období byla chronická myeloidní leukemie diagnostikována u 1 029 pacientů, validní záznamy pro analýzu mělo 1 007 z nich, z toho v chronické fázi jich bylo 964 (95,7 %). Ve skupině pacientů diagnostikovaných v chronické fázi byl během léčby inhibitory tyrozinkináz zjištěn alespoň jeden cévní nežádoucí účinek u 82 pacientů (8,5 %) a podle očekávání se nejčastěji vyskytovaly u pacientů užívajících nilotinib (10,8 %) a ponatinib (8,3 %). Při léčbě první linie se vyskytl alespoň jeden cévní nežádoucí účinek u 60 pacientů (6,3 %). Při přímém porovnání imatinibu a nilotinibu v první linii byl zaznamenán signifikantně častější výskyt kardiovaskulárních (2,6 vs. 7,2 %; p = 0,013), cerebrovaskulárních (1,4 vs. 4,8 %; p = 0,019) i periferních vaskulárních nežádoucích účinků (0,2 vs. 4,0 %; p = 0,001) při léčbě nilotinibem. Předkládaná práce nabízí detailnější pohled na výskyt cévních nežádoucích účinků u pacientů s chronickou myeloidní leukemií léčených inhibitory tyrozinkináz v klinické praxi v České republice ve srovnání s dostupnými literárními údaji.
Klíčová slova:
chronická myeloidní leukemie – nilotinib – ponatinib – inhibitory tyrozinkináz – cévní nežádoucí účinky – INFINITY
ÚVOD
Chronická myeloidní leukemie (CML) je myeloproliferativní onemocnění charakterizované přítomností chromozomu Philadelphia (Philadelphia chromosome – Ph1) a fúzního genu BCR:: ABL1 [1,2]. Nalezení tohoto terapeutického cíle vedlo k vývoji specifické léčby ve formě inhibitorů tyrozinkináz (tyrosine kinase inhibitors – TKI) cílených právě na konstitutivně aktivovanou tyrozinkinázu BCR:: ABL1, což představuje jeden z největších úspěchů moderní medicíny jako takové. Zavedení prvního TKI imatinibu do terapie CML znamenalo zásadní změnu v její léčbě a vedlo k progresivnímu zlepšení prognózy pacientů s nově diagnostikovaným onemocněním a k pro - dloužení předpokládané délky jejich života na úroveň délky života zdravých vrstevníků [3]. To je však dle aktuálních doporučení Evropské leukemické sítě (European LeukemiaNet – ELN) z roku 2020 vykoupeno nutností mnohdy celoživotní farmakoterapie s možnými důsledky v podobě výskytu nežádoucích účinků (NÚ) [4]. Dobrá tolerance léku je přitom vzhledem k obvykle dlouhodobé léčbě klíčová. Velká část NÚ se objeví brzy po zahájení terapie, často jsou nízkého stupně závažnosti dle CTCAE (Common Terminology Criteria for Adverse Events) a jen u malé části pacientů vedou k trvalému vysazení léku. Daleko závažnější jsou NÚ vyššího stupně závažnosti dle CTCAE, týkající se spíše TKI vyšších generací, které mohou pacienta ohrozit na životě [5]. Mezi takové NÚ patří i ty cévní (CNÚ), jejichž výskyt byl popisován již v prvních studiích s některými z dostupných TKI (imatinib, nilotinib, dasatinib, bosutinib, ponatinib) [6–15].
V 10letém sledování v rámci studie ENESTnd (Evaluating Nilotinib Efficacy and Safety in Clinical Trials – Newly Diagnosed Patients) byly CNÚ zastoupeny ischemickou chorobou srdeční (ICHS), ischemickou cévní mozkovou příhodou (iCMP) a uzávěrem periferních arterií (peripheral artery occlusive disease – PAOD) a byly popsány u 3,6 % pacientů užívajících imatinib 400 mg denně, u 16,5 % pacientů užívajících nilotinib v dávce 300 mg 2× denně, a dokonce u 23,5 % pacientů užívajících nilotinib 400 mg 2× denně. Roční incidence nově vzniklých CNÚ byla v jednotlivých léčebných ramenech srovnatelná v průběhu celého sledování [7]. Ve studii DASISION (Dasatinib Versus Imatinib Study in Treatment-Naïve Chronic Myeloid Leukemia Patients) byly CNÚ v průběhu 5letého sledování výjimečné, ICHS se objevila u 4 % pacientů užívajících dasatinib 100 mg denně a u 2 % pacientů užívajících imatinib 400 mg denně. Tranzientní ischemická ataka (TIA) proběhla u 1 % pacientů v rameni s dasatinibem, nevyskytla se v rameni s imatinibem a u žádného pacienta neproběhla ani iCMP. V rameni s dasatinibem se PAOD nevyskytly vůbec, v rameni s imatinibem u 1 % pacientů. Výskyt plicní arteriální hypertenze byl pozorován u 5 % pacientů léčených dasatinibem a pouze u 0,4 % pacientů léčených imatinibem [9]. Cévní NÚ byly sledovány i ve studii BFORE (Bosutinib Trial in First-Line Chronic Myelogenous Leukemia Treatment). Po 1 roce sledování se vyskytly u 5,2 % pacientů léčených bosutinibem 400 mg denně a u 5,3 % pacientů léčených imatinibem 400 mg denně. Nejčastějším kardiovaskulárním NÚ bylo prodloužení QT intervalu [13]. Po úpravách v dávkování ponatinibu právě na vrub zvýšeného výskytu CNÚ byla po přechodném pozastavení provedena studie PACE (Ponatinib Ph+ ALL and CML Evaluation) u předléčených pacientů, ve které se některá z forem ICHS vyskytla u 16 % pacientů, iCMP nebo TIA u 13 % pacientů, PAOD u 14 % pacientů a některý z CNÚ postihl téměř jednu třetinu pacientů léčených ponatinibem. Žilní trombóza se vyskytla celkem u 6 % pacientů užívajících ponatinib [15]. Nečekaný výskyt CNÚ, zejména PAOD, vedl také k ukončení studie EPIC (Evaluation of Ponatinib versus Imatinib in Chronic Myeloid Leukemia). Z pacientů s nově zjištěným onemocněním v CP užívajících ponatinib 45 mg denně bylo PAOD postiženo 7 % pacientů v porovnání se 2 % pacientů užívajících imatinib 400 mg denně [16].
Vzhledem k možné závažnosti CNÚ a jejich zpočátku často překvapivému výskytu byly podrobeny řadě klinických studií a jejich četnost byla analyzována i v reálné klinické praxi. Frekvence se v literatuře značně liší a variuje mezi 0,32 a 47,8 % [7,17–33]. Široký rozptyl výskytu je ovlivněn jednak zvoleným TKI, ale také velikostí souboru a definicí sledovaných CNÚ, která se v jednotlivých pracích může značně lišit. Jednoznačný mechanizmus vzniku CNÚ není přesně objasněn, ale podle dostupných literárních údajů se na jejich genezi může podílet přímý vliv na buňky cévního endotelu a progenitorové endotelové buňky vč. ponatinibem indukované apoptózy a nekrózy pozorované in vitro, vazospazmus, vaskulitida, ovlivnění angiogeneze, off target působení na ostatní kinázy, akcelerace aterosklerózy ovlivněním metabolizmu lipidů a glukózy, a také přítomnost rizikových faktorů (RF) v podobě komorbidit nebo např. kouření [17,34–43]. Léčba CNÚ závisí na tíži NÚ, stavu pacienta a kontrole základního onemocnění, a kromě specifické léčby odpovídající typu NÚ může zahrnovat přechodné vysazení TKI s následným navrácením stejného TKI v redukované dávce nebo trvalé vysazení TKI buď s remisí bez nutnosti terapie, nebo změnou za jiný TKI [44,45]. Právě trvalým vysazením s následnou remisí bez nutnosti léčby byl řešen i případ plicní arteriální hypertenze, jak bylo prezentováno formou kazuistiky v českém písemnictví v uplynulém roce [46]. Předkládaná práce se věnuje analýze výskytu CNÚ v rutinní klinické praxi v České republice (ČR). Jejím cílem je zhodnotit nejen výskyt CNÚ u pacientů s CML léčených TKI v reálné klinické praxi v ČR, ale také analyzovat spojitost s komorbiditami a jinými rizikovými faktory pacientů léčených TKI a také porovnat naše zjištění s literárními údaji. Pro klinickou praxi mohou vyplynout konsekvence v podobě rozpoznání rizikových faktorů a odhalení pacientů potenciálně rizikových pro konkrétní TKI.
PACIENTI A METODIKA
Pro retrospektivní analýzu byla data čerpána z celonárodní databáze INFINITY (tyrosine kinase INhibitors in FIrst aNd followIng CML Treatment) s využitím dat ze čtyř center vysoce specializované hematologické péče v ČR (IHOK FN Brno, ÚHKT Praha, KOH FN Ostrava a HOK FN Hradec Králové). Mezi pacienty léčenými jednotlivými TKI byl porovnán výskyt CNÚ definovaných jako kardiovaskulární postižení (stabilní i nestabilní angina pectoris, akutní infarkt myokardu), cerebrovaskulární postižení (TIA, iCMP), plicní arteriální hypertenze, periferní arteriální uzávěry (peripheral arterial occlusive disease – PAOD) a žilní trombembolické postižení (hluboká žilní trombóza, plicní embolie). K porovnávání v rámci léčebné linie byl využit Fisherův exaktní test s hladinou významnosti 0,05. Při vícenásobném porovnávání byla p-hodnota adjustována Bonferroniho korekcí.
V období od ledna 2005 do konce srpna 2020 byla v uvedených centrech CML diagnostikována u 1 029 pacientů, TKI bylo léčeno a validní data pro analýzu mělo 1 007 z nich. Charakteristiky pacientů při diagnóze a bližší informace o jejich terapii jsou uvedeny v tab. 1. V době analýzy bylo naživu 801 z nich (79,5 %). CML byla příčinou úmrtí v necelé čtvrtině případů (44 ze 191 zemřelých, 23,0 %). V souvislosti s CNÚ zemřelo 11 pacientů (5,8 %). V 8 případech se jednalo o pacienty léčené v rámci první linie: 7 nich bylo léčeno imatinibem, zbývající nilotinibem. V 6 případech se jednalo o úmrtí na vrub cerebrovaskulárního NÚ, v 5 pak na vrub NÚ kardiovaskulárního.
Tab. 1. Charekteristiky pacientů při diagnóze CML. 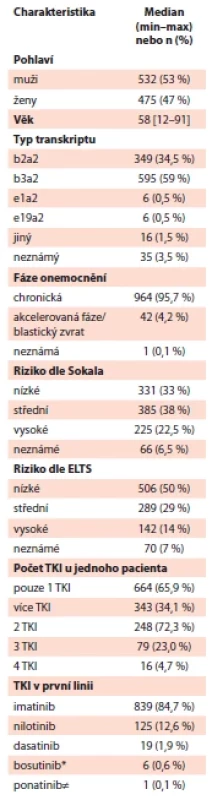
*bosutinib byl podáván v 1.–7. linii (medián 3. linie); ≠ponatinib byl podáván v 1.–12. linii (medián 4. linie) CML – chronická myeloidní leukemie; ELTS– the EUTOS long-term survival skóre; TKI – inhibitory tyrozinkináz VÝSLEDKY
Rizikové faktory
Rizikové faktory byly hodnotitelné u 873 pacientů. Zahrnovaly nadváhu a obezitu (53,7 %), arteriální hypertenzi (41,2 %), dyslipidemii (19,1 %), kouření (17,6 %), diabetes mellitus (15,5 %), ischemickou chorobu srdeční (10,8 %), srdeční selhávání (5,0 %), iCMP (4,8 %), arytmie (0,6 %), ischemickou chorobu dolních končetin (0,6 %) a trombembolickou nemoc (0,1 %). Alespoň 1 RF byl přítomen u 668 pacientů (76,5 %). Při samostatném hodnocení RF u pacientů s CNÚ byla také nejčastějším rizikovým faktorem nadváha a obezita vyskytující se dokonce u 73,7 % pacientů. Dále se u těchto pacientů vyskytovala arteriální hypertenze (64,0 %), diabetes mellitus (24,7 %), kouření (22,9 %), dislipidemie (22,5 %), ischemická choroba srdeční (19,1 %), srdeční selhávání (11,2 %), cévní mozková příhoda v minulosti (10,1 %) a ischemická choroba dolních končetin (2,2 %). Detailnější výskyt RF u sledovaných skupin CNÚ uvádí tab. 2a.
Tab. 2. a. Rizikové faktory přítomné u pacientů s cévním nežádoucím účinkem. 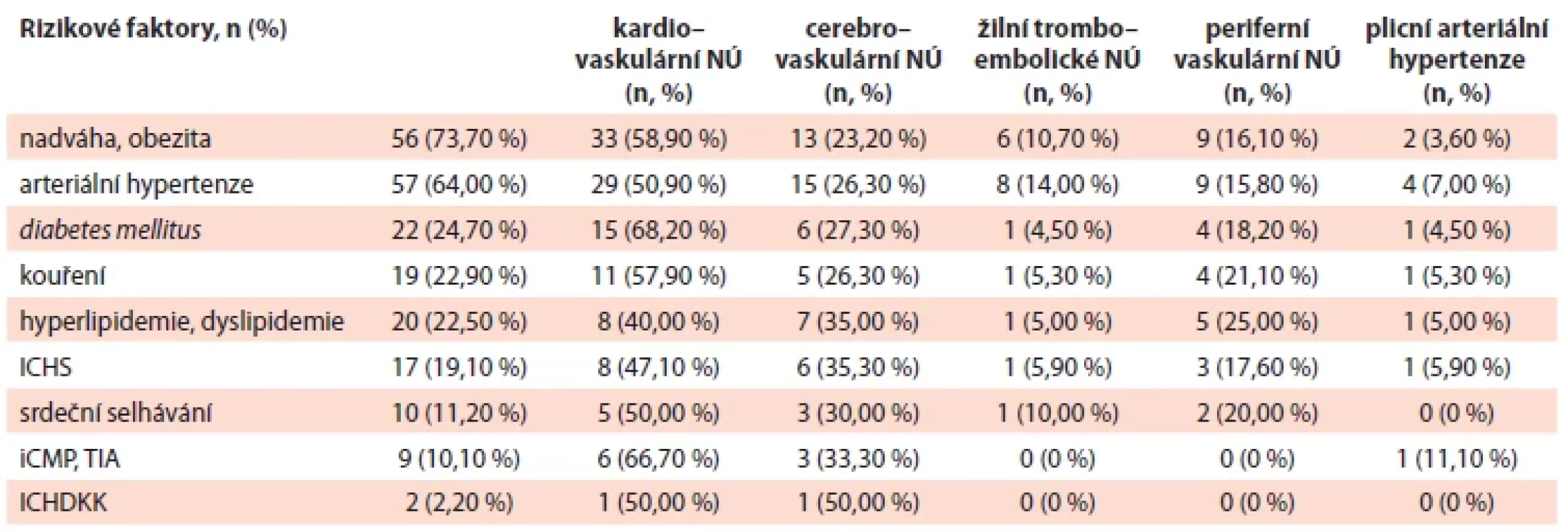
iCMP – ischemická cévní mozková příhoda; ICHDKK – ischemická choroba dolních končetin; ICHS – ischemická choroba srdeční; NÚ – nežádoucí účinky; TIA – tranzitorní ischemická ataka Vyšší výskyt RF u pacientů s kardiovaskulárními NÚ může být dán také tím, že se jedná o nejčastěji se vyskytující typ CNÚ. Medián počtu RF na pacienta byl 1 u všech pacientů s hodnotitelnými záznamy (rozmezí 0–8), u pacientů s proběhlým CNÚ pak 2 (rozmezí 0–7). Při srovnání výskytu RF u pacientů v chronické fázi (chronic phase – CP) při 1. linii léčby TKI bylo pozorováno, že imatinib byl přednostně nasazován pacientům s vyšším zastoupením RF v porovnání s nilotinibem, což odráží běžnou klinickou praxi v České republice. Zastoupení RF dle zvoleného TKI podrobněji uvádí tabulka 2b (tab. 2b).
Tab. 2. b. Rizikové faktory hodnocené u pacientů v CP při 1. linii terapie TKI. 
≠ hodnoceno u pacientů s dostupnými údaji o všech rizikových faktorech; * procenta hodnocena z počtu pacientů s daným rizikovým faktorem CP – chronická fáze; iCMP – ischemická cévní mozková příhoda; ICHDKK – ischemická choroba dolních končetin; ICHS – ischemická choroba srdeční; TIA – tranzitorní ischemická ataka Cévní nežádoucí účinky u pacientů v chronické fázi CML
Celkem 110 CNÚ se v CP vyskytlo u 82 pacientů (8,5 %). Nejčastější byly při podávání nilotinibu (10,8 %) a ponatinibu (8,3 %). Naopak nejméně frekventní byly při terapii dasatinibem (5,2 %) a imatinibem (5,4 %) – podrobněji tab. 3. Testování hypotéz o závislosti NÚ na TKI nebylo provedeno, protože jeden pacient se může vyskytovat ve více kategoriích TKI v důsledku sekvenčního podání terapie ve více liniích. Medián času do objevení se CNÚ se pro jednotlivé TKI lišil. Nejdelší byl pro bosutinib – 40,2 měsíce, což může být ovlivněno faktem, že se při terapii bosutinibem vyskytl pouze 1 CNÚ. Pro další TKI byl medián do vzniku CNÚ následující: 32 měsíců pro imatinib (rozmezí 0,2–142,6 měsíců), 22,8 měsíců pro nilotinib (rozmezí 0–118 měsíců), 18,4 měsíce pro dasatinib (rozmezí 0,3–131 měsíců) a 14,7 měsíců pro ponatinib (rozmezí 0,3–34,7 měsíců). Vzhledem k nárůstu kumulativního rizika vzniku CNÚ s délkou léčby nilotinibem popisovaném v literatuře jsme kromě mediánu analyzovali také jejich výskyt v jednotlivých letech terapie tímto TKI. Již ve 2. roce terapie je sice patrný nárůst výskytu CNÚ na 15 u 200 paciento-linií (7,5 %), ale v následujících letech výskyt klesá na 1,8 % ve 3. roce, 1,5 % ve 4. roce, a dokonce 1,1 % v 5. roce. V 9. a 10. roce byl sice pozorován opět nárůst výskytu CNÚ na 18,8 %, resp. 33,3 %, což ale může být dáno malými čísly (pouze 16, resp. 6 paciento-linií).
Tab. 3. Cévní nežádoucí účinky u pacientů v chronické fázi dle TKI ve všech liniích. 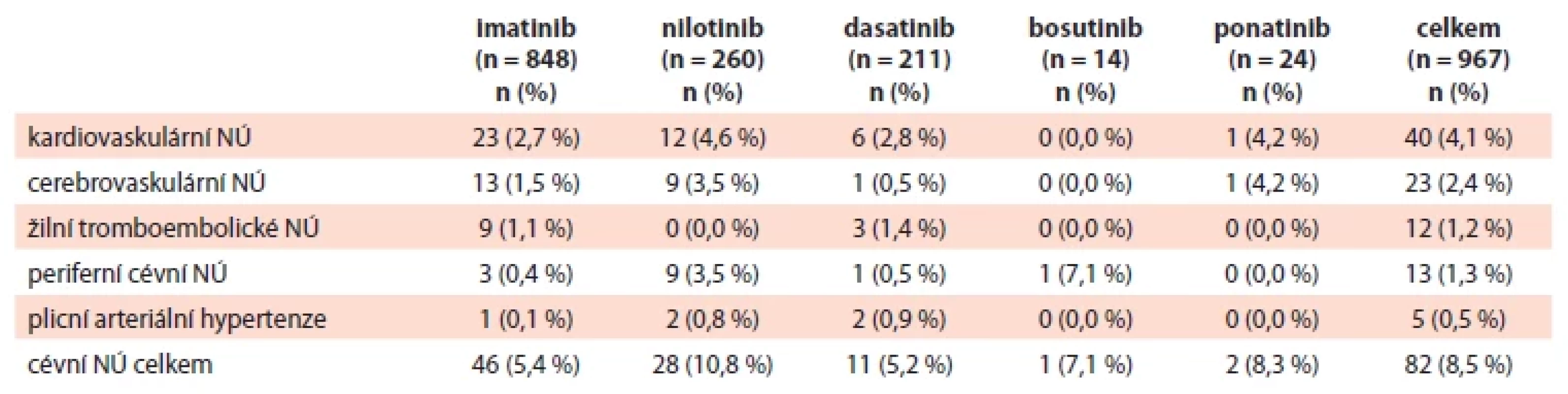
NÚ – nežádoucí účinky; TKI – inhibitory tyrozinkináz Při analýze výskytu CNÚ v rámci 1. linie TKI byl mezi jednotlivými TKI pozorován statisticky významný rozdíl v podílu pacientů s cerebrovaskulárními (p = 0,004) a periferními cévními NÚ (p = 0,004) a také CNÚ souhrnně (p < 0,001). Během terapie dasatinibem a bosutinibem se v našem souboru nevyskytl žádný ze sledovaných NÚ, při terapii ponatinibem se vyskytl pouze 1 cerebrovaskulární NÚ a k dalšímu zhodnocení bude nezbytné zahrnout do analýzy více ponatinibem léčených pacientů. Při přímém porovnání nejčastěji užívaných TKI v 1. linii – imatinibu a nilotinibu – byl evidován statisticky významný rozdíl jak u výše zmíněných kategorií (cerebrovaskulární NÚ – p = 0,019, periferní cévní NÚ – p = 0,001, souhrnně vaskulární NÚ – p < 0,001), tak i u kardiovaskulárních NÚ (p = 0,013) při terapii nilotinibem, jak ukazuje tab. 4.
Tab. 4. Přímé porovnání cévních nežádoucích účinků u pacientů v chronické fázi při léčbě imatinibem nebo nilotinibem v 1. linii. 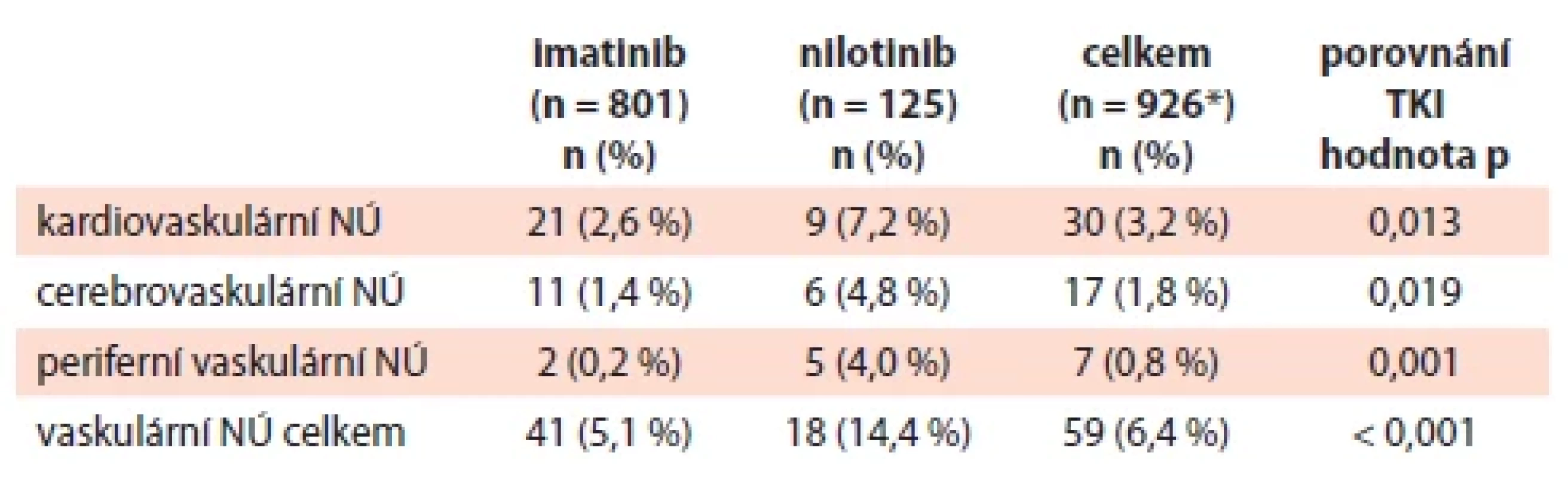
NÚ – nežádoucí účinky; TKI – inhibitory tyrozinkináz Z těch CNÚ, u kterých byl vyplněn stupeň závažnosti, jich 39 bylo nízkého stupně závažnosti, 26 bylo závažných. Blíže o tom informuje graf 1.
Graf 1. Rozložení cévních nežádoucích účinků vyskytujících se v chronické fázi podle stupně závažnosti. 
Cévní nežádoucí účinky u pacientů v akcelerované fázi / blastickém zvratu CML
V pokročilých fázích onemocnění se celkem 8 CNÚ vyskytlo u 6 pacientů (7,1 %) bez ohledu na linii léčby. Nejčastěji se jednalo o kardiovaskulární NÚ při terapii nilotinibem (14,3 % pacientů), což shrnuje tab. 5. Testování hypotéz o závislosti NÚ na TKI taktéž nebylo provedeno, protože jeden pacient se mohl vyskytovat ve více kategoriích TKI důsledkem sekvenčního podání terapie ve vícero liniích a kvůli malému počtu pacientů užívajících některé TKI (zejména bosutinib a ponatinib).
Tab. 5. Cévní nežádoucí účinky u pacientů v akcelerované fázi/blastickém zvratu dle TKI ve všech liniích léčby TKI. 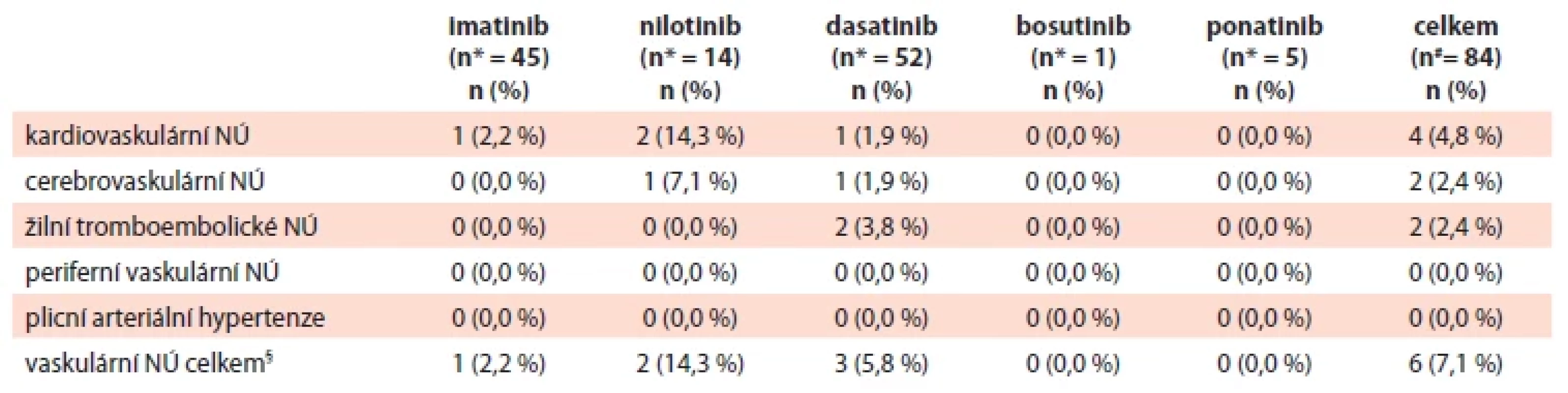
*odpovídá počtu paciento-linií jednotlivých TKI, jeden pacient mohl užívat sekvenčně více TKI a také mohl užívat jeden TKI opakovaně v různých liniích léčby; § počet paciento-linií, na kterých byl alespoň 1 CNÚ, v případě více CNÚ na jedné linii je každá linie započítána jen jednou; # počet pacientů s daným CNÚ bez ohledu na užívaný TKI
NÚ – nežádoucí účinky; TKI – inhibitory tyrozinkinázDávka TKI a odpověď v době vzniku cévního NÚ
Při analýze dávky TKI v době vzniku CNÚ v CP bylo zjištěno, že medián denní dávky pro imatinib (400 mg) i nilotinib (600 mg) odpovídá standardní plné denní dávce doporučené pro CP. Pro dasatinib a ponatinib byl medián dávky TKI v době vzniku CNÚ nižší – 70 mg, resp. 15 mg. Výsledek může být zkreslen malým počtem CNÚ, které se při terapii těmito TKI vyvinuly. Rozložení dávek jednotlivých TKI ukazuje graf 2 (s výjimkou bosutinibu, který užíval v době vzniku CNÚ pouze 1 pacient, a to v dávce 500 mg). V pokročilých fázích onemocnění nebyly parametry dávkování TKI jako rozložení dávek a medián dávky analyzovány vzhledem k malému počtu CNÚ.
Graf 2. Rozložení denních dávek TKI v době vzniku cévního nežádoucího účinku. 
V době vzniku CNÚ u pacientů v CP dosáhlo kompletní hematologické odpovědi (complete hematological response – CHR) 80 pacientů (72,7 %), kompletní cytogenetické odpovědi (complete cytogenetic response – CCyR) 67 pacientů (60,9 %) a velké molekulární odpovědi (major molecular response – MMR) 60 pacientů (54,5 %). Podrobněji jsou léčebné odpovědi pacientů uvedeny v tab. 6 a–c.
Tab. 6. Odpověď na terapii TKI v době vzniku cévního nežádoucího účinku u pacientů v CP. 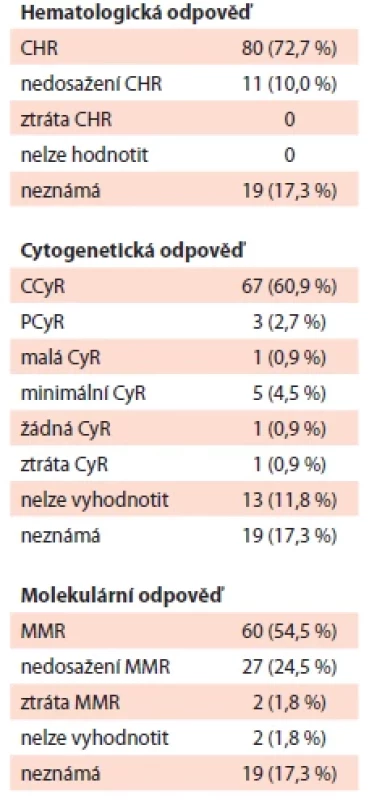
CCyR – kompletní cytogenetická odpověď (complete cytogenetic response); CyR – cytogenetická odpověď (cytogenetic response); CHR – kompletní hematologická odpověď (complete hematological response); PCyR – částečná cytogenetická odpověď (parcial cytogenetic response); MMR – velká molekulární odpověď (major molecular response) Léčebná a preventivní opatření při výskytu cévního nežádoucího účinku
Reakce na CNÚ mohou být různé od symptomatické léčby NÚ přes přechodné vysazení TKI až po remisi bez nutnosti terapie. V našem souboru byla samotná symptomatická terapie zvolena u 71 pacientů (59,7 %), změna za jiný TKI u 17 pacientů (14,3 %), přechodné vysazení TKI u 8 pacientů (6,7 %), redukce dávky u 6 pacientů (5,0 %) a u 3 pacientů (2,5 %) byla terapie TKI ukončena, přestože pacienti nedosahovali optimální odpověď dle aktuálních doporučení pro terapii CML a nadále byli léčeni pouze cytoredukční terapií. Do remise bez nutnosti terapie vstoupil 1 pacient (0,8 %). Na 13 CNÚ nebylo možné reagovat, protože vedly k úmrtí celkem 11 pacientů.
Vzhledem k mediánu věku pacientů při diagnóze a vysokému výskytu RF také řada pacientů užívala statin (celkem 285 pacientů, 28,3 %) a antiagregační terapii (206 pacientů, 20,5 %). Z 89 pacientů, u kterých se některý ze sledovaných NÚ vyskytl, jich 48 užívalo statin a z nich 21 (43,8 %) lék užívalo již před výskytem CNÚ. Podobně v případě antiagregace 23 pacientů (50,0 %) z celkových 46 tuto terapii užívalo ještě před objevením CNÚ.
DISKUZE A ZÁVĚR
Cévní nežádoucí účinky při terapii TKI představují závažnou komplikaci léčby CML. Předkládaná práce je retrospektivní analýzou provedenou na více než 1 000 pacientech v reálné klinické praxi, a byla tak provedena bez předchozí selekce pacientů zejména s ohledem na jejich věk či komorbidity, čímž se liší od řady klinických studií. Např. ze studie ENESTnd byli vyloučeni pacienti se sníženou srdeční funkcí a medián věku zařazených pacientů byl 47 let v rameni s nilotinibem, resp. 46 let v rameni s imatinibem [10]. Stejně tak do studie DASISION nebyli zařazeni pacienti s těžkým kardiálním onemocněním a medián věku byl 46 let pro pacienty s dasatinibem, resp. 49 let pro pacienty s imatinibem [11]. V předkládané práci je však medián v době diagnózy 58 let. I přes to byl výskyt hlavně kardiovaskulárních CNÚ ve studii ENESTnd v porovnání s naší analýzou podstatně vyšší (v rameni s nilotinibem 400 mg 2× denně 23,5 vs. 4,6 % u pacientů léčených nilotinibem v naší analýze, u pacientů užívajících imatinib 3,6 vs. 2,7 %) [7]. Obdobně vypadá i porovnání našich výsledků pro výskyt plicní hypertenze u pacientů léčených dasatinibem s výsledky studie DASISION – 0,9 vs. 5,0 % [9].
Jak se ukázalo v předkládané analýze, riziko CNÚ je největší při terapii ponatinibem a nilotinibem, což odpovídá i dostupným literárním údajům. V provedené analýze byl výskyt CNÚ v porovnání s literaturou spíše nižší: v CML-CP objevily u 10,8 % pacientů užívajících nilotinib a u 8,3 % pacientů při terapii ponatinibem, a to jak u pacientů s RF, tak i u pacientů bez nich. Mezi nejčastější RF v našem souboru patřily nadváha, diabetes mellitus a dyslipidemie, proto by těsné kompenzaci metabolických poruch stejně jako úpravě tlaku krve měla být věnována bedlivá pozornost ve spolupráci s internistou, a to i přes to, že nilotinib je přednostně nasazován pacientům bez RF.
V celonárodní retrospektivní analýze provedené ve Švédsku na 896 pacientech s CML byl pozorován dokonce ještě nižší výskyt CNÚ. Byly evidovány u 38 pacientů (4,9 %) léčených imatinibem, 7 (2,9 %) léčených nilotinibem a pouze u 5 (2,4 %) léčených dasatinibem [25]. Naproti tomu v práci italských autorů popisujících výskyt arteriálních uzávěrů u 57 pacientů s CML léčených TKI 2. a 3. generace v každodenní klinické praxi byly výsledky o poznání horší. Kumulativní incidence sledovaných CNÚ (infarkt myokardu, angina pectoris, TIA, iCMP a PAOD) byla po 60 měsících terapie 47,8 %, u pacientů léčených nilotinibem dokonce 76,7 % a 64,0 % u pacientů léčených ponatinibem. Tyto výsledky mohou být dány jednak malým souborem pacientů, ale také charakterem souboru. Některou z forem arteriálního uzávěru měli totiž v anamnéze všichni sledovaní pacienti [29]. Přestože ponatinib je již z registrační studie znám svým častým výskytem CNÚ, což potvrzují kromě výše zmíněné italské práce i další pozorování [31,33], jsou k dispozici i analýzy, kde se CNÚ při léčbě ponatinibem nevyskytly vůbec nebo jen u mizivého počtu pacientů [28,32]. Obě tyto práce však byly provedeny na velmi malých souborech pacientů (37, resp. 29), a může tedy jít o chybu malých čísel.
Při srovnání s analýzou hodnotící evropskou epidemiologii vaskulárních onemocnění (zastoupených nemocemi koronárních tepen a CMP), ve které byla roční prevalence těchto chorob v ČR 5,5 % u mužů a 4,4 % u žen [47], byl jejich výskyt srovnatelný s výskytem kardiovaskulárních a cerebrovaskulárních onemocnění u pacientů užívajících nilotinib (4,6, resp. 3,5 %) a ponatinib (4,2 % pro oba typy CNÚ) v naší analýze. Naopak frekvence těchto NÚ při terapii ostatními TKI je v naší analýze nižší. Výsledky při terapii ponatinibem jsou také zkresleny malým počtem pacientů, kteří jím byli v CP léčeni, a potvrzuje to potřebu dalších analýz z reálné klinické praxe. Celková spíše nižší četnost výskytu CNÚ prokázaná v naší práci je pravděpodobně dána tím, že v klinické praxi je RF a NÚ věnována velká pozornost, ať již při samotném výběru TKI, nebo v průběhu terapie. To je v ČR umožněno centralizovanou péčí o pacienty s CML probíhající ve fakultních nemocnicích, kde o ně pečuje malý okruh erudovaných specialistů napojený na další odbornosti nejen v rámci vnitřního lékařství. To může napomoci vyhodnocení kardiovaskulárního rizika např. pomocí stanovení AB Indexu (ankle brachial index, index kotníkových tlaků), ultrazvukového vyšetření cév dolních končetin nebo srdce ať už před nasazením TKI, či v průběhu jejich podávání. Dávka ponatinibu může být redukována promptně po dosažení velké molekulární nebo dokonce již velké cytogenetické odpovědi. V případě nilotinibu je pak při objevení NÚ zvažována časná změna za jiný TKI. Naše analýza naopak neprokázala význam užívání statinů či antiagregační terapie v primární prevenci, neboť v našem souboru užívalo 43,8 % pacientů s výskytem CNÚ statin a 50 % antiagregaci ještě před objevením některého ze sledovaných NÚ. Primární prevence není jednoznačně doporučovaná ani v literatuře. Individuálně by měla být zvážena individuálně zejména u pacientů s vysokým kardiovaskulárním rizikem, na rozdíl od prevence sekundární, jejíž indikace je nesporná [49, 50]. Nelze vyloučit, že za relativně nízkou četností CNÚ částečně stojí také retrospektivní charakter provedené analýzy, kvalita dat v registru či zpoždění v jejich zadávání a v neposlední řadě poddiagnostikování CNÚ nízkého stupně závažnosti, které jsou v klinických studiích cíleně vyhledávány.
Minimalizace NÚ, vč. těch cévních, je také jedním z cílů akademické celonárodní prospektivní studie HALF, zaměřené na bezpečnost a efektivitu vysazení TKI po předchozí dvoustupňové redukci dávky, do které nyní úspěšně probíhá nábor pacientů (ClinicalTrials.gov Identifier: NCT04147533) [51].
Imatinib se v předložené analýze jednoznačně ukázal jako bezpečný lék, a proto je právem považován za zlatý standard léčby CML, který je vhodný i pro starší a komorbidní pacienty. Uvážlivá indikace, zhodnocení a včasná korekce případných vstupních rizikových faktorů, pečlivé sledování a management NÚ v průběhu léčby a proaktivní optimalizace dávkování ale umožňují bezpečné využití potenciálu i dalších TKI vyšších generací.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
PČ – zpracování souboru pro analýzu, příprava manuskriptu, finální úpravy textu
DŽ – korekce rukopisu, schválení finální verze, ambulantní péče o pacienty
JM, HK, PB, LS, AK, TH, LS – připomínkování rukopisu, ambulantní péče o pacienty
ZK, JB, NŠ – zpracování statistické analýzy
JP, RM – zadávání dat do databáze INFINITY
ČESTNÉ PROHLÁŠENÍ
PČ, JM, HK, PB, LS, AK, ZK, JB, NŠ, JP a RM prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
DŽ poskytla konzultační služby společnosti Angelini a přednášela na edukačním sympoziu společnosti Angelini.
TH poskytl konzultační služby společnosti Angelini.
PODĚKOVÁNÍ
Práce byla realizována za podpory Grantu pro specifický výzkum LF MU pod grantovým číslem MUNI/A/1224/2022 a podpořena z programového projektu MZ ČR s reg. č. NU22-03-00136 a projektu Národního ústavu pro výzkum rakoviny (Program EXCELES, ID: LX22NPO5102) financovaného Evropskou unií – Next Generation EU.
Doručeno do redakce dne: 27. 9. 2022.
Přijato po recenzi dne: 9. 1. 2023.
doc. MUDr. Daniela Žáčková, Ph.D.
Interní hematologická a onkologická klinika
Fakultní nemocnice Brno a LF MU
Jihlavská 340/20
625 00 Brno
e-mail: zackova.daniela@fnbrno.cz
Transfuze Hematol Dnes 2023; 29(1): 29 – 37
Zdroje
1. Nowel PC. A minute chromosome (Ph1) in human chronic granulocytic leukaemia. Blut. 1962; 8 : 65–66.
2. Shtivelman E, Lifshitz B, Gale RP, Canaani E. Fused transccript of abl and bcr genes in chronic myelogenous leukaemia. Nature. 1985; 315 (6020): 550–554.
3. Bower H, Björkholm M, Dickman PW et al. Life expectancy of patients with chronic myeloid leukemia approaches the life expectancy of the general population. J Clin Oncol. 2016; 34 (24): 2851–2857.
4. Hochhaus A, Baccarani M, Silver RT, et al. European LeukemiaNet 2020 recommendation for treating chronic myeloid leukemia. Leukemia. 2020; 34 (4): 966–984.
5. Hochhaus A, Saussele S, Rosti G, et al. Chronic myeloid leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017; 28 (suppl_4): iv41–iv51.
6. Hochhaus A, Larson RA, Guilhot F, et al. Long-term outcomes of imatinib treatment for chronic myeloid leukemia. Engl J Med. 2017; 376 (10): 917–927.
7. Kantarjian HM, Huges TP, Larson RA, et al. Long-term outcomes with frontline nilotinib versus imatinib in newly diagnosed chronic myeloid leukemia in chronic phase: ENESTnd 10-year analysis. Leukemia. 2021; 35 : 440–453.
8. Kantarjian HM, Giles F, Gattermann N, et al. Nilotinib (formerly AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is effective in patients with Philadelphia chromosome-positive chronic myelogenous leukemia in chronic phase following imatinib resistance and intolerance. Blood. 2007; 110 (10): 3540–3546.
9. Cortes JE, Saglio G, Kantarjian HM, et al. Final 5-year study results of DASISION: The dasatinib versus imatinib study in treatment-naïve chronic myeloid leukemia patients trial. J Clin Oncol. 2016; 34 (20): 2333–2340.
10. Saglio G, Kim DW, Issaragrisil S, et al. Nilotinib versus imatinib for newly diagnosed chronic myeloid leukemia. N Engl J Med. 2010; 362 (24): 2251–2259.
11. Kantarjian H, Shah NP, Hochchaus A, et al. Dasatinib versus imatinib in newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2010; 362 : 2260–2270.
12. Hochhaus A, Kantarjian HM, Baccarani M, et al. Dasatinib induces notable hematologic and cytogenetic response in chronic-phase chronic myeloid leukemia after failure of imatinib therapy. Blood. 2007; 109 (6): 2303–2230.
13. Cortes JE, Gabacorti-Passerini C, Deininger MW, et al. Bosutinib versus imatinib for newly diagnosed chronic myeloid leukemia: results from the randomized BFORE trial. J Clin Oncol. 2018; 36 (3): 231–239.
14. Cortes JE, Kantarjian HM, Brümmendorf TH, et al. Safety and efficacy of bosutinib (SKI-606) in chronic phase Philadelphia chromosome-positive chronic myeloid leukemia patients with resistance or intolerance to imatinib. Blood. 2011; 118 (17): 4567–4576.
15. Cortes JE, Kim DW, Pinila-Ibraz J, et al. Ponatinib efficacy and safety in Philadelphia chromosome-positive leukemia: final 5-year results of the phase 2 PACE trial. Blood. 2018; 132 (4): 393–404.
16. Lipton JH, Chuah Ch, Guerci-Bresler A, et al. Ponatinib versus imatinib for newly diagnosed chronic myeloid leukaemia: an international, randomised, open-label, phase 3 trial. Lancet Oncol. 2016; 17 : 612–621.
17. Quintás-Cardama A, Kantarjian H, Cortes J. Nilotinib-associated vascular events. Clin Lymphoma Myeloma Leuk. 2012; 12 (5): 337–340.
18. Giles FJ, Mauro MJ, Hong F, et al. Rates of peripheral arterial occlusive disease in patients with chronic myeloid leukemia in the chronic phase treated with imatinib, nilotinib, or non-tyrosine kinase therapy: a retrospective cohort analysis. Leukemia. 2013; 27 : 1310–1315.
19. Cortes JE, Kantarjian HM, Mauro MJ, et al. Long-term cardiac, vascular, hypertension, and effusion safety of bosutinib in patients with Philadelphia chromosome-positive leukemia resistent or intolerant to prior therapy. Eur J Haematol. 2021; 106 (6): 808–820.
20. Jain P, Kantarjian H, Boddu PC, et al. Analysis of cardiovascular and arteriothrombotic adverse events in chronic-phase CML patients after frontline TKIs. Blood Adv. 2019; 3 (6) 851–861.
21. Gugliotta G, Castagnetti F, Breccia M, et al. Long-term outcomes of a phase 2 trial with nilotinib 400 mg twice daily in first-line treatment of chronic myeloid leukemia. Haematologica. 2015; 100 (9): 1146–1150.
22. le Coutre PD, Hughes TP, Mahon FX, et al. Low incidence of peripheral arterial disease in patients receiving dasatinib in clinical trials. Leukemia. 2016; 30 : 1593–1596.
23. Lang K, McGarry LJ, Huang H, et al. Mortality and vascular events among elderly patients with chronic myeloid leukemia: a retrospective analysis of linked SEER-Medicare data. Clin Lymphoma Myeloma Leuk. 2016; 16 (5): 275–285.
24. Aichberg KJ, Herndlhofer S, Schernthaner GH, et al. Progressive peripheral arterial occlusive and other vascular events during nilotnib therapy in CML. Am J Hematol. 2011; 86 : 533–539.
25. Dahlén T, Edgren G, Lambe M, et al. Cardiovascular events associated with use of tyrosine kinase inhibitors in chronic myeloid leukemia. Ann Intern Med. 2016; 165 : 161-166.
26. Gora-Tybor J, Medras E, Calbecka M, et al. Real-life comparison of severe vascular events and other non-hematological complications in patients with chronic myeloid leukemia undergoing second-line nilotinib or dasatinib treatment. Leuk Lymphoma. 2015; 56 (8): 2309–2314.
27. Caocci G, Mulas O, Abruzzese E, et al. Incidence and evaluation of predisposition to cardiovascular toxicity in chronic myeloid leukemia patients treated with bosutinib in the real-life practice. Ann Hematol. 2019; 98 : 1885–1890.
28. Shacham-Abulafia A, Raanani O, Lavie D, et al. Real-life experience with ponatinib in chronic myeloid leukemia: a multicenter observational study. Clin Lymphoma Myeloma Leuk. 2018; 18 (7): e295–e301.
29. Caocci G, Mulas O, Bonifacio M, et al. Recurrent arterial occlusive events in patients with chronic myeloid leukemia treated with second - and third-generation tyrosine kinase inhibitors and role of secondary prevention. Int J Cardiol. 2019; 288 : 124–127.
30. Huguet F, Cayuela JM, Cambier N, et al. Nilotinib efficacy, safety, adherence and impact on quality of life in newly diagnosed patients with chronic myeloid laukaemia in chronic phase: a prospective observational study in daily clinical practice. Br J Haematol. 2019; 187 : 615–626.
31. Caocci G, Mulas O, Abruzzese E, et al. Arterial occlusive events in chronic myeloid leukemia patients treated with ponatinib in the real-life practice are predicted by the Systematic Risk Evaluation (SCORE) chart. Hematol Oncol. 2019; 37 : 296–302.
32. Breccia M, Abruzzese E, Castagnetti F, et al. Ponatinib as second-line treatment chronic phase chronic myeloid leukemia patients in real-life practice. Ann Hematol. 2018; 97 : 1577–1580.
33. Heiblig M, Rea D, Chrétien ML, et al. Ponatinib evaluation and safety in real-life chronick myelogenous leukemia patients failing more than two tyrosine kinase inhibitors: the PEARL observational study. Experiment Hematol. 2018; 67 : 41–48.
34. Hadzijusufovic E, Albrecht-Schgoer K, Huber K, et al. Nilotinib-induced vasculopathy: identificationof vascular endothelial cells as a primary target site. Leukemia. 2017; 31 (11): 2388–2397.
35. Haguet H, Bouvy C, Delvigne AS, et al. The risk of arterial thrombosis in patients with chronic myeloid leukemia treated with second and third generation BCR-ABL tyrosine kinase inhibitors may be explained by their impact on endotelial cells: an in-vitro study. Front Farmacol. 2020; 11 : 1–11.
36. Hieschbuehl K, Rank A, Pfeiffer T, et al. Large vessel vasculitis as a possible mechanism of vascular side effects of ponatinib: a cacse report. J Hematol. 2019; 8 (2): 83–85.
37. Gover-Proaktor A, Granot G, Pasmanik-Chor M, et al. Bosutinib, dasatinib, imatinib, nilotinib and ponatinib differentially affect vascular, molecular pathways and functionality of human endothelial cells. Leuk Lymphoma. 2019; 60 (1): 189–199.
38. Gover-Proaktor A, Granot G, Shapira S, et al. Ponatinib reduces viability, migration, and functionality of human endotelial cells. Leuk Lymphoma. 2017; 58 : 1455–1467.
39. Horňák R, Semerád L, Žáčková D, et al. Analysis of serum lipids, cardiovascular risk, and indication for statin use during nilotinib and imatinib therapy in de novo CML patients – results from real-life prospective study. Leuk Lymphoma. 2020; 61 (2): 494–496.
40. Rea D, Mirault T, Cluzeau T et al. Early onset hypercholesterolemia induced by the 2nd-generation tyrosine kinase inhibitor nilotinib in patients with chronic myeloid leukemia. Haematologica. 2014; 99 (7): 1197–1203.
41. Racil Z, Razga F, Drapalova J, et al. Mechanism of impaired glucose metabolism durong nilotinib therapy in patients with chronic myelogenous leukemia. Hematologica. 2013; 98 (10): e124–e126.
42. Valent P, Hadzijusufovic E, Schernthaner GH, et al. Vascular safety issues in CML patients treated with BCR/ABL1 kinase inhibitors. Blood. 2015; 125 (6): 901–905.
43. P, Valent. Severe adverse events associated with the use of second-line BCR/ABL tyrosine kinase inhibitors: preferential occurence in patients with comorbities. Haematologica. 2011; 96 (10): 1395–1397.
44. Steegmann JL, Baccarani M, Breccia M, et al. European LeukemiaNet recommendations for the management and avoidance of adverse events of treatment in chronic myeloid leukaemia. Leukemia. 2016; 30 : 1648–1671.
45. Žáčková D, Čičátková P, Kvetková A, et al. Jaké dávky inhibitorů tyrozinkináz jsou v léčbě pacientů s chronickou myeloidní leukemií optimální? Transfuze Hematol Dnes. 2021; 27 (1): 28–41.
46. Čičátková P, Kvetková A, Horňák T, et al. Úskalí léčby chronické myeloidní leukemie dasatinibem – plicní arteriální hypertenze jako vzácná komplikace. Transfuze Hematol Dnes. 2021; 27 (2): 166–171.
47. Townsend N, Wilson L, Bhatnagar P, at al. Cardiovascular disease in Europe: epidemiological update 2016. Eur Heart J. 2016; (42): 3232–3245.
48. Huguet F, Cayuela JM, Cambier N, et al. Nilotinib efficacy, safety, adherence and impact on quality of life in newly diagnosed patients with chronic myeloid laukaemia in chronic phase: a prospective observational study in daily clinical practice. Br J Haematol. 2019; 187 : 615–626.
49. Saussele S, Haverkamp W, Lang F, et al. Ponatinib in the treatment of chronic myeloid leukemia and Philadelphia chromosome-positive acute leukemia: recommendations of a German expert consensus panel with focus on cardiovascular management. Acta Hematol. 2020; 143 : 217-231.
50. Aghel N, Delgado DH, Lipton JH. Cardiovascular toxicities of BCR-ABL tyrosine kinase inhibitors in chronic myeloid leukemia: preventive strategies and cardiovascular surveillance. Vasc Health Risk Manag. 2017; 13 : 293–303.
51. Žáčková D, Faber E, Stejskal L, et al. HALF: A prospective multi-centre phase II clinical trial evaluating the efficacy and safety of tyrosine kinase inhibitors‘ discontinuation after two-step dose reduction in patients with chronic myeloid leukemia in deep molecular remission. Blood. 2021; 138 : 3606.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2023 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Blastický zvrat chronické myeloidní leukemie
- Cévní nežádoucí účinky u pacientů s chronickou myeloidní leukemií při terapii inhibitory tyrozinkináz v každodenní klinické praxi – analýza z databáze INFINITY
- Editorial
- Nezvyklý a nepriaznivý priebeh chronickej myelocytovej leukémie – kazuistika a prehľad literatúry
- Doporučený postup stratifikace rizika trombózy a cílené tromboprofylaxe u žen podstupujících asistovanou reprodukci
- Prevence, diagnostika a léčba trombózy spojené se zhoubným nádorem
- Doporučení České hematologické společnosti pro diagnostiku a léčbu imunitní trombocytopenie dospělých
- Sympozium a workshop – aktuální výzvy a uplatnění nových technologií v léčbě chronické myeloidní leukemie
- Fixní délka léčby CLL – realita, nebo fikce?
- Jubileum primářky Lenky Walterové
- Povrchové markery leukemických kmenových buněk u chronické myeloidní leukemie
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení České hematologické společnosti pro diagnostiku a léčbu imunitní trombocytopenie dospělých
- Doporučený postup stratifikace rizika trombózy a cílené tromboprofylaxe u žen podstupujících asistovanou reprodukci
- Blastický zvrat chronické myeloidní leukemie
- Nezvyklý a nepriaznivý priebeh chronickej myelocytovej leukémie – kazuistika a prehľad literatúry
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



