-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nové perspektivní jednotky: nádory ledvin popsané v době po WHO histopatologické klasifikaci z roku 2016
New emerging entities: renal tumors described after WHO Classification 2016
Hes O, Hora M, Pitra T, Šedivcová M, Kolář J, Veselá A, Fiala O. New emerging entities: renal tumors described after WHO Classification 2016.
Histopathological Classification of renal tumors is more complicated every year. New emerging entities are defined not only by morphology and immunohistochemical profile, but also more frequently using molecular genetic techniques.
In this review, new perspective entities with clearly defined molecular‑genetic background are introduced. Groups of renal tumors sharing abnormalities in the mTOR pathway were recognized recently. It is eosinophilic solid and cystic renal cell carcinoma, high grade oncocytic tumor, and low grade oncocytic tumor. All subtypes follow an indolent non aggressive course despite presence of high‑grade nuclei.
MitF related renal cell carcinomas (translocation) renal cell carcinomas were listed in WHO classification since 2004. New member of RCC with impaired TFEB gene is renal cell carcinoma with TFEB amplification. This subtype is aggressive (contrary to TFEB translocated RCC) and very difficult to diagnose.
Several other entities are intensively studied and examined. Their current status is questionable and more likely they will not be listed in upcoming WHO classification. Despite the rapid progression in diagnostic abilities, practical impact for routine clinical practice is (in 2020) limited.
Conclusions: Urologists and oncologists should expect new, relatively complicated classification of renal tumors, partly based on molecular genetic features. However, a more personalized approach to individual patients is desirable, clinical specialists do not dispose appropriate spectrum of systemic treatment modalities.
Keywords:
kidney – Renal cell carcinoma – new entities – molecu‑ lar genetic diagnosis
Autoři: Ondřej Hes 1; Milan Hora 2; Tomáš Pitra 2; Monika Šedivcová 1; Jiří Kolář 2; Adriana Veselá 2; Ondřej Fiala 3
Působiště autorů: Šiklův ústav patologie, Lékařská fakulta Plzeň, Univerzita Karlova a Fakultní nemocnice Plzeň 1; Urologická klinika, Lékařská fakulta Plzeň, Univerzita Karlova a Fakultní nemocnice Plzeň 2; Onkologická a radioterapeutická klinika, Lékařská fakulta Plzeň, Univerzita Karlova a Fakultní nemocnice Plzeň 3
Vyšlo v časopise: Ces Urol 2020; 24(3): 183-190
Kategorie: Přehledový článek
Souhrn
Hes O, Hora M, Pitra T, Šedivcová M, Kolář J, Veselá A, Fiala O. Nové perspektivní jednotky: nádory ledvin popsané v době po WHO histopatologické klasifikaci z roku 2016. Histopatologická klasifikace renálních tumorů je každým rokem komplikovanější. Nové perspektivní nádorové jednotky jsou definovány nejen na podkladě morfologických a imunohistochemických vlastností, ale častěji na základě molekulárně genetických vlastností.
V tomto přehledném článku představujeme nové jednotky, které mají jasně definován genetický podklad. V současnosti jsou popisovány nádory s postiženou mTOR drahou. Jde o eosinofilní solidní a cystický renální karcinom, „high‑grade“ onkocytický tumor a „low‑grade“ onkocytický tumor. Všechny tyto podtypy, přes přítomnost „high‑grade“ cytologických vlastností se chovají indolentně. Další jsou MiTF renální (translokační) karcinomy, které jsou zařazeny do WHO klasifikací od roku 2004. Nově se ale rozpoznává renální karcinom s amplifikací TFEB genu. Jde o léze agresivní (oproti TFEB translokovaným renálním karcinomům) a jsou bez molekulární genetiky obtížně diagnostikovatelné. Dále jsou zmíněny další intenzivně studované jednotky nádorů ledvin. Jejich současné postavení vzhledem k oficiální WHO klasifikaci zůstává nejasné. Přes rychlý pokrok v diagnostice renálních nádorů se zdá, že využití těchto poznatků v rutinní klinické praxi bude limitované (rok 2020).
Závěr: Urologové a onkologové musí v brzké době očekávat novou poměrně složitou klasifikaci nádorů ledvin založenou z části na molekulárně genetickém vyšetření. Dalším krokem by měla být personalizace léčby, k tomu však klinikům zatím chybí vhodné portfolio léčebných možností zejména u systémové léčby.
Klíčová slova:
ledviny – renální karcinom – molekulárně genetická diagnóza
ÚVOD
Histopatologická klasifikace nádorů ledvin zažívá v posledních deseti letech nebývalý přerod. Z poměrně jednoduché a snadno uchopitelné sestavy několika typů karcinomů a pár benigních jednotek se stává seznam nádorových typů, který si nezadá svojí délkou a komplikovanou strukturou s klasifikací nádorů ovária či například s lymfomy (1, 2). V současné době je platná klasifikace WHO z roku 2016 (3). V krátké době začne příprava nové WHO klasifikace. Zdá se, že žádná z nádorových jednotek u ledviny uváděných v klasifikaci WHO 2016 nebude vypuštěna, naopak zařazeny budou nové typy nádorů. V tomto krátkém přehledu se pokusíme představit perspektivní typy nádorů, které by se mohly v nové klasifikaci nově vedle zavedených jednotek objevit. Každá WHO klasifikace je výsledkem rozsáhlých diskuzí mezi autory, řady kompromisů a pečlivého zvažování, a proto je tvorba nového klasifikačního systému komplikovaná.
Je evidentní, že přestože je to trend, který kliničtí lékaři nevítají s nadšením, bude nejspíše komplikované dělení nádorů ledviny s často těžko zapamatovatelnými popisnými názvy a složitou definicí pokračovat. Pokud se podíváme do oblastí mimo urologii, je stratifikace nádorových jednotek na stále užší a užší skupiny běžná všude a molekulárně genetické rysy nádorů se stávají naprosto nedílnou součástí diferenciálně diagnostického vyšetřovacího algoritmu.
Z pohledů klinických lékařů by měla nová klasifikace směřovat k lepšímu léčebnému ovlivnění. Pokud se podíváme na současné možnosti léčby nádorů ledvin a požadavky na histopatologickou klasifikaci, musíme si léčbu rozdělit dle pokročilosti nádoru. U nádorů lokalizovaných s nízkým rizikem je a patrně ještě dlouho bude dostatečná léčba chirurgická (T1N0M0 záchovné výkony – resekce, je‑li technicky možné, u pokročilejších nefrektomie) s následným sledováním. U pečlivě vybraných jedinců lze zvolit aktivní sledování či termální ablační metodiky. Role histopatologie bude mít zásadnější vliv u rizikových lokalizovaných nádorů (velké nádory, agresivnější typy). Zde by mohla histopatologie pomoci s výběrem vhodné adjuvantní léčby. Bohužel zatím klinické studie s adjuvantní léčbou nevykazují uspokojivé výsledky. Pravda, jsou založeny hlavně na užití TKI (inhibitorů tyrosinkinázy – sunitinib, axitinib a další), studie s novější imunoterapií zatím nejsou k dispozici. Zcela zásadní bude ale úloha histopatologie s genetickou stratifikací v přesné diagnostice generalizovaných nádorů. Přesná stratifikace bude základem tzv. personalizované medicíny, tedy určení individualizované léčby pro každého konkrétního nemocného. Limitujícím i u přesnější stratifikace bude dostupnost vhodných léčebných metod systémové léčby založené nyní zejména na kombinaci imunoterapie dvěma preparáty či kombinace imunoterapie s TKI. Zmíněnou v současnosti dostupnou imunoterapií jsou inhibitory PD-1 (nivolumab, pembrolizumab) resp. PD‑L1 (avelumab) a léky cílící na CTLA-4 (ipilimumab). Nutno však doufat v další vývoj nových principů systémové léčby (4).
Jelikož molekulární genetika proniká do každodenních histopatologických diagnostických postupů, na úvod považujeme za vhodné alespoň krátce zmínit základní technologie, které se v současné době využívají v této diagnostice nádorů ledvin. Je třeba zdůraznit, že genetikou se ve většině světových laboratoří zabývají genetici, nikoliv lékaři a i velká část patologů, kteří výsledky běžně využívají a o analýzy žádají, jsou pouze „uživatelé“. Technologií je velké množství, lze je kombinovat a různě modifikovat. Podrobnější popis metod molekulární genetiky je zcela mimo rámec tohoto článku, zde je uveden jen stručný výčet pro klinické urology.
Jednak je to klasická FISH (Fluorescence In Situ Hybridisation), kterou používáme například ke určení zlomu patřičného genu (například u genu TFE3, TFEB) (Obr. 1). Dále rutinně využíváme mutační analýzu ke zjištění přítomnosti/ nepřítomnosti mutace určitého genu (například u FH, SDHB nebo BHD) (5) (Obr. 2). Další často využívanou technologií je NGS (Next Generation Sequencing), kterou mimo jiné používáme ke screeningu mutací na daném panelu genů (komerčně zakoupená nebo individuálně vyrobená sestava). NGS je schopna v jedné analýze prověřit desítky i stovky genů. Technologie NGS se používá například k vyhledávání partnera při translokacích (translokační renální karcinomy) (Obr. 3). aCGH (Array Comparative Genomic Hybdridisation) je technologie, která detekuje ztráty a zisky (losses and gains) u jednotlivých chromozomů a bývá používána například pro analýzu chromozomu 7 a 17 u papilárních renálních karcinomů.
Obr. 1. FISH – 7/17 trisomie u papilárního renálního karcinomu, typ 1
Fig. 1. FISH – 7/17 trisomy in papillary renal cell carcinoma, type 1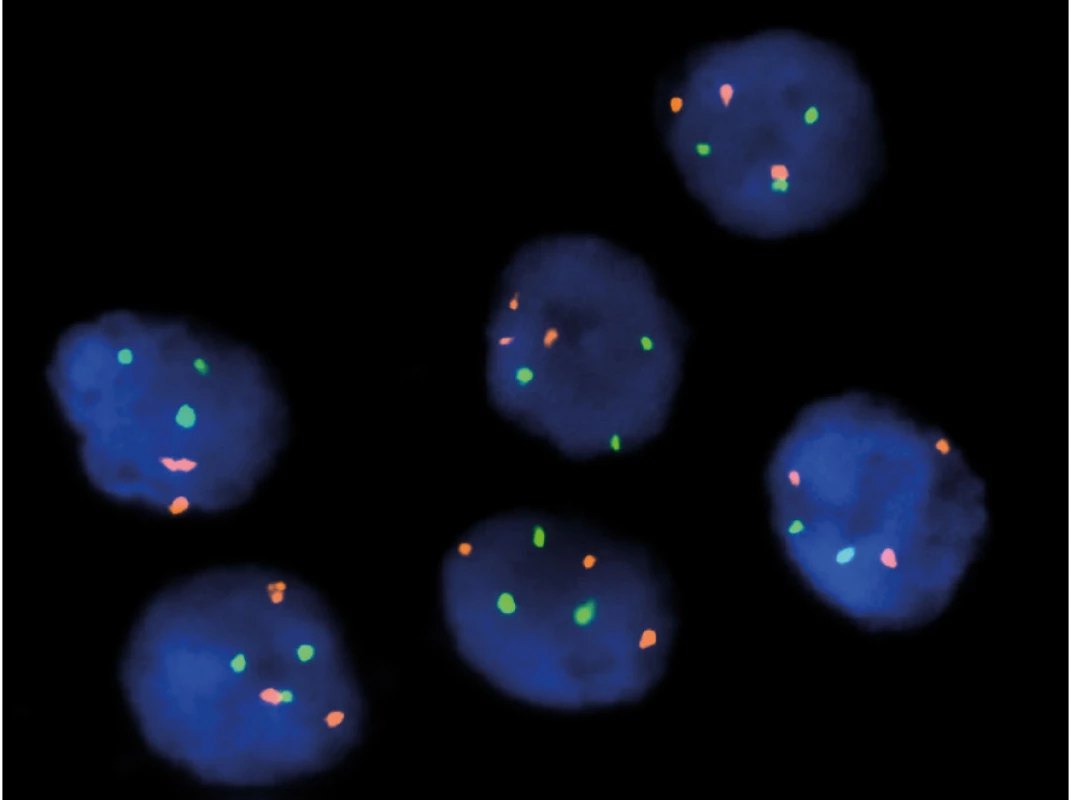
Obr. 2. SDHB deficientní renální karcinom s nalezenou mutací: NM_003000.2(SDHB): c.725G>A (p.Arg242His). Sanger sequencing
Fig. 2. SDHB deficient renal cell carcinoma with mutation: NM_003000.2(SDHB): c.725G>A (p.Arg242His). Sanger sequencing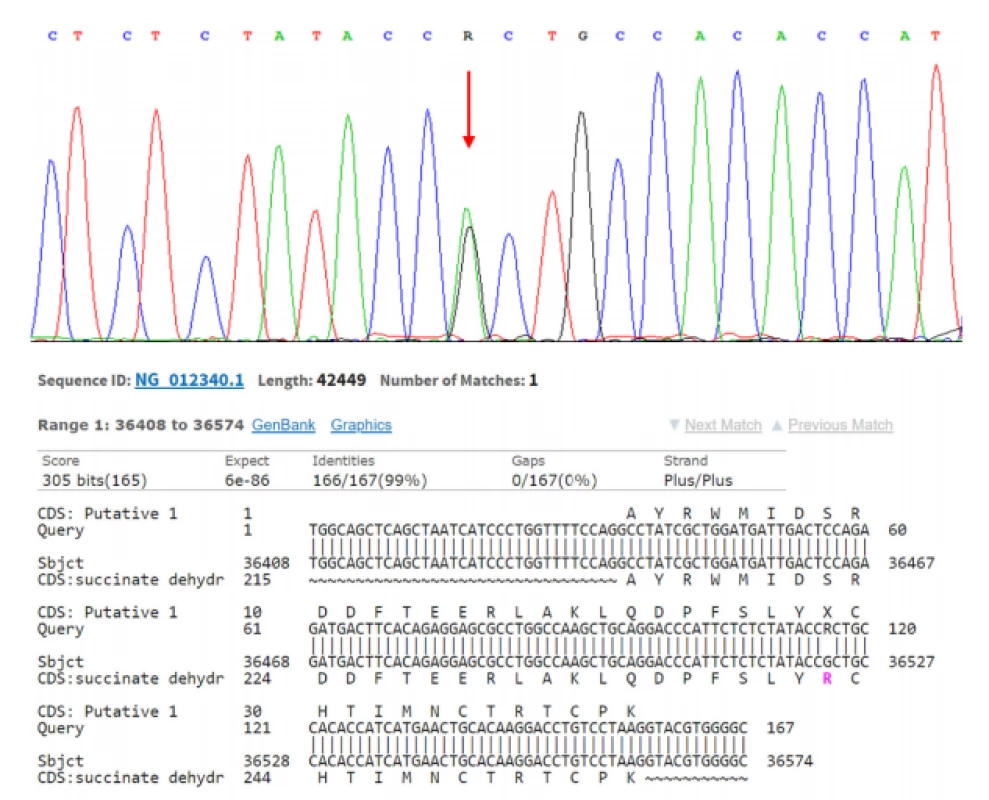
Obr. 3. Translokační Xp11 (TFE3-PRCC) renální karcinom. Výstup z NGS: fúze genů PRCC/TFE3
Fig. 3. Xp11 (TFE3-PRCC) translocation renal cell carcinoma. NGS analysis: fusion of genes PRCC/TFE3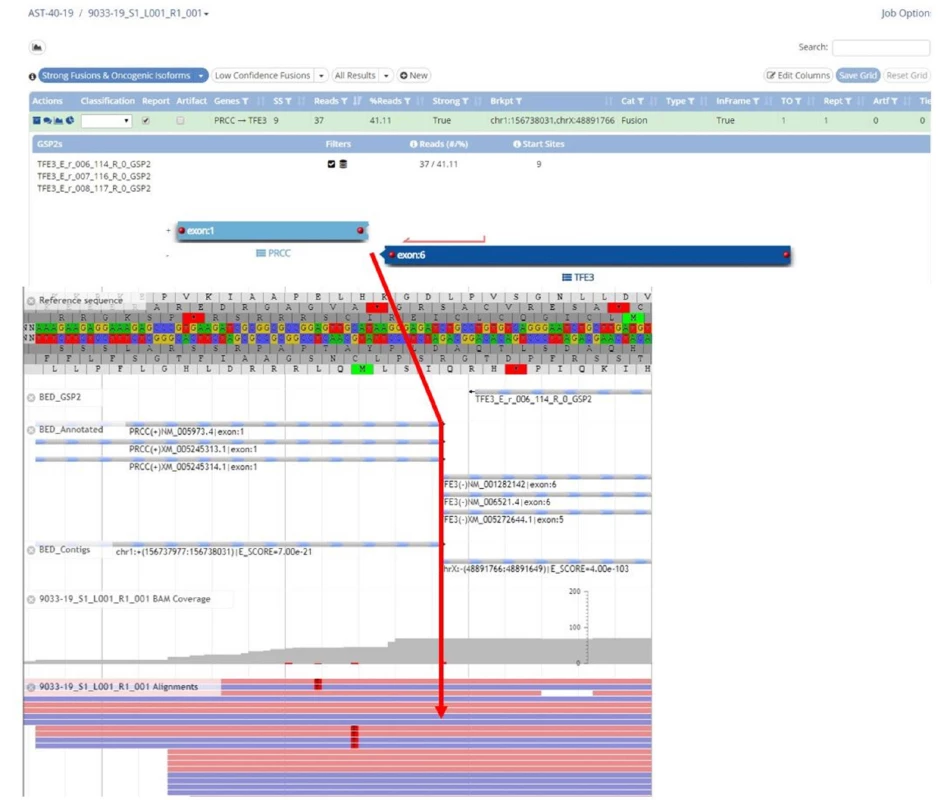
Vývoj, který se pokusíme představit, je tedy logickým důsledkem výše uvedených diagnostických možností. Pevně věříme, že jde o cestu správným směrem, na jejímž konci bude skutečná cílená léčba určitého konkrétního nádoru u našeho pacienta. Současnou snahou renální patologie je nalézt jasné znaky nádorové jednotky, které jsou specifické pro daný typ a které pokud možno reflektují její genetické vlastnosti či zužují výběr potřebných vyšetření k přesnějšímu určení. Genetické testy nelze dělat „naslepo“ a je nutné přemýšlet v rámci diferenciální diagnostiky.
V posledních několika letech bylo popsáno několik perspektivních typů nádorů, zdá se, že nalezena byla celá skupina nádorů, která má společné poškození mTOR dráhy a tvoří tak protipól nádorům, které mají poškozeny geny ovlivňující Krebsův cyklus (FH deficientní renální karcinom nebo SDH deficientní renální karcinom).
Do nádorů, které jsou zcela nové a které mají porušenou mTOR dráhu, patří nádory, jejichž jméno je tvořeno akronymem: ESC, HOT a pravděpodobně LOT (viz níže). Jména nejsou důležitá, podstatné je, že jde o morfologicky kompaktní jednotky, které jsou snadno rozpoznatelné v běžném hematoxylinovém‑eosinovém barvení bez nutnosti složitě podporovat diagnostické úsilí drahou genetikou. Samozřejmě správně určená diagnóza vyžaduje zvýšené úsilí v laboratoři, ale 90 % diagnostické práce odvede patolog s „obyčejnými sklíčky“.
ESC – eosinophilic solid and cystic renal cell carcinoma
Tento typ nádoru byl poprvé popsán v rámci dvou studií mapujících renální karcinomy u pacientů s tuberózní sklerózou (6, 7). Spektrum nádorů je poměrně pestré. Později byly tyto nádory popsány také u sporadických pacientů. Zde se vyskytují spíše u starších žen (8). Přes poměrně „divoký“ vzhled a grade 3 (ISUP/WHO) se chovají v převážné většině případů neagresivně a případy s metastatickou aktivitou jsou spíše výjimečné. Tyto nádory mají jak ve své familiární formě, tak ve formě sporadické mutace v genech TSC1, TSC2 (Obr. 4) (9). Pro klinické lékaře tedy platí, že pokud je ESC diagnostikován u jejich pacienta, měli by vždy pomyslet na možnost familiárního výskytu v rámci tuberózní sklerózy.
Obr. 4. Typický ESC (eosinofilní solidní a cystický renální karcinom)
Fig. 4. Typical ESC (eosinophilic solid and cystic renal cell carcinoma)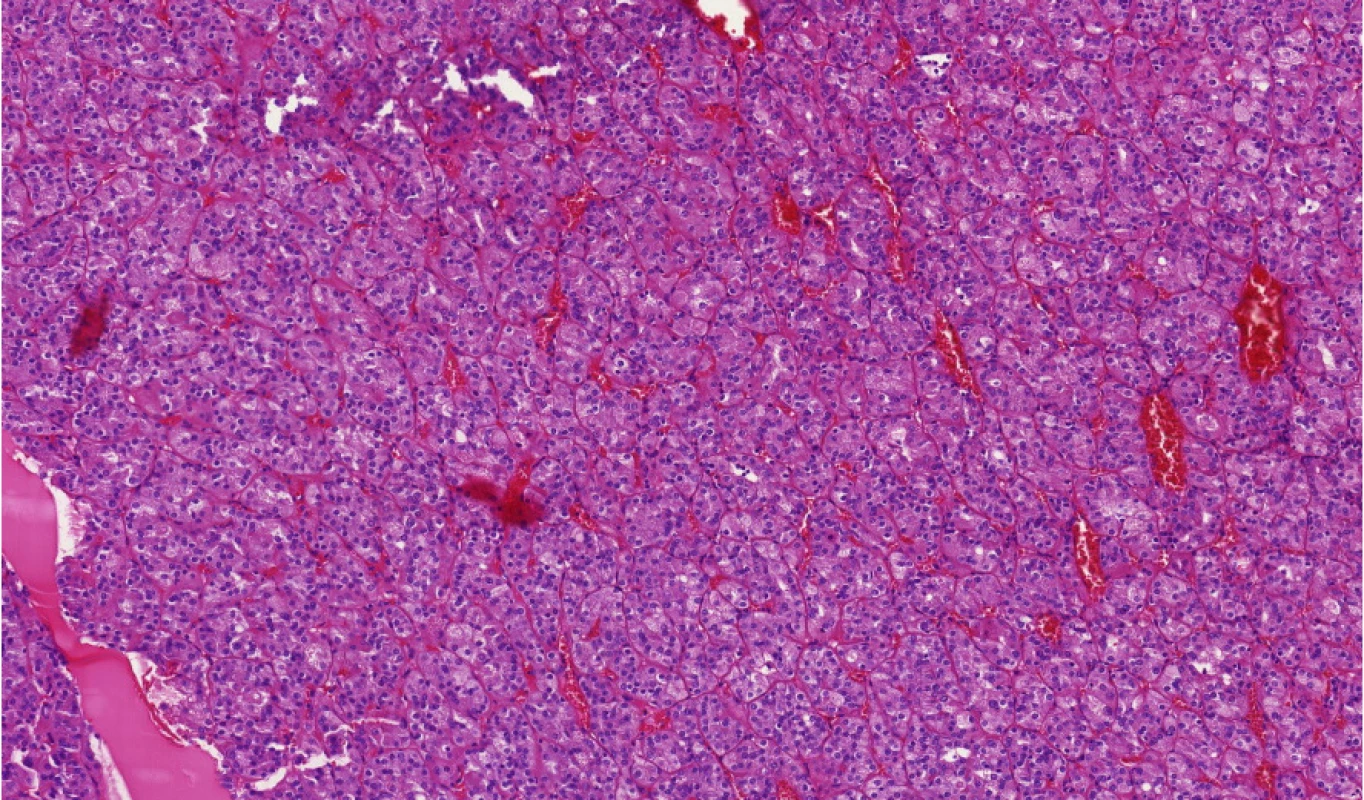
HOT – High Grade Oncocytic Tumor
Tumor byl publikován poprvé v roce 2018 (10). Jedná se o onkocytický typ nádoru, který vypadá agresivně, grade je minimálně 3 dle ISUP/WHO systému, ale zatím nebyl popsán nádor, který by metastazoval. V roce 2019 byla popsána skupina totožných nádorů, ale byla u nich objevena poškozená MTOR dráha s mutacemi v genech TSC1, TSC2, MTOR (11). Kazuistika byla publikována ve stejném roce, navíc u pacienta s tuberózní sklerózou (12). A v roce 2020, zatím ve formě abstraktu, byla představena další sestava popisující a potvrzující patologický nález v mTOR dráze, kde navíc přibyl další gen – folikulin (BHD gen) (13).
Zdá se tedy, že HOT je nádor, který má společný genetický základ, velmi uniformní morfologii a přes high‑grade vzhled jader se nechová agresivně (Obr. 5).
Obr. 5. HOT (high-grade oncocytic tumor) je nádorová léze spojená s mutacemi v MTOR, TSC1, TSC2 nebo BHD genu
Fig. 5. HOT (high-grade oncocytic tumor) is neoplastic lesion associated with mutations in MTOR, TSC1, TSC2 or BHD genes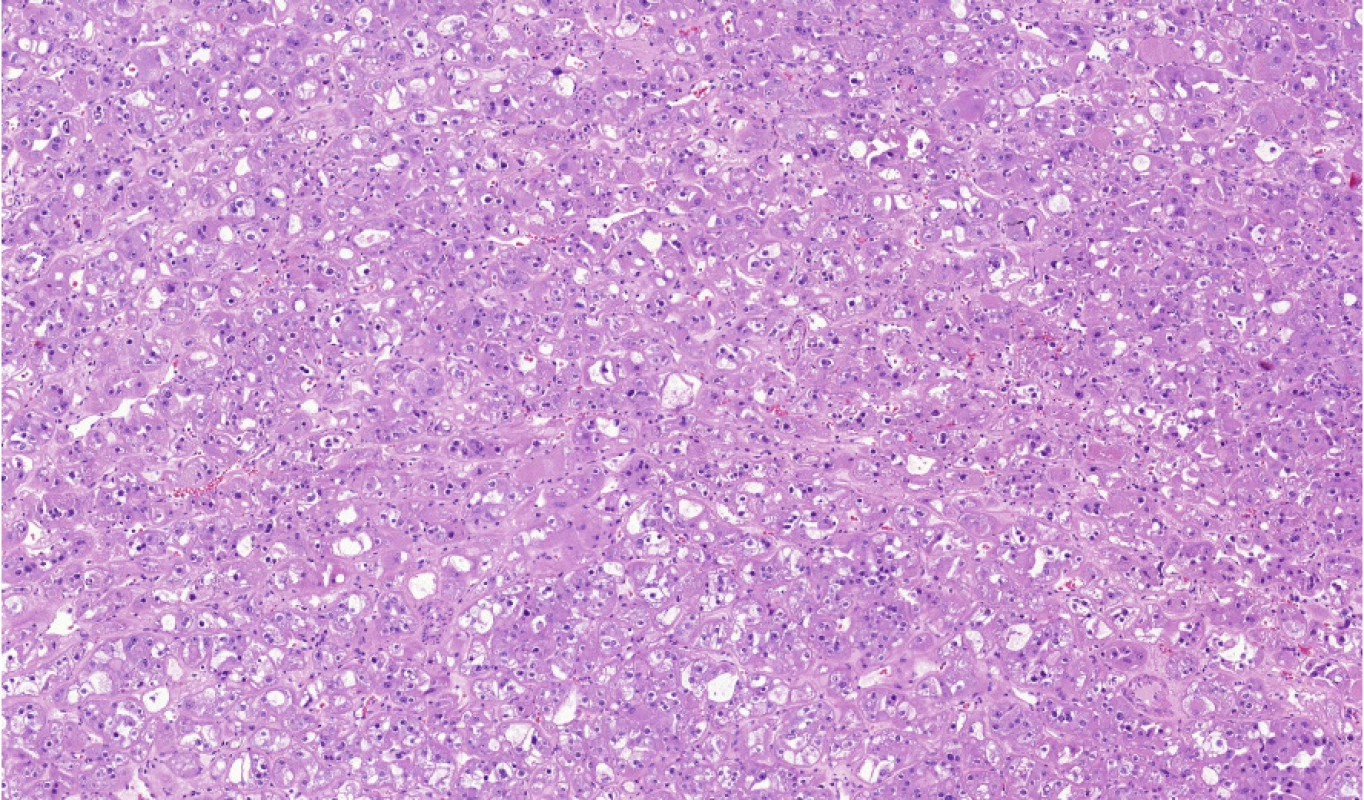
LOT – Low Grade Oncocytic Tumor
Jedná se o lézi, která není vzácná. Tyto nádory jsou v archivech schovány pod diagnózou neobvyklého chromofobocelulárního renálního karcinomu s nestandardním imunofenotypem nebo jako léze hybridní (onkocyticko‑chromofóbní), popřípadě jako neklasifikovatelné renální karcinomy. Připomínají svojí stavbou chromofobocelulární karcinom, ale imunofenotyp je zcela charakteristický (Obr. 6). Jsou difuzně CK 7 pozitivní (jako chromofobocelulární renální karcinom), ale zároveň CD117 negativní (14). Stavba je však natolik charakteristická, že diagnózu lze snadno určit již ze základního hematoxylinového‑eosinového barvení. Doposud není znám agresivní případ. Vzhledem k probíhajícím studiím lze říci, že s vysokou pravděpodobností i tyto nádory mají poškozenou mTOR dráhu.
Obr. 6. LOT (low-grade oncocytic tumor) je nádor, který vykazuje abnormality v MTOR pathway
Fig. 6. LOT (low-grade oncocytic tumor) is tumor with abnormalities in MTOR pathway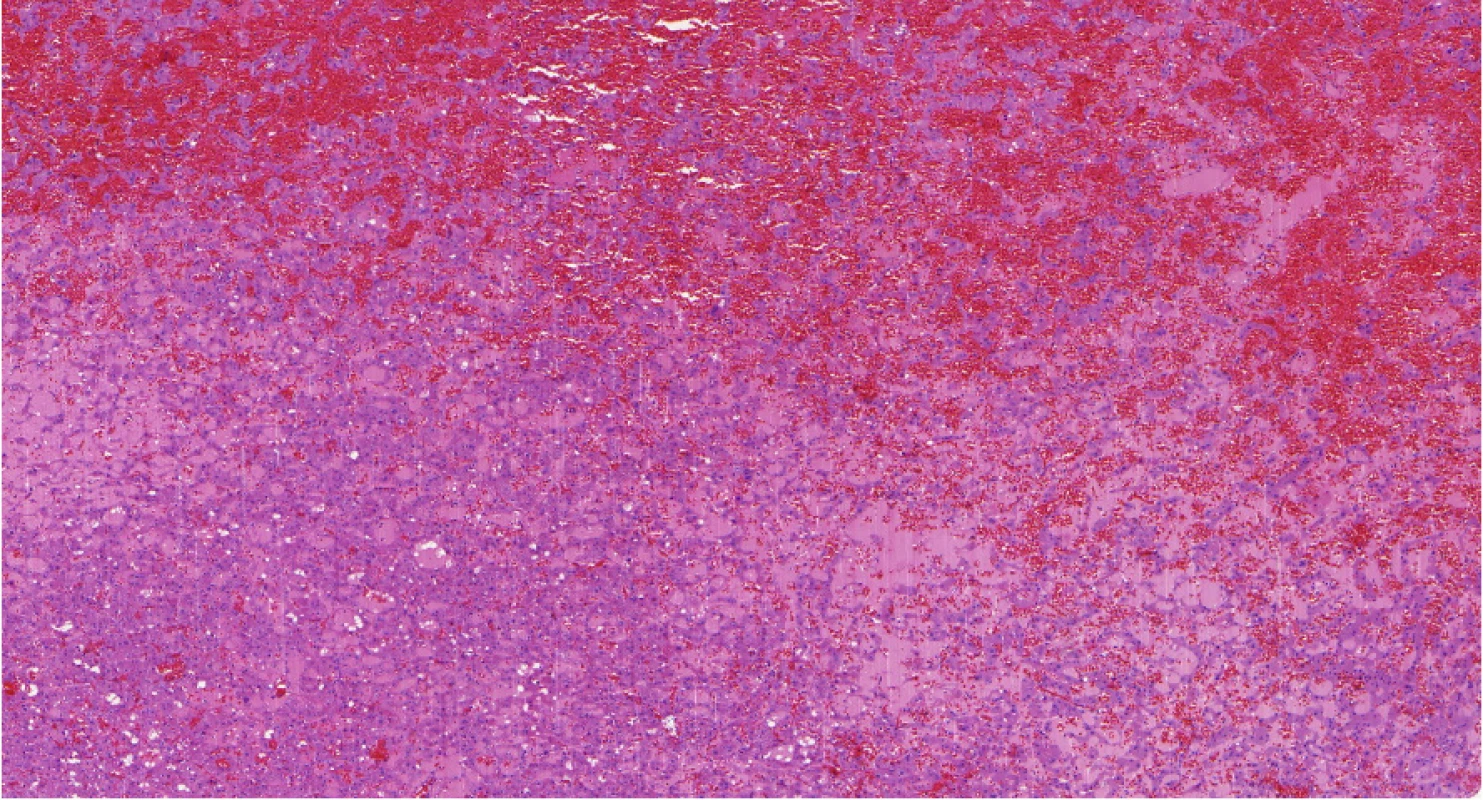
Stejný genetický základ jako předchozí nádory má s vysokou pravděpodobností tzv. renální karcinom s leiomyomatózním stromatem (15). Jde o nádor, který morfologicky lze jen nanejvýš obtížně odlišit od světlobuněčného renálního karcinomu s leiomyomatózním stromatem. Přestože jsou si nádory podobné, druhý ze jmenovaných má větší agresivní potenciál.
Molekulárně geneticky je nutné diagnostikovat další z nádorů, které jsou potencionálně perspektivní pro budoucí klasifikace (16):
Renální karcinomy s přestavbou ALK genu
Jsou nádory onkology bedlivě sledované vzhledem k možnosti využití ALK inhibitorů. Léze jsou vzácné, avšak z velké části hlavně nerozpoznávané v běžném rutinním diagnostickém provozu (17).
TFEB amplifikované renální karcinomy
Jedná se o morfologicky variabilní nádory, které se ve většině případů nepodobají již dobře známým TFEB translokačním karcinomům. Již v roce 2014 byl publikován názor, že amplifikace genu TFEB by mohla vysvětlovat agresivní chování toho nádoru (18). TFEB translokované karcinomy obvykle nevykazují agresivní klinický průběh. Velmi vzácně lze najít TFEB translokované a současně amplifikované karcinomy. A to jsou ty nádory, které se chovají maligně. Následně práce mapující právě renální karcinomy s amplifikací TFEB genu potvrdily prvotní domněnku a roli amplifikace TFEB genu v predikci biologického chování (19, 20, 21).
V současné době existují práce popisující další nádorové jednotky, které jsou velmi pravděpodobně „distinktní“ druhy nádorů („atrophic‑like“ renální tumor, „TCEB1 mutated“ renální karcinom, „NF2 mutated“ renální karcinom, atd.) (16). V současné chvíli je brzy na jejich hodnocení a bude třeba vyčkat publikací, které tyto jednotky dále definují.
Z krátkého přehledu je patrné, jak komplikovaná diagnostika renálních nádorů je. Je jasné, že za několik let budeme muset přehodnotit procentuální složení renálních nádorů. Přesnější určení podílu jednotlivých podtypů renálního karcinomu je velmi obtížné, jelikož nově popsané jednotky se nepromítnou statisticky do počtu celosvětově diagnostikovaných nádorů ledvin, respektive se promítnou s velkým zpožděním.
Je rovněž zřejmé, že dělení renálních karcinomů na světlobuněčné a na ostatní (označované zejména ve studiích s metastatickým renálním karcinomem jako „nesvětlobuněčné renální karcinomy”) (Non‑Clear Cell RCC) nemůže do budoucna obstát. Pokud je snahou nabídnout pacientovi skutečně cílenou onkologickou léčbu, bude nutné renální nádory detailně popsat a precizně klasifikovat. Cesta k personalizovanému přístupu bude ale ještě dlouhá a v nejbližších letech asi ještě není zcela reálná. Limitující je nízké zastoupení vzácnějších lézí s téměř nemožností organizovat kvalitní prospektivní randomizované studie, omezená škála léčiv pro systémovou terapii.
Došlo: 7. 7. 2020
Přijato: 18. 8. 2020
Kontaktní adresa:
prof. MUDr. Ondřej Hes, Ph.D.
Oddělení speciální diagnostiky ŠÚP
Fakultní nemocnice Plzeň
Alej Svobody 80,
304 60 Plzeň
e‑mail: hes@fnplzen.cz
Střet zájmů: Žádný střet zájmů.
Prohlášení o podpoře: Tento výstup vznikl v rámci projektu Specifického vysokoškolského výzkumu SVV 2020–2022 č. 260 539.
Hlavní stanovisko: Nové perspektivní nádory ledvin.
Major statement: New emerging renal tumors.
Zdroje
1. Hora M, Hes O. Histologie nádorů ledvin dospělých. Ces Urol 1998; 2 : 29–32.
2. Hora M, Ürge T, Kalusová K, et al. Novelizovaná klasifikace nádorů ledvin 2013 (International society of urological pathology vancouver classification of renal neoplasia). Ces Urol 2014; 18 : 9–20.
3. Moch H, Humphrey PA, Ulbright TM, VE R. WHO Classification of Tumours of the Urinary System and Organs. IARC Lyon 2016.
4. Ljungberg BAL, Bensalah K, Bex (Vice‑chair) A, et al. EAU guidelines on renal cell carcinoma. https:// uroweb.org/guideline/renal‑cell‑carcinoma/, ISBN 978-94-92671-07-3 2020.
5. Kolář J, Pitra T, Pivovarčíková K, et al. Hereditární renální nádorové syndromy. Ces Urol 2020; 24 : 26–41.
6. Guo J, Tretiakova MS, Troxell ML, et al. Tuberous sclerosis‑associated renal cell carcinoma: a clinicopathologic study of 57 separate carcinomas in 18 patients. Am J Surg Path 2014; 38; 1457–1467.
7. Yang P, Cornejo KM, Sadow PM, et al. Renal cell carcinoma in tuberous sclerosis complex. Am J Surg Path 2014; 38 : 895–909.
8. Trpkov K, Hes O, Bonert M, et al. Eosinophilic, solid, and cystic renal cell carcinoma: clinicopathologic study of 16 unique, sporadic neoplasms occurring in women. Am J Surg Path 2016; 40 : 60–71.
9. Palsgrove DN, Li Y, Pratilas CA, et al. Eosinophilic solid and cystic (ESC) renal cell carcinomas harbor TSC mutations: molecular analysis supports an expanding clinicopathologic spectrum. Am J Surg Path 2018; 42 : 1166–1181.
10. Hes H, Trpkov K, Martinek P, et al. „High‑grade oncocytic renal tumor“: morphologic, immunohistochemical, and molecular genetic study of 14 cases. Virchows Arch.: an international journal of pathology 2018; 473 : 725–738.
11. Chen YB, Mirsadraei L, Jayakumaran G, et al. Somatic mutations of TSC2 or mtor characterize a morphologically distinct subset of sporadic renal cell carcinoma with eosinophilic and vacuolated cytoplasm. Am J Surg Path 2019; 43 : 121–131.
12. Trpkov K, Bonert M, Gao Y, et al. High‑grade oncocytic tumour (HOT) of kidney in a patient with tuberous sclerosis complex. Histopathology 2019; 75 : 440–442.
13. Farcas M, Gatalica Z, Swensen J, et al. High‑grade oncocytic tumor (HOT) of kidney is characterized by frequent TSC1, TSC2 and mtor mutations – a further characterization of an emerging entity. Lab Invest 2020; 10 : 885.
14. Trpkov K, Williamson SR, Gao Y, et al. Low‑grade oncocytic tumour of kidney (cd117-negative, cytokeratin 7-positive): A distinct entity? Histopathology 2019; 75 : 174–184.
15. Shah RB, Stohr BA, Tu ZJ, et al. „Renal cell carcinoma with leiomyomatous stroma“ harbor somatic mutations of TSC1, TSC2, MTOR, and/or ELOC (TCEB1): clinicopathologic and molecular characterization of 18 sporadic tumors supports a distinct entity. The American Journal of Surgical Pathology 2020; 44(5): 571–581.
16. Trpkov K, Hes O. New and emerging renal entities: a perspective post‑who 2016 classification. Histopathology 2019; 74 : 31–59.
17. Kuroda N, Trpkov K, Gao Y, et al. Alk rearranged renal cell carcinoma (ALK-RCC): a multi‑institutional study of twelve cases with identification of novel partner genes clip1, kif5b and kiaa1217. Mod Pathol: an official journal of the United States and Canadian Academy of Pathology, Inc 2020. Online ahead of print.
18. Peckova K, Vanecek T, Martinek P, et al. Aggressive and nonaggressive translocation t(6; 11) renal cell carcino ‑ ma: Comparative study of 6 cases and review of the literature. Annals of Diagnostic Pathology 2014; 18 : 351–357.
19. Argani P, Reuter VE, Zhang L, et al. Tfeb‑amplified renal cell carcinomas: an aggressive molecular subset demonstrating variable melanocytic marker expression and morphologic heterogeneity. The American Journal of Surgical Pathology 2016; 40 : 1484–1495.
20. Williamson SR, Grignon DJ, Cheng L, et al. Renal cell carcinoma with chromosome 6p amplification including the tfeb gene: a novel mechanism of tumor pathogenesis? The American Journal of Surgical Pathology 2017; 41 : 287–298.
21. Skala SL, Xiao H, Udager AM, et al. Detection of 6 tfeb‑amplified renal cell carcinomas and 25 renal cell carcinomas with mitf translocations: Systematic morphologic analysis of 85 cases evaluated by clinical tfe3 and tfeb fish assays. Modern Pathology: an official journal of the United States and Canadian Academy of Pathology, Inc 2018; 31 : 179–197.
Štítky
Dětská urologie Nefrologie Urologie
Článek Editorial
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2020 Číslo 3- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Editorial
- Role urologa v léčbě komplikací roztroušené sklerózy
- Nové perspektivní jednotky: nádory ledvin popsané v době po WHO histopatologické klasifikaci z roku 2016
- Minimálně invazivní operační metody léčby benigní hyperplazie prostaty jako alternativa klasických desobstrukčních výkonů
- Prevence recidivujících cystitid pomocí roztoku hyaluronátu sodného Flaveran®
- Metastáza karcinomu prostaty do varlete
- Parciální amputace penisu jako léčba verukózního karcinomu
- Arterio‑ureterální píštěl – vzácná příčina masivní hematurie?
- Šetření hrdla močového měchýře při RARP
- as. MUDr. Jaroslav Droppa, CSc. (*1938 – †2020)
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Minimálně invazivní operační metody léčby benigní hyperplazie prostaty jako alternativa klasických desobstrukčních výkonů
- Prevence recidivujících cystitid pomocí roztoku hyaluronátu sodného Flaveran®
- Metastáza karcinomu prostaty do varlete
- Šetření hrdla močového měchýře při RARP
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



