-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Heydeho syndróm
Heyde’s syndrome
Gastrointestinal bleeding is a severe and potentially life-threatening condition associated with significant morbidity and mortality. In clinical practice, its differential diagnosis can sometimes be complicated, especially when bleeding is recurrent. One of the lesser-known reasons for recurrent gastrointestinal bleeding is the so called Heyde’s syndrome. It is a combination of bleeding from gastrointestinal angiodysplasia, aortic stenosis and acquired type 2A von Willebrand syndrome. In the submitted article, authors present a summary of the current knowledge on etiology and pathogenesis of the disease. The degenerative aortic valve disease, typically present in elderly patients, causes changes in the blood flow through stenotic opening. This results in elongation of otherwise globular von Willebrand’s factor (vWF) molecules, resulting in its reduced efficacy in hemostasis. According to new scientific discoveries, vWF also plays a role in angiogenesis and therefore in gastrointestinal angiodysplasia formation. This combination of factors results in recurrent bleeding typical for Heyde’s syndrome. Surgical aortic valve replacement is the gold standard treatment. A vicious circle can often be created between the gastroenterologist, who refers the patient for cardiac surgery procedures, and the cardiothoracic surgeon, who is waiting for a time when the patient will stop bleeding. A close communication and cooperation between the gastroenterologist, hematologist and cardiothoracic surgeon is required to properly manage the patient. The presence of angiodysplasia in an elderly patient, associated with recurrent gastrointestinal bleeding, should lead clinicians to look for aortic stenosis and consider Heyde’s syndrome as a potential diagnosis. Its interesting etiopathogenesis and rare occurrence led the authors to further investigate this topic. They also present a short summary of their own group of patients.
Keywords:
Heyde’s syndrome – aortic stenosis – angiodysplasia – von Willebrand’s syndrome
Autoři: Michalová R. 1; Šimonová R. 2; Michalová R. jr. 3; P. Bánovčin Jr. 1
; Hyrdel R. 1
Působiště autorů: Interná klinika gastroenterologická JLF UK a UN Martin, 2 Klinika hematológie a transfuziológie JLF UK a UN Martin, 3 I. interná klinika JLF UK a UN Martin 1
Vyšlo v časopise: Gastroent Hepatol 2021; 75(4): 298-303
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
doi: https://doi.org/10.48095/ccgh2021298Souhrn
Krvácanie do tráviaceho traktu je závažný, potenciálne život ohrozujúci stav spojený so signifikantnou morbiditou a mortalitou. Jeho diferenciálna diagnostika v klinickej praxi môže byť náročná, predovšetkým ak je krvácanie recidivujúce. Jedným z menej známych dôvodov recidivujúceho krvácania do gastrointestinálneho traktu je takzvaný Heydeho syndróm. Jedná sa o kombináciu krvácania z angiodysplázií vznikajúcich v gastrointestinálnom trakte, aortálnej stenózy a získaného von Willebrandovho syndrómu typu 2A. V predloženom článku sú uvedené aktuálne poznatky o etiológii a patogenéze tohto ochorenia. Aortálna stenóza ako dôsledok degeneratívneho procesu aortálnej chlopne je typická svojím výskytom vo vyššom veku. Poruchou prúdenia krvi cez zúžené miesto dochádza k elongácii inak globulárnych molekúl von Willebrandovho faktora (vWF), následkom čoho sa znižuje jeho efektivita v rámci hemostázy. Podľa nových poznatkov vWF zároveň zohráva úlohu aj v angiogenéze a podieľa sa na vzniku angiodysplázií v tráviacom trakte. Kombinácia uvedených faktorov má za následok recidivujúce krvácanie typicky sprevádzajúce Heydeho syndróm. Zlatým štandardom jeho liečby je výmena aortálnej chlopne. Často však môže dôjsť k vzniku bludného kruhu medzi gastroenterológom, ktorý indikuje pacienta na kardiochirurgický zákrok, a kardiochirurgom, ktorý zákrok odkladá na čas, keď pacient krvácať nebude. Úzka komunikácia a spolupráca gastroenterológa, hematológa a kardiochirurga zohráva kľúčovú úlohu v správnom manažmente pacientov. Prítomnosť angiodysplázií a s nimi spojeného recidivujúceho krvácania u pacienta vo vyššom veku by mala byť výstrahou, že môže byť prítomné aj postihnutie aortálnej chlopne a do diferenciálne-diagnostických možností by mal byť zahrnutý aj Heydeho syndróm. Zaujímavá etiopatogenéza a predpokladaný zriedkavý výskyt ochorenia viedli autorov k bližšej analýze problematiky. V predloženej práci aj v krátkosti prezentujú vlastný súbor pacientov.
Klíčová slova:
Heydeho syndróm – aortálna stenóza – angiodysplázia – von Willebrandov syndróm
Úvod
Krvácanie do gastrointestinálneho traktu (GIT) je závažný, potenciálne život ohrozujúci stav a jeho diferenciálna diagnostika je často náročná. Okrem bežných dôvodov je možné sa v klinickej praxi stretnúť aj s problematickým objasňovaním jeho príčiny, hlavne ak pacient krváca opakovane a dôvod na recidívu krvácania nie je zjavný. Na pracovisku autorov sa opakovane riešili pacienti, u ktorých sa ako príčina stavu diagnostikoval Heydeho syndróm. Predpokladaný zriedkavý výskyt ochorenia a jeho zaujímavá etiopatogenéza viedli autorov k bližšej analýze problematiky. Ochorenie patrí do kategórie multidisciplinárnych, u ktorých je medziodborová komunikácia gastroenterológ–kardiológ–hematológ nevyhnutná.
Z histórie
Na možnú spojitosť medzi krvácaním do tráviaceho traktu a aortálnou stenózou po prvý krát upozornil washingtonský internista Edward C. Heyde v krátkom liste editorovi časopisu The New England Journal of Medicine v roku 1958. V liste opísal 10 pacientov s aortálnou stenózou a krvácaním do tráviaceho traktu z nevysvetlenej príčiny a hľadal informácie o možných súvislostiach [1]. Počas nasledujúcich rokov boli ako zdroj krvácania identifikované angiodysplázie tráviaceho traktu. Greenstein et al v roku 1986 dokumentovali kauzálnu súvislosť na súbore pacientov v 10-ročnom sledovaní [2]. Zaujímavou bola teória o mechanizme vzniku angiektázií. Za ich príčinu považovali abnormálnu periférnu pulzovú vlnu vznikajúcu pri aortálnej stenóze.
Úloha získanej koagulopatie v patogenéze Heydeho syndrómu, a síce závislosť na multiméroch von Willebrandovho faktora (vWF) s vysokou molekulovou hmotnosťou bola objasnená až v roku 1992 [3].
V súčasnosti je Heydeho syndróm definovaný ako spoločný výskyt dvoch procesov degeneratívnych, a to aortálnej stenózy a intestinálnych angiodysplázií, tretím znakom je prítomnosť sekundárneho von Willebrandovho sydrómu typu 2A [4].
Aortálna stenóza
Aortálna stenóza (AoS) ako dôsledok degeneratívneho procesu aortálnej chlopne je najčastejšou valvulárnou chybou u pacientov v pokročilom veku a patrí na popredné miesta v morbidite a mortalite v tejto vekovej kategórii. Jej prevalencia s vekom stúpa a vo veku nad 65 rokov dosahuje 2–7 %. Rozvoj jej klinických prejavov je spojený s horšou prognózou a je indikáciou na chirurgickú liečbu. Klinické prejavy sú tiež spojené s vyšším rizikom krvácania do GITu [5]. Naopak tiež platí, že ak má pacient prejavy krvácania do tráviaceho traktu, je pravdepodobnosť súčasnej prítomnosti aortálnej stenózy 30–40 % [6].
Zlatým štandardom v diagnostike AoS a určení závažnosti postihnutia je v súčasnosti echokardiografia.
Angiodysplázia
Angiodysplázie sú ďalším degeneratívnym procesom, vyskytujúcim sa pri Heydeho syndróme. Hlavne v staršom veku sú zriedkavou, ale dôležitou príčinou zjavného aj okultného krvácania do GITu [7]. U pacientov vo veku nad 60 rokov sú v GITe najčastejšou vaskulárnou abnormalitou. Postihnuté bývajú arterioly, kapiláry a venuly. V tunica mucosa a submucosa GITu dochádza k ich dilatácii a zmenšeniu hrúbky cievnej steny [8].
Môžu sa vyskytovať v celom priebehu GIT, predominantne však býva postihnuté colon ascendes a cékum [5]. Táto lokalizácia súvisí s intermitentným vysokým napätím črevnej steny. Cékum a colon ascendens majú väčší priemer a menšiu hrúbku steny ako ľavá časť hrubého čreva, čo prispieva ku intermitentnej kompresii submukóznych venúl. Je to následok zvýšenej kontraktility na úrovni muscularis propria, artérie ostávajú neovplyvnené. Dochádza ku kongescii kapilár a zlyhaniu prekapilárnych sfinkterov. Vzniknutá hypoxia spúšťa neovaskularizáciu. Aktívnu úlohu v tomto procese zohráva endotelový rastový faktor (EGF), čím predstavuje potenciálny cieľ terapeutickej intervencie. Z uvedeného vyplýva, že akýkoľvek proces, ktorý generuje hypoxiu, môže provokovať vznik angiodysplázií [7,9].
V endoskopickom obraze (schéma 1) sú na slizniciach viditeľné ako malé, ploché, čerešňovo sfarbené zmeny alebo ektatické krvné cievy. U pacientov, hospitalizovaných pre krvácanie do tráviaceho traktu, sú jeho príčinou v 1–6 % prípadov [10]. Kolonoskopicky sú tiež detekovateľné u cca 3 % asymptomatických pacientov vo veku nad 65 rokov a sú bežnou príčinou opakovaného krvácania a perzistencie anémie v pokročilom veku [5].
Schéma 1. Vývoj angiodysplázií GITu.
A: norma. B: intermitentná obštrukcia submukóznych venúl ako dôsledok zvýšeného napätia muscularis propria.
C: kongescia kapilár a zlyhanie prekapilárnych sfinkterov vedie k angiogenéze a následne krvácaniu [7].
Scheme 1. Development of angiodysplasia in gastrointestinal tract.
A: normal finding. B: intermittent obstruction of submucous venules as a result of increased tension in muscularis propria.
C: capillary congestion and failure of precapillary sphincters resulting in angiogenesis and bleeding [7].![Schéma 1. Vývoj angiodysplázií GITu.<br>
A: norma. B: intermitentná obštrukcia submukóznych venúl ako dôsledok zvýšeného napätia muscularis propria.<br>
C: kongescia kapilár a zlyhanie prekapilárnych sfinkterov vedie k angiogenéze a následne krvácaniu [7].<br>
Scheme 1. Development of angiodysplasia in gastrointestinal tract.<br>
A: normal finding. B: intermittent obstruction of submucous venules as a result of increased tension in muscularis propria.<br>
C: capillary congestion and failure of precapillary sphincters resulting in angiogenesis and bleeding [7].](https://pl-master.mdcdn.cz/media/image_pdf/975597b9c2a2f13c6afb9b99e8911a4e.png?version=1630159453)
Získaná porucha koagulácie – vWS 2A
Článkom, spájajúcim aortálnu stenózu a krvácanie z angiodysplázií, je narušenie fungovania von Willebrandovho faktora (vWF). Je to veľký multimerický plazmatický proteín, syntetizovaný endotelom a megakaryocytmi. V krvi cirkuluje vo forme multimérov s molekulovou hmotnosťou 1 000–20 000 kDa a vytvára komplex vWF/FVIII. Vysokomolekulové multiméry (HMW) vWF majú dôležité postavenie v primárnej hemostáze, kde sprostredkovávajú adhéziu trombocytov na subendotelový matrix cievnej steny [11]. Za normálnych okolností sú HMW vWF štiepené metaloproteázou ADAMTS13 počas formovania trombu [12]. Deficit alebo dysfunkcia vWF zapríčiňuje von Willebrandovu chorobu (vWD), relatívne bežnú vrodenú hemoragickú diatézu. Získané kvalitatívne alebo kvantitatívne abnormality vWF sa označujú ako získaný von Willebrandov syndróm (vWS). Vyskytuje sa zriedka, zvyčajne v asociácii s rôznymi ochoreniami. Jedným z nich je aortálna stenóza (tab. 1) [5,12].
Tab. 1. Príčiny sekundárneho vWS [5,12].
Tab. 1. Causes of secondary vWS [5,12].![Príčiny sekundárneho
vWS [5,12].<br>
Tab. 1. Causes of secondary
vWS [5,12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f0b12d27715ff51542a20105d406d49b.png)
Von Willebrandov faktor a angiogenéza
Nedávne experimentálne štúdie odhalili, že vWF má okrem účasti v koagulácii aj ďalšiu biologickú funkciu, a to moduláciu angiogenézy. Táto jeho úloha bola postulovaná na klinických pozorovaniach, že kvalitatívny alebo kvantitatívny defekt vWF je často spojený s neoangiogenézou, hlavne v gastrointestinálnom trakte. Experimentálnym základom pre toto pozorovanie bolo zistenie, že nedostatok vWF v endoteliálnych bunkách angiogenézu spúšťa, čo sa prejavilo badateľným nárastom proliferácie na bunkovej kultúre týchto buniek a výskytom neovaskularizácie u vWF deficientných myší. Molekulárnym základom pre tento efekt je vWF dependentná negatívna modulácia angiogenézy, ktorá funguje cez viacero intra - a extracelulárnych mechanizmov, vrátane endoteliálneho rastového faktora (EGF) [13,14].
Patogenéza Heydeho syndrómu
Aortálna stenóza predstavuje prekážku v krvnom prúde. Krvný prúd v mieste stenózy má vysokú rýchlosť a tým prítomné vysoké šmykové napätie. Toto umožňuje uplatnenie tzv. strihových síl. Ich pôsobením sa koagulačne funkčné globulárne formované multiméry vWF elongujú na lineárnu formu, čím sú vo zvýšenej miere exponované proteolytickému enzýmu ADAMTS13. Výsledkom zvýšenej proteolýzy je prítomnosť menších a menej funkčných fragmentov vWF a deplécia HMW, ktorý je hemostaticky efektívnejší [11,12]. Menšie fragmenty vWF nie sú schopné kooperácie s trombocytmi v procese primárnej hemostázy, a pri prítomnosti angiodysplázií je klinickým dôsledkom tohto porušeného procesu krvácanie (schéma 2).
Schéma 2. Vznik Heydeho syndrómu (volne podľa https://en.wikipedia.org/ Wiki/Heyde%27/16.6.2021). Scheme 2. Development of Heyde syndrome (adapted from https://en.wikipedia. org /Wiki/Heyde%27/ 16.6.2021). 
Vzhľadom na podstatnú úlohu, ktorú v patogenéze ochorenia hrá porucha koagulácie, je nevyhnutné realizovať hemostazeologické vyšetrenie. Na poruchu koagulácie môže upozorniť už vyšetrenie bežných základných koagulačných parametrov – aPTT, čas krvácania podľa Duka. Bližšia špecifikácia poruchy vyžaduje špecializované vyšetrenia – napr. test funkcie trombocytov – PFA-100, resp. elektroforézu multimérov vWF na agarózovom géle (obr. 1) [15].
Obr. 1. Stanovenie multimérov vWF na agarózovom géle – materiál autorov. Pravý prúžok – zdravá kontrola.
Fig. 1. Von Willenbrand factor multimers determination on agarose gel – authors archive. Right stripe – healthy control group.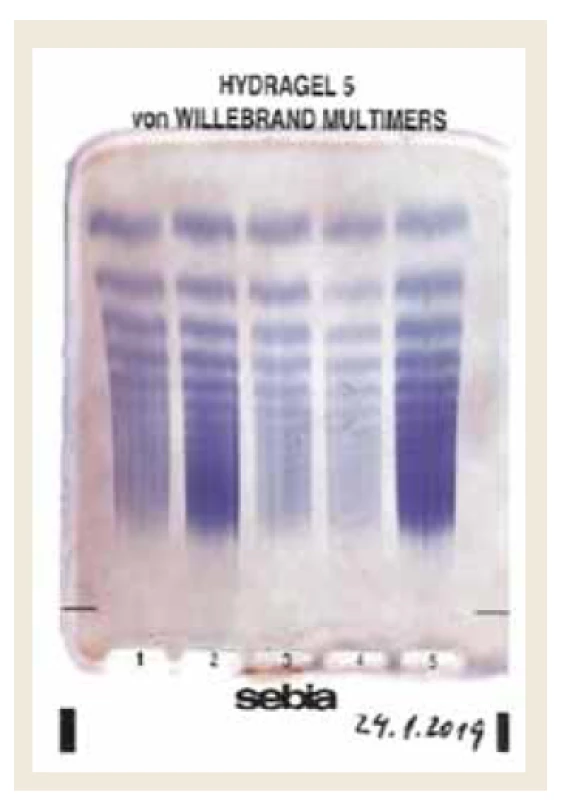
Klinický obraz a liečba ochorenia
Krvácanie do GITu
Pacient s Heydeho syndrómom najčastejšie prichádza k lekárovi pre anémiu nejasnej príčiny alebo krvácanie do tráviaceho traktu. Krvácanie je charakterizované recidívami, ktoré často bývajú hemodynamicky významné.
Typickým endoskopickým nálezom pri HS sú angiodysplázie, rozmiestnené kdekoľvek v GIT. Pokiaľ ale aktívne nekrvácajú, môžu byť pri endoskopii prehliadnuté [9]. V prípade ich krvácania je možné endoskopické ošetrenie – najčastejšie APC (argón plazma koagulácia). Ak pacient opakovane anemizuje a objasnenie zdroja nie je v dosahu endoskopických vyšetrení, je indikovaná realizácia kapsulovej endoskopie. V prípade ťažkého, život ohrozujúceho krvácania, môže byť pri jeho lokalizácii nápomocná realizácia CT angiografie s následnou angiografiou a embolizáciou hlavnej tepny zásobujúcej postihnutú oblasť. Na lokalizáciu zdroja krvácania sa dá použiť aj scintigrafia značenými erytrocytmi. Samozrejmosťou by mala byť realizácia diferenciálne diagnostických vyšetrení na odhalenie jeho iného zdroja. Každý klinický gastroenterológ by mal pacienta s recidivujúcim krvácaním z angiodysplázií konzultovať s kardiológom a hemostazeológom aj preto, že závažnosť a frekvencia krvácavých epizód narastá s vekom a stupňom aortálnej stenózy [16]. Krajným riešením život ohrozujúceho krvácania je resekčný výkon s odstránením krvácajúcej časti čreva. Všetky uvedené terapeutické postupy sú pri HS rizikové pre vysokú pravdepodobnosť objavenia sa krvácania v inej lokalite [5].
Farmakoterapia
Okrem všeobecne používanej konzervatívnej liečby krvácania do tráviaceho traktu sa za okolností, daných prítomnou koagulopatiou, dá uvažovať aj o použití iných postupov.
Liečebné modality, využívané pri liečbe vWD (napr. desmopresin, octreotid alebo suplementácia faktora VIII alebo vWF) sú zvyčajne pri získanom vWS insuficientné alebo neefektívne. O podaní faktora VIII/koncentrátu vWF tesne pred chirurgickým zákrokom môžeme uvažovať u pacientov, ktorí majú laboratórne dokázané zlepšenie aktivity F VIII po podaní testačnej dávky [13].
Pokusy ovplyvniť angiogenézu boli tiež robené s látkami s antiangiogenéznymi vlastnosťami, ako talidomid, ktorý účinku prostredníctvom EGF, alebo vysokými dávkami atorvastatínu (80 mg/deň). V niekoľkých prípadoch bol zaznamenaný pozitívny vplyv na frekvenciu krvácania, ale na potvrdenie účinnosti tejto liečby sú nutné väčšie klinické štúdie [13,17]. V literatúre sú zmienky aj o použití hormonálnej liečby (estrogény, progesterón), ale mechanizmus ich účinku objasnený nebol [10,11].
Medikamentózne a endoskopické intervencie by mali byť použité ako premosťujúca terapia pred náhradou aortálnej chlopne.
Náhrada aortálnej chlopne
Náhrada aortálnej chlopne sa považuje za jedinú kauzálnu liečbu HS. Niektorí autori považujú rýchlu konzultáciu kardiochirurga za dôležitejšiu ako vykonanie endoskopickej hemostázy [16].
Pri indikácii pacienta na kardiochirurgický zákrok sa do popredia dostáva otázka pokračujúcej antikoagulačnej, resp. antiagregačnej liečby po výmene chlopne pri prítomnosti angiodysplázií v tráviacom trakte. Dôležité je poznať patogenézu ochorenia a v kooperácii s kardiológom, resp. kardiochirur - gom správne navrhnúť terapeutický postup.
Zhodnotenie rizika operácie je nevyhnutné, avšak aj pokročilá stenóza ťažkého stupňa môže byť vyriešená menej rizikovým zákrokom – a to transkatétrovou implantáciou aortálnej chlopne (TAVI) [5].
Rekurentné ťažké gastrointestinálne krvácanie, obzvlášť keď medikamentózne a endoskopické intervencie zlyhajú, potvrdzujú nutnosť včasnej realizácie kardiochirurgického zákroku.
Podstatným argumentom pre uvedený terapeutický postup je skutočnosť, že úprava koagulačných parametrov je zistiteľná už 24 hodín po implantácii chlopňovej náhrady. Až 95 % pacientov po náhrade chlopne nemá žiadne prejavy krvácania [12]. Následne realizované kapsulové endoskopie potvrdili perzistenciu angiodysplázií, ktoré sú pravdepodobne ireverzibilné, avšak bez prejavov krvácania [6,10,16].
Vlastné skúsenosti
Záujem autorov o problematiku vyplynul z nutnosti opakovaného riešenia pacientov s recidivujúcim krvácaním do tráviaceho traktu, ktorého príčinou bol HS. V priebehu 3 rokov na pracovisku bolo ošetrených 9 pacientov (5 mužov a 4 ženy) s priemerným vekom 72 (62–83) rokov. Všetci boli odoslaní zo spádových nemocníc za účelom vykonania endoskopických výkonov, vrátane enteroskopie, pre recidivujúce krvácanie do GITu, 3 z nich v čase prijatia s aktívnym krvácaním. Len 1 pacient prišiel na hospitalizáciu s vysloveným podozrením, že sa môže jednať o HS. Všetci pacienti mali už diagnostikovanú chlopňovú chybu – 8 pacientov malo aortálnu stenózu stredne ťažkého až ťažkého stupňa (AVA 0,64–1,4 cm2), 1 pacient mal kombinovanú mitrálnu chybu. Anamnéza recidivujúceho krvácania pred hospitalizáciou na pracovisku autorov trvala priemerne 15 (1–29) mesiacov.
Krvácanie, resp. angiodysplázie boli lokalizované 3× v duodene a proximálnom jejune, v ostatných prípadoch to bolo kolon-ascendentná časť. U všetkých pacientov bolo realizované APC ošetrenie.
Výsledky vyšetrení koagulačných parametrov boli často ovplyvnené nutnosťou podania krvnej plazmy, a tým nedodržania štandardných podmienok odberu.
Následne boli pacienti konzultovaní s kardiológom ohľadom indikácie výmeny chlopne.
Jedna pacientka (69-ročná, ťažko polymorbídna) mala priebeh ochorenia ilustrujúci jeho možné závažné mutilujúce dôsledky. Dvakrát sa musela podrobiť resekčnej operácii pre život ohrozujúce krvácanie – 1× parciálnej resekcii ilea, následne totálnej kolektómii s terminálnou ileostómiou. Vzhľadom na vysoké riziko pre ďalšie pridružené ochorenia (renálna insuficintia, st. po dezobliterácii a. carotis, infarkte myokardu 2. typu pri ťažkej anémii, hypothyreóze, cievnej mozgovej príhode…) sa o možnej výmene chlopne ani neuvažovalo. Na pracovisko autorov bola preložená s masívnym pokračujúcim krvácaním z terminálnej ileostómie, ktoré bolo zvládané opakovanými (6×) APC ošetreniami počas enteroskopie. Následne bola indikovaná na výmenu aortálnej chlopne, ktorú úspešne absolvovala metódou TAVI aj s efektom na ústup krvácania.
Diskusia
Aj keď môžeme dnes etiológiu a patogenézu HS považovať za objasnenú, nie je vylúčené, že na vývoji ochorenia sa podieľajú aj iné, dnes neznáme faktory. Postihuje pacientov vo vyššom veku, polymorbídnych, u ktorých je často prítomných aj niekoľko iných patologických procesov, spôsobujúcich sekundárny vWS [9]. Dá sa predpokladať, že aktuálne je ochorenie do veľkej miery poddiagnostikované a jeho skutočný výskyt oveľa častejší. Svedčia o tom aj nami pozorované údaje, kde len u jediného pacienta bolo uvažované o kauzálnej súvislosti krvácania a aortálnej stenózy.
V situácii, keď je stanovená diagnóza HS a na prvé poradie v manažmente sa dostáva výmena aortálnej chlopne, sa často pacient dostáva do bludného kruhu. Gastroenterológ indikuje výmenu chlopne, aby pacient prestal krvácať do GITu, na druhej strane kardiológ, resp. kardiochirurg odkladá zákrok až na obdobie, keď pacient do GITu krvácať nebude. Za daných okolností je úzka medziodborová komunikácia a spolupráca nevyhnutnosťou.
U pacientov s HS, ktorí sa podrobili náhrade aortálnej chlopne, je prognóza veľmi dobrá [18]. Významne uvedenú skutočnosť dokumentuje súbor 57 pacientov s HS, sledovaných 15 rokov po výmene chlopne. Väčšina (79 %) z nich nemalo rekurenciu krvácania [19].
Nevyriešenou otázkou ostáva manažment pacientov, ktorí sa z akýchkoľvek dôvodov výmene chlopne podrobiť nemôžu. Uvedená skutočnosť značne ich prognózu zhoršuje. V takej situácii sú nevyhnutné opakované ošetrovania krvácajúcich lézií, náhrada zložiek, absentujúcich v reťazci koagulácie, nádeje sa vkladajú aj do liečby ovplyvňujúcej angiogenézu, napr. vplyvom cez EGF, alebo cez iné mechanizmy.
Záver
Manažment pacienta s HS vyžaduje multidisciplinárny prístup a širokú paletu diagnostických a liečebných postupov, zahàňajúcich medikamentóznu liečbu, endoskopické intervencie, chirurgickú liečbu abdominálnych komplikácií, intravaskulárne intervencie a kardiochirurgický zákrok v podobe náhrady aortálnej chlopne.
Prítomnosť angiodysplázií a krvácania z angiodysplázií v gastrointestinálnom trakte u pacienta vo vyššom veku by mala byť výstrahou, že môže byť prítomné aj postihnutie aortálnej chlopne a do diferenciálne-diagnostických možností by mal byť zahrnutý aj Heydeho syndróm.
Doručené/Submitted: 6. 7. 2021
Prijaté/Accepted: 12. 7. 2021
MUDr. Renáta Michalová, PhD.
Interná klinika gastroenterologická
JLF UK a UN Martin
Kollárova 2
036 59 Martin
Konflikt záujmov: Autori deklarujú, že text článku zodpovedá etickým štandardom, bola dodržaná anonymita pacientov, a vyhlasujú, že v súvislosti s predmetom článku nemajú finančné, poradenské ani iné komerčné záujmy.
Publikačná etika: Príspevok nebol doteraz publikovaný ani nie je v súčasnosti zaslaný do iného časopisu na posúdenie. Autori súhlasia s uverejnením svojho mena a e-mailového kontaktu v publikovanom texte.
Dedikácia: Článok nie je podporený grantom ani nevznikol za podpory žiadnej spoločnosti.
Redakčná rada potvrdzuje, že rukopis práce splnil ICMJE kritériá pre publikácie zasielané do biomedicínskych časopisov.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in the published article/ manuscript.
Dedication: The article/ manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Zdroje
1. Heyde EC. Gastrointestinal bleeding in aortic stenosis. N Engl J Med 1958; 259 : 196.
2. Greenstein RJ, McElhinney AJ, Reuben D et al. Colonic vascular ectasias and aortic stenosis: coincidence or causal relationship? Am J Surg 1986; 151 (3): 347–351. doi: 10.1016/0002-9610 (86) 90465-4.
3. Warkentin TE, Moore JC, Morgan DG. Aortic stenosis and bleeding gastrointestinal angiodysplasia: is acquired von Willebrand‘s disease the link? Lancet 1992; 340 (8810): 35–37. doi: 10.1016/0140-6736 (92) 92434-h.
4. Sadler JE. Aortic stenosis, von Willebrand factor, and bleeding. N Engl J Med 2003; 349 (4): 323–325. doi: 10.1056/NEJMp030055.
5. Hudzik B, Wilczek K, Gasior M. Heyde syndrome: gastrointestinal bleeding and aortic stenosis. CMAJ 2016; 188 (2): 135–138. doi: 10.1503/cmaj.150194.
6. Islam S, Cevik C, Islam E et al. Heyde‘s syndrome: a critical review of the literature. J Heart Valve Dis 2011; 20 (4): 366–375.
7. Sami SS, Al-Araji SA, Ragunath K. Review article: gastrointestinal angiodysplasia – pathogenesis, diagnosis and management. Aliment Pharmacol Ther 2014; 39 (1): 15–34. doi: 10.1111/apt.12527.
8. Regula J, Wronska E, Pachlewski J. Vascular lesions of the gastrointestinal tract. Best Pract Res Clin Gastroenterol 2008; 22 (2): 313–328. doi: 10.1016/j.bpg.2007.10.026.
9. Chukwudum CA, Vera S, Sharma M et al. Heyde syndrome: a case report and literature review. Cureus 2020; 12 (4): e7896. doi: 10.7759/cureus.7896.
10. Pate GE, Chandavimol M, Naiman SC et al. Heyde‘s syndrome: a review. J Heart Valve Dis 2004; 13 (5): 701–712.
11. Šimonová R, Sokol J, Chudej J et al. Heydeho syndróm: etiopatogenéza, diagnostia a liečba. Vask Med 2014; 6 (2): 70–72.
12. Gola W, Lelonek M. Clinical implication of gastrointestinal bleeding in degenerative aortic stenosis: an update. Cardiol J 2010; 17 (4): 330–334.
13. Franchini M, Mannucci PM. Von Willebrand disease-associated angiodysplasia: a few answers, still many questions. Br J Haematol 2013; 161 (2): 177–182. doi: 10.1111/bjh.12272.
14. Starke RD, Ferraro F, Paschalaki KE et al. Endothelial von Willebrand factor regulates angiogenesis. Blood 2011; 117 (3): 1071–1080. doi: 10.1182/blood-2010-01-264507.
15. Škorňová I, Staško J, Hollý P et al. Von Willebrandova choroba – porovanie dvoch metód analýzy multimérov von Willebrandovho faktora. Transfuze Hematol Dnes 2021; 27 (1): 42–50. doi: 10.48095/cctahd202142.
16. Akutagawa T, Shindo T, Yamanouchi K et al. Persistent Gastrointestinal Angiodysplasia in Heyde‘s Syndrome after Aortic Valve Replacement. Intern Med 2017 15; 56 (18): 2431–2433. doi: 10.2169/internalmedicine.8603-16.
17. Loscalzo J. From clinical observation to mechanism – Heyde‘s syndrome. N Engl J Med 2012; 367 (20): 1954–1956. doi: 10.1056/NEJMcibr 1205363.
18. Theis SR, Turner SD. Heyde syndrome. Treasure Island (FL): StatPearls Publishing 2021.
19. Thompson JL 3rd, Schaff HV, Dearani JA. Risk of recurrent gastrointestinal bleeding after aortic valve replacement in patients with Heyde syndrome. J Thorac Cardiovasc Surg 2012; 144 (1): 112–116. doi: 10.1016/j.jtcvs.2011.05. 034.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Kvíz z klinické praxe
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2021 Číslo 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Parkinsonova choroba a postihnutie GITu
- Heydeho syndróm
- Cytomegalovirová enteritida jako neobvyklý zdroj krvácení do gastrointestinálního traktu
- Význam sarkopenie a myosteatózy u kandidátů transplantace jater na peritransplantační průběh a přežívání pacientů a štěpů
- Sérové protilátky proti laminarinu u kolorektálního karcinomu: prospektivní pilotní studie
- Endoscopic management of ampullary tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline and Endoscopic management of superficial nonampullary duodenal tumors: European Society of Gastrointestinal Endoscopy (ESGE) Guideline
- Neobvyklý případ systémové AA amyloidózy
- Vitamín D a nealkoholová steatóza pečene u detí
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Aktualita z kongresu EASL-ILC: pokroky v poznání a léčbě primární biliární cholangitidy
- Výběr z mezinárodních časopisů
- Správná odpověď na předchozí kvíz Dlouhodobé bolesti břicha
- Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Heydeho syndróm
- Infekce SARS-CoV-2 a postižení slinivky břišní
- Vliv CDED diety na rozvoj remise u pacienta s přetrvávající aktivitou Crohnovy choroby – kazuistické sdělení a zkušenosti pracoviště
- Vitamín D a nealkoholová steatóza pečene u detí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



