-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnostika ložiskových lézí jater u dětí s využitím kontrastní ultrasonografie
Diagnosis of focal liver lesions in children using contrast enhanced ultrasound
Dynamic contrast enhanced ultrasound (CEUS) is a novel imaging method that enables assessment of blood vessels and tissues. Among the methods used for CEUS are Doppler and double space ultrasound imaging. In children, this method can be used to diagnose focal liver lesions and to assess traumatic lesions of the abdomen. The authors demonstrate their contemporary experience of using this method to diagnose focal liver lesions in children.
Submitted: 7. 11. 2019
Accepted: 9. 12. 2019
Conflict of Interest: The authors declare that the article/manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/manuscript has not been published or is currently being submitted for another review. The authors agree to publish their name and e-mail in the published article/manuscript.
Dedication: The article/manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Keywords:
body mass index – contrast enhanced ultrasound – liver – hemangioma
Autoři: Michnová Z.; Pršo M.; Zúbriková L.; Murgašová M.; Havlíčeková Z.; P. Bánovčin Jr.
Působiště autorů: Klinika detí a dorastu JLF UK a UN v Martině, Slovenská republika
Vyšlo v časopise: Gastroent Hepatol 2019; 73(6): 481-487
Kategorie: Dětská gastroenterologie a hepatologie: přehledová práce
doi: https://doi.org/10.14735/amgh2019481Souhrn
Dynamická kontrastní ultrasonografie (CEUS – contrast-enhanced ultrasound) je poměrně novou zobrazovací modalitou, která umožňuje hodnotit průběh opacifikace cév a tkání, a to nejen v dopplerovském, ale i ve dvourozměrném ultrasonografickém obrazu. Největšího uplatnění u dětí dosud metoda nalezla v diagnostice ložiskového postižení jater a při hodnocení poúrazových změn parenchymatózních orgánů dutiny břišní. Autoři prezentují své dosavadní zkušenosti s využitím metody při diagnostice fokálních lézí jater u dětí.
Klíčová slova:
kontrastní ultrasonografie – játra – hemagiom – deti
Úvod
Dynamická kontrastní ultrasonografie (CEUS – contrast enhanced ultrasound) je novou zobrazovací modalitou pro diagnostiku postižení parenchymatózních orgánů dutiny břišní. US kontrastní látky (KL) jsou tvořeny plynovými mikrobublinami, které mají stabilizovaný fosfolipidový obal. Mikrobubliny rezonují s dopadajícím ultrazvukovým (UZ) vlněním, a tím zvyšují počet odrazů, které jsou detekovány krystalem sondy [1]. Velikost mikrobublin se pohybuje v rozmezích 1–10 µm, díky čemuž jsou schopny pronikat kapilárním řečištěm, tedy ze žilního do systémového a posléze i do portálního oběhu. Mikrobublinové KL mají po intravenózním podání jinou farmakokinetiku než KL používané při CT a magnetickorezonanční (MR) diagnostice [2]. Nepronikají totiž do extravaskulárního prostoru, zůstávají lokalizovány přísně intravaskulárně a o to více je možné s jejich pomocí hodnotit perfuzní charakteristiky normálních a patologických tkání [3]. Kontrastní látky jsou cca po 6–10 min metabolizovány a vydechovány plícemi, nezatěžují tedy ledviny, játra a nejsou kardiotoxické [4,5].
V SR a ČR je registrována a používána KL 2. generace SonoVue (BR1, Bracco, Miláno, Itálie). Preparát SonoVue je tvořen sulfur hexafluoridem s fosfolipidovým obalem, 1 ml této KL obsahuje 8 μl mikrobublin síranu hexafluoridu. Tato KL je ve vodě méně rozpustná než vzduch, a proto je v krvi stabilnější. Doposud nebyl popsán žádný klinicky relevantní bioefekt na lidský organizmus při použití UZ KL [6,7]. Při vyšetření není potřebné podávat protialergickou přípravu. Doporučeno je omezení u dospělých jedinců na podkladě reakcí, které byly zaznamenány u pacientů s akutním koronárním syndromem (ARDS – akutní respirační distress syndrom), s významným chronickým srdečním selháním a závažnou arytmií. S užíváním UZ KL nejsou dostatečné zkušenosti u gravidních žen [3,8]. U dětí je potřebné zohlednit relativní kontraindikace, kterými jsou sepse, hyperkoagulační stav, nedávná tromboembolie, umělá plicní ventilace a nestabilní neurologické onemocnění [4,6].
K CEUS vyšetření je potřebný dedikovaný UZ software pro CEUS s nízkým mechanickým indexem (MI) okolo 0,14. Tento index odráží riziko vzniku mechanického účinku. Jde o poměr vrcholového tlaku (peak rarefactional pressure – Pr, jednotky MPa) ke druhé odmocnině nosné, střední frekvence UZ sondy (MHz), nabývá hodnot 0–2 [3]. Při nízkém MI se potlačí signál okolní tkáně a do popředí vystoupí struktury, které se opacifikují kontrastní látkou a nedochází k destrukci mikrobublin. Další důležitou schopností UZ přístrojů k CEUS vyšetření je možnost snímání vyšších harmonických frekvencí [1].
V porovnání s vyšetřením kontrastní CT nebo MR má CEUS při charakterizaci nádorů jater několik výhod, jednak je to schopnost dynamického zobrazení v reálném čase se zachycením charakteristického sycení ložiska, možnost opakovaného podání kontrastní látky a skutečnost, že mikrobublinové kontrastní látky nejsou nefro-a kardiotoxické [1,2,9]. U spolupracujícího pacienta je možné vyšetření realizovat ambulantně. U kojenců a batolat realizujeme vyšetření za hospitalizace pacienta v sedaci ve spolupráci s dětským anesteziologem. V pediatrii je CEUS metodou off label. Na Klinice dětí a dorostu UN v Martině realizujeme od roku 2018 v indikovaných případech u dětí s ložiskovými lézemi jater se souhlasem zákonného zástupce pacienta a etické komise JLF UK v Martině.
Vlastní UZ vyšetření probíhá v B-módu (charakteristika léze, segmentální klasifikace, velikost a povaha léze). Dále je pacientovi za kontinuálního vyšetřování v dynamickém B-módu abdominální konvexní sondou o frekvenci 5 MHz (v případě kojenců event. lineární sondou o frekvenci 7,5 MHz) intravenózně aplikována KL o objemu 1–5 ml dle hmotnosti pacienta s bezprostředním podáním 10 ml solného roztoku k průplachu periferního venózního katétru. Samotná kontrastní látka SonoVue se připravuje smícháním 5 ml solného roztoku s mikrobublinami. K aplikaci KL je potřebné zajistit adekvátní žilní vstup, optimální je růžová kanyla o zevním průměru 1,1 mm, zavedená v levé kubitě. Dostatečný průměr venózní kanyly umožňuje rychlé podání KL a současně nedochází k mechanickému poškození mikrobublin [5,10].
Při hodnocení charakteru lézí v játrech sledujeme chování ložiska v průběhu čtyř fází [2,3,11]:
- I. časná arteriální fáze trvá od podání kontrastní látky 15–20 s;
- II. arteriální fáze (25–30 s);
- III. venózní (portální) fáze v rozmezí 45–90 s;
- IV. pozdní fáze následuje po 100 s, v této fázi se mikrobubliny hromadí v sinusoidálních prostorech jater.
Již podle toho, jak se léze opacifikuje v arteriální fázi, se dá určit charakter části benigních lézí. V portální a pozdní fázi lze odlišit charakter léze ve smyslu benignity a malignity [9]. Maligní léze mají porušené sinusoidální prostory, proto v pozdní fázi dochází k rychlejšímu odtoku kontrastní látky z léze v porovnání s normálním okolitým parenchymem a maligní léze se stává hypoechogenní vůči okolí [3]. Většina benigních lézí naproti tomu v pozdní fázi akumuluje mikrobubliny v sinusoidálních prostorech, a proto se benigní léze zobrazují jako izo-anebo hyperechogenní v porovnání s okolním parenchymem [1].
CEUS obraz benigních lézí jater
Cysta
V průběhu celého vyšetření nedochází k žádné opacifikaci léze [12].
Fokální steatóza
Po podání KL ve všech čtyřech fázích léze splývá s okolním parenchymem jater, je izoechogenní vůči okolí [13].
Hemangiom
V arteriální fázi dochází k postupné nodulární opacifikaci, která postupuje z periferie do centra ložiska, adekvátně opacifikaci při CT a MR vyšetření. V portální a pozdní fázi zůstává ložisko vysycené a jeví se hyperechogenní vůči svému okolí [11]. V literatuře je popisován také příznak tečkovité opacifikace, která přetrvává ve všech fázích sycení jaterního parenchymu. Tento jev vysvětlují dvě teorie: první popisuje tento příznak u trombotizovaných, fibrosklerotických nebo atypických jaterních hemagiomů; druhá u hluboko uložených hemagiomů v dorzálních partiích jater, kde je signál CEUS obtížně detekovatelný [14].
Jiným diagnostickým problémem jsou drobné hypervaskularizované hemagiomy, které vykazují kompletní časnou opacifikaci během arteriální fáze [13]. Některá tato ložiska mohou v průběhu časné arteriální fáze jevit známky periferní nodulární opacifikace, kterou při konvenčním zobrazení nemůžeme postihnout, protože ve 20–30 s, kdy je zobrazíme na CT nebo MR, jsou již kompletně opacifikována. Zachycení celého průběhu arteriální fáze je výhodou CEUS oproti CT a MR [12].
Adenom
V arteriální fázi dochází k výrazné opacifikaci ložiska, v portální a pozdní fázi nedochází k vyplavování KL, léze zůstává izo-nebo hyperechogenní vůči okolnímu parenchymu jater [15].
Fokální nodulární hyperplazie
V arteriální fázi dochází k rychlé opacifikaci ložiska podél hlavní vyživující tepny a v průběhu jejích „loukoťovitě“ uspořádaných větví plnících se z centra do periferie. V portální a pozdní fázi obvykle přetrvává izo-nebo hyperechogenní opacifikace [1]. Dalším, pro fokální nodulární hyperplazie typickým příznakem je přítomnost centrální jizvy, která se při CEUS ve všech fázích opacifikace na rozdíl od CT a MR nesytí. Odlišnost je dána charakterem KL, která je u CEUS čistě intravaskulární a nedifunduje do intersticiálního prostoru [16].
Zánětlivý pseudotumor
V arteriální fázi hypervaskularizovaná léze s mírným vyplavováním KL, která se nedá jednoznačně odlišit od maligních lézí [15].
CEUS obraz maligních lézí jater
Metastázy
Metastázy mohou být v arteriální fázi hyper-nebo hypovaskulární, v portální a v pozdní fázi dochází ke zřetelnému vyplavení KL z ložiska a ta se stává hypoechogenní vůči svému okolí [14].
Hepatocelulární karcinom
V necirhoticky změněných játrech může být obraz kacinomu odlišný od obrazu v cirhotickém terénu, je přítomna hypervaskularizace v arteriální fázi a vyplavování KL v portální a v pozdní fázi, kdy se léze stává hypoechogenní vůči okolí. V cirhoticky změněných játrech je obraz vyplavování KL zčásti zkreslený. Charakteristický je příznak košíku, kdy se hlavní sytící tepna táhne přes ložisko a okolo ložiska a podél ní dochází v arteriální fázi k rychlé opacifikaci ložiska, čímž vzniká obraz tzv. ohnivé bouřky (firestorm) [1].
Cholangiokarcinom
Hypervaskularizovaná léze v arteriální fázi, se zřetelným vyplavováním KL v portální a pozdní fázi [15].
Shrnutí CEUS charakteristik nejčastějších jaterních lézí je uvedeno v tab. 1. Na obr. 1–4 prezentujeme CEUS nálezy našich pacientů (multilokulární cysta, fokální steatóza, hemagiom, hepatoblastom).
Tab. 1. CEUS charakteristiky opacifikace nejčastějších jaterních lézí. Tab. 1. CEUS characterisation of hepatic lesions on the contrast-enhanced ultrasound. 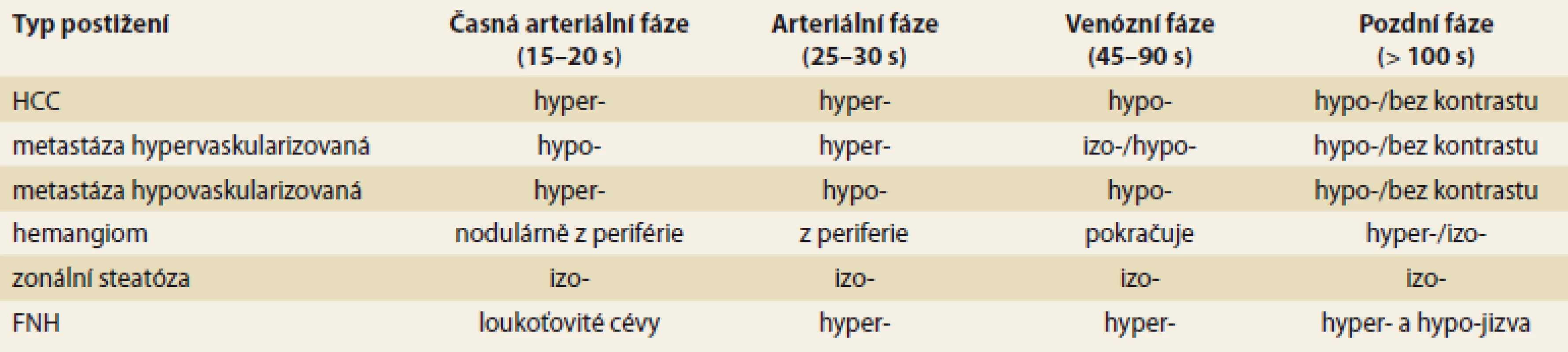
HCC – hepatocelulární karcinom, FNH – fokální modulární hyperplazie, hyper- – hyperechogenní, hypo- – hypoechogenní, izo- – izoechogenní Obr. 1. Multilokulární cysta jater nativně; B-mód (A), CEUS arteriální fáze (B), portální fáze (C), pozdní fáze (D). Nedošlo k žádné opacifikaci léze.
Fig. 1. Multilocular liver cyst native US; B-mode (A), CEUS arterial phase (B), portal phase (C), late phase (D). Without opacification of lesion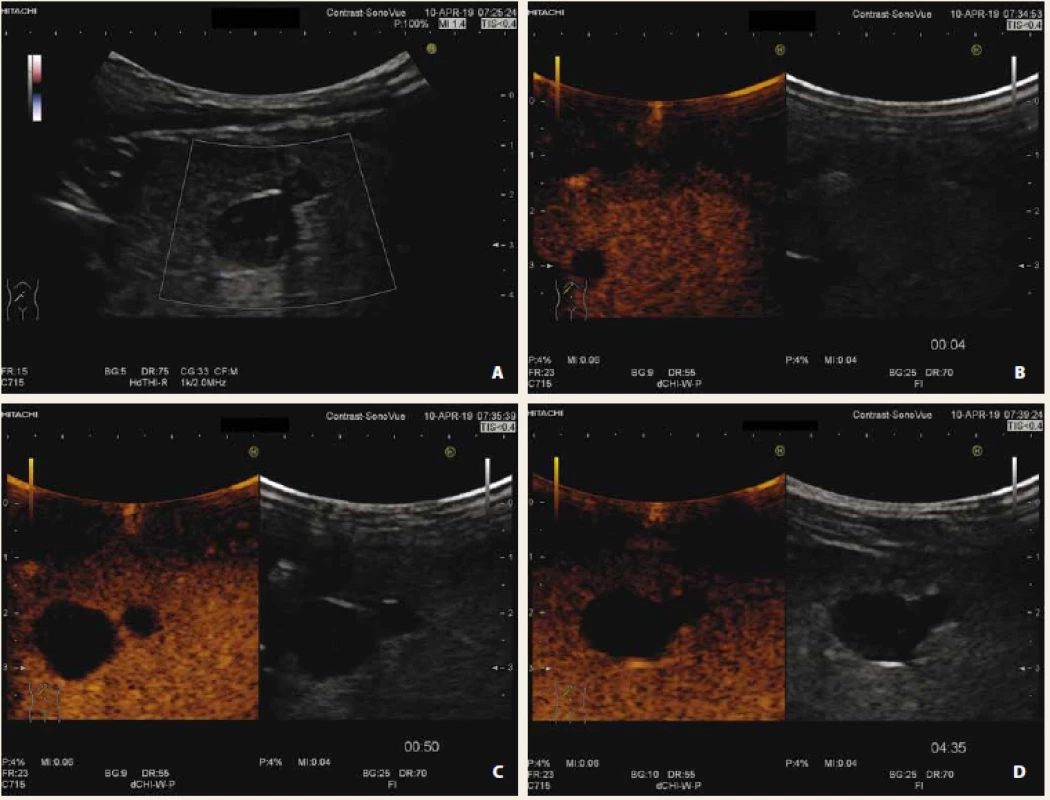
Obr. 2. Fokální steatóza jater s využitím dopplerovského zobrazení (A), CEUS arteriální fáze (B), portální fáze (C), pozdní fáze (D). Po podání kontrastní látky léze ve všech fázích splývá (je izoechogenní) s okolním parenchymem jater.
Fig. 2. Focal liver steatosis with use of doppler mode (A), CEUS arterial phase (B), portal phase (C), late phase (D). After application of contrast agent, lesion is isoechogenic with surrounding liver parenchyma during all phases.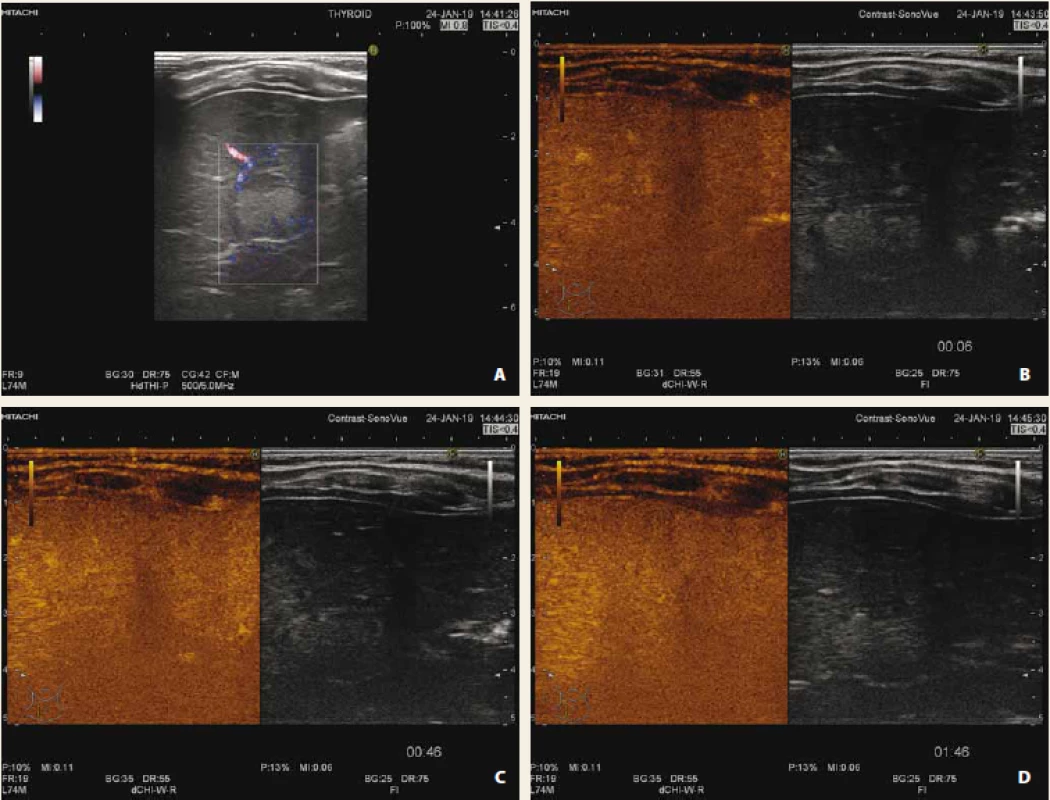
Obr. 3. Hemangiom jater CEUS časná arteriální fáze (A), arteriální fáze (B), portální fáze (C), pozdní fáze (D). Typický patognomický obraz centripetální nodulární opacifikace ložiska.
Fig. 3. Liver haemangioma in early arterial phase (A), arterial phase (B), portal phase (C), late phase (D). Typical patognomical sign of centripetal nodular opacification of lesion.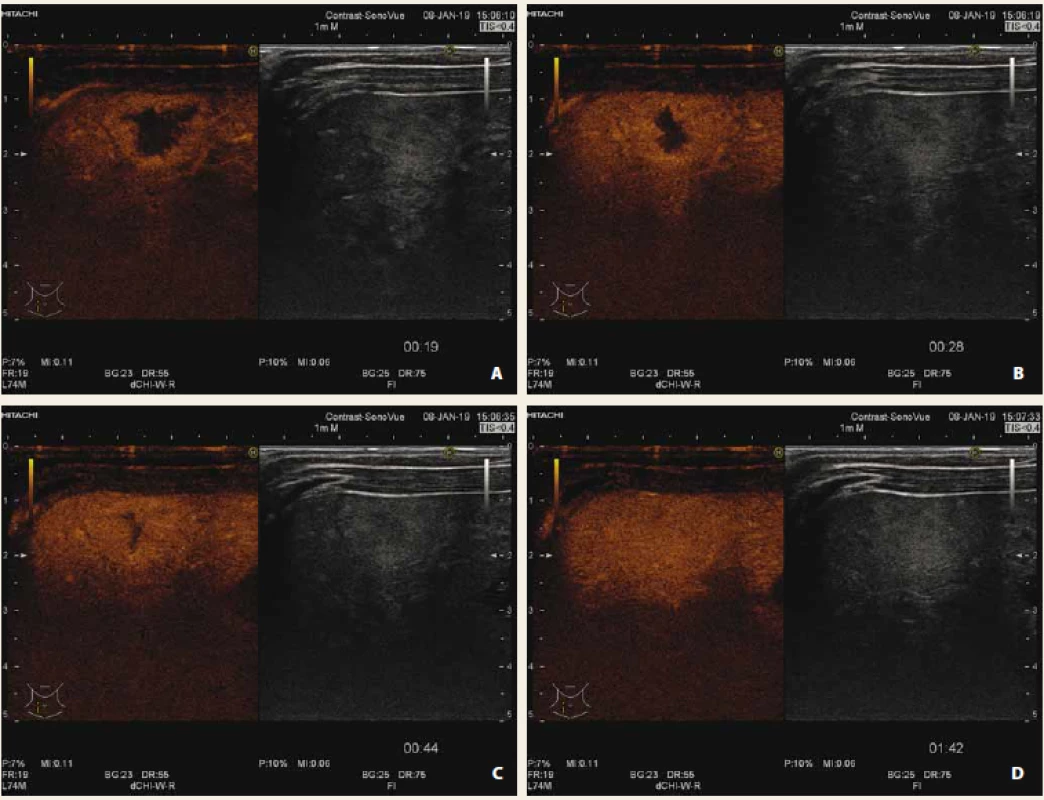
Tab. 2. Hepatoblastom nativně, B mód (A), CEUS arteriální fáze (B), portální fáze (C), pozdní fáze (D) s vymýváním kontrastní látky „wash out“ fenomén. Signifikantně zvýšená hladina alfa-fetoproteinu.
Fig. 4. Liver hepatoblastoma native US, B-mode (A), CEUS arterial phase (B), portal phase (C), late phase (D) with „wash out“ of contrast agent. Significant elevation of alpha-fetoprotein.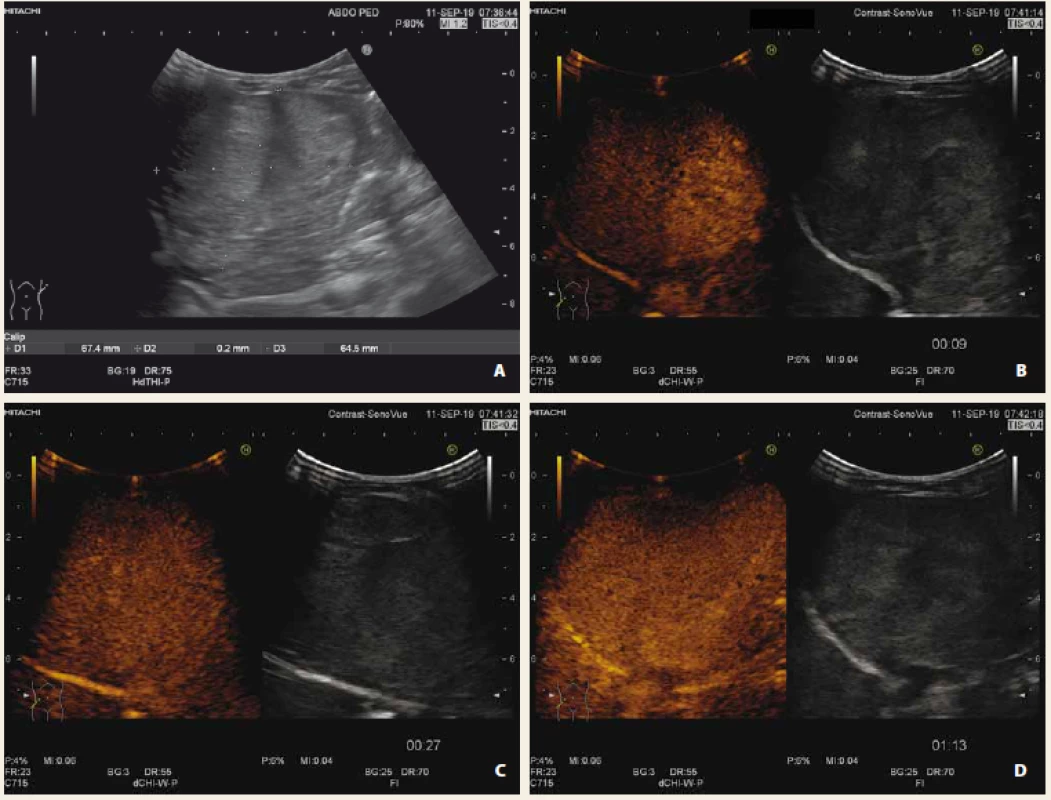
Diskuze
Nádory jater tvoří 1–4 % solidních tumorů u dětí. Nejčastějšími maligními nádory jater dětského věku jsou hepatoblastom a hepatocelulární karcinom, typickým metastatickým nádorem je neuroblastom a Wilmsův tumor. Hepatoblastom je nejčastější dětský vysoce maligní tumor jater s různým stupněm diferenciace. V 90 % případů se manifestuje do 5. roku života, z toho 68 % před 2. rokem života. Chlapci jsou postiženi častěji než dívky (v poměru 2 : 1). Hepatoblastom může být asociován s trisomií 18. chromozomu, glykogenózou 1. typu, familiární adenomatózní polypózou a Gardnerovým syndromem [17]. Metastazuje do plic, kostí, mozku a dalších orgánů. Laboratorně bývá provázen anémií, trombocytózou a vysokými hladinami alfa-1-fetoproteinu (AFP), jaterní testy bývají obvykle bez odchylek. US prokazuje velkou heterogenní dobře ohraničenou vaskularizovanou masu smíšené echogenity (hemoragie, nekrózy), v 50 % případů jsou přítomny kalcifikace, okolité struktury jsou odtlačovány, ne infiltrovány [14,18]. Hepatocelulární karcinom (HCC) je 3. nejčastějším tumorem jater u dětí. Častěji se vyskytuje u dětí starších 10 let. V dětském věku má úzký vztah k hereditární tyrozinemii, zde se vyvíjí až v 37 % do 2 let věku, a základní onemocnění má být řešeno transplantací jater před dosažením tohoto věku. HCC se obvykle vyvíjí v terénu chronické hepatitidy B. Blízký vztah má HCC k progresivní familiární intrahepatální cholestáze 2. typu, Alagilleovu syndromu a biliární atrezii [17]. Laboratorně je provázen zvýšenou hodnotou AFP. Charakteristický je US obraz hypervaskularizovaného uzlu v cirhoticky změněných játrech, s typickým arteriálním sycením a venózním vymýváním kontrastu při CT/MR/CEUS vyšetření [8]. Vzhledem k vysokému výskytu malignit je nutné přesně odlišit benigní léze (hemangiom, mezenchymální hamartom, fokální modulární hyperplazii a adenom) [19].
K diagnostice ložiskových procesů v játrech se nejčastěji využívají tři zobrazovací metody: US, CT a MR. CT i MR mají své nesporné výhody a indikace, ale i omezení a kontraindikace. Jediné US vyšetření nemá žádné známé kontraindikace, je levné a není omezeno ani u těhotných a dětí. Problémem je subjektivní hodnocení nálezů, v některých případech limitace habitem pacienta. Diagnostický potenciál US výrazně zvýšila aplikace UZ KL [2]. Doposud nebyl popsán žádný klinicky relevantní bioefekt na lidský organizmus při použití UZ KL. Aktuálně u nás nejsou pro pediatrickou populaci schváleny indikace, při kterých se dá CEUS spolehlivě použít [5]. I přesto se CEUS jeví jako velmi slibná zobrazovací modalita zejména v charakterizaci ložiskových lézí jater, ledvin, pankreatu, při hodnocení poúrazových změn parenchymatózních orgánů dutiny břišní a při diagnostice vezikoureterálního refluxu [10,20]. Práce vydaná European Federation of Societies for Ulrasound in Medicine and Biology (EFSUMB) doporučuje pro dospělý věk začlenit CEUS do diagnostického řetězce při vyšetřování jater v čtyřech oblastech:
- použití CEUS při charakterizaci náhodně nalezeného ložiska jater;
- diagnostika HCC u pacientů s cirhózou jater;
- detekce jaterních metastáz u onkologicky nemocných;
- použití CEUS při provádění a sledování výsledků ablace jaterních tumorů [9].
Závěr
Přesnost CEUS dle výsledků publikovaných prací významně převyšuje senzitivitu i specificitu nativní US a je srovnatelná s výsledky CT a MR [4,15,16]. Způsob vyšetření a použití přísně intravaskulární KL přináší některé specifické opacifikační znaky benigních a maligních ložiskových jaterních lézí. Přestože je v pediatrii CEUS doposud metodou off label, ukazuje se, že může v budoucnosti ve vyhraněných indikačních oblastech nahradit kontrastní CT a MR vyšetření. Benefitem tohoto vyšetření jsou především eliminace radiační zátěže, možnost dynamického vyšetření v reálném čase a extrémně nízký výskyt nežádoucích účinků [4,6].
Doručeno: 7. 11. 2019
Přijato: 9. 12. 2019
MUDr. Marek Pršo, PhD.
Klinika detí a dorastu JLF UK a UN Martin
Kollárova 2
036 59 Martin
Slovenská republika
Konfllikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Zdroje
1. Ungerman L, Eliáš P, Ryška P et al. Dynamická kontrastní ultrasonografie jater. Ces Radiol 2009; 63 (1): 34–41.
2. Nolse CP, Lorentzen T. International guidelines for contrast-enhanced ultrasonography: ultasound imaging in the new millenium. Ultrasonography 2016; 35 (2): 89–103. doi: 10.14366/usg.15057.
3. Gindlová P, Belan V, Lackovič J et al. Diagnostika ložiskových lézií pečene kontrastným ultrazvukom. Slov Radiol 2010; 17 (2): 3–9.
4. Piskunowicz M, Kosiak W, Batko T et al. Safety of intravenous application of second-generation ultrasound contrast agent in children: prospective analysis. Ultrasound Med Biol 2015; 41 (4): 1095–1099. doi: 10.1016/ j.ultrasmedbio.2014.11.003.
5. Pršo M, Michnová Z, Zúbriková L et al. Kontrastná ultrasonografia v pediatrii. Pediatria (Bratislava) 2017; 12 (2): 95–98.
6. Coleman JL, Navid F, Furman WL et al. Safety of ultrasound contrast agents in the pediatric oncologic populations: a single-institution experience. AJR Am J Roentgenol 2014; 202 (5): 966–970. doi: 10.2214/AJR.13.12010.
7. Efsumb. EFSUMB Pediatric Registry. [online]. Available from: http: //www.efsumb.org/education/scientific-corner01.asp.
8. Seitz K, Strobek D. A Milestone: approval of CEUS for diagnostic liver imaging in adults and children in the USA. Ultraschall Med 2016; 37 (3): 229–232. doi: 10.1055/s-0042-107411.
9. Claudon M, Dietrich CF, Choi BI et al. Guidelines and good clinical practice recommendations for contrast enhanced ultrasound (CEUS) in the liver-update 2012: a WFUMB-EFSUMB initiative in cooperation with representatives of AFSUMB, AIUM, ASUM, FLAUS and ICUS. Ultraschall Med 2013; 34 (1): 11–29. doi: 10.1055/s-0032-1325499.
10. Laugesen NG, Nolsoe CP, Rosenberg J. Clinical applications of contrast-enhanced ultrasound in the pediatric work-up of focal liver lesions and blunt abdominal trauma: a systematic review. Ultrasound Int Open 2017; 3 (1): E2–E7. doi: 10.1055/s-0042-124502.
11. Jacob J, Deganello A, Sellars ME et al. Contrast enhanced ultrasound (CEUS) characterization of grey-scale sonographic indeterminate focal liver lesions in pediatric practice. Ultraschall Med 2013; 34 (6): 529–540. doi: 10.1055/s-0033-1355785.
12. Catala V, Nicolau C, Vilana R et al. Characterization of focal liver lesions: comparative study of contrast-enhanced ultrasound versus spiral computed tomography. Eur Radiol 2007; 17 (4): 1066–1073. doi: 10.1007/s00330-006-04 44-6.
13. Chiorean L, Cui XW, Tannapfel A et al. Benign liver tumors in pediatric patiens – rewiew with emphasis on imaging features. World J Gastroenterol 2015; 21 (28): 8541–8561. doi: 10.3748/wjg.v21.i28.8541.
14. Solbiati I, Tonolino M, Cova L et al. The role of contrast-ehanced ultrasound in the detection of focal lesions. Eur Radiol 2001; 11 (Suppl 3): E15–E26. doi: 10.1007/pl00014125.
15. Strobel D, Seitz K, Blank W et al. Contrast-enhanced ultrasound for the characterization of focal liver lesions-diagnostic accurancy in clinical practice (DEGUM multicenter trial). Ultraschall Med 2008; 29 (5): 499–505. doi: 10.1055/s-2008-1027806.
16. Westwood M, Joore M, Grutters J et al. Contrast-enhanced ultrasound using SonoVue® (sulphur hexafluoride microbubbles) compared with contrast-enhanced computed tomography and contrast-enhanced magnetic resonance imaging for the characterisation of focal liver lesions and detection of liver metastase: a systematic review and cost-effectiveness analysis. Health Technol Assess 2013; 17 (16): 1–243. doi: 10.3310/hta17160.
17. Kotalová R. Nádory jater. In: Nevoral J et al. Praktická pediatrická gastroenterologie, hepatologie a výživa. Praha: Mladá fronta 2013 : 376–379.
18. Šnajdauf J. Nádory jater. In: Šnajdauf J, Škába R, Bartůňková J et al. Dětská chirurgie. Praha: Galen 2005 : 295–230.
19. Meyers RL. Tumor of the liver in children. Surg Oncol 2007; 16 (3): 195–203. doi: 10.1016/ j.suronc.2007.07.002.
20. Menichini G, Sessa B, Trinci M et al. Accuracy of contrast-enhanced ultrasound (CEUS) in the identification and characterization of traumatic solid organ lesions in children: a retrospective comparison with baseline US and CE-MDCT. Radiol Med 2015; 120 (11): 989–1001. doi: 10.1007/s11547-015-0535-z.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek EditorialČlánek Obezita a dětská ledvina
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2019 Číslo 6- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Editorial
- Chirurgická léčba obezity a metabolických onemocnění – nové výzvy i pro další obory
- Stanovisko Pracovní skupiny pro dětskou gastroenterologii, hepatologii a výživu České pediatrické společnosti (PSDG ČPS) k používání dietních opatření v léčbě Crohnovy nemoci u dětských pacientů
- Dieta CDED v indukční terapii Crohnovy nemoci
- Diagnostika ložiskových lézí jater u dětí s využitím kontrastní ultrasonografie
- Vitamin D – substituce po malabsorpční operaci
- Výživa a bariatricko-metabolická chirurgie
- Kožné imunologicky mediované nežiaduce účinky indukované anti-TNF alfa terapeuticky zvládnuté zmenou liečby za ustekinumab
- Ložiskové zánětlivé procesy jater
- Obezita a dětská ledvina
- Díl VI. – Příčiny úmrtí pacientů s idiopatickými střevními záněty se zaměřením na hospitalizace v závěru života pacienta
- Ružinovský gastroenterologický deň 2019 8. november 2019 ABSTRAKTA
- Zpráva z kongresu Obezitologie a bariatrie 2019, Brno
- 36th Czech and Slovak Congress of Gastroenterology
- Vzpomínka na profesora Meinharda Classena
- Novinky z výzkumu horního GIT
- Výběr z mezinárodních časopisů
- Kreditovaný autodidaktický test: dětská gastroenterologie a hepatologie obezitologie a bariatricko-metabolická chirurgie
- Alogenní mezenchymální kmenové buňky (ALOFISEL) jsou efektivní v eradikaci komplexních perianálních píštělí u Crohnovy nemoci
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ložiskové zánětlivé procesy jater
- Dieta CDED v indukční terapii Crohnovy nemoci
- Vitamin D – substituce po malabsorpční operaci
- Alogenní mezenchymální kmenové buňky (ALOFISEL) jsou efektivní v eradikaci komplexních perianálních píštělí u Crohnovy nemoci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



