-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Použití albuminu v perioperační a intenzivní medicíně
Use of albumin in perioperative and intensive care medicine
Albumin is still a widely studied protein of the human body. Historically, it has been infused as a volume replacement using its oncotic properties. In the field of fluid therapy in recent years, it has been compared with other types of solutions in various clinical indications and its safety was monitored. Another subject of research is its other biological effects, which are used in specific clinical situations: liver failure, prevention of acute renal failure, adult acute respiratory distress syndrome, traumatic brain injury, ovarian hyperstimulation syndrome. The review article summarizes the current state of knowledge and its use in adult patients in intensive care as well as in neonatology. It also discusses selected clinical syndromes and the hitherto known physiology of albumin in the human body. It also deals with the use of albumin in extracorporeal support of organ functions: extracorporeal circulation in the cardiac surgery, dialysis and plasmapheresis.
Keywords:
shock – liver failure – fluid therapy – albumin – acute respiratory distress syndrome in adults
Autoři: D. Astapenko 1,2; J. Pouska 3,4; J. Škola 2,5; J. Beneš 2,5; J. Náhlovský 2,6; M. Mynář 1,2; Z. Turek 1,2; J. Beneš 3,4; V. Černý 1,2,5,7,8
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové 1; Lékařská fakulta v Hradci Králové, Univerzita Karlova 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Plzeň 3; Lékařská fakulta v Plzni, Univerzita Karlova 4; Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně v Ústí nad Labem, Masarykova nemocnice v Ústí nad Labem 5; Dětská klinika, Fakultní nemocnice Hradec Králové 6; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové 7; Department of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Nova Scotia, Canada 8
Vyšlo v časopise: Anest. intenziv. Med., 31, 2020, č. 3, s. 96-102
Kategorie: Přehledové články
Souhrn
Albumin je stále široce studovaným proteinem lidského těla. Historicky nejdéle je podáván jako objemová náhrada s využitím jeho onkotických vlastností. V oblasti tekutinové terapie je v posledních letech dále srovnáván s ostatními typy roztoků v různých klinických indikacích a je sledována zejména jeho bezpečnost. Předmětem zájmu výzkumu jsou jeho další biologické účinky, které jsou využívány ve specifických klinických situacích: jaterní selhání, prevence selhání ledvin, syndrom akutní respirační tísně dospělých, traumatické poškození mozku, ovariální hyperstimulační syndrom. Přehledový článek shrnuje současný stav odborného poznání a jeho využití jak u dospělých pacientů v intenzivní péči, tak v neonatologii. Diskutuje vybrané klinické syndromy a dosud známou fyziologii albuminu v lidském těle. Věnuje se též použití albuminu v postupech mimotělní podpory orgánových funkcí: mimotělní oběh v kardiochirurgii, dialýza a plazmaferéza.
Klíčová slova:
albumin – tekutinová terapie – šok – jaterní selhání – syndrom akutní respirační tísně dospělých
Úvod
Význam albuminu a jeho klinická relevance v kontextu kritických stavů je předmětem odborné diskuze již od 40. let minulého století [1]. Nicméně přes velké množství publikovaných prací zůstává řada otázek stále otevřená, resp. nemající jednoznačnou odpověď z pohledu jeho využití v denní klinické praxi. Albumin zastává v organismu velké množství biologických funkcí (viz dále), část z nich je detailně popsána (např. význam albuminu v regulaci koloidně‑osmotického tlaku). Na druhou stranu se objevují i dříve neznámé vlastnosti albuminu, jejichž bližší poznání s sebou nese potenciál použití albuminu jako farmaka schopného modulovat orgánové funkce [2].
Cílem článku je shrnutí současného stavu odborného poznání o albuminu, jeho využití u pacientů v intenzivní péči a diskutovat nové oblasti potenciálního využití albuminu v klinické medicíně (obr. 1).
Obr. 1. Koncepty využití albuminu v oboru anesteziologie a intenzivní medicína 
Metody
Studie a články vhodné pro sestavení přehledového sdělení byly identifikovány pomocí elektronického vyhledání v on‑line databázi MEDLINE. Hledána byla následující klíčová slova spojená se slovem „albumin“: shock, sepsis, hypovolemia, fluid resuscitation, burns, hepatic failure, ARDS, neonatology, ovarian hyperstimulation syndrome, traumatic brain injury, cardiac surgery, plasmapheresis, dialysis. Nebylo provedeno žádné časové omezení, preferovaným jazykem byla angličtina. Celkově bylo k 10/2019 identifikováno 28 768 článků. Relevantní publikace byly následně vybrány jednotlivými autory podle oblasti zadané ke zpracování rukopisu.
Fyziologie a biochemie albuminu
Albumin představuje nejčastěji se vyskytující protein ve většině tělesných tekutin. Jeho fyziologická koncentrace je v rozmezí 35–50 g/l (celkově 250–350 g), což představuje asi 60 % proteinů v plazmě u dospělého jedince. Jeho molekulová hmotnost je 66,5 kDa a poločas v plazmě kolem 20 dnů. Z celkového obsahu albuminu v organismu se intravaskulárně nachází kolem 40 % (obr. 2). Jeho poločas v oběhu je 16 hodin, a tedy podléhá recirkulaci skrze lymfatický systém. Albumin je syntetizován pouze v játrech s produkcí 12 g za den a je složen z jednoho polypeptidového řetězce [3]. Tvar molekuly albuminu a jeho molekulová hmotnost jsou limitními při glomerulární filtraci. Albuminurie lze tedy využít k monitoringu míry renálního poškození (např. u diabetes mellitus nebo arteriální hypertenze) [4]. Jeho koncentrace se snižuje v akutní fázi zánětu a při proteinové malnutrici [5]. Ve vztahu k perioperační medicíně byla hypoalbuminemie prokázána jako negativní prognostický faktor délky hospitalizace, nozokomiální infekce a celkové nemocniční mortality [6]. Z patofyziologického hlediska se zde uplatňuje peroperačně rozvoj syndromu zvýšené propustnosti kapilár (capillary leak syndrome) [7].
Obr. 2. Distribuce a obměna albuminu v organismu (ilustrace volně dle: Valerio C, Theocharidou E, Davenport A, Agarwal B. Human albumin solution for patients with cirrhosis and acute on chronic liver failure: Beyond simple volume expansion. World J Hepatol. 2016; 8(7): 345–354) 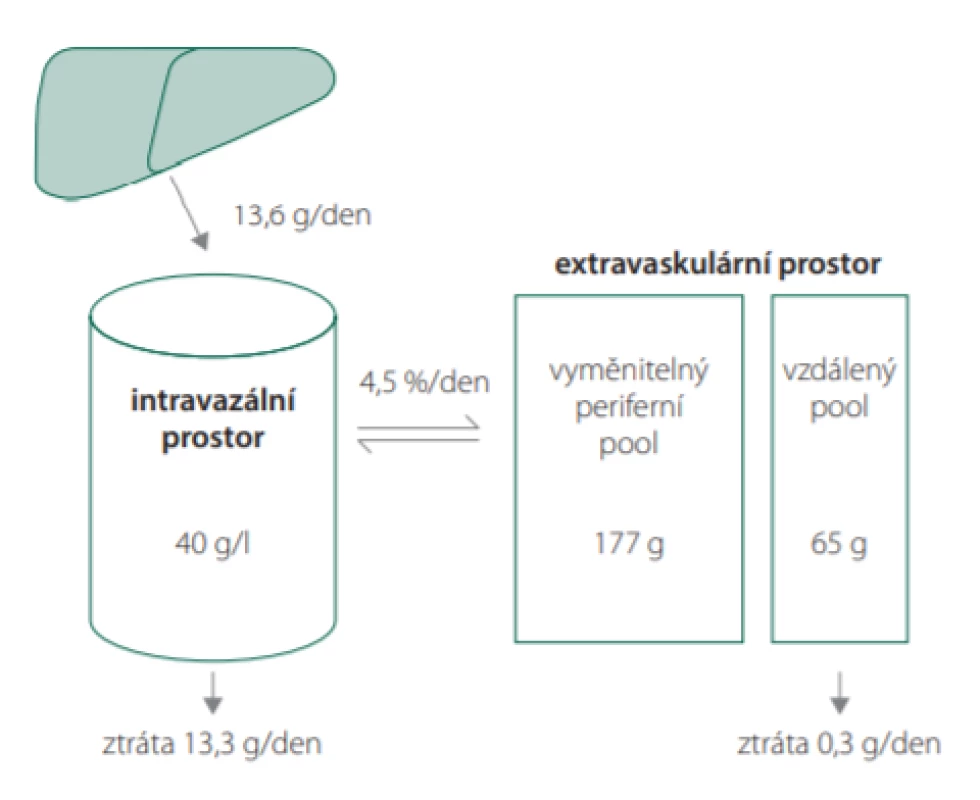
Albumin má v našem organismu pleiotropní efekt. Představuje rozhodující faktor udržující onkotický tlak a s tím související stabilitu náplně krevního řečiště. Prostřednictvím interakce s endoteliálním glykokalyxem (EG) se podílí na výměně tekutin mezi intravaskulárním a intersticiálním prostorem a moduluje průtok krve v mikrocirkulaci [8]. Albumin zastává rovněž důležité transportní funkce. Váže na sebe řadu hydrofobních substancí endogenní i exogenní povahy (bilirubin, neesterifikované mastné kyseliny, léky, steroidní hormony a hormony štítné žlázy, kovy a kalcium) [9]. Při hypoalbuminemii se zvyšuje riziko toxických účinků řady léků, které je třeba zohlednit nejen u pacientů v kritickém stavu: antibiotika, cytostatika, antikonvulziva, nitrožilní anestetika atd. [10, 11]. Albumin se dále podílí na udržování acidobazické rovnováhy jak intravaskulárně, tak v intersticiu. Svým průnikem do intersticia udržuje koloběh proteinů ve tkáních, přičemž díky svému složení zásobuje tkáně esenciálními aminokyselinami. Méně známé, avšak neméně důležité, jsou jeho další biologické funkce. Albumin funguje též jako antioxidant (vychytává volné kyslíkové a dusíkové radikály) [12], působí proti zánětu (váže lipopolysacharidy, kyselinu lipoteichoovou, peptidoglykany, prozánětlivé prostaglandiny) [13] a inhibuje buněčnou apoptózu [3]. Recentně je diskutována role albuminu ve vztahu ke koagulační rovnováze. Albumin má slabý antikoagulační efekt obdobný heparinu. Zesiluje neutralizaci faktoru Xa antitrombinem III, mírně inhibuje aktivaci destiček a je popsán jeho efekt na snižování hladiny fibrinogenu [14, 15].
Albumin v tekutinové terapii
Hypovolemický šok
Tekutinová resuscitace je základním pilířem terapie hypovolemického šoku. Z fyziologického hlediska by měl ideální roztok vést k předvídatelnému a dlouhodobému navýšení intravaskulárního objemu bez negativního efektu na endoteliální buňky, orgánové funkce, hemostázu, imunitní systém a být kompletně eliminovatelný bez akumulace v tkáních [16]. Albumin v tomto ohledu prodělal historický zvrat, a to především pro nejistotu o bezpečnost jeho podávání kvůli možnému přenosu latentních infekcí od dárců, což bylo postupně vyřešeno vývojem technologie zpracování plazmy od dárců [17]. Koloidní roztoky mají v klasickém Starlingově modelu teoretickou výhodu potřeby podání menšího množství k dosažení stejného objemového efektu v porovnání s krystaloidy. Albumin zodpovídá za přibližně 80 % koloidního osmotického (onkotického) tlaku plazmy. Výsledný onkotický gradient, a tedy teoretický objemový efekt, je tak dán nikoliv prostou plazmatickou koncentrací, ale jejím poměrem vůči koncentraci v intersticiu, která odráží permeabilitu endoteliální bariéry a významnou interakci s EG (obr. 3), který je de facto místem působení Starlingových sil [8, 18]. Data ze studie SAFE umožňují posoudit objemový efekt 4% albuminu v porovnání s roztokem 0,9% NaCl. Poměr podaného albuminu a fyziologického roztoku byl v průměru prvních čtyř dnů 1 : 1,4, tedy nižší než předpokládaný na základě Starlingova modelu. Na konci každého studijního dne měly obě skupiny pacientů stejný střední arteriální tlak. Ve skupině léčené albuminem byla klinicky nevýznamně nižší průměrná tepová frekvence a vyšší centrální žilní tlak. V prvních dvou dnech bylo použití albuminu spojeno též s méně pozitivní tekutinovou bilancí, přibližně o 500 ml/den. S výjimkou podskupiny s traumatem mozku nebyl významný rozdíl v mortalitě pacientů v jednotlivých větvích studie. Na druhou stranu, u skupiny pacientů randomizovaných pro léčbu 4% albuminem během prvních čtyř dnů léčby bylo signifikantně větší množství transfundovaných erytrocytárních přípravků. Z publikovaných dat není možné uzavřít, zda se jednalo o efekt větší hemodiluce či vyšších krevních ztrát [19]. Roztoky albuminu jsou standardně k dispozici v různých koncentracích. Studie SWIPE poskytla srovnání efektu podání 4–5% a 20% roztoku u pacientů vyžadujících objemovou terapii. V porovnání s méně koncentrovaným roztokem byl objemový účinek 20% albuminu roven přibližně dvojnásobku podaného objemu a byl spojen s nižší kumulativní bilancí za prvních 48 hodin léčby [20]. Albumin představuje alternativu v léčbě hypovolemického šoku (názor autorského týmu). S výjimkou pacientů s traumatem mozku je jeho použití pravděpodobně bezpečné a spojené s nižší kumulativní bilancí. Skutečnost, že albumin nesplňuje parametry ideálního infuzního roztoku (viz výše), je třeba vnímat v kontextu rizika možných alternativ – krystaloidů, syntetických koloidů či krevní plazmy. V neposlední řadě hovoří v neprospěch albuminu i vyšší ekonomická nákladnost spojená s jeho podáním.
Obr. 3. Distribuce náhradních roztoků dle jejich typů. 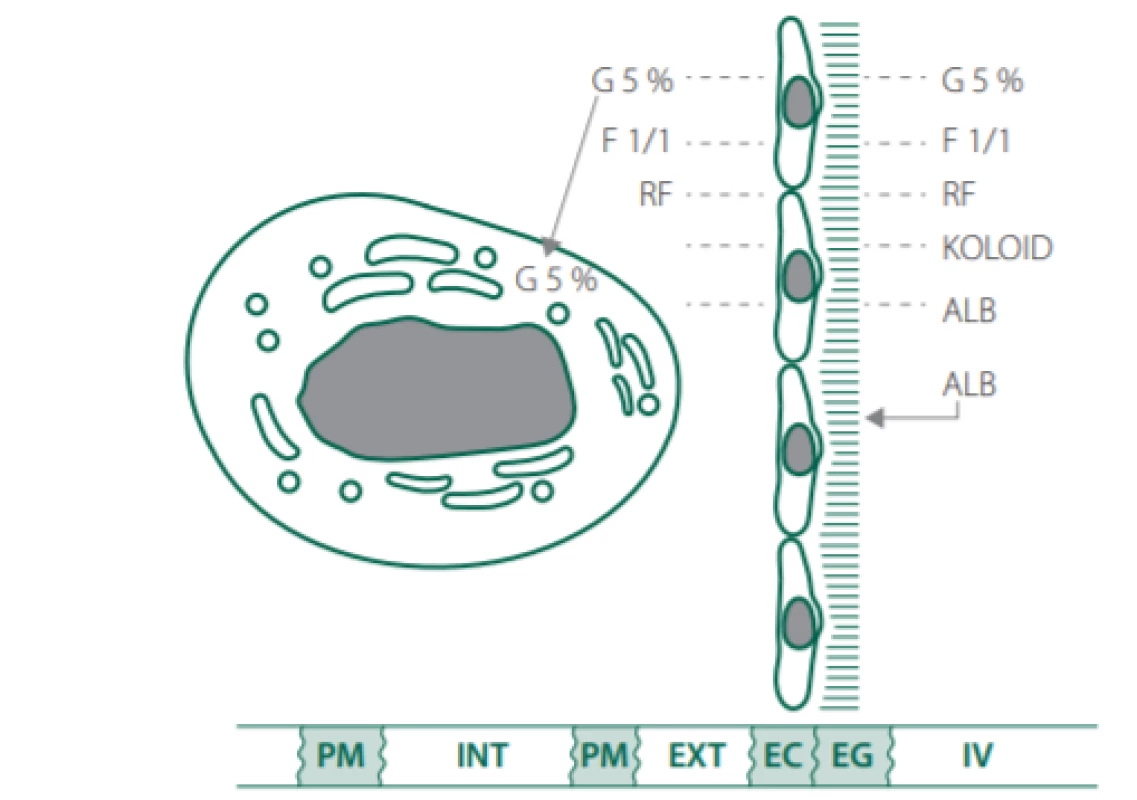
Vysvětlivky:
G 5% – roztok 5% glukózy, F 1/1 – fyziologický roztok, RF – Ringerfundin, ALB – albumin, PM – plazmatická membrána, INT – intracelulární prostor, EXT – extracelulární prostor, EC – endoteliální buňky, EG – endoteliální glykokalyx, IV – intravaskulární prostor.Sepse a septický šok
Sepse je definována jako život ohrožující stav, který vzniká reakcí těla hostitele na infekci a která vede k poškození tkání a orgánů. Přestože je role albuminu u pacientů v sepsi zatím nejasná [21], někteří autoři zdůrazňují přínos jeho použití i pro imunomodulační a antioxidativní vlastnosti [22], zejména u pacientů s jaterní cirhózou [13]. Albumin má stabilizující efekt na kapilární membránu a renální funkce a je považován za přínosný ve fázi tekutinové optimalizace při nízké hladině albuminu [23]. Přestože první metaanalýzy tomu nenasvědčovaly, albumin podávaný pacientům v kritickém stavu signifikantně zvyšuje přežití [24] a je zařazen do možností iniciální objemové resuscitace v mezinárodních doporučeních [25]. Vedle krystaloidních roztoků je albumin koloidním roztokem první volby s ohledem na jeho koloidně osmotický efekt (slabé doporučení s nízkou úrovní důkazů). Lze ho použít i jako preferovaný náhradní koloidní roztok, pokud je nutnost vysokých dávek roztoků krystaloidních. Předpokládá se totiž, že albumin setrvá delší dobu intravaskulárně, a tedy delší dobu plní objemovou funkci a nezvyšuje intersticiální otok. Naopak, albumin napomáhá správné funkci kapilární bariéry a EG [26] a ve srovnání se syntetickými koloidy nevykazuje riziko nefrotoxicity [27]. Pozitivním vlivem na EG může albumin přispívat ke stabilizaci endotelu a snížení známek syndromu zvýšené propustnosti kapilár, který je nejčastěji pozorován právě u sepse. V léčbě idiopatické formy syndromu (Clarksonova choroba) nejsou jednoznačná doporučení pro využití albuminu vzhledem k omezeným datům z literatury a vzácnosti onemocnění [28].
Popáleniny
Popáleniny vedou k rozvoji traumatického šoku a systémové zánětlivé odpovědi. Významnou roli hrají makrofágy produkované cytokiny (TNFa, IL-6, prozánětlivě působící prostaglandiny a bradykinin) a oxidační stres [29]. Na buněčné úrovni dochází k apoptóze endoteliálních buněk, poškození tzv. těsných spojů (tight junctions) a poškození EG, což vede ke ztrátě bariérové funkce kapilár. Zvýšená permeabilita kapilár je největší za 8 hodin po popáleninovém traumatu a přetrvává více než 48 hodin [30]. Pokud je rozsah popálenin větší než 25 % tělesného povrchu, dochází ke zvýšení vaskulární permeability také ve zdravé tkáni [31]. Podání albuminu v akutní fázi popáleninového traumatu snižuje filtrační tlak napříč kapilárou, intersticiální edém (i v nepostižených místech) a snižuje celkové množství podaných tekutin [32]. Další možnou využitelnou biologickou funkcí albuminu je jeho antioxidativní působení, přestože pro tuto indikaci zatím není dostatek důkazů umožňující formulovat jednoznačná doporučení do klinické praxe. Podávání albuminu po resuscitační fázi léčby popálenin není v literatuře prakticky zkoumáno, a tedy by se mělo řídit principy obecné intenzivní péče.
Použití albuminu mimo tekutinovou terapii (vybrané klinické syndromy a nosologické jednotky)
Jaterní selhání
Pacient s akutním, nebo akutně zhoršeným chronickým selháním jater (např. dekompenzace cirhózy), má typické klinické příznaky: jaterní encefalopatie, koagulopatie (snížená hladina koagulačních faktorů a trombocytopatie), ikterus a hypoalbuminemie spojená s otoky a tvorbou ascitu. U pacientů s cirhózou se navíc můžeme setkat i s dalšími typickými syndromy (např. refrakterní ascites, hepatorenální syndrom, spontánní bakteriální peritonitida). U těchto pacientů představuje exogenní substituce albuminem náhradu jeho fyziologických biologických funkcí. Bylo opakovaně prokázáno delší přežití při podávání albuminu u pacientů se spontánní bakteriální peritonitidou a po velkoobjemových paracentézách. V kombinaci s vazopresorem může být albumin prospěšný u pacientů s hepatorenálním syndromem [33].
Syndrom akutní dechové tísně dospělých
Syndrom akutní dechové tísně dospělých (ARDS, Acute Respiratory Distress Syndrome) je způsoben zánětem alveolo‑kapilární membrány a následným zvýšením její permeability v důsledku plicního nebo mimoplicního inzultu. Zvýšení permeability membrány vede k extravazaci tekutiny bohaté na proteiny do alveolů a vzniku plicního edému, přičemž se snižuje proteinemie a albuminemie v plazmě. Jak nízká absolutní hladina albuminu, tak její pokles jsou silným nezávislým prediktorem rozvoje ARDS a jeho závažnosti. Dynamika poklesu albuminu (až pod 20 g/l) je pozitivně asociována se zvyšující se tíží ARDS [34]. Hladina albuminu může tak být využita jako doplňující informace v diagnostice a monitoraci vývoje onemocnění. Výhodou sériového měření albuminu jako biomarkeru vývoje ARDS oproti sledování změn poměru PaO2 /FI O2 nebo změn obrazu plic na rentgenovém snímku je, že není přímo ovlivněn umělou plicní ventilací a nastavením ventilátoru. Obecně přijímanou a prokázanou léčebnou strategií u ARDS je restriktivní tekutinový režim [35]. Podání albuminu pomáhá udržet adekvátní cirkulující objem krve a zlepšuje oběhovou toleranci diuretické léčby. Infuze 25% albuminu (100 ml po dobu 30 minut každých 8 hodin po dobu 3 dnů) následovaná podáním furosemidu vede k významné redukci tělesné hmotnosti a zlepšení oxygenace v prvních 48 hodinách ve srovnání s placebem nebo samotným furosemidem u pacientů s hypoproteinemií a ARDS [36]. Pozorovaný efekt vysvětluje i zmírnění oxidačního stresu a zánětu. Vliv na mortalitu, dobu umělé plicní ventilace a dobu pobytu na jednotce intenzivní péče nebyl prokázán. Metaanalýza a systematický přehled použití albuminu v léčbě ARDS z roku 2014 [37] konstatuje absenci vlivu albuminu na mortalitu a zlepšení oxygenace v prvních 48 hodinách. Albumin nelze považovat za standardní součást léčby ARDS, ale je možné zvážit jeho využití v kombinaci s furosemidem u pacientů s hypoalbuminemií k dosažení kontroly tekutinové bilance.
Použití albuminu v neonatologii
Hladina albuminu u novorozenců je výrazně závislá na gestačním stáří a pohybuje se od 20 g/l u novorozenců narozených mezi 27. a 30. týdnem až po 30 g/l u zralých novorozenců. U kriticky nemocných novorozenců jsou nejčastějšími mechanismy vzniku hypoalbuminemie: nízká syntéza v důsledku nezralosti, malnutrice, jaterního selhání a imunního hydropsu, zvýšené ztráty krvácením, exsudací, při nefrotickém syndromu a enteropatii spojené se ztrátou proteinů, redistribuce albuminu do extravaskulárního kompartmentu při zvýšené kapilární propustnosti u sepse a jiných zánětlivých stavů. Podobně jako u dospělých byl prokázán vztah mezi hypoalbuminemií a mortalitou [38]. Existuje také asociace mezi hladinou albuminu a tíží onemocnění, jako je syndrom respirační tísně, nekrotizující enterokolitida a sepse [39]. Nízká hladina albuminu per se však není příčinou zvýšené mortality a morbidity, ale jen ukazatelem tíže onemocnění. Nebylo prokázáno, že substituce albuminu má vliv na klinický výsledek při léčbě výše uvedených stavů. Podobně rutinní substituce albuminu u předčasně narozených novorozenců nijak neovlivňuje jakýkoli klinicky výsledek [40]. Substituce albuminu může být zvážena u stavů spojených s vysokými ztrátami, jako je významný chylothorax, stomie s vysokým výdejem nebo těžký vrozený nefrotický syndrom [39]. Udržení optimální hladiny albuminu je důležité v léčbě závažné hyperbilirubinemie, kde albumin váže nekonjugovaný bilirubin a snižuje tak riziko poškození mozku. Albumin je někdy používán jako koloidní substituční roztok při tekutinové resuscitaci, ačkoli neexistují přesvědčivé důkazy pro jeho lepší účinek oproti roztokům krystaloidním.
Traumatické poškození mozku
Cílem tekutinové strategie u pacientů s traumatem mozku (TBI, Traumatic Brain Injury) je udržení adekvátního průtoku krve mozkem (CBF), jako jednoho z hlavních předpokladů zajištění adekvátní dodávky kyslíku. Na rozdíl od nemocných bez poranění mozku je klíčovým faktorem ovlivňujícím efekt podaných tekutin jejich tonicita na straně jedné a integrita hematoencefalické bariéry (HEB) na straně druhé. Intaktní HEB je pro elektrolyty i albumin neprostupná a voda (tedy i objem) následuje koncentrace iontů. Narušená HEB, například u perifokálního edému mozku, pak tuto neprostupnost pro elektrolyty i albumin ztrácí. V porovnání se systémovou hemodynamikou jsou způsoby monitorace efektu podaných tekutin a CBF méně dostupné, invazivnější, technicky náročnější a hodnocení naměřených veličin komplexnější [41]. Podání albuminu u pacientů s (TBI) a nitrolební hypertenzí bylo součástí tzv. Lund concept zaměřeného na regulaci nitrolebního objemu. Terapeutickým cílem bylo obnovení normálního plazmatického koloidně‑osmotického tlaku s předpokladem absorpce tekutin z intersticiálního prostoru přes HEB neprostupnou pro albumin [42]. Aplikace konceptu v jeho původním pojetí však nebyla do rutinní praxe adoptována, jakkoliv část konceptu měla silný racionální podklad.
Post‑hoc analýza 460 pacientů s TBI zahrnutých ve studii SAFE ukázala významný nárůst mortality pacientů léčených albuminem v porovnání s 0,9% NaCl po dvou letech od randomizace. Příčina negativního vlivu albuminu na přežití je spojována se zvýšením nitrolebního tlaku (ICP) a nižší osmolaritou použitého 4% albuminu v porovnání s 0,9% NaCl v kontrolní skupině [43]. Aktuální stav poznání, zejména citované post‑hoc analýzy studie SAFE, neumožňují doporučit použití albuminu u pacientů s TBI, zejména v prvním týdnu po úrazu. Ve zvláštních případech jiné souběžné indikace jeho podání je racionální vyhnout se použití 4% nebo 5% roztoků a důsledně dbát o udržení adekvátní osmolarity séra.
Albumin v prevenci akutního renálního poškození
Subanalýza studie ALBIOS [44] ukázala v podskupině pacientů se septickým šokem, že podání albuminu bylo spojeno s rychlejším zvratem šoku, nižší pozitivitou tekutinové bilance, v potřebě náhrady funkce ledvin rozdíly nalezeny nebyly. Přesto existuje řada argumentů, které naznačují potenciální nefroprotektivní efekt podání albuminu, jako je např. zlepšení mikrocirkulace nebo obnovení integrity endoteliálního glykokalyxu [45]. Hypoalbuminemie představuje rizikový faktor pro rozvoj akutního renálního poškození [46], zvyšuje riziko toxicity nefrotoxických farmak, např. amikacinu [11]. Substitucí albuminu podpořená redukce pozitivní tekutinové bilance představuje rovněž biologicky dostatečně plauzibilní možný mechanismus ochrany ledvin pacientů v kontextu kritických stavů a vysoké pozitivity bilance tekutin [47].
Ovariální hyperstimulační syndrom
Ovariální hyperstimulační syndrom (OHSS) je komplikace vznikající v průběhu léčby neplodnosti. OHSS může být provázen vznikem generalizované poruchy propustnosti kapilár s anasarkou. V patofyziologii závažných forem hraje klíčovou roli zvýšená produkce vazoaktivních látek (např. vaskulárního endoteliálního růstového faktoru) stimulovanými ovarii. OHSS může vyústit až v renální a respirační selhání. Albumin v profylaktickém podání s jinými koloidními roztoky (HES, manitol), případně proti placebu, nevedl k jednoznačným výsledkům [48]. Nevýhodou použití albuminu je výrazně nižší úspěšnost početí. Zvyšování koloidního tlaku podáním albuminu má význam jen pro sní ‑ žení filtrace skrz kapilární bariéru, podle revidovaného Frank‑Starlingova principu. Přesnější doporučení nelze pro tuto konkrétní klinickou situaci formulovat.
Albumin a postupy mimotělní podpory orgánových funkcí
Mimotělní oběh a speciální postupy u kardiochirurgických pacientů
Podání albuminu u mimotělního oběhu (ECC, Extracorporeal Circulation) má za cíl minimalizaci hemodiluce, převodů erytrocytárních koncentrátů, udržení koloidně‑osmotického tlaku plazmy a minimalizaci vlivu na hemostázu. U dětí byl prokázán přínos podání albuminu do náplně ECC [49]. U dospělých byl prokázán příznivý vliv na pooperační glomerulární filtraci [50]. Rutinní použití zmiňovaného postupu však doporučováno není.
Další klinickou situací v kardiochirurgii v perioperačním období je problematika nemocných s vysokým pooperačním stupněm SIRS s multiorgánovou dysfunkcí, nízkou cévní rezistencí a oxygenační poruchou, kdy je současně nutné udržet vysoký efektivní cirkulující volum k zajištění adekvátního srdečního výdeje, kdy se ukazuje, že podání albuminu může zkrátit dobu do vysazení vazoaktivní podpory a předejít výrazně pozitivní tekutinové bilanci [51]. Zcela specifickou situací použití 20% roztoku albuminu je hyperkinetická cirkulace se vznikem dynamické obstrukce výtokového traktu předním cípem mitrální chlopně se současně vzniklou mitrální regurgitací a plicním edémem, zde je albumin podáván pro maximální objemový efekt v kombinaci s ostatními postupy léčby těchto pacientů.
Orgánová podpora typu ECMO (Extracorporeal Membrane Oxygenation, mimotělní membránová oxygenace), je stále častěji používanou metodou v kardiochirurgii u nemocných s obtížným odpojením od ECC či postkardiotomickým syndromem, ale i v řadě jiných stavů v intenzivní péči, kde konvenční metody zajištění ade ‑ kvátní oxygenace orgánů nestačí. S narůstající dobou užití ECMO roste riziko mnoha komplikací. Použitím albuminu v okruhu lze snížit riziko vzniku konzumpční koagulopatie a krvácivých komplikací [52]. Albumin má též své místo při velkém riziku toxického vlivu farmak vázaných na bílkoviny při hemodiluci předplněním ECMO a u syndromu zvýšené propustnosti kapilár v souvislosti s ECMO [53]. Popsán je též pozitivní vliv na přežití při tekutinové resuscitaci s albuminem u pacientů s ECMO [54].
Plazmaferéza
Terapeutická plazmaferéza je mimotělní očišťovací metoda, jejímž principem je odstranění součástí plazmy způsobujících onemocnění (nejčastěji protilátky). Existuje několik modalit plazmaferézy: výměna plazmy, plazmaferéza s dvojitou filtrací (DFPP) a adsorpce plazmy (nedochází ke ztrátám plazmy). Výběr substitučního roztoku se řídí použitou metodou plazmaferézy a léčenou patologií, respektive složkou krevní plazmy, která je za danou patologii zodpovědná. U výměny plazmy se jako substituční roztok používá plazma anebo albumin, u DFPP, kde jsou selektivní ztráty především albuminu, je preferována substituce albuminem samotným [55]. Výhodou podání 4–5% albuminu, jako substitučního roztoku, je minimální riziko přenosu infekce a alergické reakce, jednoduché skladování a dostupnost. Nevýhodou je izolovaná substituce albuminu a riziko diluční koagulopatie.
Albuminová dialýza
Další eliminační metodou, kde lze využít albumin, je hemodialýza využívaná u pacientů s jaterním selháním pro překlenutí doby ke spontánní regeneraci jater nebo transplantaci. Je to dosud nejlépe prostudovaná mimotělní nebiologická náhrada jaterních funkcí. Principem metody (v různých dalších modifikacích, např. MARS, Prometheus atd.) je difuze molekul z krve pacienta do dialyzátu a absorpce na plně funkční lidský albumin. Metoda je vysoce efektivní pro snížení koncentrace bilirubinu a zlepšení symptomů jaterní encefalopatie, méně efektivní pro snížení amoniaku a žlučových kyselin. Celkové přežití ovšem významně nezvyšuje [56].
Závěr
Racionální a z hlediska medicíny založené na důkazech (EBM) je využití albuminu v klinické medicíně nadále spojeno s řadou nezodpovězených otázek. Jakkoliv existuje z pohledu metod EBM slabá evidence pro argumentaci podání albuminu s ohledem na mortalitní data, vybrané biologické vlastnosti a vysoká bezpečnost jeho podání umožňují pova ‑ žovat albumin v kontextu objemové náhrady za ideální koloid, pokud chceme jeho koloidně‑osmotického efektu v konkrétní individuální klinické situaci využít. Narůstající objem znalostí o tzv. „ne‑onkotických“ vlastnostech albuminu naznačuje řadu dalších oblastí jeho potenciálního využití v příštích letech.
PROHLÁŠENÍ AUTORŮ:
Prohlášení o původnosti: Práce je původní, nebyla publikována ani nebyla zaslána k recenznímu řízení do jiného média.
Střet zájmů: AD uvádí honorovanou přednáškovou činnost pro CSL Behring, s. r. o., ČV uvádí honorovanou přednáškovou činnost pro Fresenius Kabi, s. r. o., CSL Behring, s. r. o., Abbvie, s. r. o., Baxter Czech, spol. s r. o., Bard Czech Republic spol s r.o.
Podíl autorů: Všichni autoři rukopis četli, souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. AD: sezval autorský tým, připravil metodiku a osnovu rukopisu, podílel se na sepsání rukopisu, provedl finální revizi rukopisu. PJ, ŠJ, BJ, NJ, MM, TZ, BJ: podíleli se na sepsání rukopisu. ČV: podílel se na přípravě osnovy rukopisu, sepsání rukopisu, sepsání úvodu a závěru.
Financování: Práce vznikla bez finanční podpory. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena všemi autory
KORESPONDENČNÍ ADRESA AUTORA:
Článek přijat redakcí: 25. 2. 2020; Článek přijat k tisku: 11. 5. 2020; Cit. zkr: Anest intenziv Med. 2020; 31(3): 96–102
MUDr. David Astapenko, Ph.D.,
Zdroje
1. Vincent JL. Relevance of albumin in modern critical care medicine. Best Pract Res Clin Anaesthesiol. 2009; 23(2): 183–191.
2. Vincent J‑L, Russell JA, Jacob M, Martin G, Guidet B, Wernerman J, et al. Albumin administration in the acutely ill: what is new and where next? Crit Care BioMed Central Ltd. 2014; 18(4): 231.
3. Quinlan GJ, Martin GS, Evans TW. Albumin: Biochemical properties and therapeutic potential. Hepatology 2005; 41(6): 1211–1219.
4. Waijer SW, Gansevoort RT, Heerspink HJL. Change in albuminuria as a surrogate endpoint. Curr Opin Nephrol Hypertens 2019; 28(6): 519–526.
5. Artigas A, Wernerman J, Arroyo V, Vincent JL, Levy M. Role of albumin in diseases associated with severe systemic inflammation: Pathophysiologic and clinical evidence in sepsis and in decompensated cirrhosis. J Crit Care 2016; 33 : 62–70.
6. Delgado‑Rodríguez M, Cuadros MM, Ortega AG, Galego‑Martínez G, Mariscal‑Ortiz M, Martinez‑Gonzalez MA, et al. Cholesterol and serum albumin levels as predictors of cross infection, death, and length of hospital stay. Arch Surg American Medical Association 2002; 137(7): 805–812.
7. Bascom JU, Gosling P, Zikria BA. Hypoalbuminemia, surgical leak, and clinical capillary leak syndrome. Arch Surg 2000; 135(1): 95.
8. Vink H, Duling BR. Capillary endothelial surface layer selectively reduces plasma solute distribution volume. Am J Physiol Heart Circ Physiol 2000; 278(1): H285–H289.
9. Mitzner S, Stange J, Klammt S, Peszinsky P, Hickstein H, Korten G, et al. Albumin‑bound substances‑a new target in liver failure therapy. Z Gastroenterol 2001; 39(Suppl 2): 6–7.
10. Dasgupta A. Usefulness of monitoring free (unbound) concentrations of therapeutic drugs in patient management. Clin Chim Acta 2007; 377(1–2): 1–13.
11. Contreras AM, Ramírez M, Cueva L, Alvarez S, de Loza R, Gamba G. Low serum albumin and the increased risk of amikacin nephrotoxicity. Rev Invest Clin 1994; 46(1): 37–43.
12. Stamler JS, Jaraki O, Osborne J, Simon DI, Keaney J, Vita J, et al. Nitric oxide circulates in mammalian plasma primarily as an S‑nitroso adduct of serum albumin. Proc Natl Acad Sci U S A 1992; 89(16): 7674–7677.
13. Arroyo V, García‑Martinez R, Salvatella X. Human serum albumin, systemic inflammation, and cirrhosis. J Hepatol 2014; 61(2): 396–407.
14. Pathirana S, Wong G, Williams P, Yang K, Kershaw G, Dunkley S, et al. The effects of haemodilution with albumin on coagulation in vitro as assessed by rotational thromboelastometry. Anaesth Intensive Care 2015; 43(2): 187–192.
15. Fransson F, Kyrk T, Skagerlind M, Stegmayr B. Rinsing the extra corporeal circuit with a heparin and albumin solution reduces the need for systemic anticoagulant in hemodialysis. Int J Artif Organs 2013; 36(10): 725–729.
16. Montomoli J, Donati A, Ince C. Should Albumin be the Colloid of Choice for Fluid Resuscitation in Hypovolemic Patients? Annual Update in Intensive Care and Emergency Medicine 2019 : 277–292.
17. Tabor E. The epidemiology of virus transmission by plasma derivatives: Clinical studies verifying the lack of transmission of hepatitis B and C viruses and HIV type 1. Transfusion. 1999; 39(11–12): 1160–1168.
18. Fanali G, Masi A Di, Trezza V, Marino M, Fasano M, Ascenzi P. Human serum albumin: From bench to bedside. Mol Aspects Med. 2012; 33(3): 209–290.
19. Finfer S, Bellomo R, Boyce N, French J, Myburgh J, Norton R, et al. A Comparison of Albumin and Saline for Fluid Resuscitation in the Intensive Care Unit. N Engl J Med 2004; 350(22): 2247–2256.
20. Mårtensson J, Bihari S, Smith JB, Glassford NJ, Lloyd‑Donald P, Cioccari L, et al. Small volume resuscitation with 20 % albumin in intensive care: physiological effects The SWIPE randomised clinical trial. Intensive Care Med. 2018; 44(11): 1797–1806.
21. Winters ME, Sherwin R, Vilke GM, Wardi G. What is the Preferred Resuscitation Fluid for Patients with Severe Sepsis and Septic Shock? J Emerg Med 2017; 53(6): 928–939.
22. Gleeson MW, Dickson RC. Albumin gains immune boosting credibility. Clin Transl Gastroenterol American College of Gastroenterology 2015; 6(4): e86.
23. Malbrain MLNG, Regenmortel N Van, Saugel B, De Tavernier B, Van Gaal PJ, Joannes‑Boyau O, et al. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Ann Intensive Care SpringerOpen 2018; 8(1): 66.
24. Vincent J‑L, Navickis RJ, Wilkes MM. Morbidity in hospitalized patients receiving human albumin: a meta‑analysis of randomized, controlled trials. Crit Care Med 2004; 32(10): 2029–2038.
25. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med 2017; 43(3): 304–377.
26. Uchimido R, Schmidt EP, Shapiro NI. The glycocalyx: a novel diagnostic and therapeutic target in sepsis. Crit Care 2019; 23(1): 16.
27. Vincent JL, Backer D De, Wiedermann CJ. Fluid management in sepsis: The potential beneficial effects of albumin. J Crit Care 2016; 35 : 161–167.
28. Siddall E, Khatri M, Radhakrishnan J. Capillary leak syndrome: etiologies, pathophy ‑ siology, and management. Kidney Int 2017; 92(1): 37–46.
29. Santos F, Arroyo C, García I, Blasco R, Obispo JM, Hamann C, et al. Role of mast cells in the pathogenesis of postburn inflammatory response: reactive oxygen species as mast cell stimulators. Burns 2000; 26(2): 145–147.
30. Demling RH. The burn edema process: Current concepts. J Burn Care Rehabil 2005; 26(3): 207–227.
31. Vlachou E, Gosling P, Moiemen NS. Microalbuminuria: A marker of endothelial dysfunction in thermal injury. Burns 2006; 32(8): 1009–1016.
32. Goodwin CW, Dorethy J, Lam V, Pruitt Jr. BA. Randomized Trial of Efficacy of Crystalloid and Colloid Resuscitation on Hemodynamic Response and Lung Water Following Thermal Injury. Ann Surg 1983; 197(5): 520–531.
33. Paine CH, Biggins SW, Pichler RH. Albumin in Cirrhosis: More Than a Colloid. Curr Treat Options Gastroenterol. 2019; 17(2): 231–243.
34. Hoeboer SH, Oudemans‑van Straaten HM, Groeneveld ABJ. Albumin rather than C‑reactive protein may be valuable in predicting and monitoring the severity and course of acute respiratory distress syndrome in critically ill patients with or at risk for the syndrome after new onset fever. BMC Pulm Med BioMed Central 2015; 15 : 22.
35. National Heart, Lung and BIARDS (ARDS) CTN, Wiedemann HP, Wheeler AP, Bernard GR, Thompson BT, Hayden D, et al. Comparison of Two Fluid‑Management Strategies in Acute Lung Injury. N Engl J Med 2006; 354(24): 2564–2575.
36. Martin GS, Moss M, Wheeler AP, Mealer M, Morris JA, Bernard GR. A randomized, controlled trial of furosemide with or without albumin in hypoproteinemic patients with acute lung injury. Crit Care Med 2005; 33(8): 1681–1687.
37. Uhlig C, Silva PL, Deckert S, Schmitt J, de Abreu MG. Albumin versus crystalloid solutions in patients with the acute respiratory distress syndrome: a systematic review and meta‑analysis. Crit Care BioMed Central 2014; 18(1): R10.
38. Torer B, Hanta D, Yapakci E, Gokmen Z, Parlakgumus A, Gulcan H, et al. Association of Serum Albumin Level and Mortality in Premature Infants. J Clin Lab Anal John Wiley and Sons Inc. 2016; 30(6): 867–872.
39. Shalish W, Olivier F, Aly H, Sant’Anna G. Uses and misuses of albumin during resuscitation and in the neonatal intensive care unit. Semin Fetal Neonatal Med 2017; 22(5): 328–335.
40. Jardine LA, Jenkins‑Manning S, Davies MW. Albumin infusion for low serum albumin in preterm newborn infants. Cochrane database Syst Rev 2004; (3): CD004208.
41. Gantner D, Moore EM, Cooper DJ. Intravenous fluids in traumatic brain injury: what’s the solution? 2014; 385–389.
42. Nordström C‑H. Physiological and Biochemical Principles Underlying Volume‑Targeted Therapy - The „Lund Concept“. Neurocritical Care 2005; 2 : 83–95.
43. Cooper DJ, Myburgh J, Heritier S, Finfer S, Bellomo R, Billot L, et al. Albumin Resuscita ‑ tion for Traumatic Brain Injury: Is Intracranial Hypertension the Cause of Increased Mortality? 2013; 518 : 512–518.
44. Xu J‑Y, Chen Q‑H, Xie J‑F, Pan C, Liu SQ, Huang LW, et al. Comparison of the effects of albumin and crystalloid on mortality in adult patients with severe sepsis and septic shock: a meta‑analysis of randomized clinical trials. Crit Care BioMed Central 2014; 18(6): 702.
45. Jacob M, Paul O, Mehringer L, Chappell D, Rehm M, Welsch U, et al. Albumin Augmentation Improves Condition of Guinea Pig Hearts After 4 hr of Cold Ischemia. Transplantation 2009; 87(7): 956–965.
46. Wiedermann CJ, Wiedermann W, Joannidis M. Hypoalbuminemia and acute kidney injury: a meta‑analysis of observational clinical studies. Intensive Care Med 2010; 36(10): 1657–1665.
47. Wiedermann CJ, Joannidis M. Nephroprotective Potential of Human Albumin Infusion: A Narrative Review. Gastroenterol Res Pract 2015; 2015 : 912839.
48. Youseff MA, Mourad S. Volume expanders for the prevention of ovarian hyperstimulation syndrome. Cochrane Database of Systematic Reviews 2016; 8: CD001302.
49. Patel J, Prajapati M, Solanki A, Pandya H. Comparison of albumin, Hydroxyethyl starch and ringer lactate solution as priming fluid for cardiopulmonary bypass in paediatric cardiac surgery. J Clin Diagnostic Res Journal of Clinical and Diagnostic Research 2016; 10(6): UC01–UC04.
50. Maleki MH, Derakhshan P, Sharifabad AR, Amouzeshi A. Comparing the effects of 5% albumin and 6% hydroxyethyl starch 130/0.4 (Voluven) on renal function as priming solutions for cardiopulmonary bypass: A randomized double blind clinical trial. Anesthesiol Pain Med Kowsar Medical Publishing Company 2016; 6(1): 1–6.
51. Wigmore GJ, Anstey JR, St John A, Greaney J, Morales‑Codina M, Presneill JJ, et al. 20% Human Albumin Solution Fluid Bolus Administration Therapy in Patients After Cardiac Surgery (the HAS FLAIR Study). J Cardiothorac Vasc Anesth 2019; 33(11): 2920–2927.
52. Sangalli F, Patroniti N, Pesenti A. ECMO‑Extracorporeal Life Support in Adults. 2014. Springer [on‑line] [cit. 2019]. Dostupné z: https://www.springer.com/gp/book/9788847054264.
53. Dzierba AL, Abrams D, Brodie D. Medicating patients during extracorporeal membrane oxygenation: The evidence is building. Critical Care 2017 [on‑line]. BioMed Central Ltd. 2017.
54. Wengenmayer T, Schroth F, Biever PM, Duerschmied D, Benk Ch, Trummer G, et al. Albumin fluid resuscitation in patients on venoarterial extracorporeal membrane oxygenation (VA‑ECMO) therapy is associated with improved survival. Intensive Care Med. 2018; 44(12): 2312–2314.
55. Nakanishi T, Suzuki N, Kuragano T, Nagasawa Y, Hasuike Y. Current topics in therapeutic plasmapheresis. Clin Exp Nephrol 2014; 18(1): 41–49. 56. Tsipotis E, Shuja A, Jaber BL. Albumin Dialysis for Liver Failure: A Systematic Review. Adv Chronic Kidney Dis 2015; 22(5): 382–390.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2020 Číslo 3- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Sedace v intenzivní péči – část II. Monitorování hloubky sedace v intenzivní péči pomocí analýzy EEG
- Význam hyperbarické medicíny a současná doporučení u vybraných akutních indikací v urgentní medicíně a intenzivní péči
- Dárcovství orgánů po nevratné zástavě oběhu: Jak na to?
- Doporučení pro tzv. off‑label použití léčivých přípravků pro pacienty s COVID-19
- Opomíjená příčina reverzibilní anizokorie – jednostranné mydriázy
- Zajištění dýchacích cest u pacientů s COVID-19
- Syndrom akutní dechové tísně spojený s kouřením elektronických cigaret
- Rezistence na diuretika
- Zajímavosti, tipy a triky, informace z jiných oborů
- Třicet let časopisu – čas na změnu
- Metamizol – 100 let od objevu
- Fasciální prostory trupu ve vztahu k regionální anestezii – část druhá: lumbální oblast
- Použití albuminu v perioperační a intenzivní medicíně
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Opomíjená příčina reverzibilní anizokorie – jednostranné mydriázy
- Použití albuminu v perioperační a intenzivní medicíně
- Doporučení pro tzv. off‑label použití léčivých přípravků pro pacienty s COVID-19
- Zajištění dýchacích cest u pacientů s COVID-19
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



