-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akutní srdeční selhání a časný rozvoj dysfunkce levé komory u pacientů s akutním infarktem myokardu s elevacemi ST léčených primární perkutánní koronární intervencí
Acute heart failure and early development of left ventricular dysfunction in patients with ST segment elevation acute myocardial infarction managed with primary percutaneous coronary intervention
Background:
Acute heart failure during ST elevation myocardial infarction (STEMI) makes worse prognosis. The aim of the work was to find independent factors with relationship to acute heart failure (AHF) and the early development of left ventricular dysfunction within the prospective followed patients with STEMI.Methods:
A total of 593 patients with STEMI treated by primary PCI (164 patients with AHF) were the study population. The activity of BNP and NT ‑ ProBNP were measured at hospital admission and 24 h after MI onset. Left ventricular angiography was done before PCI; echocardiography was undertaken between the third and fifth day after MI.Results:
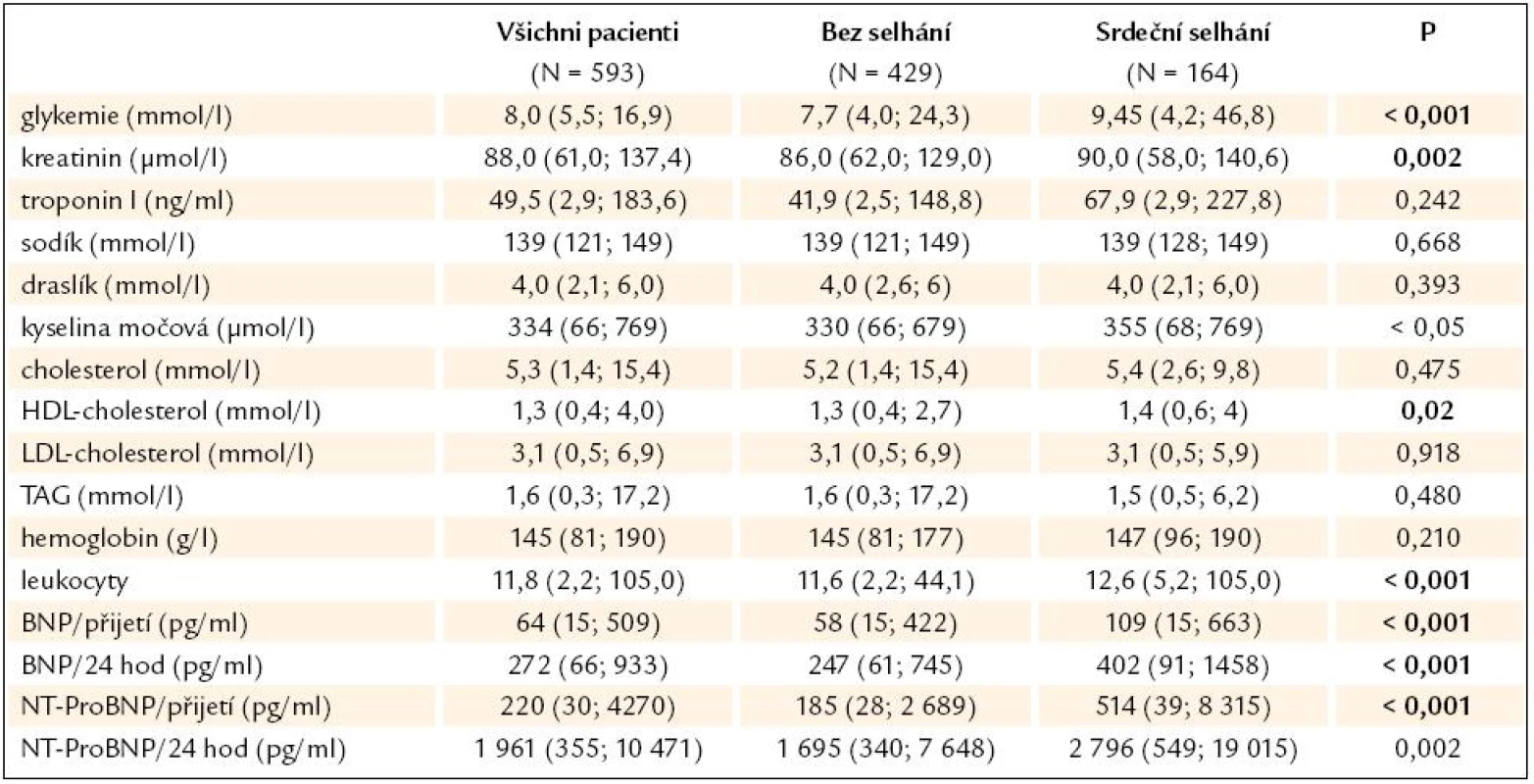
The patients with AHF had higher level of glycaemia, creatinine, uric acid, HDL‑cholesterol, leukocytosis and natriuretic peptid. The total hospital mortality was 3.7%. 0.2% within the patients without AHF, 3.2%, 14.3%, resp. 63.6% within the patients with mild AHF, with pulmonary oedema, resp. with cardiogenic shock. The patients with AHF had lower ejection fraction (45.4 ± 11.9% vs 53.0 ± 10.3%). According to the multiple logistic regression we found higher glycaemia, age, heart rate, anterior wall MI, lower aortic pulse pressure and collaterals of infarct related artery as factors with independent relationship to AHF. Higher glycaemia, age, heart rate, anterior wall MI and lower aortic pulse pressure were found as independent factors with relationship to left ventricular dysfunction. According to ROC analysis possible cut off corresponding with AHF we suggested 29.5 mm Hg for LVEDP, 28.5 for dP/ dt/ P, 9.5 mmol/ l for glycaemia, 50 mm Hg for aortic pulse pressure.Conclusions:
Our results found the development of AHF in one third of patients with STEMI. AHF increases the risk of in‑hospital mortality and the risk depends upon severity of failure. As the independent factors with relationship to development of AHF or left ventricular dysfunction we detected higher glycaemia, heart rate, anterior wall MI, age. Lower risk had patients with higher aortic pulse pressure.Key words:
STEMI – primary PCI – acute heart failure – left ventricular dysfunction
Autoři: J. Pařenica 1; P. Kala 1; Jiří Jarkovský 2
; M. Poloczek 1; O. Toman 1; M. Pávková Goldbergová 3; J. Maňoušek 1; K. Prymusová 4; L. Kubková 1; M. Tesák 1; L. Elbl 1; Z. Čermáková 5; J. Špinar 1
Působiště autorů: Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MU Dr. Jindřich Špinar, CSc., FESC 1; Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty MU Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 2; Ústav patologické fyziologie Lékařské fakulty MU Brno, přednostka prof. MU Dr. Anna Vašků, CSc. 3; Kardiologické oddělení Nemocnice Podlesí a. s., přednosta prim. MU Dr. Marian Branny 4; Oddělení klinické biochemie a hematologie FN Brno, pracoviště Bohunice, přednosta doc. MU Dr. Milan Dastych, CSc. 5
Vyšlo v časopise: Vnitř Lék 2011; 57(1): 43-51
Kategorie: Původní práce
Souhrn
Úvod:
Akutní srdeční selhání (ASS) u pacientů s infarktem myokardu s elevacemi ST (STEMI) významně zhoršuje krátkodobou i dlouhodobou prognózu. Cílem práce je v prospektivně sledované skupině pacientů se STEMI zjistit nezávislé faktory spojené se vznikem akutního srdečního selhání a časného rozvoje dysfunkce levé komory.Metodika:
Celkem bylo vyhodnoceno 593 pacientů se STEMI léčených primární perkutánní koronární intervencí (PCI), z toho 164 pacientů mělo projevy ASS. BNP (brain natriuretic peptid) a NT ‑ proBNP (N‑terminal pro brain natriuretic peptid) byly stanoveny při přijetí a 24 hod od vzniku IM. U všech pacientů byla před primární PCI provedena levostranná ventrikulografie, echokardiografické vyšetření bylo provedeno 3. – 5. den.Výsledky:
Pacienti se selháním měli při přijetí vyšší hladinu glykemie, kreatininu, kyseliny močové, HDL‑cholesterolu, vyšší počet leukocytů a vyšší hladiny natriuretických peptidů. Celková hospitalizační mortalita byla 3,7 %, ve skupině pacientů bez selhání byla mortalita 0,2 %, při mírném srdečním selhání 3,2 %, při plicním edému 14,3 % a pacienti v kardiogenním šoku měli mortalitu 63,6 %. Ejekční frakce pacientů bez selhání byla 53,0 ± 10,3 %, pacientů se selháním 45,4 ± 11,9 %. Podle vícerozměrné logistické regrese patří mezi faktory, které nezávisle ovlivňují riziko rozvoje ASS a dysfunkce levé komory (EF ≤ 40 % dle echokardiografie) zvýšená glykemie při přijetí, infarkt přední stěny, vyšší věk a vyšší tepová frekvence, naopak snížené riziko představuje vyšší hodnota pulzního tlaku. Nižší riziko rozvoje ASS představují rovněž již vytvořené kolaterály infarktové tepny. Dle ROC analýzy jsme určili možné cut off hodnoty pro end‑diastolický tlak v levé komoře (LVEDP) odpovídající ASS v akutní fázi IM nad 29,5 mm Hg, pro dP/ dt/ P (vyjadřující inotropní sílu LK) pod 28,5, pro glykemii při přijetí > 9,5 mmol/ l, pro centrální pulzní tlak < 50 mm Hg.Závěr:
ASS se rozvíjí u necelé 1/ 3 pacientů se STEMI. Rozvoj ASS představuje vysoké riziko hospitalizační mortality, která narůstá s tíží srdečního selhání. Jako nezávislé faktory se vztahem ke vzniku ASS nebo dysfunkce levé komory jsme identifikovali zvýšenou glykemii při přijetí, infarkt přední stěny, věk, zvýšenou tepovou frekvenci. Nižší riziko mají pacienti se zachovaným vyšším pulzním tlakem.Klíčová slova:
STEMI – primární PCI – akutní srdeční selhání – dysfunkce levé komoryÚvod
V České republice je hospitalizováno pro akutní koronární syndrom (AKS) 33 000 – 36 000 pacientů ročně [1]. Z toho je asi 6 500 – 7 500 pacientů s akutním infarktem s elevacemi ST (STEMI) léčených primární perkutánní koronární intervencí (PCI). Díky komplexní péči, která zahrnuje propracovaný systém Rychlé zdravotnické pomoci s telefonickým přenosem EKG do kardiocenter, přímý transfer pacientů se STEMI přímo na katetrizační sál, síť kardiologických center s katetrizačními laboratořemi s 24hodinovou pohotovostí umožňující revaskularizační léčbu akutního infarktu myokardu pomocí primární PCI a farmakologickou léčbu, je hospitalizační mortalita nízká. Dle Národního registru koronárních intervencí (NRKI) je hospitalizační mortalita pacientů se STEMI 6,9 %, podle amerického národního registru infarktů myokardu (National Registry of Myocardial Infarction – NRMI) je to asi 5,7 % [2]. Závažným problémem u pacientů po akutním infarktu myokardu zůstává rozvoj dysfunkce levé komory. Dysfunkce levé komory vede ke vzniku chronického srdečního selhání, zhoršení kvality života, opakovaným hospitalizacím pro akutní dekompenzaci chronického srdečního selhání a zvyšuje riziko náhlé smrti.
Cílem této práce je v homogenní prospektivně sledované skupině pacientů se STEMI léčených primární PCI zjistit nezávislé faktory spojené s rozvojem akutního srdečního selhání a časného rozvoje dysfunkce levé komory. Zároveň se pokusit stanovit hranici pro invazivně měřené parametry LVEDP a dP/ dt/ P, které by korelovaly s projevy akutního srdečního selhání v akutní fázi infarktu myokardu.
Pacienti a metodika
Pacienti
Od listopadu roku 2005 do října roku 2008 bylo referováno na Interní kardiologickou kliniku FN Brno celkem 913 pacientů se STEMI, kteří byli léčeni primární PCI. Doba od vzniku bolestí na hrudi do provedení primární PCI byla < 12 hod. Pacienti byli léčeni standardní terapií včetně ACE inhibitorů, beta-blokátorů a statinů, které byly podány co nejdříve, většinou po primární PCI. Vylučovacími kritérii k zařazení do sledování byl věk nad 80 let (n = 112), známá nebo nově diagnostikovaná malignita, zánětlivé onemocnění nebo systémové onemocnění pojiva, předchozí známá dysfunkce levé komory, odhadovaná doba života pro jiné závažné onemocnění < 1 rok (n = 48), odmítnutí podepsání informovaného souhlasu nebo předpokládaná nespolupráce (n = 74), regionální příčiny (vzdálenost bydliště od Brna nad 100 km z důvodu dlouhodobého sledování pacientů; n = 35). Pouze 51 pacientů nebylo zařazeno z technických a organizačních důvodů. Celkem bylo vyhodnoceno 593 pacientů se STEMI. Všichni pacienti podepsali informovaný souhlas s účastí ve studii. Protokol studie byl schválen Etickou komisí Fakultní nemocnice Brno.
Diagnóza STEMI byla založena na symptomech s odpovídajícími EKG známkami akutní ischemie (ST elevace nebo nový blok levého Tawarova raménka) a elevací markerů myokardiální nekrózy (troponin I). Diagnóza akutního srdečního selhání byla stanovena při přijetí a/ nebo během hospitalizace (Killip I – IV). Mírné srdeční selhání bylo definováno jako plicní městnání s vlhkými chrůpky v dolní polovině plic a/ nebo srdeční gallop. Předchozí nestabilita byla definována jako projevy nestabilní anginy pectoris v posledním týdnu před IM.
Laboratorní metody
Vzorek žilní krve pro stanovení BNP a NT - ProBNP byl odebrán okamžitě při přijetí před primární PCI (vzorek 1), následující krevní vzorek byl odebrán přesně 24 hod od vzniku bolestí (vzorek 2). Vzorky byly okamžitě centrifugovány v chlazené centrifuze a plazma a sérum byly skladovány při – 80 °C. Standardní biochemické a hematologické vyšetření bylo provedeno při přijetí a 24 hod od vzniku bolestí na hrudi (včetně Troponinu - I ADSV, Abbott). BNP bylo analyzováno metodou AxSYM BNP – Microparticle Enzyme Immunoassay (Abbott Laboratories, Abbott Park, USA). NT - ProBNP bylo analyzováno metodou Cobas E411 NT - proBNP imunoassay (Roche Diagnostics, Indianapolis, USA).
Echokardiografické vyšetření
Echokardiografické vyšetření bylo provedeno během hospitalizace (3. – 5. den od vzniku IM). End-systolický objem levé komory (ESV), end-diastolický objem levé komory (EDV) a ejekční frakce levé komory (EF) byly stanoveny podle Simpsonovy biplanární metody z apikální pozice. Echokardiografické vyšetření bylo prováděno dvěma zkušenými echokardiografisty na přístrojích Vivid 7 nebo Vivid i (GE Vingmed Ultrasound).
Invazivní měření
Invazivně měřené parametry – centrální aortální systolický (SBP) a diastolický krevní tlak (DBP), end-diastolický tlak v levé komoře (LVEDP) a maximální dP/ dt/ P byly stanoveny před ventrikulografií levé komory použitím 5 Fr katétru pigtail u pacientů před primární PCI. Ejekční frakce byla stanovena podle ventrikulografie levé komory. Počet významně postižených tepen (Diseased coronary vessel – DCV) byl definován jako přítomnost minimálně 50% redukce intraluminálního průměru koronární tepny (kmen levé koronární tepny – LM, ramus interventricularis anterior – RIA, ramus circumflexus – RCx, pravá koronární tepna – RCA), nebo jejich hlavních větví s průměrem ≥ 2,0 mm. Významné zúžení kmene levé koronární tepny bylo kódováno jako postižení dvou tepen.
Statistická analýza
Kategoriální data jsou popsána procentuálním zastoupením kategorií, spojitá data průměrem a směrodatnou odchylkou v případě normálně rozložených dat a mediánem doplněným o 5 – 95 % kvantil u nenormálně rozložených dat. V případě použití parametrických testů byla nenormálně rozložená data před následnými analýzami logaritmicky transformována.
Změny v rámci jednotlivých pacientů byly testovány Wilcoxonovým párovým testem, rozdíly mezi dvěma skupinami pacientů Mann-Whitney U testem. Korelace spojitých parametrů byly hodnoceny Spearmanovým pořadovým korelačním koeficientem.
Odds ratia prediktorů ASS a dysfunkce levé komory doplněné o 95% interval spolehlivosti byla odvozena pomocí logistické regrese a doplněna o testování statistické významnosti Wardovým testem.
Hodnota α < 0,05 byla využita jako hranice statistické významnosti ve všech testech. Statistická analýza byla provedena za použití softwaru Stat View version 8.0 (SAS Institute Inc, Cary, NC, USA), SPSS 18.0.2 (SPSS, Inc.) a STATISTICA 8.0 (StatSoft, Inc. 2008).
Výsledky
Charakteristika populace pacientů s akutním srdečním selhání
Celkem bylo vyhodnoceno 593 pacientů, příznaky akutního srdečního selhání mělo 164 pacientů (27,7 %), z toho mírné srdeční selhání (Killip II) mělo 21,4 % pacientů, 2,4 % pacientů mělo plicní edém (Killip III) a 3,7 % pacientů splňovalo kritéria kardiogenního šoku. Příznaky akutního srdečního selhání mělo při přijetí 24,8 % pacientů, během hospitalizace se rozvinulo srdeční selhání u dalších 2,9 % pacientů. Základní charakteristiku pacientů ukazuje tab. 1 – ve srovnání s pacienty bez selhání byli pacienti s akutním srdečním selháním starší, častěji diabetici, v minulosti častěji prodělali infarkt myokardu a současný infarkt byl častěji v povodí ramus interventricularis anterior. Při přijetí měli vyšší tepovou frekvenci (TF) a trend k nižšímu systolickému tlaku. V chronické medikaci nebyl významný rozdíl.
Tab. 1. Základní charakteristika souboru. 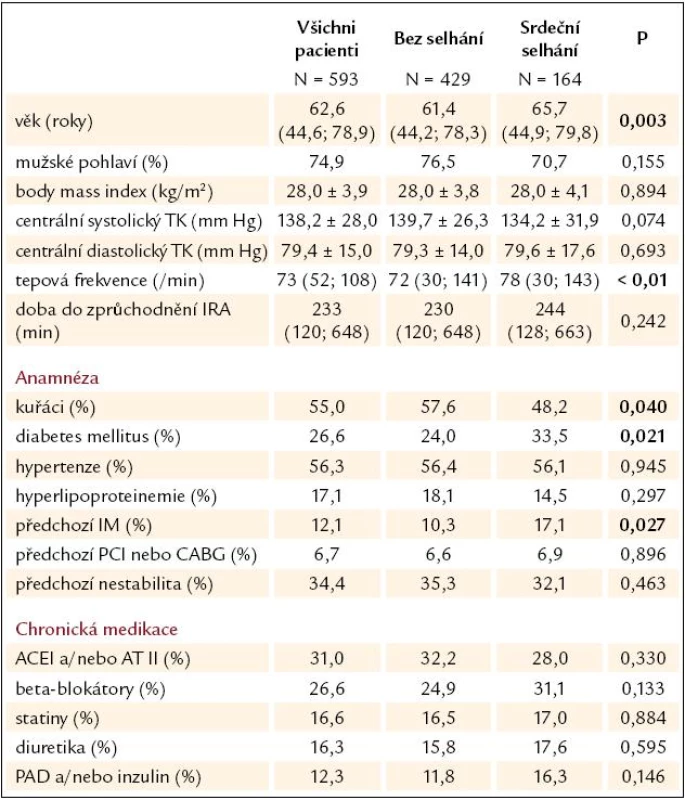
Laboratorní charakteristika pacientů s ASS
Pacienti se selháním měli při přijetí vyšší hladinu glykemie, kreatininu, kyseliny močové, HDL-cholesterolu a vyšší počet leukocytů. Zároveň měli vyšší hladiny natriuretických peptidů a následně došlo k jejich dalšímu výraznějšímu vzestupu. Měli vyšší hodnotu troponinu I odpovídající většímu rozsahu infarktu myokardu (tab. 2).
Hospitalizační léčba pacientů s akutním srdečním selháním
Pacienti se srdečním selháním vyžadovali podání pozitivně inotropních léků (dopamin, dobutamin, levosimendan) v 32,7 % případů, intraaortální balónková kontrapulzace (IABC) byla zavedena u 7,5 % pacientů, v kombinaci s perkutánně zavedenou axiální pumpou (Impella, Danvers, Massachusetts, USA, 2,5 l/ min) u 1 pacienta v kardiogenním šoku při infarktu myokardu s uzávěrem kmene levé koronární tepny. Vazopresory jsme použili pro hypotenzi (noradrenalin) u 23,9 % pacientů se srdečním selháním, umělou plicní ventilaci u 17,6 % pacientů, dočasná kardiostimulace (DKS) byla zavedena u 7,3 % pacientů s ASS (infarktová tepna 6krát RIA, 4krát ACD, 2krát RC).
Invazivní a echokardiografické parametry pacientů s ASS
Pacienti s ASS měli vyšší LVEDP před PCI a nižší hodnotu dP/ dt/ P vyjadřující inotropní sílu levé komory. EF levé komory byla nižší u pacientů s ASS jak vstupně při ventrikulografii, tak 3. – 5. den po infarktu podle echokardiografického vyšetření. Pacienti s ASS měli signifikantně vyšší end-systolický objem levé komory (tab. 4).
Tab. 3. Medikace při propuštění. 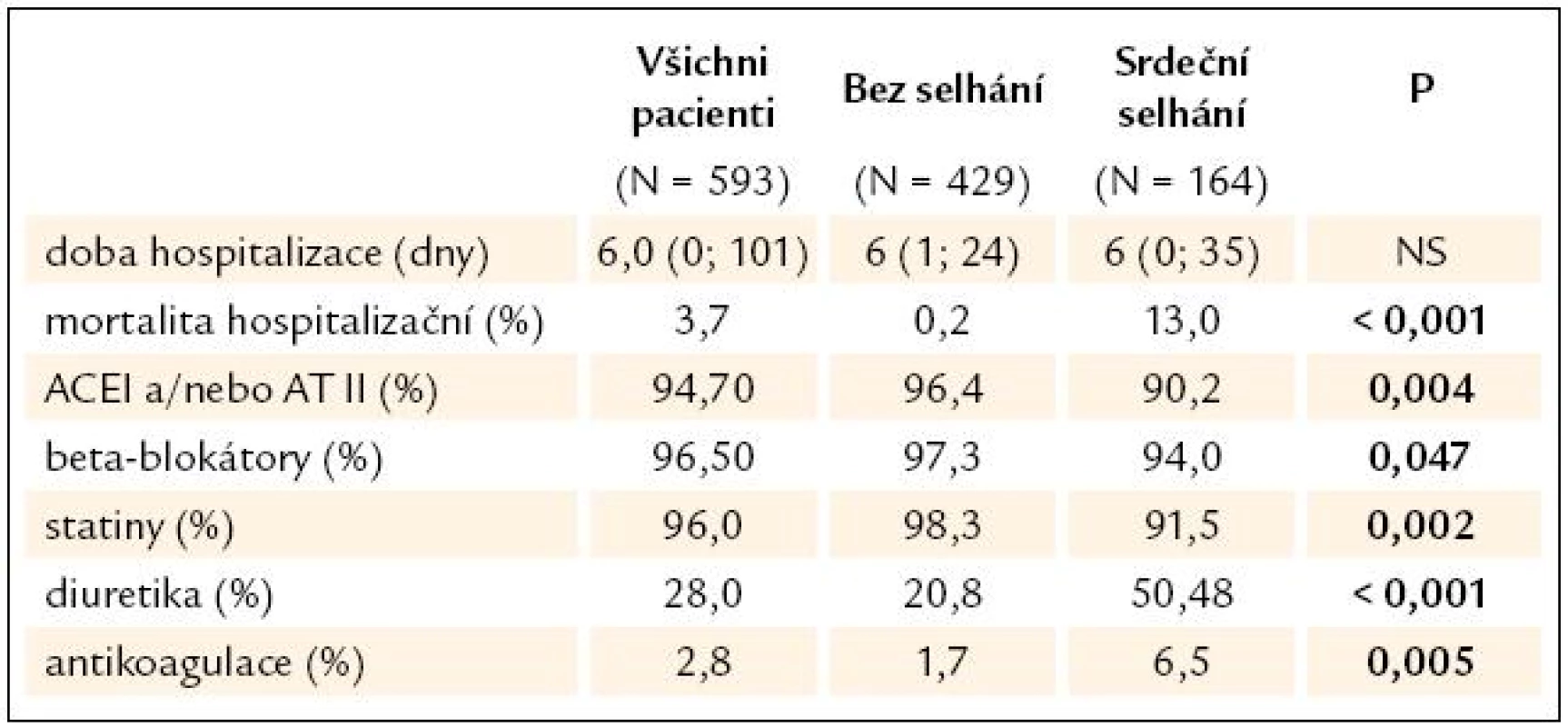
Hospitalizační mortalita
Celková hospitalizační mortalita sledovaného souboru byla 3,7 %. Ve skupině pacientů bez srdečního selhání byla mortalita 0,2 % (pacient po protrahované kardiopulmonální resuscitaci pro fibrilaci komor v akutní fázi IM), ve skupině pacientů s projevy ASS byla mortalita 13,0 %. Nemocniční mortalita významně stoupala s tíží srdečního selhání, pacienti s mírným srdečním selháním nesplňujícím kritéria plicního edému nebo kardiogenního šoku (Killip II) měli mortalitu 3,2 %, pacienti s plicním edémem 14,3 % a pacienti v kardiogenním šoku měli mortalitu 63,6 %.
Medikace při propuštění
Při propuštění mělo přes 95 % pacientů ACEI, BB a statiny, významně více pacientů s ASS mělo diuretika. Kombinovanou antiagregační a antikoagulační terapii mělo při propuštění 2,8 % pacientů, častěji pacienti se srdečním selháním (tab. 3).
Tab. 4. Invazivní a echokardiografické parametry – hospitalizační fáze. 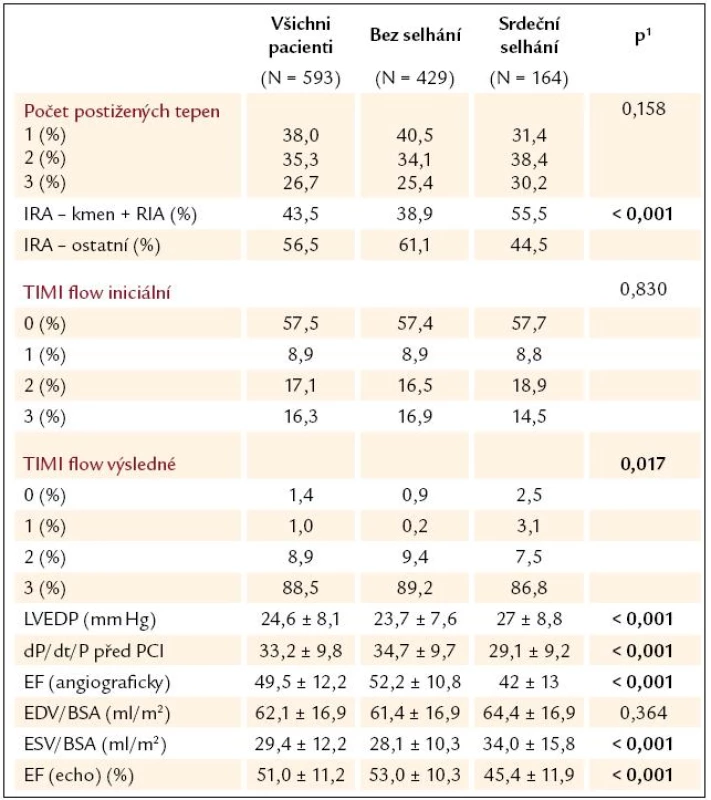
1 statistická významnost hodnocená χ2 testem maximální věrohodnosti pro kategoriální data a Mann‑Whitney U testem pro data spojitá Faktory nezávisle spojené se vznikem akutního srdečního selhání
Provedli jsme univariantní logistickou regresi, abychom identifikovali faktory, které souvisí s rozvojem akutního srdečního selhání (tab. 5). Z parametrů, které v univariantní analýze měly signifikantní vztah k ASS, byl vytvořen multivariantní model, který identifikoval nezávislé faktory ovlivňující vznik ASS (tab. 6). Do tohoto modelu nebyly zavzaty natriuretické peptidy, které lze považovat za jiné vyjádření akutního srdečního selhání. Mezi faktory, které nezávisle na ostatních ovlivňují nebo predikují zvýšené riziko akutního srdečního selhání, patří zejména zvýšená glykemie při přijetí, lokalizace infarktu v oblasti přední stěny, dále pak vyšší věk a vyšší tepová frekvence při přijetí. Naopak menší riziko mají pacienti s vyšší hodnotou pulzního tlaku a již vytvořenými kolaterálami infarktové tepny.
Tab. 5. Univariantní logistická regrese mezi vznikem ASS nebo rozvojem dysfunkce LK (EF < 40 %) a vybranými anamnestickými, laboratorními nebo invazivními parametry. 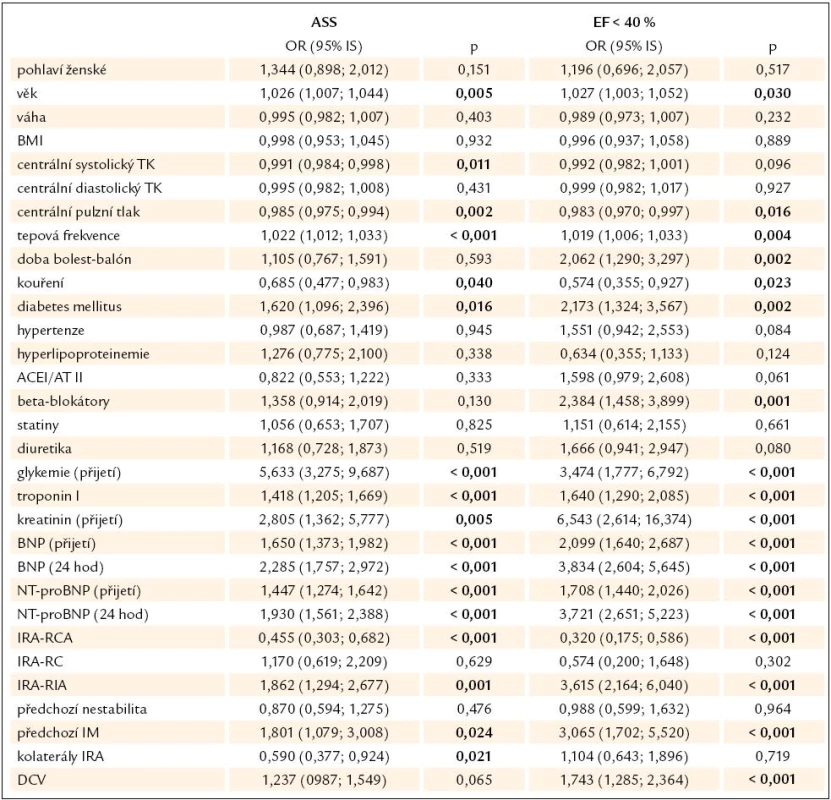
Faktory nezávisle spojené s rozvojem dysfunkce levé komory
Podobným způsobem jako u srdečního selhání byla provedena univariantní a následně multivariantní logistická regrese a byly identifikovány faktory nezávisle spojené s rozvojem dysfunkce levé komory. Zvýšené riziko představuje zvýšená glykemie při přijetí, infarkt přední stěny, vyšší věk a vyšší tepová frekvence, naopak nižší riziko představoval vyšší aortální pulzní tlak (tab. 6).
Tab. 6. Multivariantní model mezi vznikem ASS nebo rozvojem dysfunkce levé komory (EF < 40 %) a parametry vybranými na základě univariantní analýzy. 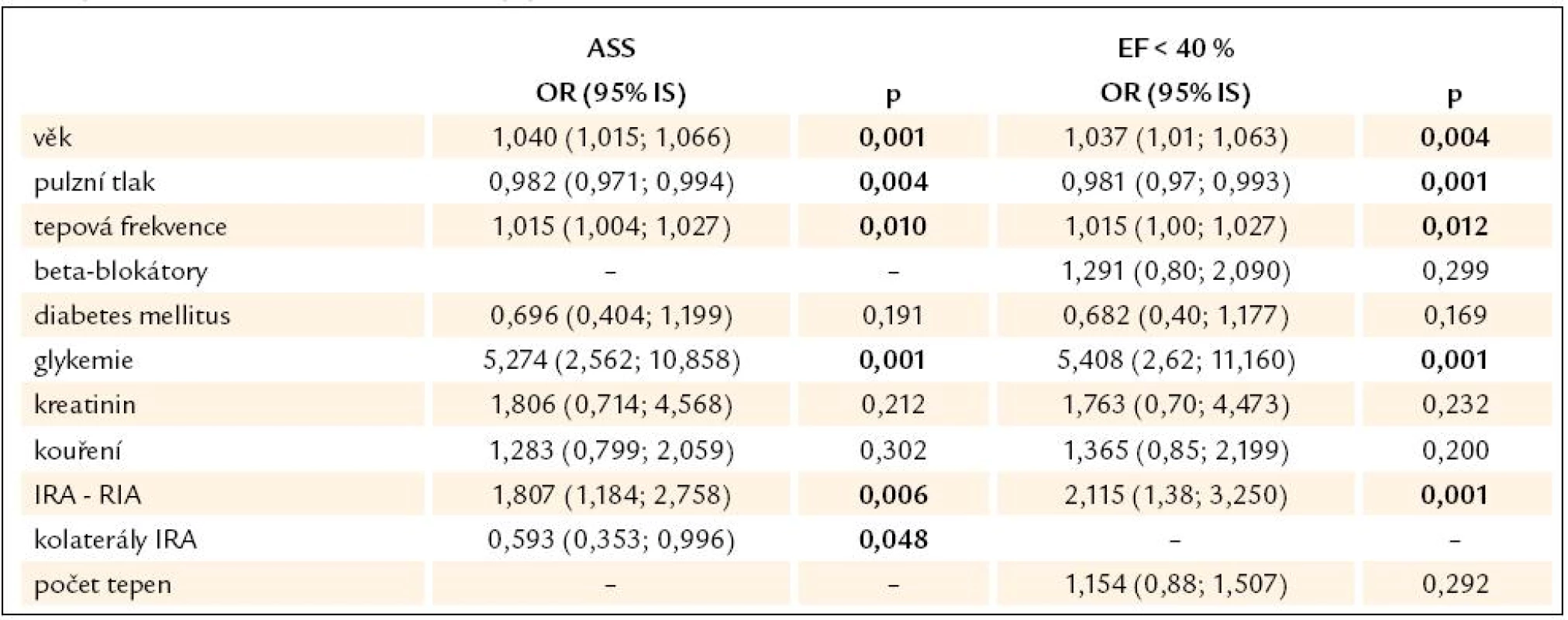
Cut off pro parametry spojené s rozvojem srdečního selhání
Podle ROC analýzy byly stanoveny možné hranice LVEDP, dP/ dt/ P, glykemie při přijetí, pulzního tlaku, BNP a NTproBNP při přijetí a za 24 hod od vzniku IM (tab. 7) pro akutní srdeční selhání.
Tab. 7. ROC analýza vztahu mezi vybranými sledovanými parametry a rozvojem ASS. 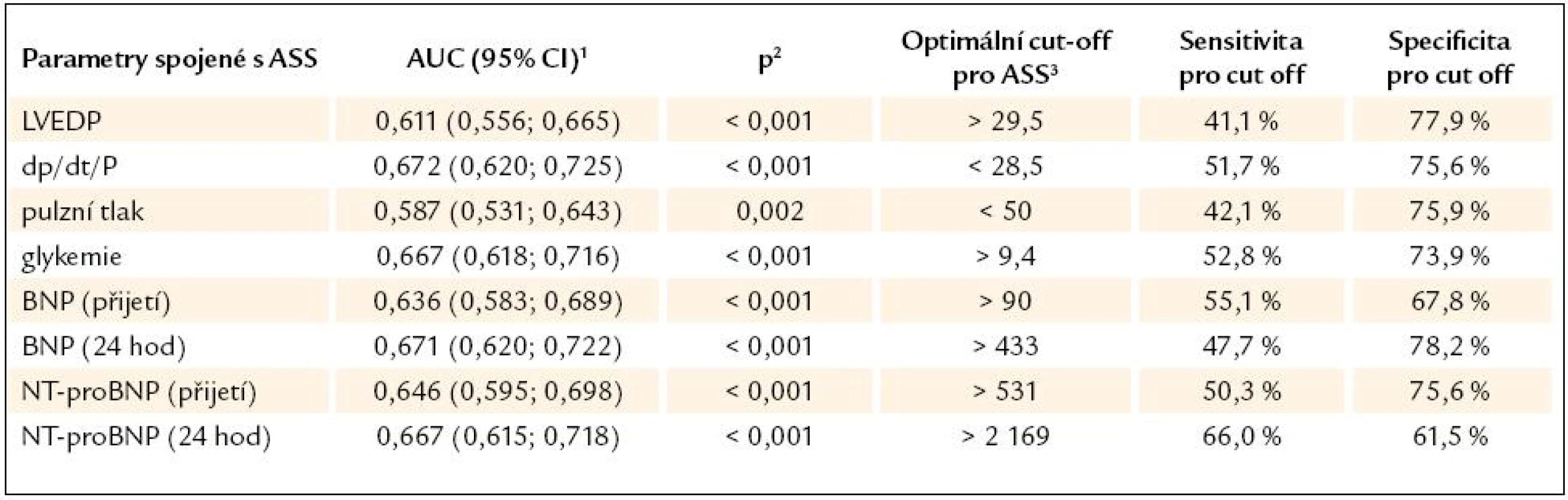
1 area under curve a její 95% confidence interval 2 statistická signifikance AUC v ROC analýze 3 optimální cut off pro ASS založené na nejlepší kombinaci sensitivity a specificity Diskuze
Hospitalizační mortalita pacientů se STEMI, vliv ASS
Hospitalizační mortalita našeho souboru (3,7 %) je nižší než mortalita z velkých registrů pacientů se STEMI. Dle NRKI je hospitalizační mortalita pacientů se STEMI v ČR 6,9 %, hospitalizační mortalita pacientů v Euro Heart Survey on acute coronary syndromes II (EHS - ACS - II; n = 3 004 pacientů) byla 5,3 % [3], v rozsáhlém registrů akutních koronárních syndromů GRACE byla 5,5 % [4] (pacienti se STEMI, ale byli vyloučeni pacienti s kardiogenním šokem a předchozím srdečním selháním). V našem případě je nízká mortalita ovlivněna vylučovacími kritérii, především věkem a jiným závažným onemocněním, které byly dány vzhledem k plánovanému prospektivnímu sledování pacientů.
Mortalita pacientů se srdečním selháním je výrazně vyšší než mortalita pacientů bez selhání. Naše výsledky jsou konzistentní s výsledky jiných studií a registrů. Registr GRACE udává mortalitu pacientů bez ASS 1,4 %, pacientů se selháním 17,2 % [4], americký národní registr infarktů myokardu (National registry of Myocardial Infarction) NRMI 2 a 3 udává mortalitu všech pacientů s AKS bez selhání 6,2 %, u pacientů se STEMI se selháním 22,4 % [5]. Santoro et al [6] hodnotili hospitalizační mortalitu ve skupině 2 089 pacientů se STEMI léčených primární PCI, u pacientů bez selhání byla 1,1 %, se selháním 9,4 % (vyloučeni byli pacienti s kardiogenním šokem při přijetí). Ve shodě s literaturou jsme zdokumentovali, že tíže selhání výrazně ovlivňuje mortalitu pacientů.
Některé práce ukazují, že hospitalizační i dlouhodobá prognóza pacientů, u kterých se rozvine srdeční selhání až za hospitalizace, je horší než u pacientů, u kterých je ASS prezentováno při přijetí. Rozvoj ASS za hospitalizace ve srovnatelné skupině pacientů se STEMI léčených primární PCI [6] byl u 1,3 % pacientů; v našem souboru to bylo 2,9 %. Dle registru GRACE došlo k rozvoji ASS za hospitalizace u 5,3 % pacientů, dle NRMI 2 a 3 až u 9,5 % pacientů. K rozvoji ASS za hospitalizace dochází častěji u pacientů s NSTEMI, kteří nejsou řešeni invazivně [4]. Podle [6] byla mortalita pacientů se STEMI léčených primární PCI, kteří měli projevy srdečního selhání při přijetí, 8 % a mortalita pacientů, u nichž se ASS rozvinulo až za hospitalizace, byla 26 %. Reperfuzní léčba snižuje výskyt následného rozvoje srdečního selhání za hospitalizace.
Výskyt ASS u pacientů se STEMI
Výskyt ASS v našem souboru byl 27,7 %, tj. o něco větší než u pacientů se STEMI dle registru EHS - ACS - I, resp. EHS - ACS - II, kde byl výskyt srdečního selhání (Killip II, III, IV) 22,7 %, resp. 20,4 % [3]. Srovnatelný výskyt akutního srdečního selhání u pacientů se STEMI byl referován rovněž z rozsáhlého amerického registru NRMI – 28,5 % [7]. Výskyt srdečního selhání je u pacientů s NSTEMI srovnatelný, u pacientů s nestabilní anginou pectoris je nižší – 10 – 12 % [4].
Terapie za hospitalizace
Intraaortální balonková kontrapulzace je obecně indikována u pacientů s akutním infarktem myokardu v kardiogenním šoku, u těžké refrakterní dysfunkce levé komory nebo u mechanických komplikací IM (ruptura mezikomorové přepážky nebo významná mitrální regurgitace v důsledku ischemické dysfunkce nebo ruptury papilárního svalu) [8]. IABC jsme použili u 2,1 % pacientů, což představovalo 7,5 % případů pacientů s projevy srdečního selhání, všichni pacienti byli v kardiogenním šoku. Dle registru EHS - ACS - II byla používána IABC u 2,6 % pacientů. Mortalita v této skupině pacientů byla 69 %.
Inhibitory glykoproteinu IIb/ IIIa byly častěji aplikovány u pacientů se srdečním selháním, častěji byl použit abciximab než eptifibatid. U rizikových pacientů je časné podání abciximabu alespoň 30 min před PCI ve srovnání s pozdním podáním spojeno s častějším výsledným TIMI flow 3 po PCI a nižším rizikem úmrtí do 1 roku (8,7 % vs 15,8 %; P = 0,01; OR 0,51). V multivariantním Cox modelu se brzké podání inhibitoru GP IIb/ IIIa spolu s TIMI skóre 3 nebo více jevily jako nezávislé prediktory jednoročního přežití. Bez ohledu na rizikový profil brzké podání nezvýšilo výskyt krvácivých komplikací [9]. Dle EHS - ACS - I a EHS - ACS - II došlo mezi lety 2000 – 2004 k častějšímu užívání inhibitorů glykoproteinu IIb/ IIIa z 19,6 % na 30,7 % [3]. Inhibitory GP IIb/ IIIa byly na našem pracovišti podávány ve srovnání s registrem EHS - ACS - II z roku 2004 méně často.
Pozitivně inotropní látky a vazopresory jsou podávány především pacientům s projevy ASS. Ve srovnání s registrem GRACE byla frekvence podání pozitivně inotropních látek srovnatelná (18,6 – 31,6 %). Samotný noradrenalin společně s volumoexpanzí byl indikován zejména u pacientů s hypotenzí při infarktu dolní stěny a postižení pravé komory. Při srdečním selhání provázeném hypotenzí je na našem pracovišti preferována kombinace noradrenalinu s dobutaminem s cílem udržení systolického krevního tlaku 90 – 100 mm Hg. Katecholaminy jsou vysazovány co nejdříve, i s ohledem na prokázaný negativní vliv dlouhodobějšího podávání dobutaminu ve studii First [10].
Levosimendan jsme použili celkem u 11 pacientů. Přestože studie RUSSLAN [11] prokázala bezpečnost a účinnost podání levosimendanu u akutního infarktu myokardu se srdečním selháním, a i další menší práce [12] prokázaly pozitivní hemodynamický efekt u pacientů v kardiogenním šoku, mortalitní studie Survive [13] neprokázala pozitivní efekt na dlouhodobou mortalitu u pacientů s infarktem myokardu. Vzhledem k vazodilatačnímu a mírně hypotenznímu účinku podáváme levosimendan velmi opatrně pouze u pacientů, kteří vyžadují pozitivně inotropní podporu (trvající známky městnání po primární PCI bez promptní reakce na diuretika), se systolickým tlakem nad 90 – 100 mm Hg (při možném podání vazopresorů). Lék nepodáváme u pacientů s hypotenzí, vazodilatací a známkami severe imulogy response syndrom (SIRS) po infarktu myokardu pro riziko rozvoje těžké hypotenze.
Medikace BB, ACEI/ AT II blokátory a statiny
Beta-blokátory, ACEI a statiny byly při propuštění ordinovány častěji, jak ve srovnání s registry akutních koronárních syndromů (EHS - ACS - II: beta-blokátor 78 %, ACEI/ ARB 67 %, statiny 76 %), tak s farmakologickými studiemi (např. studie Plato [14] – beta-blokátory 89 %, ACEI/ ARB 75 %/ 12 %, statiny 90 %). Pacientům s ASS byla ve srovnání s registry při propuštění méně často ordinována diuretika (v registrech mělo 70 – 80 % pacientů při propuštění diuretika). Důvodem nepodání ACEI/ ARB při propuštění byl sklon k hypotenzi. Ve skupině bez srdečního selhání to byli převážně pacienti s infarktem dolní stěny (63 %), ve skupině pacientů s ASS to byli převážně pacienti s infarktem přední stěny (57 %). Celkem 27 % pacientů bez ACEI/ ARB bylo přeloženo na jiné pracoviště a lze předpokládat, že při propuštění část z nich ještě ACEI/ ARB dostala. Antikoagulační terapii mělo při propuštění domů v kombinaci s antiagregační terapií 2,8 %, častěji pacienti se srdečním selháním. Indikací kombinované antiagregační a antikoagulační léčby byla umělá chlopeň, trombus v levé komoře a perzistentní nebo permanentní fibrilace síní s CHADS skóre 2 a více [8,15]. Amiodaron mělo ordinováno při propuštění 1,5 % pacientů, všichni kromě jednoho pacienta nově, indikací nasazení amiodaronu byly recidivující ataky fibrilace síní. Blokátory kalciového kanálu mělo při propuštění 2,3 % pacientů, což je výrazně méně, než odpovídá četnosti podání Ca blokátorů ve studiích i registrech (studie Plato – 30 %, NRMI 2 a 3 15 – 30 %).
Aktivace sympatického autonomního nervového systému u pacientů s akutním srdečním selháním
Akutní srdeční selhání představuje pro organizmus stres, který vede k aktivaci sympatického autonomního nervového systému (ANS). Aktivace sympatického ANS se u pacientů s ASS podílí na vyšší tepové frekvenci a částečně i na jejich vyšší příjmové hladině glykemie [16]. Studie GISSI - 2 [17], která hodnotila 10 000 pacientů po infarktu myokardu ukázala, že nejhorší prognózu měli pacienti s TF nad 100/ min, nicméně i pacienti s TF 80 – 100/ min měli výrazně vyšší mortalitu než pacienti s TF pod 80/ min. Rozvoj akutního srdečního selhání a zároveň aktivace ANS je do určité míry dána rozsahem infarktu myokardu. K orientačnímu posouzení rozsahu infarktu jsme využili v naší práci troponin I, a jak ukazuje tab. 2, měli pacienti s akutním srdečním selháním nesignifikantní trend k vyšším hladinám troponinu. Rozsah ischemického ložiska je jedním z faktorů, který vedl k nárůstu natriuretických peptidů od přijetí do 2. odběru (za 24 hod od vzniku infarktu myokardu). Jak ukazuje tab. 3, měli pacienti se srdečním selháním výsledné TIMI flow v infarktové tepně signifikantně nižší než pacienti bez selhání. Nedostatečná reperfuze infarktové tepny je zřejmě jedním z faktorů, který ovlivňuje rozsah infarktového ložiska, a tím i následný vzestup hladiny natriuretických peptidů. Zjistili jsme statistickou významnou, i když volnější, korelaci mezi troponinem I a hodnotou BNP, resp. NT - proBNP za 24 hod po infarktu myokardu (r = 0,302, resp. r = 0,278; p < 0,01).
Rozsah infarktu myokardu a jednorázové stanovení troponinu
Pacienti s projevy ASS měli statisticky nesignifikantně vyšší hladinu troponinu I, kterou lze považovat za míru velikosti IM. Podle literatury jednorázové stanovení troponinu koreluje s rozsahem infarktu myokardu a metoda je srovnatelná se sériovým stanovením CK - MB. Troponin je nutné odebrat minimálně za 24 hod od vzniku infarktu, nejlépe za 48 – 72 hod. To je však v praxi hůře proveditelné, a proto na našem pracovišti stanovujeme standardně troponin I za 24 hod od vzniku bolestí [18].
Prediktory akutního srdečního selhání
Santoro et al [6] zjistili v multivariantní analýze jako nezávislé prediktory ASS věk (HR 1,05), DM (HR 1,62), předchozí IM (HR 1,6), dobu „bolest - balón“ (HR 1,07), přední infarkt (HR 2,42), TIMI 0 – 1v IRA před PCI (HR 1,57) a peak CKMB (HR 1,001). Podle registru akutních koronárních syndromů GRACE [4] byl rizikovým faktorem rozvoje akutního srdečního selhání vyšší věk, vyšší TF, předchozí medikace diuretiky, diabetes mellitus a předchozí infarkt myokardu. Podle registru studie Valiant byly stanoveny v multivariantní logistické regresi jako rizikové faktory rozvoje ASS nebo systolické dysfunkce levé komory (EF < 40 %) vyšší TF, vyšší systolický krevní tlak, předchozí srdeční selhání, vyšší věk a LBBB nebo infarkt myokardu přední stěny [19]. Oproti předchozí literatuře přinášíme jako nový parametr s nezávislým vztahem k ASS centrální pulzní tlak a kolaterály IRA.
Zatímco vyšší hodnota pulzního tlaku je u stabilních pacientů významným prediktorem vyšší kardiovaskulární a cerebrovaskulární mortality, je nižší hodnota pulzního tlaku u pacientů se srdečním selháním obrazem nízkého srdečního výdeje. U pacientů s pokročilým chronickým srdečním selháním (NYHA III - IV) představuje nižší hodnota pulzního tlaku (< 45 mm Hg) silný nezávislý prediktor mortality. V literatuře zatím nebyl studován vztah mezi centrálním pulzním tlakem a rozvojem akutního srdečního selhání v rámci STEMI léčeného primární PCI.
Cutt of pro parametry spojené se srdečním selháním
Pomocí ROC analýzy jsme se pokusili stanovit hranice pro některé parametry, které charakterizují nebo ovlivňují rozvoj ASS (tab. 7). Vzhledem k relativně nízké senzitivitě lze tyto hodnoty považovat pouze za velmi orientační, nicméně přináší další důležité informace do mozaiky o pacientovi s akutním IM provázeným srdečním selháním. Hodnoty natriuretických peptidů při přijetí jsou ve shodě se všeobecně doporučenými hodnotami. K nárůstu natriuretických peptidů 24 hod od vzniku IM dochází i v důsledku proběhlého ischemického postižení myokardu.
Limitace práce
Limitací práce je, že nezahrnuje přísně konsekutivně všechny pacienty se STEMI hospitalizované na klinice. Vzhledem k tomu, že se jedná o prospektivně prováděnou práci podle předem daného protokolu, lze považovat vzorek pacientů splňujících vstupní kritéria vzhledem k cílům práce za reprezentativní. Pacienti nad 80 let tvoří relativně významnou část populace pacientů se STEMI, ale vzhledem k plánovanému dlouhodobému klinickému a echokardiografickému sledování nebyli tito pacienti do sledování zařazeni. Určitým nedostatkem této práce je, že přestože byl kladen velký důraz na informace z invazivního vyšetření, konečný výsledek reperfuze byl hodnocen pouze TIMI flow po výkonu a nebyly vyhodnoceny další parametry, jako je TIMI frame count nebo myocardial blush grade.
Závěr
Závěrem lze říci, že k rozvoji ASS dochází u necelé 1/ 3 pacientů se STEMI. Rozvoj ASS představuje vysoké riziko hospitalizační mortality, zvláště u pacientů v plicním edému, kardiogenním šoku nebo při pozdním rozvoji ASS až za hospitalizace. Jako nezávislé faktory se vztahem ke vzniku ASS nebo dysfunkce levé komory jsme identifikovali zvýšenou glykemii při přijetí, infarkt myokardu přední stěny, věk, zvýšenou tepovou frekvenci. Nižší riziko mají pacienti se zachovaným vyšším centrálním pulzním tlakem a již vytvořenými kolaterálami infarktové tepny.
Práce byla podpořena VVZ MŠMT 0021624202.
MU Dr. Mgr. Jiří Pařenica
www.fnbrno.cz
e-mail: jiri.parenica@atlas.czDoručeno do redakce: 23. 6. 2010
Přijato po recenzi: 2. 9. 2010
Zdroje
1. Widimský P, Želízko M, Janský P et al. Jak léčíme akutní koronární syndromy v České republice? Výsledky registru CZECH. Cor Vasa 2007; 49: K237 – K239.
2. Gibson CM. NRMI and current treatment patterns for ST‑elevation myocardial infarction. American Heart Journal 2004; 148 (Suppl 1): S29 – S33.
3. Mandelzweig L, Battler A, Boyko V et al. The second Euro Heart Survey on acute coronary syndromes: characteristics, treatment, and outcome of patients with ACS in Europe and the Mediterranean Basin in 2004. Eur Heart J 2006; 27 : 2285 – 2293.
4. Steg PG, Dabbous OH, Feldman LJ et al. Determinants and Prognostic Impact of Heart Failure Complicating Acute Coronary Syndromes: Observations From the Global Registry of Acute Coronary Events (GRACE). Circulation 2004; 109 : 494 – 499.
5. Wu AH, Parsons L, Every NR et al. Hospital outcomes in patients presenting with congestive heart failure complicating acute myocardial infarction: A report from the Second National Registry of Myocardial Infarction (NRMI ‑ 2). J Am Coll Cardiol 2002; 40 : 1389 – 1394.
6. Santoro GM, Carrabb N, Migliorini A et al. Acute heart failure in patients with acute myocardial infarction treated with primary percutaneus coronary intervention. Eur J Heart Fail 2008; 10 : 780 – 785.
7. Spencer FA, Meyer TE, Gore JM et al. Heterogeneity in the Management and Outcomes of Patients With Acute Myocardial Infarction Complicated by Heart Failure: The National Registry of Myocardial Infarction. Circulation 2002; 105 : 2605 – 2610.
8. Widimsky P, Hlinomaz O, Kala P et al. Diagnostika a léčba akutního infarktu s elevacemi ST. Doporučení České kardiologické spole. Cor Vasa 2010; 51 : 724 – 740.
9. Tomasz R, Zbigniew S, Artur D et al. Early abciximab administration before transfer for primary percutaneous coronary interventions for ST‑elevation myocardial infarction reduces 1‑year mortality in patients with high‑risk profile. Results from EUROTRANSFER Registry. Am Heart J 2009; 158 : 569 – 575.
10. Christopher MO, Wendy AG, Barry FU et al. Continuous intravenous dobutamine is associated with an increased risk of death in patients with advanced heart failure: Insights from the Flolan International Randomized Survival Trial (FIRST). Am Heart J 1999; 138 : 78 – 86.
11. Moiseyev VS, Pöder P, Drejevs N et al. Safety and efficacy of a novel calcium sensitizer, levosimendan, in patients with left ventricular failure due to an acute myocardial infarction. A randomized, placebo ‑ controlled, double‑blind study (RUSSLAN). Eur Heart J 2002; 23 : 1422 – 1432.
12. Rokyta jr. R, Pechman V. The effects of Levosimendan on global haemodynamics in patients with cardiogenic shock. Neuro Endocrinol Lett 2006; 27 : 121 – 127.
13. Mebazaa A, Nieminen MS, Packer M et al. Levosimendan vs Dobutamine for Patients With Acute Decompensated Heart Failure: The SURVIVE Randomized Trial. JAMA 2007; 297 : 1883 – 1891.
14. Wallentin L, Becker RC, Budaj A et al. Ticagrelor versus Clopidogrel in Patients with Acute Coronary Syndromes. N Engl J Med 2009; 361 : 1045 – 1057
15. Špinar J, Janský P, Kettner J et al. Doporučení pro diagnostiku a léčbu akutního srdečního selhání. Cor Vasa 2006; 48: K3 – K31.
16. Souček M, Nevrlka J, Říháček I et al. Zvýšená aktivita sympatiku a možnosti terapeutického ovlivnění. Vnitř Lék 2007; 53 : 554 – 559.
17. Zuanetti G, Mantini L, Hernandez ‑ Bernal F. Relevance of heart rate as a prognostic factor in patients with acute myocardial infarction: insight from the GISSI ‑ 2 study. Eur Heart J 1998 (Suppl F): 19 – 26.
18. Remppis A, Ehlermann P, Giannitsis E et al. Cardiac Troponin T Levels at 96 Hours Reflect Myocardial Infarct Size: A Pathoanatomical Study. Cardiology 2000; 93 : 249 – 253.
19. Velazquez EJ, Francis GS, Armstrong PW et al. An international perspective on heart failure and left ventricular systolic dysfunction complicating myocardial infarction: the VALIANT registry. Eur Heart J 2004; 25 : 1911 – 1919.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2011 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Opoždění diagnózy HELLP syndromu
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
- MU Dr. Václav Jedlička se dožil 85 let
- Terapeutická hypotermie po srdeční zástavě: proč a na jak dlouho? – editorial
- Geny a osteoporóza – editorial
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Obezita, body mass index, obvod pasu a mortalita – editorial
- Charakteristika reziduálních tachykardií spojených s koronárním sinem během ablace dlouhodobé perzistentní fibrilace síní
- Akutní srdeční selhání a časný rozvoj dysfunkce levé komory u pacientů s akutním infarktem myokardu s elevacemi ST léčených primární perkutánní koronární intervencí
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Přínos celotělové magnetické rezonance v diagnostice monoklonální gamapatie nejistého významu, mnohočetného myelomu a stanovení stadia pokročilosti nemoci s pomocí systému Durie‑ Salmon Plus
- Faktory ovlivňující přítomnost varixů a varikózního krvácení u pacientů s jaterní cirhózou
- Terapeutická hypotermie po srdeční zástavě na 12 hodin: Karlovy Vary 2006– 2009
- Význam genetiky v predikci rizika osteoporózy
- Obezita, body mass index, obvod pasu a mortalita
- Prečo vzniká fibrilácia predsiení po kardiochirurgických operáciách?
- Schnitzler‑ syndrom: popis případu, zkušenosti s léčbou glukokortikoidy a preparátem anakinra (KineretTM) a sledování cytokinové odpovědi organizmu
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Opoždění diagnózy HELLP syndromu
- Diagnostika a léčba akutní plicní embolie v roce 2010
- Obezita, body mass index, obvod pasu a mortalita
- Prípad vlajúceho infikovaného trombu v. jugularis interna, septických pneumónií a heparínom indukovanej trombocytopénie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání