-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaLaparoskopická resekcia karcinómu rekta: zhodnotenie perioperačných výsledkov primárnej resekcie a resekcie po neoadjuvantnej chemorádioterapii
Laparoscopic Resection of Rectal Cancer: Evaluation of Perioperative Results of the Primary Resection and Resection after Preoperative Chemoradiotherapy
Aims:
To evaluate and compare perioperative results of laparoscopic resection for low and middle third rectal cancer subgroup of patients intended for primary resection (PR) with those operated after chemoradiotherapy (CHRT).Methods:
291 patients were operated for rectal cancer during the years 2005–2007 in Department of Surgery, J.G.Mendel Oncological Centre Nový Jičín. 155 patients (49 women and 106 men, mean age 65 ± 9.7, range 27–87) having laparoscopic resection for low and middle rectal cancer were included in the present prospective single centre study. Primary surgical approach was adopted in 74 patients and 81 patients had a preoperative chemoradiotherapy.Results:
Both groups were comparable regarding intraoperative (p = 0.632) and postoperative surgical complications (p = 0.179) andnonsurgical complications (p = 0.654) too. Operative time and postoperative stay were similar in both groups. Number of harvested lymphnodes was higher for PR group (p < 0.001).Conclusion:
In summary, after short term results evaluation, there is no significant difference for PR and CHRT groups in laparoscopic rectal resection. Neoadjuvant chemoradiotherapy did not lead to worsening of the perioperative results of our patients.Key words:
rectal cancer – laparoscopy – preoperative radiotherapy – postoperative complications
Autoři: M. Škrovina 1; J. Bartoš 1; R. Soumarová 2; S. Czudek 1; J. Parvez 1; P. Bartoš 3; L. Adamčík 1; V. Kokavec 1
Působiště autorů: Chirurgické oddělení, Onkocentrum J. G. Mendela a Nemocnice Nový Jičín, primář: MUDr. S. Czudek, CSc. 1; Radioterapie a. s., Onkocentrum J. G. Mendela a Nemocnice Nový Jičín primář: doc. MUDr. R. Soumarová, Ph. D. 2; Gynekologické oddělení, Onkocentrum J. G. Mendela a Nemocnice Nový Jičín primář: MUDr. P. Bartoš, Ph. D., M. MED. 3
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 8, s. 417-425.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cieľ:
V prospektívnej unicentrickej štúdii zhodnotenie a porovnanie perioperačných výsledkov laparoskopickej resekcie karcinómu strednej a dolnej tretiny rekta v skupine pacientov indikovaných k primárnej operácii (PR) so skupinou pacientov operovaných po absolvovaní predoperačnej chemorádioterapie (CHRT).Materiál a metódy:
V rokoch 2005–2007 bolo na chirurgickom oddelení Onkocentra J. G. Mendela a Nemocnice Nový Jičín operovaných 291 pacientov s karcinómom rekta. Do štúdie bolo zaradených 155 pacientov (49 žien a 106 mužov; vek 65 ± 9,7; 27–87) s karcinómom strednej a dolnej tretiny rekta, u ktorých bola vykonaná laparoskopická resekcia. 74 pacientov bolo indikovaných k primárnej operácii a 81 pacientov absolvovalo predoperačnú chemorádioterapiu s následnou laparoskopickou resekciou.Výsledky:
V oboch skupinách bola porovnateľná incidencia intraoperačných komplikácii (p = 0,632), pooperačných chirurgických (p = 0,179) aj nechirugických komplikácií (p = 0,654). Taktiež nebol zaznamenaný štatisticky signifikantný rozdiel v dĺžke operácie a pooperačnej hospitalizácie. Počet zhodnotených lymfatických uzlín bol výrazne vyšší v skupine pacientov s primárnou resekciou (p < 0,001).Záver:
Porovnaním intraoperačných a krátkodobých pooperačných výsledkov laparoskopickej resekcie karcinómu strednej a dolnej tretiny rekta nebol zaznamenaný rozdiel v skupine PR v porovnaní so skupinou CHRT.Kľúčové slová:
karcinóm rekta – laparoskopia – predoperačná rádioterapia – pooperačné komplikácieÚVOD
Predoperačná chemorádioterapia je indikovaná u pacientov s lokálne pokročilým karcinómom rekta, eventuálne pri náleze prítomnosti metastáz v regionálnych lymfatických uzlinách. Jej cieľom je dosiahnutie redukcie nádorovej hmoty (downstagingu) a následne zlepšenie operovateľnosti tumoru ako aj zlepšenie dlhodobých výsledkov liečby. Randomizovanými štúdiami bola dokázaná pri použití predoperačnej rádioterapie väčšia lokálna kontrola nádorového ochorenia, ale aj nižšia toxicita, ako u pacientov absolvujúcich pooperačnú rádioterapiu. Akcelerovanou predoperačnou rádioterapiou (5krát 4–5 Gy) s následnou okamžitou operáciou nie je možné dosiahnuť downstaging. Lepšie terapeutické výsledky je možné dosiahnuť využitím kombinovanej neoadjuvantnej chemorádioterapie [1, 2].
Cenou za dosiahnutie regresie nádorovej infiltrácie rekta a zlepšenie lokálnej kontroly predoperačnou chemorádioterapiou je, v niektorých prácach uvádzané, vyššie riziko vzniku septických komplikácií po radikálnej resekcii rekta [3].
Cieľom štúdie je vyhodnotenie výsledkov laparoskopickej resekcie karcinómu dolnej a strednej tretiny rekta so zameraním na možnosť sfinkter zachovávajúcich operácii a zhodnotenie intraoperačných a skorých pooperačných komplikácií u pacientov indikovaných k primárnej laparoskopickej resekcii (PR) so skupinou operovaných po absolvovaní neoadjuvantnej chemorádioterapie (CHRT).
SÚBOR PACIENTOV A METÓDA ZPRACOVANIA
V rokoch 2005 až 2007 bolo na chirurgickom oddelení Onkocentra J. G. Mendela a Nemocnice Nový Jičín operovaných 570 pacientov s kolorektálnym karcinómom, z toho 291 pacientov s karcinómom rekta. Do prospektívnej štúdie bolo zaradených 155 pacientov s karcinómom dolnej a strednej tretiny rekta (< 12 cm od anokutánneho prechodu) bez dokázaných vzdialených metastáz, u ktorých bola vykonaná plánovaná kuratívna laparoskopická resekcia s totálnou excíziou mezorekta alebo abdominoperineálna resekcia.
Zo štúdie boli vyradení pacienti s karcinómom hornej tretiny rekta, s primárne indikovanou otvorenou resekciou, s multiviscerálnou resekciou alebo združeným operačným výkonom, s prítomným synchrónnym karcinómom kolorekta, s duplicitným onkologickým ochorením alebo malignitou v osobnej anamnéze, ako aj pacienti so vzdialenými metastázami alebo lokoregionálnou recidívou karcinómu. Taktiež do štúdie neboli zaradení chorí s iným, ako resekčným operačným výkonom.
U všetkých pacientov bol karcinóm rekta verifikovaný endoskopickým vyšetrením kolorekta s biopsiou. Výška tumoru bola určovaná ako vzdialenosť dolného okraja nádorovej lezie od anokutánneho prechodu, meraná pri vyťahovaní napriameného flexibilného kolonoskopu a opakovane kontrolovaná v úvode operácie. Za základ rozdelenia rekta na jednotlivé časti bolo použité Woodove pravidlo štyroch [4]. Predoperačný staging ochorenia bol určovaný na základe transrektálnej ultrasonografie a CT vyšetrením dutiny brušnej a malej panvy. U pacientov s lokálne pokročilým karcinómom bola vykonaná taktiež MRI. V skupine chorých s indikovanou predoperačnou chemorádioterapiou, bolo po jej ukončení vždy realizované kontrolné CT vyšetrenie a opakovaná transrektálna ultrasonografia, eventuálne MRI. Výberovo bolo doplnené PET-CT vyšetrenie k vylúčeniu alebo potvrdeniu prítomnosti vzdialených metastáz.
Pacienti scTl-2N0M0 karcinómom boli indikovaní k primárnej laparoskopickej resekcii. K primárnej operácii boli indikovaní taktiež starí pacienti so závažnou primorbiditou, ktorí by pravdepodobne neprofitovali s pred-operačnej onkologickej liečby, alebo táto bola kontraindikovaná. U chorých s nálezom cTl-4Nl2M0 a cT3-4N0M0 tumoru bola indikovaná predoperačná chemorádioterapia. Všetci pacienti absolvovali 5týždňový režim s rádioterapiou na oblasť panvy v celkovej dávke 45 Gy. Bolo aplikovaných 5 frakcií v týždni (pondelok až piatok) s dávkou l,8 Gy na frakciu. Súčasne bol kontinuálne intravenózne aplikovaný 5-FU v dávke 225 mg/m2/deň po celú dobu trvania rádioterapie alebo capecitabin (Xeloda®) 825 mg/m2 perorálne dvakrát denne po celú dobu trvania rádioterapie alebo bol aplikovaný FUFA MAYO režim: 5-FU 425 mg/m2 + LV 20 mg/m2 intravenózne denne 1. až 5. deň v 1. a 5. týždni trvania rádioterapie. U pacientov kontraindikovaných k aplikácii konkomitantnej chemoterapie bola indikovaná samostatná predoperačná rádioterapia na oblasť panvy 45–50 Gy. S odstupom štyroch až šiestich týždňov po ukončení neoadjuvantnej terapie boli pacienti operovaní [5, 6]. U všetkých operovaných pacientov bola v úvode operácie vykonaná intraoperačná ultrasonografia pečene k vylúčeniu prítomnosti synchrónnych metastáz ako doplňujúce stagingové vyšetrenie. Operačný výkon bol štandardizovaný. Prvým krokom resekcie bola preparácia, klipovanie a prerušenie a. mesenterica inferior 5–15 mm periférne od odstupu z abdominálnej aorty a následne prerušenie v. mesenterica inferior vysoko pri dolnej hrane pankreasu. Totálna excízia mesorecta (TME) ako aj abdominoperineálna resekcia (APR) bola realizovaná taktikou nervs sparing surgery. U väčšiny pacientov so sfinkter zachovávajúcim výkonom (LAR – low anterior resection) bola uvoľňovaná aj lienálna flexúra. Koloanálna anastomóza bola konštruovaná v úrovni vstupu do levátorového kanálu double stapling technikou. Do novembra 2006 bola rekonštrukcia realizovaná ako „straight anastomóza“ bez protektívnej ileostómie. Od novembra 2006 to bola vždy „side to end“ koloanálna anstomóza s loop protektívnou ileostómiou v pravom mezogastriu. Za konverziu laparoskopickej operácie v otvorenú bol považovaný taký operačný výkon, pri ktorom laparoskopická resekcia bola zahájená, avšak z rôznej príčiny nemohla byť kompletne laparoskopicky dokončená.
V prípade, že po laparoskopickej revízii brušnej dutiny bol laparoskopicky výkon uznaný ako nevhodný a v operácii bolo pokračované otvorene, táto operácia bola považovaná za otvorenú resekciu a pacient nebol zaradený do štúdie [7]. Doba hospitalizácie bola vypočítaná ako súčet operačného dňa a dĺžky pooperačnej hospitalizácie. Ako peroperačná komplikácia bola hodnotená nehoda vyžadujúca zmenu taktiky operačného výkonu a ošetrenie jatrogénnej lezie mimo plánovaného rozsahu resekcie. Za včasnú pooperačnú komplikáciu boli považované všetky chirurgické aj nechirurgické komplikácie zaznamenané do 30. pooperačného dňa. Štádium ochorenia bolo stanovené na základe predoperačné a intraoperačne realizovaných vyšetrení a histopatologického spracovania preparátu podľa TNM klasifikácie zhubných novotvarov [8].
74 pacientov bolo indikovaných k primárnej laparoskopickej resekcii a u 81 operovaných bola realizovaná predoperačná onkologická liečba, z toho u 78 konkomitantná chemorádioterapia, väčšinou s capecitabinom (Xeloda®). U 3 pacientov bola aplikovaná len samotná rádioterapia.
Tabuľka 1 zobrazuje charakteristiku súboru podľa jednotlivých sledovaných parametrov. V obidvoch skupinách dominuje zastúpenie mužov, vek pacientov v skupine CHRT bol signifikantne nižší (p = 0,002) a taktiež v tejto skupine sa nádorová lézia nachádzala v kratšej vzdialenosti od anokutánneho prechodu v porovnaní so skupinou PR (p = 0,002). Dĺžka pooperačnej hospitalizácie bola v obidvoch skupinách zrovnateľná.
Tab. 1. Klinické dáta 155 pacientov zaradených do štúdie Tab. 1. Clinical data from 155 patients included in the study 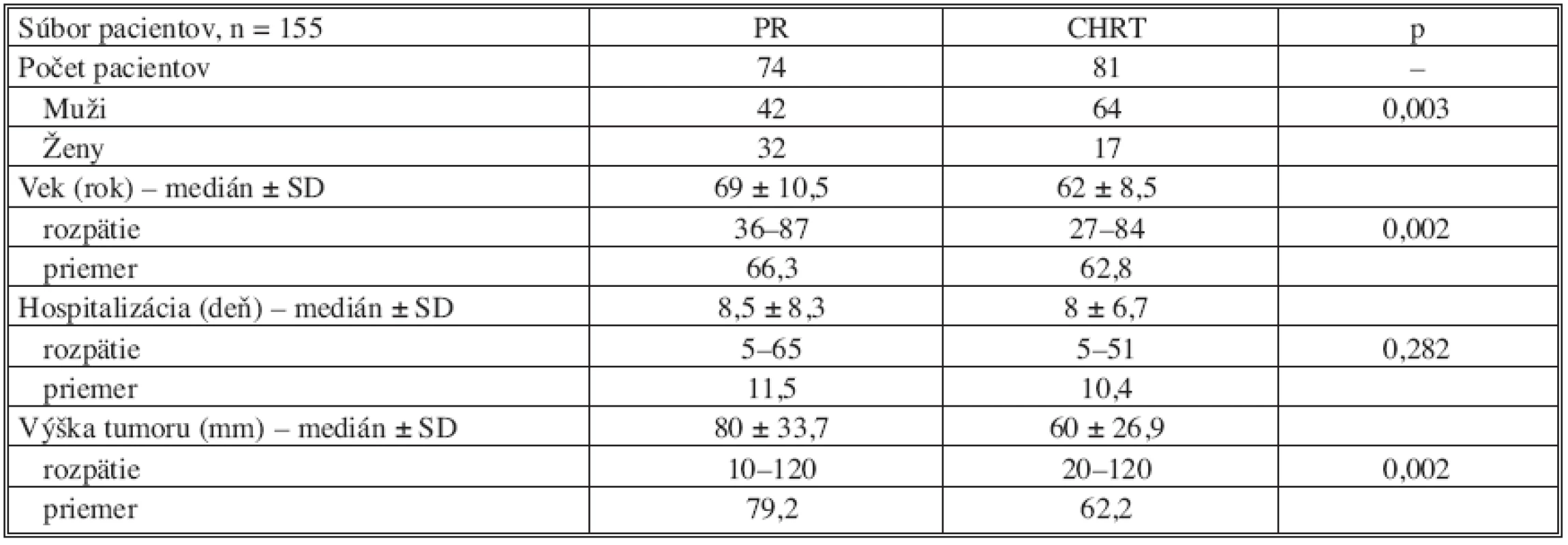
V tabuľke 2 je rozdelenie, pacientov v jednotlivých skupinách podľa klinického štádia karcinómu rekta, vychádzajúceho z TNM klasifikace [8]. V oboch skupinách súboru bolo porovnateľné rozloženie jednotlivých štádií ochorenia. U 7 pacientov (9 %) po predoperačnej chemorádioterapii bola dosiahnutá kompletná patologická odpoveď a u 43 pacientov (53 %) došlo k zníženiu štádiu ochorenia (downstaging) v porovnaní s predliečebným stagingom.
Tab. 2. Rozdelenie súboru 155 pacientov v skupinách podľa klinického štádia ochorenia Tab. 2. Distribution of the study group of 155 subjects according to clinical stages of the disorder 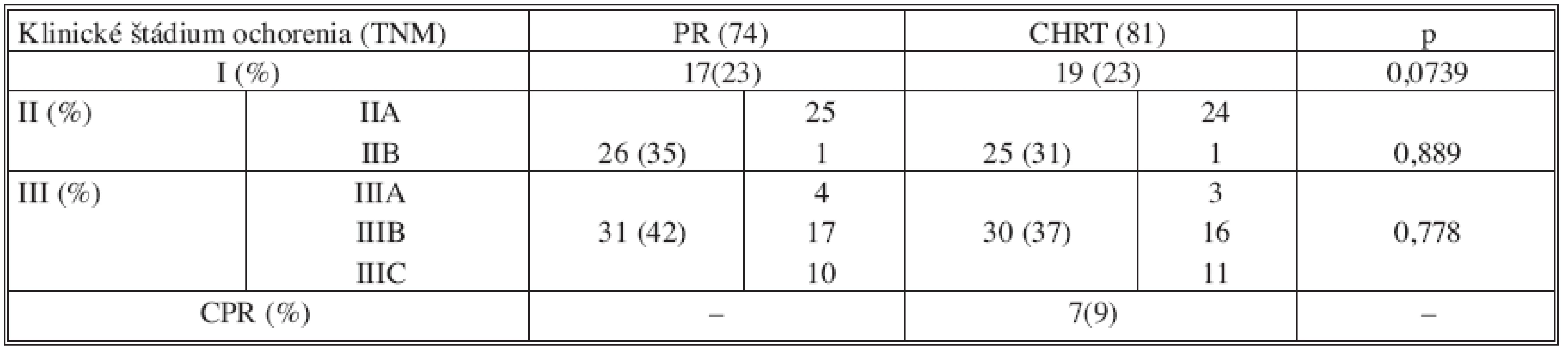
CPR – Complete pathological response Rozdelenie súboru pacientov podľa stupňa diferenciácie karcinómu na základe definitívneho histologického nálezu je zhrnuté v tabuľke 3. V skupine pacientov s primárne indikovanou resekciou rekta dominoval nález stredne diferencovaných tumorov. V skupine pacientov po absolvovanej predoperačnej chemorádioterapii až v 27 histopatologických (33 %) popisoch absentovalo hodnotenie stupňa diferenciácie karcinómu v definitívnom náleze. Dôvodom bola jatrogénna deštrukcia nádorového tkaniva predoperačnou onkologickou liečbou.
Tab. 3. Hodnotenie histopatologického gradingu (G) v jednotlivých skupinách Tab. 3. Assessment of the histopathological grading (G) in the individual groups 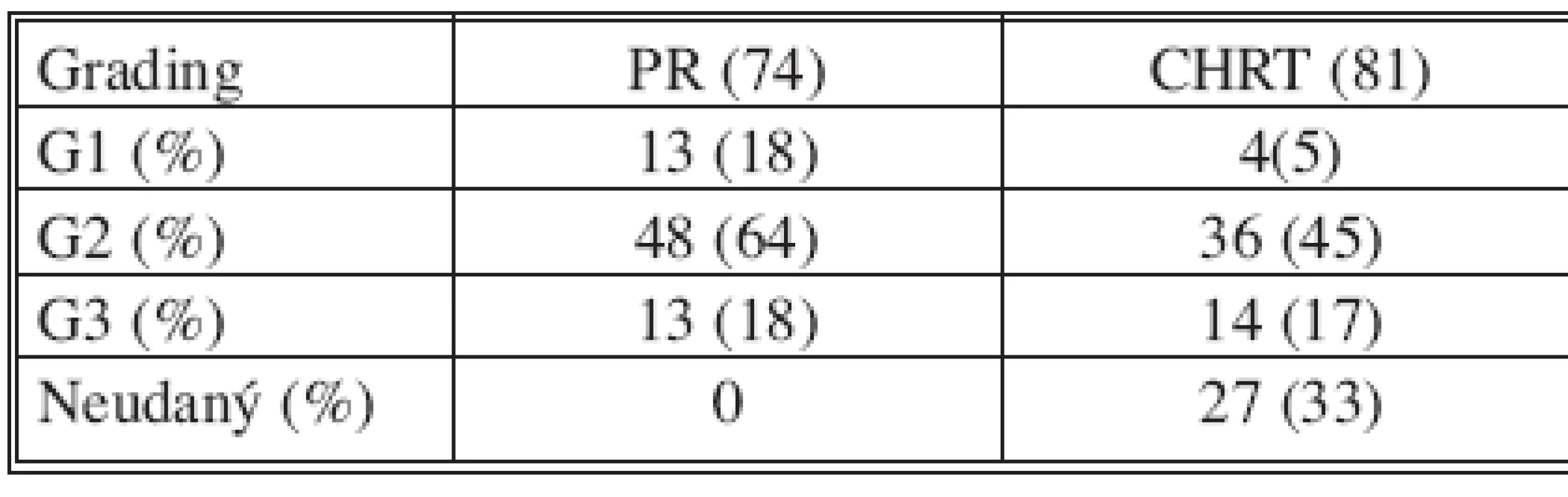
Štatistické metódy
V jednotlivých skupinách pacientov boli sledované parametre spracované metódou popisnej štatistiky (medián, smerodajná odchýlka, rozpätie, priemer). K testovaniu rozdielu medzi skupinami podľa parametru pohlavia bol použitý Fischerov exaktný test. K porovnaniu parametrov vek, operačný čas, trvanie pooperačnej hospitalizácie, vzdialenosť nádoru od anokutánneho prechodu a počet vyšetrených lymfatických uzlín bol použitý Mannov-Whitneyov U test. Analýza bola vykonaná použitím programu SPSS (SPSS Inc., Chicago IL) a SAS (SAS Institute, Cary NC). Hladina významnosti menšia ako 0,05 bola považovaná za štatisticky signifikantnú.
VÝSLEDKY
V skupine PR bolo možné vykonať sfinkter zachovávajúcu operáciu u 56 pacientov, t.j. u 75,7 % primárne operovaných. Lokalizácia nádorovej lezie bola u pacientov s APR signifikantne nižšie v porovnaní so vzdialenosťou nádoru od anokutánneho prechodu pri sfinkter zachovávajúcej resekcii (p < 0,001). Ako je uvedené v tabuľke 4 všetky ostatné sledované parametre pri porovnaní podskupín pacientov s APR a LAR v skupine PR boli zrovnateľné. Laparoskopický výkon bol konvertovaný v otvorenú resekciu u 7 pacientov (9,5 %).
Tab. 4. Vyhodnotenie výsledkov v skupine primárne operovaných pacientov (PR) Tab. 4. Results evaluation in the group of primary operated patients (PR) 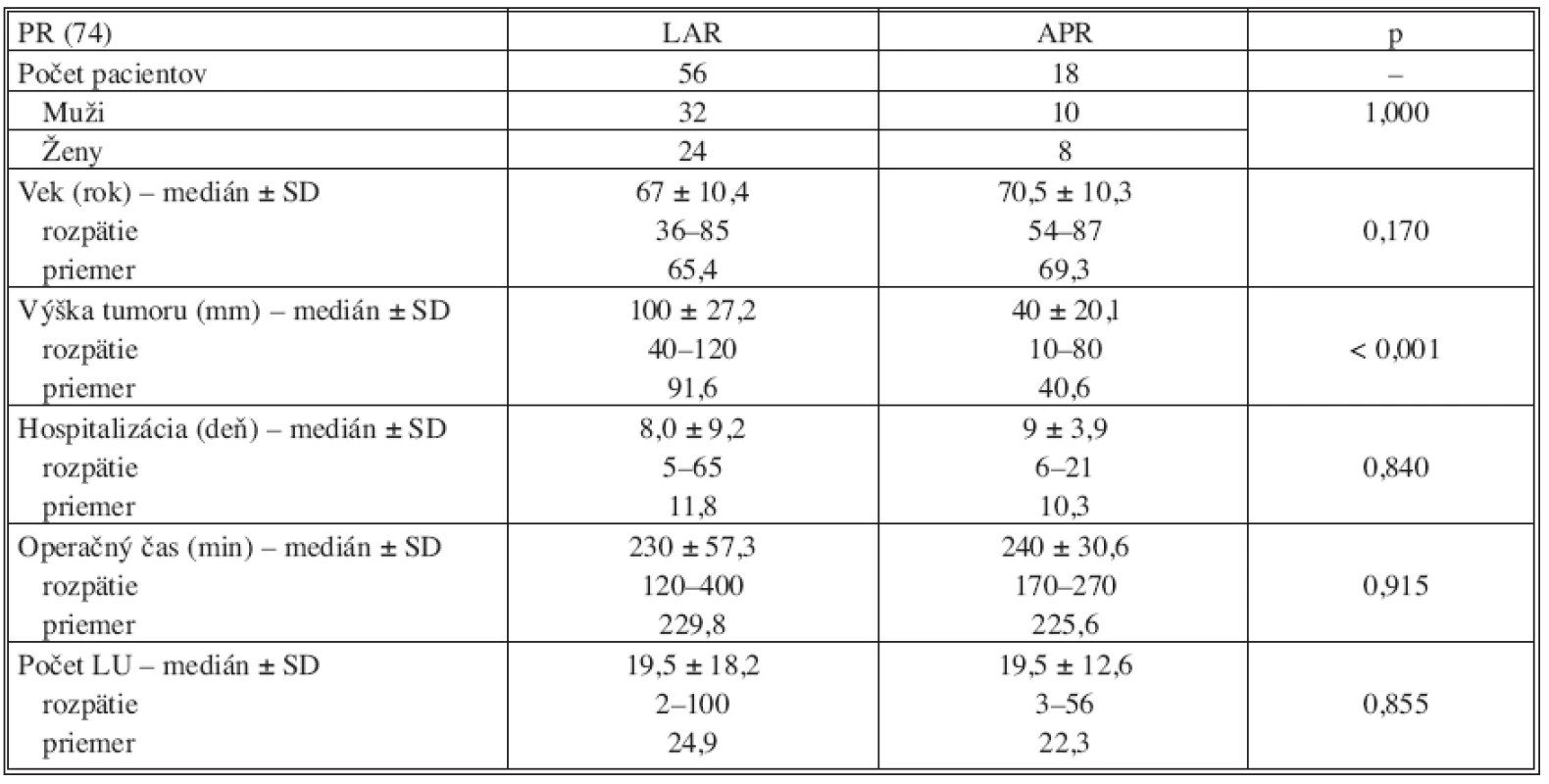
V skupine operovaných po absolvovaní neoadjuvantnej liečby (RCHT) bola vykonaná sfinkter šetriaca resekcia len u 46,9 % pacientov, avšak dolný okraj nádoru bol u pacientov v tejto skupine bližšie k anokutánnemu prechodu v porovnaní so skupinou primárne operovaných pacientov (p = 0,002). V tejto skupine bol zaznamenaný signifikantne vyšší vek v podskupine pacientov s APR v porovnaní s LAR (p = 0,003). Taktiež v tejto skupine bol dolný okraj tumoru lokalizovaný nižšie u pacientov s APR (p = 0,014). Zastúpenie pohlavia, trvanie operačného výkonu, dĺžka pooperačnej hospitalizácie a počet vyšetrených lymfatických uzlín, ako ukazuje tabuľka 5, bol porovnateľný. V tejto skupine bolo nutné vykonať konverziu laparoskopickej resekcie v 13 prípadoch (16 %).
Tab. 5. Vyhodnotenie výsledkov v skupine operovaných pacientov po predoperačnej chemorádioterapii (CHRT) Tab. 5. Results evaluation in the group of operated subjects with preoperative chemotherapy (CHRT) 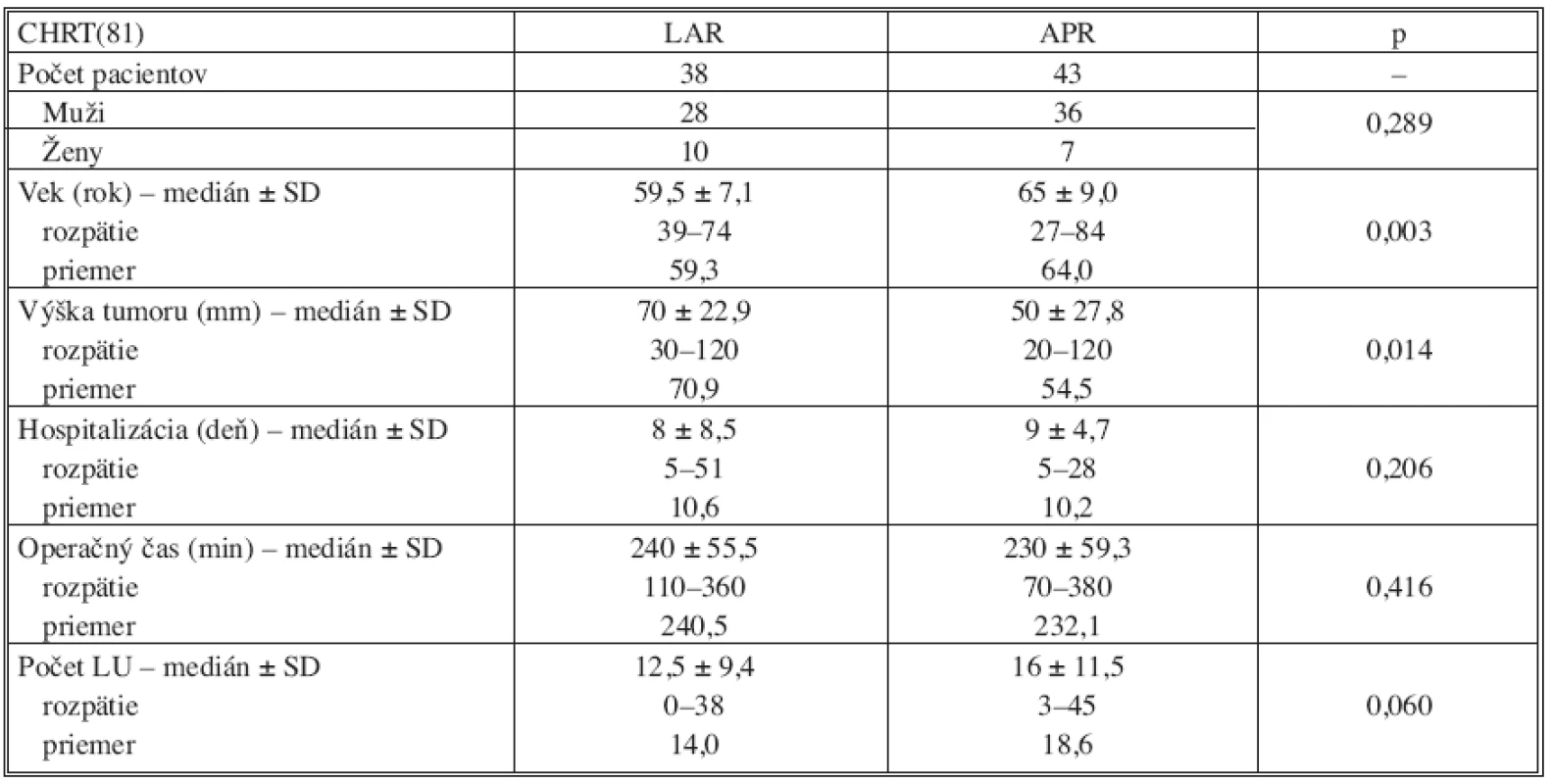
Porovnanie jednotlivých sledovaných parametrov v podskupine pacientov so sfinkter zachovávajúcou operáciou v skupine PR a CHRT ukázalo signifikantný rozdiel vo veku operovaných (p = 0,001) ale najmä v počte vyšetrených lymfatických uzlín. V skupine PR bolo zhodnotených priemerne 24,9 uzlín v porovnaní s 14,0 v skupine CHRT (p < 0,001). U pacientov, ktorí absolvovali predoperačnú chemorádioterapiu bolo možné zrealizovať sfinkter šetriacu operáciu aj pri nižšie lokalizovaných karcinómoch (p = 0,001). Ostatné porovnávané parametre boli v obidvoch skupinách bez zrejmého rozdielu – tabuľka 6. Porovnanie tých istých sledovaných parametrov u pacientov s APR nedokázalo signifikantný rozdiel u skupiny primárne operovaných v porovnaní s operáciou realizovanou po neoadjuvantnej onkologickej liečbe.
Tab. 6. Porovnanie sledovaných parametrov v podskupine sfinkter šetriacich resekcií (LAR) Tab. 6. Assessment of the studied parameters in the sphincter-saving resections subgroup (LAR) 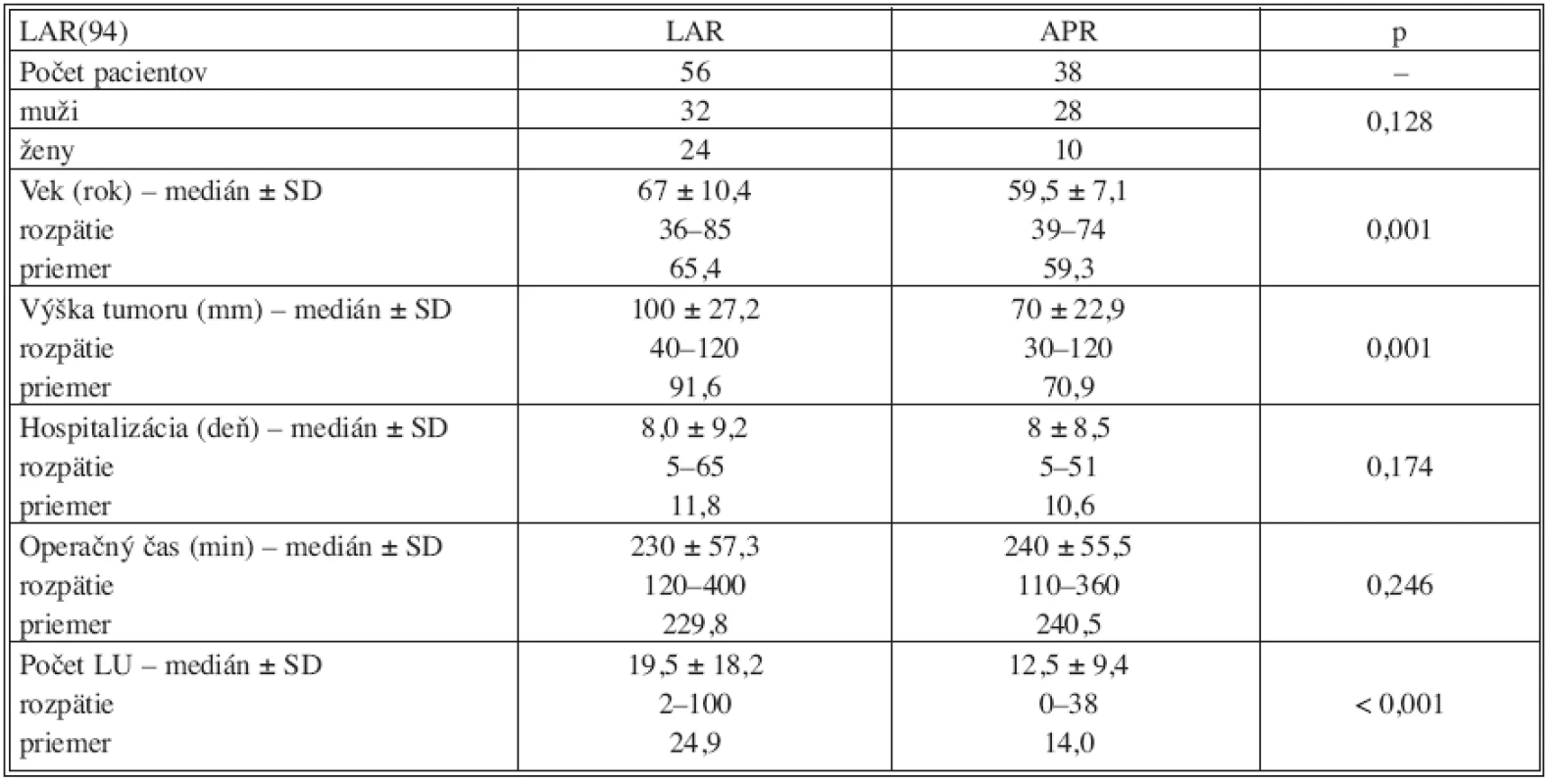
V 9 prípadoch, t.j. u 5,8 % operovaných, bola zaznamenaná peroperačná komplikácia. Najčastejšou intraoperačnou komplikáciou bola perforácia rekta v úrovní nádoru, ktorá bola zaznamenaná v 3 prípadoch. Výskyt iných peroperačných komplikácii bol veľmi zriedkavý. Nebol zaznamenaný štatisticky významný rozdiel v skupine PR v porovnaní so skupinou CHRT (p = 0,632) a ich charakteristiku podáva tabuľka 7. Lézia močovej rúry si vyžiadala konverziu laparoskopickej resekcie a ošetrenie poranenia dolnou strednou laparotómiou. Všetky ostatné intraoperačné komplikácie boli ošetrené laparoskopicky a u týchto pacientov nebola zaznamenaná v pooperačnom období ďalšia komplikáciu stavu.
Tab. 7. Porovnanie výskytu peroperačných komplikácií v súbore pacientov (n=155) Tab. 7. Assessment of intraoperative complications rates in the subject group (n=155) 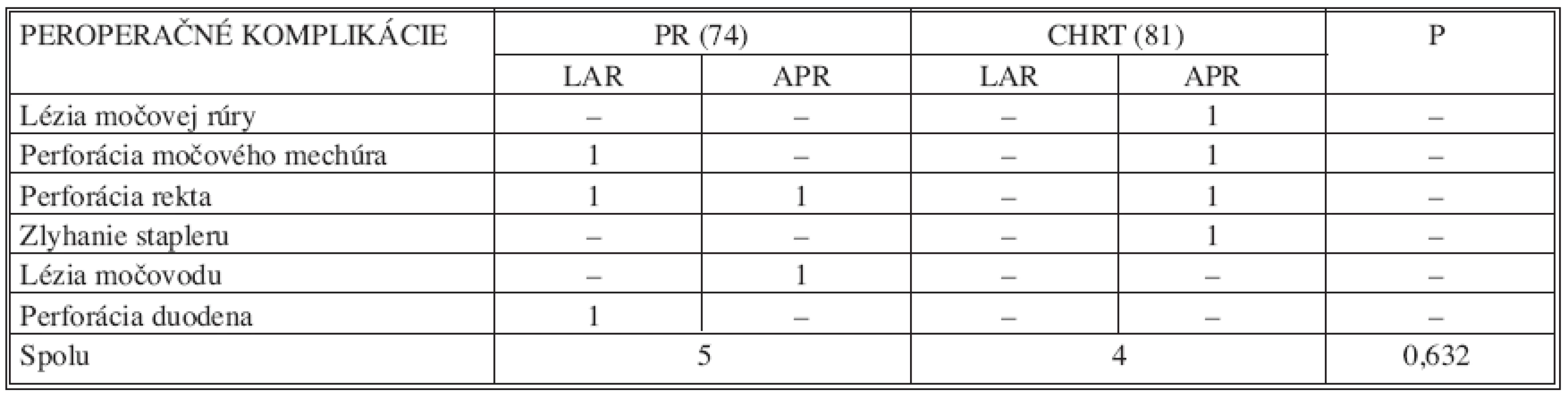
U 13 pacientov, t.j. 13,8 %, so sfinkter šetriacou operáciou bol verifikovaný leak v oblasti koloanálnej anastomózy, z toho u 7 pacientov (7,4 %) musela byť táto komplikácia riešená reoperáciou. Zo 7 reoperaovaných pacientov pre dehiscenciu anastomózy bola u 6 po resekcii rekta primárne konštruovaná „straight“ koloanálna anastomóza bez protektívnej ileostómie a u jedného chorého side to end koloanálna anastomóza s protektívnou ileostómiou. Vo všetkých prípadoch komplikácie v hojení anastomózy sa jednalo o pacientov s karcinómom lokalizovaným v dolnej tretine rekta. Zo skupiny s primárne indikovanou resekciou sa jednalo o 9 pacientov (16,1 %) a zo skupiny po absolvovanej predoperačnej chemorádioterapii o 4 pacientov (10,5 %). U reoperovaných pacientov so symptomatickým leakom anastomózy bol stav riešený založením protektívnej ileostómie a drenážou malej panvy, u pacienta s primárne založenou protektívnou ileostómiou evakuáciou a drenážou presakrálneho abscesu. V súbore nebol zaznamenaný štatisticky významný rozdiel v incidencii skorých pooperačných chirurgických (p = 0,179) a nechirurgických komplikácii (p = 0,654) v skupine PR v porovnaní so skupinou CHRT. Ani jeden pacient zaradený do štúdie nezomrel v sledovanom perioperačnom období. Charakteristiku pooperačných komplikácii a ich zastúpenie v jednotlivých skupinách ukazuje tabuľka 8.
Tab. 8. Porovnanie výskytu chirurgických a nechirurgických pooperačných komplikácii v súbore pacientov (n = 155) Tab. 8. Comparison of surgical and non-surgical postoperative complication rates in the subject group (n = 155) 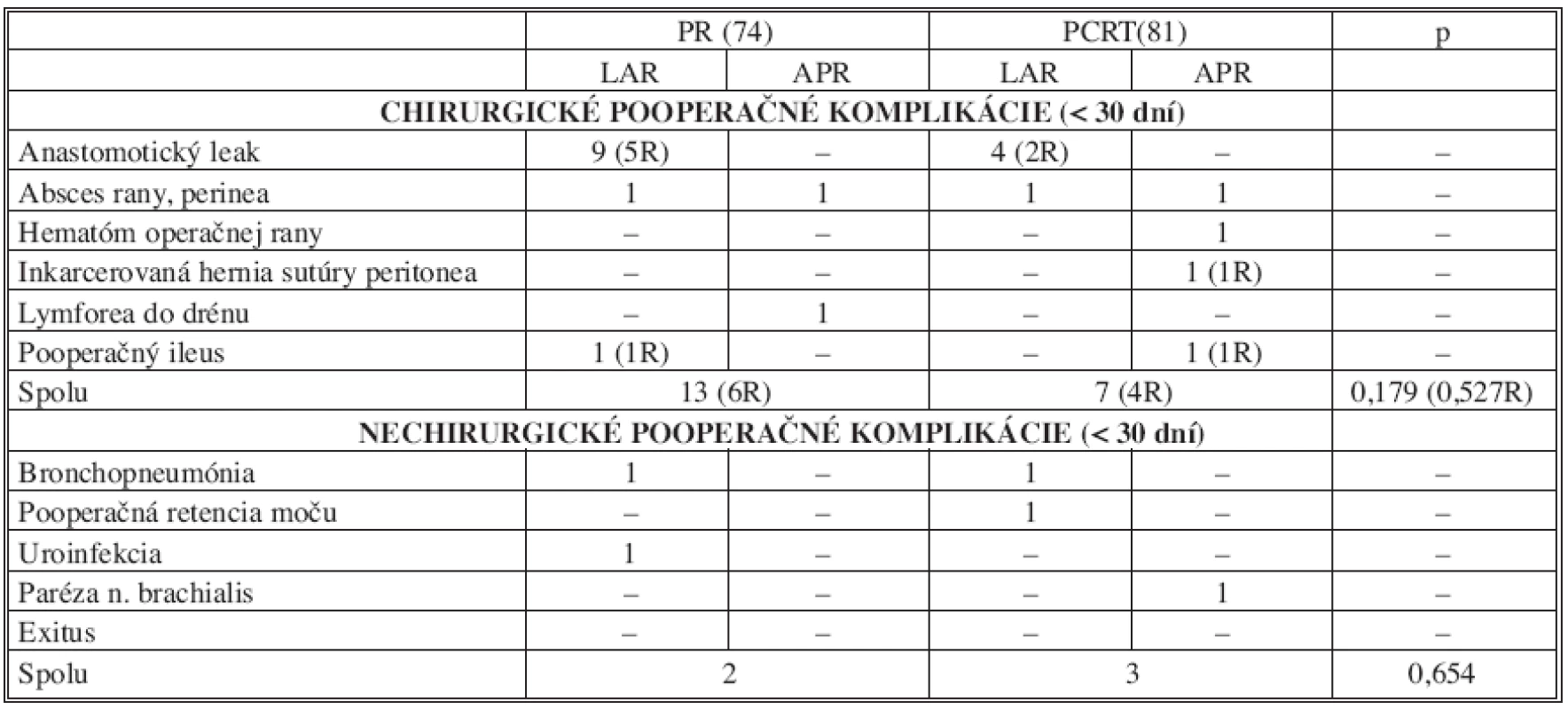
(R) – komplikácia riešená reoperáciou DISKUSIA
Laparoskopický prístup v chirurgickej liečbe karcinómu hrubého čreva a rekta je v súčasnosti akceptovanou alternatívou otvorenej resekcie [7]. Predchádzajúce publikované štúdie prezentujú niekoľko všeobecných výhod laparoskopického prístupu v porovnaní s otvorenou chirurgiou [9]. Je to jednak zníženie peroperačnej krvnej straty [10, 11, 12, 13, 14, 15], nižšia potreba pooperačnej analgetickej liečby [13, 14, 16, 17, 18], skorší návrat črevnej funkcie, skrátenie doby pooperačnej hospitalizácie [11, 12, 13, 14, 19]. Operačný čas laparoskopickej resekcie kolorektálneho karcinómu v porovnaní s otvorenou operáciou sa podľa niektorých štúdii výrazne nelíši [11, 12, 16, 20] podľa iných autorov je laparoskopicky výkon dlhší so štatistickou významnosťou [10, 13, 14, 17]. Taktiež niektoré práce udávajú nižšiu celkovú cenu hospitalizácie po laparoskopickej resekcii [10, 14, 21, 22].
Prežívanie bez prítomnosti ochorenia a celkové prežívanie pacientov s kolorektálnym karcinómom operovaných laparoskopicky je zrovnateľné, v niektorých štúdiách dokonca lepšie, ako po otvorenej resekcii [12, 14, 20, 23, 24].
V súbore z nášho pracoviska bolo možné vykonať sfinkter zachovávajúcu operáciu u 75,7 % v podskupine primárne operovaných, zatiaľ čo v podskupine operovaných po absolvovaní neoadjuvantnej liečby bola vykonaná sfinker šetriaca resekcia len u 46,9 % pacientov. U operovaných, ktorí absolvovali predoperačnú chemorádioterapiu bolo však možné zrealizovať sfinkter šetriaci výkon aj pri nižšie lokalizovaných karcinómoch v porovnaní so skupinou primárne resekovaných nádorov (p = 0,001). Na voľbu typu resekčného výkonu u pacientov s karcinómom rekta vplýva viacero dôležitých faktorov. Najdôležitejším faktorom je možnosť zaistenia dostatočnej onkologickej radikality resekcie dodržaním princípu proximálnej radikality, laterálnej radikality a bezpečnej vzdialenosti dolnej resekčnej línie 1–2 cm. Ďalšími faktormi rozhodujúcimi o type výkonu sú vzdialenosť aborálneho okraja nádoru od zvieračov a anokutánneho prechodu a možnosť vykonania sfinkter šetriaceho operačného výkonu s dosiahnutím optimálnej pooperačnej funkčnosti. Dôležitú úlohu zohráva samozrejme aj veľkosť samotného nádoru a anatomická charakteristika panvy pacienta [25, 26, 27, 28, 29, 30].
Symptomatický leak anastomózy po nízkej resekcii rekta s totálnou excíziou mezorekta je uvádzaný medzi 1 % až 24 % [31]. V nami prezentovanej skupine operovaných po sfinkter zachovávajúcej resekcii bol zaznamenaný leak v oblasti koloanálnej anastomózy v 13,8 %, v podskupine s primárne indikovanou resekciou to bolo 16,1 % a v podskupine po absolvovanej predoperačnej chemorádioterapii u 10,5 % prípadov. Len v 7,4 % prípadoch bolo symptomatickú dehiscenciu anastomózy nutné riešiť reoperáciou. Sauer a kol. z German Rectal Cancer Study Group udávajú vo svojej multicentrickej randomizovanej klinickej štúdii pooperačné komplikácie u 36 % pacientov po predoperačnej chemorádioterapii oproti 34 % pooperačných komplikácii v skupine pacientov operovaných primárne s plánom pooperačnej chemorádioterapie (p = 0,68). Leak anastomózy udávajú u pacientov po predoperačnej chemorádioterapii u 12 % oproti 11 % v skupine pacientov primárnou operáciou (p = 0,77). Mortalita bola v skupine predoperačnej chemorádioterapie 0,7 % oproti 1,3 % v druhej skupine (p = 0,41) [32]. V randomizovanej multicentrickej štúdii publikovanej švédskymi autormi skupiny RECTODES (REctal Cancer Trial On DEfunctioning Stoma) sú porovnávané výsledky u pacientov s karcinómom rekta < 15cm od análneho okraja s primárne založenou loop protektívnou ileostómiou a bez nej. Prítomnosť symptomatického leaku udávajú v 19,2 % prípadov, u pacientov s protektívnou ileostómiou v 10,3 %, bez primárne založenej ileostómie v 28,0 % (p < 0,0001). Urgentná reoperácia bola nutná u 8,6 % pacientov so stómiou a u 25,4 % operovaných bez protektívnej ileostómie (p < 0,0001) [33]. Johnson a kol. vo svojej práci neudávajú signifikantný rozdiel vo výskyte pooperačných infekčných komplikácii u pacientov s primárnou resekčnou operáciou v porovnaní so skupinou pacientov absolvujúcich predoperačnú rádioterapiu [34]. V nami prezentovanej štúdii nebol zaznamenaný štatisticky významný rozdiel v incidencii skorých pooperačných chirurgických (p = 0,179) a ani nechirurgických komplikácii (p = 0,654) v skupine PR v porovnaní so skupinou CHRT.
Medzi kritéria onkologickej radikality patrí okrem dostatočnej vzdialenosti od okrajov nádorovej lezie aj radikálna lymfadenektómia. Počet odohraných a vyšetrených lymfatických uzlín v preparáte je jedným z ukazovateľov kvality vykonanej operácie. Absolútny počet odohraných lymfatických uzlín je určovaný niekoľkými faktormi. Je to jednak faktor pacienta, ktorý svojimi anatomickými danosťami určuje absolútny možný počet lymfatických uzlín v resekovanej oblasti. Druhým je faktor chirurga, ktorý operačnou taktikou, technikou a rozsahom resekcie môže výrazne ovplyvniť počet zhodnotených lymfatických uzlín. Tretím faktorom je patológ, ktorý spôsobom spracovania preparátu a detailnosťou vyšetrenia určuje pN zložku TNM klasifikácie kolorektálneho karcinómu. Taktiež predoperačná chemorádioterapia výrazne ovplyvňuje počet vyšetrených lymfatických uzlín [8, 35, 36, 37, 38]. V našom súbore bol počet zhodnotených lymfatických uzlín u pacientov primárne operovaných signifikantne vyšší (p < 0,001) v porovnaní so skupinou pacientov operovaných po absolvovaní chemorádioterapie.
Gavioly a kol. vo svojej práci udáva dosiahnutie downstagingu u 46,7 % pacientov po absolvovaní predoperačnej chemorádioterapii au 17,9 % kompletnú odpoveď bez nálezu buniek karcinómu [39]. Habr-Gama a kol. udáva kompletnú regresiu až u 28 % pacientov absolvujúcich predoperačnú chemorádioterapiu [40]. V našom súbore bola u 7 pacientov (9 %) po predoperačnej chemorádioterapii dosiahnutá kompletná patologická odpoveď a u 43 pacientov (53 %) došlo k zníženiu štádia ochorenia (downstaging) v porovnaní s predliečebným stagingom.
ZÁVER
Po vyhodnotení perioperačných výsledkov v prospektívnej štúdii Chirurgického oddelení Onkocentra J. G. Mendela a Nemocnice v Novom Jičíne za obdobie posledných 3 rokov, do ktorej bolo zaradených 155 pacientov s karcinómom dolnej a strednej tretiny rekta, môžeme dodať, že laparoskopická resekcia u chorých po absolvovaní neoadjuvantnej chemorádioterapie je síce sprevádzaná vyšším percentom konverzie, avšak v incidencii intraoperačných ako aj skorých pooperačných komplikácii nebol zaznamenaný štatisticky významný rozdiel pri porovnaní výsledkov v skupine primárne resekovaných pacientov so skupinou chorých operovaných po absolvovaní predoperačnej chemorádioterapie.
MUDr. M. Škrovina
Chirurgické oddělení
Onkocentrum J. G. Mendla
K Nemocnici 76
741 01 Nový Jičín
Zdroje
1. Coia, L. R., Gunderson, L. L., et al. Randomised trial of surgery alone versus radiotherapy followed by surgery for potentially operable locally advanced rectal cancer. Mediacal Research Council Rectal Cancer Working Party, Lancet, 1996; 148, 16 : 1605–1610.
2. Martling, A., Holm, T., Johansson, H., Rutqvist, L.E., Cedermark, B. Stockholm Colorectal Cancer Study Group, The Stockholm II trial on preoperative radiotherapy in rectal carcinoma: long-term follow-up of a population-based study. Cancer, 2001; 92 : 896–902.
3. Buie, W. D., MacLean, A. R., Auard, J–A. P., Brasher, P. M., Chan, A. K. Neoadjuvant chemoradiation increases the risk of pelvic sepsis after radical Ecision of rectal cancer. Dis. Colon Rectum, 2005; 18 : 1868-1871.
4. Wood, W. C., Skandalakis, J. E. Anatomic basis of tumor surgery. Quality Medical Publisching Inc., St. Louis, Missouri, 1999 : 884.
5. National Comprehensive Cancer Network: Clinical Practice Guidelines in Oncology [on line], Rectal Cancer: Version 2.2006 [cit. 2007-02-11]. Dostupný z WWW: <http://www.nccn.org>.
6. Tjandra, J. J., Klikenny, J. H., Buie, W. D., Hyman, N., Simmang, C, Anthony, T., Orsay, Ch., Church, J., Otchy, D., Cohen, J., Place, R., Denstman, F., Rakinic, J., Moore, R., Whiteford, M. Practice parameters for the management of rectal cancer (Revised). Dis. Colon Rectum, 2005; 48 : 411–423.
7. Veldkamp, R., Gholghesaei, M., Bonjer, H. J., Meijer, D. W., Buunen, M., Jeekel, J., Anderberg, B., Cuesta, M. A., Cuschieri, A., Fingerhut, A., Fleshman, J. W., Guillou, P. J., Haglind, E., Himpens, J., Jacobi, C. A., Jakimowitz, J. J., Koeckerling, F., Lacy, A. M., Lezoche, E., Monson, J. R., Morino, M., Neugebauer, E., Wexner, S. D., Whelan, R. L. European Association of Endoscopic Surgery (EAES) Laparoscopic resection of colon cancer: consensus of the European Association of Endoscopic Surgery (EAES). Surg. Endosc., 2004; 18 : 1163–1185.
8. International Union Against Cancer (UICC): TNM klasifikace zhoubných novotvaru, Šesté vydaní 2002. Ústav zdravotnických informací a statistiky České republiky, Praha, 2004; 65–68, ISBN 80-7280-391-3.
9. Martínek, L., Dostalík, J., Vávra, P., Guňková, P., Guňka, I. Implementation of POSSUM Scoring System in Assessing Morbidity after Laparoscopic Colorectal Surgery. Rozhl. Chir., 2008; 87 : 26–31.
10. Psaila, J., Bulley, S. H., Ewings, P., Sheffield, J. P., Kennedy, R. H. Outcome following laparoscopic resection for colorectal cancer. Br. J. Surg., 1998; 85 : 662–664.
11. Lacy, A. M., Garcia-Valdecasas, J. C., Delgado, S., Castells, A., Taurá, P., Piqué, J. M., Visa, J. Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet, 2002; 359 : 2224–2229.
12. Champault, G. G., Barrat, Ch., Raselli, R., Elizalde, A., Catheline, J. M. Laparoscopic versus open surgery for colorectal cancer: aprospective clinical trial involving 157 cases with a mean follow-up of 5 yers. Surg. Laparosc. Endosc., 2002;12:, 88–95.
13. Hasegawa, H., Kabeshima, M., Watanabe, M., Yamamoto, S., Kitajima, M. Randomized controlled trial of laparoscopic versus open colectomy for advanced colorectal cancer. Surg. Endosc., 2003; 17 : 636–640.
14. Leung, K. L., Kwok, S. P. Y., Lam, S. C. W., Lee, J. F. Y., Ziu, R. Y. C., Ng, S. S. M., Lai, P. B. S., Lau, W. Z. Laparoscopic resection of rectosigmoid carcinoma: prospective randomised trial. Lancet, 2004; 363 : 1187–1192.
15. Kiran, R. P., Delaney, C. P., Senagore, A. J., Millward, B. L., Fazio, V. W. Operative blood loss and use of blood products after laparoscopic and conventional open colorectal operations. Arch. Surg., 2004; 139 : 39–42.
16. Hewitt, P. M., Ip, S. M., Kwok, S. P. Y., Somers, S. S., Li, K., Leung, K. L., Lau, W. Y., Li, A. K. C. Laparoscopic-assisted vs. open surgery for colorectal cancer: comparative study of immune effects. Dis. Colon Rectum, 1998; 41 : 901–909.
17. Nelson, H., Sargent, D. J., Wieand, S. W., Fleshman, J., Anvari, M., Stryker, S. J., Beart, R. W. Jr, et al. COST (The Clinical Outcomes of Surgical Therapy Study Group), A comparsion of laparoscopically assisted and open colectomy for colon cancer. N. Engl. J. Med., 2004; 350 : 2050–2059.
18. Sklow, B., Read, T., Birnbaum, E., Fry, R., Fleshman, J. Age and type of procedure infuence the choise of patients for laparoscopic colectomy. Surg. Endosc., 2003; 17 : 923–929.
19. Guillou, P. J., Quirke, P., Thorpe, H., Walker, J., Jayne, D. G., Smith, A. M. H., Heath, R. M., Brown, J. M., for the MRC CLASICC trial group: Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer (MRC CLASICC trial): multicentre, randomised controlled trial. Lancet, 2005; 365 : 1718–1726.
20. Lezoche, E., Feliciotti, F., Paganini, A. M., Guerrieri, M., De Sanctis, A., Minervini, S., Campagnacci, R. Laparoscopic vs open hemicolectomy for colon cancer. Surg. Endosc., 2002; 16 : 596–602.
21. Delaney, C. P., Kiran, R. P., Senagore, A. J., Brady, K., Fazio, V. W. Case-matched comparsion of clinical and financial outcome after laparoscopic or open colorectal surgery. Ann. Surg., 2003; 238 : 41–44.
22. Senagore, A. J., Duepree, H. J., Delaney, C. P., Dissanaike, S., Brady, K. M., Fazio, V. W. Cost structure of laparoscopic and open sigmoid colectomy for diverticular disease: similarities and differences. Dis. Colon Rectum, 2002; 45 : 485–490.
23. Feliciotti, F., Paganini, A. M., Guerrieri, M., De Sanctis, A., Campagnacci, R., Lezoche, E. Results of laparoscopic vs open resections for colon cancer in patients with a minimum follow-up of 3 yers. Surg. Endosc., 2002; 16 : 1158–1161.
24. Jacob, B. P., Salky, B. Laparoscopic colectomy for colon adenocarcinoma. Surg. Endosc., 2005; 19 : 643–649.
25. Karanjia, N. D., Schache, D. J., North, W. R. S., Heald, R. J. ‘Close shave‘ in anterior resection. Br. J. Surg., 1990; 77 : 510–512.
26. Pollett, W. G., Nicholls, R. J. The relationship between the extent of distal clearance and survival and local recurrence rates after curative anterior resection for carcinoma of the rectum. Ann. Surg., 1983; 198 : 159–163.
27. Vernava, A. M., Moran, M. A prospective evaluation of distal margins in carcinoma of the rectum. Surg. Gynecol. Obstet, 1992; 175 : 333–336.
28. Williams, N. S., Dixon, M. F., Johnston, D., Reappraisal of the 5 centimetre rule of distal excision for carcinoma of the rectum: A study of distal intramural spread and of patients‘ survival. Br. J. Surg., 1983, 70 : 150–154.
29. Vávra, P., Rýdlová, M., Pelikán, A., Guňková, P., Martínek, L., Guňka, L, Vávrová, M., Anděl, P. Safe distance of the inferior resection line in the rectal carcinoma surgery. Rozhl. Chir., 2006; 85 : 45–50.
30. Rullier, E., Laurent, Ch., Bretagnol, F., Rullier, A., Vendrely, V., Zerbib, F. Sphincter-saving resection for all rectal carcinomas, the end of the 2-cm distal Rule. Ann. Surg., 2005; 241 : 465–469.
31. Rullier, E., Laurent, C, Garrelon, J. F., Michel, P., Saric, J., Pameix, M. Risk factors for anastomotic leakage after resection for rectal cancer. Br. J. Surg., 1998; 85 : 355–358.
32. Sauer, R., Becker, H., Hohenberger, W., Rodel, C, Wittekind, C, Fietkau, R., Martus, P., Tschmelitsch, J., Hager, E., Hess, C. F., Karstens, J. H., Liersch, T., Scmidberger, H., Raab, R., German Rectal Cancer Study Group Preoperative versus postoperative chemoradiotherapy for rectal cancer. N. Engl. J. Med., 2004; 351 : 1731–1740.
33. Matthiessen, P., Hallböök, O., Rutegärd, J., Simert, G., Sjödahl, R. Defunctioning storna reduces symptomatic anastomotic leakage after low anterior resection of the rectum for cancer, a randomized multicenter trial. Ann. Surg., 2007; 246 : 207–214.
34. Johnson, L. B., Jorgensen, L. N., Adawi, D., Blomqvist, P., Asklöf, G. B., Gottrup, F., Jeppsson, B. The effect of preoperative radiotherapy on systemic collagen deposition and postoperative infective complications in rectal cancer patients. Dis. Colon Rectum, 2005; 48 : 1573–1580.
35. Wichmann, M. W., Muller, C, Meyer, G., et al. Effect of preoperative radiochemotherapy on lymph node retrieval after resection of rectal cancer. Arch. Surg., 2002; 137 : 206–210.
36. Wheeler, J. M. D., Warren, B. F., Mortensen, N. J., et al. Quantification of histologie regression of rectal cancer after irradiation: a proposal for a modified staging system. Dis. Colon Rectum, 2002; 45 : 1051–1056.
37. Rinkus, K. M., Ruseell, G. B., Levine, E. A., et al. Prognostic significance of nodal disease following preoperative radiation for rectal adenocarcinoma. Am. Surg., 2002; 68 : 482–487.
38. Beresford, M., Glynne-Jones, R., Richman, P., Makris, A., Mawdsley, S., Stott, D., Harrison, M., Osborne, M., Ashford, R., Al-Jabbour, J., Talbot, L, Mitchell, I. C., Meyrick Thomas, J., Livingstone, J. I., McCue, J., MacDonald, P., Northover, J. A., Windsor, A., Novell, R., Wallace, M., Harrison, R. A. The reliability of lymph-node staging in rectal cancer after preoperative chemoradiotherapy. Clin. Oncol., 2005; 17 : 448–455.
39. Gavioly, M., Luppi, G., Losi, L., Bertolini, F., Santantonio, M., Flachi, A. M., D‘Amico, R., Conte, P. F., Natalini, G. Incidence and clinical impact of sterilized disease and minimal residual disease after preoperative radiochemotherapy for rectal cancer. Dis. Colon Rectum, 2005; 48 : 1851–1857.
40. Habr-Gama, A., Perez, R. O., Nadalin, W., Nahas, S. C., Ribeiro, U. jr., Silva e Sousa, A. H. jr., Campos, F. G., Kiss, D. R., Gama-Rodrigues, J. Long-term results of preoperative chemoradiation for distal rectal cancer correlation between final stage and survival. J. Gastrointest. Surg., 2005; 9 : 90–101.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2008 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Koloproktologie
- Infekce v koloproktologii – slovo úvodem
- Infekce v koloproktologii pohledem mikrobiologa
- Endoluminal Vacuum Therapy for the Treatment of Anastomotic Leakage after Anterior Rectal Resection
- Fournièr’s Gangrene
- Invazivní zygomykóza tlustého střeva u pacienta s diabetem
- Kolitidy vyvolané Clostridium difficile
- Závažné komplikace po prosté apendektomii
- Laparoskopická resekcia karcinómu rekta: zhodnotenie perioperačných výsledkov primárnej resekcie a resekcie po neoadjuvantnej chemorádioterapii
- Rekonstrukce análních svěračů pro fekální inkontinenci a hodnocení funkčních výsledků
- Laparoskopická proktokolektómia s ileo-pouch-análnou anastomózou
- Prof. MUDr. František Řehák, DrSc.
- Ohlédnutí za sympoziem „Endosonografie a virtuální endoskopie“
- Jozef Korček: Diagnostika a terapia análnej inkontinencie
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rekonstrukce análních svěračů pro fekální inkontinenci a hodnocení funkčních výsledků
- Závažné komplikace po prosté apendektomii
- Laparoskopická proktokolektómia s ileo-pouch-análnou anastomózou
- Kolitidy vyvolané Clostridium difficile
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



