-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
Extracellular vesicles in infectious diseases – importance and perspectives
Extracellular vesicles (EVs) are mother cell derived transport units released into the extracellular environment. They are a new pillar of intercellular communication as they carry nucleic acids, proteins, and other signalling molecules, protecting them from degradation in the extracellular environment until fusion of the vesicle with the target cell. The transport mechanism relies on surface structures involved in cell adhesion. It is well known that all cellular organisms are capable of producing EVs. Most human cells have this capability, and EVs can be detected in all body compartments. At the time of their discovery, EVs were considered as useless waste vesicles of marginal interest. Thanks to the newly described transport mechanisms of biologically active molecules, EVs are currently known to participate in a variety of homeostatic mechanisms. In infectious diseases, the most studied area is the modulation of the immune response, where they are seen as potential biomarkers, as their production or the content they carry can be altered under pathological conditions. For microbes, interactions at the pathogen-pathogen and pathogen-host level are at the forefront of attention. EVs also have potential for use as drug delivery systems and novel targets for pharmacotherapy.
Keywords:
infectious diseases – biomarker – extracellular vesicles – pathogen
Autoři: D. Vydrář; S. Snopková; P. Husa
Působiště autorů: Klinika infekčních chorob Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 72, 2023, č. 3, s. 164-171
Kategorie: Souhrnné sdělení
Souhrn
Extracelulární vezikuly (EV) jsou transportní váčky derivované ze zdrojové buňky do extracelulárního prostředí. Představují nový pilíř mezibuněčné komunikace, neboť přenáší nukleové kyseliny, proteiny a různé signální molekuly, které jsou chráněny před degradací v extracelulárním prostředí a posléze jsou uvolněny fúzí vezikuly s cílovou buňkou. Transportní mechanismus je zajištěn povrchovými strukturami účastnícími se buněčné adheze. Je všeobecně známé, že všechny buněčné organismy jsou schopné tvořit EV. Většina lidských buněk je schopna produkovat EV, díky tomu je možná jejich detekce ve všech tělesných kompartmentech. EV při svém objevu byly vnímány jako nepotřebné odpadní váčky a stály na okraji zájmů. Zásluhou nově popsaným mechanismům transportu biologicky aktivních molekul je známo, že se EV účastní celé řady homeostatických mechanismů. V infekčním lékařství je nejvíce studována oblast modulace imunitní odpovědi, kdy jsou vnímány jako potenciální biomarkery, neboť jejich produkce či nesený obsah může být alterován za patologických stavů. U mikrobů stojí v popředí interakce na úrovni patogen-patogen a patogen-hostitel. Další možností je potenciální využití EV jako transportních lékových systémů a nových cílů farmakoterapie.
Klíčová slova:
biomarker – extracelulární vezikuly – infekční lékařství – patogen
ÚVOD DO NOMENKLATURY A KLASIFIKACE VEZIKUL
Extracelulární vezikuly (EV) představují heterogenní skupinu sekrečních vezikul tvořených lipidovou dvouvrstvou, které nejsou schopny replikace a neobsahují buněčné jádro. Vzhledem k progresivně probíhajícímu výzkumu dosud není v literatuře ustálena jejich jednotná klasifikace [1]. Nejstarší a stále používané dělení respektující biogenezi vezikul zahrnuje exozomy, ektozomy, apoptoická tělíska a jiné vezikuly [2]. Jejich vznik je ilustrován na obrázku 1.
Obr. 1. Extracelulární vezikuly – biogeneze a jejich role v mezibuněčné komunikaciFigure 1. Extracellular vesicles – biogenesis and their role in intercellular communication 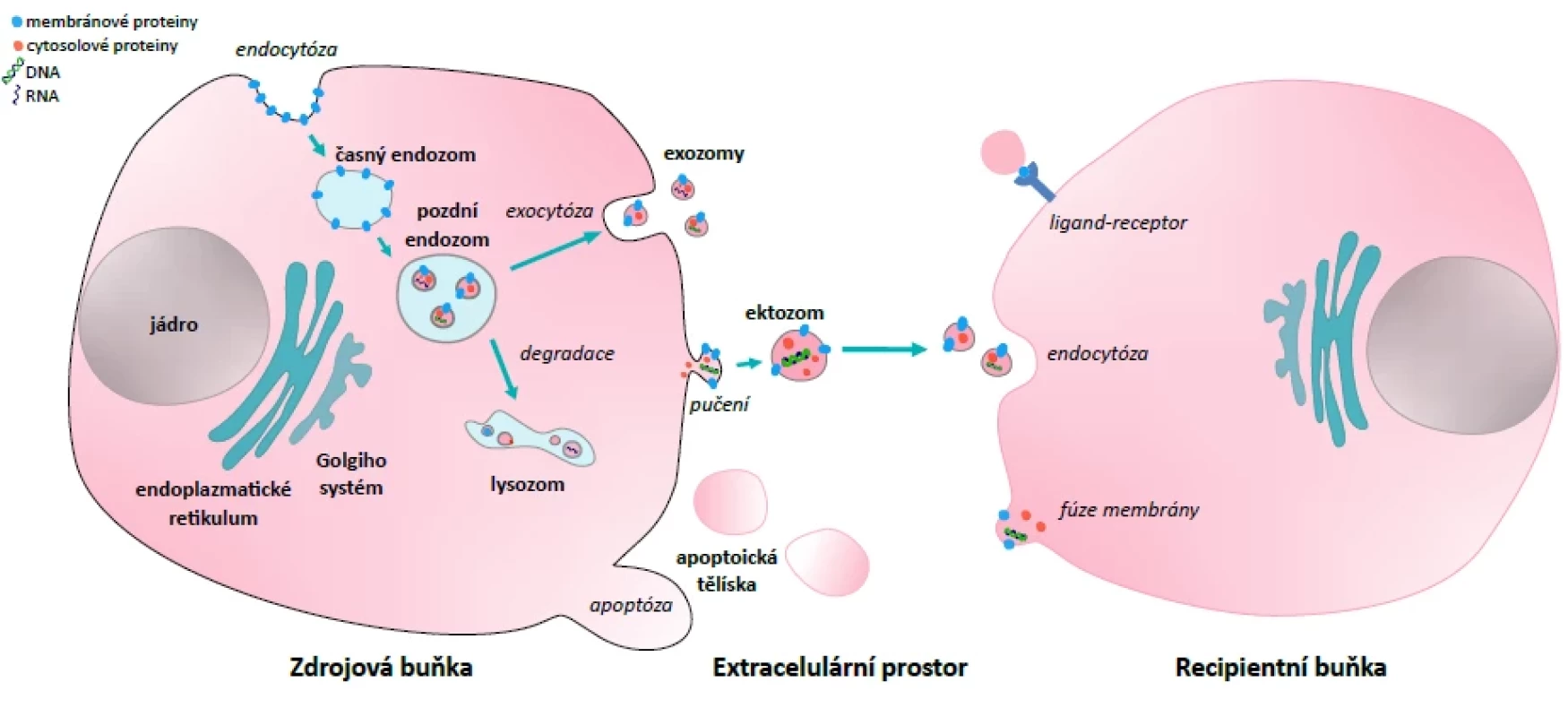
Exozomy představují nejmenší subtyp EV (velikost 30–100 nm). Vzhledem ke své velikosti tyto váčky mohou snáze prostupovat mezi buňkami tvořící přirozené bariéry, a uvolňovat se tak do systémové cirkulace, což je důvod největšího zájmu probíhajících studií. Vznikají endocytózou cytoplazmatické membrány za vzniku časného endozomu, ten prochází vnitřním pučením membrány generující pozdní endozom, který obsahuje intraluminální váčky (budoucí exozomy). Fúzí pozdního endozomu s cytoplazmatickou membránou se uvolňují do extracelulárního prostředí exozomy [3, 4]. Dosud není vyřešena otázka selektivního zabudování obsahu a tvorby membrány vezikul, neboť se dramaticky odlišují od cytosolu a cytoplazmatické membrány zdrojové buňky [5]. V roce 2007 bylo prokázáno, že exozomy mohou obsahovat kódující mRNA, ale i signální mikroRNA, aktivní v recipientní buňce. Tato skutečnost posunula vnímání EV z okrajového tématu do centra zájmů [2, 6].
Ektozomy se označují také jako mikrovezikuly či mikropartikule. Jsou zpravidla větší než exozomy (100 až 1000 nm). Vznikají přímým pučením cytoplazmatické membrány do extracelulárního prostoru. Jejich povrchové znaky do značné míry závisí na složení původní cytoplazmatické membrány buňky, ze které pochází [3, 5, 7]. Při biogenezi ektozomů také dochází k selektivnímu začlenění neseného nákladu [5].
Apoptoická tělíska jsou největší subfrakcí EV (100 až 5000 nm). Vznikají při apoptóze fragmentací buňky a to je důvodem jejich výrazné variability velikosti i obsahu [8]. Předpokládaným hlavním cílem tvorby apoptoických tělísek je buněčná clearance pomocí fagocytujících buněk za absence zánětlivé reakce. Podle novějších prací jsou však navíc zapojeny do mezibuněčné komunikace zejména regulací imunitní odpovědi ve smyslu aktivace nebo suprese [9]. Pro úplnost je vhodné zmínit, že apoptoické buňky dokonce tvoří více EV než buňky zdravé a jsou schopny tvořit ostatní typy EV (ektozomy i exozomy – označované souhrnně apoEV), což reflektuje jejich roli v mezibuněčné komunikaci [10].
Mimo základní tři typy EV jsou mnohými autory dále vyčleňovány vezikuly odkazující na jejich buněčnou funkci, izolační techniky nebo velikost. Jedná se například o onkozomy, nanovezikuly, migrazomy a jiné.
Jejich definice si často napříč různými pracemi protiřečí, mnohdy se liší i základní údaj o jejich velikosti [1, 11]. Úskalí této klasifikace tkví v různorodém buněčném původu vezikul, heterogenitě transportovaného obsahu i povrchových struktur, absenci univerzálního povrchového znaku pro detekci a rozlišení jednotlivých druhů EV a jejich odlišení od podobných částic (lipoproteiny, exomery). Problematické je také to, že stejná buňka může produkovat několik druhů vezikul [11]. Východiskem z této problematiky měla být nová klasifikace vydaná International Society for Extracellular Vesicles v roce 2018 [1]. Je v ní doporučeno používat obecný termín extracelulární vezikula a zdržet se historických termínů odkazujících na biogenezi. Jednoznačně je preferované členění podle měřitelných veličin (velikost, denzita, biochemické složení neseného obsahu, povrchové znaky a buněčný původ). Například dělení dle velikosti na velké, střední a malé EV (Small Extracellular Vesicles, SEV), do kterých jsou řazeny exozomy a malé ektozomy. Tato nová klasifikace vyvrací historické představy o jedinečné biogenezi vezikul a možnou zaměnitelnost při měření v překryvných velikostech EV. Nová klasifikace však není všeobecně přijímána, což činí danou problematiku nesmírně nepřehlednou [12].
Funkce a obsah vezikul
Funkce EV je do značné míry odrazem buněčného původu jednotlivých vezikul, který určuje nesený obsah i povrchové znaky. Tyto charakteristické vlastnosti vezikul se mohou měnit mimo jiné při infekci, buněčném stresu vyvolaném signálními molekulami či jiným patologickým stavem [13]. Membrána EV je složením odlišná od zdrojové buňky (má mimo jiné vyšší obsah lipidů) a na svém povrchu nese adhezní molekuly (např. integriny, selektiny) a specifické proteiny dle zdrojové buňky, které fungují jako receptory, koreceptory nebo ligandy (např. hlavní histokompatibilní komplex 1 a 2, receptor T buněk). Výsledná konformace membrány určuje, zda dochází k aktivaci signální dráhy interakcí ligand-receptor na povrchu cílové buňky nebo k internalizaci vezikuly s uvolněním obsahu do cytosolu – obrázek 1 [3, 4, 6]. V některých pracích bylo popsáno také splynutí vezikuly s lysozomem s následnou degradací obsahu. Dosud není prokázán určující mechanismus rozhodující o degradaci či uvolnění obsahu do cytosolu [14]. Vezikulární lumen může obsahovat zejména nukleové kyseliny (DNA, mRNA, mikroRNA a ostatní nekódující RNA) [6], proteiny, lipidy a komplexnější biomolekuly – enzymy a cytokiny [3, 14, 15]. Tímto způsobem přenesené biomolekuly mohou v recipientní buňce aktivovat nebo inhibovat řadu signálních drah, či dokonce částečně změnit buněčný fenotyp [13, 16]. EV tak mohou zprostředkovat autokrinní, parakrinní, endokrinní i juxtakrinní mezibuněčnou komunikaci [23].
Regulace imunitní odpovědi
V rámci imunitního systému je popsána role EV na mnoha úrovních. Dobře je prozkoumán přenos cytokinů, které jsou EV schopny nést buď na svém povrchu (např. TNFα,TGFβ), nebo jako vnitřní náklad chráněný před degradací v extracelulárním prostředí [14]. Dále mohou transportovat lipidové mediátory odvozené od kyseliny arachidonové a enzymy zapojené do jejich tvorby, a tím přispívat k modulaci zánětlivé reakce [16, 17]. Takto je zajištěna dostatečná koncentrace imunomodulačních faktorů bez ohledu na vzdálenost, což je podkladem charakteristické kooperace buněk imunitního systému označované jako orchestrace [18, 19].
Na úrovni vrozené imunity jsou EV významné jako spouštěč zánětlivé reakce pomocí přenosu signálů exogenního poškození (Pathogen Associated Molecular Patterns, PAMPs) a signálů endogenního poškození (Damage Associated Molecular Patterns, DAMPs). Zdroje PAMPs jsou patogeny přímo produkující EV (bakterie, protozoa) nebo infikované buňky inkorporující do EV cizorodé struktury [20, 21]. Tvorba DAMPs je spojena zejména s oxidačním stresem, mitochondriální toxicitou nebo se zánikem buněk [22]. V obou případech dochází k aktivaci buněk nespecifické imunity. V rámci adaptivní imunity je důležité postavení vezikul v aktivaci T lymfocytů pomocí antigen prezentujících buněk [23]. Bylo prokázáno, že EV pocházející z dendritických buněk mohou nést hlavní histokompatibilní komplex i kostimulační molekuly a také ovlivňují funkční polarizaci T buněk [23, 24, 25]. Konkrétní imunoregulační funkce EV jsou odvozeny od nesených molekul. Byly popsány EV nesoucí ligand indukující apoptózu FasL (FAS Ligand) a dále PDL1 (Programmed Cell Death Ligand 1) a CTLA4 (Cytotoxic T-lymphocyte Associated Antigen 4), které slouží k regulaci imunitní reakce [26, 27].
EV hrají významnou úlohu v regulaci imunitního systému, která probíhá na mnoha úrovních a doplňuje výraznou komplexnost dosud známých imunoregulačních mechanismů. Svým působením potvrzují další charakteristiku imunitního systému, kterou je redundance. EV mohou působit prozánětlivě i protizánětlivě, a tím vytváří dynamickou rovnováhu nutnou k zachování homeostázy [23, 28, 29]. Vychýlení této rovnováhy je podkladem mnoha patologických stavů, např. autoimunitních [30], nádorových [31] a kardiovaskulárních onemocnění [29].
EV a infekční agens
Cílem následujícího textu není přinést úplný seznam patogenů a jejich popsaného vztahu k EV, ale spíše obecné principy, které povedou k pochopení komplexity dané problematiky. V jedné rovině je možné pozorovat interakci přirozeného systému extracelulárních vezikul hostitele a samotného patogenu, kdy působí protektivní funkcí ve smyslu aktivace imunitní odpovědi. Naopak ale mohu sloužit také při diseminaci infekce z pozice transportních váčků mezi buňkami. V další rovině jsou buněčné patogeny schopné rovněž produkovat své EV, které mohou narušovat funkci imunitního systému a mimo jiné sloužit jako transportéry faktorů virulence [21, 28]. Interakci mikrobiálních a endogenních EV ilustruje obrázek 2.
Viry
Viry dokáží využít hostitelského transportního systému EV několika mechanismy. Viriony mohou být inkorporovány do EV hostitelské buňky a posléze transportovány do jiných buněk. Tento mechanismus je popsán zejména u malých EV (SEV), neboť syntéza virové kapsidy a exozomů sdílí stejné buněčné mechanismy [32]. Tato „infikovaná“ vezikula chrání viriony před rozpoznáním imunitním systémem a podílí se na šíření viru do dalších cílových buněk. Jde o hypotézu trojského koně, formulovanou již roku 2003, která predikovala tento mechanismus u retrovirů [33]. Dosud byl popsán například u viru hepatitidy C [34], viru hepatitidy A [35], viru hepatitidy E [36], viru herpes simplex [37] a lidského viru imunodeficience (Human Immunodeficiency Virus, HIV) [38]. EV mohou nést také nekompletní virové struktury. Tento mechanismus je nejlépe prozkoumán u HIV. Recentně byly popsány EV vznikající z buněk infikovaných HIV, které nesou na svém povrchu virový glykoprotein gp120 [39] a dále vezikuly s obsahem TAR RNA (Trans-Activation Response element) nebo genů gag a nef. Tyto vezikuly pak mohou být derivovány z rezervoárů infekce přes přirozené bariéry a aktivovat imunitní buňky. Tímto mechanismem je z části vysvětlen fenomén chronické imunitní aktivace navzdory nedetekovatelné RNA HIV v plazmě u lidí žijících s HIV [40]. Na druhou stranu EV mohou v okolních buňkách blokovat virovou replikaci spuštěním mechanismů přirozené protivirové imunitní reakce tvorbou interferonů [41] či tvorbu endogenního oxidu dusnatého [42]. Dalším mechanismem je tvorba EV nesoucích vazebné receptory, na které se váží viry. Představují tak analogii neutralizačních protilátek. U HIV byl popsán mechanismus tvorby vezikul z CD4+ buněk, které mohou obalovat viriony HIV interakcí s gp120, a tím blokovat vazbu viru s cílovou buňkou [43]. Obdobný mechanismus byl popsán u pacientů s infekcí virem SARS-CoV-2, u kterých byly detekovány zvýšené hodnoty EV nesoucích angiotensin konvertující enzym typu 2 [44].
Obr. 2. Schematické zobrazení původu endogenních a mikrobiálních EVFigure 2. Schematic representation of the origin of endogenous and microbial EVs 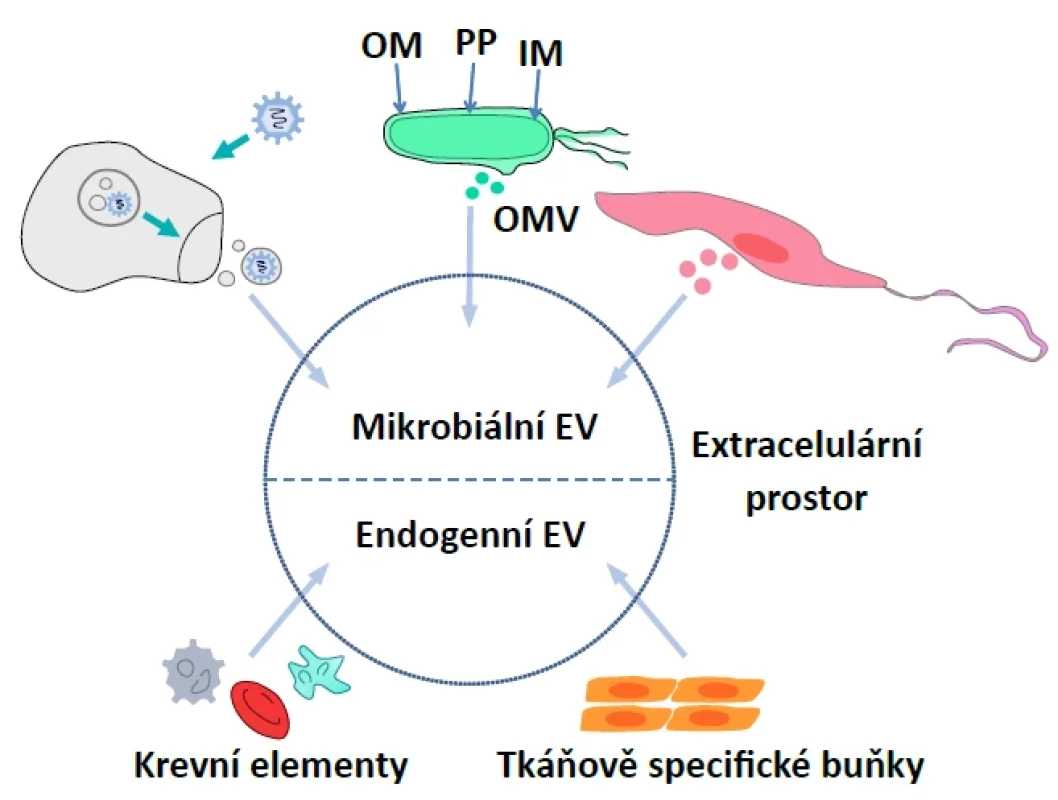
OMV – vezikuly zevní membrány, OM – zevní membrána, PP – periplazmatický prostor, IM – vnitřní membránaOMV – outer membrane vesicles, OM – outer membrane, PP – periplasmic space, IM – inner membrane) Bakterie
Většina bakterií je schopna produkovat EV, které se někdy souhrnně označují jako bakteriální extracelulární vezikuly (BEV). Jde o heterogenní skupinu EV lišící se strukturou i obsahem v závislosti na bakteriálním druhu, biogenezi a stresových faktorech prostředí (např. expozice antibiotikům). BEV mají rozměry v průměru od 40 do 400 nm. Podobně jako u eukaryotních EV, byly BEV prvotně vnímány jako nepotřebné buněčné remnanty. Intenzivní výzkum a průkaz transferu biomolekul poukázal na zásadní roli v buněčné funkci a interakci na mnoha úrovních (bakterie-bakterie, bakterie-hostitel) [45]. U gramnegativních bakterií jsou BEV generovány procesem vezikulace (pučením) zevní membrány a buněčnou lýzou. Pučením zevní membrány vznikají vezikuly zevní membrány (Outer Membrane Vesicles, OMV), které jsou znázorněny na obrázku 2. Vnitřní (cytoplazmatická) membrána zůstává intaktní, vezikulu tak tvoří obsah periplazmatického prostoru a struktury zevní membrány. Mnoho studií v nich prokázalo nukleové kyseliny, cytosolové proteiny a také schopnost transportovat faktory virulence a rezistence k antibiotikům. Selektivita neseného obsahu dokazuje, že jde o dosud neznámým způsobem řízený proces. Druhým mechanismem u gramnegativních bakterií je explozivní buněčná lýza, při které dochází k endolysinem indukovanému štěpení peptidoglykanu buněčné stěny. Tímto mechanismem vznikají OIMV (Outer-Inner Membrane Vesicles) a EOMV (Explosive Outer Membrane Vesicles). Vzhledem k charakteristické biogenezi se předpokládá náhodné začlenění bakteriálních struktur včetně cytoplazmatických a membránových složek [46]. Dle některých prací však OIMV mohou vznikat činností autolysinů při absenci buněčné lýzy [47]. Také grampozitivní bakterie jsou schopné produkovat BEV. Díky absenci zevní membrány se označují jako cytoplazmatické membránové vezikuly (Cytoplasmic Membrane Vesicles, CMV). CMV vznikají procesem buněčné lýzy i vezikulací [48].
BEV slouží jako transportéry signálních molekul a také živin, čímž se podílí na tvorbě a stabilizaci biofilmu. Jejich funkce je odrazem neseného obsahu. Mohou obsahovat chromozomální i plazmidovou DNA, a podílet se tak na horizontálním přenosu genů (např. genů podmiňujících faktory virulence nebo antimikrobiální rezistence) [47, 49]. V bakteriální populaci mohou BEV přenášet také enzymy inaktivující antibiotika. Vzhledem k podobnosti BEV s bakteriální stěnou dochází k vychytávání molekuly antibiotika v extracelulárním prostoru, čímž snižují jeho efektivní koncentraci [50]. BEV mohou interagovat nejenom s bakteriemi jiného druhu, ale překvapivě i s eukaryotními buňkami. Zde je nejpodstatnější přenos faktorů virulence, který je prokázán u celé řady patogenů (např. Escherichia coli, Shigella spp., Pseudomonas spp.). Takto membránou obalené faktory virulence jsou chráněné před účinky degradačních enzymů a protilátek a mohou být neporušené internalizovány hostitelskou buňkou [49]. Další interakce BEV a eukaryotní buňky je podmíněna aktivací přirozené imunity rozpoznáním PAMPs na povrchu vezikul [23, 49]. V současnosti je přikládána velká pozornost detekci vysokých hodnot BEV v systémové cirkulaci člověka u onemocnění asociovaných s poruchou střevní bariéry (infekce HIV, idiopatické střevní záněty, nádorová onemocnění) [51]. Recentně publikované práce také poukazují na prostup BEV (derivovaných ze střeva) přes hematoencefalickou bariéru se vznikem lokální zánětlivé reakce [52]. O významu BEV v systémové cirkulaci zatím můžeme pouze spekulovat. Jsou však důkazem komplexity interakce mikrobioty a hostitele za fyziologických i patologických stavů [49, 51].
Parazitární původci
Problematika EV u parazitů je velmi málo prozkoumána. Jedná se o nesourodou skupinu zahrnující jednobuněčné i mnohobuněčné organismy s odlišnými fyziologickými procesy. Vzhledem k zaměření celé práce jsou dále diskutováni pouze původci lidských parazitárních onemocnění. Parazitární EV mohou modulovat imunitní odpověď hostitele inhibicí tvorby prozánětlivých cytokinů regulací genové transkripce. Tato strategie umožňuje únik před imunitním systémem hostitele. Byla popsána například u Leishmania spp. a Plasmodium spp. [53]. U příslušníků rodu Schistosoma byly popsány EV, které tlumí funkci Th2 lymfocytů [54]. Odlišným mechanismem studovaným například u Echinococcus spp. [55], Heligmosomoides spp.[56] a Toxoplasma gondi [57] je tvorba EV s obsahem nekódujících mikroRNA podobných s hostitelskými mikroRNA se známou imunoregulační funkcí. Na druhou stranu EV mohou indukovat tvorbu prozánětlivých cytokinů (Plasmodium spp. a Trypanosoma spp.) [53,58]. Duální modulace imunitní odpovědi je odrazem složitosti interakce parazita a hostitele. Dále mohou EV nést faktory virulence, které usnadňují následnou invazi patogenu [58]. EV produkované Trichomonas vaginalis tak např. usnadňují adherenci k epiteliálním buňkám urotraktu [59]. EV transferují také diferenciační faktory. Tento jev byl studován u Plasmodim falciparum, kdy EV uvolněné z infikovaného erytrocytu spustili gametogenezi, což je klíčový proces pro přenos plazmodií komářím vektorem [60]. Nedávno byl popsán přenos genů rezistence k antiprotozoálním molekulám mezi příslušníky rodu Leishmania spp. pomocí EV [61]. Studium EV může přinést cenné informace k bližšímu prozkoumání složité patogeneze parazitárních onemocnění s možností tvorby nových terapeutických strategií.
Extracelulární vezikuly jako nové biomarkery
Většina lidských buněk je schopna produkovat EV, což je předpokladem jejich výskytu ve všech tělesných kompartmentech. Dosud byly EV detekovány v krvi, moči, slinách, mozkomíšním moku, mateřském mléce i synoviální tekutině [62]. EV představují jeden ze základních pilířů mezibuněčné komunikace, čímž přispívají k udržení homeostázy. Výsledný účinek je podmíněn intravezikulárním nákladem a také povrchovými strukturami na membráně vezikuly. Jejich tvorba a nesený náklad může být alterován za patologických stavů, kde byly popsány četné kvantitativní i kvalitativní rozdíly ve složení EV. Vzhledem k tomu, že EV jsou specifické buněčným původem a signálními dráhami, které vedly k jejich uvolnění, stávají se velmi slibným nástrojem k bližšímu pochopení složitých patofyziologických procesů a také diagnostickým nástrojem stavů, které k této alteraci vedli [13].
Nejlépe je popsán výskyt EV v krvi, kde jsou nejhojněji zastoupeny EV pocházející z trombocytů, erytrocytů a endoteliálních buněk. Průlomové zjištění přinesla detekce orgánově specifických EV, které díky svému nesenému obsahu umožňují odhadnout funkční stav buněk, ze kterých pochází [63]. Jde o metodu tzv. fluidní biopsie, při které se analyzují například EV, volné cirkulující nukleové kyseliny a tkáňově specifické buňky v periferní krvi [64]. Svým potenciálem neinvazivního biomarkeru má fluidní biopsie velký přesah mimo diagnostiku patogenních infekcí, a to zejména v diagnostice nádorových [65] a neurodegenerativních onemocnění [66].
Detekce patogen specifických EV představuje velmi perspektivní možnost diagnostiky některých infekčních onemocnění. Obecně jsou zde aplikovány dva principy. Jednou možností je stanovení extracelulárních vezikul derivovaných patogenem s obsahem specifických proteinů a nukleových kyselin (např. mikroRNA). Tento způsob detekce je nejlépe prozkoumán u parazitárních onemocnění například u infekcí vyvolanými helminty [67], echinokoky [68] a schistozomami [69]. Druhou možností je stanovení extracelulárních vezikul hostitele obsahující patogenní komponenty, což je výhodné a slibné pro diagnostiku intracelulárních patogenů, jak dokazuje recentní studie popisující diagnostiku plicní i mimoplicní tuberkulózy detekcí EV z makrofágů nesoucí faktory virulence Mycobacterium tuberculosis v séru [70].
V současnosti výrazně vzrůstá zájem o studium EV a jejich role jako biomarkerů při detekci infekčních i neinfekčních onemocnění. Jejich široké přijetí do klinické praxe však omezuje mnoho faktorů. Stěžejní je absence standardizovaných metod izolace a detekce EV z tělních tekutin. Viriony a lipoproteiny mohou mít podobné biofyzikální i molekulární charakteristiky jako EV detekované v plazmě [71]. Podobně je nutné odlišení EV od recentně popsaných exomer a supermer, souhrnně označovaných jako nanočástice nebo non-EV [1, 72]. Dále také není vyřešena otázka intraindividuální a interindividuální variability [73].
Potenciální terapeutika nové generace
Extracelulární vezikuly jsou díky své přirozené funkci transportních váčků perspektivní terapeutickou modalitou. Předpokládá se využití EV jako platforem pro dodání terapeutik se zacílením na konkrétní buněčné populace [74]. Další slibnou možností je ovlivnění biogeneze endogenního systému EV ve smyslu inhibice/ stimulace tvorby a také inhibice příjmu EV recipientní buňkou [75]. Inhibice tvorby mikrobiálních EV představuje novou možnost antimikrobiální terapie [76]. Jako samostatná terapeutika jsou studovány EV derivované z mezenchymálních kmenových buněk [77]. Intenzivně je zkoumána možnost využití bakteriálních extracelulárních vezikul jako nové vakcinační platformy. Toto využití je výhodné pro nízkou výrobní cenu, přítomnost několika imunogenních povrchových antigenů a také nemožnost samostatné replikace vezikul [75, 78]. V současnosti jsou používány vakcíny proti Neisseria meningitidis skupiny B založené na vezikulách zevní membrány (OMV) [79].
Navzdory nadějným terapeutickým možnostem musí být překonána četná omezení. Je třeba dalších studií, které osvětlí dosud neznámá místa ve fyziologii a patofyziologii endogenních i exogenních vezikul, což umožní vytyčit nové farmakoterapeutické cíle. Velkou výzvu představuje výběr buněčných kultur umožňující dostatečnou produkci pro klinické využití [75, 80].
ZÁVĚR
Intenzivní výzkum výraznou měrou přispěl k lepšímu pochopení významu a funkce EV. Jde o nesmírně komplexní problematiku, danou heterogenitou neseného obsahu i strukturou měnící se napříč buněčnými organismy. Definování obsahu extracelulárních vezikul v kontextu jak endogenních (hostitelských), tak i exogenních (mikrobiálních) složek a jejich změny v průběhu infekce je zásadní pro lepší pochopení modulace imunitních reakcí a mechanismů patogenity. Zůstává zde však mnoho otázek a proměnných, zasahujících od samotné biogeneze a transferu biomolekul až po analytické a produkční záměry. Progresivní výzkum v této oblasti může vést k lepšímu pochopení duální role EV v procesech fyziologických i patofyziologických a vést k vývoji nových biomarkerů a farmakoterapeutických cílů.
Poděkování
Autoři děkují Mgr. Lence Kosečkové Micenkové, Ph.D. (pracoviště: RECETOX Masarykova univerzita) za grafické zpracování obrázků.
Podpořeno MZ ČR – RVO (FNBr, 65269705).
Do redakce došlo dne 10. 1. 2023.
Adresa pro korespondenci:
MUDr. David Vydrář
Klinika infekčních chorob LF MU a FN Brno
Jihlavská 340/20 625 00 Brno
e-mail: vydrar.david@fnbrno.cz
Zdroje
- Théry C, Witwer KW, Aikawa E, et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. J Extracell Vesicles, 2018;7(1):1535750.
- Bazzan E, Tinè M, Casara A, et al. Critical Review of the Evolution of Extracellular Vesicles’ Knowledge: From 1946 to Today. Int J Mol Sci, 2021;22(12):6417.
- van Niel G, D’Angelo G, Raposo G. Shedding light on the cell biology of extracellular vesicles. Nat Rev Mol Cell Biol, 2018;19(4):213–228.
- Mathieu M, Martin-Jaular L, Lavieu G, et al. Specificities of secretion and uptake of exosomes and other extracellular vesicles for cell-to-cell communication. Nat Cell Biol, 2019;21(1):9–17.
- Margolis L, Sadovsky Y. The biology of extracellular vesicles: The known unknowns. PLoS Biol, 2019;17(7):e3000363.
- Valadi H, Ekström K, Bossios A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol, 2007;9(6):654–659.
- Słomka A, Urban SK, Lukacs-Kornek V, et al. Large Extracellular Vesicles: Have We Found the Holy Grail of Inflammation? Front Immunol, 2018;9 : 2723.
- Battistelli M, Falcieri E. Apoptotic Bodies: Particular Extracellular Vesicles Involved in Intercellular Communication. Biology, 2020;9(1):21.
- Caruso S, Poon IKH. Apoptotic Cell-Derived Extracellular Vesicles: More Than Just Debris. Front Immunol, 2018;9 : 1486.
- Kakarla R, Hur J, Kim YJ, et al. Apoptotic cell-derived exosomes: messages from dying cells. Exp Mol Med, 2020;52(1):1–6.
- van der Pol E, Böing AN, Gool EL, et al. Recent developments in the nomenclature, presence, isolation, detection and clinical impact of extracellular vesicles. J Thromb Haemost, 2016;14(1):48 – 56.
- Witwer KW, Théry C. Extracellular vesicles or exosomes? On primacy, precision, and popularity influencing a choice of nomenclature. J Extracell Vesicles, 2019;8(1):1648167.
- Yates AG, Pink RC, Erdbrügger U, et al. In sickness and in health: The functional role of extracellular vesicles in physiology and pathology in vivo. J Extracell Vesicles, 2022;11(1):e12151.
- Benjamin-Davalos S, Koroleva M, Allen CL, et al. Co-Isolation of Cytokines and Exosomes: Implications for Immunomodulation Studies. Front Immunol, 2021;12 : 638111.
- Aiello A, Giannessi F, Percario ZA, et al. An emerging interplay between extracellular vesicles and cytokines. Cytokine Growth Factor Rev, 2020;51 : 49–60.
- Amjadi MF, Avner BS, Greenlee-Wacker MC, et al. Neutrophil-derived extracellular vesicles modulate the phenotype of naïve human neutrophils. J Leukoc Biol, 2021;110(5):917–925.
- Boilard E. Extracellular vesicles and their content in bioactive lipid mediators: more than a sack of microRNA. J Lipid Res, 2018;59(11):2037–2046.
- Kriebel PW, Majumdar R, Jenkins LM, et al. Extracellular vesicles direct migration by synthesizing and releasing chemotactic signals. J Cell Biol, 2018;217(8):2891–2910.
- Martinon F. Orchestration of pathogen recognition by inflammasome diversity: Variations on a common theme. Eur J Immunol, 2007;37(11):3003–3006.
- Hui WW, Emerson LE, Clapp B, et al. Antigen-encapsulating host extracellular vesicles derived from Salmonella-infected cells stimulate pathogen-specific Th1-type responses in vivo. PLoS Pathog, 2021;17(5):e1009465.
- Schorey JS, Cheng Y, Singh PP, et al. Exosomes and other extracellular vesicles in host–pathogen interactions. EMBO reports, 2015;16(1):24–43.
- Picca A, Guerra F, Calvani R, et al. Extracellular Vesicles and Damage-Associated Molecular Patterns: A Pandora’s Box in Health and Disease. Front Immunol, 2020;11 : 601740.
- Buzas EI. The roles of extracellular vesicles in the immune system. Nat Rev Immunol, 2022 : 1–15.
- Segura E, Amigorena S, Théry C. Mature dendritic cells secrete exosomes with strong ability to induce antigen-specific effector immune responses. Blood Cells Mol Dis, 2005;35(2):89–93.
- Tkach M, Kowal J, Zucchetti AE, et al. Qualitative differences in T-cell activation by dendritic cell-derived extracellular vesicle subtypes. EMBO J, 2017;36(20):3012–3028.
- Hofmann L, Ludwig S, Vahl JM, et al. The Emerging Role of Exosomes in Diagnosis, Prognosis, and Therapy in Head and Neck Cancer. Int J Mol Sci, 2020;21(11):E4072.
- Ma F, Vayalil J, Lee G, et al. Emerging role of tumor-derived extracellular vesicles in T cell suppression and dysfunction in the tumor microenvironment. J Immunother Cancer, 2021;9(10):e003217.
- Zhang W, Jiang X, Bao J, et al. Exosomes in Pathogen Infections: A Bridge to Deliver Molecules and Link Functions. Front Immunol, 2018;9 : 90.
- Yates AG, Pink RC, Erdbrügger U, et al. In sickness and in health: The functional role of extracellular vesicles in physiology and pathology in vivo. J Extracell Vesicles, 2022;11(1):e12151.
- Lu M, DiBernardo E, Parks E, et al. The Role of Extracellular Vesicles in the Pathogenesis and Treatment of Autoimmune Disorders. Front Immunol, 2021;12 : 566299.
- Xu R, Rai A, Chen M, et al. Extracellular vesicles in cancer – implications for future improvements in cancer care. Nat Rev Clin Oncol, 2018;15(10):617–638.
- Nolte-‘t Hoen E, Cremer T, Gallo RC, et al. Extracellular vesicles and viruses: Are they close relatives? Proc Natl Acad Sci U S A, 2016;113(33):9155–9161.
- Gould SJ, Booth AM, Hildreth JEK. The Trojan exosome hypothesis. Proc Natl Acad Sci U S A, 2003;100(19):10592–10597.
- Ramakrishnaiah V, Thumann C, Fofana I, et al. Exosome-mediated transmission of hepatitis C virus between human hepatoma Huh7.5 cells. Proc Natl Acad Sci U S A, 2013;110(32):13109–13113.
- Feng Z, Hensley L, McKnight KL, et al. A pathogenic picornavirus acquires an envelope by hijacking cellular membranes. Nature, 2013;496(7445):367–371.
- Nagashima S, Jirintai S, Takahashi M, et al. Hepatitis E virus egress depends on the exosomal pathway, with secretory exosomes derived from multivesicular bodies. J Gen Virol, 2014;95(Pt 10):2166–2175.
- Bello-Morales R, López-Guerrero JA. Isolation/Analysis of Extracellular Microvesicles from HSV-1-Infected Cells. Methods Mol Biol, 2020;2060 : 305–317.
- Kadiu I, Narayanasamy P, Dash PK, et al. Biochemical and biologic characterization of exosomes and microvesicles as facilitators of HIV-1 infection in macrophages. J Immunol, 2012;189(2):744 – 754.
- Arakelyan A, Fitzgerald W, Zicari S, et al. Extracellular Vesicles Carry HIV Env and Facilitate Hiv Infection of Human Lymphoid Tissue. Sci Rep, 2017;7(1):1695.
- Dias MVS, Costa CS, daSilva LLP. The Ambiguous Roles of Extracellular Vesicles in HIV Replication and Pathogenesis. Front Microbiol, 2018;9 : 2411.
- Martins S de T, Alves LR. Extracellular Vesicles in Viral Infections: Two Sides of the Same Coin? Front Cell Infect Microbiol, 2020;10 : 593170.
- Nocera AL, Mueller SK, Stephan JR, et al. Exosome swarms eliminate airway pathogens and provide passive epithelial immunoprotection through nitric oxide. J Allergy Clin Immunol, 2019;143(4):1525–1535.
- de Carvalho JV, de Castro RO, da Silva EZM, et al. Nef neutralizes the ability of exosomes from CD4+ T cells to act as decoys during HIV-1 infection. PLoS One, 2014;9(11):e113691.
- El-Shennawy L, Hoffmann AD, Dashzeveg NK, et al. Circulating ACE2-expressing extracellular vesicles block broad strains of SARS-CoV-2. Nat Commun, 2022;13(1):405.
- Toyofuku M, Nomura N, Eberl L. Types and origins of bacterial membrane vesicles. Nat Rev Microbiol, 2019;17(1):13–24.
- Sartorio MG, Pardue EJ, Feldman MF, et al. Bacterial Outer Membrane Vesicles: From Discovery to Applications. Annu Rev Microbiol, 2021;75(1):609–630.
- Aytar Çelik P, Derkuş B, Erdoğan K, et al. Bacterial membrane vesicle functions, laboratory methods, and applications. Biotechnol Adv, 2022;54 : 107869.
- Briaud P, Carroll RK. Extracellular Vesicle Biogenesis and Functions in Gram-Positive Bacteria. Infect Immun, 2020;88(12):e00433–20.
- Caruana JC, Walper SA. Bacterial Membrane Vesicles as Mediators of Microbe – Microbe and Microbe – Host Community Interactions. Front Microbiol, 2020;11 : 432.
- Liu X, Xiao J, Wang S, et al. Research Progress on Bacterial Membrane Vesicles and Antibiotic Resistance. Int J Mol Sci, 2022;23(19):11553.
- Hendrix A, De Wever O. Systemically circulating bacterial extracellular vesicles: origin, fate, and function. Trends Microbiol, 2022;30(3):213–216.
- Cuesta CM, Guerri C, Ureña J, et al. Role of Microbiota-Derived Extracellular Vesicles in Gut-Brain Communication. Int J Mol Sci, 2021;22(8):4235.
- Carrera-Bravo C, Koh EY, Tan KSW. The roles of parasite-derived extracellular vesicles in disease and host-parasite communication. Parasitol Int, 2021;83 : 102373.
- Abou-El-Naga IF. Emerging roles for extracellular vesicles in Schistosoma infection. Acta Trop, 2022;232 : 106467.
- Zhang X, Gong W, Cao S, et al. Comprehensive Analysis of Non-coding RNA Profiles of Exosome-Like Vesicles From the Protoscoleces and Hydatid Cyst Fluid of Echinococcus granulosus. Front Cell Infect Microbiol, 2020;10 : 316.
- White R, Kumar S, Chow FWN, et al. Extracellular vesicles from Heligmosomoides bakeri and Trichuris muris contain distinct microRNA families and small RNAs that could underpin different functions in the host. Int J Parasitol, 2020;50(9):719–729.
- Silva VO, Maia MM, Torrecilhas AC, et al. Extracellular vesicles isolated from Toxoplasma gondii induce host immune response. Parasite Immunol, 2018;40(9):e12571.
- Szempruch AJ, Dennison L, Kieft R, et al. Sending a message: extracellular vesicles of pathogenic protozoan parasites. Nat Rev Microbiol, 2016;14(11):669–675.
- Twu O, de Miguel N, Lustig G, et al. Trichomonas vaginalis exosomes deliver cargo to host cells and mediate host∶parasite interactions. PLoS Pathog, 2013;9(7):e1003482.
- Mantel PY, Hoang AN, Goldowitz I, et al. Malaria-infected erythrocyte-derived microvesicles mediate cellular communication within the parasite population and with the host immune system. Cell Host Microbe, 2013;13(5):521–534.
- Douanne N, Dong G, Amin A, et al. Leishmania parasites exchange drug-resistance genes through extracellular vesicles. Cell Rep, 2022;40(3):111121.
- Ciferri MC, Quarto R, Tasso R. Extracellular Vesicles as Biomarkers and Therapeutic Tools: From Pre-Clinical to Clinical Applications. Biology (Basel), 2021;10(5):359.
- Alberro A, Iparraguirre L, Fernandes A, et al. Extracellular Vesicles in Blood: Sources, Effects, and Applications. Int J Mol Sci, 2021;22(15):8163.
- Zhou B, Xu K, Zheng X, et al. Application of exosomes as liquid biopsy in clinical diagnosis. Sig Transduct Target Ther, 2020;5(1):1–14.
- Hu T, Wolfram J, Srivastava S. Extracellular Vesicles in Cancer Detection: Hopes and Hypes. Trends Cancer, 2021;7(2):122–133.
- Abdel-Haq H. The Potential of Liquid Biopsy of the Brain Using Blood Extracellular Vesicles: The First Step Toward Effective Neuroprotection Against Neurodegenerative Diseases. Mol Diagn Ther, 2020;24(6):703–713.
- Mu Y, McManus DP, Gordon CA, et al. Parasitic Helminth-Derived microRNAs and Extracellular Vesicle Cargos as Biomarkers for Helminthic Infections. Front Cell Infect Microbiol, 2021;11 : 708952.
- Guo X, Wang S, Zhang J, et al. Proteomic profiling of serum extracellular vesicles identifies diagnostic markers for echinococcosis. PLoS Negl Trop Dis, 2022; 16(10):e0010814.
- Chen Y, Giri BR, Li X, et al. Preliminary evaluation of the diagnostic potential of Schistosoma japonicum extracellular vesicle proteins for Schistosomiasis japonica. Acta Trop, 2020;201 : 105184.
- Zheng W, LaCourse SM, Song B, et al. Diagnosis of paediatric tuberculosis by optically detecting two virulence factors on extracellular vesicles in blood samples. Nat Biomed Eng, 2022;6(8):979–991.
- Holcar M, Kandušer M, Lenassi M. Blood Nanoparticles – Influence on Extracellular Vesicle Isolation and Characterization. Front Pharmacol, 2021;12 : 773844.
- Zhang Q, Jeppesen DK, Higginbotham JN, et al. Supermeres are functional extracellular nanoparticles replete with disease biomarkers and therapeutic targets. Nat Cell Biol, 2021;23(12):1240 – 1254.
- Shah R, Patel T, Freedman JE. Circulating Extracellular Vesicles in Human Disease. N Engl J Med, 2018;379(10):958–966.
- Herrmann IK, Wood MJA, Fuhrmann G. Extracellular vesicles as a next-generation drug delivery platform. Nat Nanotechnol, 2021;16(7):748–759.
- Cheng L, Hill AF. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov, 2022;21(5):379–399.
- Chen J, Zhang H, Wang S, et al. Inhibitors of Bacterial Extracellular Vesicles. Front Microbiol, 2022;13 : 835058.
- You J, Fu Z, Zou L. Mechanism and Potential of Extracellular Vesicles Derived From Mesenchymal Stem Cells for the Treatment of Infectious Diseases. Front Microbiol, 2021;12 : 761338.
- Santos P, Almeida F. Exosome-Based Vaccines: History, Current State, and Clinical Trials. Front Immunol, 2021;12 : 711565.
- Carter NJ. Multicomponent Meningococcal Serogroup B Vaccine (4CMenB; Bexsero®): A Review of its Use in Primary and Booster Vaccination. BioDrugs, 2013;27(3):263–274.
- Gimona M, Brizzi MF, Choo ABH, et al. Critical considerations for the development of potency tests for therapeutic applications of mesenchymal stromal cell-derived small extracellular vesicles. Cytotherapy, 2021;23(5):373–380.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2023 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Monitoring hladiny protilátok v súvislosti s očkovaním proti SARS-CoV-2 – 11-mesačné sledovanie
- Úloha endogénnych retrovírusov v ľudskom organizme
- Mykobakteriózy – nejčastější původci
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Lidská babesióza
- Detekce superantigenů u izolátů Streptococcus pyogenes na základě dat celogenomové sekvenace
- Prevalencia meticilín-rezistentného Staphylococcus aureus medzi obyvateľmi domovov dôchodcov na Slovensku
- Vzpomínka na RNDr. Václava Rupeše, CSc.
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mykobakteriózy – nejčastější původci
- Lidská babesióza
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



