-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMonitoring hladiny protilátok v súvislosti s očkovaním proti SARS-CoV-2 – 11-mesačné sledovanie
Antibody levels following vaccination against SARS-CoV-2 during an 11-month follow-up
Aims: The primary aim of our monitoring was to determine the duration of persistence of antibody levels following administration of the Comirnaty (Pfizer/BioNTech) mRNA vaccine. The second aim was to analyse the effect of selected factors on the level of antibodies.
Methods: The study cohort consisted of 250 employees of the Medirex JSC laboratories. For the quantitative determination of specific IgG anti-S1 and anti-S2 antibodies to SARS-CoV-2, chemiluminescence immunoassay was used. Twenty-nine subjects were excluded from the analysis due to extreme values of antibody levels in individual measurements. The effect of gender, age, BMI, comorbidity, and adverse reactions after vaccination with the Comirnaty (Pfizer/BioNTech) mRNA vaccine on antibody levels was analysed. Comparisons were made for five samples collected from two weeks after the 1st dose to 36 weeks after the 2nd dose of the mRNA vaccine. After the fifth sampling, the cohort was divided into two groups. Group 1 received the 3rd dose, and Group 2 were controls. We performed the last (sixth) sample collection two weeks after booster administration in Group 1and 11 months after the 2nd dose of the vaccine in controls. Between months 8 and 10 after the 2nd dose, we performed a cellular immunity test.
Results: Altogether 99.6% of the participants had a positive antibody level at week 36. Antibodies were still present in controls at month 11 after the 2nd dose. Significantly higher antibody levels were found in females, younger subjects, and those with selected adverse reactions. Reactive specific T lymphocytes were present in 65.6% of the subjects between weeks 36 and 44.
Conslusion: The antibody response decreased with the time since the 2nd dose but was still present in the control group at week 48. The effect of booster on antibody levels was clearly demonstrated. We have not confirmed an association of cellular immunity with the level of antibodies or with the antibodies present.
Keywords:
antibody response dynamics – mRNA vaccine – age – gender – adverse effects – age – gender – adverse effects – mRNA vaccine – antibody response dynamics
Autoři: E. Miková 1; K. Szabóová 2; M. Bunčák 3; E. Tibenská 2,4; V. Štiglincová 1
Působiště autorů: Oddelenie virológie, sérológie a molekulárnej biológie infekčných ochorení, Medirex, a. s., Bratislava, Slovenská republika 1; Oddelenie klinickej imunológie, Medirex, a. s., Bratislava, Slovenská republika 2; Medirex, a. s., Bratislava, Slovenská republika 3; Medirex group academy, Nitra, Slovenská republika 4
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 72, 2023, č. 3, s. 127-139
Kategorie: Původní práce
Souhrn
Ciele: Prvotným cieľom nášho monitorovania bolo zistiť dĺžku pretrvávania hladín protilátok po podaní mRNA vakcíny Comirnaty (Pfizer/BioNTech). Druhým cieľom bola analýza vplyvu vybraných faktorov na hladinu protilátok.
Metódy: Súbor pozostával z 250 zamestnancov laboratórií Medirex, a. s. Na kvantitatívne stanovenie špecifických protilátok IgG anti-S1 a anti-S2 proti SARS-CoV-2 bola použitá chemiluminiscenčná imunoanalýza. Z analýzy bolo vyradených 29 osôb pre extrémne hodnoty hladín protilátok v jednotlivých meraniach. Analyzoval sa vplyv pohlavia, veku, BMI, pridružených ochorení a nežiadúcich účinkov po vakcinácii mRNA vakcínou Comirnaty (Pfizer/BioNTech) na hladinu protilátok. Porovnanie sa vykonalo na piatich odberoch v rozmedzí od 2 týždňov od podania 1. dávky po 36 týždňov od podania 2. dávky mRNA vakcíny. Po piatom odbere sa súbor rozdelil na dve skupiny. Prvá skupina sa očkovala 3. dávkou a druhá skupina ostala ako kontrolný súbor. Posledný (šiesty) odber sme vykonali v skupine s boostrom 3. dávky vakcíny 2 týždne po podaní boostra a v kontrolnej skupine v 11. mesiaci od podania 2. dávky vakcíny. Medzi 8. až 10. mesiacom od podania 2. dávky sme vykonali test bunkovej imunity.
Výsledky: Pozitívnu hladinu protilátok malo v 36. týždni 99,6 % účastníkov. V kontrolnej skupine boli prítomné protilátky aj v 11. mesiaci od podania 2. dávky. Signifikantne vyššie hladiny protilátok boli u ženského pohlavia, mladších jedincov a pri vybraných nežiadúcich účinkoch. Reaktívne špecifické T lymfocyty boli prítomné u 65,6 % testovaných medzi 36. až 44. týždňom.
Záver: Protilátková odpoveď klesá s časom od podania 2. dávky, avšak v kontrolnej skupine bola aj v 48. týždni stále prítomná. Efekt podania boostra na hladinu protilátok bol jednoznačne preukázaný. Súvislosť bunkovej imunity s hladinou protilátok ani s prítomnými protilátkami sme nepotvrdili.
Klíčová slova:
věk – nežiaduce účinky – mRNA vakcína – dynamika protilátkovej odpovede – pohlavie
ÚVOD
SARS-CoV-2 patrí k trom vysoko patogénnym koronavírusom vyvolávajúcim ochorenie u ľudí. Od jeho prvej detekcie v decembri 2019 vo Wuhane sa celosvetovo rozšíril, pričom infikoval a usmrtil milióny ľudí [1–4]. Infekcia môže prebiehať asymptomaticky, prípadne s miernymi príznakmi. Sú však popísané aj ťažké priebehy s chronickými následkami [4, 5]. Imunitná odpoveď na infekciu vzniká ako po prekonaní infekcie, tak aj po očkovaní. Pri prekonaní infekcie reaguje imunitný systém na viaceré antigénne štruktúry vírusu. Pri očkovaní sa imunitný systém cizeluje na povrchový spike proteín vírusu. Antigény, respektíve kódovaná informácia k štruktúre antigénu, sú cielene vytypované tak, aby zabezpečili najefektívnejšiu imunitnú odozvu po strete s reálnym vírusom [6, 7]. Od prelomu rokov 2020/2021 sú na Slovensku k dispozícii vakcíny proti ochoreniu covid-19, ktoré infekcia vírusom SARS-CoV-2 spôsobuje. Od januára 2021 sme začali prospektívne monitorovať hladiny protilátok u zamestnancov laboratórií Medirex, a. s., očkovaných mRNA vakcínou Comirnaty (Pfizer/BioNTech). Cieľom nášho sledovania bolo zistiť dynamiku hladiny protilátok s odstupom času od podania 2. dávky vakcíny a vplyv vybraných faktorov na hladinu protilátok.
SÚBOR A METÓDY
Súbor pozostával z 250 zamestnancov laboratórií Medirex, a. s., z toho bolo 202 žien a 48 mužov vo vekovom zložení od 21 do 69 rokov. Štúdie sa zúčastnili pracovníci z centrálnych laboratórií v Bratislave, Nitre a v Košiciach a k nim priľahlých satelitných laboratórií. Projekt bol schválený etickou komisiou Bratislavského samosprávneho kraja dňa 12. 1. 2021. Každý účastník štúdie vyplnil dotazník s cieľom zistiť prítomné poruchy imunitného systému, aktívne onkologické ochorenia, závažné ochorenia kardiovaskulárneho systému, nežiadúce účinky po očkovaní a užívanie imunomodulancií a imunosupresív. Aktívne onkologické ochorenia neboli diagnostikované u žiadneho z účastníkov. Základné charakteristiky súboru a výsledky sumarizácie údajov z dotazníkov sú uvedené v tabuľkách 1 a 2.
Celkovo bolo realizovaných 6 meraní hladín protilátok. Pred aplikáciou 1. dávky vakcíny sme nestanovovali hladinu protilátok. Jednotlivé odbery krvi a následné analýzy sa konali 2 týždne po 1. dávke a 2, 12, 24 a 36 týždňov po 2. dávke. Medzi 36. až 44. týždňom po aplikácii druhej dávky sme vykonali test bunkovej imunity. Súbor sa následne rozdelil na 2 vetvy. Jednu vetvu tvorila skupina očkovaná 3. dávkou (159 probandov) a druhú vetvu tvorila kontrolná skupina (91 probandov). V skupine po 3. dávke sme vykonali šieste meranie 2 týždne po aplikácii 3. dávky a v kontrolnej skupine sme vykonali odber v 48. týždni od aplikácie 2. dávky. V kontrolnej skupine sme vykonali v 48. týždni aj test bunkovej imunity u tých probandov, ktorí mali pozitívny alebo nehodnotiteľný test bunkovej imunity v predchádzajúcom testovaní. Schému jednotlivých odberov uvádzame v schéme 1. V rámci súboru sme sledovali vplyv vybraných faktorov na výšku hladiny protilátok. Porovnávali sme hodnoty v závislosti od veku, pohlavia, výskytu pridružených ochorení, BMI a popísaných nežiadúcich účinkov po podaní vakcíny.
Štatistickú významnosť rozdielov v priemernej výške protilátok sme testovali v jazyku R metódou ANOVA pre opakované merania. Pri výpočte testovacích kritérií sme postupovali podľa podrobného online kurzu A. Kassambara: Comparing multiple means in R [8]. Pred samotným ANOVA testom sme prostredníctvom Quantile – quantile plots overili, či má závislá premenná (hladina protilátok) normálne rozloženie. Vzhľadom na robustnosť testovanej vzorky N = 221 prípadov sme uprednostnili túto metódu pred Shapiro-Wilkovým testom, ktorý je vhodnejší na testovanie skupín s menej ako 50 osobami. Post-hoc testy v podobe párových testov s upravenou významnosťou podľa Bonferroniho korekcie nám následne pomohli identifikovať významnosť zmien vo vývoji priemerných hladín protilátok medzi jednotlivými obdobiami merania. Testy uvedené v tomto článku boli vypočítané s 5-% hladinou významnosti.
Z dôvodu metodológie výskumu a požiadaviek na kvalitu dát sme z ďalších analýz zo súboru vylúčili 29 probandov. Z dôvodu prekonanej alebo suspektne prekonanej infekcie SARS-CoV-2 sme vyradili 14 osôb od začiatku merania do 5. odberu. Prekonanie infekcie bolo potvrdené pozitívnym antigénovým testom alebo PCR metódou. Suspektné prekonanie bolo vyhodnotené na základe prítomnosti klinických príznakov po kontakte s pozitívnou osobou pri negativite antigénového alebo PCR testu alebo nameranou hladinou protilátok v prvom meraní > 400 AU/ml. U ďalších 15 osôb sme porovnaním medzikvartilového rozpätia identifikovali extrémne hodnoty v odberoch 1–5, ktoré by mohli výrazne skresliť výsledky štatistickej analýzy. Z dôvodu nízkych početností v kategóriách „Podváha“ sme sa rozhodli sledovať úroveň BMI v 3 kategóriách: „Podváha + Normálne BMI“ (BMI do 24,9 kg/m2) „Nadváha“ (BMI v rozsahu 25,0–29,9 kg/m2) a „Obezita“ (BMI 30,0 kg/m2 a vyššie).
Na kvantitatívne stanovenie špecifických protilátok IgG anti-S1 a anti-S2 proti SARS-CoV-2 sme používali komerčnú chemiluminiscenčnú imunoanalýzu (LIA-ISON® SARS-CoV-2 S1/S2 IgG, Diasorin, Italy) podľa návodu výrobcu s využitím analyzátora LIAISON® XL. Rozsah merania súpravy je od 3,8 do 400 AU/ml. Hraničné hodnoty sú väčšie alebo rovné 12,0 a menšia ako 15 AU/ml; pozitívne hodnoty sú väčšie alebo rovné 15 AU/ml [9]. Hodnoty nad 400 AU/ml sme ďalej neriedili a pri štatistickom spracovaní sme počítali s najvyššou hodnotou 400 AU/ml.
Na stanovenie prítomnosti antigén špecifických efektorových T lymfocytov sme použili súpravu QuantiFERON® SARS-CoV-2 ELISA Kit (Qiagen, USA), ktorý je založený na schopnosti antigén špecifických efektorových T lymfocytov produkovať po stimulácii špecifickými proteínmi SARS-CoV-2 IFN-gama. Odberový set QuantiFERON SARS-CoV-2 obsahuje dve odlišné skúmavky s antigénom 1 (Ag1) a skúmavku s antigénom 2 (Ag2). Skúmavka Ag1 obsahuje zmes peptidov S1-RBD spike proteínu, ktoré sú navrhnuté na zistenie bunkovej imunitnej odpovede CD3+CD4+ T-pomocných lymfocytov. Skúmavka Ag2 obsahuje sadu peptidov celého spike proteínu (RBD, S1 a S2) zameraných na indukciu odpovede CD3+CD4+ a CD3+CD8+ T lymfocytov [10].
Schéma 1. Jednotlive odbery Scheme 1. Individual samplings 
Tab. 1. Vekové zastúpenie v súboreTable 1. Age characteristics of the study group 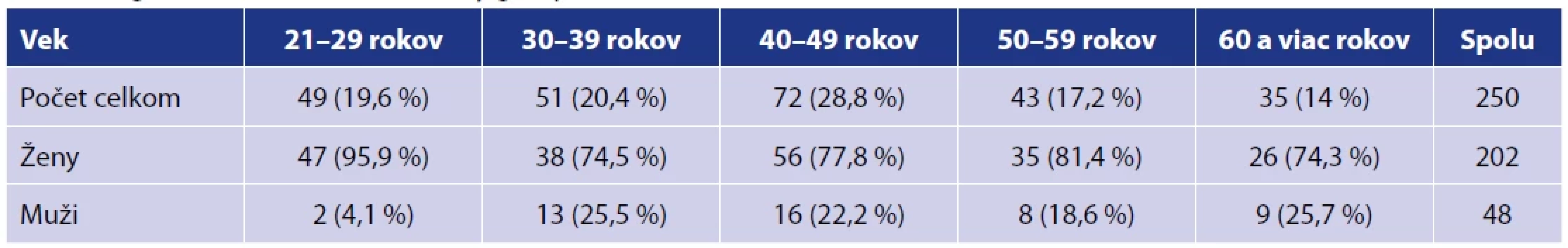
Tab. 2. Pridružené ochorenia probandov v súboreTable 2. Comorbidities present in the study group 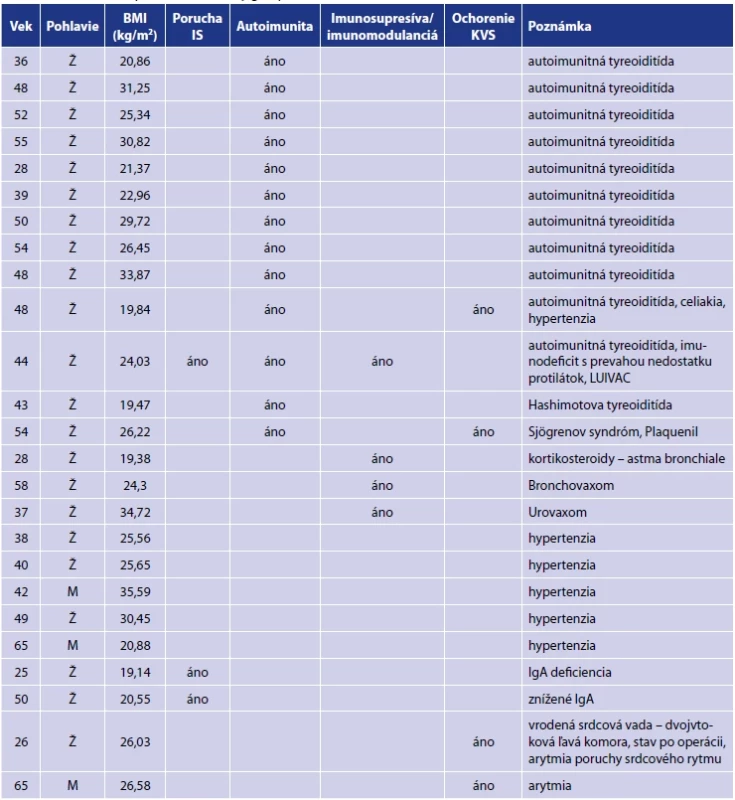
Legenda:Ž – žena, M – Muž, IS – imunitný systém, KVS – kardiovaskulárny systémŽ – woman, M – man, IS – immune system, KVS – cardiovascular system VÝSLEDKY
Z testovaných 250 zamestnancov malo už dva týždne po aplikácii prvej dávky 221 účastníkov pozitívne hodnoty hladín protilátok (88,4 %). Sedem účastníkov malo hraničné respektíve nejednoznačné hodnoty (2,8 %) a u 22 účastníkov sa protilátky nevytvorili (8,8 %). Po aplikácii druhej dávky vakcíny sme zaznamenali prítomnosť protilátok v celom testovanom súbore a u všetkých účastníkov štúdie boli protilátky detegované až do 36. týždňa (5. odberu) od podania druhej dávky. U jedného účastníka v 36. týždni klesli protilátky pod hranicu pozitivity. Zastúpenie jednotlivých hladín protilátok v testovanom súbore počas piatich odberov sú znázornené na obrázku 1 a tabuľke 3.
Zo skupiny 29 probandov s negatívnymi a hraničnými hodnotami dva týždne po podaní prvej dávky vakcíny absolvovalo 24 z nich mimoriadny odber tesne pred aplikáciou 2. dávky. Pozitívne hodnoty hladín protilátok sme zaznamenali u 16/24 (66 %), hraničné hodnoty u 3/24 (12,5 %) a 5/24 (20,8 %) probandov nezareagovalo tvorbou protilátok. V súbore bolo 21 žien, 8 mužov a z pridružených ochorení sa vyskytli 3x autoimunitná tyreoiditída, 1x imunodeficiencia s prevahou nedostatku protilátok a 1x hypertenzia. U všetkých„non responderov“ po prvej dávke došlo k sérokonverzii po podaní druhej dávky vakcíny, avšak výškami hladín zaostávali voči priemeru celého súboru aj v nasledujúcich meraniach. Počiatočná hladina, respektíve hladina 2 týždne od prvej dávky, sa javí byť rozhodujúca pre výšku hladiny v nasledujúcich meraniach. Probandi s vyššou hladinou na začiatku meraní si ju častejšie udržovali počas dlhšieho obdobia hoci s postupom času od 4. odberu sa rozdiely začínali stierať. Vplyv počiatočnej výšky hladiny protilátok na pretrvávanie hladín je štatisticky významný p < 0,001. Dynamiku hladín protilátok v závislosti od výšky hladiny v prvom meraní uvádzame na obrázku 2.
Tab. 3. Deskriptívna štatistika nameraných hladín protilátok v súbore počas jednotlivých odberovTable 3. Descriptive statistics of measured antibody levels in the population during individual collections 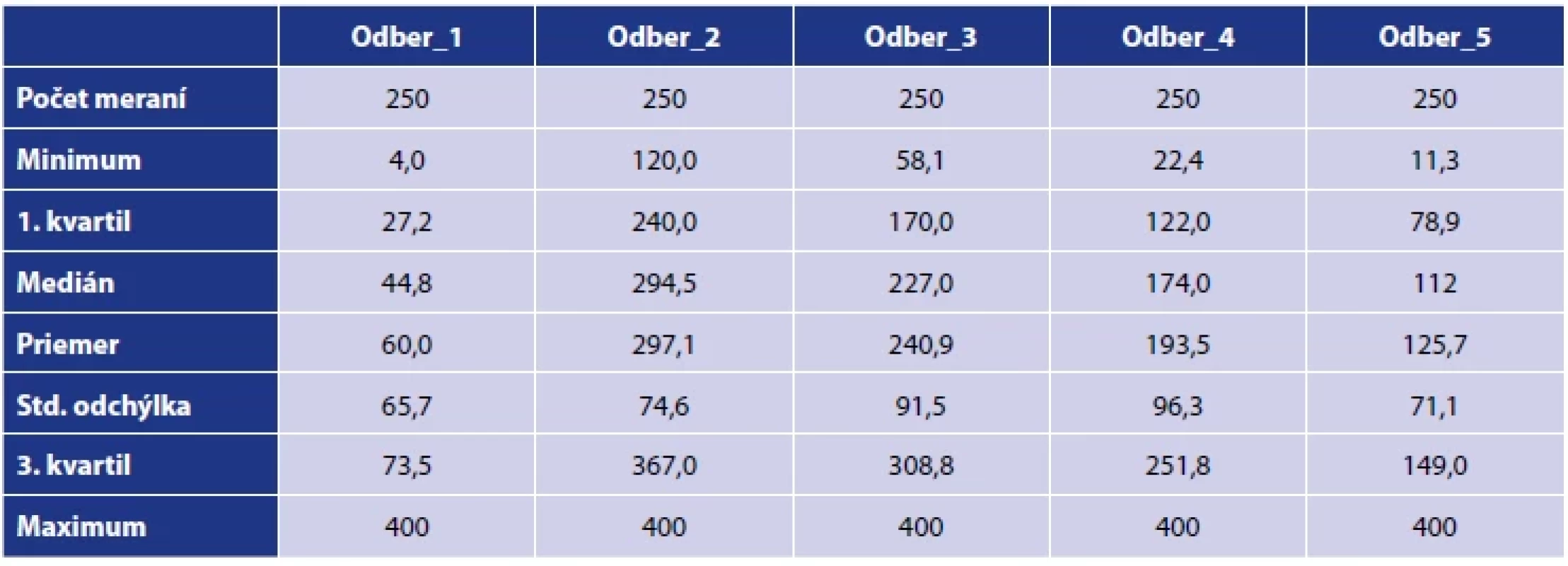
Obr. 1. Zastúpenie jednotlivých hladín protilátok v závislosti od času od podania vakcínyFigure 1. Representation of antibody levels depending on time since vaccine administration 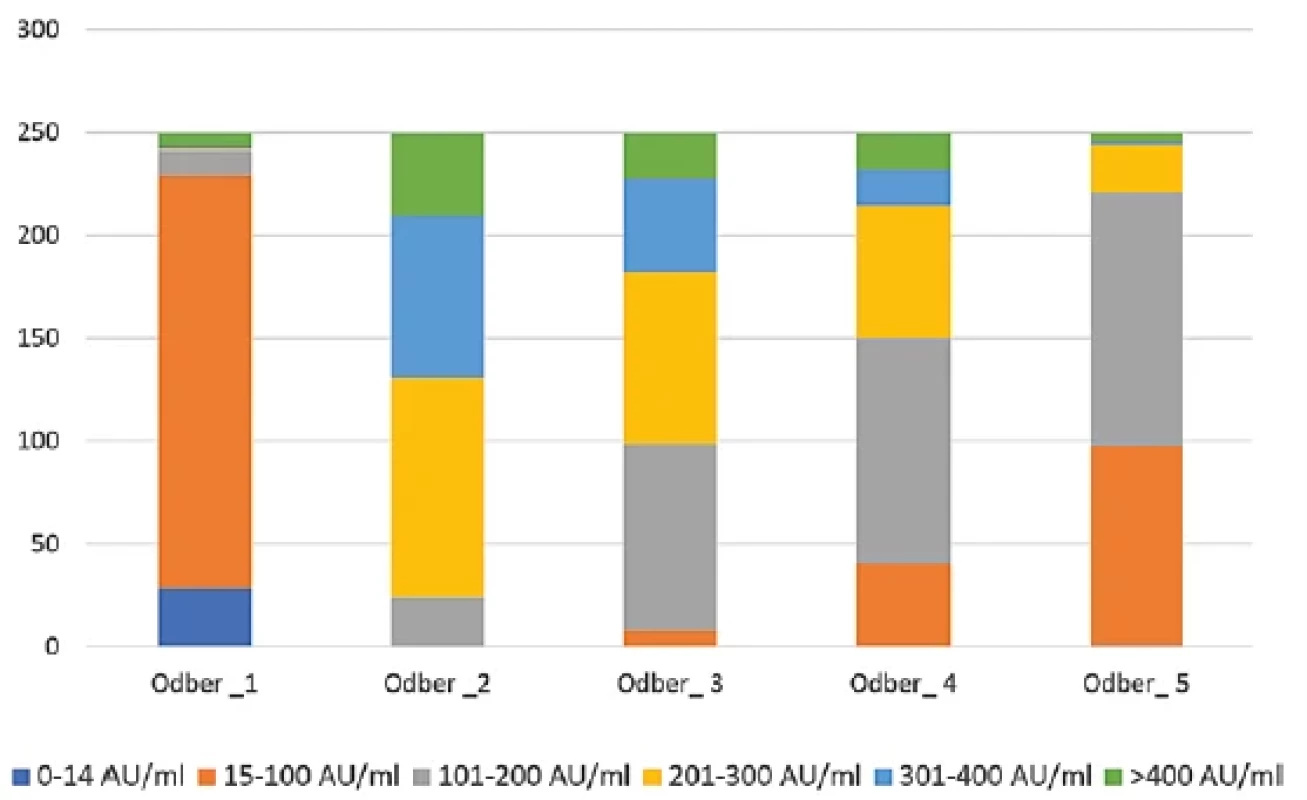
Legenda: Tmavomodrá farba reprezentuje hladiny protilátok do 14 AU/ml; oranžová farba hladiny od 15 po 100 AU/ml; šedá farba hladiny od 101 po 200 AU/ml; žltá farba od 201 po 300 AU/ml; svetlomodrá farba od 301 po 400 AU/ml a zelená farba reprezentuje hladiny viac ako 400 AU/ml.Legend: Dark blue colour, antibody levels up to 14 AU/ml; orange colour, from 15 to 100 AU/ml; grey colour, from 101 to 200 AU/ml; yellow colour, from 201 to 300 AU/ml; light blue colour, from 301 to 400 AU/ml, and green colour, levels greater than 400 AU/ml. Obr. 2. Vývoj hladiny protilátok v jednotlivých odberoch podľa počiatočného stavu v prvom odbereFigure 2. Evolution of antibody levels in individual samples in comparison with the first sampling. 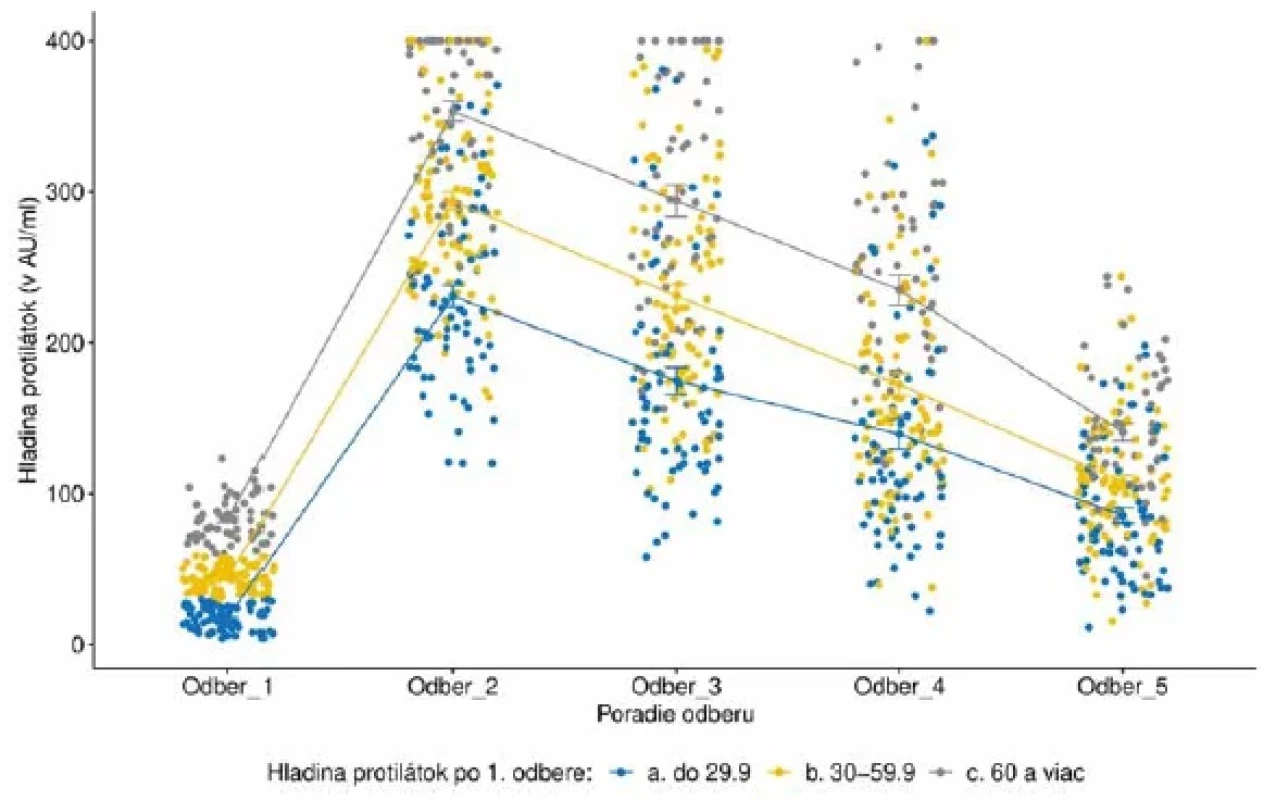
Legenda: Každý bod reprezentuje jedno meranie/probanda. Lomená čiara predstavuje vývoj priemernej hladiny protilátok v každej skupine probandov rozdelených podľa počiatočného stavu koncentrácie protilátok v prvom odbere. Modrá farba reprezentuje hladiny protilátok do 29,9 AU/ml; žltá farba hladiny od 30 po 59,9 AU/ml a šedá farba 60 a viac AU/ml.Legend: Each point represents one measurement/proband. The line illustrates the evolution of the average level of antibodies in each category of probands stratified by initial antibody levels at the first sampling. Blue colour, antibody levels up to 29.9 AU/ml,yellow colour, from 30 to 59.9 AU/ml, and grey colour, levels of 60 AU/ml and above. U šiestich účastníkov sme už v prvom odbere zachytili hladinu protilátok > 400 AU/ml. Z tejto skupiny boli tri osoby pozitívne testované na infekciu SARS-CoV-2 ešte pred vakcináciou a tri osoby si neboli vedomé infekcie, nakoľko boli asymptomatické a bez pozitívneho výsledku Ag alebo PCR testu. Namerané hodnoty protilátok > 400 AU/ml pretrvali do 5. odberu u 3 zo 6 účastníkov a následne klesli u všetkých.
Vplyv vybraných faktorov na hladinu protilátok je znázornený na obrázku 3. Pohlavie má signifikantný vplyv na vývoj priemernej hodnoty protilátok v čase. Hladiny protilátok u žien boli počas celého obdobia merania štatisticky významne vyššie [F(3,02;661,71) = 4,39; p = 0,004]. V testovanej vzorke sme však mali viac žien v mladších vekových kategóriách. Na overenie vplyvu pohlavia na hladinu protilátok sme zopakovali analýzu na menšom, proporcionálne rovnakom výbere 41 mužov a 41 žien v rovnakých vekových kategóriách. Aj na tomto výbere sa potvrdil štatisticky významný rozdiel medzi ženami a mužmi [F(2,94;235,53) = 3,02; p = 0,031].
Pri analýze tvorby protilátok v súvislosti s vekom sme zaznamenali rozdiely v hladine protilátok v závislosti od vekovej kategórie [F(12,09;652,68) = 1,81; p = 0,043]. Probandi boli rozdelení do piatich desaťročných vekových kohort: 20–29 rokov (38 probandov), 30–39 rokov (49 probandov), 40–49 rokov (63 probandov), 50–59 rokov (40 probandov) a 60 a viac rokov (31 probandov). Mladšie vekové skupiny mali na začiatku tendenciu k prudšiemu nárastu hodnoty protilátok. Následne v časovom odstupe od druhého očkovania hladina protilátok postupne klesala. Rozdiely medzi jednotlivými vekovými skupinami sú výrazne štatisticky odlišné v 1. a 2. odbere (p < 0,001). Od tretieho odberu je štatisticky významný rozdiel len medzi vekovými kategóriami do 39 rokov na jednej strane a skupinou 60+ na druhej strane (p = 0,003). V súbore však mali prevahu ženy v mladšom veku v porovnaní s mužmi. Na overenie vzťahu veku a hladiny protilátok s vylúčením vplyvu pohlavia sme spravili kontrolný test štatistickej významnosti rozdielov na dvoch užších výberoch probandov. Prvým bol výber mužov aj žien vo veku 30 a viac rokov (176 probandov v štyroch desaťročných vekových kohortách od 30 do 70 rokov). Druhýkrát sme testovali štatistickú významnosť len na 30a viacročných mužoch (38 mužov v štyroch desaťročných vekových kohortách od 30 do 70 rokov, v každej kohorte bolo aspoň 7 probandov). Vplyv veku na hladinu protilátok sa potvrdil v oboch testovaných kontrolných výberoch. U mužov bol štatisticky významný rozdiel vo vývoji hladiny protilátok medzi vekovými kategóriami [F(9,22;104,53) = 2,4; p = 0,015]. Post-hoc test v podobe párových t-testov (s Bonferroniho korekciou štatistickej významnosti) ukázal, že štatisticky významné rozdiely medzi jednotlivými vekovými skupinami boli hlavne v čase prvého a druhého odberu.
Testovanie vplyvu BMI na vývoj hladiny protilátok na celom súbore probandov bolo štatisticky významné [F(5,97;650,85) = 2,66; p = 0,015)]. Vplyv BMI na hladinu protilátok bol štatisticky významný predovšetkým v prvom odbere, čo potvrdil aj post-hoc test kategórií BMI u probandov v čase. Táto doplnková analýza ukázala rozdiely na hranici významnosti v čase odberu 1 medzi 1. skupinou (podváha + normálne BMI) a 3. skupinou (obézni). Podobné významnosti boli aj pri treťom odbere. Znamená to, že pri testovaní vplyvu BMI na celom súbore probandov sme zaznamenali v kategórii obéznych pomalší rast protilátok po prvom očkovaní a potom v priebehu času o niečo rýchlejší pokles.
Vzhľadom na to, že sme predtým potvrdili vplyv veku a pohlavia na hladiny protilátok a zároveň vo všeobecnosti existuje priama úmera medzi vekom a BMI, overovali sme vplyv BMI aj na menšom výbere probandov s rovnomerným rozložením podľa pohlavia a veku. Na tomto užšom datasete s 82 členmi s rovnomernejším zastúpením v zmysle veku, pohlavia a BMI sme nepotvrdili vplyv BMI na hladinu protilátok.
Vplyv pridružených ochorení sa v našom súbore nepotvrdil. V rámci súboru malo iba 25 probandov pridružené ochorenia. U niektorých sa vyskytli kombinácie sledovaných ochorení.
Obr. 3. Vývoj hladiny protilátok podľa pohlavia, veku, BMI a pridruženého ochorenia probandovFigure 3. Evolution of antibody levels by gender, age, BMI, and comorbidity 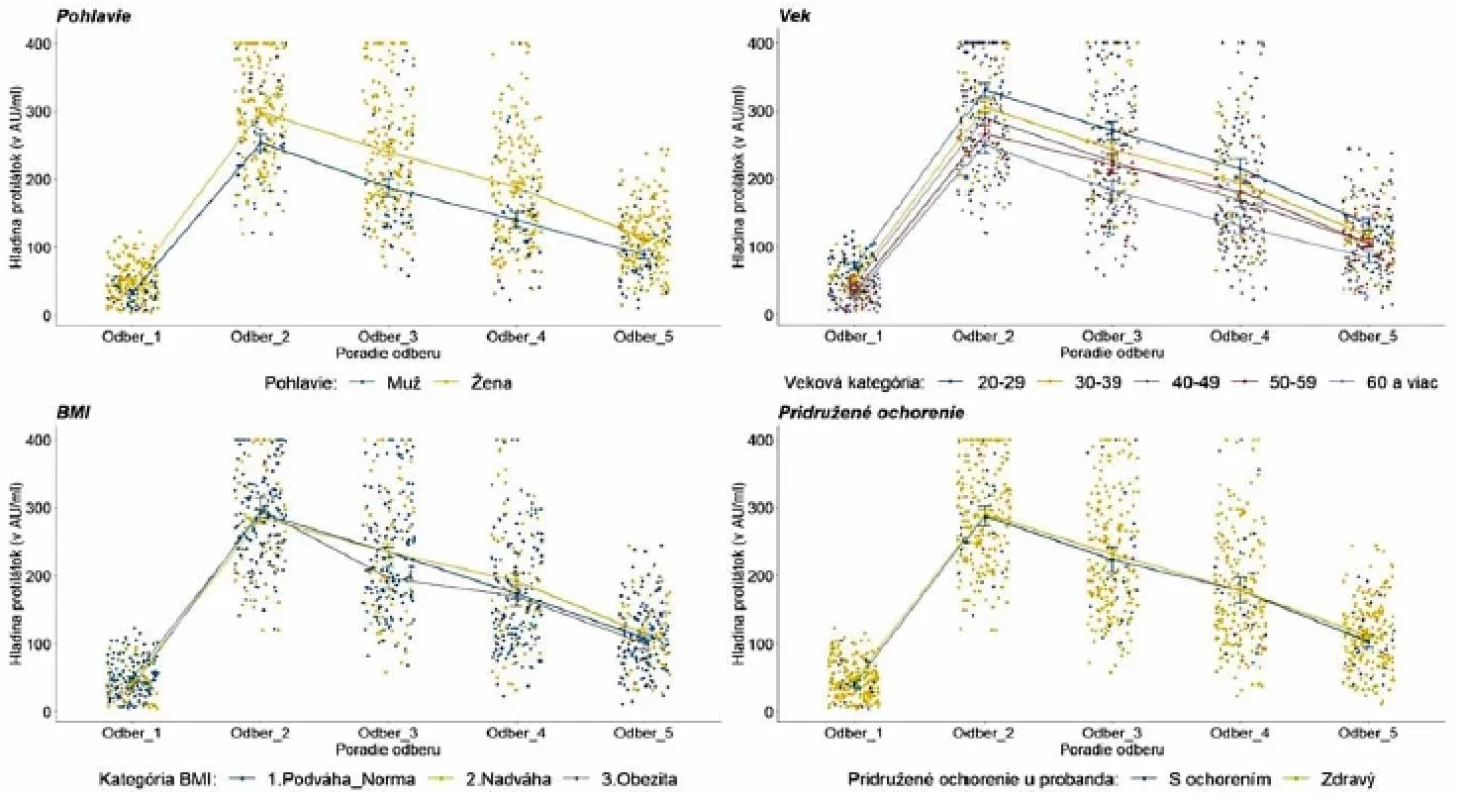
Legenda: Každý bod reprezentuje jedno meranie/probanda. Lomená čiara predstavuje vývoj priemernej hladiny protilátok v každej kategórii. V kategórii pohlavie reprezentuje modrá farba mužov a žltá farba ženy. V kategórii vek reprezentuje tmavomodrá farba vek 20–29 rokov, žltá farba vek 30–39 rokov, šedá farba vek 40–49 rokov, červená farba 50–59 rokov a bledomodrá farba 60 a viac rokov. V kategórii BMI reprezentuje modrá farba podváhu a normu, žltá farba nadváhu a šedá farba obezitu. V kategórii pridružené ochorenie reprezentuje modrá farba probandov s ochorením a žltá farba zdravých probandov. Legend: Each point represents one measurement/proband. The line illustrates the evolution of the average level of antibodies in each category. In the gender category, blue colour is used for men and yellow colour for women. In the age category, dark blue colour indicates 20 to 29 years; yellow colour, 30 to 39 years; grey colour, 40 to 49 years; red colour, 50 to 59 years, and light blue colour, 60 and over. In the BMI category, blue colour shows underweight and normal weight; yellow colour, overweight, and grey colour, obesity. In the comorbidity category, blue colour represents probands with comobidities and yellow colour represents healthy probands. Po vakcinácii sme zaznamenali väčšinou bežne očakávané nežiadúce prejavy. Kým po aplikácii prvej dávky prevažovali lokálne reakcie, po aplikácii druhej dávky už dominovali systémové reakcie. Z jednotlivých nežiadúcich prejavov bola najčastejšia bolesť ruky po podaní oboch dávok. Z celého testovaného súboru malo po prvej dávke 70 probandov (28 %) iba bolesti ruky a 39 (15,6 %) malo okrem bolesti ruky ešte ďalší nežiadúci prejav. 18 probandov (7,2 %) malo iba iný nežiadúci prejav v časovej súvislosti s podaním prvej dávky vakcíny. Po druhej dávke malo 31 probandov (12,4 %) iba bolesti ruky a 54 (21,6 %) malo okrem bolesti ruky ešte ďalší nežiadúci prejav. Počet probandov s prítomnými iba inými nežiadúcimi prejavmi v časovej súvislosti s podaním druhej dávky vakcíny sa zvýšil na 53 (21,2 %). Výskyt nežiadúcich prejavov v súvislosti s podaním vakcíny uvádzame v tabuľke 4. Do štatistického testovania vplyvu nežiadúcich účinkov na vývoj hladiny protilátok sme zaradili zúžený súbor 221 probandov s bežnými nežiadúcimi účinkami po aplikácii prvej a druhej dávky. Vplyv nežiadúcich účinkov ako celku (prítomné/neprítomné) na vývoj hladiny protilátok sa nám však nepodarilo potvrdiť. Detailnejšou analýzou vzťahu jednotlivých druhov nežiadúcich účinkov k hladine protilátok sme zistili, že po aplikácii prvej dávky probandi s bolesťami ruky, zvýšenou teplotou, zimnicou, triaškou a zväčšenými lymfatickými uzlinami mali vyššie priemerné hladiny protilátok, ale rozdiel nebol štatisticky významný. Probandi s opuchom a začervenaním v mieste vpichu mali vyššie priemerné hladiny protilátok a rozdiel bol štatisticky významný od 3. odberu [F (3,02;660,82) = 2,83; p = 0,037] a probandi s bolesťami hlavy alebo migrénou mali štatisticky významne vyššie hladiny protilátok do 3. odberu [F (3,0;655,97) = 3,31; p = 0,020]. Doanalýzy však bolo zaradených 7, respektíve 9 účastníkov. Probandi s bolesťami ruky po aplikácii druhej dávky mali o niečo vyššie hladiny protilátok, avšak rozdiel nebol štatisticky významný. Vplyv opuchu v mieste vpichu sa nedal vyhodnotiť vzhľadom k nízkemu počtu probandov s danými príznakmi. Štatisticky významné rozdiely vo všetkých odberoch sme zaznamenali u probandov s bolesťami hlavy, migrénou [F (3,02;662,1) = 5,1; p = 0,002], bolesťami svalov, kĺbov, chrbta [F (3,04;666,33) = 6,05; p < 0,001], únavou, slabosťou, malátnosťou [F (3,05;667,63) = 6,56; p < 0,001], zvýšenou teplotou a zväčšenými lymfatickými uzlinami [F (3,04;665,07) =10,06; p = <0,001], zimnicou a triaškou [F (3,02;662,43) = 5,43; p =0,001] po aplikácii druhej dávky. Hladiny protilátok v závislosti od výskytu nežiadúceho účinku uvádzame na obrázku 4 až 6.
Tab. 4. Významnosť ANOVA testu a rozdielov v priemerných hladinách protilátok pri vybraných nežiadúcich účinkoch po aplikácii prvej a druhej dávkyTable 4. Significance of ANOVA test and differences in mean antibody levels for selected adverse effects after the application of the first and second dose 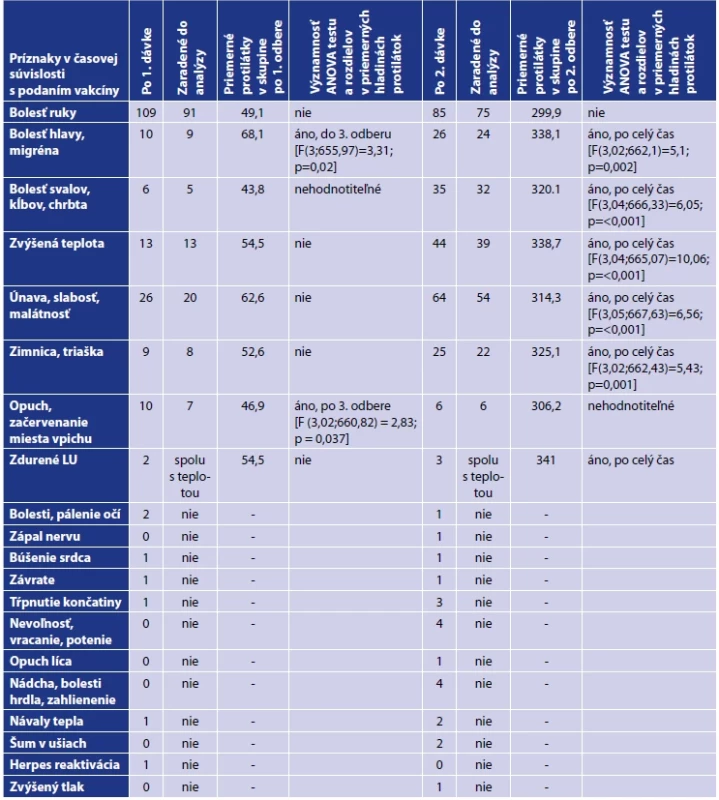
Obr. 4. Hladina protilátok podľa prítomnosti akýchkoľvek nežiadúcich účinkov po aplikácii prvej a druhej dávkyFigure 4. Antibody level by adverse reaction after the first and second dose 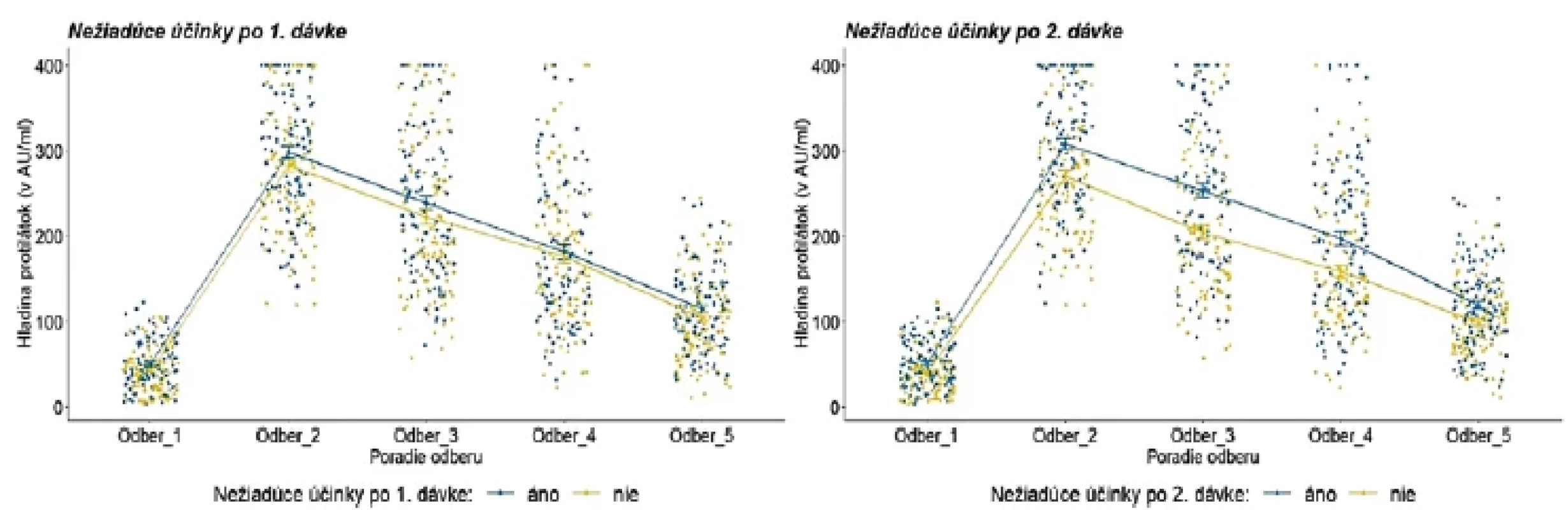
Legenda: Každý bod reprezentuje jedno meranie/probanda. Lomená čiara predstavuje vývoj priemernej hladiny protilátok v každej kategórii. Modrá farba reprezentuje prítomnosť (áno) sledovaných nežiadúcich účinkov; žltá farba reprezentuje ich neprítomnosť (nie).Legend: Each point represents one measurement/proband. The line illustrates the evolution of the average level of antibodies in each category. Blue colour represents the presence (yes) of adverse reactions, and the yellow colour indicates their absence (no). Obr. 5. Vývoj hladiny protilátok u probandov s vybranými nežiadúcimi účinkami po aplikácii prvej dávky Figure 5. Evolution of antibody levels after the first dose in relation to selected adverse reactions. 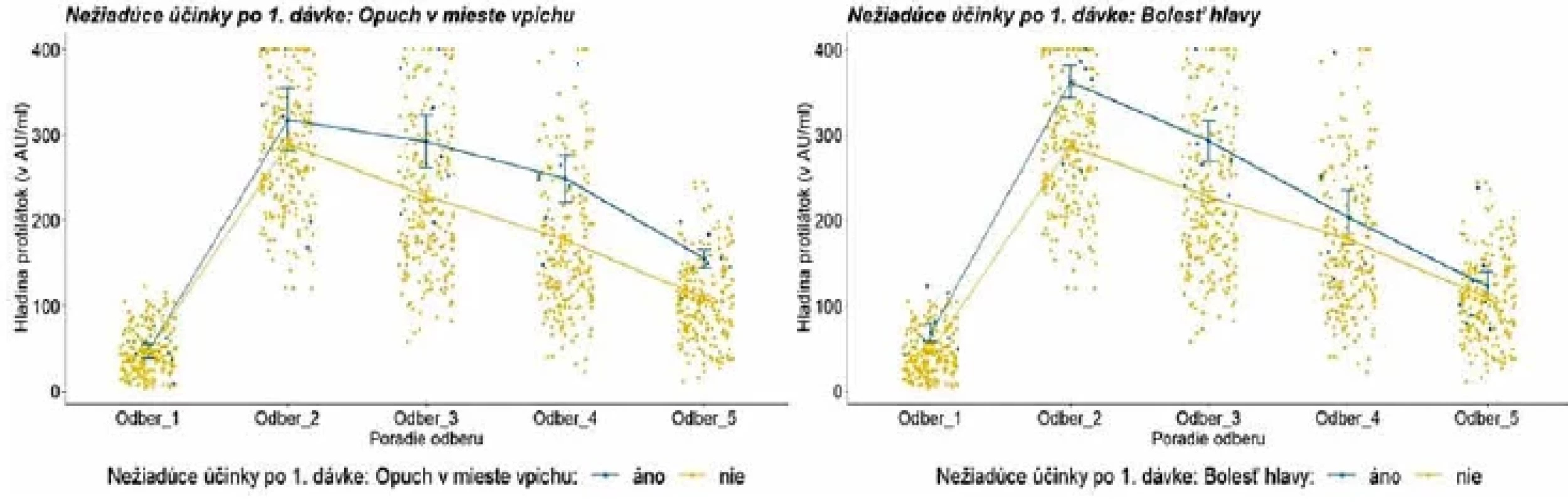
Legenda: Každý bod reprezentuje jedno meranie/probanda. Lomená čiara predstavuje vývoj priemernej hladiny protilátok v každej kategórii. Modrá farba reprezentuje prítomnosť (áno) sledovaných nežiadúcich účinkov; žltá farba reprezentuje ich neprítomnosť (nie).Legend: Each point represents one measurement/proband. The line illustrates the evolution of the average level of antibodies in each category. Blue colour represents the presence (yes) of selected adverse reactions, and the yellow colour indicates their absence (no). Obr. 6. Vývoj hladiny protilátok u probandov po aplikácii druhej dávky podľa vybraných nežiadúcich účinkovFigure 6. Evolution of antibody levels after the second dose in relation to selected adverse reactions 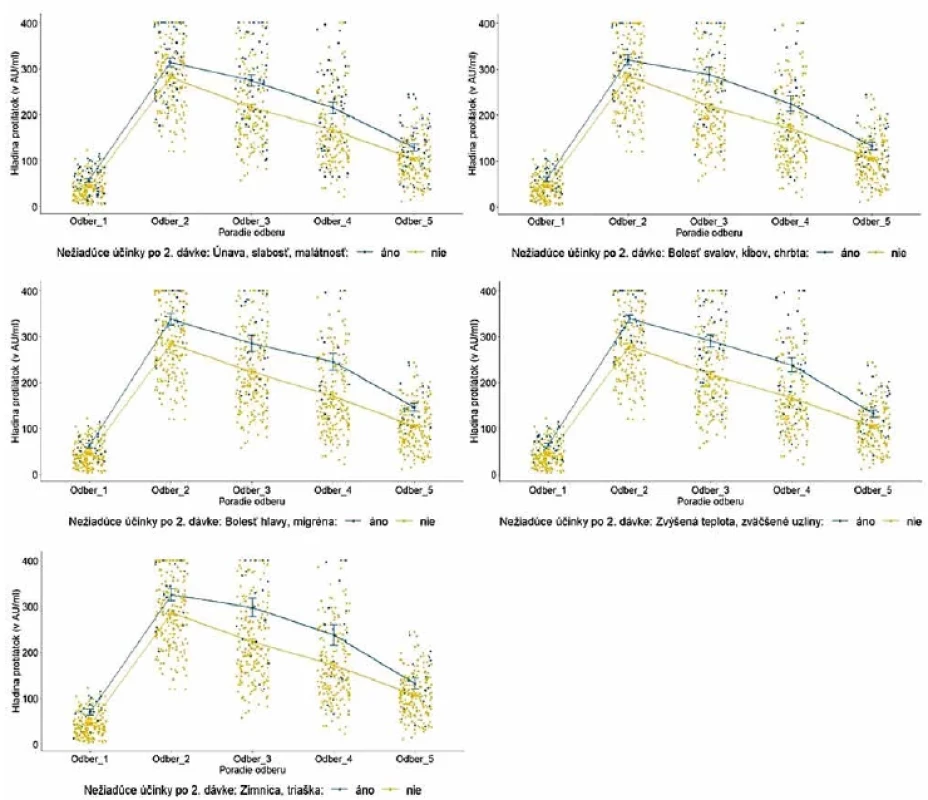
Legenda: Každý bod reprezentuje jedno meranie/probanda. Lomená čiara predstavuje vývoj priemernej hladiny protilátok v každej kategórii. Modrá farba reprezentuje prítomnosť (áno) sledovaných nežiadúcich účinkov; žltá farba reprezentuje ich neprítomnosť (nie).Legend: Each point represents one measurement/proband. The line illustrates the evolution of the average level of antibodies in eachcategory. Blue colour represents the presence (yes) of selected adverse reactions, and the yellow colour indicates their absence (no). Medzi 36. až 44. týždňom od druhej dávky sme vyšetrili bunkovú imunitu u 241 z 250 účastníkov. Zvyšných 9 sa na odber nedostavilo z dôvodu práceneschopnosti, alebo pracovnej zaneprázdnenosti. U 158 testovaných (65,6 %) sme zachytili prítomnosť reaktívnych špecifických T lymfocytov. Časť z testovaných osôb absolvovalo odber po očkovaní 3. dávkou, alebo po prekonaní infekcie SARS-CoV-2. Výsledky celého súboru uvádzame v tabuľke 5.
V rámci analýzy vzťahu bunkovej a humorálnej imunity sme porovnávali výsledok testu bunkovej imunity s nameranou hladinou protilátok v 5. odbere. Do analýzy sme zaradili probandov, ktorí absolvovali odber na test bunkovej imunity ešte pred boostrom 3. dávkou a bez preukázaného prekonania ochorenia covid-19. Rozdiel v hladine protilátok medzi skupinou s prítomnou bunkovou imunitou a skupinou s neprítomnou, prípadne nehodnotiteľnou bunkovou imunitou nebol štatisticky významný.
Súbor sa po 9. mesiaci rozdelil na 2 vetvy. Booster 3. dávkou absolvovalo 159 účastníkov. Posledný odber hladiny protilátok sme vykonali 2 týždne po absolvovaní 3. dávky a v prípade kontrolnej skupiny, ktorá sa rozhodla zatiaľ neboostrovať, sme vykonali odber v 48. týždni od druhej dávky. Po očkovaní všetkým probandom výrazne stúpla hladina protilátok; okrem 2 účastníkov boli namerané hodnoty > 400 AU/ml. Dvaja účastníci mali hodnoty 369 a 389 AU/ml. V kontrolnej skupine s výnimkou tých, ktorí sa nakazili SARS-CoV-2, protilátky ďalej klesali. Namerané hodnoty mali rozpätie od 28 po > 400 AU/ml. Vzostup hladín protilátok na > 400 AU/ml bol jednoznačne spôsobený prekonanou infekciou SARS-CoV-2, pričom PCR, resp. Ag potvrdenú infekciu malo 14 z 15 účastníkov. V kontrolnej skupine probandov, ktorí počas sledovaného obdobia neprekonali infekciu SARS-CoV-2, bola priemerná hodnota hladiny protilátok 126,9 AU/ml. V kontrolnej skupine, ktorá mala pozitívny nález reaktívnej bunkovej imunity v predchádzajúcom meraní, sme vykonali opakovaný test v 48. týždni. Vzhľadom k výsledkom porovnania humorálnej a bunkovej imunity v 36. až 44. týždni sme štatisticky neanalyzovali výsledky bunkovej imunity v 48 týždni. Súbor sa zúžil na 36 probandov a výsledky už nebolo možné štatisticky hodnotiť.
Tab. 5. Výsledky meraní bunkovej imunity medzi 36. až 44. týždňom od druhej dávkyTable 5. Results of cellular immunity measurements between 36 and 44 weeks after the second dose 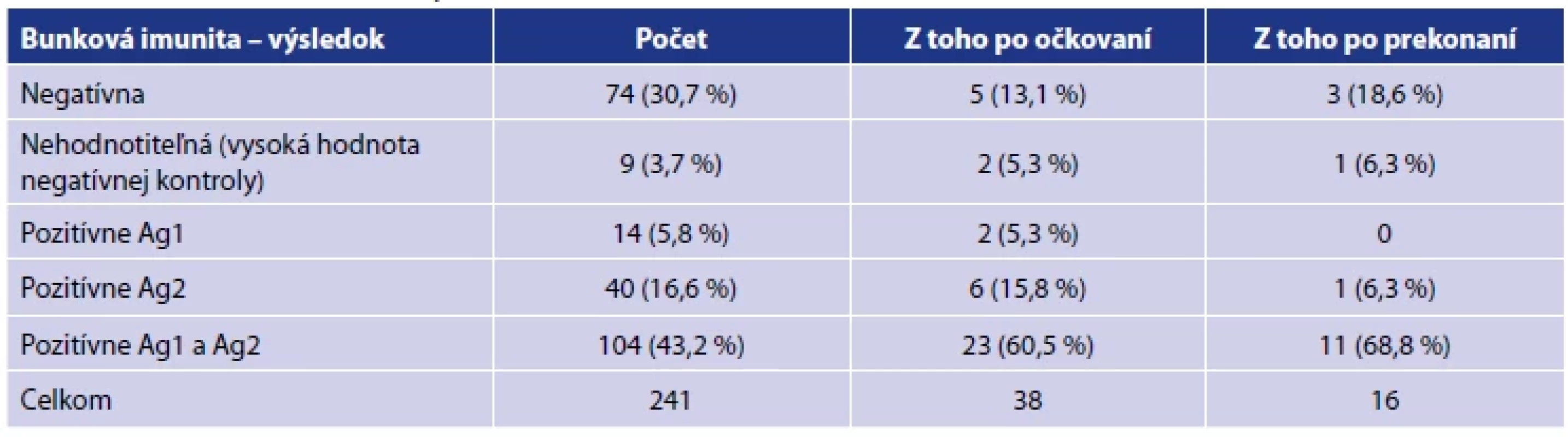
DISKUSIA
Dlhodobým monitorovaním účastníkov našej štúdie sme získali možnosť sledovať dynamiku hladiny protilátok do úrovne 48 týždňov, čo zodpovedá 11 mesiacom od aplikácie 2. dávky. Monitorovanie zdravotníckych pracovníkov prebiehalo vo väčšine štúdií do 9 mesiacov[14, 17, 25, 26]. Po aplikácii druhej dávky vakcíny boli detegované protilátky v celom súbore. Najvyššie priemerné hladiny protilátok sme zaznamenali 2 týždne od podania 2. dávky. Následne priemerné hladiny protilátok klesali. Po 36 týždňoch sa ich hladina začínala približovať k hodnotám nameraným 2 týždne po aplikácii prvej dávky. Kontrolný súbor mal aj v 48. týždni od podania 2. dávky stále prítomné protilátky, hoci hladina protilátok od podania 2. dávky postupne klesala. Efekt podania 3. dávky na hladinu protilátok bol jednoznačne preukázaný. Vplyv vybraných demografických ukazovateľov na hladinu protilátok sme analyzovali na užšej skupine účastníkov (N = 221).
Signifikantne vyššie hladiny protilátok sme zaznamenali u žien a mladších vekových kategórií. Vplyv veku sa nám podarilo potvrdiť na viacerých užšie vybraných súboroch, ktoré obmedzujú vplyv pohlavia na výsledky jednotlivých analýz. Vyššie hladiny protilátok u žien a mladších vekových kategórií potvrdili mnohé štúdie. Väčšina z nich sledovala probandov v kratšom časovom intervale jeden až štyri týždne od podania 2. dávky [11–13, 23, 24]. Vplyv pohlavia a veku na výšku hladiny protilátok súvisia s vplyvom hormónov na imunitný systém a imunosenescenciou [13]. Aj dlhodobejšie štúdie, ktoré sledovali hladinu protilátok v intervale 3 až 6 mesiacov od podania druhej dávky, dospeli k rovnakým záverom [15, 17, 25].
Vplyv BMI na hladinu protilátok bol v našej štúdii na hranici štatistickej významnosti. Obézni probandi s BMI nad 30,0 kg/m2 reagovali pomalšie na vakcínu a protilátky u nich rýchlejšie klesali. Na užšej skupine probandov (N = 82) s rovnomernejším zastúpením v zmysle veku, pohlavia a BMI sme však nepotvrdili vplyv BMI na hladinu protilátok. Pellini et al. nepotvrdil štatisticky významný vplyv BMI alebo hypertenzie na hladinu protilátok. Hladiny protilátok boli síce vyššie v kategórii podváha a normálne BMI do 24,9 kg/m2 v porovnaní s osobami s nadváhou a obezitou, avšak po zohľadnení veku a pohlavia už vplyv nebol štatisticky významný (p = 0,04). Costa et al. rovnako nezaznamenali signifikantnú asociáciu medzi BMI a hladinou protilátok [12, 22]. Levin et al. zaznamenal dokonca signifikantne vyššie hladiny neutralizujúcich protilátok u osôb s BMI > 30 kg/m2 v porovnaní s osobami s BMI menej ako 30 kg/m2 [25]. Vplyv obezity na hladinu protilátok bol však dokázaný vo viacerých štúdiách, avšak BMI nie je postačujúci parameter na stanovenie obezity, keďže neodzrkadľuje správne distribúciu tuku. Malavazos et al. potvrdili, že osoby s abdominálnou obezitou dosiahli nižšie hladiny po vakcinácii a protilátky u nich výraznejšie klesali 3 mesiace od podania 2. dávky. Podobne Watanabe et al. potvrdili u osôb s centrálnou obezitou nižšie hladiny protilátok nezávisle od BMI, veku a pohlavia [20, 21].
Vplyv pridružených ochorení na hladinu protilátok nebolo možné v našej štúdii dokázať pravdepodobne aj pre nízke zastúpenie probandov s ochoreniami.
Vplyv imunodeficiencií a imunosupresie na hladinu protilátok bol potvrdený vo viacerých štúdiách [11, 22, 25]. Lustig et. al. pozoroval nižšie hladiny protilátok aj u ďalších špecifických komorbidít; konkrétne diabetes mellitus, hypertenzia, ochorenie kardiovaskulárneho systému a autoimunitné ochorenia [11]. V porovnaní s našou štúdiou mali všetky spomenuté štúdie v súbore vyšší podiel probandov s pridruženými ochoreniami. Skupiny probandov s výskytom vybraných nežiadúcich účinkov dosiahli vo všetkých odberoch o niečo vyššie priemerné hladiny protilátok. Štatisticky významné rozdiely boli po aplikácii prvej dávky v prípade bolesti hlavy, migrény, opuchu a začervenaní v mieste vpichu. Výsledky však môžu byť skreslené vplyvom nízkeho počtu probandov v analýze. Výskyt nežiadúcich účinkov po aplikácii druhej dávky výraznejšie súvisel s hladinou protilátok vo všetkých meraniach. Štatisticky významný vplyv bol pri výskyte systémových nežiadúcich účinkov, konkrétne bolesti hlavy, migréne, bolesti svalov, kĺbov, chrbta, zvýšenej teplote, únave, slabosti, malátnosti, zimnice a triaške. Asociáciu, či už na úrovni lokálnych alebo predovšetkým systémových nežiadúcich účinkov, potvrdili viaceré štúdie na menšom aj väčšom počte účastníkov. Naaber et al. našiel súvislosť medzi viacerými nežiadúcimi účinkami a hladinou protilátok, silná závislosť bola pri teplote, ale aj bolestiach hlavy, únave, slabosti, zimnici a nevoľnosti [14]. Azzolini et al. potvrdila asociáciu výšky protilátkovej odpovede meranej 10 dní od podania druhej dávky s výskytom nežiadúcich účinkov, predovšetkým horúčky, bolesti svalov a lymfadenopatie [18]. Rechavi et al. potvrdil vplyv lokálnych nežiadúcich účinkov po prvej dávke a systémových po druhej dávke na hladinou protilátok. Meranie však realizoval v intervale 32.4 ± 4.84 dni po aplikácii druhej dávky [16]. Speletas et. al. popísal krátkodobý vplyv systémových nežiadúcich účinkov, hlavne horúčky a bolestí svalov na hladinu protilátok. Asociáciu však nepotvrdil pri meraní v 3. a 6. mesiaci [15]. Coggins et al. nepotvrdil súvis medzi nežiadúcimi účinkami a hladinou protilátok. Tento nedostatok závislosti pozoroval aj po zohľadnení veku, hmotnosti a pohlavia. V rámci dotazníka pozoroval častejší výskyt nežiadúcich účinkov u žien, ktoré nepriamo súviseli s vekom a hmotnosťou [19].
Prítomnosť špecifických CD4 a/alebo CD8 T lymfocytov medzi 36.–44. týždňom po aplikácii 2. dávky bola u 65,6 % testovaných účastníkov, kým protilátková odpoveď v 36. týždni bola prítomná u 99,6 % testovaných. Nepodarilo sa však potvrdiť asociáciu medzi hladinou protilátok a prítomnou bunkovou imunitou. K rovnakým záverom prišiel aj Naaber et. al. analýzou pamäťových CD4 a CD8 T lymfocytov v 12. týždni od aplikácie 2. dávky [14]. Speletas et al., meraním prítomnosti reaktívnych T lymfocytov v 6. mesiaci od prvej dávky potvrdil závislosť medzi celulárnou a humorálnou imunitou v zmysle prítomná/neprítomná. Porovnávanie však realizoval iba na skupine 10 protilátkovo pozitívnych a 11 negatívnych participantov [15]. V našom súbore sa u 65 probandov s prítomnými protilátkami v 36. týždni nepotvrdila prítomnosť špecifických efektorových T lymfocytov a teda sa nepodarilo nájsť súvislosť medzi protilátkovou odpoveďou a pozitívnym quantiferonovým testom.
Protektívna hladina anti SARS-CoV-2 protilátok, na základe ktorej by sa rozhodovalo o potrebe boostra, však nebola doteraz definovaná. Situáciu zľahka komplikuje aj veľké množstvo používaných diagnostických súprav s vyjadrením hladiny protilátok v rôznych jednotkách. WHO odporúča vyjadrovať výsledky nameraných hladín anti SARS-CoV-2 protilátok v jednotkách BAU/ml [27]. Časť výrobcov už teraz vo svojich diagnostických súpravách priamo používa jednotky BAU/ml a pri niektorých súpravách je možnosť prepočtu týchto jednotiek cez koeficienty. Napriek týmto snahám o zjednotenie, stále sú pri kvantitatívnych diagnostických súpravách isté odlišnosti; napríklad v štruktúre použitého antigénu respektíve jeho časti, alebo v meracom rozmedzí, prípadne detegovanej triedy protilátok. Aj pri prepočte výsledkov nameraných hladín protilátok na jednotky BAU/ml pri analýze rovnakých vzoriek, existujú medzi vybranými súpravami štatisticky významné rozdiely. Ďalšia harmonizácia diagnostických súprav s použitím medzinárodného štandardu WHO by bola prospešná [27, 28, 29].
Diagnostická súprava použitá v tejto štúdii nemá možnosť prepočtu jednotiek AU/ml na BAU/ml cez koeficienty, nakoľko medzičasom výrobca vyvinul novšiu verziu súpravy s vyjadrením hladín protilátok priamo v BAU/ml. V čase začiatku štúdie však novšia verzia súpravy nebola dostupná a pre zachovanie kontinuity dát sme dokončili štúdiu s pôvodnou diagnostickou súpravou.
ZÁVER
V rámci našej štúdie môžeme potvrdiť prítomnosť protilátkovej odpovede po druhej dávke u 100 % účastníkov a jej pretrvávanie v 36. týždni u 99,6 % účastníkov. Reaktívne špecifické T lymfocyty boli prítomné u 65,6 % testovaných medzi 36. až 44. týždňom. Asociáciu medzi protilátkovou odpoveďou a pozitívnym quantiferónovým testom sme nenašli. Vyššie hladiny protilátok sme potvrdili u žien, mladších vekových kategórií a u probandov so systémovými nežiadúcimi účinkami po aplikácii 2. dávky. Vývoj pandémie SARS-CoV-2 naznačuje potrebu podávania ďalších dávok vakcín v budúcnosti. Znalosť minimálnej protektívnej hladiny protilátok by pomohla v optimalizácii schém preočkovaní. Sľubné je vyjadrovanie hladín protilátok v jednotkách BAU/ml a snaha výrobcov upraviť používané jednotky v diagnostických súpravách buď priamo, alebo prostredníctvom koeficientov na tieto jednotky.
Táto publikácia vznikla vďaka podpore v rámci Operačného programu Integrovaná infraštruktúra pre projekt: Výskum progresívnych metód diagnostiky COVID-19 a biomarkerov umožňujúcich skorú detekciu jedincov so zvýšeným rizikom ťažkého priebehu ochorenia, kód ITMS: 313011ATA2, spolufinancovaný zo zdrojov Európskeho fondu regionálneho rozvoja.
Do redakce došlo dne 2. 8. 2022.
Adresa pro korespondenci:
MUDr. Emília Miková
Medirex, a. s. Galvaniho 17/C 820 16 Bratislava
Slovenská republika e-mail: emilia.mikova@medirex.sk
Zdroje
- Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat Microbiol, 2020;5(4):536–544.
- Zhou, P, Yang, XL, Wang, XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 2020;579 : 270–273.
- WHO: Coronavirus disease 2019 (COVID-19) Situation Report – 91, 2020. Dostupné na www: https://www.who.int/docs/ default-source/coronaviruse/situation-reports/20200420-sitrep-91-covid-19.pdf?sfvrsn=fcf0670b_10.
- Huang, C, Wang Y, Xingwang L, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 2020;395 : 497–506.
- Wu Z, McGoogan JM. Characteristics of and important lessons From the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72,314 cases from the Chinese Center for Disease Control and Prevention. JAMA, 2020;323(13):1239 – 1242.
- Grigoryan L, Pulendran B. The immunology of SARS-CoV-2 infections and vaccines. Semin Immunol, 2020;50 : 101422.
- Post N, Eddy D, Huntley C, et al. Antibody response to SARS-CoV-2 infection in humans: A systematic review. PLoS One, 2020;15(12):e0244126.
- Kassambara A. Comparing multiple menas in R. Repeated measures ANOVA in R. Dostupné na www: https://www.datanovia. com/en/lessons/repeated-measures-anova-in-r/
- Diasorin [online]. LIAISON® SARS-CoV-2 S1/S2 IgG. Príbalová informácia, 2020. SK-200/007-797 Verzia 04-2020-05. Dostupné na www: https://www.diasorin.com/sites/default/files/allegati/ liaisonr_sars-cov-2_s1s2_igg_brochure.pdf.pdf.
- Qiagen® [online] QuantiFERON® SARS-CoV-2 ELISA Kit. Príbalová informácia 2021-11,Verzia 1. Dostupné na www: https:// www.qiagen.com/de/resources/resourcedetail?id=3d27842e - c811-442c-bcad-a9d42945e59c&lang=en.
- Lustig Y, Sapir E, Regev-Yochay G, et al. BNT162b2 COVID-19 vaccine and correlates of humoral immune responses and dynamics: a prospective, single-centre, longitudinal cohort study in health-care workers. Lancet Respir Med, 2021;9 : 999–1009.
- Pellini R, Venuti A, Pimpinelli F, et al. Initial observations on age, gender, BMI and hypertension in antibody responses to SARS-CoV-2 BNT162b2 vaccine. EClinicalMedicine, 2021;36 : 100928.
- Di Resta Ch, Ferrari D, Vigano M, et al. The gender impact assesment among healthcare workers in the SARS-CoV-2 vaccination – an analysis of serological response and side effects. Vaccines, 2021;9 : 22.
- Naaber P, Tserel L, Kangroo K, et al. Dynamics of antibody response to BNT162b2 vaccine after six months: a longitudinal prospective study. The Lancet Regional Health – Europe, 2021;10 : 100208
- Speletas M, Voulgaridi I, Sarrou S, et al. Intensity and Dynamics of Anti-SARS-CoV-2 Immune Responses after BNT162b2 mRNA Vaccination: Implications for Public Health Vaccination Strategies. Vaccines, 2022;10 : 316.
- Rechavi Y, Shashar M, Lellouche J, et al. Occurrence of BNT162b2 Vaccine Adverse Reactions Is Associated with Enhanced SARS-CoV-2 IgG Antibody Response. Vaccines, 2021;9 : 977.
- Silva JO, Reis T, Lopes C, et al. Humoral response to the SARS-CoV-2 BNT162b2 mRNA vaccine: Real-world data from a large cohort of healthcare workers. Vaccine, 2022;40 : 650–655.
- Azzolini E, Canziani, LM, Voza A, et al. Short-Term Adverse Events and Antibody Response to the BNT162b2 SARS-CoV-2 Vaccine in 4156 Health Care Professionals. Vaccines, 2022;10 : 439.
- Coggins SAA, Laing ED, Olsen CH, et al. Adverse Effects and Antibody Titers in Response to the BNT162b2 mRNA COVID-19 Vaccine in a Prospective Study of Healthcare Workers. Open Forum Infect Dis, 2021;9(1): 575.
- Watanabe M, Balena A, Tuccinardi D, et al. Central obesity, smoking habit, and hypertension are associated with lower antibody titres in response to COVID-19 mRNA vaccine. Diabetes Metab Res Rev, 2022;38(1):e3465.
- Malavazos AE, Basilico S, Iacobellis G, et. al. Antibody responses to BNT162b2 mRNA vaccine: Infection-naïve individuals with abdominal obesity warrant attention. Obesity (Silver Spring), 2022;30(3):606–613.
- Costa C, Migliore E, Galassi C, et al. Factors Influencing Level and Persistence of Anti SARS-CoV-2 IgG after BNT162b2 Vaccine: Evidence from a Large Cohort of HealthcareWorkers. Vaccines, 2022;10 : 474.
- Vassilaki N, Gargalionis AN, Bletsa A, et al. Impact of Age and Sex on Antibody Response Following the Second Dose of COVID-19 BNT162b2 mRNA Vaccine in Greek Healthcare Workers. Microorganisms, 2021;9(8):1725.
- Terpos E, Trougakos IP, Apostolakou F, et al. Age-dependent and gender-dependent antibody responses against SARS-CoV-2 in health workers and octogenarians after vaccination with the BNT162b2 mRNA vaccine. Am J Hematol, 2021;96(7):E257–E259.
- Levin EG., Lustig Y, Cohen C, et al. Waning Immune Humoral Response to BNT162b2 Covid-19 Vaccine over 6 Months. N Engl J Med, 2021;385(24):e84.
- Pilmis B, Elkaibi I, Péan de Ponfilly G, et al. Evolution of antiSARS-CoV-2 immune response in a cohort of French healthcare workers followed for 7 months. Infect Dis Now, 2022;52(2):68–74.
- Infantino M, Pieri M, Nuccetelli M, et al. The WHO International Standard for COVID-19 serological tests: towards harmonization of anti-spike assays. International Immunopharmacology, 2021;100 : 108095.
- Müller L, Kannenberg J, Biemann R, et al. Comparison of the measured values of quantitative SARS-CoV-2 spike antibody assays. Journal of Clinical Virology, 2022;155 : 105269.
- Kobayashi R, Suzuki E, Murai R, et al. Performance analysis among multiple fully automated anti-SARS-CoV-2 antibody measurement reagents: A potential indicator for the correlation of protection in the antibody titer. Journal of Infection and Chemotherapy, 2022;28 : 1295–1303
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek Lidská babesióza
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2023 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Prokalcitonin: marker vhodný pro diagnostiku sepse i hodnocení antimikrobiální léčby
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Monitoring hladiny protilátok v súvislosti s očkovaním proti SARS-CoV-2 – 11-mesačné sledovanie
- Úloha endogénnych retrovírusov v ľudskom organizme
- Mykobakteriózy – nejčastější původci
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Lidská babesióza
- Detekce superantigenů u izolátů Streptococcus pyogenes na základě dat celogenomové sekvenace
- Prevalencia meticilín-rezistentného Staphylococcus aureus medzi obyvateľmi domovov dôchodcov na Slovensku
- Vzpomínka na RNDr. Václava Rupeše, CSc.
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mykobakteriózy – nejčastější původci
- Lidská babesióza
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



