-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Úloha endogénnych retrovírusov v ľudskom organizme
The role of endogenous retroviruses in the human body
Endogenous retroviruses (ERVs) are genetic elements that were integrated into the host genome more than 100 million years ago. Their integration took place in germ cells, ensuring their vertical transmission in the human population. They are currently thought to make up to 8 % of the human genome. During evolution, various mutations have accumulated in endogenous retroviruses, leading to their dysfunction, and were therefore considered as junk DNA in the past. However, in recent years it has turned out that they are not completely dysfunctional. With more data becoming available from human genome analyses, their potential roles in the human body are being revealed.
Keywords:
genome – endogenous retroviruses – integration
Autoři: M. Mazúrová 1; P. Kabát 1,2
Působiště autorů: Univerzita Komenského, Prírodovedecká fakulta, Katedra mikrobiológie a virológie, Bratislava, Slovenská republika 1; Biomedicínske centrum SAV – Virologický ústav, Bratislava, Slovenská republika 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 72, 2023, č. 3, s. 140-150
Kategorie: Souhrnné sdělení
Souhrn
Endogénne retrovírusy (ERV) sú genetické elementy, ktoré boli integrované do genómu hostiteľa pred viac ako 100 miliónmi rokov. Ich integrácia prebehla v zárodočných bunkách, čím sa v ľudskej populácii zabezpečil ich prenos z generácie na generáciu. V súčasnosti sa predpokladá, že tvoria až 8 % ľudského genómu. V priebehu evolúcie došlo v endogénnych retrovírusoch ku hromadeniu rôznych mutácii, čo viedlo k ich znefunkčneniu, a preto sa v minulosti považovali za odpadovú DNA. V posledných rokoch sa však ukazuje, že nie sú úplne nefunkčné. S pribúdajúcimi analýzami ľudského genómu sa odhaľujú ich potenciálne úlohy aj v ľudskom organizme.
Klíčová slova:
genom – endogénne retrovírusy – integrácia
ÚVOD
Sú alebo nie sú ľudské endogénne retrovírusy nefunkčnou a zbytočnou súčasťou ľudského genómu? Najnovšie poznatky naznačujú, že majú v ľudskom organizme svoj osobitý význam.
Aj keď je expresia ľudských endogénnych retrovírusov za normálnych okolností potlačená, po čase môže vplyvom viacerých faktorov dôjsť k aktivácii týchto elementov a následnej expresii retrovírusových génov. Prítomnosť HERV v ľudskom genóme spôsobuje jeho nestabilitu pomocou mechanizmov, ako sú inzerčná mutagenéza či nealelická homológna rekombinácia. Genóm mnohých endogénnych retrovírusov obsahuje LTR oblasti (Long terminal repeat – dlhé koncové opakovania), ktoré môžu pôsobiť ako promótory či enhancery okolitých génov. V neposledom rade môžu byť transkripty ľudských endogénnych retrovírusov vbalené do exozómov či mikrovezikúl a ovplyvniť charakter okolitých buniek. Všetky tieto udalosti môžu mať v ľudskom organizme pozitívny alebo negatívny vplyv.
Najvýznamnejší vplyv ľudských endogénnych retrovírusov sa pripisuje ich prítomnosti v procese formovania placenty. Okrem toho však dokážu chrániť pred infekciou iných retrovírusov či ovplyvňovať reguláciu niektorých užitočných génov. Ich negatívny význam bol z viacerých hľadísk dokázaný u pacientov s rakovinou či leukémiou. Taktiež bola dokázaná súvislosť medzi endogénnymi retrovírusmi a rôznymi autoimunitnými či neuropsychiatrickými ochoreniami.
RETROVÍRUSY
Čeľaď Retroviridae je veľká čeľaď vírusov, ktoré sa vyskytujú u všetkých stavovcov.
Vírusové častice obsahujú genomickú RNA, ktorá je pri vstupe do hostiteľskej bunky spätne prepisovaná do DNA a tá je následne integrovaná do chromozómov hostiteľa. Takto integrovaná forma vírusovej DNA sa nazýva provírus a slúži ako templát na tvorbu nových vírusových RNA a proteínov potrebných pre tvorbu vírusových častíc. Práve tieto vlastnosti životného cyklu, reverzný prepis genetickej informácie z RNA do DNA a vytvorenie DNA v integrovanej forme v hostiteľskom genóme, sú charakteristickými znakmi retrovírusov [1].
ENDOGÉNNY VERZUS EXOGÉNNY RETROVÍRUS
Retrovírusy sa u ľudí môžu vyskytovať v dvoch formách. Prvú skupinu predstavujú retrovírusy ako genetické prvky, ktoré sú stabilne zabudované v chromozomálnej DNA zárodočných buniek. Túto skupinu nazývame endogénne retrovírusy a tieto retrovírusy sú prenášané z generácie na generáciu vertikálne cez zárodočnú líniu [2].
Retrovírusy, ktoré sa prenášajú z jedného hostiteľa na druhého počas vírusovej infekcie nazývame exogénne [3]. Ich prenos sa u ľudí uskutočňuje hlavne prostredníctvom telových tekutín (materského mlieka, slín, krvi alebo sexuálneho kontaktu) [4].
Medzi týmito dvomi skupinami pozorujeme isté rozdiely. Zatiaľ čo endogénny retrovírus je začlenený do zárodočných buniek hostiteľa, exogénny sa vyskytuje iba v somatických bunkách. Endogénne retrovírusy sa prenášajú z rodičov na potomkov prostredníctvom gamét bez vzniku infekčnej vírusovej častice. Pri exogénnych retrovírusoch musí opakovane dochádzať k produkcii viriónov a infekcii nových buniek, aby sa zachovala ich prítomnosť v organizme (obr. 1) [5]. Zatiaľ čo exogénna retrovírusová infekcia v konečnom dôsledku vedie k tvorbe nových infekčných viriónov, endogénne retrovírusy sú v genóme perzistentné a dochádza v nich k hromadeniu mutácii a vzniku defektných neinfekčných vírusových častíc [6].
Exogénne retrovírusy sú často spájané s vývojom rôznych ochorení (autoimunitné ochorenia, určité typy leukémii a solídnych nádorov, imunodeficiencie a iné) [4]. Počet známych exogénnych retrovírusov je však malý. Najznámejším horizontálne sa prenášajúcim retrovírusom je vírus HIV, ktorý vyvoláva syndróm získanej imunitnej nedostatočnosti – AIDS. Ďalšie významné vírusy sú napríklad ľudský lymfocytárny vírus T-buniek typu 1 – HTLV-1, a typu 2 – HTLV-2, ktoré sú zodpovedné za vznik leukémií [3].
ENDOGÉNNE RETROVÍRUSY
Endogénne retrovírusy sa vyskytujú u všetkých druhov stavovcov, vrátane ľudí, a tvoria významnú súčasť genómu. Ľudské endogénne retrovírusy (Human Endogenous Retroviruses, HERV) tvoria okolo 8 % genómu svojho hostiteľa a sú jeho stabilnou súčasťou. Provírus obsahuje otvorené čítacie rámce ohraničené LTR oblasťami. Tieto sú veľmi dôležité, pretože obsahujú promótorové sekvencie a majú vplyv nielen na expresiu samotného HERV, ale aj okolitých ľudských génov [7]. HERV sa vyznačujú vysokou mierou rekombinácie, najmä homologickou rekombináciou medzi vírusovými LTR, čo vedie k vzniku sólo LTR a zároveň rekombináciou medzi dvomi rôznymi provírusmi, čo vedie k vzniku mutácii buď vo forme inzercii alebo delécii. LTR oblasti zasiahnuté týmito rekombinačnými udalosťami viedli v priebehu evolúcie k strate funkčnosti HERV.
Dedičnosť provírusových sekvencii môže vyvolať u hostiteľa niekoľko následkov. Inzercia provírusov môže spôsobovať preskupenia génov, čo môže viesť ku vzniku nových kontrolných sekvencii alebo mutovaných génov. Vloženie viacerých sekvencii do genómu hostiteľa môže viesť k modifikácii transkripcie, alebo spracovaniu RNA. Expresia vírusových génov môže mať patogénne aj prospešné účinky. V extrémnych prípa doch môže dôjsť k aktivácii vírusu a tvorbe vírusom indikovaných nádorov [8]. To, či sa ERV v genóme udržia alebo nie závisí od prirodzeného výberu. Endogénne retrovírusy, ktoré neposkytujú hostitelovi akékoľvek benefity, zvyčajne podliehajú negatívnej selekcii a počas niekoľkých generácii dochádza k ich eliminácii z genómu. U neutrálnych ERV môže dôjsť aj k negatívnej selekcii, aj k fixácii. ERV, ktoré poskytujú hostiteľovi významné selektívne výhody, môžu svoju frekvenciu zvýšiť a s veľkou pravdepodobnosťou dochádza k ich fixácii a zachovaniu v genóme [9].
Obr. 1. Rozdiel medzi horizontálnym a vertikálnym prenosom vírusu Figure 1. Difference between horizontal and vertical transmission of the virus 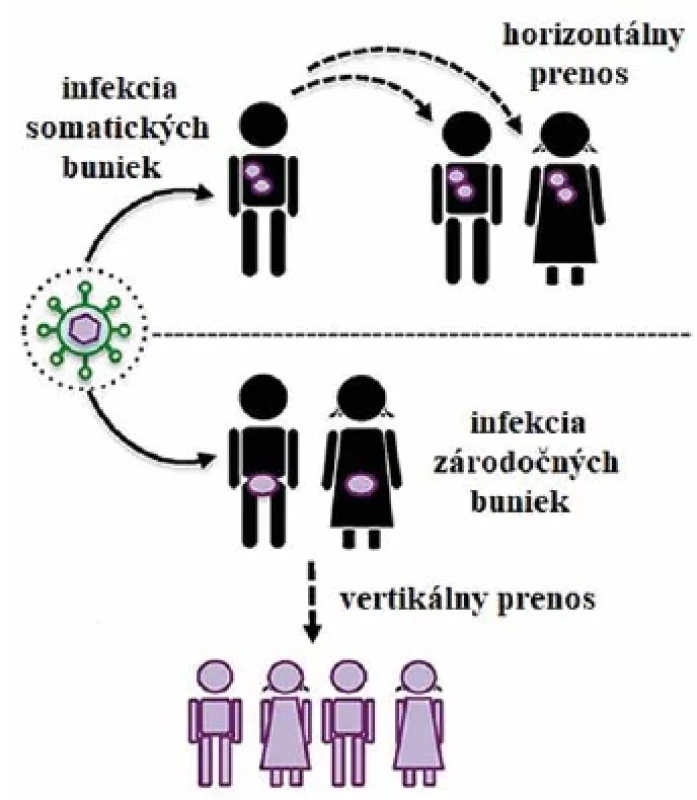
Infekcia somatických buniek v populácii spôsobuje horizontálny prenos – opakovanú infekciu jedného jedinca od druhého. Infekcia zárodočných buniek spôsobuje vertikálny prenos – infekcia prechádza z rodičovskej generácie na potomkov.(Grandi a Tramontano, 2018 -upravené) Infection of somatic cells in a population causes horizontal transmission, i.e., repeated person-to-person infection. Germ cell infection leads to vertical transmission, with the infection being passed from the ancestral generation to the offspring.(Adapted from Grandi and Tramontano, 2018) VPLYV ENDOGÉNNYCH RETROVÍRUSOV NA ĽUDSKÝ ORGANIZMUS
U mnohých ERV bolo potvrdené, že ovplyvňujú fyziologické funkcie svojho hostiteľa. Na základe týchto informácii už nemôžeme ERV považovať za odpadovú DNA [10]. Jedna z úloh ERV, ktorá bola potvrdená vo viacerých prípadoch je ich úloha pri vzniku placenty.
Niektoré ERV využívajú mechanizmy, vďaka ktorým dokážu blokovať jednotlivé kroky replikácie iných retrovírusov a ochrániť tak organizmus pred superinfekciou. Okrem toho bolo dokázané, že expresia viacerých génov v ľudskom organizme je regulovaná kontrolnými oblasťami pochádzajúcimi z LTR HERV [11].
POZITÍVNY VPLYV ENDOGÉNNYCH RETROVÍRUSOV NA ĽUDSKÝ ORGANIZMUS
V posledných rokoch sa vplyv ERV spája s vývojom placenty. Vývoj placenty je u cicavcov asociovaný s prítomnosťou génu pochádzajúceho z retrovírusu, ktorý sa pred niekoľkými miliónmi rokov zabudoval do hostiteľského genómu. Pozitívny vplyv HERV na vývoj placenty je podložený štúdiami zaoberajúcimi sa zmenami expresie tohto génu, ktoré viedli k vzniku rôznych komplikácii počas tehotenstva [12].
ERV sa podieľajú aj na obranných mechanizmoch v organizme, ovplyvňujú aktiváciu imunitnej odpovede a expresiu viacerých génov pomocou ich LTR oblastí [13].
Vývoj placenty, preeklampsia a priebeh tehotenstva
Placenta je dočasný, samostatný orgán vyvíjajúci sa v tele matky. Počas tehotenstva oddeľuje krvný obeh matky a krvný obeh plodu. Medzi jej funkcie patrí sprostredkovanie výmeny plynov a transfer živín a odpadových produktov medzi matkou a plodom. Má taktiež imunologickú funkciu, keďže umožňuje prechod protilátok z krvného obehu matky do krvného obehu plodu. Zároveň zabezpečuje sekréciu rôznych hormónov a v neposlednom rade chráni samotný plod.
Pre vznik placenty je v ranom štádiu tehotenstva kľúčová fúzia buniek trofoblastu. Počas implantácie trofoblastu dochádza k jeho diferenciácii, pričom vznikajú dve vrstvy – vnútorná vrstva (cytotrofoblast) a vonkajšia vrstva (syncytiotrofoblast), ktorá vzniká fúziou buniek cytotrofoblastov [14]. Do procesu fúzie trofoblastov sú zapojené produkty génov env pochádzajúcich z endogénnych retrovírusov, konkrétne syncytín-1 a syncytín-2 [15]. Syncytín-1 a 2 sú proteíny exprimované v placente, ktoré po reakcii so špecifickými receptormi indukujú vzájomnú fúziu buniek [16].
Oba sú produktami obalových génov HERV, vyskytujúcich sa vo forme provírusu na chromozóme 7, konkrétne syncytín-1 pochádza z HERV-WE1 a syncytín-2 z HERV-FRD [15, 17]. Syncytín-1 je proteín zodpovedný za proliferáciu a fúziu buniek a je nevyhnutný pri tvorbe syncytiotrofoblastu, ktorý vylučuje hormóny podporujúce rast plodu ako sú choriový gonadotropín a ľudský choriový somatomamotropín [17]. Syncytín-2 sa podieľa aj na procese morfogenézy placenty, chráni plod pred imunologickým odmietnutím a pred mikrobiálnymi infekciami [6, 15]. Okrem rozdielneho pôvodu sa odlišujú aj rozdielnou distribúciou v bunkách. Syncytín-1 je prítomný vo všetkých trofoblastových bunkách, pričom syncytín-2 je exprimovaný iba v cytotrofoblastoch [16].
Tieto proteíny sú schopné vyvolať fúziu buniek práve vďaka svojmu vírusovému pôvodu. Obalové glykoproteíny na povrchu viriónu ukotvené v lipidovej dvojvrstve dokážu po rozoznaní špecifického receptora na hostiteľskej bunke vyvolať fúziu vírusového obalu s bunkovou membránou. K rovnakému mechanizmu dochádza aj v prípade syncytínov [15]. Exprimované syncytíny sú na povrchu trofoblastov rozpoznávané špecifickými receptormi. Receptor SLC1A5 rozpoznáva syncytín-1, zatiaľ čo receptor MFSD2 je špecifický pre syncytín-2 [16]. Práve interakcia medzi proteínmi a ich špecifickými receptormi umožňuje fúziu buniek, čo je nevyhnutný krok pre tvorbu syncytiotrofoblastu, a teda aj vznik placenty [17]. Vznik placenty predstavuje v evolúcii nesmierne významný krok, vďaka ktorému došlo k prechodu od vajcorodosti k živorodosti [11].
Bezproblémový priebeh tehotenstva z veľkej miery závisí aj od správneho vývoja placenty. Ten môže byť okrem iného ovplyvnený aj zmenou expresie niektorých génov, čo môže viesť k vývojovým chybám plodu. Abnormality pri vývine syncytiotrofoblastu sú spájané so vznikom preeklampsie. Bolo dokázané, že expresia génov kódujúcich syncytín bola u pacientiek s preeklampsiou výrazne znížená. Zároveň bola u týchto pacientiek odlišná aj lokalizácia syncytínu. U zdravých pacientiek je syncytín v placente exprimovaný na bazálnej membráne, pričom u pacientiek s preeklampsiou je syncytín lokalizovaný na apikálnej membráne, čo znemožňuje fúziu buniek [14].
Znížená expresia syncytínu-2 znemožňuje fúziu buniek. Následkom nesprávnej fúzie buniek môže dôjsť v skorých týždňoch tehotenstva k potratu, ktorý je spôsobený nesprávnym vývinom syncytiotrofoblastu a neschopnosťou zárodku prichytiť sa k endometriu [16].
Ochrana pred infekciou exogénnymi retrovírusmi
Ďalšou z výhod, ktorú môžu integrované endogénne retrovírusy poskytovať hostiteľovi, je ochrana pred infekciou exogénnymi retrovírusmi. Expresia produktov endogénnych vírusov môže brániť infekcii v rôznych krokoch replikačného cyklu vírusu [10].
Expresia HERV môže ochrániť hostiteľa pred superinfekciou tromi spôsobmi (obr. 2):
- Expresia HERV mRNA môže komplementárne interagovať s RNA exogénneho vírusu, pričom sa vytvorí dsRNA, ktorá je vrodenou imunitou rozpoznaná ako molekulárny vzor asociovaný s patogénom (PAMP – Pathogen-associated molecular patterns). Prítomnosť PAMP v buňkách spúšťa metabolické kaskády, ktoré vedú k ich eliminácii.
- Pri skladaní vírusovej častice dochádza k včleneniu štruktúrnych proteínov pochádzajúcich z HERV, čo môže mať vplyv na zhromažďovanie a uvoľnenie častíc exogénneho vírusu.
- Proteíny translatované z mRNA HERV sa môžu viazať na rovnaký receptor ako exogénny retrovírus, čo bráni jeho naviazaniu na receptor a následnému vstupu do bunky [6].
Obr. 2. Vplyv HERV na replikačný cyklus exogénnych retrovírusov Figure 2. Effect of HERV on the replication cycle of exogenous retroviruses 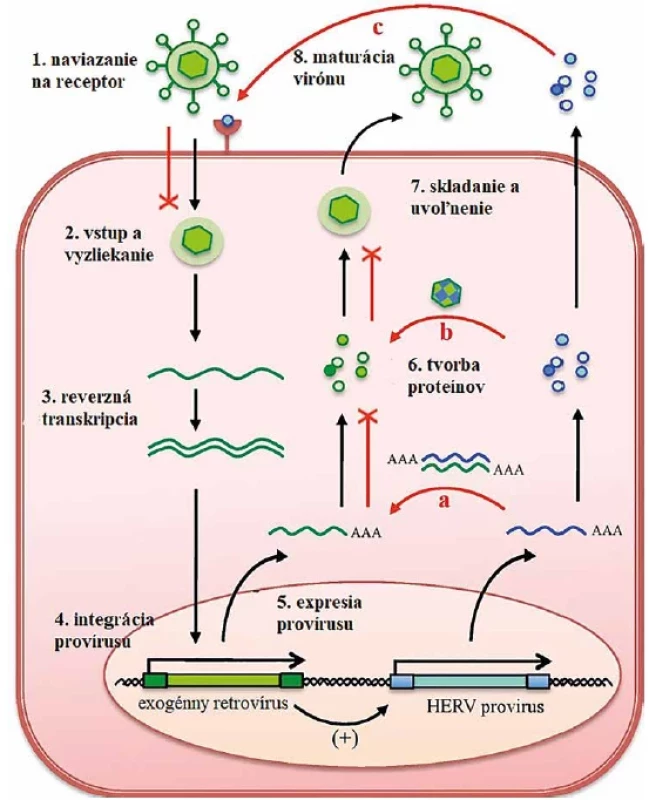
Schopnosť HERV ovplyvňovať jednotlivé kroky replikácie exogénneho vírusu dokážu ochrániť hostiteľa pred superinfekciou.(Grandi a Tramontano, 2018 – upravené)The ability of HERV to alter different steps of exogenous virus replication can protect the host from superinfection.(Adapted from Grandi and Tramontano, 2018) Najnovšie výskumy opisujú aj ďalšie dôležité mechanizmy, pomocou ktorých dokážu HERV obrániť organizmus pred infekciou iným vírusom. Bolo dokázané, že tak, ako interakcia medzi mRNA HERV s mRNA iného vírusu dokáže aktivovať imunitnú odpoveď, rovnakým spôsobom dokážu imunitnú odpoveď stimulovať aj proteíny či nekódujúce RNA (ncRNA) pochádzajúce z HERV. HERV prispievajú aj ku plasticite genómu a ich LTR oblasti môžu ovplyvňovať expresiu génov, ktoré sú zodpovedné za syntézu antivírusových proteínov napríklad imunoregulačné transkripčné faktory ako ako NF-κB, interferónové regulačné faktory (IRF) alebo STAT [18].
LTR oblasti ako promótory a enhancery
Okrem toho, že ERV slúžia ako prekurzory pre syntézu niektorých proteínov, ich LTR oblasti sa môžu správať ako promótory či enhancery a ovplyvňovať tak reguláciu expresie okolitých génov [11].
Nedávne štúdie ukazujú, že približne 75 % všetkých ľudských génov využíva aj takzvané alternatívne promótory. Medzi ich hlavné funkcie patrí riadenie transkripcie v rôznych vývojových štádiách alebo na rôznych úrovniach expresie, regulácia alternatívneho zostrihu, ktorá môže viesť k tvorbe rozličných izoforiem proteínov, alebo schopnosť riadiť preklad viacerých otvorených čítacích rámcov [19].
LTR promótory pochádzajúce z ERV majú zvyčajne priaznivé alebo neutrálne účinky, pretože keby inzercia LTR oblasti vyvolala v organizme nepriaznivé účinky, podliehala by negatívnej selekcii a bola by z genómu eliminovaná [9]. Vo väčšine prípadov majú LTR promótory relatívne slabý účinok na tkanivovú špecificitu a ich význam sa prikladá zvýšeniu expresie natívneho (primárneho) promótora.
Medzi produkty génov, ktorých tkanivová špecificita je ovplyvnená činnosťou LTR promótorov patria napríklad β-1,3-galaktozyltransferáza 5, aromatáza, receptor interleukínu-2, syntáza oxidu dusnatého 3 či pleiotropín. Vplyv LTR promótora na posledné 4 vymenované spôsobuje, že všetky dokážu byť exprimované v placente, pričom ich primárna expresia sa odohráva v iných bunkách a tkanivách.
V prípade, že LTR promótor poskytuje rovnaké spôsoby expresie ako natívny promótor, môžu nastať dva scenáre – LTR sa bude považovať za primárny promótor alebo, ak je aktivita LTR promótora nižšia ako aktivita pôvodného natívneho promótora, jeho vplyv na expresiu bude len veľmi malý.
Produkty génov, u ktorých sú LTR promótory považované za primárne sú alkoholdehydrogenáza 1C, proteín podobný inzulínu 4, pappalyzín 2 a iné. Pri týchto proteínoch je ich expresia možná vďaka prítomnosti ERV v ľudskom genóme. Medzi gény, na ktoré majú LTR promótory len veľmi slabý účinok, patria gény kódujúce apolipoproteín C1, proteín inhibujúci neurálnu apoptózu, semaforín-4D, endoteliálny receptor B a iné [19]. Vzájomné pôsobenie medzi HERV a inými génmi bolo pozorované pri génoch podieľajúcich sa na energetickom metabolizme ako sú transaldoláza, apoC-I lipoproteín, leptínový receptor a samotný leptín a amyláza [20]. Avšak neboli popísané žiadne metabolické ochorenia v dôsledku nefunkčného LTR HERV.
LTR oblasti fungujúce ako enhancery boli popísané v prípade hormónu uvoľňujúceho kortikotropín (CRH). CRH je regulovaný enhancerom pochádzajúcim z ERV [21]. Táto sekvencia sa nachádza 2 kbp upstream od génu kódujúceho CRH. Tento hormón je spojený s kontrolou načasovania pôrodu, čo znamená, že endogénne retrovírusy nepriamo vplývajú nielen na správny vývoj placenty, ale môžu mať vplyv aj na včasné ukončenie tehotenstva [11].
NEGATÍVNY VPLYV ENDOGÉNNYCH RETROVÍRUSOV NA ĽUDSKÝ ORGANIZMUS
Faktory aktivácie ľudských endogénnych retrovírusov Ľudské endogénne retrovírusy (HERV) sú v genóme za normálnych okolností prísne regulované a ich expresia je potlačená. Napriek tomu môžu niektoré vonkajšie alebo vnútorné faktory spôsobiť, že nastane ich aktivácia (obr. 3) [22].
Medzi vonkajšie faktory spúšťajúce nadmernú expresiu HERV patrí ultrafialové a röntgenové žiarenie, fajčenie alebo vírusová infekcia (EBV, HIV), zatiaľ čo k vnútorným faktorom patria hormóny, cytokíny a regulačné proteíny. Neprimeraná expresia HERV môže zapríčiniť vznik a rozvoj rôznych ochorení (neurologické, autoimunitné a nádorové). Vznik nádoru môže byť vplyvom expresie HERV indukovaný procesmi, ako je expresia onkogénov Rec a Np9 pochádzajúcich z HERV, inaktivácia tumor supresorových génov prostredníctvom inzerčnej mutagenézy, homologická rekombinácia a transkripcia onkogénov alebo rastových faktorov v blízkosti ich LTR oblastí [23].
V prípade autoimunitných a neurologických ochorení sa predpokladá, že HERV vytvárajú akési prepojenie medzi genetickými, environmentálnymi a biologickými faktormi vyvolávajúcimi ich vznik [24]. Rozsiahle analýzy odobratých vzoriek a tkanív od pacientov trpiacich týmito ochoreniami potvrdili zvýšené hladiny expresie génov, zvýšený výskyt mRNA transkriptov a prítomnosť proteínov pochádzajúcich z HERV [25, 26].
Onkogenéza
Prítomnosť HERV proteínov bola dokázaná u viacerých typov nádorov (melanómy, lymfómy, nádory prsníka, obličiek, vaječníkov, močového mechúra, prostaty).
Spomedzi jednotlivých skupín HERV je skupina endogénnych retrovírusov HERV-K najmladšou a najaktívnejšou. HERV-K využívajú niekoľko mechanizmov, pomocou ktorých dokážu navodiť onkogenézu (obr. 4) [27].
Obr. 3. Vplyv faktorov na aktiváciu HERV a ich následná činnosť v organizmeFigure 3. Factors involved in HERV activation and their subsequent activity in the body 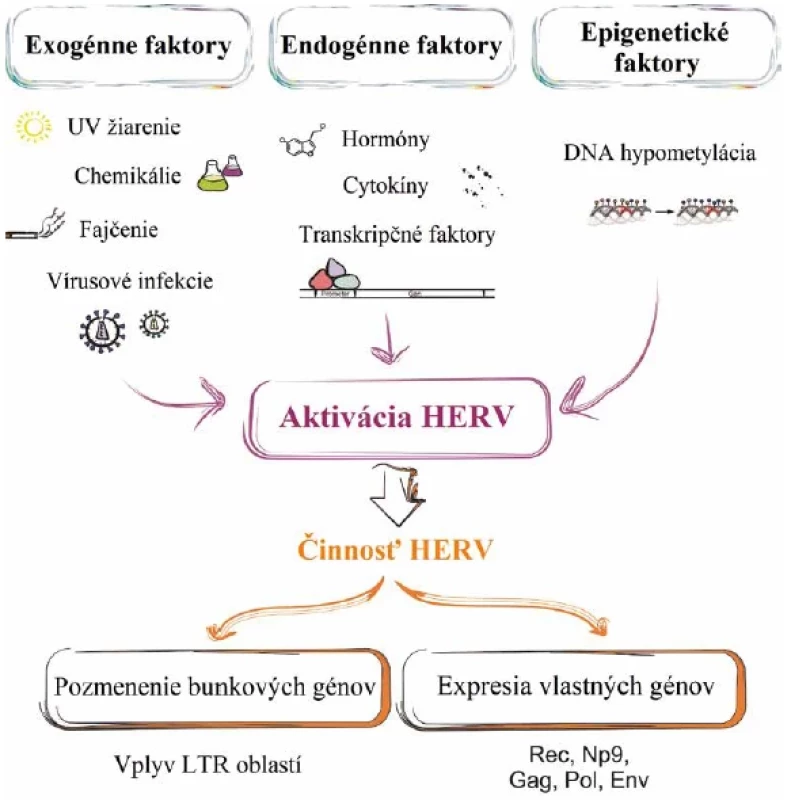
Aktivácia HERV môže byť spôsobená viacerými exogénnymi, endogénnymi a epigenetickými faktormi (Fischer et al., 2016 – upravené)HERV activation can be triggered by the interplay of multiple exogenous, endogenous, and epigenetic factors(Adapted from Fischer et al., 2016) Obr. 4. Rôzne mechanizmy HERV schopné navodiť onkogenézuFigure 4. Different HERV mechanisms capable of inducing oncogenesis 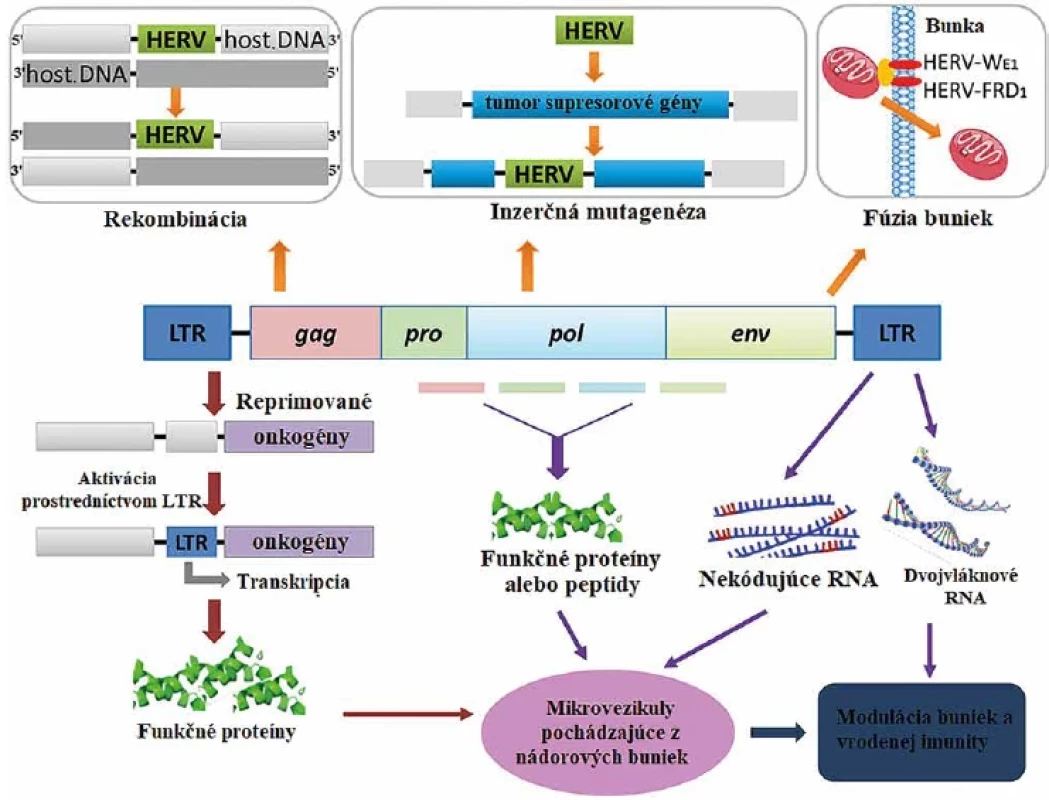
Homologická rekombinácia a inzerčná mutagenéza môžu spôsobiť zmeny v genóme hostiteľa, a ovplyvniť tak expresiu génov. LTR oblasti môžu byť zdrojom nekódujúcich a dvojvláknových RNA a môžu aktivovať niektoré onkogény. HERV môžu prepisovať svoje gény a ich produkty môžu spôsobiť fúziu buniek či vznik vezikúl.(Zhang et al., 2019 – upravené)Homologous recombination and insertional mutagenesis can result in changes to the host genome and thus to the gene expression. LTR regions can be a source of non-coding and double-stranded RNAs and can be involved in the activation of some oncogenes. HERVs can transcribe their genes, and their products can cause cell fusion or vesicle formation. (Adapted from Zhang et al., 2019) Expresia onkogénov Rec a Np9 kódovaných HERV-K
Rec a Np9 sú proteíny kódované env génom HERV-K. Vyskytujú sa v malígnych tkanivách a ich zvýšená expresia sa považuje za jeden z faktorov, ktoré môžu prispievať k onkogenéze [28]. Oba proteíny interagujú s promyelocytickým leukemickým proteínom obsahujúcim zinkový prst (PLZF), ktorý je tumor supresor a transkripčný supresor protoonkogénu c-myc [13, 29]. Za normálnych okolností je aktivita c-myc potlačená, avšak zvýšená expresia proteínov Rec a Np9 vedie k potlačeniu transkripčnej represie génu c-myc 29]. Následne dochádza k nadmernej expresii c-myc proteínov. Celá kaskáda udalostí vedie potom k zmenám v proliferácii buniek a k zníženiu apoptózy [13] .
Fuzogénna aktivita Env proteínov
Schopnosť fúzie buniek je dôležitá pri tvorbe syncytiotrofoblastu, avšak v niektorých prípadoch môže byť nežiadúca. Nekontrolovateľná fúzia buniek môže totiž v ľudskom tele indukovať tumorigenézu [30]. Env gén HERV kóduje dve podjednotky: povrchovú SU a transmembránovú TM. TM podjednotka dokáže inhibovať aktiváciu T-buniek, pričom dochádza k zvýšeniu expresie cytokínov ako sú IL-6, IL-8 a IL-10 [27]. Env proteíny kódované HERV by mohli spustiť fúziu melanómových buniek, a spôsobiť tak vznik syncytií, čo v konečnom dôsledku vedie ku genetickým zmenám (strata heterozygotnosti). To má za následok malígny rast nádorových buniek, progresiu nádoru a odolnosť voči protinádorovej liečbe [31]. U pacientov s melanómami, u ktorých bola dokázaná prítomnosť protilátok proti Env proteínom, táto zvyčajne naznačuje zlú prognózu ich prežitia [32].
Zmeny v génome spôsobené vplyvom HERV
HERV dokážu spôsobovať aj nestabilitu ľudského genómu. Medzi mechanizmy, ktoré využívajú na narušenie stability genómu patrí inzerčná mutagenéza, zmeny v chromozómoch a aktivita ich LTR oblastí ako promótorov či enhancerov. Inzercia provírusu v genóme môže vyvolať aktiváciu onkogénov, alebo prerušiť funkciu tumor supresorových génov [27]. Zmeny v chromozómoch spôsobuje aj nealelická homológna rekombinácia, počas ktorej dochádza v genóme k deléciám, duplikáciám, translokáciám či inverziám. To môže spôsobovať napríklad mužskú neplodnosť, pri ktorej dochádza k intrachromozomálnej rekombinácii medzi dvoma homologickými sekvenciami HERV-I nachádzajúcimi sa na chromozóme Y [6]. LTR oblasti a ich promótorová a enhancerová funkcia môže byť pre organizmus v niektorých prípadoch nevýhodou. LTR oblasti HERV môžu pôsobiť ako promótory alebo enhancery pre protoonkogény, môže dôjsť k ich aktivácii a karcinogenéze [27].
V Hodgkinovom lymfóme bol exprimovaný myeloidne špecifický protoonkogén CSF1R, ktorý bol aktivovaný LTR promótorom [29].
Produkcia RNA transkriptov
Počas evolúcie dochádza u HERV k hromadeniu mutácii a delécii (výsledkom je zastavenie ich transkripcie), alebo k produkcii nekódujúcich RNA transkriptov (ncRNA) [25]. Viacero z nich sa spája so vznikom nádorov. Nekódujúca RNA produkovaná HERV-K11 sa priamo viaže na PSF proteín (proteínový faktor zostrihu) asociovaný s proteínom viažucim polypyrimidínový trakt (PTB). Tento je zodpovedný za represiu transkripcie protoonkogénov. Po naviazaní ncRNA transkriptu na tento proteín dochádza k potlačeniu funkcie PSF ako represoru, čo umožňuje transformáciu buniek a tumorigenézu [29].
Vznik exozómov a mikrovezikúl
Exozómy a mikrovezikuly sú extracelulárne vezikuly obsahujúce rôzne formy RNA (mRNA, miRNA či ncRNA), proteíny, lipidy, nádorové antigény. Ich obsah závisí od kompozície a fyziologického stavu bunky [27, 29]. Niektoré RNA transkripty HERV, ako napríklad HML-2 mRNA sa môžu zabaliť do exozómov odvodených z nádorových buniek a takéto exozómy sa ďalej môžu preniesť do iných buniek, čo môže viesť k šíreniu metastáz. U exozómov pochádzajúcich z nádorových buniek bola dokázaná zvýšená prítomnosť niektorých protoonkogénov, ako napríklad c-myc, ktorý je regulovaný PLZF na ktorý sa viaže Rec a Np9 proteín retrovírusov [27].
Výskyt mikrovezikúl obsahujúcich retrovírusové elementy bol pozorovaný u pacientov s lymfómami, melanómami a teratómami, rovnako ako u pacientov s rakovinou prsníka. S prebiehajúcou liečbou rakoviny došlo k výraznému poklesu mikrovezikúl obsahujúcich retrovírusové elementy, čo znamená, že tieto mikrovezikuly pochádzali z nádorových buniek. Vo všeobecnosti môžu nádorové bunky pomocou mikrovezikúl a exozómov obsahujúcich RNA HERV meniť susedné aj vzdialené bunky, čo môže stimulovať rast nádorov a šírenie metastáz [29].
Hematoonkologické ochorenia – leukémia
Niektoré gény a ich produkty, pochádzajúce z HERV-K boli nájdené aj u pacientov s hematoonkologickými ochoreniami. Spojitosť medzi leukémiou a expresiou HERV bola prvýkrát dokázaná v bunkách pacientov trpiacich lymfoidnou leukémiou, kde bol zaznamenaný zvýšený výskyt RNA pochádzajúcich z HERV a zistená aj protilátková odpoveď voči produktom HERV-K. Špecifický význam sa pri leukémii pripisuje proteínu Np9, u ktorého bolo dokázané, že potlačenie jeho expresie viedlo k spomaleniu rastu myeloidných a lymfoidných leukemických buniek, a naopak, jeho aktivácia ich rast podporovala. Z tohto dôvodu sa môže proteín Np9 považovať za dôležitý regulačný prvok vo viacerých signalizačných dráhach [22].
Autoimunitné ochorenia
Autoimunitné ochorenia sú komplexné ochorenia, ktoré vznikajú ako dôsledok poruchy imunitného systému. Imunitný systém pri tomto type ochorení rozpoznáva vlastné bunky ako cudzie a mieri proti nim imunitnú odpoveď [33]. Takto namierená imunitná odpoveď spôsobuje poškodenie a zničenie vlastných tkanív [25].
Rovnako ako pri štúdiu rakoviny, aj pri autoimunitných ochoreniach sa sledoval výskyt transkriptov HERV alebo antiretrovírusových protilátok v sére u pacientov s autoimunitným ochorením. Keďže HERV sú stálou súčasťou genómu, ich produkty sa považujú za telu vlastné a sú tolerované imunitným systémom [34]. Jeden z najdôležitejších mechanizmov, ktorý uplatňujú HERV pri indukcii autoimunitných ochorení sú molekulárne mimikry. Ide o jav, ktorý je charakteristický tým, že cudzie antigény vstupujúce do ľudského organizmu sa môžu pomocou homologických sekvencii podobať na telu vlastné antigény a spustiť tak krížovú reaktivitu [25]. Imunitná odpoveď namierená proti cudziemu antigénu však pôsobí aj na vlastné bunky, čo môže viesť k narušeniu tolerancie vlastných buniek a prispieť k rozvoju autoimunitných ochorení [35]. Medzi autoimunitné ochorenia, u ktorých bol pozorovaný možný vplyv HERV, patrí skleróza multiplex, reumatoidná artritída, systematický lupus erythematosus, diabetes mellitus typu 1 a amyotrofická laterálna skleróza [36].
Skleróza multiplex (SM) je ochorenie imunitného systému vyznačujúce sa zápalom myelínových obalov, ktoré pokrývajú nervové axóny. Vznik tohto ochorenia môže byť zapríčinený kombináciou viacerých faktorov (vplyv prostredia, epigenetické či genetické faktory). U pacientov so sklerózou multiplex, v porovnaní so zdravými jedincami, bola v mozgu pozorovaná zvýšená expresia env génu skupiny HERV-W [36], nadexpresia Gag proteínov HERV-W v axónoch, podstatne vyšší výskyt epitopov Env HERV-H na B-bunkách a monocytoch a významný nárast RNA HERV-Fc1 [34]. Gén env skupiny HERV-W u pacientov so sklerózou multiplex pôsobí ako superantigén a vyvoláva zápalovú a imunitnú kaskádu [37].
Reumatoidná artritída (RA) je zápalové ochorenie kĺbov postihujúce najmä synoviálne kĺby [31]. Je najvýznamnejším autoimunitným ochorením, u ktorého sa uplatňuje molekulárne mimikry, nakoľko HERV K-10 zdieľa rovnaké aminokyselinové sekvencie s IgG1Fc, ktorý je cieľom pre reumatoidný faktor [35]. Pacienti trpiaci týmto ochorením vykazovali v porovnaní so zdravými pacientami v sére zvýšený výskyt protilátok proti Env proteínu HERV-K. Zároveň bola u týchto pacientov dokázaná zvýšená expresia mRNA HERV-K 10, zvýšená aktivita Gag proteínov HERV-K a výrazne zvýšená protilátková odpoveď proti Gag peptidom HERV-K10 [34].
Systémový lupus erythematosus (SLE) je chronické zápalové autoimunitné ochorenie charakterizované zvýšenou produkciou autoprotilátok a imunokomplexov zameraných na vlastné tkanivá a orgány, čo vedie k ich poškodeniu. Základným diagnostickým vyšetrením je imunologické vyšetrenie protilátok v sére. V prípade pretrvávajúceho ochorenia v ľudskom organizme sú v sére nájdené autoprotilátky voči veľkému množstvu antigénov, ako sú molekuly DNA, históny, jadrové a membránové proteíny, červené krvinky a krvné doštičky [38]. U pacientov boli študované aj viaceré skupiny HERV. V súvislosti s HERV-E skupinou bola dokázaná u pacientov zvýšená expresia mRNA HERV-E v CD4+ T-bunkách [36]. Rovnako bol u nich pozorovaný zvýšený výskyt protilátok proti peptidom env génu HERV-K10. HERV-K10 má integračné miesto v mieste génu pre komplement C2, čo môže teoreticky viesť aj k nesprávnej aktivácii komplementovej dráhy. S týmto ochorením sa často spája HERV označovaný ako HRES-1. Je to transkripčne aktívny HERV, ktorý kóduje jadrový autoantigén p28 a malú GTP-ázu s názvom HRES-1/ Rab4. Sledovaní pacienti mali zvýšený titer autoprotilátok voči proteínu p28 a zároveň bola u nich dokázaná v bunkách CD4+ nadexpresia HRES-1/Rab 4 [38].
Diabetes mellitus typu 1 (DM1) je charakterizovaný ničením vlastných pankreatických β buniek, ktoré sú zodpovedné za produkciu inzulínu, čo vedie v organizme k jeho úplnému nedostatku [34]. Pacienti s cukrovkou vykazovali nadmerné zvýšenú expresiu najmä HERV-W a HERV-K. U pacientov s T1D boli dokázané protilátky proti Env proteínu HERV-W a zároveň bol tento proteín prítomný aj v pankreatických bunkách [39].
Amyotrofická laterálna skleróza (ALS) je neurodegeneratívne ochorenie charakterizované stratou spinálnych a kortikálnych motorických neurónov [36]. Postihnutie motorických neurónov vedie k poruchám pohybového aparátu, atrofii a v konečnom dôsledku až k smrti zapríčinenej zlyhaním dýchania [34]. U odobratých vzoriek mozgu, svalov a séra pacientov boli zistené viaceré skupiny HERV [37]. V sérach pacientov bol zaznamenaný zvýšený výskyt IgG protilátok proti Gag proteínu HERV-K ERV(HML-2) [40]. Zároveň bola dokázaná po smrti pacienta v tkanivách mozgu aj zvýšená úroveň expresie pol génu HERV-K. Vo vzorkách svalov odobratých pomocou biopsie bola zvýšená úroveň expresie gag a env génov HERV-W.
Neustála aktivita HERV-K v CNS môže spustiť vrodenú bunkovú imunitnú odpoveď, zosilňovať zápaly neurónov a v konečnom dôsledku viesť k ich poškodeniu [37].
Neuropsychiatrické ochorenia
Potencionálna úloha HERV bola skúmaná aj v súvislosti s neuropsychiatrickými ochoreniami, ako je schizofrénia, porucha autistického spektra či hyperkinetická porucha.
Schizofrénia je ťažké chronické psychiatrické ochorenie, ktoré sa prejavuje bludmi, halucináciami, afektami a podobne [36]. Rovnako ako ostatné ochorenia, aj schizofrénia vzniká kombináciou faktorov, ako sú genetické faktory, infekcie či neurozápalové a neurovývojové aspekty. Vzájomné prepojenie medzi spomínanými faktormi môže poskytnúť výskum HERV-W, ktoré pri tomto ochorení vykazujú najväčšiu aktivitu.
Z výsledkov viacerých štúdii je jasné, že u pacientov trpiacich schizofréniou bola v rôznych odobratých vzorkách dokázaná prítomnosť niekoľkých HERV transkriptov. Rozdiely v prítomnosti RNA pol génu HERV-W medzi pacientmi so začínajúcou schizofréniou a chronickou schizofréniou naznačujú, že zvýšená transkripčná aktivita HERV-W môže súvisieť s akútnou schizofréniou. Pacienti, u ktorých bola potvrdená prítomnosť gag génu v plazme vykazovali závažnejšie psychotické príznaky, ale expresia Gag proteínu HERV-W, zisťovaná post mortem v mozgu pacientov so schizofréniou v porovnaní so zdravými jedincami, je znížená. Potencionálnym prepojením medzi schizofréniou a HERV môže byť prítomnosť Gag a Env proteínov v sére pacientov, čo je zároveň spojené so zápalovými markermi.
Okrem HERV-W bolo vo vzorkách mozgu, odobratých po smrti pacienta, dokázané aj zvýšené zastúpenie skupiny HERV-K, konkrétne HERV-K10 [26].
Porucha autistického spektra (PAS) (ang. Autism Spectrum Disorder) je neurovývinové ochorenie ovplyvňujúce sociálne interakcie a komunikáciu človeka.
Balestrieri et al. poskytli prvú analýzu zaoberajúcu sa koreláciou medzi HERV a PAS, v ktorej dokazovali prítomnosť mRNA zo 4 skupín HERV (E, H, K a W). Výsledky analýzy dokazujú zvýšený výskyt mRNA HERV-H a HERV-W u pacientov s PAS v porovnaní so zdravými jedincami, výskyt HERV-K bol v oboch skupinách podobný a v prípade HERV-E nebola ich mRNA takmer vôbec prítomná ani u pacientov, ani u zdravých ľudí. Zároveň bolo dokázané, že vyššie hladiny expresie HERV-H boli spájané s nižším vekom pacientov [41].
Hyperkinetická porucha správania (HPS) (ang. Attention Deficit Hyperactive Disorder) je neurovývinová porucha charakterizovaná pretrvávajúcou nepozornosťou, hyperaktivitou a impulzívnosťou, pričom postihuje 3–8 % detí na celom svete [41, 42].
Balestrieri sa s cieľom rozšíriť poznatky o účasti HERV na neuropsychiatrických ochoreniach rozhodol vykonať podobnú analýzu ako u pacientov s PAS, tentokrát s pacientami trpiacimi HPS, a zistiť tak u nich prítomnosť rodín HERV-H, W a K. Z výsledkom analýzy vyplýva, že u pacientov trpiacich týmto ochorením bola zaznamenaná výrazne vyššia expresia HERV-H v porovnaní so zdravými jedincami. U HERV-K a W neboli pozorované žiadne rozdiely v expresii u zdravých ľudí a postihnutých pacientov.
Okrem iného, môžeme na základe poznatku, že HERV sa dokážu integrovať do akéhokoľvek miesta v genóme predpokladať, že integrované HERV v blízkosti génu kódujúceho dopamín, dopamínový receptor či dopamínový transportér, ktoré sú zapojené do patogenézy HPS, môžu ovplyvňovať nástup ochorenia [41].
ZÁVER
Endogénne retrovírusy majú v ľudskom organizme svoj význam. Ich nezastupiteľná úloha pri formovaní placenty dokazuje, že nebyť vírusov, ktoré sa integrovali do genómu cicavcov pred miliónmi rokov, cicavce by neboli schopné rodiť živé mláďatá. Vďaka kontrolovanej aktivite nám endogénne retrovírusy dokážu poskytovať selekčnú výhodu vo forme ochrany pred superinfekciou. Ich LTR oblasti pôsobia ako promótory a enhancery a ovplyvňujú expresiu niektorých užitočných génov.
Ak neberieme do úvahy tvorbu syncytiotrofoblastu, negatívne úlohy endogénnych retrovírusov v ľudskom organizme však prevyšujú tie pozitívne. Ľudské endogénne retrovírusy využívajú rôzne mechanizmy, ktorými môžu prispievať k vzniku alebo progresii viacerých ochorení. Ich gény, proteíny a protilátky voči nim boli dokázané v súvislosti s viacerými typmi nádorov vrátane pacientov s leukémiou, širokým spektrom autoimunitných ochorení, ako sú skleróza multiplex, reumatoidná artritída, systémový lupus erythematosus, diabetes mellitus typu 1 či amyotrofická laterálna skleróza, a aj u pacientov trpiacich neuropsychiatrickými ochoreniami, ako napríklad schizofrénia, porucha autistického spektra a hyperkinetická porucha správania.
V súčasnosti však disponujeme veľmi malým množstvom dôkazov na to, aby sme mohli endogénne retrovírusy považovať za jednoznačný stimul, ktorý vyvolal vznik spomínaných ochorení. S najväčšou pravdepodobnosťou sú len jedným z mnohých faktorov, ktoré prispievajú k vzniku týchto ochorení. V najbližších rokoch bude preto kľúčové získavať o ľudských endogénnych retrovírusoch nové poznatky a odhaliť tak, aký veľký je v skutočnosti ich vplyv v ľudskom organizme. Rovnako dôležité bude aj sledovanie ich úloh v súvislosti s ďalšími ochoreniami, ktoré zatiaľ neboli preskúmané. Na základe získaných informácii môžeme potom modifikovať liečbu takýchto ochorení, ktorá bude namierená proti ľudským endogénnym retrovírusom, sledovať ďalší vývoj ochorenia a prinášať tak nové liečebné postupy a metódy.
Do redakce došlo dne 26. 8. 2022.
Adresa pro korespondenci:
doc. RNDr. Peter Kabát, CSc.
Univerzita Komenského, Prírod. fakulta
Katedra mikrobiológie a virológie
Mlynská dolina Ilkovičova 6
842 15 Bratislava
Slovenská republika
e-mail: peter.kabat@uniba.sk
Zdroje
- Knipe DM, Howley PM, Cohen JI, et al. Fields Virology, 6th Edition. Lippincott Williams & Wilkins a Wolters Kluwer. Philadelphia. 2013. 2582 s. ISBN 978-1-45-110563-6.
- Weiss RA. The discovery of endogenous retroviruses. Retrovirology, 2006;3(67):1–11. doi: 10.1186/1742-4690-3-67.
- Cloyd MW. Human Retroviruses. In: Baron S. Medical Microbiology, 4th edition. University of Texas Medical Branch: Galveston; 1996. ISBN 10 : 0-9631172-1-1, Chapter 62. Dostupné na https://www.ncbi.nlm.nih.gov/books/ NBK7934.
- Fauquet CM, Fargette D. International Committee on Taxonomy of Viruses and the 3,142 unassigned species. Virol J, 2005;2 : 64. doi: 10.1186/1743-422X-2-64. PMID: 16105179; PMCID: PMC1208960.
- Haig D. Retroviruses and the placenta. Curr Biol, 2012;22(15): R609-613. doi: 10.1016/j.cub.2012.06.002. PMID: 22877784.
- Grandi N, Tramontano E. Human Endogenous Retroviruses Are Ancient Acquired Elements Still Shaping Innate Immune Responses. Front Immunol, 2018;9 : 2039. doi: 10.3389/fimmu.2018.02039. PMID: 30250470; PMCID: PMC6139349.
- Hurst TP, Magiorkinis G. Epigenetic Control of Human Endogenous Retrovirus Expression: Focus on Regulation of Long-Terminal Repeats (LTRs). Viruses, 2017;9(6):130. doi: 10.3390/ v9060130.
- Stoye JP. Endogenous retroviruses: still active after all these years? Curr Biol, 2001;11(22):R914–6. doi: 10.1016/s09609822(01)00553-x. PMID: 11719237.
- Johnson WE. Origins and evolutionary consequences of ancient endogenous retroviruses. Nat Rev Microbiol, 2019; 17(6):355–370. doi: 10.1038/s41579-019-0189-2.10.
- Gifford R, Tristem M. The evolution, distribution and diversity of endogenous retroviruses. Virus Genes, 2003;26(3):291–315. doi: 10.1023/a:1024455415443.
- Chuong EB. The placenta goes viral: Retroviruses control gene expression in pregnancy. PLoS Biol. 2018;16(10):e3000028. doi: 10.1371/journal.pbio.3000028.
- Mi S, Lee X, Li X, et al. Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis. Nature, 2000;403(6771):785–789. doi: 10.1038/35001608. PMID: 10693809.
- Kurth R, Bannert N. Beneficial and detrimental effects of human endogenous retroviruses. Int J Cancer, 2010;15;126(2):306–314. doi: 10.1002/ijc.24902. PMID: 19795446.
- Lee X, Keith JC Jr, Stumm N, et al. Downregulation of placental syncytin expression and abnormal protein localization in pre-eclampsia. Placenta, 2001;22(10):808–812. doi: 10.1053/ plac.2001.0722. PMID: 11718567.
- Esnault C, Priet S, Ribet D, et al. A placenta-specific receptor for the fusogenic, endogenous retrovirus-derived, human syncytin-2. Proc Natl Acad Sci U S A, 2008, 11;105(45):17532–17537. doi: 10.1073/pnas.0807413105. Epub 2008 Nov 6. PMID: 18988732; PMCID: PMC2582322.
- Tug E, Yirmibes Karaoguz M, Nas T. Expression of the syncytin-1 and syncytin-2 genes in the trophoblastic tissue of the early pregnancy losses with normal and abnormal karyotypes. Gene, 2020;741 : 144533. doi: 10.1016/j.gene.2020.144533. Epub 2020 Mar 4. PMID: 32145327.
- Gao Y, He Z, Wang Z, et al. Increased expression and altered methylation of HERVWE1 in the human placentas of smaller fetuses from monozygotic, dichorionic, discordant twins. PLoS One, 2012;7(3):e33503. doi: 10.1371/journal. pone.0033503. Epub 2012 Mar 21. PMID: 22457770; PMCID: PMC3310130.
- Srinivasachar Badarinarayan S, Sauter D. Switching Sides: How Endogenous Retroviruses Protect Us from Viral Infections. J Virol, 2021;95(12):e02299–02320. doi: 10.1128/JVI.02299-20. PMID: 33883223; PMCID: PMC8315955.
- Cohen CJ, Lock WM, Mager DL. Endogenous retroviral LTRs as promoters for human genes: a critical assessment. Gene, 2009;448(2):105–114. doi: 10.1016/j.gene.2009.06.020. Epub 2009 Jul 3. PMID: 19577618.
- Blonberg J, Ushameckis D, Jern P. Evolutionary Aspects of Human Endogenous Retroviral Sequences (HERVs) and Disease. In Madame Curie Bioscience Database [Internet]. Landes Bioscience, Austin. 2000–2013. Dostupné na www: https://www.ncbi. nlm.nih.gov/books/NBK6235/.
- Dunn-Fletcher CE, Muglia LM, Pavlicev M, et al. Anthropoid primate-specific retroviral element THE1B controls expression of CRH in placenta and alters gestation length. PLoS Biol, 2018;16(9):e2006337. doi: 10.1371/journal.pbio.2006337. PMID: 30231016; PMCID: PMC6166974.
- Fischer S, Echeverria N, Cristina J, et al. Human Endogenous Retrovirus: Their Relationship with Hematological Diseases. J Leuk, 2016;4 : 217. doi: 10.4172/2329-6917.1000217.
- Gonzalez-Cao M, Iduma P, Karachaliou N, et al. Human endogenous retroviruses and cancer. Cancer Biol Med. 2016 Dec;13(4):483-488. doi: 10.20892/j.issn.2095-3941.2016.0080. PMID: 28154780; PMCID: PMC5250606.
- Balestrieri E, Pitzianti M, Matteucci C, et al. Human endogenous retroviruses and ADHD. World J Biol Psychiatry, 2014;15(6):499–504. doi: 10.3109/15622975.2013.862345. Epub 2013 Nov 28.PMID: 24286278.
- Tugnet N, Rylance P, Roden D, et al. Human Endogenous Retroviruses (HERVs) and Autoimmune Rheumatic Disease: Is There a Link? Open Rheumatol J, 2013;7 : 13–21. doi: 10.2174/1874312901307010013. PMID: 23750183; PMCID: PMC3636489.
- Aftab A, Shah AA, Hashmi AM. Pathophysiological Role of HERV-W in Schizophrenia. J Neuropsychiatry Clin Neurosci, 2016;28(1):17–25. doi: 10.1176/appi.neuropsych.15030059.Epub 2015 Sep 25. PMID: 26404170.
- Salavatiha Z, Soleimani-Jelodar R, Jalilvand S. The role of endogenous retroviruses-K in human cancer. Rev Med Virol, 2020;30(6):1–13. doi: 10.1002/rmv.2142. PMID: 32734655.
- Chan SM, Sapir T, Park SS, Rual JF, Contreras-Galindo R, Reiner O, Markovitz DM. The HERV-K accessory protein Np9 controls viability and migration of teratocarcinoma cells. PLoS One, 2019;14(2):e0212970. doi: 10.1371/journal.pone.0212970. PMID: 30818388; PMCID: PMC6394991.
- Zhang M, Liang JQ, Zheng S. Expressional activation and functional roles of human endogenous retroviruses in cancers. Rev Med Virol, 2019;29(2):e2025. doi: 10.1002/rmv.2025. Epub 2019 Jan 6. PMID: 30614117; PMCID: PMC6590502.
- Bannert N, Hofmann H, Block A, et al. HERVs New Role in Cancer: From Accused Perpetrators to Cheerful Protectors. Front Microbiol, 2018;13;9 : 178. doi: 10.3389/fmicb.2018.00178. PMID: 29487579; PMCID: PMC5816757.
- Gröger V, Cynis H. Human Endogenous Retroviruses and Their Putative Role in the Development of Autoimmune Disorders Such as Multiple Sclerosis. Front Microbiol, 2018 ;9 : 265. doi: 10.3389/fmicb.2018.00265. PMID: 29515547; PMCID: PMC5826199.
- Huang G, Li Z, Wan X, et al. Human endogenous retroviral K element encodes fusogenic activity in melanoma cells. J Carcinog, 2013;12 : 5. doi: 10.4103/1477-3163.109032. PMID: 23599687; PMCID: PMC3622401.
- Lin AT, Magiorkinis G. Role of Endogenous Retroviruses in Human Genetic Diseases. In eLS. John Wiley & Sons, Chichester. 2016. doi:10.1002/9780470015902.a0026711.
- Greenig M. HERVs, immunity, and autoimmunity: understanding the connection. PeerJ. 2019;7:e6711. doi: 10.7717/ peerj.6711. PMID: 30984482; PMCID: PMC6452852.
- Trela M, Nelson PN, Rylance PB. The role of molecular mimicry and other factors in the association of Human Endogenous Retroviruses and autoimmunity. APMIS, 2016;124(1–2):88–104. doi: 10.1111/apm.12487. PMID: 26818264.
- Brütting C, Emmer A, Kornhuber ME, et al. Cooccurrences of Putative Endogenous Retrovirus-Associated Diseases. Biomed Res Int, 2017;2017 : 7973165. doi: 10.1155/2017/7973165. Epub 2017 Feb 23. PMID: 28326328; PMCID: PMC5343228.
- Arru G, Mameli G, Deiana GA, et al. Humoral immunity response to human endogenous retroviruses K/W differentiates between amyotrophic lateral sclerosis and other neurological diseases. European Journal of Neurology, 2018;25(8):1076–1084.
- Nelson P, Rylance P, Roden D, et al. Viruses as potential pathogenic agents in systemic lupus erythematosus. Lupus, 2014;23(6):596–605.
- Levet S, Charvet B, Bertin A, et al. Human Endogenous Retroviruses and Type 1 Diabetes. Curr Diab Rep, 2019;19(12):141. doi: 10.1007/s11892-019-1256-9.
- Hadlock K, Miller RR, JIN X, et al. Elevated rates of antibody reactivity to HML-2/Herv-K but not other endogenous retroviruses in ALS. Neurology, 2004;5(2):63.
- Balestrieri E, Arpino C, Matteucci C, et al. HERVs expression in Autism Spectrum Disorders. PLoS One. 2012;7(11):e48831. doi:10.1371/journal.pone.0048831.
- D΄Agati E, Pitzianti M, Balestrieri E, et al. First evidence of HERV-H transcriptional activity reduction after methylphenidate treatment in a young boy with ADHD. New Microbiol, 2016;39(3):237 – 239.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2023 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Monitoring hladiny protilátok v súvislosti s očkovaním proti SARS-CoV-2 – 11-mesačné sledovanie
- Úloha endogénnych retrovírusov v ľudskom organizme
- Mykobakteriózy – nejčastější původci
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Lidská babesióza
- Detekce superantigenů u izolátů Streptococcus pyogenes na základě dat celogenomové sekvenace
- Prevalencia meticilín-rezistentného Staphylococcus aureus medzi obyvateľmi domovov dôchodcov na Slovensku
- Vzpomínka na RNDr. Václava Rupeše, CSc.
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mykobakteriózy – nejčastější původci
- Lidská babesióza
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



