-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Monogénová obezita u detí na Slovensku
Monogenic obesity in children in Slovakia
Background:
Monogenic obesity is caused by a mutation in on of the genes regulating leptin-melanocortin pathway, which is playing a key role by maintaining energetic homeostasis of organism, mainly inducing a feeling of satiety.Aim:
The aim of this work is to conclude results of DNA analysis of monogenic obesity in laboratorium DIABGENE in years 2009–2015. This work is focused on etiology and epidemiology of the most frequent types of monogenic obesity in children.Patients and methods:
DNA analysis of varios genes was performed together in 565 patients with a clinical suspicion of monogenic obesity to date. The suggested most frequent type of monogenic obesity (due to a mutation in melanocortin receptor 4 gene – MC4R) was analysed in 268 patients with obesity onset up to 11. years, without other specific clinical signs. In patients with more specific clinical signs (endocrinopathies, infections, decreased growth, red hair, hypocorticism and other) was performed DNA analysis of other genes (SIM1, LEP, LEPR, POMC) causing monogenic obesity.Results:
We have found 2 probands (0.7%) with a MC4R mutation in our study. One mutation was found in SIM1 gene and no mutations in LEP, LEPR and POMC gene to date, reffering Slovakia to European countries with probably the lowest prevalence of monogenic obesity.Conclusion:
Monogenic obesity is a rare cause of childhood obesity in Slovakia, however searching and diagnosing of these patients is very important, because of the need of specific management as well as real possibility of causal treatment today or in the future.Key words:
monogenic obesity, MC4R, children, Slovak republik
Autoři: D. Staníková 1,2; M. Sůrová 1; Ľ. Tichá 2; D. Lobotková 2; D. Gabčová 1; M. Škopková 1; I. Klimeš 1; J. Staník 1,2; D. Gašperíková 1
Působiště autorů: DIABGENE a Laboratórium diabetu a porúch metabolizmu, Ústav experimentálnej endokrinológie Biomedicínske centrum SAV, Bratislava 1; Detská klinika LFUK a DFNsP, Bratislava 2
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (5): 293-300.
Kategorie: Původní práce
Souhrn
Úvod:
Monogénová obezita je podmienená mutáciou v jednom z génov zúčastňujúcich sa regulácie leptín-melanokortínovej osi, ktorá hrá dôležitú úlohu v udržiavaní energetickej homeostázy organizmu, najmä v navodzovaní pocitu sýtosti.Cieľ:
Cieľom práce je zhrnutie výsledkov DNA analýzy monogénovej obezity u detí od roku 2009 do roku 2015 v laboratóriu DIABGENE. Práca je zameraná najmä na etiológiu a epidemiológiu najčastejších foriem monogénovej obezity u detí na Slovensku.Pacienti a metódy:
DNA analýza rôznych génov bola vykonaná doteraz u 565 pacientov s klinickým podozrením na monogénovú obezitu. Podľa literatúry najčastejšie sa vyskytujúci typ monogénovej obezity (v dôsledku mutácií v géne pre melanokortínový receptor 4 – MC4R) bol analyzovaný u 268 detských pacientov so vznikom obezity do 11. roku života, bez špecifickejších klinických príznakov. U pacientov so špecifickejšími príznakmi (endokrinopatie, častý výskyt infekcií, znížený vzrast, ryšavé vlasy, hypokorticizmus a iné) bola vykonaná analýza ďalších génov (SIM1, LEP, LEPR, POMC) spôsobujúcich iné typy monogénovej obezity.Výsledky:
V našej štúdii sme našli 2 probandky (0,7 %) s mutáciou v MC4R. Doteraz sme našli jednu mutáciu v SIM1 géne, žiadne sme nenašli v génoch pre LEP, LEPR alebo POMC, čo radí Slovensko medzi krajiny Európy s pravdepodobne najnižším výskytom monogénovej obezity.Záver:
Monogénová obezita je zriedkavou príčinou obezity na Slovensku, napriek tomu je vyhľadávanie a diagnostika týchto pacientov dôležité, pretože vyžadujú špecifický manažment ako aj reálnu možnosť kauzálnej liečby v súčasnosti alebo v budúcnosti.KĽÚČOVÉ SLOVÁ:
monogénová obezita, MC4R, deti, Slovenská republikaÚVOD
Obezita u detí predstavuje jeden zo závažných a veľmi častých medicínskych problémov. Podľa štatistických údajov, prevalencia obezity v detskom veku sa za posledných 30 rokov viac ako zdvojnásobila, pričom u adolescentov je až štvornásobne vyššia. V USA percento obéznych detí (6–9-ročných) vzrástlo od roku 1980 zo 7 % na 18 % v roku 2012, u adolescentov (12–19 rokov) stúplo toto percento z 5 % na 21 %. V roku 2012 mala viac ako jedna tretina detí a adolescentov nadhmotnosť alebo boli obézni [1]. Situácia bohužiaľ nie je omnoho priaznivejšia ani v Európe; prevalencia nadhmotnosti sa pohybuje okolo 12 % a obezity 7 % [2]. Na Slovensku sa odhaduje, že nadhmotnosť má 15 % detí, kritériá obezity spĺňa približne 10 % detí a adolescentov [3].
Obezita je spájaná s viacerými krátko - aj dlhodobými vplyvmi na zdravie a kvalitu života. Sú to najmä zvýšené riziko kardiovaskulárnych, metabolických, kostných, onkologických a autoimunitných ochorení, spánkového apnoe a v neposlednom rade aj psychických dôsledkov. Deti a adolescenti, ktorí sú obézni, majú niekoľkonásobne vyššiu pravdepodobnosť stať sa obéznymi dospelými [4].
Nárast výskytu obezity je všeobecne spájaný najmä s environmentálnymi a behaviorálnymi faktormi (sedavý spôsob života, zvýšená, ako aj rýchla konzumácia vysokoenergetických potravín atď.). V posledných 3–4 dekádach sa však jednoznačne ukazuje, že telesný tuk a telesná hmotnosť, a teda aj „náchylnosť“ k vzniku obezity, sú vo veľkej miere podmienené najmä genetickou výbavou jedinca [5]. Tieto tvrdenia jednoznačne podporilo niekoľko významných štúdií monozygotných dvojčiat a štúdie adoptovaných detí, ktoré preukázali vyššiu koreláciu BMI s biologickými než s adoptívnymi rodičmi – čiže vyššiu koreláciu s genetickými než s environmentálnymi faktormi [6–7]. Udáva sa, že genetické faktory zodpovedajú až za 64–84 % výslednej hodnoty BMI [8–10]. To viedlo k pátraniu po génoch či génových variantoch, ktoré determinujú vznik alebo zvýšené riziko vzniku obezity.
Celogenómové asociačné štúdie (Genome Wide Association Studies - GWAS) doteraz identifikovali množstvo génov, ktoré sa (priamo alebo nepriamo) zúčastňujú na regulácii telesnej hmotnosti. Kombinácia týchto variantov (ktorých jednotlivý výsledný efekt na hmotnosť je malý) a obezitogénneho prostredia vedie ku vzniku tzv. polygénovej („bežnej“) obezity. Najznámejšie a zároveň v kaukazoidnej populácii najčastejšie sú varianty FTO („fatt mass and obesity associated“) génu. Kompletný deficit FTO génu u ľudí je asociovaný s autozomálne recesívnym syndrómom, ktorý zahŕňa mentálnu retardáciu, viaceré malformácie a predčasnú smrť, čo potvrdzuje dôležitú úlohu FTO v rozvoji centrálneho nervového a kardiovaskulárneho systému [11]. Strata jednej funkčnej kópie sa nespája s určitým špecifickým fenotypom, pretože heterozygotné mutácie vedúce k strate funkcie („loss of function“) sa identifikovali u obéznych, ale aj u štíhlych jedincov. Predpokladá sa, že intrónové varianty FTO génu zvyšujú riziko vzniku obezity prostredníctvom modulácie expresie tohto génu. FTO je asociovaný aj s inzulínovou rezistenciou (a diabetom 2. typu), lipidmi a hodnotami krvného tlaku. Varianty FTO génu vedú k zvýšenému celkovému príjmu potravy, ako aj k vyššiemu príjmu tukovej potravy a zníženému pocitu sýtosti. Treba však povedať, že FTO variant prispieva veľmi mierne k výslednému fenotypu obezity, pretože dospelí homozygoti majú v priemere zvýšenú hmotnosť o 2–3 kg oproti jedincom bez rizikových variantov v FTO géne [12].
Veľmi podstatným míľnikom (od roku 1994) sa stala identifikácia génov leptín-melanokortínovej osi, ktorá je kľúčová v regulácii energetickej rovnováhy organizmu (najmä príjmu potravy a navodzovania pocitu sýtosti) a ich zmeny vedú ku vzniku tzv. monogénovej obezity. Podľa miesta mutácie môžeme rozdeliť monogénovú obezitu na obezitu spôsobenú mutáciou génu pre leptín (LEP), leptínový receptor (LEPR), proopiomelanokortín (POMC), pro-hormón konvertázu 1 (PCSK1), melanokortínový receptor 4 (MC4R), transkripčný faktor single-minded 1 (SIM1), hypotalamický neurotropný faktor (BDNF) a jeho tyrozín kinázový receptor B (TRKB) [13–14]. Vzhľadom na fakt, že leptín-melanokortínová os hrá kľúčovú úlohu v navodzovaní pocitu sýtosti, monogénovú obezitu typicky charakterizuje závažná hyperfágia už v prvých mesiacoch/rokoch života s následným skorým začiatkom obezity – zväčša do 10.–11. roku života. Opisuje sa možná asociácia s poruchami správania sa a endokrinnými poruchami [15], typicky však u týchto detí (na rozdiel od syndrómových obezít) nie je prítomná mentálna retardácia, dysmorfické črty alebo orgánové abnormality. Každý typ monogénovej obezity sa môže ešte spájať so špecifickými príznakmi, ktoré môžu byť vyjadrené v rôznej miere, v závislosti od toho, či ide o homozygotnú alebo heterozygotnú mutáciu a podľa typu mutácie. Podľa odhadov monogénová obezita tvorí priemerne 3–4 % všetkých pacientov s obezitou [15–16].
Mutácie v géne pre leptín (LEP, prejavujúce sa leptínovou deficienciou) sú laboratórne spojené s nedetekovateľnou koncentráciou leptínu a klinicky sú charakterizované závažnou hyperfágiou (3–5x vyšším príjmom jedla ako u jedincov bez mutácie), ktorá vedie už v prvých mesiacoch života k rozvoju ťažkej až morbídnej obezity (priemerné SDS: 5,8–7,8), hyperinzulinémiou, častými infekciami (v dôsledku poruchy a zníženého počtu T-lymfocytov), hypotalamickým hypotyreoidizmom a chýbajúcim alebo oneskoreným nástupom puberty (keďže leptín hrá dôležitú úlohu v jej inicializácii) [17]. V literatúre bolo do súčasnosti opísaných menej ako 20 jedincov na svete s týmto typom a išlo zväčša o potomkov z konsangvinných partnerstiev. Nedávno sa u dvoch rodín [18–19] identifikovali mutácie v leptínovom géne, ktoré spôsobujú produkciu biologicky inaktívneho leptínu a majú identické klinické prejavy ako pri deficite leptínu [18]. V oboch prípadoch (leptínový deficit, biologicky inaktívny leptín) je možná kauzálna liečba rekombinantným ľudským leptínom, ktorý okrem zníženia hmotnosti navodzuje aj primeraný nástup puberty a upravuje imunologické a endokrinologické funkcie.
Veľmi podobný klinický obraz majú mutácie v géne pre leptínový receptor (LEPR), najmä veľmi rýchly nárast hmotnosti v prvých mesiacoch života v dôsledku intenzívnej hyperfágie, hypogonadotropný hypogonadizmus, insuficientná sekrécia rastového a tyreotropného hormónu. Na rozdiel od pacientov s mutáciou v géne pre leptín, laboratórne majú nosiči týchto mutácií extrémne zvýšené hodnoty cirkulujúceho leptínu. Problémom zostáva ich odlíšenie od pacientov s polygénovou (bežnou) obezitou, kde sú takisto hladiny leptínu, najmä u pacientov s ťažkou a morbídnou obezitou, vysoké. Liečba u pacientov s mutáciou génu pre leptínový receptor spočíva v prevencii vzniku morbídnej obezity, diétnom manažmente a korekcii endokrinopatií. Podávanie leptínu je vzhľadom na poškodenie receptoru neúčinné [20]. Podľa niektorých štúdií je predpoklad, že zastúpenie tohto typu monogénovej obezity môže byť 2–3 % medzi obéznymi pacientmi [21].
Mutácie v géne pre proopiomelanokrotín (POMC) a prohormón konvertázu 1 (PCSK1), mozgový neurotropný faktor (BDNF) a tyrozínkinázu B (TRKB) sú vzácne, opísané iba u niekoľkých jedincov na svete. Pre POMC je charakteristická hypokortizolémia, ryšavé vlasy a bledá pokožka, pri mutáciách PCSK1 génu sa objavuje okrem hypokortizolémie aj refraktérna diarrhea. V súčasnosti sa nosiči POMC mutácií dostali opäť do väčšej pozornosti, nakoľko u dvoch z nich sa úspešne odskúšala liečba agonistami MC4R [22]. Pacienti s mutáciou v BDNF/TRKB mávajú retardáciu psychomotorického vývoja, poruchu krátkodobej pamäte poruchy správania, emočnú labilitu a porušené vnímanie bolesti [23].
Najčastejšie sa vyskytujúcou formou monogénovej obezity sú mutácie v géne pre melanokortínový receptor 4 (MC4R), s varírujúcou prevalenciou medzi jednotlivými krajinami, doteraz najvyššou prevalenciou v Anglicku a Francúzku – 6 % medzi obéznymi deťmi [24]. V Českej populácii sa zistila prevalencia 2,4 % [25]. V zásade sú títo pacienti klinicky neodlíšiteľní od pacientov bez mutácie (s bežným typom obezity), typicky však jedinci s danou mutáciou majú akcelerovaný vzrast v detstve (zvyčajne nad 97. percentil), so zvyšovaním tukovej aj netukovej hmoty, rôznym stupňom obezity, zvýšenou denzitou kostí a závažnou hyperinzulinémiou [24]. Zaujímavé je, že mutácia v tomto receptore pôsobí aj ako ochranný faktor a pacienti typicky nemávajú hypertenziu [26]. V súčasnosti sa veľké terapeutické nádeje vkladajú do vysokoselektívnych MC4R agonistov (Ipsen 17), ktoré slúžia ako farmakologické „chaperony“ ľudského MC4R a zvyšujú expresiu MC4R na povrchu buniek a ich signálnu kapacitu voči α-MSH molekulám. Znamená to, že existuje reálna šanca liečby týchto pacientov v blízkej budúcnosti [27]. Do úvahy v súčasnosti pripadajú aj selektívne inhibítory spätného vychytávania serotonínu a noradrenalínu (SNRI), pri morbídnej obezite sa zvažuje aj bariatrická chirurgia; ako efektívny sa ukázal najmä gastrický bypass [28].
Mutácie génu SIM1 sa vyskytujú približne u 1 % detí so včasným začiatkom obezity a cca u 10 % pacientov s fenotypom podobným Praderovmu-Williho syndrómu [29]. V prvej skupine sa nosiči mutácií klinicky nelíšia od nosičov MC4R mutácií, nemajú však zvýšený vzrast. V druhej skupine ide o pacientov, s niektorými črtami Praderovho-Williho syndrómu,najmä s dysmorfnými črtami a mentálnou retardáciou.U týchto pacientov nie je opísaná hypotónia a neprospievanie v prvom roku života. Pacienti obidvoch skupín majú poruchy učenia, správania sa, prípadne mentálny deficit [30]. Liečba, tak ako aj u ďalších typov monogénovej obezity (okrem deficitu leptínu), spočíva vo včasnej diagnostike, agresívnych režimových a diétnych opatreniach (berúc do úvahy vek, pohlavie a vývojovú fázu pacienta), aby sa predišlo vzniku ťažkej až morbídnej obezity. Prehľad génov spôsobujúcich monogénovú obezitu ako aj špecifické znaky jednotlivých typov uvádza tabuľka 1 (upravené podľa [31]).
Tab. 1. Prehľad génov spôsobujúcich monogénovú obezitu ako aj špecifické znaky jednotlivých typov (upravené podľa Huvenne 2014). 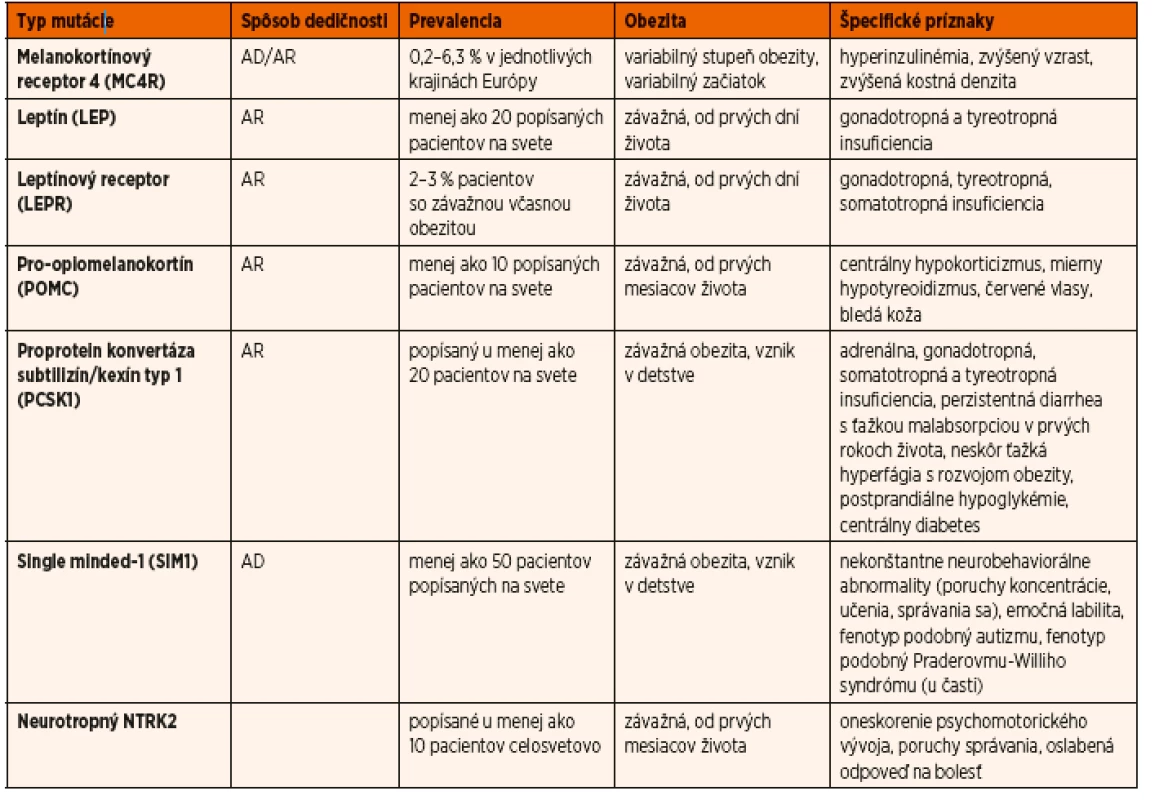
VÝSKUM MONOGÉNOVEJ OBEZITY V LABORATÓRIU DIABGENE
Vyhľadávanie pacientov prebieha v spolupráci s detskými endokrinológmi v rámci celého územia Slovenskej republiky. Kritériom pre výber pacientov je obezita (BMI >97. percentil pre daný vek a pohlavie) vzniknutá do 11. roku života. Vylučovacím kritériom pre vyšetrenie monogénovej obezity je podozrenie na sekundárne podmienenú alebo syndrómovú obezitu (okrem pacientov s fenotypom podobným Praderovmu-Williho syndrómu, kde tento syndróm nebol potvrdený – tu je indikovaná analýza SIM1 génu). Pacienti s klinickým podozrením na určitý typ syndrómovej obezity sú zaradení do jednotlivých analýz.
Ošetrujúci lekár odoberie od pacienta podrobnú osobnú a genealogickú anamnézu a výsledky antropometrických, biochemických a hormonálnych parametrov zapíše do nami vytvoreného dotazníka pre vyšetrenie monogénovej obezity (http://www.diabgene.sk/). Predpokladom genetického vyšetrenia je podpísaný informovaný súhlas zákonným zástupcom dieťaťa. Dotazník, informovaný súhlas a vzorka krvi na DNA analýzu sa odosielajú do laboratória DIABGENE.
DNA ANALÝZA OD ROKU 2009 DO SÚČASNOSTI
V priebehu rokov 2009–2016 boli do laboratória DIABGENE zaslané vzorky od celkového počtu 565 pacientov s podozrením na monogénovú obezitu.
DNA analýza bola indikovaná u detských pacientov, ktorí spĺňali vyššie uvedené inklúzne kritériá. Gén, ktorý sa analyzoval (prípadne poradie génov), sa určil podľa pravdepodobnosti nálezu mutácie a klinického priebehu. Gén MC4R (kde sa najčastejšie vyskytujú mutácie) sa analyzoval u detí pri obezite vzniknutej do 11. roku života; gény LEP a LEPR sa analyzovali u probandov so začiatkom obezity do 5. roku života, častými (najmä respiračnými) infekciami, okrem toho LEPR gén sa analyzoval u detí so zníženým rastom. Indikáciou na analýzu POMC bola obezita do 11. roku života, hypokorticizmus alebo fenotyp bledej pokožky a ryšavých vlasov. Analýza génu SIM1 sa vykonala u pacientov so vznikom obezity do 5. roku života, pričom prítomné mohli/nemuseli byť aj niektoré z nasledujúcich znakov: oneskorenie psychomotorického vývoja, mentálna retardácia alebo poruchy učenia a/alebo správania, dysmorfické črty v zmysle Praderovho-Williho syndrómu (Praderovho-Williho-like syndrómu).
Identifikácia mutácií sa vykonala technikou priameho sekvenovania podľa Sangera. Identifikované mutácie sa overovali v mutačnej databáze (The Human Gene Mutation Database, 1000 Genomes) a publikovaných prácach. V prípade novej mutácie sa jej funkčnosť overila v in silico analýzach (SIFT, PolyPHEN-2, Mutation Taster, Provean, MutationAssesor a Pmut). Výsledky DNA analýzy sa zaslali vo forme štandardizovaného tlačiva ošetrujúcemu lekárovi, ktorý ho interpretoval pacientovi. Pri náleze mutácie v cieľovom géne sa rovnaká analýza vykonala aj u rodičov, súrodencov a ďalších dostupných príbuzných probanda.
VÝSLEDKY A DISKUSIA
Mutácie MC4R génu
Mutácie MC4R sa uvádzajú ako najčastejšie sa vyskytujúci typ monogénovej obezity s variabilnou prevalenciou v rôznych krajinách (až do 6,3 %).
V roku 2015 sme publikovali štúdiu skúmajúcu prevalenciu týchto mutácií u obéznych detí v Slovenskej republike [32]. Do štúdie bolo zahrnutých 268 detí a adolescentov zo Slovenska vo veku od 2 do 18 rokov s BMI nad 97. percentilom pre daný vek a pohlavie a začiatkom obezity do 11. roku života. Kontrolnú skupinu tvorilo 45 nepríbuzných dospelých pacientov zo Slovenskej republiky s BMI <25 kg/m2. Spomedzi 268 obéznych detí sa identifikovali dve (0,7 %) rôzne, v minulosti opísané, heterozygotné mutácie génu MC4R: c.55delA (p.Ser19Alafs*34) a c.380C>T (p.Ser127Leu) [25]. Rovnaká mutácia sa našla aj u obézneho (BMI 34,5 kg/m2) otca probandky s mutáciou p.Ser19Alafs*34 a u štíhlej (BMI 24,2 kg/m2) matky nosičky mutácie p.Ser127Leu (obr. 1), obe rovnako v heterozygotnom stave. U ďalších 10 probandov sa našli dva známe polymorfizmy v heterozygotnom stave: c.307G>A (p.Val103Ile) sa dokázal u 8 probandov a c.751A>C (p.Ile251Leu) u 2 probandov.
Obr. 1. Rodokmene rodín s MC4R mutáciami. 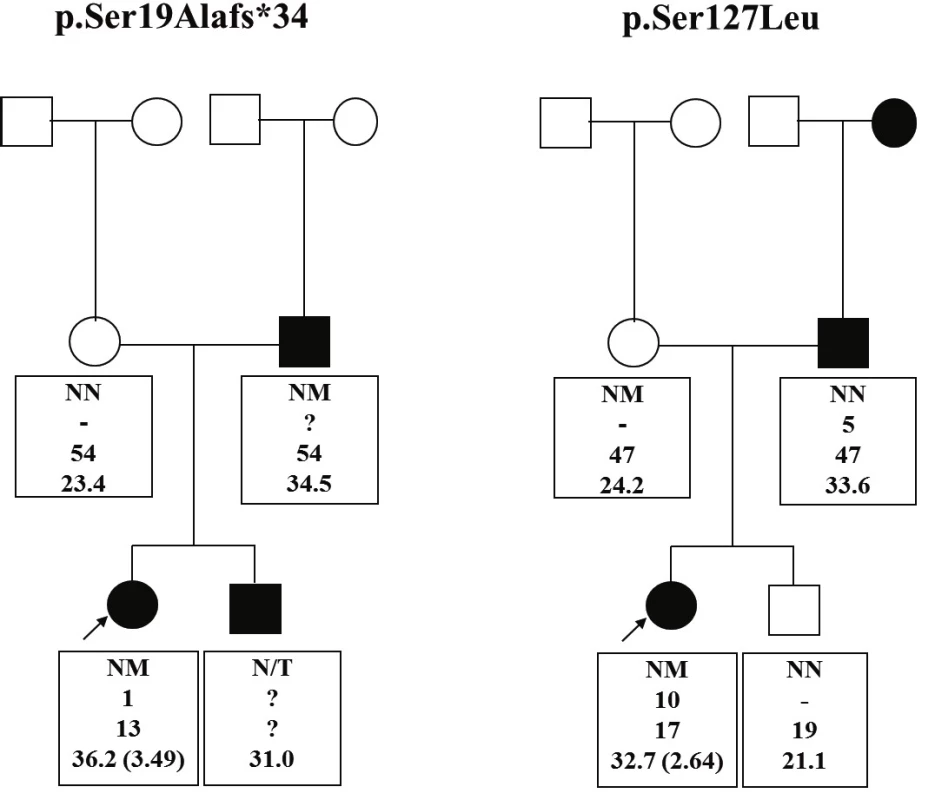
Štvorec reprezentuje mužské pohlavie, kruh ženské. Biele symboly reprezentujú neobéznych, čierne obéznych jedincov. Probandi sú vyznačení šípkami. Text pod každým jedincom uvádza: prítomnosť mutácie (NM – MC4R mutácia prítomná; NN – wild type/neprítomná, N/T – netestované, informácie nedostupné); vek začiatku obezity v rokoch (? – neznámy), súčasný vek v rokoch; BMI (v zátvorkách BMI Z-skóre). V kontrolnej skupine štíhlych probandov sa nezistila žiadna MC4R mutácia, našli sa tu len dva v minulosti už opísané MC4R polymorfizmy (c.307G>A (p.Val103Ile) a c.335C>T (p.Thr112Met)) v heterozygotnom stave, každá u jedného probanda. Efekt polymorfizmu p.Val103Ile nájdený v skupine obéznych ale aj štíhlych probandov je (rovnako ako aj polymorfizmus p.Ile251Leu) podľa veľkých populačných štúdií popisovaný ako protektívny (negatívne asociovaný s BMI) [33–34]. V našom súbore pre malý súbor identifikovaných pacientov nie je možné vyvodiť asociáciu s BMI.
Nosička nonsense mutácie c.55delA (p.Ser19Alafs*34) mala závažnejší fenotyp so skorším začiatkom obezity v porovnaní s probandkou s mutáciou p.Ser127Leu (BMI Z-skóre 3,49 vs. 2,64, a 1 vs. 10 rokov pri začiatku obezity, stupeň hyperinzulinizmu a prítomnosť komplikácií), čo koreluje s ďalšími publikovanými prácami. V tabuľke 2 a na obrázku 1 sa uvádza podrobná fenotypová charakteristika dvoch nosičiek MC4R mutácií z tejto štúdie – jednu s nonsense a jednu s missense mutáciou, kde jasne vidieť závažnejší vplyv nonsense mutácie na fenotyp, ako aj rozdielnu kosegregáciu v rodinách probandiek.
Tab. 2. Genetické, klinické a biochemické charakteristiky probandov s MC4R mutáciami. 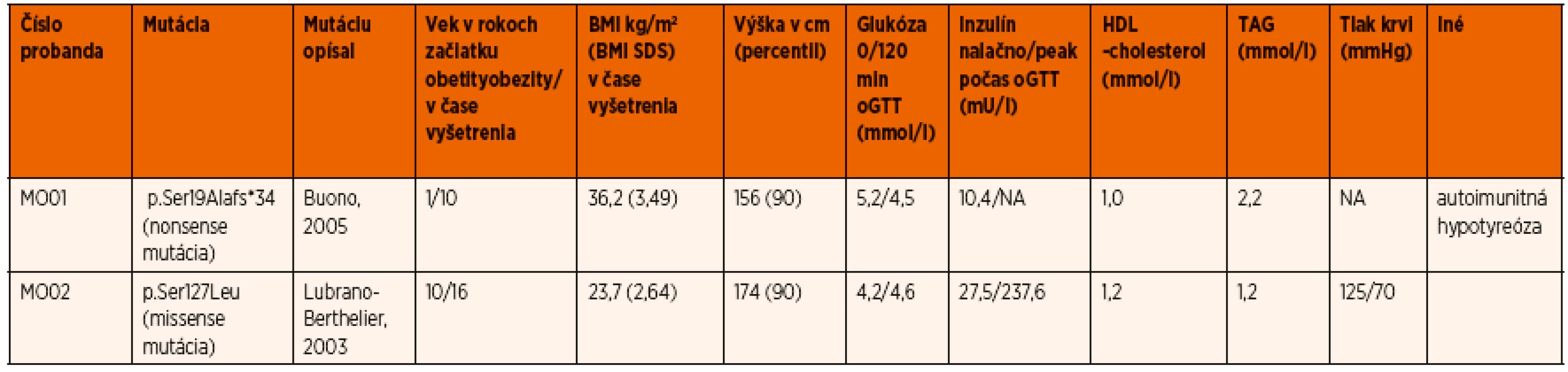
(NA = neanalyzované) Podobnú štúdiu mapujúcu prevalenciu týchto mutácií u slovenských detí publikoval o niečo neskôr Polák a spol. [35], kde v súbore 210 obéznych detí a adolescentov boli identifikované 4 rôzne mutácie (1,9 %) u štyroch pacientov (tri známe mutácie: p.Arg7Cys, p.Ser127Leu, p.Arg305Trp a jedna nová p.Trp174*).
Pokiaľ zoberieme do úvahy výsledky oboch štúdií, odhadovaná prevalencia monogénovej obezity spôsobenej mutáciou MC4R v Slovenskej republike je 1,25 %.
V porovnaní s ostatnými štúdiami z Európy (tab. 3) je prevalencia MC4R mutácií u detí na Slovensku jedna z najnižších v Európe (napr. v Českej republike 2,4 % [25], najvyššia publikovaná prevalencia je v Anglicku (5,8 %) a Francúzsku (6,3 %). Dôvodov, ktoré môžu ovplyvňovať prevalenciu mutácií MC4R, môže byť viacero: jednak to je počet a vek pacientov zahrnutých do štúdie, ďalej vek začiatku obezity. Príkladom môžu byť dve štúdie z Talianska [36], kde sa zistila vyššia MC4R prevalencia u detí so skorším začiatkom (1,6 % u detí so začiatkom obezity vo veku 2,8 ± 2,0 rokov vs. 0,5 % u detí so začiatkom obezity vo veku 4,5 ± 2,6 rokov). Nepochybne dôležitým faktorom v ovplyvňovaní záchytu mutácií je aj stupeň závažnosti obezity (čo dokazujú dve štúdie, s vyššou prevalenciou ako 5 % zahrňujúce iba pacientov so závažnou obezitou) [24, 37], efekt zakladateľa (aj keď zdá sa, že má iba malý vplyv na prevalenciu MC4R mutácií, pretože len málo štúdií (napr. [38]) publikovalo viac ako 2 probandov s tou istou mutázou), prevalencia obezity v danej krajine a penetrancia MC4R mutácií.
Tab. 3. Štúdie zamerané na <i>MC4R</i> mutácie u detí v krajinách Európy. 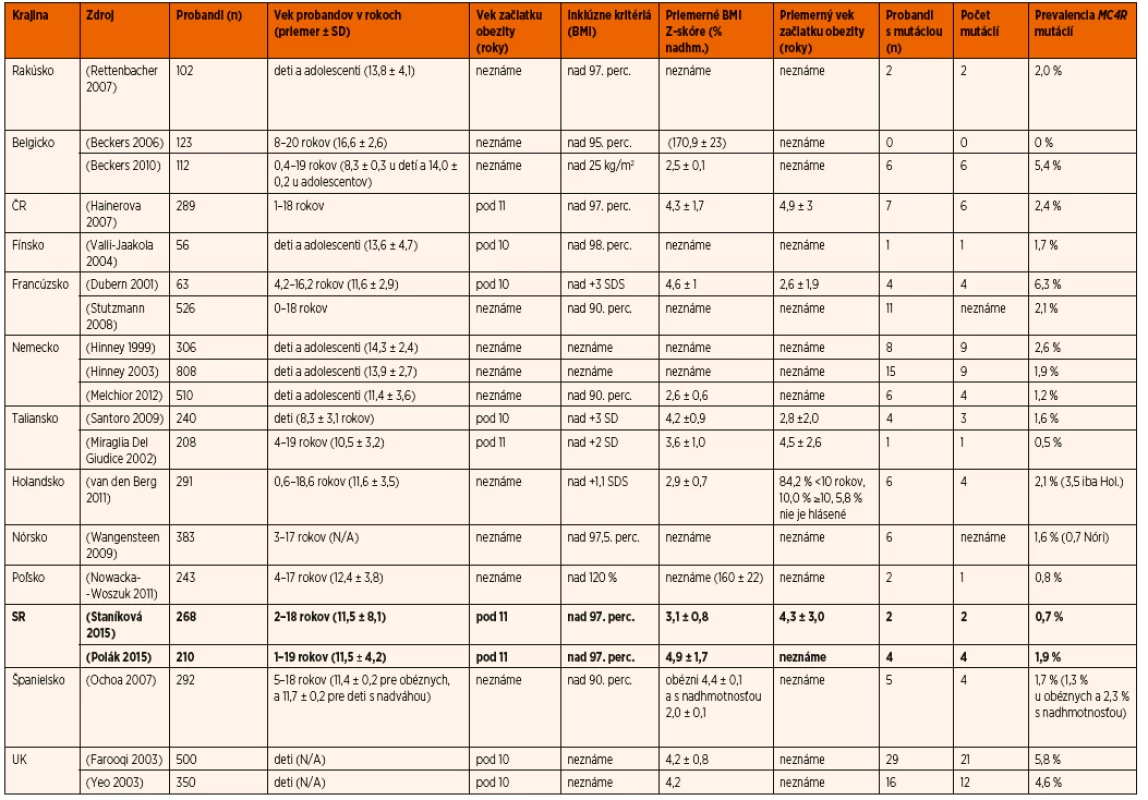
Či súčasný životný štýl (obezitogénnejšie prostredie oproti minulosti) má vplyv na fenotyp nosičov mutácií a či zvyšuje penetranciu mutácií, sme skúmali v našej ďalšej práci [39]. DNA analýzu MC4R génu sme vykonali u 268 nepríbuzných slovenských a moravských obéznych detí a adolescentov (0–18 rokov) so vznikom obezity do 5. roku života, priemerným BMI SDS 3,1 ± 0,8 SD a priemerným vekom vzniku obezity 4,2 ± 2,6 rokov. Kontrolnú skupinu tvorilo 175 obéznych dospelých probandov (19–73 rokov) a 28 dospelých rodinných príslušníkov s nadváhou alebo obezitou. Priemerné BMI v tejto skupine bolo 42,0 ± 7,8 kg/m2 a priemerný vek vzniku obezity bol 14,2 ± 12,6 rokov. V skupine obéznych detí a adolescentov sa identifikovali 3 rôzne heterozygotné „loss of function“ MC4R mutácie (p.Ser19Alafs*34, p.Ser127Leu a p.Gly181Asp) u troch obéznych detských probandov, troch obéznych dospelých probandov a u 6 dospelých rodinných príslušníkov s nadváhou alebo obezitou. U všetkých nosičov mutácií v skupine detí vznikla obezita už v prvom roku života, kým u dospelých nosičov mutácií sa rozvoj obezity pohyboval od 1–35 rokov (medián 11 rokov). Vek začiatku obezity signifikantne koreloval (R = 0,809, p = 0,028) s aktuálnym vekom všetkých nosičov MC4R mutácií. Znamená to, že vek vzniku obezity v súčasnej generácii detí s MC4R mutáciami klesá. Obezita u nosičov MC4R mutácií v dnešnej generácii detí vzniká v nižšom veku, ako to bolo v generácii ich rodičov, čo zodpovedá stúpajúcej celkovej prevalencii obezity v dôsledku obezitogénnejšieho prostredia oproti minulosti.
Mutácie v génoch LEP, LEPR, POMC a SIM1
Gény LEP (22 detí) a LEPR (12 detí) sme analyzovali u probandov so začiatkom obezity do 5. roku života a častými (najmä respiračnými) infekciami. Indikáciou na analýzu POMC (3 pacienti) bola obezita vzniknutá do 11. roku života, hypokorticizmus alebo fenotyp bledej pokožky a ryšavých vlasov. Do súčasnosti sme nenašli žiadneho pacienta s mutáciou v génoch pre LEP, LEPR alebo POMC, čo zodpovedá veľmi nízkej prevalencii týchto mutácií vo väčšine európskych krajín. V zahraničných štúdiách boli opísané mutácie v týchto génoch najmä v konsagvinných rodinách [21]. Naše dáta sú však pre nízky počet vyšetrených pacientov (pretože len malé percento pacientov spĺňalo klinické kritériá pre DNA analýzu) len ťažko interpretovateľné. Identifikovalo sa viacero už opísaných polymorfizmov v génoch LEP a LEPR, pričom jediný z nich, p.Gln223Arg, bol vo veľkých populačných štúdiách asociovaný s obezitou a predpovedá malé zvýšenie telesnej hmotnosti a stavby tela v geneticky homogénnej populácii [40].
Indikáciou pre analýzu SIM1 génu (113 detí) bolo BMI >97. percentil pre dané pohlavie a vek a začiatok obezity do 5. roku života. Do štúdie boli zaradené aj deti, ktoré mali minimálne jeden z nasledujúcich znakov: oneskorenie psychomotorického vývoja, mentálna retardácia alebo poruchy učenia a/alebo správania, faciálnu dysmorfiu v zmysle Praderovho-Williho syndrómu (Praderov-Williho like syndróm). Predbežné spracovanie výsledkov analýzy génu SIM1 poukazuje na nízky výskyt mutácií. Identifikovali sme jednu mutáciu u probandky so vznikom obezity v 2. roku života a v súčasnosti už s morbídnou obezitou (podrobnejšie výsledky sú súčasťou in extenso publikácie).
ZÁVER
Monogénová obezita je zriedkavou príčinou obezity u detí na Slovensku. Najčastejšie ide o monogénovú obezitu podmienenú mutáciou v géne pre melanokortínový receptor 4 (MC4R), pričom predpokladáme, že na Slovensku sa pohybuje prevalencia týchto mutácií okolo 1,25 %. Klinický význam genotypovej analýzy je napriek nízkemu záchytu v populácií obéznych detí ale dôležitý, lebo deteguje chorých s rizikom vzniku ťažkej až morbídnej obezity a s tým spojenými závažnými komplikáciami. V súčasnosti je k dispozícii iba kauzálna liečba rekombinantným leptínom pre pacientov s mutáciou leptínového génu, avšak v blízkej budúcnosti sa očakáva terapia agonistami MC4R u pacientov s mutáciami MC4R. Vo všetkých prípadoch monogénovej obezity je nutná skorá diagnostika, dôsledná limitácia zvýšeného príjmu potravy (vzhľadom na porušené navodzovanie pocitu sýtosti v organizme) a zvýšený pohybový režim, ktoré by mali zabrániť rozvoju ťažkej až morbídnej obezity.
Vyššia pravdepodobnosť nálezu mutácie je, ak sa DNA analýza vykonáva u detí a adolescentov: 1. so vznikom obezity v prvých mesiacoch až rokoch života (najmä do 5. roku), 2. s kontinuálnym priberaním a so závažnou hyperfágiou, 3. s akcesórnymi príznakmi (napríklad akcelerovaný rast pri podozrení na mutácie MC4R alebo Praderov-Williho-like fenotyp pri negatívnom výsledku DNA analýzy na Praderov-Williho syndróm), 4. na raritné formy (LEP, LEPR, POMC) je nutné myslieť najmä v prípade detí z konsangvinných rodín.
Podporené projektom VEGA 2/0166/14 a DIASAN s. r. o.
Došlo: 20. 10. 2016
Přijato: 23. 5. 2017
MUDr. Daniela Staníková, PhD.
Detská klinika LFUK a DFNsP
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: daniela.stanikova@savba.sk
Zdroje
1. Ogden CL, Carroll MD, Kit BK, et al. Prevalence of childhood and adult obesity in the United States, 2011–2012. JAMA 2014; 311 (8): 806–814.
2. Ahrens W, Pigeot I, Pohlabeln H, et al. Prevalence of overweight and obesity in European children below the age of 10. Int J Obes (Lond) 2014; 38 (Suppl 2): S99–107.
3. Volkovova K, Chorvathova V, Jurcovicova M, et al. Antioxidative state of the myocardium and kidneys in acute diabetic rats. Physiol Res 1993; 42 (4): 251–255.
4. Freedman DS, Khan LK, Serdula MK, et al. The relation of childhood BMI to adult adiposity: the Bogalusa Heart Study. Pediatrics 2005; 115 (1): 22–27.
5. Farooqi S. Obesity genes-it‘s all about the parents! Cell Metab 2009; 9 (6): 487–488.
6. Skytthe A, Kyvik K, Holm NV, et al. The Danish Twin Registry: 127 birth cohorts of twins. Twin Res 2002; 5 (5): 352–357.
7. Stunkard AJ, Sorensen TI, Hanis C, et al. An adoption study of human obesity. N Engl J Med 1986; 314 (4): 193–198.
8. Farooqi IS, O‘Rahilly S. New advances in the genetics of early onset obesity. Int J Obes (Lond) 2005; 29 (10): 1149–1152.
9. Maes HH, Neale MC, Eaves LJ. Genetic and environmental factors in relative body weight and human adiposity. Behav Genet 1997; 27 (4): 325–351.
10. Meyre D, Lecoeur C, Delplanque J, et al. A genome-wide scan for childhood obesity-associated traits in French families shows significant linkage on chromosome 6q22.31-q23.2. Diabetes 2004; 53 (3): 803–811.
11. Boissel S, Reish O, Proulx K, et al. Loss-of-function mutation in the dioxygenase-encoding FTO gene causes severe growth retardation and multiple malformations. Am J Hum Genet 2009; 85 (1): 106–111.
12. Dina C, Meyre D, Gallina S, et al. Variation in FTO contributes to child-hood obesity and severe adult obesity. Nat Genet 2007; 39 (6): 724–726.
13. O‘Rahilly S, Farooqi IS. Genetics of obesity. Philos Trans R Soc Lond B Biol Sci 2006; 361 (1471): 1095–1105.
14. Ramachandrappa S, Raimondo A, Cali AM, et al. Rare variants in single-minded 1 (SIM1) are associated with severe obesity. J Clin Invest 2013; 123 (7): 3042–3050.
15. Farooqi IS, O‘Rahilly S. Monogenic obesity in humans. Annu Rev Med 2005; 56 : 443–458.
16. Ranadive SA, Vaisse C. Lessons from extreme human obesity: monogenic disorders. Endocrinol Metab Clin North Am 2008; 37 (3): 733–751.
17. Montague CT, Farooqi IS, Whitehead JP, et al. Congenital leptin deficiency is associated with severe early-onset obesity in humans. Nature 1997; 387 (6636): 903–908.
18. Wabitsch M, Funcke JB, Lennerz B, et al. Biologically inactive leptin and early-onset extreme obesity. N Engl J Med 2015; 372 (1): 48–54.
19. Wabitsch M, Funcke JB, von Schnurbein J, et al. Severe early-onset obesity due to bioinactive leptin caused by a p.N103K mutation in the leptin gene. J Clin Endocrinol Metab 2015; 100 (9): 3227–3230.
20. Dubern B, Clement K. Leptin and leptin receptor-related monogenic obesity. Biochimie 2012; 94 (10): 2111–2115.
21. Farooqi IS, Wangensteen T, Collins S, et al. Clinical and molecular genetic spectrum of congenital deficiency of the leptin receptor. N Engl J Med 2007; 356 (3): 237–247.
22. Kuhnen P, Clement K, Wiegand S, et al. Proopiomelanocortin deficiency treated with a melanocortin-4 receptor agonist. N Engl J Med 2016; 375 (3): 240–246.
23. Gray J, Yeo GS, Cox JJ, et al. Hyperphagia, severe obesity, impaired cognitive function, and hyperactivity associated with functional loss of one copy of the brain-derived neurotrophic factor (BDNF) gene. Diabetes 2006; 55 (12): 3366–3671.
24. Farooqi IS, Keogh JM, Yeo GS, et al. Clinical spectrum of obesity and mutations in the melanocortin 4 receptor gene. N Engl J Med 2003; 348 (12): 1085–1095.
25. Hainerova I, Larsen LH, Holst B, et al. Melanocortin 4 receptor mutations in obese Czech children: studies of prevalence, phenotype development, weight reduction response, and functional analysis. J Clin Endocrinol Metab 2007; 92 (9): 3689–3696.
26. Tao YX. The melanocortin-4 receptor: physiology, pharmacology, and pathophysiology. Endocr Rev 2010; 31 (4): 506–543.
27. Fani L, Bak S, Delhanty P, et al. The melanocortin-4 receptor as target for obesity treatment: a systematic review of emerging pharmacological therapeutic options. Int J Obes (Lond) 2014; 38 (2): 163–169.
28. Hainerova IA, Lebl J. Treatment options for children with monogenic forms of obesity. World Rev Nutr Diet 2013; 106 : 105–112.
29. Bonnefond A, Raimondo A, Stutzmann F, et al. Loss-of-function mutations in SIM1 contribute to obesity and Prader-Willi-like features. J Clin Invest 2013; 123 (7): 3037–3041.
30. Montagne L, Raimondo A, Delobel B, et al. Identification of two novel loss-of-function SIM1 mutations in two overweight children with developmental delay. Obesity (Silver Spring) 2014; 22 (12): 2621–2624.
31. Huvenne H, Dubern B, Clement K, et al. Rare genetic forms of obesity: Clinical approach and current treatments in 2016. Obes Facts 2016; 9 (3): 158–173.
32. Stanikova D, Surova M, Ticha L, et al. Melanocortin-4 receptor gene mutations in obese Slovak children. Physiol Res 2015; 64 (6): 883–890.
33. Hinney A, Schmidt A, Nottebom K, et al. Several mutations in the melanocortin-4 receptor gene including a nonsense and a frameshift mutation associated with dominantly inherited obesity in humans. J Clin Endocrinol Metab 1999; 84 (4): 1483–1486.
34. Rosmond R, Chagnon M, Bouchard C, et al. A missense mutation in the human melanocortin-4 receptor gene in relation to abdominal obesity and salivary cortisol. Diabetologia 2001; 44 (10): 1335–1338.
35. Polak E, Vitariusova E, Celec P, et al. The prevalence of melanocortin-4 receptor gene mutations in Slovak obese children and adolescents. J Pediatr Endocrinol Metab 2016; 29 (1): 55–61.
36. Santoro N, Cirillo G, Xiang Z, et al. Prevalence of pathogenetic MC4R mutations in Italian children with early onset obesity, tall stature and familial history of obesity. BMC Med Genet 2009; 10 : 25.
37. Dubern B, Clement K, Pelloux V, et al. Mutational analysis of melanocortin-4 receptor, agouti-related protein, and alpha-melanocyte-stimulating hormone genes in severely obese children. J Pediatr 2001; 139 (2): 204–209.
38. van den Berg L, van Beekum O, Heutink P, et al. Melanocortin-4 receptor gene mutations in a Dutch cohort of obese children. Obesity (Silver Spring) 2011; 19 (3): 604–611.
39. Stanikova D, Surova M, Buzga M, et al. Age of obesity onset in MC4R mutation carriers. Endocr Regul 2015; 49 (3): 137–140.
40. Yiannakouris N, Yannakoulia M, Melistas L, et al. The Q223R polymorphism of the leptin receptor gene is significantly associated with obesity and predicts a small percentage of body weight and body composition variability. J Clin Endocrinol Metab 2001; 86 (9): 4434–4439.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Seriál o EET
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2017 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Editorial: Idiopatické střevní záněty v dětském věku
- Enterální výživa v léčbě idiopatických střevních zánětů
- Seriál o EET
- Identifikace prediktivních faktorů časného relapsu onemocnění u dětských pacientů s Crohnovou chorobou léčených thiopuriny
- Perianálne lézie – kondylómy alebo prejav Crohnovej choroby?
- Monogénová obezita u detí na Slovensku
- Uzlinový syndrom u nemoci z kočičího škrábnutí u dětí ošetřených na Klinice infekčního lékařství v Ostravě
- Zemřel prof. MUDr. László Kovács, DrSc., MPH
- Korekce vrozených vývojových vad prsu a hrudníku technikou lipomodelace
- Histamínová intolerancia v detskom veku – kazuistiky z praxe
- Fatální meningokoková sepse způsobená Neisseria meningitidis séroskupiny W
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Histamínová intolerancia v detskom veku – kazuistiky z praxe
- Enterální výživa v léčbě idiopatických střevních zánětů
- Korekce vrozených vývojových vad prsu a hrudníku technikou lipomodelace
- Perianálne lézie – kondylómy alebo prejav Crohnovej choroby?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



