-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPrognostické faktory u mezenchymálních a smíšených nádorů děložního těla
Prognostic factors of mesenchymal and mixed tumors of uterus
Objective:
Analysis of clinical and histopathological prognostic factors with emphasis on carcinosarcomas, leiomyosarcomas and endometrial sarcomas of uterus.Subject:
Review.Setting:
Department of Obstetrics and Gynaecology, Medical Faculty Hradec Králové, Charles University, Prague; The Fingerland Department of Pathology, Medical Faculty Hradec Králové, Charles University, Prague; Department of Clinical Oncology, Medical Faculty Hradec Králové, Charles University, Prague; Department of Biological and Medical Sciences, Faculty of Pharmacy, Hradec Králové; Charles University, Prague.Subject and method:
Discussion about our experience and current evidence.Conclusion:
Mesenchymal and mixed tumors of uterus are characterized by several prognostic factors as well. Except clinical prognostic variables, histopathological and molecular biological factors may play a role. The most important prognostic significance carry stage of disease, age and performance status of patient and sufficient therapy, especially surgery. In particular tumors some other prognostic factors are recognized. Except cases in really early stage of disease there is usually short interval between end of primary therapy and tumor recurrence. With the exception of endometrial stromal sarcoma, prognosis of these tumors remains very poor.Key words:
sarcoma, prognostic factor, stage.
Autoři: J. Špaček 1; J. Laco 2; J. Petera 3; P. Jílek 4; E. Křepinská 1; A. Řezáč 1; S. Štipl 1,2
Působiště autorů: Porodnická a gynekologická klinika, LF a FN, Hradec Králové, přednosta doc. MUDr. J. Tošner, CSc. 1; Fingerlandův ústav patologie, LF a FN, Hradec Králové, přednosta prof. MUDr. A. Ryška, Ph. D. 2; Onkologická klinika, LF a FN, Hradec Králové, přednosta prof. MUDr. J. Petera, Ph. D. 3; Katedra biologických a lékařských věd, FAF UK, Praha, vedoucí PharmDr. P. Jílek, CSc. 4
Vyšlo v časopise: Ceska Gynekol 2009; 74(4): 292-297
Kategorie: Původní práce
Souhrn
Cíl studie:
Analýza klinických a histopatologických prognostických faktorů zejména u karcinosarkomů, leiomyosarkomů a endometriálních sarkomů dělohy.Typ studie:
Souhrnný přehled.Název a sídlo pracoviště:
Klinika porodnictví a gynekologie, LF UK v Hradci Králové; Fingerlandův ústav patologie v Hradci Králové; Klinika onkologie a radioterapie, LF UK v Hradci Králové; Katedra biologických a lékařských věd, FAF UK.Metodika:
Diskuse na základě vlastních zkušeností a současného literárního přehledu.Závěr:
Také mezenchymální a smíšené nádory dělohy jsou charakterizovány řadou prognostických faktorů. Kromě klinických proměnných je velmi špatná prognóza odrazem řady histopatologických a molekulárně biologických ukazatelů. Největší prognostický význam má stadium onemocnění, věk a celkový stav pacientky, ale i adekvátní léčba, a zejména pak chirurgie. U jednotlivých typů nádorů se uplatňují i faktory další. S výjimkou zastižení skutečně časného stadia onemocnění nebývá interval mezi koncem primární léčby a začátkem recidivy nádoru dlouhý. Kromě endometriálních stromálních nádorů je prognóza těchto nádorů velmi špatná.Klíčová slova:
sarkom, prognostický faktor, stadium.ÚVOD
V onkogynekologii představují sarkomy a smíšené nádory děložního těla kontroverzní kapitolu z více důvodů, a i když se s nimi v běžné praxi příliš často nesetkáváme (0,5–3,3 případů na 100 000 žen/1rok), tak se na straně druhé jedná o kohortu pacientek (4–9 % děložních malignit), se kterou musíme zejména v onkogynekologických centrech reálně počítat. Oproti endometriálnímu karcinomu jsou tyto nádory mnohem hůře zmapované a jejich prognostické faktory je logické posuzovat zejména s ohledem na jejich histogenetický původ. Základním klíčem k rozluštění tohoto problému však není pouze jejich odlišná biologická povaha. Konkrétní případ vždy dotvářejí faktory hostitele a zevní prostředí. Na straně druhé lze zejména vůči endometriálním karcinomům určité odlišnosti logicky předvídat. Vzhledem k tomu, že dosud publikované práce většinou nepracovaly s většími soubory nemocných, přispívají zejména v poslední době multicentrické a metaanalytické studie k nárůstu informací i o těchto nádorech, a vzniká tak ucelenější obraz zejména o karcinosarkomech, leiomyosarkomech a endometriálních sarkomech na úrovni „evidence based medicine“. O vzácněji se vyskytujících nádorech patřících do této skupiny se budeme vzhledem k jejich nízké incidenci i nadále dovídat spíše formou kazuistik. Nelze opomenout ani to, že této problematice byla věnována pozornost i v českém písemnictví. Za zmínku stojí například retrospektivní studie (n=103) brněnských autorů z Masarykova onkologického ústavu [25].
OBECNÁ CHARAKTERISTIKA A ZÁKLADNÍ KLASIFIKACE
Sarkomy (z řeckého sarcos „maso“) jsou maligní tumory mezenchymálního původu. Až na výjimky je pro ně charakteristické agresivní chování a velmi špatná prognóza. Typické je jejich šíření krevní cestou a s tím související možnost vzniku vzdálených metastáz [8, 14, 28, 34]. Některé z těchto nádorů jsou mimořádně agresivní a během krátké doby (řádově měsíce od stanovení diagnózy) mohou pacientku usmrtit. Jejich základní klasifikace je založena na histogenezi, tj. zda pocházejí ze stromatu endometria (stromální sarkomy) nebo z myometria (leiomyosarkomy). Kromě čistých forem se vyskytují také nádory smíšené, které kromě mezenchymální složky obsahují i epiteliální elementy. Zjednodušenou verzi klasifikace mezenchymálních a smíšených nádorů těla děložního [33] podle současné WHO klasifikace ukazuje tabulka 1.
Tab. 1. WHO klasifikace mezenchymálních a smíšených nádorů těla děložního 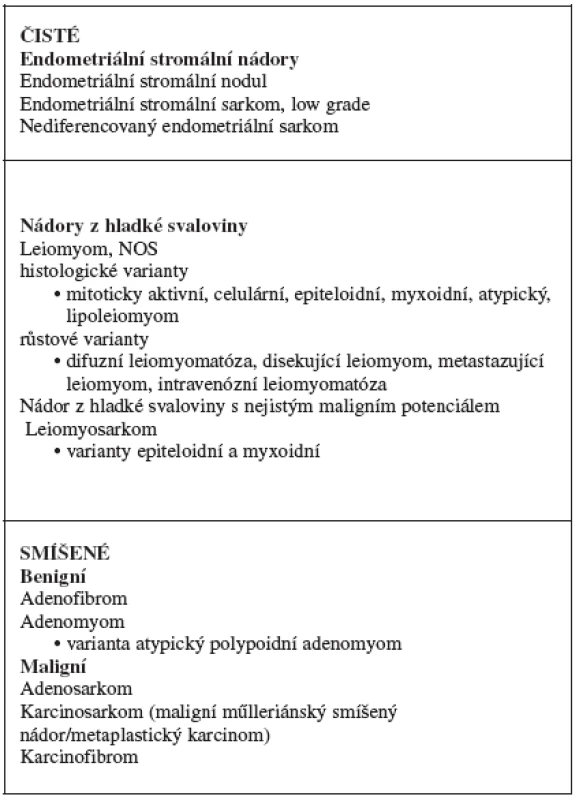
Podle vzhledu mezenchymální komponenty se smíšené nádory dělohy rozdělují na homologní, u kterých se mezenchymální komponenta nádoru diferencuje směrem ke tkáním normálně se v děloze vyskytujícím, tj. diferenciace fibrosarkomatózní, leiomyosarkomatózní a vzácněji typu stromálního sarkomu. Naproti tomu u heterologních smíšených nádorů se mezenchymální komponenta diferencuje směrem ke tkáním, které se normálně v děloze nevyskytují. Nejčastěji se vyskytuje diferenciace rabdomyosarkomatózní, chondrosarkomatózní, osteosarkomatózní a liposarkomatózní. Původně se předpokládalo, že heterologní komponenta znamená u smíšených nádorů horší prognózu. Recentně však tento vztah nebyl prokázán a naopak se ukazuje, že prognosticky významnější je typ komponenty epiteliální [31].
Leiomyosarkomy a karcinosarkomy se vyskytují nejčastěji ve středním věku a v postmenopauze, častější výskyt je popisován u černošek. Naopak, botryoidní rabdomyosarkom je typickým nádorem dětského věku. Rizikové faktory, které jsou obvyklé u karcinomu endometria (expozice neoponovaným estrogenům, diabetes mellitus, hypertenze), se u těchto nádorů většinou nevyskytují. Výjimku však představují karcinosarkomy (podle novějších poznatků vlastně metaplastické karcinomy), v jejichž etiologii je zmiňována kromě předchozí iradiace pánve a léčby Tamoxifenem také dlouhodobá aplikace estrogenů a syndrom polycystických ovarií. Obecné onkologické pravidlo platí i u těchto nádorů: nejdůležitějším prognostickým faktorem zůstává stadium onemocnění. Údaje o přežití u sarkomů a smíšených nádorů dělohy bude nutné doplnit většími studiemi, nicméně již dnes je patrné, že v porovnání s pětiletým přežitím u karcinomu endometria vychází u této skupiny nádorů hůře. U stadia I se pohybuje okolo 50-55 %, u vyšších stadií (II-IV) pak pouze 8-12 % [29]. Specifický staging pro sarkomy a smíšené nádory děložního těla neexistuje a je používán modifikovaný systém pro karcinom endometria (tab. 2).
Tab. 2. Staging sarkomů a smíšených nádorů děložního těla 
Kromě rozsahu nádorového postižení souvisí další prognostické faktory také s tím, o jaký histologický typ jde. Frekvenci výskytu nejčastěji se vyskytujících nádorů této skupiny ukazuje tabulka 3.
Tab. 3. Zjednodušená klasifikace sarkomů a smíšených nádorů děložního těla podle jejich původu a četnosti výskytu 
1. Karcinosarkom (maligní műlleriánský smíšený nádor)
Je nejčastějším typem sarkomů dělohy (0,82 případů na 100 000 žen/1 rok) a jeho druhé označení dokládá, že epiteliální tumory jsou mülleriánského původu. Karcinosarkomy jsou bifázické nádory složené z maligních mezenchymálních a epitelových struktur. Průměrný věk v době stanovení diagnózy je 62 - 67 let [2, 15, 29], před 40. rokem života se s nimi obvykle nesetkáváme a s přibývajícím věkem dochází k nárůstu jejich výskytu. Existují určité společné epidemiologické charakteristiky u pacientek s karcinosarkomy a s karcinomem endometria. Nuliparita se u nich vyskytuje v průměru ve 25 % případů, ve 40 % je to obezita a v 15 % diabetes mellitus. Karcinosarkom je dáván také do souvislosti s předchozí iradiací pánve (0-30 %). Pacientky s heterologními tumory bývají starší, mívají pokročilejší onemocnění, větší dělohu a častěji u nich předcházela iradiace pánve. Původně byly karcinosarkomy považovány za nejzhoubnější nádory děložního těla, ale prvenství v tomto ohledu získaly leiomyosarkomy. U karcinosarkomů je typický jejich polypoidní růst. Na řezu jsou nehomogenní s nekrózami, cystickými změnami a krvácením. Ačkoliv bývá invaze do myometria pravidlem, tumor může být omezen pouze na polyp. Mezenchymální komponenta karcinosarkomu může být homologní nebo heterologní. V současné době jsou tyto nádory považovány (včetně WHO) za metaplastické karcinomy. Například v Blausteinově Patologii ženského pohlavního traktu [16] jsou karcinosarkomy uvedeny jako varianta endometriálního adenokarcinomu. Zatímco sarkomatoidní komponenta je výsledkem dediferenciace, je to právě epiteliální část, která je pro jejich malignitu určující. Toto rozdílné pojetí má důležitý klinický důsledek související s léčbou, která by měla být vedena spíše jako u karcinomu [20]. V porovnání s karcinomem endometria upozorňují práce z poslední doby na daleko horší prognózu [3] a také doporučují u těchto pacientek adjuvantní chemoterapii založenou na platině [35]. Do budoucna by bylo vhodné prokázat, zda toto skutečně souvisí s častějším postižením pánevních a paraaortálních lymfatických uzlin v porovnání s high-risk histologickými subtypy karcinomu endometria, jak o tom někteří referují [3].
Nejdůležitějším prognostickým faktorem u karcinosarkomu je stadium onemocnění, hloubka invaze do myometria a extrauterinní šíření nádoru. Lymfovaskulární invaze je spojena se signifikantně vyšší pravděpodobností metastazování. V GOG studii (n=301) bylo multivariační analýzou prokázáno jako signifikantní prognostický faktor postižení adnex, postižení lymfatických uzlin, histologický typ (heterologní v. homologní) a grade nádoru. V některých studiích byl prokázán prognostický význam typu epiteliální komponenty, tj. zda vykazovala diferenciaci endometroidní či serózní/světlobuněčnou, přičemž karcinosarkomy s endometroidní diferenciací epiteliální komponenty vykazovaly lepší prognózu.
2. Leiomyosarkom
Frekvence výskytu leiomyosarkomů (LMS) je o něco nižší (0,64 případů na 100 000 žen/1 rok) než u karcinosarkomů. Jedná se však téměř o jednu třetinu děložních sarkomů [39], přičemž jejich maximální výskyt je v premenopauze okolo 50. roku života. U černošek se maximální incidence výskytu pohybuje mezi 35. až 55. rokem, u bělošek pak mezi 40. až 50. rokem. Ve většině případů se jedná o retrospektivní diagnózu z hysterektomie pro domnělý leiomyom. U žen, které podstoupily hysterektomii pro předpokládaný leiomyom, se frekvence výskytu leiomyosarkomů pohybuje okolo 0,2 % (31 až 40 let), 0,9 % (41-50 let), 1,4 % (51-60 let) a 1,7 % (61 až 81 let) [18]. Průměrný věk v době stanovení diagnózy se pohybuje mezi 48 až 54 lety [10, 29].
Leiomyosarkomy jsou typicky solitární nádory, které tvoří intramurální nádorovou masu průměrné velikosti 8 cm. Oproti leiomyomům jsou měkké a méně ohraničené, často obsahují ložiska nekrózy a krvácení. Nejčastěji jsou tyto nádory tvořeny fascikulárně uspořádanými vřetenitými buňkami s hojnou eozinofilní cytoplazmou. Diagnostickými histologickými kritérii děložního leiomyosarkomu jsou přítomnost koagulačního typu nekrózy, difuzních cytologických atypií a zvýšené mitotické aktivity nádorových buněk, a to v tomto pořadí [1, 5, 36]. Správné stanovení diagnózy leiomyosarkomu je primárně založeno na pečlivém zhodnocení všech těchto kritérií. Za maligní jsou v případě „klasické“ varianty leiomyosarkomu považovány nádory s koagulačním typem nekrózy. Pokud ta není přítomna, vyžaduje se přítomnost difuzních středních až výrazných cytologických atypií a více než 10 mitóz (mf) na 10 polí velkého zvětšení (hpf). V případě, že mitotický index je menší než 10 mf/10 hpf, je nádor označen jako „atypický leiomyom s nízkým rizikem recidivy“. Pokud v nádoru chybí koagulační nekróza a difúzní cytologické atypie, ale vykazuje vysoký mitotický index, jedná se o „mitoticky aktivní leiomyom“. V případě, že mitotický index je vyšší než 15 mf/10 hpf se může použít termín „mitoticky aktivní leiomyom s limitovanou zkušeností (experience)“. U epiteloidní a myxoidní varianty leiomyosarkomu je diagnostický nález koagulační nekrózy. Pokud tato chybí, je pro diagnózu nutná přítomnost difuzních středních až výrazných cytologických atypií a mitotický index vyšší než 5 mf/10 hpf [22]. U aneuploidních tumorů však jejich chování nekoreluje s mitotickou aktivitou. U leiomyosarkomů se navíc poměrně často setkáváme s nepravidelnými a infiltrujícími okraji a vaskulární invazí nádorových buněk.
Hladkosvalové nádory dělohy zahrnují celé spektrum afekcí různé biologické povahy od benigních leiomyomů přes hladkosvalové tumory s nejistým maligním potenciálem (smooth muscle tumours of uncertain malignant potential – STUMP) až po leiomyosarkomy. Označení „STUMP“ se používá pro nádory, u nichž nelze při použití klasických diagnostických kritérií spolehlivě rozhodnout o jejich biologické dignitě (benigní vs. maligní) [36]. Tato kategorie zahrnuje zejména epiteloidní/světlobuněčné varianty hladkosvalových nádorů [1, 5]. Léčba těchto nádorů je stejná jako u leiomyomů, ale na rozdíl od nich je doporučována přísnější dispenzarizace.
Nejdůležitějším prognostickým faktorem zůstává u leiomyosarkomu opět stadium onemocnění. Jako statisticky významný prognostický faktor prokázaly některé práce též mitotický index, což však další autoři nepotvrdili. Zdá se, že hranice velikosti tumoru 5 cm může být považována za signifikantní prognostický faktor zejména ve stadiu I [22]. Ve vztahu k věku nejsou z hlediska prognózy u tohoto onemocnění stejné názory. Některé práce věk jako prognostický faktor u leiomyosarkomu dělohy potvrdily, další však to neprokázaly.
3. Endometriální stromální sarkomy
Frekvence výskytu těchto nádorů je nejnižší (0,19/100 tisíc). Klasicky byly endometriální stromální sarkomy děleny v závislosti na počtu mitóz na subkategorii low-grade (LGSS) a high-grade (HGSS) [11], přičemž tumory s méně než 10 mf/10 hpf byly považovány za LGSS a tumory s více než 10 mf/10 hpf za HGSS. Současná WHO klasifikace však endometriální stromální nádory dělí nikoliv podle mitotické aktivity, ale podle jaderného pleomorfismu a přítomnosti nekróz, a to na low-grade endometriální stromální sarkomy a na nediferencované endometriální sarkomy [33]. Průměrný věk v době stanovení diagnózy se pohybuje mezi 41-63 roky [6, 11].
LGSS jsou pomalu rostoucí nádory s tendencí ke vzniku pozdních lokálních recidiv [26, 27, 37]. Disease-free interval bývá průměrně 3-5 let (popsáno více než 20 let) [13]. Exprimují estrogenové a progesteronové receptory [38]. O prokázané objektivní odpovědi na hormonální terapii svědčí i kazuistická sdělení o hormonální léčbě inhibitorem aromatázy Letrozolem u recidiv tohoto onemocnění.
Vzhledem k tomu, že prognóza high-grade endometriálních sarkomů je podobně jako u pacientek s jinými high-grade děložními sarkomy (např. leiomyosarkomy) nebo heterologními sarkomy špatná, bylo v poslední době navrženo některými autory opuštění termínu „HGSS“ a použití k jejich označení „nediferencovaný nebo špatně diferencovaný endometriální sarkom“ [4, 17, 21, 24, 32], což bylo akceptováno i autory současné WHO klasifikace [32].
Také u endometriálního stromálního sarkomu je nejdůležitějším prognostickým faktorem opět stadium onemocnění. V univariační analýze pacientek se stadiem I bylo prodloužení přežití spojeno s minimální invazí do myometria a nízkým mitotickým indexem.
4. Další sarkomy
V děložním těle se můžeme setkat s celou řadou dalších nádorů, jak o tom vypovídá mnoho kazuistických sdělení. Zde jsou zmíněny jenom některé.
Adenosarkom
Adenosarkom patří spolu s karcinosarkomem do skupiny tumorů mülleriánského původu. Na rozdíl od karcinosarkomu se však pokládá za pravý smíšený nádor sestávající z maligní mezenchymální a benigní epiteliální komponenty. Většinou má charakter polypu, který prominuje do děložní dutiny a vyplňuje děložní hrdlo. Oproti karcinosarkomu má adenosarkom podstatně lepší prognózu. Souvisí to s tím, že většina pacientek je zachycena ve stadiu I. K myometriální invazi dochází přibližně ve 20 % případů. Makroskopicky na řezu bývá nádor solidní struktury s drobnými cystickými prostory. Mikroskopické odlišení tohoto tumoru od benigního adenofibromu bývá obtížné a často kontroverzní, protože buněčnost je v jednotlivých částech nádoru odlišná. Za arbitrární diferenciálně diagnostické kritérium pro odlišení adenosarkomu od adenofibromu je přítomnost více než 1 mf/10 hpf ve stromální komponentě nádoru. Adenosarkomy jsou považovány za indolentní tumory s tendencí ke vzniku pozdních lokálních recidiv (25-40 % případů).
Botryoidní rabdomyosarkom
Botryoidní rabdomyosarkom je podvarianta embryonálního rabdomyosarkomu vyskytujícího se v orgánech se slizničním povrchem. Ačkoli byl popsán i v dospělosti, je jeho hlavní výskyt v dětství a v adolescenci. Typický je jeho makroskopický vzhled, který připomíná hrozníčky vína s hladkým, kluzkým povrchem, jež mohou prominovat děložním hrdlem do pochvy. Mikroskopicky botryoidní rabdomyosarkom sestává z malých kulatých nediferencovaných buněk s nepravidelným hyperchromním jádrem a s úzkým lemem cytoplazmy rostoucích pod slizničním epitelem. Čistý rabdomyosarkom dělohy je velmi vzácné onemocnění. V letech 1869–1968 (100 let) bylo popsáno pouze 28 případů.
Perivaskulární epiteloidní tumory (PEComy)
Jde o nově zavedenou nádorovou jednotku, která zahrnuje angiomyolipom ledviny, plicní lymfangiomyomatózu, světlobuněčný nádor plic a měkkotkáňové tumory, tj. vlastní PEComy, které se relativně častěji vyskytují v děloze a v pánevních ligamentech. V děloze bylo zatím popsáno pouze několik případů. Tyto tumory rostou intramurálně a mikroskopicky sestávají z buněk, které připomínají epiteloidní buňky hladké svaloviny. Imunohistochemicky nádorové buňky variabilně exprimují svalové markery, např. hladkosvalový aktin, a melanocytární markery, např. HMB-45, melan A a tyrozinázu. Histogeneticky jsou PEComy odvozovány od perivaskulárních epiteloidních buněk, jejichž přítomnost však dosud nebyla v normální tkáni prokázána. V současné době je doporučeno PEComy dělohy považovat za nádory s nejistým maligním potenciálem, u kterých je dostačujícím léčebným výkonem hysterektomie. Vzhledem k tomu, že se nádor v některých případech choval agresivně, je však nutná dlouhodobá dispenzarizace.
Závěr
Vyhodnocování prognostických faktorů v managementu protinádorové léčby je její důležitou součástí. Vyjma low-grade endometriálních stromálních sarkomů mají karcinosarkomy, leiomyosarkomy a nediferencované stromální sarkomy (dříve HGSS) vesměs velmi špatnou prognózu. Výjimkou jsou ty případy, kdy se nám podaří odoperovat skutečně nejčasnější stadium. Často bývají postiženy ženy ve vyšším věku, kde mohou být možnosti chirurgické léčby značně omezené. Prognóza leiomyosarkomů zohledňující věk pacientky, grade a stadium nádoru je horší než u karcinosarkomů. Nebyly nalezeny rozdíly v délce přežití mezi leiomyosarkomem a nediferencovaným endometriálním sarkomem.
Zejména u leiomyosarkomů je specifitou i to, že diagnóza nebývá stanovena ex ante, ale až ex post. V tomto případě musí být postup opět individuální. Rozhodujeme-li o nutnosti následné operace, neměli bychom nikdy zapomínat ani na hematogenní afinitu, která je pro sarkomy typická. Z těchto důvodů se jeví paraaortální lymfadenektomie (vyjma karcinosarkomu) v rámci radikalizace chirurgické léčby jako kontroverzní.
I když obecné principy týkající se klinických prognostických faktorů jsou u sarkomů dělohy podobné jako u karcinomů, měla by právě jejich biologická povaha souviset se snahou o individualizaci léčby. Zejména v časném stadiu je hledání účinné adjuvantní léčby u nejrizikovějších případů logickou konsekvencí.
Práce byla podpořena Výzkumným záměrem MZO ČR 00179906.
Doc. MUDr. Jiří Špaček, Ph.D., IFEPAG
Porodnická a gynekologická klinika
LF a FN v Hradci Králové
Sokolská 581
500 05 Hradec Králové
e-mail: spacekj@fnhk.cz
Zdroje
1. Al-Nafussi, A. Uterine smooth-muscle tumors: practical approach to diagnosis. Curr Diag Pathol, 2004, 10, p.140-156.
2. Ali, S., Wells, M. Mixed müllerian tumors of the uterine corpus: a review. Int J Gynecol Cancer, 1993, 3, p. 1-11.
3. Amant, F., Cadron, I., Fuso, L., et al. Endometrial carcinosarcomas have a different prognosis and pattern of spread compared to high-risk epithelial endometrial cancer. Gynecol Oncol, 2005, 98, p. 274-280.
4. Amant, F., Vergote, I., Moerman, P. The classification of a uterine sarcoma as „high-grade endometrial stromal sarcoma“ should be abandoned. Gynecol Oncol, 2004, 95, p. 412-413.
5. Bell, SW., Kempson, RL., Hendrickson MR. Problematic uterine smooth muscle neoplasms. A clinicopathologic study of 213 cases. Am J Surg Pathol, 1994, 18, p. 535-558.
6. Berchuck, A., Rubin, SC., Hoskins, WJ., et al. Treatment of endometrial stromal tumors. Gynecol Oncol, 1990, 36, p. 60-65.
7. Brooks, SE., Zhan, M., Cote, T., Baquet, CR. Surveillance, epidemiology and results analysis of 2677 cases of uterine sarcoma 1989-1999. Gynecol Oncol, 2004, 93, p. 204-208.
8. Falconi, M., Crippa, S., Sargenti, M., et al. Pancreatic metastasis from leiomyosarcoma of the broad ligament of the uterus. Lancet Oncol, 2006, 7, p. 94-95.
9. Freitag, P. Rizikové a prognostické faktory gynekologických zhoubných nádorů. Mod Gynekol Porod, 2007, 16, p. 488-497.
10. Gadducci, A., Landoni F., Sartori, E., et al. Uterine leiomyosarcoma: analysis of treatment failures and survival. Gynecol Oncol, 1996, 62, p. 25-32.
11. Gadducci, A., Sartori, E., Landoni, F., et al. Endometrial stromal sarcoma: analysis of treatment failures and survival. Gynecol Oncol, 1996, 63, p. 247-253.
12. Harlow, BL., Weiss, NS., Lofton, S. The epidemiology of sarcomas of the uterus. J Natl Cancer Inst, 1986, 76, p. 399-402.
13. Inayama, Y., Shoji, A., Odagiri, S., et al. Detection of pulmonary metastasis of low grade endometrial stromal sarcoma 25 years afer hysterectomy. Pathol Res Pract, 2000, 196, p. 129-134.
14. Iwamoto, I., Fujino T., Higashi, Y., et al. Metastasis of uterine leiomyosarcoma to the pancreas. J Obstet Gynaecol Res, 2005, 31, p. 531-534.
15. Jonson, AL., Bliss, RL., Truskinovsky, A., et al. Clinical features and outcomes of uterine and ovarian carcinosarcoma. Gynecol Oncol, 2006, 100, p. 561-564.
16. Kurman, RJ. Blaustein’s Pathology of the Female Genital Tract. Fifth Edition. New York, Berlin, Heidelberg: Springer-Verlag, 2002.
17. Leath, CA, Huh, WK., Hyde, J., et al. A multi-institutional review of outcomes of endometrial stromal sarcoma. Gynecol Oncol, 2007, 105, p. 630-634.
18. Leibson, S., d’Ablaing, G., Mishell, DR., Schlaerth, JB. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. Am J Obstet Gynecol, 1990, 162, p. 968-976.
19. Major, FJ., Blessing, JA., Silverberg, SG., et al. Prognostic factors in early-stage uterine sarcoma. A Gynecologic Oncology Group study. Cancer, 1993, 71 (Suppl.4), p. 1702-1709.
20. McCluggage, WG. Uterine carcinosarcomas (malignant mixed Müllerian tumors) are metaplastic carcinomas. Int J Gynecol Cancer, 2002, 12, p. 687-690.
21. Moinfar, F., Azoli, M., Tavassoli, FA. Uterine sarcomas. Patology, 2007, 39, p. 55-71.
22. Nordal, RR., Kristensen, GB., Kaern, J., et al. The prognostic significance of stage, tumor size, cellular atypia and DNA ploidy in uterine leiomyosarcoma. Acta Oncol, 1995, 34, p. 797-802.
23. Nordal, RR., Thoresen, SO. Uterine sarcomas in Norway 1956-1992; incidence, survival and mortality. Eur J Cancer, 1997, 33, p. 907-911.
24. Oliva, E., Clement, P., Young, RH. Endometrial stromal tumors: an update on a group of tumors with a protean phenotype. Adv Anat Pathol, 2000, 7, p. 257-281.
25. Ptáčková, B., Krejčí, E. Sarkomy dělohy. Léčba a prognostické faktory. Gynekolog, 2000, 9, p. 215-218.
26. Reich, O., Winter, R., Regauer, S. Should lymphadenectomy be performed in patients with endometrial stromal sarcoma? Gynecol Oncol, 2005, 97, p. 982-983.
27. Riopel, J., Plante, M., Renaud, MC., et al. Lymph node metastases in low-grade endometrial stromal sarcoma. Gynecol Oncol, 2005, 96, p. 402-406.
28. Saiz, AD., Sachdev, U., Brodman, ML., et al. Metastatic uterine leiomyosarcoma presenting as a primary sarcoma of the parotid gland. Obstet Gynecol, 1998, 92, p. 667-668.
29. Salazar, OM., Dunne, ME. The role of radiation therapy in the management of uterine sarcomas. Int J Radiat Oncol Biol Phys, 1980, 6, p. 899-902.
30. Sartori, E., Bazzurini, L., Gadducci, A., et al. Carcinosarcoma of the uterus: a clinicopathological multicenter CTF study. Gynecol Oncol, 1997, 67, p. 70-75.
31. Silverberg, SV., Major, FJ., Blessing, JA., et al. Carcinosarcoma (malignant mixed mesodermal tumor) of the uterus. A Gynecologic Oncology Group pathologic study. Int J Gynecol Pathol, 1990, 9, p. 1-19.
32. Tavassoli, FA., Devilee, P. eds. WHO Classification of Tumours. Pathology and Genetics. Tumours of the Breast and Female Genital Organs. Lyon: IARCPress, 2003, p. 217-257.
33. Temkin, SM., Hellmann, M., Lee, YC., et al. Early-stage carcinosarcoma of the uterus: the significance of lymph node count. Int J Gynecol Cancer, 2007, 17, p. 215-219.
34. Uchino, M., Endo, G., Shibata, I., et al. Uterine leiomyosarcoma metastasis to the skull-case report. Neurol Med Chir, 1996, 36, p. 469-471.
35. Vaidya, AP., Horowitz, NS., Oliva, E., et al. Uterine malignant mixed müllerian tumors should not be included in studies of endometrial carcinoma. Gynecol Oncol, 2006,103, p. 684-687.
36. Wilkinson, N., Rollason, TP. Recent advanced in the pathology of smooth muscle tumours of the uterus. Histopathology, 2001, 39, p. 331-341.
37. Yokoyama, Y., Ono, Y., Sakamoto, T., et al. Asymptomatic intracardiac metastasis from a low-grade endometrial stromal sarcoma with successful surgical resection. Gynecol Oncol, 2004, 92, p. 999-1001.
38. Zaloudek, C., Hendrickson, MR. Mesenchymal tumors of the uterus. In: Kurman, RJ., ed. Blausteinęs pathology of the female genital tract. New York: Springer-Verlag Inc, 2002. p. 561-615.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2009 Číslo 4- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Mediolaterální epiziotomie a poranění análního sfinkteru
- Chemoterapie během těhotenství
- Preeklampsie – některé možnosti predikce
- Ischemizující metody léčby děložních myomů
- Vliv hodnoty CA125 a hemoglobinu na prognózu ovariálního karcinomu
- Proteomika a biomarkery karcinomu endometria
- Markery aktivace endoteliálních buněk – možnosti jejich vyšetření a klinický význam v gynekologii a porodnictví
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Prognostické faktory u mezenchymálních a smíšených nádorů děložního těla
- Doporučený postup pro diagnostiku a terapii genitálního herpesu u žen
-
Operování přirozenými tělními otvory
Hybridní transvaginální cholecystektomie - Placenta adherens partim accreta – ojedinělé možnosti terapie
- Doporučený postup k vyšetřování obětí sexuální agrese při poskytování péče obětem znásilnění a sexuálního zneužívání
- ZÁPIS ze 40. konference Sekce gynekologie dětí a dospívajících
- AKCE IPVZ
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Placenta adherens partim accreta – ojedinělé možnosti terapie
- Doporučený postup k vyšetřování obětí sexuální agrese při poskytování péče obětem znásilnění a sexuálního zneužívání
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



