-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMarkery aktivace endoteliálních buněk – možnosti jejich vyšetření a klinický význam v gynekologii a porodnictví
Endotelial activation markers – possibilities of their detection and clinical signification in gynaecology and obstetric
Objective:
Summary of the current knowledge of the role of endotelial activation markers in the pathogenesis of the selected diseases and high-risk pregnancy.Design:
Review article.Methods:
Compilation of the published data from scientific literature.Conclusions:
The endothelium functions in a multitude of physiological processes including the control of cellular trafficking, the regulation of vasomotor tone and maintenance of blood fluidity. Preeclampsia is compared by the the insufficient trofoblastic invasion to the maternal spiral arteries. This changes lead to the insufficiency of the fetoplacental blood flow. The ischaemia of the fetoplacental unit cause the release of specific factors into maternal vessels and subsequent activation of the endothelium and vasoconstriction. We present a short summary of the clinically important endothelial markers and current possibilities of laboratory testing.Key words:
endothelium, pregnancy, preeclampsia.
Autoři: J. Procházková 1; R. Pilka 2; A. Měchurová 3; O. Šimetka 4
; P. Brychtová 5; M. Procházka 2
Působiště autorů: Hemato-onkologická klinika FN a LF UP, Olomouc, přednosta prof. MUDr. K. Indrák, DrSc. 1; Porodnicko-gynekologická klinika FN a LF UP, Olomouc, přednosta doc. MUDr. R. Pilka, Ph. D. 2; Ústav pro péči o matku a dítě, Praha, ředitel doc. MUDr. J. Feyereisl, CSc. 3; Porodnicko-gynekologická klinika FN, Ostrava, přednosta MUDr. O. Šimetka 4; Baťova nemocnice, Zlín, primář MUDr. Z. Adamík, Ph. D. 5
Vyšlo v časopise: Ceska Gynekol 2009; 74(4): 279-281
Kategorie: Původní práce
Souhrn
Cíl práce:
Shrnutí současných znalostí o vybraných markerech aktivace endotelu v patogenezi některých chorob včetně patologických stavů v graviditě.Typ studie:
Přehledový článek.Metodika:
Zpracování literárních údajů.Závěr:
Endotel je extrémně metabolicky aktivní orgán tvořící bariéru mezi krví a tkáněmi. Při jeho aktivaci se uvolňuje řada produktů, kterými endotelové buňky řídí vazomotoriku, koagulaci, reologické vlastnosti krve a zánětlivou reakci. Při preeklampsii dochází k insuficientní trofoblastické invazi mateřských spirálních arterií, což může vést k sekreci faktorů do mateřské cirkulace, které způsobují alteraci endotelu. Uvádíme přehled vyšetřovaných markerů aktivace endotelu, jejich klinický význam a možnosti laboratorního stanovení.Klíčová slova:
endotel, těhotenství, preeklampsie.ÚVOD
Endotelové buňky tvoří spolu s buňkami hladkého svalstva a fibroblasty cévní stěnu. Jsou umístěny v jedné vrstvě na luminálním povrchu cév. Netvoří jen pasivní výstelku cévního lumen, ale naopak jsou extrémně metabolicky aktivním orgánem tvořícím bariéru mezi krví a tkáněmi. Lze je považovat jak za senzorické struktury přijímající hemodynamické a humorální signály, tak za efektorové buňky, produkující celou řadu působků s vlivem jak na sousední vrstvu svalových buněk, tak cestou cirkulace na celý organismus. V organismu dospělého člověka se nachází 6 trilionů endotelových buněk, tyto tvoří orgán vážící 1 kg a zaujímající plochu 5000 m2 [2].
Jako první objevil díky užití primitivního mikroskopu existenci bariéry mezi krví a tkáněmi Malpighi, který rovněž popsal kapilární spojení mezi drobnými arteriemi a žílami [2].
Endotelové buňky nejsou uniformní hmotou, ale vykazují výraznou orgánovou specifitu. Fenotyp endotelií se liší v závislosti na umístění v jednotlivých orgánech, a dokonce i v různých segmentech cév jednoho orgánu [3]. Regulace fenotypu dokonce umožňuje odlišné složení endoteliálních struktur v jednom místě v různých časových úsecích [3].
Intaktní endotel má za fyziologických podmínek silný inhibiční vliv na koagulaci prostřednictvím faktorů, které syntetizuje a uvolňuje či exprimuje na svém povrchu. Dva z těchto faktorů – prostaglandin I2 (PGI2 či prostacyklin) a oxid dusnatý (NO či endothelium derived relaxing factor – EDRF) – mají silnou vazodilatační aktivitu [5]. Působí na buňky hladké svaloviny v cévní stěně a ovlivňují tak krevní průtok. Obě substance též inhibují agregaci destiček a adhezi leukocytů.
Endotelové buňky obsahují na svém povrchu celou řadu receptorů, kterými přijímají jak hemodynamické signály (intenzitu pulsace, proudění a roztažení cévní stěny), tak humorální působky (receptory cytokinů, růstových faktorů, bakteriálních substancí, angiotenzinu II, koagulačních faktorů II, V, IX, X apod.) [3]. Na základě těchto podnětů dojde k aktivaci endotelu, což vede k uvolňování celé řady produktů, kterými endotelové buňky řídí vazomotoriku (cévní tonus, krevní tlak, perfuzi orgánů), koagulaci (adhezi a agregaci trombocytů, aktivaci koagulační kaskády a fibrinolýzy), udržování reologických vlastností krve a v neposlední řadě zánětlivou reakci (migraci a chemotaxi leukocytů, monocytů a makrofágů, fagocytózu, cévní permeabilitu) [1, 3]. Všechny tyto děje potom hrají klíčovou roli v regulaci buněčného metabolismu. Produkty endotelových buněk ukazuje tabulka 1.
Tab. 1. Produkty endotelových buněk 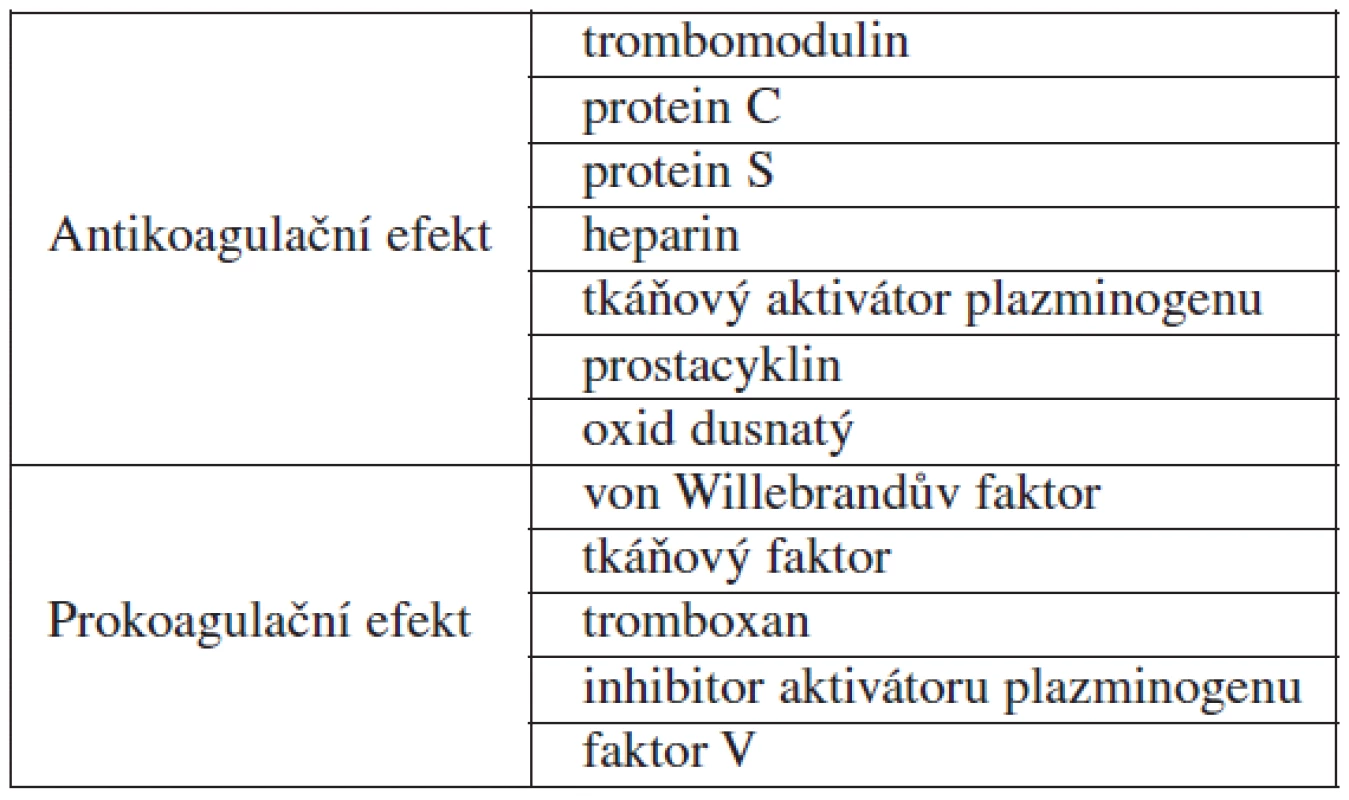
V poslední době dochází k prudkému rozvoji poznatků o funkci produktů aktivace endotelových buněk a snaze vyvinout laboratorní metody k jejich detekci. V minulosti již byl prokázán význam markerů aktivace endotelu při jeho poškození následkem aterosklerózy (především v akutní fázi ischémie myokardu, dolních končetin a ischemických cévních mozkových příhod umožňuje vyšetření jejich hladiny předpovědět tíží příhody), prediktivní potenciál markerů aktivace endoteliálních buněk ke stanovení rizika vývoje aterosklerózy v budoucnosti je teprve zkoumán. Stejně tak je zájem vědců zaměřen na význam stanovení těchto markerů u dalších patologických stavů spojených s poškozením endotelu, jako je např. vznik maligních nádorů a jejich metastázování a patologické stavy v těhotenství (preeklampsie a diabetes mellitus). Hypertenzní onemocnění v těhotenství a preeklampsie jsou multisystémová onemocnění charakterizovaná hypertenzí, někdy s proteinurií a generalizovanou systémovou vazokonstrikcí. Při preeklampsii dochází k insuficientní trofoblastické invazi mateřských spirálních arterií, což vede k poruchám prokrvení fetoplacentární jednotky. To může vést k sekreci faktorů do mateřské cirkulace, které způsobují aktivaci endotelu a alteraci vaskulární reaktivity. Tyto cirkulující faktory však dosud nebyly identifikovány.
Bylo již potvrzeno, že v klinické fázi onemocnění dochází k signifikantnímu zvýšení některých látek, které signalizují poškození endotelu – endotelin, vitronektin a endoteliální adhezivní molekuly VCAM – 1 (vascular cell adhesive molecules), ICAM – 1 (intercellular adhesive molecules) [7]. V posledních letech se prudce rozvíjejí laboratorní metody stanovující další markery aktivace endotelu, např. t-PA, PAI-1, vWF, EPCR, trombomodulin a endotelové mikropartikule s prokoagulační aktivitou, jejichž význam již byl prokázán např. při alteraci endotelu následkem aterosklerózy, zatím ovšem nebyly podrobně zkoumány ve vztahu k preeklampsii. V následující části je uveden přehled dosud nejznámějších vyšetřovaných markerů aktivace endotelu, jejich klinický význam a možnosti laboratorního stanovení.
MARKERY AKTIVACE ENDOTELU
Tkáňový aktivátor plazminogenu
Tkáňový aktivátor plazminogenu (t-PA) je serinová proteáza s fibrinolytickou aktivitou. Je detekovatelná v celé řadě tělních tekutin (sliny, mléko, žluč, cerebrospinální mok, moč), nejvyšší koncentrace je v orgánech s bohatým cévním zásobením (děloha, ledviny, plíce) [5]. Sekrece t-PA v klidovém stavu je velmi nízká, stejně tak jako jeho hladina v cirkulaci, odkud je rychle degradován, ale syntéza stimulovaná různými podněty je velmi rychlá. Endotelové buňky jsou hlavním místem jeho produkce v organismu, dalším zdrojem jsou aktivované monocyty a megakaryocyty [5]. t-PA je hlavním aktivátorem fibrinolýzy a jediným specifickým aktivátorem plazminogenu. Aktivace plazminogenu prostřednictvím t-PA je potencována fibrinem – pouze v jeho přítomnosti může t‑PA aktivovat plazminogen štěpením na aktivní molekuly plazminu [5]. Plazmin potom odbourává fibrin obsažený v trombech. V plazmě se t-PA nachází v koncentraci 2–8 ng/ml, nicméně 95 % tohoto množství je vázáno v komplexech s PAI-1 a pouze 5 % tvoří volná forma. Zvýšené hodnoty t-PA nacházíme po chirurgických zákrocích, traumatech, při zánětech, postižení cév aterosklerózou, léčbě heparinem, ale i po větší fyzické zátěži, a stresu, takže odběr krve je nutno provádět za klidových podmínek k vyloučení falešně pozitivních výsledků. Další příčinou zvýšené hladiny t-PA je těžší jaterní onemocnění, protože játra jsou hlavním místem odbourávání [4]. Hladina t-PA bývá nejčastěji vyšetřována metodou ELISA.
Inhibitor aktivátoru plazminogenu 1
Inhibitor aktivátoru plazminogenu (PAI-1) je přirozený inhibitor t-PA a urokinázy a je produkován aktivovanými endotelovými buňkami, hepatocyty a megakaryocyty [5]. V plazmě se vyskytuje ve dvou formách – ve funkčně aktivní volné formě, která je stabilizována vazbou na vitronektin a ve funkčně inaktivní formě v komplexu s t-PA či urokinázou – 80 % celkového množství.
PAI-1 je rovněž skladován v alfa-granulích trombocytů [5]. Bazální hladina v plazmě je nízká, vykazuje diurnální cyklus s ranním peakem. PAI-1 je „proteinem akutní fáze“, jeho hladina se tedy zvyšuje při infekcích, malignitách a v pooperačních stavech [4]. Zvýšená hladina PAI-1 je nalézána u pacientů s projevy aterosklerózy, při léčbě heparinem, při zánětech a v těhotenství. Fyziologická koncentrace PAI-1 je za bazálních podmínek 7–23 ng/ml, je stanovována metodou ELISA.
Von Willebrandův faktor
Von Willebrandův faktor (vWf) je produktem převážně endotelových buněk – 85 % celkového množství – a je pak skladován ve Weibelových-Paladeho tělíscích, zbývajících 15 % je tvořeno v megakaryocytech a a skladováno v alfa-granulích trombocytů. Von Willebrandův faktor hraje klíčovou roli v tvorbě primární hemostatické zátky – umožňuje adhezi trombocytů k místu poškození cévní stěny a dále stabilizuje koagulační faktor VIII, který chrání před degradací. Fyziologická hladina antigenu vWf je 61–158 % a zvyšuje se u celé řady stavů spojených s aktivací endotelu – trauma, operace, infekce, malignity. Stanovení antigenu vWf je možné imunoturbidimetricky.
Trombomodulin
Trombomodulin je transmembránový glykoprotein s významným inhibičním účinkem na proces koagulace. Je vázán na cévním endotelu. Jeho funkcí je inhibice trombinu, se kterým vytváří po vazbě inaktivní komplex [4]. Další klíčovou roli v inhibici koagulace hraje aktivací proteinu C, a to prostřednictvím komplexu s aktivovaným koagulačním faktorem II [4]. Aktivace proteinu C komplexem trombomodulin/trombin probíhá 1500–2000krát rychleji než samotným trombinem [5]. Z povrchu endotelových buněk je trombomodulin uvolňován proteolytickým štěpením elastázou neutrofilů při jejich poškození [5]. Laboratorně lze hladinu trombomodulinu stanovit metodou ELISA, fyziologická koncentrace je u mužů 10–52 ng/ml, u žen 10–42 ng/ml.
Endoteliální receptor proteinu C
Endoteliální receptor proteinu C (EPCR) je transmembránový glykoprotein primárně lokalizovaný na endotelu velkých cév. Jeho funkce spočívá v umožnění vazby proteinu C (PC) na endotel a zde jeho interakci s komplexem trombin – trombomodulin, což výrazně urychluje aktivaci PC (až pětinásobně) a současně propůjčuje PC jeho protizánětlivou aktivitu [4]. Antikoagulační působení aktivovaného PC je zprostředkováno inhibicí aktivovaného koagulačního faktoru V a VIII. Laboratorní stanovení solubilní formy EPCR je možné metodou ELISA, fyziologické rozmezí je 65–230 ng/ml.
Endoteliální mikropartikule
Neporušený povrch endotelu hraje klíčovou roli v udržování integrity cévní stěny a hemostázy. Při alteraci endotelu a obnažení subendoteliálních struktur dochází k adhezi leukocytů a trombocytů na postižené místo, k aktivaci koagulačních faktorů a dalšímu poškozování endoteliálních buněk, což má za následek uvolňování jejich fragmentů (mikropartikulí) do cirkulace. Endoteliální mikropartikule (EMP) jsou drobné (≤ 1 μm) vezikuly, jejichž množství a struktura nám umožňuje posoudit míru a povahu endoteliálního poškození. Pro vyšetření EMP je nejvýhodnější průtoková cytometrie s použitím celé řady monoklonálních protilátek, za fyziologických poměrů nalézáme 1177–1765 částic/μl.
Metaloproteinázy a inhibitory metaloproteináz
Metaloproteinazy (MMP) a jejich inhibitory (TIMP) představují skupinu proteolytických enzymů, které štěpí složky extracelulární matrix [6].
Při aktivaci MMP a TIMP jako následku aktivace endoteliálních buněk v důsledku jak fyziologických pochodů (růst a diferenciace tkání a orgánů), tak patologických procesů (zánět, ischémie, nádorová transformace apod.) dochází k modifikaci extracelulární subendoteliální matrix těmito enzymatickými systémy, poté k migraci endoteliálních buněk s následnou neovaskularizací či zánikem cév v dané oblasti.
MMP a TIMP tedy hrají důležitou roli v procesu remodelace cévní stěny, při tvorbě kolaterál v ischemizované tkáni, při procesu metastázování a neovaskularizace nádorů a v neposlední řadě v rámci implantace embrya do děložní sliznice a vývoji utero-placentární jednotky.
Práce je podpořena Grantem Ministerstva zdravotnictví ČR IGA NR 9282-3/2007.
MUDr. Jana Procházková
Hemato-onkologická klinika
FN a LF UP Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: prochazkovajana@hotmail.com
Zdroje
1. Blann, AD. Assessment of endothelial dysfunction: focus on atherothrombotic disease. Pathophysiol Haemostasis Thrombosis, 2005, p. 34.
2. De Caterina, R., Libby P. Endothelial Dysfunctions and Vascular Disease. Blackwell Publishing, 2007, p. 3-25.
3. Hoffbrand, AV., Catovsky, D., Tuddenham, EGD. Postgraduate Hematology. Blackwell Publishing, 2005, p. 787-792.
4. Kvasnička, J. Trombofilie a trombotické stavy v klinické praxi. Praha: Grada Publishing, 2003, s. 40-65.
5. Pecka, M. Laboratorní hematologie v přehledu - Fyziologie a patofyziologie hemostázy. 2004, s. 22-24, 87-97, 113-118.
6. Pilka, R., Hrachovec, P. Matrix metaloproteinázy a menstruace. Čes Gynek, 2003, 68, s. 36-40.
7. Šimetka, O., Brychtová, P., Procházková, J., Procházka, M. Laboratorní změny aktivace endotelu u syndromu HELLP. Gynekolog, 2008, 2, s. 48-53.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2009 Číslo 4- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Mediolaterální epiziotomie a poranění análního sfinkteru
- Chemoterapie během těhotenství
- Preeklampsie – některé možnosti predikce
- Ischemizující metody léčby děložních myomů
- Vliv hodnoty CA125 a hemoglobinu na prognózu ovariálního karcinomu
- Proteomika a biomarkery karcinomu endometria
- Markery aktivace endoteliálních buněk – možnosti jejich vyšetření a klinický význam v gynekologii a porodnictví
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Prognostické faktory u mezenchymálních a smíšených nádorů děložního těla
- Doporučený postup pro diagnostiku a terapii genitálního herpesu u žen
-
Operování přirozenými tělními otvory
Hybridní transvaginální cholecystektomie - Placenta adherens partim accreta – ojedinělé možnosti terapie
- Doporučený postup k vyšetřování obětí sexuální agrese při poskytování péče obětem znásilnění a sexuálního zneužívání
- ZÁPIS ze 40. konference Sekce gynekologie dětí a dospívajících
- AKCE IPVZ
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Klinické zkušenosti s kombinovanou vaginální antikoncepcí NuvaRing v České republice
- Placenta adherens partim accreta – ojedinělé možnosti terapie
- Doporučený postup k vyšetřování obětí sexuální agrese při poskytování péče obětem znásilnění a sexuálního zneužívání
- Dlouhodobé léčebné výsledky vysoké zadní plastiky s plikací levátorů s použitím síťky Vypro II
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



