-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMonoklonální imunoglobulin a kožní nemoci ze skupiny mucinóz – scleredema adultorum Buschke a scleromyxedema: popis 4 případů a přehled léčebných možností
Monoclonal immunoglobulin (M-Ig) and skin diseases from the group of mucinoses – scleredema adultorum Buschke and scleromyxedema. Description of four cases and an overview of therapies
Introduction:
The mucinoses of the type of scleredema and scleromyxedema are diseases marked by excessive production of mucin deposits in the skin and subcutaneous tissue, which causes skin hardening. The skin and subcutaneous deposits hamper the movement of limbs, the thorax as well as mouth. The same mechanism also damages other organs (the heart, lungs, oesophagus). It is probably caused by the stimulation of mucin production in fibroblasts by immunoglobulins, frequently monoclonal immunoglobulin. Therefore these diseases are typically associated with monoclonal gammopathy.Case reports:
We describe a cohort of 4 patients, skin manifestations were twice identified as scleredema and twice as scleromyxedema. All the four patients had type IgG monoclonal immunoglobulin and had clonal plasma cells in the bone marrow proven by histologic examination and flow cytometry. Therefore we commenced chemotherapy in all of them. In one case this chemotherapy was ended by a high-dose chemotherapy with transplanting of autologous red blood cells. This therapy attained the complete disappearance of monoclonal immunoglobulin as well as cutaneous and extracutaneous manifestations of scleredema (obstipation). In one case chemotherapy led to partial hematologic remission and partial improvement of skin manifestations. The other two patients did not respond to standard chemotherapy. The condition of one of them resulted in dermato-neuro syndrome (confusion, somnolence passing into coma and grand mal seizure) and improved following an intensive treatment including also intravenous application of immunoglobulins in a dose of 2 g/per 1 kg weight. This patient has now been under long-term treatment with these immunoglobulins, during which the skin symptoms have significantly diminished, but the concentration of monoclonal immunoglobulin has not changed. The fourth patient not responding to standard chemotherapy was treated with intravenous immunoglobulins also in a dose of 2 g/per 1 kg of weight 1× in a month. After 4 applications the thickening of skin and subcutaneous tissue moderately diminished, so the range of possible movement of the upper limbs and neck became larger and the itchy skin morphs which accompanied the disease disappeared completely.Conclusion:
It is possible to use chemotherapy and high-dose chemotherapy in the treatment of mucinosis associated with monoclonal gammopathy, as in the treatment of multiple myeloma. If such treatment is not possible or it has not attained disappearance of monoclonal immunoglobulin, improvement can be achieved through repeated application of intravenous immunoglobulins. The treatment with intravenous immunoglobulins in an immunomodulation dose of 2 g/per 1 kg of weight effects the moderation of skin manifestations, but it does not lead to the decrease in monoclonal immunoglobulin.Key words:
monoclonal gammopathy of undetermined significance – multiple myeloma – monoclonal immunoglobulin – mucinosis – papular mucinosis – scleredema – scleromyxedema
Autoři: Zdeněk Adam 1; Petr Szturz 1; Marta Krejčí 1; Vladimír Vašků 2; Luděk Pour 1; Eva Michalková 1; Sabina Ševčíková 3; Zdeňka Čermáková 4; Karel Veselý 5; Jiří Vaníček 6; Eva Pourová 7; Zdeněk Král 1; Jiří Mayer 1
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; I. dermatolovenerologická klinika LF MU a FN u sv. Anny Brno, přednosta prof. MUDr. Vladimír Vašků, CSc. 2; Ústav patologické fyziologie LF MU Brno, přednostka prof. MUDr. Anna Vašků, CSc. 3; Oddělení klinické biochemie FN Brno, pracoviště Bohunice, primář doc. MUDr. Milan Dastych, CSc. 4; I. patologicko-anatomický ústav LF MU a FN u sv. Anny Brno, přednostka prof. MUDr. Markéta Hermanová, Ph. D. 5; Klinika zobrazovacích metod LF MU a FN u sv. Anny Brno, přednosta MUDr. Jiří Vaníček, Ph. D. 6; Ordinace praktického lékaře pro dospělé Pustiměř 7
Vyšlo v časopise: Vnitř Lék 2015; 61(12): 1072-1087
Kategorie: Kazuistiky
Souhrn
Úvod:
Mucinózy typu skleredému a skleromyxedému jsou choroby s excesivní tvorbou depozit mucinu v kůži a podkoží, což způsobuje ztuhnutí kůže. Depozita v kůži a podkoží omezují pohyb končetin, hrudníku, ale i úst. Stejným mechanizmem jsou však poškozovány i další orgány (srdce, plíce, trávicí trubice). Příčinou je zřejmě stimulace tvorby mucinu ve fibroblastech imunoglobuliny, často se jedná o monoklonální imunoglobulin. Proto jsou tyto choroby obvykle asociovány s monoklonální gamapatií.Kazuistiky:
Popisujeme soubor 4 pacientů, 2krát byly kožní projevy hodnoceny jako skleredém a 2krát jako skleromyxedém. Všichni 4 pacienti měli monoklonální imunoglobulin typu IgG a měli klonální plazmocyty v kostní dřeni, prokázané histologicky a flowcytometricky. U všech jsme proto zahájili léčbu chemoterapií. V 1 případě byla tato chemoterapie zakončená vysokodávkovanou chemoterapií s transplantací autologních krvetvorných buněk. Tato léčba vedla k úplnému vymizení monoklonálního imunoglobulinu i úplnému vymizení kožních i mimokožních projevů skleredému (obstipace). V 1 případě vedla chemoterapie k hematologické parciální remisi a k částečnému zlepšení kožních projevů. Zbývající 2 pacienti nereagovali na běžnou chemoterapii. U 1 z nich stav vyústil do dermatoneurosyndromu (zmatenost, somnolence s přechodem do kómatu a křeče typu grand mal) a upravil se po intenzivní léčbě obsahující mimo jiné nitrožilní aplikaci imunoglobulinů v dávce 2 g/kg hmotnosti. Tento pacient je nyní těmito imunoglobuliny dlouhodobě léčena v důsledku této léčby se kožní příznaky výrazně zmenšily, koncentrace monoklonálního imunoglobulinu se však nezměnila. Posledního ze souboru, tedy 4 pacienta nereagujícího na standardní chemoterapii jsme léčili nitrožilními imunoglobuliny také v dávce 2 g/kg hmotnosti 1krát měsíčně. Po 4 aplikacích zesílení kůže a podkoží mírně ustoupilo, takže se zvětšil rozsah možných pohybů horními končetinami i krkem a zcela vymizely svědivé kožní morfy, které průběh onemocnění provázely.Závěr:
Pro léčbu mucinózy spojené s monoklonální gamapatií je možné použít chemoterapii a vysokodávkovanou chemoterapii jako u mnohočetného myelomu. Pokud tato léčba není možná anebo po ní nedojde k vymizení monoklonálního imunoglobulinu, je možné dosáhnout zlepšení opakovanou aplikací nitrožilních imunoglobulinů. Léčba nitrožilními imunoglobuliny v imunomodulační dávce 2 g/kg hmotnosti vede ke zmírnění kožních příznaků, ale nevede k poklesu monoklonálního imunoglobulinu.Klíčová slova:
mnohočetný myelom – monoklonální gamapatie nejistého významu – monoklonální imunoglobulin – mucinóza – papulární mucinóza – skleredém – skleromyxedémÚvod
Mucinózy je termín pro skupinu velmi vzácných chorob, které jsou charakterizovány hromaděním mucinu – mukopolysacharidů (glukosaminoglykanů) v kůži a podkoží, ale i v jiných orgánech a tkáních. Protože jsou změny kožního povrchu zřetelné již na první pohled a hlavně na pohmat, jsou tyto nemoci popisovány především v učebnicích dermatologie.
Skleredém a skleromyxedém je název pro velmi podobné nemoci. Jejich společným projevem je zesílení kůže a podkoží, způsobné akumulací mucinu až do té míry, že kůže představuje krunýř, omezující pohyb úst a končetin. U skléromyxedému se mohou vytvářet skupiny papul a mění se i barva kůže. Přítomnost monoklonálního imunoglobulinu je společná jak pro skleredém, tak pro skleromyxedém a dále v textu je diskutována i etiologická souvislost. Obě nemoci, skleredém i skleromyxedém, postihují nejenom kůži, ale také vnitřní orgány a tkáně a také centrální nervový systém [1].
Cílem následujícího příspěvku je poukázat na tyto choroby, které svojí etiopatogenzí, přítomností monoklonálního imunoglobulinu i způsobem léčby patří jak do oblasti dermatologie, tak do oblasti hematologie a celé vnitřní medicíny.
V textu popisujeme vlastní zkušenosti s léčbou 4 nemocných a v diskusi podrobně rozvádíme všechny publikované zkušenosti s léčbou. Na základě tohoto přehledu jsme po schválení revizními lékaři zdravotních pojišťoven volili léčbu i našich pacientů. Uvedené choroby jsou tak vzácné, že neexistují žádné randomizované studie, z nichž by bylo možné vyvodit pravidla pro léčbu. Ve světové medicínské literatuře jsou jen popisy jednotlivých případů či menších skupinek nemocných různě léčených. A z těchto údajů je nutno vycházet při rozhodování o léčbě konkrétního nemocného (www.vzacne-diagnozy.cz).
Popis 4 případů
Od roku 2000 jsme na našem pracovišti léčili celkem 4 pacienty. Z komplikací typických pro tyto nemoci jsme se u všech pacientů setkali s poruchou pasáže a obstipací, v 1 případně s primární plicní hypertenzí a v 1 případě s akutní komplikací – dermatoneurosyndromem.
Případ 1: žena (ročník 1949)
Žena, narozená roku 1949, se systémovými projevy mucinózy typu skleromyxedému, přišla na naše pracoviště poprvé v prosinci roku 2009, tedy ve věku 60 let. Před tím byla vyšetřována a léčena na I. dermatovenereologické klinice FN u sv. Anny v Brně. V roce 2010 proběhlo poslední kontrolní histologické vyšetření kůže. Patolog popsal rozšíření dermis pod úroveň potních žláz, hrubé snopce kolagenu byly odděleny množstvím mucinu. Na zvýšené celularitě dermis se podílely fibroblasty. Zánětlivý infiltrát byl velmi mírný. Nález hodnocen jako skleromyxedém s počínající sklerotizací. Ve srovnání s předchozí histologií bylo vazivo nyní vyzrálejší a množství hlenu (mucinu) nižší. Přítomnost monoklonálního imunoglobulinu v kožní biopsii patolog vůbec nezmiňoval a také po ni nepátral. Kožní specialisté poté, co uzavřeli diagnózu jako skleromyxedém, začali léčit pacientku hydrokortizonem a acitretinem (Neotigason) a lokální aplikací steroidů.
Na naše pracoviště přišla poprvé v roce 2009 k vyšetření monoklonální gamapatie. Pacientka měla povšechně zesílenou kůži a podkoží a dále měla na předloktí, na rukou a na obličeji papulózní projevy béžové barvy a voskového lesku. Kůže zesílená mucinovými hmotami měla střídavě bledou a lividní barvu (obr. 1–4). V rámci komplexního hematologického vyšetření byla provedena trepanobiopsie lopaty kosti kyčelní. Histologické vyšetření odebraného válečku kostní dřeně popsalo 2–4 % plazmocytů, které byly klonální a exprimovaly lehké řetězce kappa. Klasické cytologické hodnocení aspirátu a nátěru kostní dřeně popsalo pouze 1,6 % plazmocytů bez stanovení klonality. Flowcytometrické vyšetření kostní dřeně popsalo 0,4 % plazmocytů a převažovaly patologické klonální plazmocyty CD19-CD56 - s heterogenní expresí CD27 a CD117.
Obr. 1. Fotografie kůže pacientky se skleromyxedémem: dobře patrná je lineární konfigurace papul 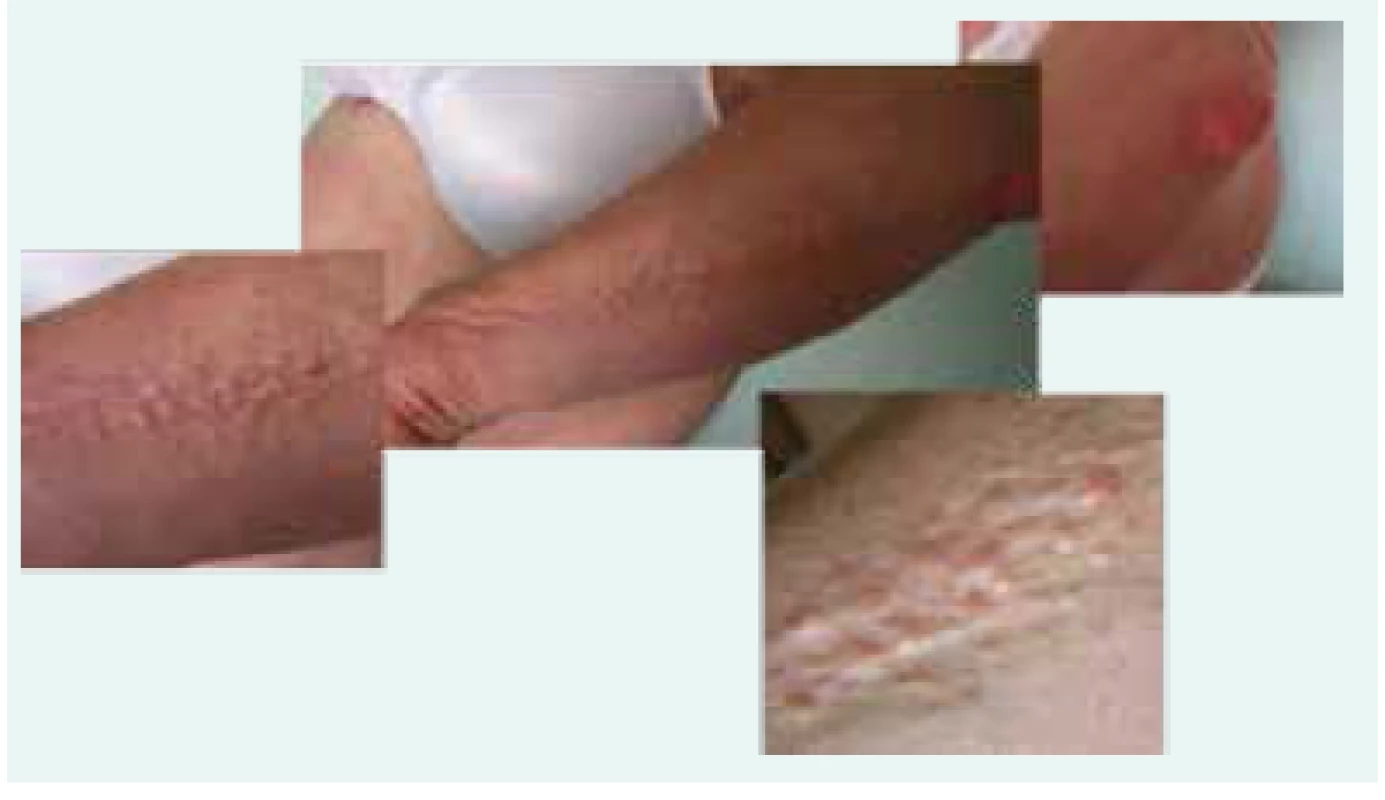
Obr. 2 a obr. 3. Mramorovaná kůže pacientky se skleromyxedémem: místy bledá, místy lividní 
Obr. 2. Struktura ztluštělé kůže pacientky se skleromyxedémem 
Dále byl vyšetřován skelet metodou PET-CT vyšetření bez průkazu osteolytických ložisek. Dle CT bylo vysloveno podezření na osteoporózu, měření kostní denzity metodou Dexa nebylo provedeno. Monoklonální imunoglobulin (M-Ig) typu IgG κ byl prokázán v koncentraci 9,0 g/l.
Vzhledem k průkazu klonálních plazmocytů v kostní dřeni histologicky i metodou flowcytometrie a M-Ig byla diagnóza dle kritérií Myeloma Working Group (MWG) z roku 2003 stanovena jako symptomatický mnohočetný myelom.
Badatelské poznatky se v průběhu času rozšiřují a v souvislosti s tím se mění i názory na podstatu problémů, a tedy i kritéria pro diagnostiku nemocí. Durie a Salmon ve svých původních kritériích požadovali přítomnost alespoň 10% infiltraci plazmatickými buňkami. Kritéria International Myeloma Working Group (IMWG) z roku 2003 definují sice asymptomatický myelom přítomností 30 g/l a více monoklonálního imunoglobulinu a/nebo infiltrací kostní dřeně klonálním plazmocyty 10 % a více a nepřítomností klinických symptomů myelomu. V definici symptomatického myelomu však tato kritéria neuvádějí žádné procentuální limity pro počty plazmocytů ani pro koncentraci monoklonálního imunoglobulinu. Kritéria IMWG z roku 2003 pro symptomatický mnohočetný myelom vyžadují pouze průkaz poškození organizmu myelom a přítomnost plazmocytů (klonálních) v kostní dřeni a/nebo přítomnost monoklonálního imunoglobulinu v séru nebo v moči, ale bez jakékoliv hranice pro jeho koncentraci. Dle International Myeloma Working Group kritérií z roku 2003 stačí ke stanovení diagnózy symptomatického myelomu prokázat klonální buňky v kostní dřeni a/nebo přítomnost monoklonálního imunoglobulinu a hlavně prokázat poškození organizmu myelomem [2]. Tato nová kritéria z roku 2003 odrážejí poznání, že v některých případech jsou plazmatické buňky nahloučené v ložiscích a necílená punkce, které se netrefí do ložiska, prokáže menší počet plazmocytů než je 10 %. A odrážejí také skutečnost, že plazmatické buňky mohou poškodit nemocného i při počtu nedosahujícím 10 %, jak je tomu v tomto případě. Proto považujeme tato kritéria symptomatického myelomu z roku 2003 za vhodnější pro praxi než původní starší kritéria Durieho a Salmona, a proto jsou převzata do Doporučení pro diagnostiku a léčbu mnohočetného myelomu, vydaného Českou myelomou skupinou v roce 2012 [3].
Chemoterapie byla zahájena v září roku 2010 kombinací cyklofosfamidu, bortezomibu a dexametazonu. Pacientka dostala celkem 7 cyklů chemoterapie, léčba byla ukončena v dubnu roku 2011. Efekt protimyelomové léčby lze charakterizovat termínem parciální remise, koncentrace M-Ig poklesla z 9,0 na 3,9 g/l. V průběhu léčby se dočasně zmenšily kožní projevy. Pacientka uvedla, že pociťovala změknutí kůže a podkoží, ale změny na kůži odpovídající skleromyxedému byly stále patrné.
Průběh léčby byl komplikován pravostrannou srdeční slabostí s retencí tekutin. Echokardiografické vyšetření prokázalo plicní hypertenzi, takže jsme logicky pomýšleli na sukcesivní plicní embolizaci. V průběhu léčby však nebyly zachyceny zvýšené D-dimery, i když byly opakovaně vyšetřovány. CT angiografie nebyla provedena. O diferenciální diagnózu hypertenze v plicním oběhu jsme požádali kardiology, kteří dospěli k závěru, že se jedná o velmi těžkou primární prekapilární plicní hypertenzi (PAMP 57 mm Hg). Proto pacientce předepsali mimo jiné Revation 20 mg tablety (sildenafilum 20 mg). Tento lék u pacientů s plicní arteriální hypertenzí vede k selektivní vazodilataci plicního řečiště a v menší míře i k systémové vazodilataci.
Po ukončení chemoterapie se opět koncentrace M-Ig v séru pomalu zvyšovala z nejnižší hodnoty po léčbě 3,9 g/l na hodnoty mezi 6–7 g/l v séru a pacientka udávala, že se zhoršují i kožní projevy nemoci.
Stanovení diagnózy primární plicní hypertenze a zahájení specifické léčby však nevedlo již k zásadnímu oběhovému zlepšení. Dušnost a fyzická nevýkonnost dominovaly v klinickém obraze a znemožňovaly další intenzivní protimyelomovou léčbu. Léčbu obsahující talidomid či lenalidomid jsme nepodávali, neboť oba léky indukují hyperkoagulaci a zvyšují četnost tromboembolických komplikací. Pacientka 8. 8. 2013 zemřela doma zřejmě v souvislosti s plicní hypertenzí.
Uvedený případ dokumentuje nepatrné zlepšení kožních projevů při parciální hematologické remisi a opětovné zhoršení kožních projevů při vzestupu koncentrace M-Ig a dále vznik primární plicní hypertenze v průběhu této formy mucinózy typu skleromyxedému.
Případ 2: muž (ročník 1953)
Muž, narozený roku 1953, měl v anamnéze diabetes mellitus léčený perorálními antidiabetiky již od roku 2003. Na naše pracoviště přišel poprvé v listopadu roku 2011. Při přijetí byla nápadná tuhá zesílená kůže a podkoží (v lékařských zprávách s rozpaky popisována jako otok kůže). Pacient měl maskovitý výraz obličeje bez možnosti mimiky. Ztuhlost kůže a podkoží v obličeji byla tak velká, že nemocný měl potíže s příjmem potravy, protože ztuhlost postihovala i pohyby úst (obr. 5 a 6). Pacient trpěl urputnou zácpou, defekoval i při podávání projímadel maximálně 1krát za týden. Bylo provedeno klasické vyšetření, které potvrdilo mnohočetný myelom: M-Ig typu IgG κ v koncentraci 36 g/l a na RTG snímcích skeletu mnohočetná osteolytická ložiska a kompresivní fraktury obratlů. MR zobrazení hrudní a bederní páteře prokázalo difuzní postižení kostní dřeně a objemné expanzivní ložisko ve sternu. Kostní dřeň byla vyšetřena metodou trepanobiopsie z lopaty kosti kyčelní. Při cytologickém hodnocení napočítáno 6,6 % plazmocytů, histologické vyšetření kostní dřeně popsalo variabilní zastoupení plazmocytů v kostní dřeni, v některých úsecích překračující 10 % s prokázanou klonalitou κ. Metodou flowcytometrie bylo v kostní dřeni popsáno do 0,9 % plazmocytů převážně patologického imunofenotypu CD56+ CD28+ CD117+κ+. Tato vyšetření splnila kritéria symptomatického mnohočetného myelomu dle kritérií IMWG z roku 2003.
Obr. 3. Obličej pacienta se skleredémem: mucinózní infiltrace kůže a podkožní způsobila zesílení kůže a podkoží a omezení hybnosti Omezení hybnosti kůže kolem úst výrazně ztěžovala příjem stravy. Periferní žíly nebylo možné pro ztuženost kůže napíchnout, proto byla pacientovi zavedena centrální kanyla. 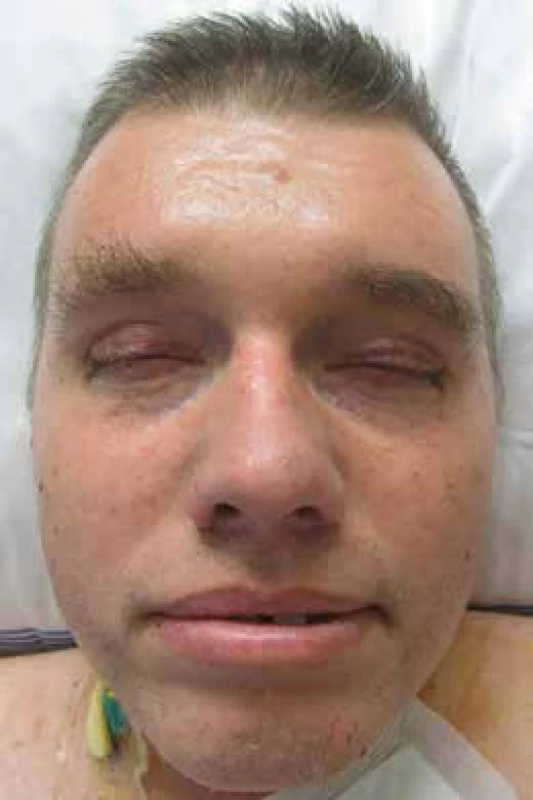
Tuto fotografii zveřejňujeme s laskavým svolením pacienta. Obr. 4. Vzhled čela pacienta se skleredémem 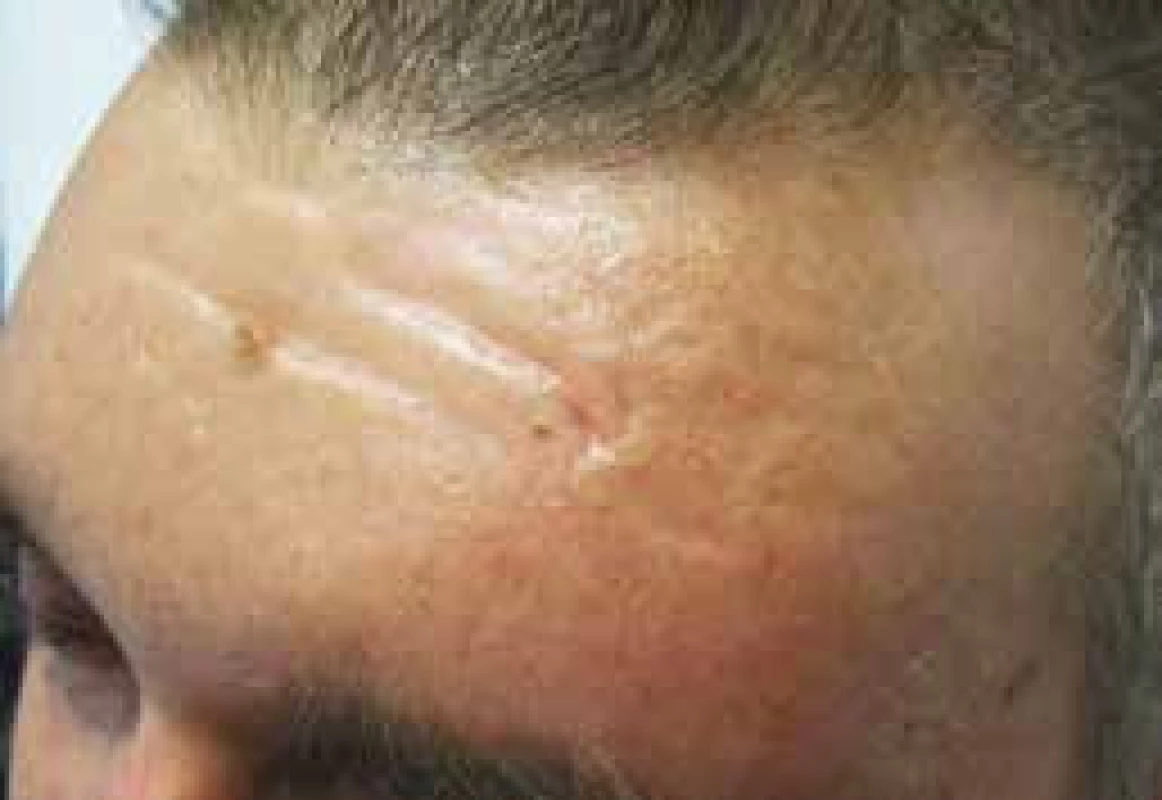
K případu proběhlo dermatologické konzilium a byla provedena biopsie kůže a podkoží a histologické vyšetření. V dermis patolog popsal malé lymfocytární perivaskulární infiltráty a hlavně zmožení mucinu (hlenu), takže společný závěr dermatologa a patologa zněl: skleredém (scleroedema adultorum Buschke).
Vzhledem k celkově špatnému stavu a k omezením, plynoucím ze skleredému, byla zahájena klasická chemoterapie cyklofosfamid, bortezomib (Velcade) a redukovaná dávka dexametazonu vzhledem k přítomnosti diabetes mellitus.
Léčebný efekt byl excelentní, pokles M-Ig byl neobvykle rychlý, po 2 cyklech léčby poklesla koncentrace M-Ig z 36,7 g/l na 3,2 g/l a po 3. cyklu již M-Ig nebyl detekovatelný.
Po 2 měsících léčby začal zřetelně ustupovat kožní nález, kůže změkla, stala se zřasitelnou. Tím se výrazně zlepšila i mimika obličeje a hybnost nemocného. Ústup skleredému a návrat struktury kůže do původního stavu vedl k zásadnímu zlepšení klinického stavu nemocného, takže jsme museli přehodnotit léčebný plán, který nepředpokládal možnost provedení intenzivní chemoterapie, a vložit do léčebného plánu i vysokodávkovanou chemoterapii. V červenci roku 2012 byla uskutečněna vysokodávkovaná chemoterapie, byl podán melfalan v dávce 200 mg/m2 a provedena transplantace autologních kmenových krvetvorných buněk. Tím byla léčba ukončena. Od července roku 2012 až doposud zůstává pacient v kompletní hematologické remisi (v březnu roku 2015 to bylo již 32 měsíců). M-Ig není metodou imunofixace prokazatelný a kůže a podkoží na pohled i pohmat vypadá zcela normálně, původní skleredém a urputná zácpa vymizely.
Uvedený případ dokumentuje, že léčba (klasická chemoterapie zakončená vysokodávkovanou chemoterapií) vedoucí k úplnému vymizení monoklonálního imunoglobulinu vedla i k úplnému a dlouhodobému vymizení kožních i mimokožních projevů skleredému.
Případ 3: muž (ročník 1956)
Muž, narozený roku 1956, byl vyšetřován od konce roku 2012 pro vznik svědivých zatuhlých ložisek na kůži trupu, šíje i hlavy. V březnu roku 2013 byla provedena biopsie kůže se závěrem skleromyxedém.
V dubnu roku 2013 byla již kůže celého těla ložiskově tuhá, mramorovitě fialovočerveně zbarvená. V dubnu roku 2013 byl, po předchozím horečnatém onemocnění, přijat pro epileptické paroxyzmy. Křeče progredovaly do epileptického záchvatu typu grand mal s kvalitativní poruchou vědomí, zmateností, která posléze přešla ze somnolence až do kómatu s rozvojem ventilačního selhání a s nutností řízené plicní ventilace. Vše bylo komplikováno sepsí a multiorgánovým selháním. Tato krize byla zvládnuta specialisty na intenzivní medicínu standardními postupy, používanými v intenzivní medicíně. Protože typ krize odpovídal dermatoneurosyndromu, tak ještě v rámci léčby na jednotce intenzivní péče byly 17. 4. 2013 podány nitrožilně imunoglobuliny v dávce 2 g/kg hmotnosti, což celkem činilo 140 g. Po nitrožilní aplikaci imunoglobulinů se stav pacienta výrazně zlepšil, dostal se do plného vědomí a obnovila se funkce ledvin.
V rámci došetření monoklonální gamapatie byla provedena trepanobiopsie lopaty kosti kyčelní. Histologické vyšetření odebraného válečku kostní dřeně prokázalo 5–20 % plazmocytů, při cytologickém hodnocení aspirátu kostní dřeně, provedeném při této trepanobiopsii, to bylo pouze 1,6 % plazmocytů. Flowcytometrické vyšetření odebrané kostní dřeně prokázalo 0,45 % plazmocytů, z toho 44,5 % plazmocytů klonálního charakteru CD20+ CD56+κ+. Biochemické vyšetření prokázalo M-Ig typu IgG κve velmi nízké koncentraci 1,9 g/l v séru. Po překonání kritického stavu se koncentrace M-Ig zvýšila a trvale se pohybuje na hodnotách 3–6 g/l. RTG vyšetření skeletu neprokázalo žádná osteolytická ložiska.
Po zlepšení stavu nemocného byla od května roku 2013 vzhledem k přítomnému M-Ig zahájena léčba cyklofosfamidem a dexametazonem (CD) v perorální formě. A od července roku 2013 byl přidán k léčbě bortezomib (Velcade), takže pacient měl trojkombinaci CVD s aplikací bortezomibu 2krát týdně dle klasického aplikačního schématu. Ale již po 3 cyklech se rozvinula závažná neuropatie, takže dále nebylo pokračováno v aplikaci bortezomibu a pacient dostával opět jen cyklofosfamid a dexametazon. Poslední aplikace cyklofosfamidu a dexametazonu proběhla v říjnu roku 2013. V průběhu léčby nedošlo k signifikantnímu poklesu koncentrace M-Ig. Při ukončení léčby v říjnu roku 2013 byla koncentrace M-Ig v séru 4,4 g/l.
Proto po schválení revizním lékařem zdravotní pojišťovny pacienta byla v listopadu roku 2013 zahájena léčba nitrožilními imunoglobuliny v celkové dávce 140 g rozdělené do 5 dní. První 3 aplikace proběhly v měsíčním intervalu, 4. byla podána v 6týdenním intervalu. Již po 3 měsících léčby nitrožilními imunoglobuliny bylo zřetelné zlepšení kožních projevů, které bylo hodnoceno jako parciální remise. Pak byla v této léčbě pauza 6 měsíců, během níž došlo opět ke zhoršení kožních projevů, a proto v měsících červenci, srpnu a říjnu roku 2014 byly podány další 3 dávky nitrožilního imunoglobulinu. Opět dosaženo léčebného efektu, charakterizovaného jako parciální remise, takže od října roku 2014 byla opět pauza v léčbě a další aplikace imunoglobulinů byla nutná až v lednu roku 2015. V té době mu byl v pořadí již po 9. aplikován nitrožilní imunoglobulin a další v pořadí 10. aplikace je plánována na měsíc březen roku 2015. Koncentrace M-Ig v séru je stabilní po celou dobu léčby, poslední hodnota z ledna roku 2015 je 5,5 g/l. Hodnoty volných lehkých řetězců κ a λ jsou stabilně ve fyziologickém rozmezí a poměru.
Uvedený případ dokumentuje, že léčba nitrožilně aplikovanými imunoglobuliny v uvedené dávce 2 g/kg 1krát měsíčně má zásadní vliv na kožní projevy, ale nemá žádný vliv na koncentraci monoklonálního imunoglobulinu. Dále tento případ ilustruje, že nitrožilně podané imunoglobuliny mají léčebný potenciální i při tak závažné akutní komplikaci, jakou je dermatoneurosyndrom.
Případ 4: muž (ročník 1959)
Pacient je na našem pracovišti sledován od března roku 2012. V té době udával, že si nejméně 3 roky, tedy od roku 2009, uvědomuje, že mu tuhne kůže a podkoží. Pacient má od roku 2009 diabetes mellitus léčený perorálními antidiabetiky. Pro kožní změny byl vyšetřován na I. dermatovenereologické klinice FN u sv. Anny v Brně. Dermatologové již v roce 2011 popisují ztuhnutí a zesílení kůže v oblasti šíje, zad, s progresí na horní polovinu trupu, obličej a horní končetiny s výraznou omezenou hybností krku ale i omezení hybnosti paží. Z dalších projevů provázejících mucinózu byla přítomna urputná obstipace, defekoval i při podávání projímadel maximálně 1krát týdně (obr. 7 a 8).
Obr. 5. Fotografie kůže pacienta z blízka 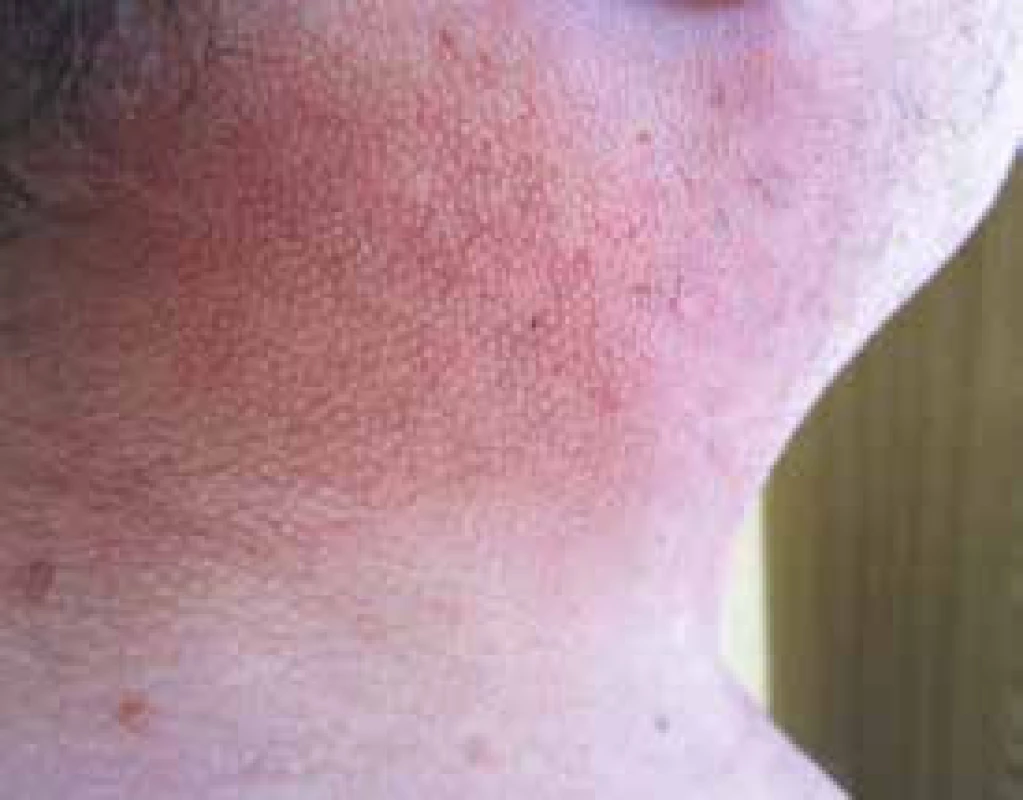
Obr. 6. MR zobrazení pacienta 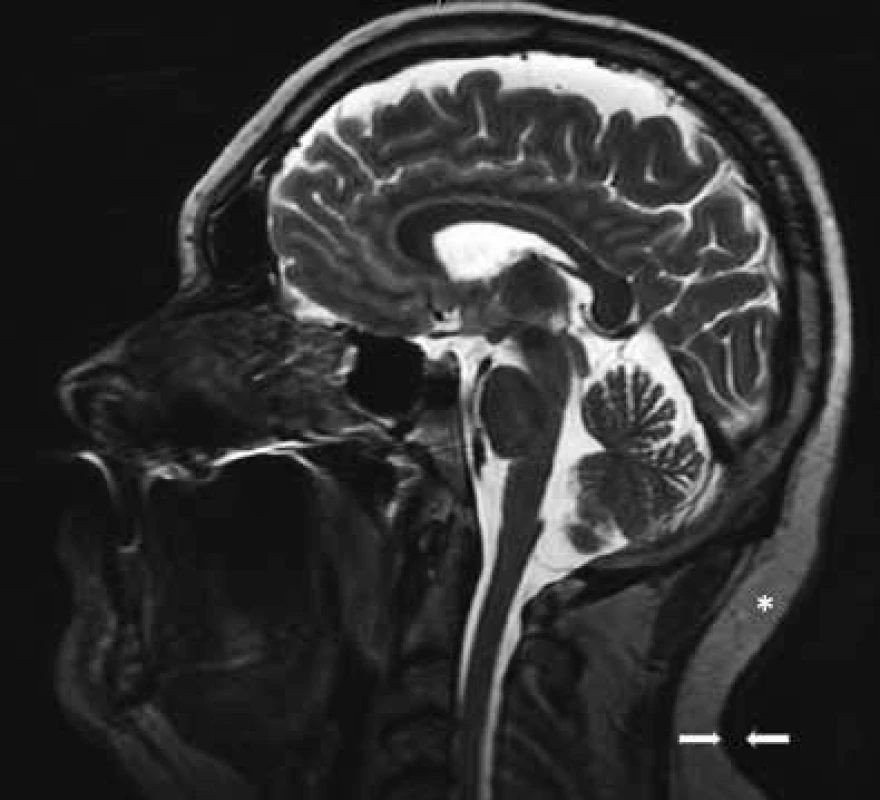
Mezi šipkami je vidět zesílení dermis až na 8 mm, normální šířka dermis je asi 3–5 mm. Hvězdička ukazuje vrstvu podkožního tuku na krku, jehož MR signál je díky fibrotizaci nižší než obvykle (3T MR přístroj, sagitální rovina T2 váženého obrazu). V pokročilých stadiích, v nichž dochází již k fibrotizaci podkoží, je jeho MR signál snížen. Byla provedena biopsie a histologické hodnocení kůže a podkoží. Jak histologický nález zmnoženého mucinu v celé retikulární dermis, tak klinický nález odpovídal diagnóze scleroedema adultorum Buschke, česky skleredém. Vzhledem k nálezu M-Ig byl pacient dále směřován k hematologickému vyšetření. Kožní specialisté vyzkoušeli léčbu penicilaminem a posléze podali acitretin (Neotigason), ale bez zjevného léčebného efektu.
Při prvním vyšetření na našem pracovišti v březnu roku 2012 jsme vyšetřili kostní dřeň metodou trepanobiopsie lopaty kosti kyčelní. Histologické vyšetření válečku kostní dřeně prokázalo 5 % plazmocytů, cytologicky bylo v kostní dřeni nalezeno 2,4 % plazmocytů, část z nich patologické morfologie. Flowcytometrické vyšetření kostní dřeně prokázalo 0,1 % plazmocytů, které byly tvořeny směsí polyklonální a klonálních plazmocytů CD56+λ+ plazmocytů.
Klasické RTG snímky skeletu neodhalily žádná osteolytická ložiska, ani později provedené PET-CT neodhalilo osteolytická ložiska či ložiska patologické akumulace fluorodeoxyglukózy. Vyšetření kostní denzity metodou DEXA však prokázalo závažnou osteoporózu (T skóre -3,1, Z skóre také -3,1) v bederní páteři. Koncentrace M-Ig v séru typu IgG λ byla nízká, jen 2,5 g/l, a hodnoty volných lehkých řetězců byly v normě.
Funkční plicní vyšetření prokázalo restrikční ventilační poruchu mírného stupně a CO difuze byla mírně snížena. Echokardiografické vyšetření popsalo hypokinézu laterální a bazální stěny srdce a globální hypokontraktilitu s ejekční frakcí 40–45 %. Pravostranné srdeční oddíly byly bez dilatace a bez známek plicní hypertenze.
Vzhledem k nízké koncentraci M-Ig jsme zpočátku vyčkávali efektu léčby předepsané dermatology (Neotigason) a v říjnu roku 2012 při známkách progrese (obtížné polykání pro tuhost úst a obstipace) jsme přikročili k chemoterapii (cyklofosfamid, doxorubicin, dexametazon – CAD). Po aplikaci 3 cyklů jsme vyhodnotili efekt – koncentrace M-Ig zůstávala stejná a kožní projevy také, takže chemoterapii CAD jsme po 3 cyklech vyhodnotili jako neúčinnou a ukončili ji. V lednu roku 2013 jsme nemocnému podali léčebnou kombinaci obsahující cyklofosfamid, bortezomib (Velcade) a dexametazon (CVD). I tato chemoterapie byla ukončena po 4 cyklech pro nedostatečnou účinnost. Koncentrace monoklonálního imunoglobulinu byla před zahájením režimu CVD 2,0 g/l a po jeho ukončení 1,5 g/l, takže i když koncentrace monoklonálního imunoglobulinu byly nízké, nedošlo k jejich vymizení. Při hodnocení vývoje skleredému v průběhu léčby CVD udával pacient zlepšení hybnosti paží, mohl s nimi udělat pohyby, které dříve nešly provést. Při pohledu a palpaci jsme zásadní zlepšení nepozorovali.
Po celou dobu pacienta trápila urputná zácpu, i s pomocí projímadel defekoval maximálně 1krát za týden. Proto byla provedena kolonoskopie, která žádné viditelné vysvětlení této zácpy nenašla. Biopsie nebyla odebrána. Po ukončení chemoterapie byl pacient jen sledován. Se zácpou a jistě i se zhoršenou vyšetřitelností břicha při velmi tuhé indurované kůži břišní stěny souvisí závažná komplikace: apendicitida s perforací a peritonitidou. Proto se dostal na delší dobu do péče chirurgů pro komplikovanou akutní břišní příhodu s obtížným hojením. U nás se objevil znovu až v lednu roku 2015. Z léčebných metod, které by mohly vést k eradikaci M-Ig v séru, nebyly zatím použity IMIDY (talidomid ani lenalidomid) z obavy z hyperkoagulačního vlivu obou preparátů. Mimoto talidomid zpomaluje pasáž trávicí trubicí. Vysokodávkovaná chemoterapie by při postižení funkce plic a srdce byla riziková.
Uvedený případ dokumentuje narušení funkce plic i srdce a trávicího traktu při skleredému tak výrazně, že vysokodávkovanou chemoterapii považujeme v této situaci za nepřiměřeně rizikovou. Proto jsme v této chvíli požádali revizní lékaře VZP o schválení léčby nitrožilními imunoglobuliny v dávce 2 g/kg (180 g celkem 1krát měsíčně). Pacient dostal uvedenou dávkou zatím celkem 4krát. Léčebnou odezvu hodnotíme dle změny rozsahu pohybů, které jsou limitovány tuhým kožním povrchem, který velmi omezuje hybnost pacienta. Pacient udává, že se mu zvětšil rozsah pohybů horními končetinami, takže například nyní je schopen sám si obléci ponožky a zašněrovat boty, což před léčbou nebyl. Dále udává zlepšení hybnosti v oblasti krku (rotace a úklony). Od první aplikace zcela vymizely ataky svědivých morf, které se objevovaly dříve nejméně 1krát týdně. Při snaze o kvantifikaci míry zlepšení udává pacient, že omezení plynoucí z tuhé kůže podkoží, která jej svírá a omezuje jako krunýř, se po 4 měsících léčby zlepšilo asi o 15–20 %.
Pokud tato léčba výrazně zmírní kožní i mimokožní příznaky skleredému, tak bychom provedli sběr kmenových buněk krvetvorby s následnou vysokodávkovanou chemoterapií, podobně jako v druhém případě.
Diskuse
Definice a klasifikace mucinóz
Mucinózy je termín pro skupinu chorob, které jsou charakterizovány hromaděním mucinu – mukopolysacharidů (glukosaminoglykanů) v kůži a podkoží, ale i v jiných orgánech a tkáních. Depozita mukopolysacharidů lze prokázat speciálním histochemickým barvením. Nahromaděné mukopolysacharidy se v jednotlivých případech liší nepatrně svým chemickým složením. Dermální mucin je produkován za normálních okolností fibroblasty a je složen z kyselých glykosaminoglykanů. Epitelový mucin, tvořený kyselými a neutrálními glykosaminoglykany, je produkován v potních žlázkách a ve vlasových folikulech. Autoři učebnic dermatologie rozdělují mucinózy do několika klinických jednotek, které uvádí tab. 1 [1,4].
Tab. 1. Přehled základních kožních mucinóz [1,4] ![Přehled základních kožních mucinóz [1,4]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/741fb3e814c89431a964c5328821538d.png)
Mucinózy se vyskytují velmi vzácně. Odborná literatura uvádí jen počty popsaných případů, jejich počet se pohybuje ve stovkách, ale vůbec neuvádí informaci o incidenci. Při zadání hesla mucinóza, skleredém, skleroedem a skleromyxedém jsme v české a slovenské literatuře nalezli celkem jen 8 publikací, zmiňujících uvedené vzácné choroby [5–11].
Klinické projevy skleromyxedém a skleredému
Lichen myxedematosus a skleromyxedém (synonymem papulární mucinóza)
Kožní projevy skleromyxedému
Jsou to vzácná onemocnění ze skupiny mucinóz, s výsevem papilomatózních projevů, podmíněných depozity mucinu v koriu a fibroprodukcí. Typické jsou bělavé, drobné, ploché, lesklé a tuhé, často lineárně uspořádané nahloučené papuly barvy kůže (vosku), někdy se sklonem ke splývání do ložisek. Papuly velikosti 2–3 mm se nacházejí na rukou, předloktí, tváři, krku, a horní části trupu. Současně dochází ke ztluštění kůže prakticky celého těla. Generalizované projevy s výrazným zmnožením vaziva a se vznikem tuhé kůže, omezující hybnost, připomínající systémovou sklerodermii či skleredém, bývají označeny jako skleromyxedém. Ztuhlá kůže může být mramorovaná, někde bledá, jinde lividní, podobně jako u naší pacientky (případ 1) [1,4].
Histopatologicky je typické nahromadění hlenu (chemicky glykosaminoglykanů) v dermis kůže, které je doprovázené proliferací fibroblastů a zmnožením kolagenu v horní a střední dermis. Fibroblasty jsou nepravidelně uspořádané a kolagen má vágně vírovité řazení. Kolem cév jsou často řídké lymfocytární infiltráty [1,4].
Dlouhodobé mimokožní projevy skleromyxedému
Nemocní se skleromyxedémem mohou mít postiženy a poškozeny i další orgány. Postižení trávicí trubice touto mucinózou způsobuje poruchu pasáže jícnem, žaludkem i tlustým střevem. Zácpou trpěli i naši pacienti.
Postižení svalů se projevuje svalovou slabostí a mohou být i zvýšené hodnoty myoglobinu a kreatinkinázy.
Poškození plic se manifestuje restrikční, méně často obstrukční ventilační poruchou. Poškození plic může být asociováno s plicní hypertenzí [12]. Zda se jedná o kauzální souvislost či koincidenci nebylo zatím objasněno. V našem souboru 4 pacientů byla v 1 případě diagnostikována primární plicní hypertenze. Patologické výsledky funkčního vyšetření plic má i poslední popsaný pacient.
Literatura popisuje u osob se skleredém také kardiomyopatií, nefropatii a také artritidu. Echokardiografické vyšetření posledního pacienta popsalo hypokontraktilitu srdce. Kloubní postižení bývá někdy dokumentováno scintigrafickými metodami [13,14].
V patogenezi orgánového poškození, které může postihnout kterýkoliv orgán, mají významnou roli mucinová depozita v medii a v adventicii cév těchto orgánů.
Akutní komplikace – dermatoneurosyndrom
Akutní, život ohrožující komplikace, způsobuje poškození mozkových cév a mozku touto chorobou. Neurologické komplikace mucinóz jsou velmi pestré, od nejlehčích, které se manifestují třeba jen jako nevýrazné závratě či změny kognitivních funkcí až po závažné neurologické symptomy, poruchy vědomí typu somnolence, soporu a kómatu a křečové stavy. Pro závažnou neurologickou poruchu u osob s mucinózou se používá termínu „dermatoneurosyndrom“. Tímto termínem se označuje kritická, život ohrožující porucha vědomí až úrovně kómatu, často komplikovaná záchvaty křečí.
Dermatoneurosyndrom může následovat v intervalu několika týdnů po prodělaném horečnatém onemocnění, které jakoby bylo spouštěčem této komplikace.
Zobrazení mozku metodou CT v průběhu této ataky bývá zpravidla normální a ve vyšetření mozkomíšního moku v průběhu dermatoneurosyndromu nebyly popsány žádné typické patologické změny. A stejně tomu bylo i u našeho pacienta s dermatoneurosyndromem.
Při adekvátní léčbě, zahrnující plazmaferézu a nitrožilní podání imunoglobulinů ve vysokých dávkách, se popisuje úprava této dramatické ataky.
Příčina dermatoneurosyndromu není jasná. Obvyklé sice bývá přítomen M-Ig, avšak v nízké koncentraci, takže není možné se domnívat, že by dermatoneurosyndrom byl projev hyperviskozity [15,16]. Akutní ataku dermatoneurosyndromu prodělal jeden z našich pacientů (případ 3), nitrožilní podání imunoglobulinů přispělo k úpravě. Nitrožilní podání vysokých dávek má výrazný imunomodulační efekt, a proto se používá při zvládání některých život ohrožujících projevů autoimunity, např. vzestupná polyradikuloneuritis, závažná imunitní trombocytopenie a jiné. Pozitivní účinek vysokých dávek imunoglobulinů svědčí pro autoimunitní mechanizmus popisovaného dermatoneurosyndromu.
Skleredém (scleroedema)
Skleredém (scleroedema adultorum Buschke) je charakterizován indurací kůže s predilekcí pro tvář, šíji, ramena a horní část trupu. Postihuje osoby v každém věku. Skleredém je vzácné onemocnění s depozity mucinu v rozsahu celého koria. Dochází k postupnému vzniku tuhé, nezřasitelné kůže, postihující hlavu, krk, horní partie trupu a někdy i končetiny. Proces přechází i do podkoží a do podkožního tuku. U osob s klinicky manifestním skleredémem může dojít k poškození trávicího ústrojí, srdce plic a svalů, stejně jak je popsáno u osob se skleromyxedémem. V případně skleredému se literární prameny shodují na 2 klinických formách [1,4].
Histopatologicky je ztluštění retikulární dermis, kolagenní vlákna jsou rozšířená a navzájem separovaná hromaděním hlenu v různém množství. Epidermis a kožní adnexa jsou intaktní. Acelulární fibróza dermis skleredému tak kontrastuje výraznou fibroblastickou proliferací u skleromyxedému.
Klinický průběh – transitorní anebo chronický
Velmi výjimečná první, tranzitorní forma nasedá na horečnaté onemocnění. Skleredém se objeví po 4–6 týdnech po odeznění horečnatého onemocnění a má tendenci ke spontánnímu ústupu a úpravy kůže a podkoží do původního stavu.
Druhá forma má chronicky progresivní průběh. Obvykle v anamnéze není zjistitelné žádné horečnaté onemocnění, ale pouze postupně se zhoršující kožní projevy, zesílení kůže a podkoží omezující pohyb. Tato forma má dlouholetý průběh, zesilující a tuhnoucí kůže a podkoží postupně více a více limituje hybnost úst, hybnost končetin i dýchací pohyby hrudníku. Nemocný člověk jakoby byl uzavřen v krunýři, který jej velmi omezuje. A k tomu se přidává poškození vnitřních orgánů, jak je popsáno u projevů předchozí jednotky, skleromyxedému [1,4]. Chronická forma popisována jak u diabetiků závislých na inzulinu, tak u pacientů s monoklonální gamapatií a výjimečně i bez těchto 2 chorob.
Diferenciální diagnóza skleredému
Skleredém a skleromyxedém má společnou charakteristiku – zesílení kůže. Skleredém postihuje obvykle hlavu, krk, šíji a hrudník, tedy celkové postižení, zatímco skleromyxedém může být lokalizovaný a mimo zesílené kůže jsou na kůži viditelné papuly barvy včelího vosku. V některých případech nemusí být zcela zřejmé, zda postižení nazvat skleredémem či skleromyxedémem.
Zásadní rozdíl je v tom, že skleromyxedém na rozdíl od skleredému je navíc provázen výskytem papulárních formací. Některé učebnice dermatologie uvádějí, že při skleredému není možné posunout kůži oproti spodině, zatímco u skleromyxedému to možné je. V případně skleromyxedému se častěji popisují generalizované orgánové poškození než u skleredému, ale zřejmě u obou těchto jednotek je nutno počítat s tím, že patologické projevy postihují a poškozují i další orgány a tkáně. U obou jednotek, skleredému a skleromyxedému je velmi často prokazatelný M-Ig.
V rámci diferenciální diagnózy jsou uváděny následující jednotky: systémová sklerodermie, eozinofilní fasciitida a hlavně skleromyxedém. Od systémové sklerózy se pacienti se skleredémem liší nepřítomností Raynaudova fenoménu, nepřítomností akrální sklerózy a nepřítomností antinukleárních protilátek (ANA a další) [17].
Etiologie mucinóz typ myxedému, skleromyxedému a skleredému
V rámci etiopatogeneze zmíníme etiologii jak dermálních mucinóz u tyreopatií, tak u ne-tyreoidních mucinóz, neboť u všech typů je pravděpodobná autoimunitní etiopatogeneze.
Etiopatogeneze myxedému u tyreopatií
Všeobecně známé extratyreoideální projevy hypotyreózy při Gravesově Basedově chorobě jsou spojeny se zvýšenou tvorbou a akumulací mucinu v určitých oblastech. Gravesova orbitopatie se vyskytují u 25 % nemocných s autoimunitní hypotyreózou, tyreoidní dermopatie (zvaná též pretibiální myxedém) u 1,5 % nemocných, kožní změny zvané „acropachy“ jen u 0,3 % pacientů s Gravesovou hypotyreózou. Uvedené extratyreoideální projevy hypotyreózy mají autoimunitní příčinu, zřejmě zprostředkovanou protilátkami proti TSH receptoru, které stimulující také fibrocyty v určité lokalizaci ke tvorbě mucinu.
A protože systémová léčba glukokortikoidy mívá nedostatečnou léčebnou odezvu, tak současná léčba středně těžké a těžké Gravesovy orbitopatie používá následující modality: radioterapii, imunosupresi cyklosporinem a nově se v této indikaci používá rituximab, podobně jako u jiných autoimunitních chorob [18].
Etiopatogeneze skleromyxedému
Starší práce popisují stimulující vliv séra pacientů se skleromyxedémem na proliferaci fibroblastů, na tvorbu hyaluronové kyseliny a na tvorbu prostaglandinu E lidskými fibroblasty [19,20]. V těchto publikacích však nebylo blíže specifikováno, která molekula má tento stimulační účinek.
Později bylo prokázáno, že u 80 % osob se skleromyxedémem je přítomný M-Ig. Nicméně diagnózu symptomatického mnohočetného myelomu splní snad jen 10 % nemocných. U většiny osob se skleromyxedémem odpovídá plazmocelulární proliferace v kostní dřeni low-grade plazmocelulární gamapatii neboli monoklonálního gamapatii nejistého významu (monoclonal gammopathy of unknown significance – MGUS) [21].
Rongioletti et al v roce 2013 popisuje kolektiv 30 osob se skleromyxedémem. U 27 z nich byl v séru detekován M-Ig, ale u žádného nebyla splněna diagnóza mnohočetného myelomu. U 30 % z nich bylo zjištěno orgánové poškození [22].
M-Ig v nízké koncentraci většinu svých nositelů nepoškozuje, nicméně v menšině případů je popisováno zaměření antigenní determinanty M-Ig proti některému z autoantigenů, se vznikem závažných klinických příznaků. Přehled prokázaných vazeb monoklonálního imunoglobulinu na autoantigeny a touto vazbou vyvolaných patologických změn v organizmu popisujeme v jiném textu [23].
Nicméně je otázka, zda je kauzální souvislost mezi monoklonálním imunoglobulinem a kožními změnami skleromyxedému, nebo zda oba tyto jevy mají stejnou vyvolávající příčinu, takže spolu koexistují. Dosažení kompletní hematologické remise u mnohočetného myelomu a vymizení skleromyxedému či skleredému se dají vysvětlit jako průkazu příčinné souvislosti mezi M-Ig a těmito mucinózami. M-Ig v těchto případech zřejmě stimuluje fibroblasty v kůži a v podkoží k nadměrné tvorbě mucinu. Úplné vymizení skleredému i obstipace, která provázela skleredém, jsme i my pozorovali u 2. popsaného pacienta, u něhož vysokodávkovaná chemoterapie vedla k dlouhodobému vymizení M-Ig.
Nicméně je fakt, že existují i případy skleredému a skleromyxedému bez M-Ig. V těchto případech jsou buď fibroblasty stimulovány imunoglobulinem v tak nízké koncentraci, že monoklonalita imunoglobulinu není prokazatelná, nebo bude existovat ještě jiný spouštěcí mechanizmus. Je pravděpodobné, že i jiná, v následujícím odstavci popsaná onemocnění, probíhající paralelně s mucinózou, mohou stimulovat tvorbu imunoglobulinu v nízké koncentraci, který stimuluje tvorbu mucinu ve fibroblastech. Také účinnost imunosupresivní léčby svědčí pro autoimunitní mechanizmus vzniku mucinóz.
Etiopatogeneze chronické formy skleredému
Nemoc bývá pozorována častěji u diabetiků, a proto byla dávána do souvislosti s diabetes mellitus. Nicméně není jasné, zda obě nemoci mají společný vyvolávající mechanizmus nebo zda mezi diabetes mellitus a skleredémem je příčinná souvislost. Hyperglykemie přímou příčinou skleredému zřejmě nebude, neboť diabetes mellitus je velmi častá choroba a jen zcela výjimečně je diabetes mellitus provázen skleredémem.
U nemocných se skleredémem byly současně popsány i další choroby, sarkoidóza, karcinoid, karcinom žlučníku a další maligní choroby a bylo spekulováno o možné souvislosti [24–27].
Ale také byla popisována přítomnost skleredému u osob se systémovými nemocemi pojiva [28].
Již od 80. let minulého století let je známo, že osoby se skleredémem mívají často přítomný M-Ig. Koncentrace M-Ig je obvykle v nízké koncentraci, odpovídající monoklonální gamapatii nejistého významu (MGUS). Vzácněji jsou popisovány vyšší M-Ig, odpovídající symptomatickému myelomu. A zcela výjimečně byl popsán souběh skleredému a Waldenströmovy makroglobulinemie [29–33].
Asi u poloviny publikovaných případů skleredému, citovaných v tomto textu, byla popsána přítomnost M-Ig. Především jsou to dermatologické publikace, a tak výsledek imunofixační elektroforézy a denzitometrie není obsažen ve všech popisech případů, neboť tyto metody jsou dominantně používány při vyšetřování krevních chorob. Přesnější vyjádření než že: „monoklonální imunoglobulin je u osob se skleredémem často nalézán“, jsme v odborné literatuře nenašli.
Popisy případů skleredému a MGUS či mnohočetného myelomu, u nichž protimyelomová léčba navodila kompletní hematologickou remisi a současně i vymizení skleredému, signalizují, že M-Ig a skleredém spolu mohou etiopatogeneticky souviset podobně jako u osob se skleromyxedémem.
Na základě uvedených faktů se domníváme, že vznik uvedených ne-tyreoideálních i tyreoideálních mucinóz je indukován autoprotilátkami a že tyto autoprotilátky mohou být někdy přítomné jen v nízké koncentraci, nesplňující charakter M-Ig, zatímco v jiných případech tyto protilátky již splňují charakteristiku M-Ig, produkovaného klonem plazmocytů v kostní dřeni, většinou indolentního charakteru (MGUS) a méně často charakteru symptomatického mnohočetného myelomu.
Léčba skleredému a skleromyxedému
V literatuře lze najít velmi různorodé léčebné postupy, které dosahovaly většího či menšího efektu. Uvedeme přehled informací o léčbě z literatury, které jsou základem pro rozhodování o léčbě.
Léčba kortikoidy
Kortikoidy jsou často používány s ideou zamezit proliferaci vaziva a zastavit zánětlivé změny. Proto byly použity i s cílem zastavit proliferaci vaziva a tvorbu mukopolysacharidů u obou mucinóz. V případě skleredému a skleromyxedému se sice v literatuře objevily ojedinělé pozitivní zprávy [34,35]. Většina autorů se shoduje na tom, že efekt monoterapie kortikoidy byl malý, ne-li žádný. Rongioletti, který zveřejnil hodnocení největšího souboru, 30 nemocných, uvádí, že monoterapie glukokortikoidy neměla žádný klinicky významný přínos [22]. Podobně je tomu také u Gravesovy orbitopatie, při níž léčba glukokortikoidy většinou nepřináší zásadní zlepšení [18].
Léčba nitrožilními imunoglobuliny
Preparáty nitrožilních imunoglobulinů IgG obsahují polyklonální imunoglobulin typu IgG od tisíců dárců. První rozpoznanou indikací nitrožilních imunoglobulinů byly infekce a později preventivní pravidelné podávání u pacientů s vrozeným imunodeficitem, nebo imunodeficitem získaným při mnohočetném myelomu, chronické B lymfatické leukemii a případně u Waldenströmovy makroglobulinemie. Při dlouhodobé substituci imunoglobulinů se podává obvykle 0,2 g/kg ve 3–4týdenních intervalech [36].
Skutečnost, že zatímco substituce fyziologických dávek vede k posílení imunity, tak aplikace vysokých dávek, obvykle 2 g/kg hmotnosti pacienta, podávané v průběhu 2–5 dní, způsobuje imunosupresi či imunomodulaci, byla rozpoznána a publikována až v roce 1981 u dítěte s imunitní trombocytopenií [37]. Tehdy podávání imunoglobulinů vedlo k vzestupu počtu trombocytů. Od té doby se začala testovat léčba nitrožilními imunoglobuliny u všech autoimunitních a autoinflamatorních poruch. Nitrožilní léčba vysokými dávkami imunoglobulinů vede k rychlému poklesu prozánětlivých cytokinů a projevů zánětu, a to i u autoimunitních procesů zcela rezistentních na léčbu glukokortikoidy. Přesný mechanizmus účinku nebyl zatím vysvětlen, i když tato léčba je používána již více než 30 let. Předpokládá se, že obsazení všech receptorů pro Fc fragment imunoglobulinů infundovanými imunoglobuliny potlačí autoimunitní a autoinflamatorní reakce. Zatím jsou popsány jen dílčí mechanizmy, ale globální vysvětlení, proč vysoké dávky nitrožilně aplikovaných imunoglobulinů mají potenciál potlačit autoinflamatorní či autoimunitní zánět, refrakterní na glukokortikoidy zatím máme jen částečný [38,39].
Autoimunitní reakce začíná v autoreaktivním lymfocytu, který tvoří autoprotilátky a uvolňuje je do oběhu. Autoprotilátky najdou svůj cíl, naváží se na něj a poškodí jej formou autoimunitní reakce. Léky, které klasicky používáme k tlumení autoimunitní reakce, jako je prednison, metotrexát, případně cyklofosfamid, azatioprin (Imuran) i cyklosporin tlumí aktivitu autoreaktivních lymfocytů a snižují produkci autoprotilátek případně buněčnou imunitu, ale již zásadním způsobem neovlivňují to, co způsobí již jednou do oběhu uvolněné autoprotilátky. Hlavním cílem působení těchto klasických imunosupresiv jsou autoimunitu způsobující lymfocyty a již ne poškození, které vznikne navázáním autoprotilátky.
Oproti tomu se liší mechanizmus imunomodulačního působení vysokých dávek imunoglobulinů tím, že obsazení receptorů pro Fc fragment imunoglobulinů blokuje účinek cirkulujících autoreaktivních protilátek. Vysokodávkované imunoglobuliny tedy blokují vazbu cirkulujících autoprotilátek, a zamezují tak poškození organizmu cirkulujícími autoprotiltákami. Jinak řečeno: imunomodulační efekt vysokododávkovaných imungolobulinů se neodvozuje od zásahu na úrovni autoimunitních lymfocytů, ale inhibicí poškození organizmu autoprotilátkami a autoimunitní reakcí. Tím lze vysvětlit, proč dále popsané pokusy ovlivnit skleredém klasickými imunosupresivy (kortikoidy, cyklosporinem, metotrexátem) selhaly. Tato imunosupresiva nemají potenciál potlačit tvorbu monoklonálního imunoglobulinu, který autoimunitní poškození způsobuje a nepůsobí na probíhající reakci, vyvolanou vazbou monoklonální protilátky s autoimunitní aktivitou. Ovlivnit reakci cirkulujícími monoklonálními protilátkami s autoimunitní aktivitou mohou pouze imunoglobuliny ve vysokých dávkách svojí vazbou na receptor pro Fc fragment imunoglobulinů [38,39].
Z uvedeného vyplývá, že IVIG rozhodně nepatří mezi klasická imunosupresiva, neboť málo ovlivňují centrální část autoimunitní reakce. Asi významnější je jejich schopnost ovlivnit hladinu již vytvořených autoprotilátek. Hlavním místem působení je ale ovlivnění zánětu, ať již autoimunitního nebo jiného původu. Nejdůležitějším efektem IVIG je ovlivnění efektorové fáze imunitní reakce. To vysvětluje, proč často nejsou klasická imunosupresiva a IVIG jednoduše zaměnitelná.
Přehled indikací vysokých dávek imunoglobulinů uvádí tab. 2. Tato tabulka není výčtem naprosto všech chorob, u nichž je přínosná v určitých situacích léčba nitrožilními imunoglobulinu, ale informuje alespoň o těch nejčastějších a informuje o tom, jaké různorodé jsou důsledky autoimunity.
Tab. 2. Výčet nejčastějších indikací imunomodulační léčby vysokými dávkami nitrožilně aplikovaných imunoglobulinů [38,39] ![Výčet nejčastějších indikací imunomodulační léčby vysokými dávkami nitrožilně aplikovaných imunoglobulinů [38,39]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8d1d66fa18b2f7e741fecaae4cfceaf0.png)
Literatura pojednávající o léčbě skleromyxedému a skléredému popisuje velmi často klinicky signifikantní léčebný efekt nitrožilně podaných vysokých dávek imunoglobulinů, který však nebyl vždy trvalý. Někdy po ukončení léčby postižení recidivovalo, a proto je doporučována udržovací léčba. Nejčastěji byla podána klasická dávka 2 g/kg 1krát za měsíc, méně často byly použity dávky nižší. V publikované literatuře se nacházejí velmi četná hodnocení této léčebné metody, popisující klinicky významný přínos pro nemocné, a to jak u lidí se skleromyxedémem, tak se skleredémem [40–52]. Popsán byl i případ postreptokokového skleredému úspěšně léčeného nitrožilními imunoglobuliny [53].
V souboru 30 pacientů navodilo nitrožilní podání imunoglobulinů 4 kompletní remise a 9 parciálních remisí [22].
Němečtí autoři u svých 4 pacientů vyzkoušeli jak léčbu metodou PUVA, tak léčbu metotrexátem, acitretinem, cyklofosfamidem a talidomidem a extrakorporální fotoforézou. Nejlepšího efektu bylo dosaženo při léčbě nitrožilně aplikovanými imunoglobuliny (2 g/kg hmotnosti/měsíc), s dexametazonem a bortezomibem [54].
Léčba nitrožilními gamaglobuliny případně i s plazmaferézou pomohla v případě život ohrožujícího dermatoneurosyndromu s poruchou vědomí [55–57]. Vysoké dávky imunoglobulinů mohou zřejmě interferovat s vazbou cirkulujících monoklonálních protilátek, a rušit tak jejich autoimunitní působení, aniž by tyto vysoké dávky imunoglobulinů ovlivňovaly tvorbu monoklonálního imunoglobulinu s autoimunitní aktivitou.
Velmi dobrý efekt nitrožilních imunoglobulinů můžeme zatím potvrdit u jednoho pacienta, kterého nitrožilními imunoglobuliny již léčíme, druhý pacient čeká, zda bude schválena úhrada této léčby zdravotní pojišťovnou.
Léčba cyklosporinem
Pro léčbu skleredému a skleromyxedému byla testována také léčba cyklosporinem. V literatuře lze nalézt jen ojedinělé případy s pozitivním hodnocením [58,59].
V ostatních pracích, které popisují přínos nitrožilních imunoglobulinů pro léčbu této skupiny pacientů, je léčba cyklosporinem také zmíněna, ale jen jako neúčinná, či málo účinná [21,22]. Vzhledem k tomu, že počet publikací s pozitivním hodnocením léčby cyklosporinem je malý, podstatně menší než počet publikací pozitivně hodnotících nitrožilní imunoglobuliny, tak je zřejmé, že imunosupresivní léčba cyklosporinem nebude zdaleka tak účinná, jako imunosupresivní léčba nitrožilními imunoglobuliny.
Léčba metotrexátem
Metotrexát je stále standardním lékem pro léčbu revmatoidní artritidy a některých dalších systémových nemocí pojiva. A tak je pochopitelné, že stejná léčba byla testována u pacientů se skleredémem a skleromyxedémem. V literatuře lze najít pozitivní hodnocení metotrexátu v této indikaci [60,61], tak i negativní hodnocení [62].
Vzhledem k tomu, že pozitivních hodnocení bylo publikováno poměrně málo, takže z přehledu literatury opět vychází, že tato léčba bude podstatně méně přínosná než nitrožilní podání imunoglobulinů.
Léčba talidomidem
Talidomid má své místo při léčbě mnohočetného myelomu a v literatuře lze nalézt také publikované zprávy o přínosu pro pacienty se skleromyxedémem i skleredémem. Ve 14 publikacích je popsána léčba 17 osob talidomidem a ve většině případů je popisováno zlepšení kožních příznaků, nikoliv však úplné vymizení [63–70].
Abarzúa v roce 2014 popisuje efekt talidomidu u pacienta, který dokonce neměl prokázán M-Ig [71]. Talidomid zpomaluje pasáž trávicím traktem a má prokoagulačním vliv, což limituje jeho použití u skupiny nemocných často trpících obstipací.
Fototerapie PUVA a UVA-1
Fototerapie je jednou z častěji používaných metod v dermatologii. Někteří autoři popisují přínos této metody pro pacienty trpící skleromyxedémem, zatímco jiní u svých pacientů léčebný úspěch metody PUVA (ústup nemoci) nezaznamenali [72]. Podobně při zadání hesla skleredém lze nalézt pozitivní hodnocení fototerapie buď s aplikací psoralenu (PUVA), nebo bez psoralenu (UVA-1) [63–79].
Vzhledem k četnějším publikacím s pozitivními závěry považujeme tuto terapii za jednu z přijatelných možností, kterou je možno při neúspěchu nitrožilních imunoglobulinů otestovat. Dle informací z literatury je zřejmě nitrožilní léčba imunoglobuliny účinnější než fototerapie.
Radioterapie
Přínos radioterapie je popisován jen u onemocnění scleredama adultorum Buschke. Obvykle se používá radioterapie nízce energetickými elektrony. V literatuře lze najít publikace s pozitivním hodnocením této léčebné modality [80–83].
Němečtí autoři použili metodu nízce energetických elektronů (9 MeV v celkové dávce 20 Gy a denní dávce 2 Gy) pro léčbu pacienta, u něhož nebyla fototerapie účinná. Autoři popisují efekt této léčby jako drobné zlepšení, vymizení pruritu, ale nedošlo k signifikantní změně kožní tloušťky. Autoři této publikace jsou k možnosti přínosu radioterapie v této indikaci kritičtější než dřívější publikace [84].
Léčba plazmaferézou
Úspěšné použití plazmaferézy je v literatuře popsáno u více případů skleromyxedému s paroxyzmy alterace mozkové činnosti, vyúsťující ve zmatenost, poruchu vědomí, křeče. Tyto stavy vyžadují někdy i řízenou ventilaci, jak je výše uvedeno v popisu dermatoneurosyndromu [85–88].
Plazmaferéza je dle literárních pramenů používána jako metoda pro léčbu kritických situací u mucinóz (dermatoneurosyndromu), nikoliv však jako léčba první linie.
Vysokodávkovaná chemoterapie
Vysokodávkovaná chemoterapie s transplantací autologních kmenových buněk je standardní léčebný postup pro symptomatický mnohočetný myelom. Je však účinným léčebným postupem i při nízce agresivních (low-grade) plazmocelulárních proliferací, jako je primární systémová AL-amyloidóza a POEMS syndrom, tedy jednotky, u nichž je pouze malý počet klonálních plazmocytů v kostní dřeni a není přítomen dynamický vzestup M-Ig. Vyšší míra léčebné odezvy u osob s nízkou koncentrací M-Ig než u osob s vyšší popsal již v roce1995 Singhal [89]. V roce 2001 byla poprvé popsána kompletní remise skleromyxedému po vysokodávkované chemoterapii s autologní transplantací kostní dřeně [90].
Následně bylo popsáno více než 20 případů, kdy byl skleromyxedém úspěšně a dlouhodobě vyléčen pomocí tohoto postupu [91–102]. Léčba vysokodávkovanou chemoterapií s autologní transplantací krvetvorných buněk představuje pro pacienty s mucinózou a monoklonální gamapatií léčebnou možnost. Její použití je však limitovány věkem nemocného a současnými komorbiditami, případně poškozením vnitřních orgánů mucinózou. Při volbě vysokodávkované chemoterapie je vhodné vždy vyšetření životně důležitých orgánů, srdce a plic, ale respektovat i možné poškození motility trávicího traktu.
Léčebné postupy používané též u mnohočetného myelomu
V literatuře lze najít zprávy, popisující pacienty s mnohočetným myelomem, u nichž chemoterapie dosáhla hematologické kompletní remise a zároveň došlo k zásadnímu ústupu či totálního vymizení projevů skleredému [103–105].
Klasickým cytostatikem pro myelom je melfalan, a proto byl také použit při léčbě mucinózy s přítomností M-Ig. A v případech, kdy melfalan vedl k vymizení M-Ig (negativní imunofixace), došlo i k vymizení projevů mucinózy [106].
Následně byly používány i další léčebné postupy, klasicky používané pro mnohočetný myelom, např. cyklofosfamid a dexametazon [107].
A samozřejmě lze najít i popisy úspěšné léčby mucinóz novými léky registrovanými pro mnohočetný myelom, talidomid, bortezomib a lenalidomid [108–112].
Brunet-Possenti et al popsal případ muže, u nějž byl diagnostikován skleromyxedém. Tento pacient byl zpočátku léčen hydroxychlorochinem, kortikosteroidy a talidomidem s ne zcela uspokojivými výsledky. Obrat nastal až po zahájení režimu s lenalidomidem, derivátem talidomidu, který v obvyklém dávkování (25 mg denně po dobu 3 týdnů s navazující týdenní pauzou) uvedl onemocnění do parciální klinické remise s výrazným ústupem kožních projevů. K posílení léčebného efektu byly po 18 cyklech monoterapie lenalidomidem přidány do kombinace pravidelné aplikace intravenózních imunoglobulinů v dávce 2 g/kg v intervalu 1 měsíce (celkem 6 podání). Touto léčbou dosáhli autoři během 3 měsíců kompletní klinické remise skleromyxedému, která přetrvávala i 2 roky po ukončení podávání imunoglobulinů, a poté byl pacient ponechán na dlouhodobé udržovací terapii lenalidomidem [112].
Problém pacientů s velmi vzácnými diagnózami
Velmi vzácná onemocnění lze definovat na základě jejich prevalence nepřesahující 1 postiženého na 100 000 obyvatel. Jedná se tedy o natolik raritní jednotky, že se lékaři při jejich diagnostice a léčbě většinou řídí jen sporadickými popisy jednotlivých případů či malých souborů pacientů. I když zde nejsou k dispozici výsledky velkých prospektivních randomizovaných studií, z nichž by plynula jednoznačná doporučení pro léčebně-diagnostickou péči, mohou být také těmto pacientům poskytnuty kvalitní zdravotnické služby v rámci komplexní mezioborové spolupráce. Na Interní hematologické a onkologické klinice FN Brno se velmi vzácným diagnózám věnujeme již řadu let a zajištění účinné léčby moderními preparáty patří mezi naše priority.
Zájemci o tuto tématiku z řad odborníků, ale i nejširší veřejnosti naleznou další informace na našem pilotním internetovém portálu, jehož činnost byla zahájena v roce 2014 (www.vzacne-diagnozy.cz). Na webových stránkách jsou rovněž uveřejněna aktuální souhrnná data z našeho Registru velmi vzácných hematoonkologických onemocnění u dospělých osob, do něhož bylo ke dni 18. 3. 2015 zařazeno celkem 124 pacientů s velmi vzácnými diagnózami, a to včetně zde diskutovaných případů. Věříme, že zvýšení povědomí o této skupině chorob omezí nežádoucí diagnostické prodlevy, usnadní léčebná rozhodnutí a celkově tak povede k dalšímu zkvalitnění zdravotní péče.
Závěr pro praxi
Skleredém a skleromyxedém jsou velmi vzácné nemoci ze skupiny mucinóz s viditelným a hmatatelným ztluštěním kůže a podkoží, limitující postupně pohyb a polykání. Nejde však jen o onemocnění kožního povrchu, současně bývají poškozeny i vnitřní orgány (plíce, srdce, trávicí trakt), takže je to nemoc interní, postihující celého člověka.
Nejčastější z mimokožních projevů je poškození funkce plic ve formě restrikční či obstrukční poruchy, někdy s projevy primární plicní hypertenze. Depozita mucinu v cévách poškozují i funkce srdce.
Neurologické poškození může akutně kulminovat ve formě dermatoneurosyndromu, cože je termín pro akutně nastupující poruchu vědomí (zmatenost, somnolence až kóma). Někdy je tento stav provázený křečemi. Zásadní pro zvládnutí tohoto akutního stavu je plazmaferéza a nitrožilní podání vysokých dávek imunoglobulinů.
Etiologie uvedených mucinóz je velmi pravděpodobně způsobena stimulací tvorby mucinu ve fibroblastech imunoglobulinem, který často splňuje charakteristiku M-Ig.
Cílem léčby je zastavení stimulace tvorby mucinu ve fibroblastech. To lze dosáhnout dvěma léčebnými postupy. První možností je zastavit syntézu monoklonálního imunoglobulinu v plazmocytech, který stimuluje tvorbu mucinu pomocí klasické či vysokodávkované chemoterapie. Je prokázáno, že při úplném vymizení M-Ig vymizí i projevy mucinózy. Předpokladem úspěchu je chemosenzitivita nemoci ke klasické chemoterapii a vhodnost pacienta k vysokodávkované chemoterapii. Druhou léčebnou možností je zasáhnout do procesu navázání monoklonálního imunoglobulinu s autoimunitní aktivitou na cílové struktury, neboli přímo do procesu, který má za následek stimulaci tvorby mucinu. Toho lze dosáhnout pomocí imunomodulační léčby vysokými dávkami nitrožilní aplikovaných imunoglobulinů. Klasická imunosupresiva (prednison, azatioprin, metotrexát či cyklosporin) jsou v této indikaci neúčinná, protože jejich dominantním cílem účinku je autoimunitu vyvolávající lymfatické buňky, a nikoliv inhibice účinků již vytvořených autoprotilátek.
Pokud se stav nemocného při léčbě imunomodulačními dávkami nitrožilně podávaných imunoglobulinů zásadně zlepší a nejsou další kontraindikace vysokodávkované chemoterapie, je možné pak provést sběr krvetvorných buněk z periferní krve a vysokodávkovanou chemoterapii. Ostatní způsoby léčby jsou méně účinné či neúčinné. Léčba samotnými kortikoidy není dle našich i literárních zkušeností přínosná.
Děkujeme kolektivu pracovníků OKRZP Ústředí VZP ČR, zvláště paní doktorce Haně Burkoňové, revizní lékařce Ústředí VZP ČR, kteří posuzovali celou problematiku, za povolení úhrady léčby velmi vzácné choroby, pro kterou neexistují oficiální léčebná doporučení. Práce vznikla na podporu léčby těchto nemocných.
Práce byla vytvořena v rámci následujících grantových aktivit: MZ ČR – RVO (FNBr, 65269705) a 23/14/NAP a dále IGA NT 14575.
prof. MUDr. Zdeněk Adam, CSc.
z.adam@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno
www.fnbrno.cz
Doručeno do redakce 30. 3. 2015
Přijato po recenzi 11. 5. 2015
Zdroje
1. Štork J et al. Dermatovenerologie. 2nd ed. Galén: Praha 2013. ISBN 9788072628988.
2. International myeloma working group. Criteria for the classification of monoclonal gammopathies, multiple myelom and releated disorders: a report of the International Meyloma Working Group. Br J Hematol 2003; 121(5): 749–757.
3. Česká myelomová skupina: Diagnostika a léčba mnohočetného myelomu. Transfuze a hematologie dnes 2012; 18(Suppl 1): 1–89.
4. Pock L. Kožní mucinózy. Čes-Slov Dermatol 2006; 81(6): 313–325.
5. Žamboch K, Ščudla V, Pika T et al. Vzácná konincidence papulární mucinózy s primární systémovou AL-amyloidózou. Interní Med 2008; 10(5): 248–250.
6. Žamboch K, Tichá V, Pika T et al. Vzácná koincidence papulární mucinózy (lichen myxedematosus s primární AL-amyloidózou). Vnitř Lék 2007; 53(5): 591–592.
7. Drlík L, Pock L, Paťavová V et al. Retikulární erytematózní mucinóza. Dermatol Praxi 2011; 5(3): 150–151.
8. Sainerová A, Vencovský J. Skleromyxedém. Čes Revmatol 1998; 6(2): 90.
9. Pock L, Abrahámová S. Retikulární erytematózní mucinóza. Čes-Slov Dermatol 2000; 75(3): 117–119.
10. Štork J, Vosmík F. Klinický případ: Erytémy trupu. Čes-Slov Dermatol 1997; 72(5): 205–206.
11. Štítná M, Rasochová E. Klinický prípad: Diseminované voskové papulky a facies leontina. Čes-Slov Dermatol 2012; 87(2): 57–59.
12. Godby A, Berstresser PR, Chaker B et al. Fatal scleromyxedema. Report of a case and review of the literature. J Am Acad Dermatol 1998; 38(2): 289–294.
13. De Simone C, Castriota M, Carbone A et al. Cardiomyopathy in scleromyxedema: report of a fatal case. Eur J Dermatol 2010; 20(6): 852–853.
14. Rimon D, Lurie M, Storch S et al. Cardiomyopathy and multiple myeloma. Complications of scleredema adultorum. Arch Intern Med 1988; 148(3): 551–553.
15. Marshall K, Klepeiss SA, Ioffreda MD et al. Scleromyxedema presenting with neurologic symptoms: a case report and review of the literature. Cutis 2010; 85(3): 137–140.
16. Fleming KE, Virmani D, Sutton E et al. Scleromyxedema and the dermato-neuro syndrome: case report and review of the literature. J Cutan Pathol 2012; 39(5): 508–517.
17. Štork J. Kožní fibróza u systémové sklerodermie a její diferenciální diagnóza. Postgraduální medicína 2014; 16(2): 212–218
18. Bartalena L, Fatourechi V. Extrathyroidal manifestations of Graves’ disease: a 2014 update. J Endocrinol Invest 2014; 37(8): 691–700.
19. Herpes RA, Risper J. Lichen myxedematosus(scleromyxedema ) serum stimulates human skin fibroblast proliferation. Science 1978; 199(4328): 545–547.
20. Yaron M, Yaron I, Yust I et al. Lichen myxedematosus (scleromyxedema) serum stimulates hyaluronic acid and prostaglandin E production by human fibroblast. J Rheumatol 1985; 12(1): 171–175.
21. Rongioletti F, Rebora A. Update on classification of papular mucinosis, lichen myxedematosus and scleroxyxedema. J Am Acad Dermatol 2001; 44(2): 273–281.
22. Rongioletti F, Merlo G, Cinotti E et al. Scleromyxedema: a multicenter study of characteristics, comorbidities, course, and therapy in 30 patients. J Am Acad Dermatol 2013; 69(1): 66–72.
23. Adam Z, Kissová J, Pour L et al. Myopatie při Waldenströmově makroglobulinemii. Popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů typu IgM. Vnitř Lék 2015; 61(9): 821–828.
24. Meguerditchian C, Jacquet P, Béliard S et al. Scleredema adultorum of Buschke: an underecognized skin complication of diabetes. Diabetes Metab 2006; 32(5 Pt 1): 481–484.
25. Inokuma D, Sawamura D, Shibaki A et al Scleroedema adultorum associated with sarcoidosis. Clin Exp Dermatol 2009; 34: e428-e429. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2230.2009.03423.x>.
26. Yu JI, Park W, Lee KK et al. Scleredema adultorum of Buschke associated with a carcinoid tumor. Int J Dermatol 2009; 48(7): 784–786.
27. Manchanda Y, Das S, Sharma VK et al. Scleredema associated with carcinoma of the gall bladder. Br J Dermatol 2005; 152(6): 1373–1374.
28. Miyagawa S, Dohi K, Tsuruta S et al. Scleredema of Buschke associated with rheumatoid arthritis and Sjögren’s syndrome. Br J Dermatol 1989; 121(4): 517–520.
29. Basarab T, Burrows NP, Munn SE et al. Systemic involvement in scleredema of Buschke associated with IgG-kappa paraproteinaemia. Br J Dermatol 1997; 136(6): 939–942.
30. Ratip S, Akin H, Ozdemirli M et al. Scleredema of Buschke associated with Waldenström’s macroglobulinaemia. Br J Dermatol 2000; 143(2): 450–452.
31. Valente L, Velho GC, Farinha F et al. Scleredema, acanthosis nigricans and IgA/Kappa multiple myeloma. Ann Dermatol Venereol 1997; 124(8): 537–539.
32. Salisbury JA, Shallcross H, Leigh IM. Scleredema of Buschke associated with multiple myeloma. Clin Exp Dermatol 1988; 13(4): 269–270.
33. Hodak E, Tamir R, David M et al. Scleredema adultorum associated with IgG-kappa multiple myeloma-a case report and review of the literature. Clin Exp Dermatol 1988; 13(4): 271–274.
34. Dogra S, Handa S, Kanwar AJ. Dexamethasone pulse therapy for scleredema. Pediatr Dermatol 2004; 21(3): 280–281.
35. Kurtoğlu S, Yüksel S, Gündüz Z et al. Use of high-dose intravenous corticosteroid treatment in a child with scleredema. J Emerg Med 2004; 26(2): 245–246.
36. Kerr J, Quinti I, Eibl M et al. Is dosing of therapeutic immunoglobulins optimal? A review of a three-decade long debate in Europe. Front Immunol 2014; 5 : 629. Dostupné z DOI: http://dx.doi.org/10.3389/fimmu.2014.00629.
37. Imbach P, Barandun S, D´Apuzzo V et al. High dose intravenous gamaglobulin for idiopathic trombocytopenic purpura in childhood. Lancet 1981; 1(8232):1228–1231.
38. Nagelkerke SQ, Kuijpers TW. Immunomodulation by IVIg and the Role of Fc-Gamma Receptors: Classic Mechanisms of Action after all? Front Immunol. 2015; 5 : 674. Dostupné z DOI: http://dx.doi.org/10.3389/fimmu.2014.00674.
39. Gelfand EW. Intravenous immune globulin in autoimmune and inflammatory diseases. N Engl J Med 2012; 367(21): 2015–2025.
40. Lister RK, Whittaker JS, Blafl C et al. Scleredema: response to high dose intravenous immunoglobulin (hdIVIg). J Am Acad Dermatol 2000; 43(2 Pt 2): 403–408.
41. Caudill L, Howell E. Scleromyxedema: a case clinically and histologically responsive to intravenous immunoglobulin. J Clin Aesthet Dermatol 2014; 7(5): 45–47.
42. Macnab M, Kenny P. Successful intravenous immunoglobulin treatment of atypical lichen myxedematosus associated with hypothyroidism and central nervous system involvement: case report and discussion of the literature. J Cutan Med Surg 2013; 17(1): 69–73.
43. Majeski C, Taher M, Grewal P et al. Combination oral prednisone and intravenous immunoglobulin in the treatment of scleromyxedema. J Cutan Med Surg 2005; 9(3): 99–104.
44. Wojas-Pelc A, Błaszczyk M, Glińska M et al. Tumorous variant of scleromyxedema. Successful therapy with intravenous immunoglobulins. J Eur Acad Dermatol Venereol 2005; 19(4): 462–565.
45. Bidier M, Zschoche C, Gholam P et al. Scleromyxoedema: clinical follow-up after successful treatment with high-dose immunoglobulins reveals different long-term outcomes. Acta Derm Venereol 2012; 92(4): 408–409.
46. Manousaridis I, Loeser C, Goerdt S et al. Managing scleromyxedema with intravenous immunoglobulin: acute worsening of scleromyxedema with biclonal gammopathy. Acta Dermatovenerol Alp Pannonica Adriat 2010; 19(4): 15–19.
47. Roque Diamantino F de E, Lopes João AM et al. Treatment of scleromyxedema with intravenous immunoglobulin. Eur J Dermatol 2010; 20(6): 861–862.
48. Topf S, Simon M Jr, Schell H et al. Marked improvement in scleromyxedema with high-dose intravenous immunoglobulin. Hautarzt 2007; 58(6): 525–528.
49. Sroa N, Campbell S, Bechtel M. Intravenous immunoglobulin therapy for scleromyxedema: a case report and review of literature. J Drugs Dermatol 2010; 9(3): 263–265.
50. Jolles S, Hughes J. Use of IGIV in the treatment of atopic dermatitis, urticaria, scleromyxedema, pyoderma gangrenosum, psoriasis, and pretibia myxedema. Int Immunopharmacol 2006; 6(4): 579–591.
51. Sommer LL, Heimann WR. Fulminans in dermatology: a Call to action. A recommendation for consideration of the term skleredema fulminans. J Clin Aesthet Dermatos 2014; 7(6): 42–45.
52. Eastham AB, Femia AN, Velez NF et al. Paraproteinemia-associated scleredema treated successfully with intravenous immunoglobulin. JAMA Dermatol 2014; 150(7): 788–789.
53. Aichelburg MC, Loewe R, Schicher N et al. Successful treatment of poststreptococcal scleredema Adultorum Buschke with intravenous immunoglobulins. Arch Dermatos 2012; 148(10): 1126–1128.
54. Körber A, Franckson T, Grabbe S et al. Successful therapy of scleromyxoedema Arndt-Gottron with low-dose intravenous immunoglobulin. J Eur Acad Dermatol Venereol 2007; 21(4): 553–554.
55. Rey JB Luria RB. Treatment of scleromyxedema and the dermatoneuro syndromes with intravenous imunoglobulin. J Amer Acad Dermatos 2009; 60(6): 1037–1041.
56. Bielsa I, Benvenutti F, Guinovart RM. Good response of scleromyxedema and dermato-neuro syndrome to treatment with intravenous immunoglobulins. Actas Dermosifiliogr 2012; 103(4): 317–320.
57. Charles S, Hainaut E, Cante V et al. Dermato-neuro syndrome during scleromyxedema: efficacy of plasmapheresis and intravenous immunoglobulin. Ann Dermatol Venereol 2014; 141(8–9): 523–527.
58. Açikgöz G, Özmen I, Hüseynov S et al. A case of atypical scleromyxedema without gammopathy treated with cyclosporine. Indian J Dermatol Venereol Leprol 2014; 80(3): 278.
59. Saigoh S, Tashiro A, Fujita S et al. Successful treatment of intractable scleromyxedema with cyclosporin A. Dermatology 2003; 207(4): 410–411.
60. Dgramaci AS, Inan MU, Atik E et al. Scleredema diabeticorum partially treated with low dose methotrexate. Report of 5 cases. Balkan Med J 2012; 29(2): 218–221.
61. Seyger MM, van den Hoogen FH, de Mare S et al. A patient with severe scleredema diabeticorum partially responding to low dose methotrexate. Dermatology 1999; 198(2): 177–179.
62. Breuckmann F, Appelhans C, Harati A et al. Failure of low dose methotrexate in the treatment of skleredema diabeticorum in seven cases. Dermatology 2005; 211(3): 299–301.
63. Pascualini MF, Caballero Escuti G, Valente E et al. Response to thalidomide in scleromyxedema. Medicina (B Aires) 2013; 73(3): 252–254.
64. Laimer M, Namberger K, Massone C et al. Vincristine, idarubicin, dexamethasone and thalidomide in scleromyxoedema. Acta Derm Venereol 2009; 89(6): 631–635.
65. Sansbury JC, Cocuroccia B, Jorizzo JL et al. Treatment of recalcitrant scleromyxedema with thalidomide in 3 patients. J Am Acad Dermatol 2004; 51(1): 126–131.
66. Guarenti I, Sebastiani V, Pinto G et al. Successful treatment of scleromyxedema with oral thalidomide. Int J Dermatol 2013; 52(5): 631–632.
67. Amini-Adle M, Thieulent N, Dalle S et al. Scleromyxedema: Successful treatment with thalidomide in two patients. Dermatology 2007; 214(1): 58–60.
68. Thyssen JP, Zachariae C, Menné T. Successful treatment of scleromyxedema using thalidomide. J Eur Acad Dermatol Venereol 2006; 20(10): 1396–1397.
69. Wu MY, Hong JB, Yang CC et al. Scleromyxedema with myopathy was successfully treated by thalidomide. J Eur Acad Dermatol Venereol 2009; 23(2): 189–190.
70. Martins A, Paiva Lopes MJ, Tavares Belo R et al. Scleromyxedema – thalidomide therapy. J Eur Acad Dermatol Venereol 2008; 22(5): 622–624.
71. Abarzua AA, Giesen L, Sandoval OM et al. Skleromyxedema without paraproteinemia. Int J Dermatology 2014; 53(8): 971–974
72. Kreuter A, Stücker M, Kolios AGA et al. Skleromyxödem. Zeitschrift Rheumatol 2012; 71(6): 504–514.
73. Kochs C, Bockmann A, Hanneken S et al. Scleredema diabeticorum: successful treatment with UVA-1 phototherapy. Hautarzt 2011; 62(4): 255–257.
74. Martín C, Requena L, Manrique K et al. Scleredema Diabeticorum in a Patient with Type 2 Diabetes Mellitus. Case Rep Endocrinol 2011; 2011 : 560273. Dostupné z DOI: http://dx.doi.org/10.1155/2011/560273.
75. Yüksek J, Sezer E, Köseoğlu D et al. Scleredema treated with broad-band ultraviolet A phototherapy plus colchicine. Photodermatol Photoimmunol Photomed 2010; 26(5): 257–260.
76. Thumpimukvatana N, Wongpraparut C, Lim HW. Scleredema diabeticorum successfully treated with ultraviolet A1 phototherapy. J Dermatol 2010; 37(12): 1036–1039.
77. Nakajima K, Iwagaki M, Ikeda M et al. Two cases of diabetic scleredemathat responded to PUVA therapy. J Dermatol 2006; 33(11): 820–822.
78. Eberlein-König B, Vogel M, Katzer K et al. Successful UVA1 phototherapy in a patient with scleredema adultorum. J Eur Acad Dermatol Venereol 2005; 19(2): 203–204.
79. Janiga JJ, Ward DH, Lim HW. UVA-1 as a treatment for scleredema. Photodermatol Photoimmunol Photomed 2004; 20(4): 210–211.
80. Bowen AR, Smith L, Zone JJ. Scleredema adultorum of Buschke treated with radiation. Arch Dermatol 2003; 139(6): 780–784.
81. Lee MV, Coi JH, Sung KJ et al. Electron beam therapy in patients with skleredema. Acta Derm Venereol 2000; 80(4): 307–308.
82. Lowe NJ, Dufton PA, Hunter RD et al. Electron beam therapy of skleromyxedema. Brit J Dermatol 1982; 106(4): 449–453.
83. Tamburin LM, Pena JR, Meredith R et al. Scleredema of Buschke successfully treated with electron beam therapy. Arch Dermatol 1998; 134(4): 419–422.
84. Könemann S, Hesselmann S, Bölling T et al. Radiotherapy of benign diseases-scleredema adultorum Buschke. Strahlenther Onkol 2004; 180(12): 811–814.
85. do Prado AD, Schmoeller D, Bisi MC et al. Scleromyxedema with monoclonal gammopathy and neurological involvement: recovery from coma after plasmapheresis? Int J Dermatol 2012; 51(8): 1013–1015.
86. Nieves DS, Bondi EE, Wallmark J et al. Scleromyxedema: successful treatment of cutaneous and neurologic symptomes. Curie 2000; 65(2): 89–92.
87. Charles S, Hainaut E, Cante V et al. Dermato-neuro syndrome during scleromyxedema: efficacy of plasmapheresis and intravenous immunoglobulin. Ann Dermatol Venereol 2014; 141(8–9): 523–527.
88. El-Darouti MA, Hegazy RA, Fawzy MM et al. Scleromyxedema: a novel therapeutic approach. J Am Acad Dermatol 2013; 69(6): 1062–1066.
89. Singhal S, Powles R, Milan S et al. Kinetics of paraprotein clearence after autografting for multiple myeloma. Bone Marrow Transplant 1995; 16(4): 537–540.
90. Faesel AM, Donatu ML, Duvic M. Complete remission of scleromyxedema followit autologous stem cell transplantation. Arch Dermatos 2001; 137(8): 1071–1072.
91. Shayegi N, Alakel N, Middeke JM et al. M. Allogeneic stem cell transplantation for the treatment of refractory scleromyxedema. Transl Res 2015; 165(2): 321–324.
92. Devos T, Thiessen S, Cuyle PJ et al. Long-term follow-up in a patient with the dermato-neuro syndrome treated with high-dose melphalan, thalidomide, and intravenous immunoglobulins for more than 7 years. Ann Hematol 2014; 93(11): 1927–1928.
93. Braue A, Dolianitis C, Varigos G. Spontaneous resolution of facial popular mucinosis in a transplant patient. Australas J Dermatol 2008; 49(3): 164–166.
94. Ataergin S, Arpaci F, Demiriz M et al. Transient efficacy of double high-dose chemotherapy and autologous peripheral stem cell transplantation, immunoglobulin, thalidomide, and bortezomib in the treatment of scleromyxedema. Am J Clin Dermatol 2008; 9(4): 271–273.
95. Cheng T, Gnanakumar V, Hegedus C et al Complete and durable remission in a patient with life-threatening scleromyxedema treated with high-dose melphalan and BU with auto-SCT. Bone Marrow Transplant 2008; 42(3): 215–217.
96. Iranzo P, López-Lerma I, Bladé J et al. C. Scleromyxoedema treated with autologous stem cell transplantation. J Eur Acad Dermatol Venereol 2007; 21(1): 129–130.
97. Illa I, de la Torre C, Rojas-Garcia R et al. Steady remission of scleromyxedema 3 years after autologous stem cell transplantation: an in vivo and in vitro study. Blood 2006; 108(2): 773–774.
98. Lacy MQ, Hogan WJ, Gertz MA et al. Successful treatment of scleromyxedema with utologous peripheral blood stem cell transplantation. Arch Dermatol 2005; 141(10): 1277–1282.
99. Donato ML, Feasel AM, Weber DM et al. Scleromyxedema: role of high-dose melphalan with autologous stem cell transplantation. Blood 2006; 107(2): 463–466.
100. Feasel AM, Donato ML, Duvic M. Complete remission of scleromyxedema following autologous stem cell transplantation. Arch Dermatol 2001; 137(8): 1071–1072.
101. Bos R, de Waal EG, Kuiper H et al. Thalidomide and dexamethasone followed by autologous stem cell transplantation for scleromyxoedema. Rheumatology (Oxford) 2011; 50(10): 1925–1926.
102. Ataergin S, Arpaci F, Demiriz M et al. Transient efficacy of double high-dose chemotherapy and autologous peripheral stem cell transplantation, immunoglobulin, thalidomide, and bortezomib in the treatment of scleromyxedema. Am J Clin Dermatol 2008; 9(4): 271–273.
103. Pujol JA, Bueno M, Fuertes MA et al. Improvement of scleredema associated with IgA multiple myeloma after chemotherapy. Clin Exp Dermatol 1995; 20(2): 149–152.
104. Szturz P, Adam Z, Vašků V et al. Complete remission of multiple myeloma associated scleredema after bortezomib-based treatment. Leuk Lymphoma 2013; 54(6): 1324–1326.
105. Santos-Juanes J, Osuna CG, Iglesias JR et al. Treatment with chemotherapy of scleredema associated with Ig A myeloma. Int J Dermatol 2001; 40(11): 720–721.
106. Schubert K, Stein A, Meurer M. Initial scleromyxedema. Successful treatment with melphalan. Hautarzt 2002; 53(7): 478–482.
107. Kuldeep CM, Mittal AK, Gupta LK et al. Successful treatment of scleromyxedema with dexamethasone cyclophosphamide pulse therapy. Indian J Dermatol Venereol Leprol 2005; 71(1): 44–45.
108. Yeung CK, Loong F, Kwong YL. Scleromyxoedema due to a plasma cell neoplasm: rapid remission with bortezomib, thalidomide and dexamethasone. Br J Haematol 2012; 157(4): 411.
109. Cañueto J, Labrador J, Román C et al. The combination of bortezomib and dexamethasone is an efficient therapy for relapsed/refractory scleromyxedema: a rare disease with new clinical insights. Eur J Haematol 2012; 88(5): 450–454.
110. Fett NM, Toporcer MB, Dalmau J et al. Scleromyxedema and dermato-neuro syndrome in a patient with multiple myeloma effectively treated with dexamethasone and bortezomib. Am J Hematol 2011; 86(10): 893–896.
111. Migkou M, Gkotzamanidou M, Terpos E et al. Response to bortezomib of a patient with scleromyxedema refractory to other therapies. Leuk Res 2011; 35(11): e209-e211. Dostupné z DOI: http://dx.doi.org/10.1016/j.leukres.2011.07.021.
112. Brunet-Possenti F, Hermine O, Marinho E et al. Combination of intravenous immunoglobulins and lenalidomide in the treatment of scleromyxedema. J Am Acad Dermatol 2013; 69(2): 319–320.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo 12- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Fosfátová homeostáza při selhání ledvin je draze vykoupená maladaptivními systémovými důsledky extrémně vysokých koncentrací fosfatoninů – editorial
- ST2 a srdeční selhání: pouze další marker z rodiny nebo přeci jen něco více? – editorial
- Karotická stenóza – diagnostika a léčba – editorial
- Fallotova tetralogie dříve a dnes – editorial
- Regionální registr plicní embolie
- Antitrombotická léčba a nevarikózní krvácení do horní části gastrointestinálního traktu
- Výskyt ventilační poruchy plic u osob se silikózou a pneumokoniózou uhlokopa
- První české zkušenosti s lenalidomidem v terapii anemických nemocných s myelodysplastickým syndromem s delecí dlouhého ramene 5. chromozomu
- Vyšetřování tubulární resorpce fosfátů u pacientů s chronickým onemocněním ledvin
- Význam stanovení solubilního receptoru ST2 v diagnostice a prognostické stratifikaci pacientů se srdečním selháním
- Geriatrická multimorbidita – jeden z klíčových problémů současné medicíny
- Karotická stenóza – diagnostika a léčba
-
Studie PATHWAY-2: spironolakton vs placebo, bisoprolol a doxazosin ke stanovení optimální léčby hypertenze rezistentní na léky
Vysoká účinnost spironolaktonu ve snížení krevního tlaku u rezistentní hypertenze - Monoklonální imunoglobulin a kožní nemoci ze skupiny mucinóz – scleredema adultorum Buschke a scleromyxedema: popis 4 případů a přehled léčebných možností
- Nekorigovaná Fallotova tetralógia u 69-ročného pacienta
- Medicína na polární stanici v Antarktidě
- Vladislav Hytych. VATS lobektomie…krok za krokem
- Ventilace plic u osob se silikózou a pneumokoniózou uhlokopa – editorial
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Karotická stenóza – diagnostika a léčba
- Geriatrická multimorbidita – jeden z klíčových problémů současné medicíny
- Fallotova tetralogie dříve a dnes – editorial
- Vyšetřování tubulární resorpce fosfátů u pacientů s chronickým onemocněním ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



