-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diabetes mellitus a zhoubné nádory
Diabetes mellitus and malignancies
The epidemiological studies have proven an increased incidence of cancer in patients with diabetes and the negative effect of diabetes on their prognosis. The relation to type 2 diabetes was found in hepatic, pancreatic and endometrial malignancies, in colorectal, breast and bladder cancers. Diabetes as well as malignancies are multifactorial diseases with a number of common risk factors: age, gender, race, overweight and obesity, diet, physical activity. A higher incidence of malignancies in diabetic patients is not only a result of sharing these risk factors, as diabetes itself predisposes to carcinoma development. Possible mechanisms producing this effect include hyperinsulinemia, hyperglycemia, oxidative stress, chronic inflammation, obesity related factors and effect of diabetic complications. The development of malignancies in diabetics is also affected by the diabetes treatment. Exogenous insulin and its analogues and stimulators of insulin secretion are linked to an increased risk of cancer while insulin sensitizers to its decrease. Special attention is given to metformin which, apart from the indirect effect by influencing the levels of insulin and glycemia, has a direct anticancerogenic effect. In the clinical practice, it is necessary to give attention to the screening of diabetes related tumours, consistent glycemic control and choice of appropriate diabetes treatment in patients with a high cancer risk.
Key words:
clinical practice – diabetes mellitus – effects of diabetes treatment – malignancies
Autoři: Jiří Petera 1; Alena Šmahelová 2
Působiště autorů: Klinika onkologie a radioterapie LF UK a FN Hradec Králové, přednosta prof. MUDr. Jiří Petera, Ph. D. 1; III. interní gerontometabolická klinika LF UK a FN Hradec Králové, přednosta prof. MUDr. Luboš Sobotka, CSc. 2
Vyšlo v časopise: Vnitř Lék 2014; 60(Suppl 2): 69-74
Kategorie: 70. narozeniny prof. MUDr. Jiřího Vorlíčka, CSc.
Souhrn
Epidemiologické studie prokázaly vyšší výskyt nádorových onemocnění u pacientů s diabetem a negativní vliv diabetu na jejich prognózu. Vztah k diabetu 2. typu byl nalezen u nádorů jater, pankreatu, endometria, kolorektálního karcinomu, karcinomu prsu a močového měchýře. Diabetes i nádory jsou multifaktoriální onemocnění s řadou společných rizikových faktorů: věk, pohlaví, rasa, nadváha a obezita, dieta, fyzická aktivita. Vyšší výskyt nádorů u diabetických pacientů není pouze výsledkem sdílení těchto rizikových faktorů, ale diabetes sám so sobě vytváří predispozici pro vznik karcinomu. Možné mechanizmy tohoto účinku zahrnují hyperinzulinemii, hyperglykemii, oxidativní stres, chronický zánět, faktory spojené s obezitou a vliv diabetických komplikací. Vznik nádorů u diabetiků je ovlivňován i jeho léčbou. Exogenní inzulin a jeho analoga a stimulátory sekrece inzulinu jsou spojeny se zvýšeným rizikem nádorů, inzulinové senzitizéry s jeho snížením. Zvláštní pozornost je věnována metforminu, který vedle nepřímého účinku ovlivněním hladin inzulinu a glykemie má přímý antikancerogenní efekt. V klinické praxi je nutné věnovat pozornost screeningu s diabetem spojených nádorů, důsledné kontrole glykemie a volbě vhodné diabetické léčby u pacientů s vysokým onkologickým rizikem.
Klíčová slova:
diabetes mellitus – klinická praxe – vliv diabetické léčby – zhoubné nádoryÚvod
Diabetes mellitus a zhoubné nádory patří mezi nejčastější onemocnění a jejich incidence se zvyšuje. Celosvětově jsou zhoubné nádory na 2. místě a diabetes na 12. místě v příčinách mortality [1]. V USA jsou nádorová onemocnění na 2. místě v příčinách úmrtí a diabetes na 7. místě [2].
V 50. letech minulého století se objevily studie zabývající se výskytem nádorů u pacientů s diabetem, nicméně v důsledku metodologických nedostatků byly jejich závěry kontroverzní. V 60. letech minulého století prokázaly asociaci mezi diabetem a nádory populační studie. V současné době potvrdily metaanalýzy vyšší výskyt některých nádorů u pacientů s diabetem, převážně 2. typu [3,4]. Jedná se o nádory jater, pankreatu, endometria, kolorektální karcinom, karcinom prsu a močového měchýře (tab. 1). Jen karcinom prostaty je u mužů s diabetem méně častý, což může být spojeno s redukcí hladiny testosteronu. Přibývají také důkazy, že diabetičtí pacienti mají vyšší riziko úmrtí na karcinom v porovnání s pacienty bez diabetu. Riziko úmrtí na karcinom je u mužů diabetiků 1,1krát vyšší a u žen s diabetem 1,24krát vyšší než je průměrné riziko [3]. V metaanalýze publikované Barone et al [5] se uvádí o 40 % vyšší mortalita na nádorová onemocnění u pacientů s diabetem 2. typu v porovnání s pacienty bez diabetu. Přítomnost diabetu zhoršuje prognózu onkologických nemocných. Meyehard et al [6] analyzovali pacienty léčené chemoterapií pro karcinom tlustého střeva stadia II s vysokým rizikem a stadiem III ve velké randomizované studii. Pětileté přežití bez přítomnosti onemocnění (disease free survival) bylo signifikantně sníženo u pacientů s diabetem (48 vs 59 %; p < 0,0001), bylo zkráceno rovněž přežití bez relapsu (relapse free survival) a celkové přežití (overal survival).
Tab. 1. Relativní riziko zhoubných nádorů v závislosti na diabetu 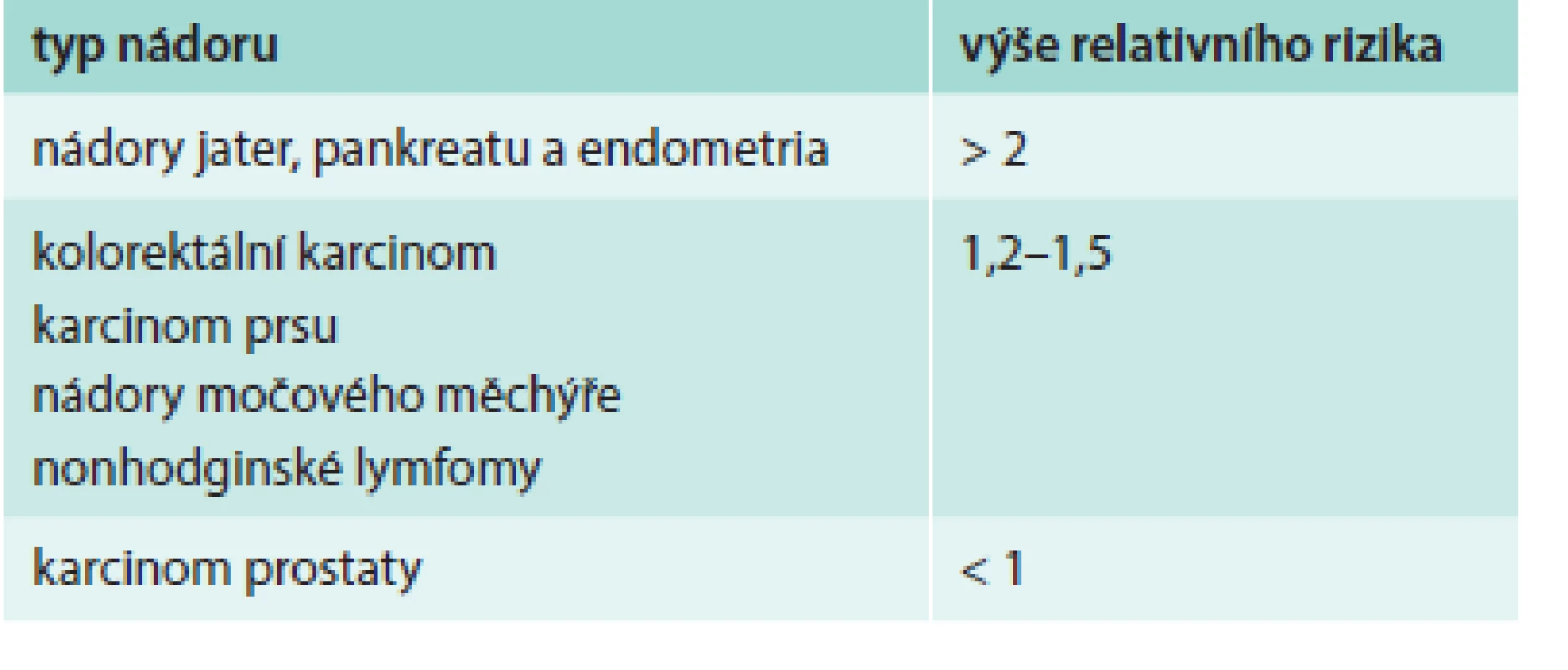
Při hodnocení těchto studií je nutné vzít v úvahu, že diabetes i nádory jsou multifaktoriální onemocnění s řadou společných rizikových faktorů: věk, pohlaví, rasa, nadváha a obezita, dieta, fyzická aktivita, kouření, alkohol. Jejich vliv na obě onemocnění je sumarizován v tab. 2. Je nutné rozlišit, zda je vyšší výskyt nádorů u diabetiků dán jen nezávislým sdílením stejných rizikových faktorů či zda diabetes sám o sobě vytváří predispozici pro vznik karcinomu. Další uváděná vysvětlení souvisejí s intenzivnějším sledováním diabetických pacientů, a tím vyšší pravděpodobností detekce karcinomů nebo s nižší intenzitou onkologické léčby u diabetiků v obavě z komplikací či v důsledku přítomnosti komplikací diabetu. Nicméně moderní velké prospektivní studie s aplikovanými korekcemi na věk, body mass index a další potenciální zkreslující faktory jednoznačně potvrzují etiologickou roli diabetu při vzniku karcinomů [7–9]. Riziko incidence a mortality na nádorová onemocnění u diabetiků není dramaticky zvýšené (relativní riziko 1,25), ale důsledky na populační úrovni jsou značné. Hlubší pochopení vazby mezi diabetem a nádory může vést k záchraně množství lidských životů. Pozornost je věnována téměř výhradně diabetu 2. typu. Diabetes 1. typu představuje jen 5–10 % všech případů diabetu a je mu věnováno jen několik studií. Malá dánská studie prokázala u diabetu 1. typu vyšší riziko karcinomu pankreatu, nicméně není jisté, zda diabetes byl příčinou či následkem nádoru [10]. Švédská studie dokumentovala u pacientů s diabetem 1. typu vyšší výskyt nádorů žaludku, hrdla děložního a endometriálního karcinomu [11].
Tab. 2. Společné rizikové faktory pro diabetes 2. typu a zhoubné nádory 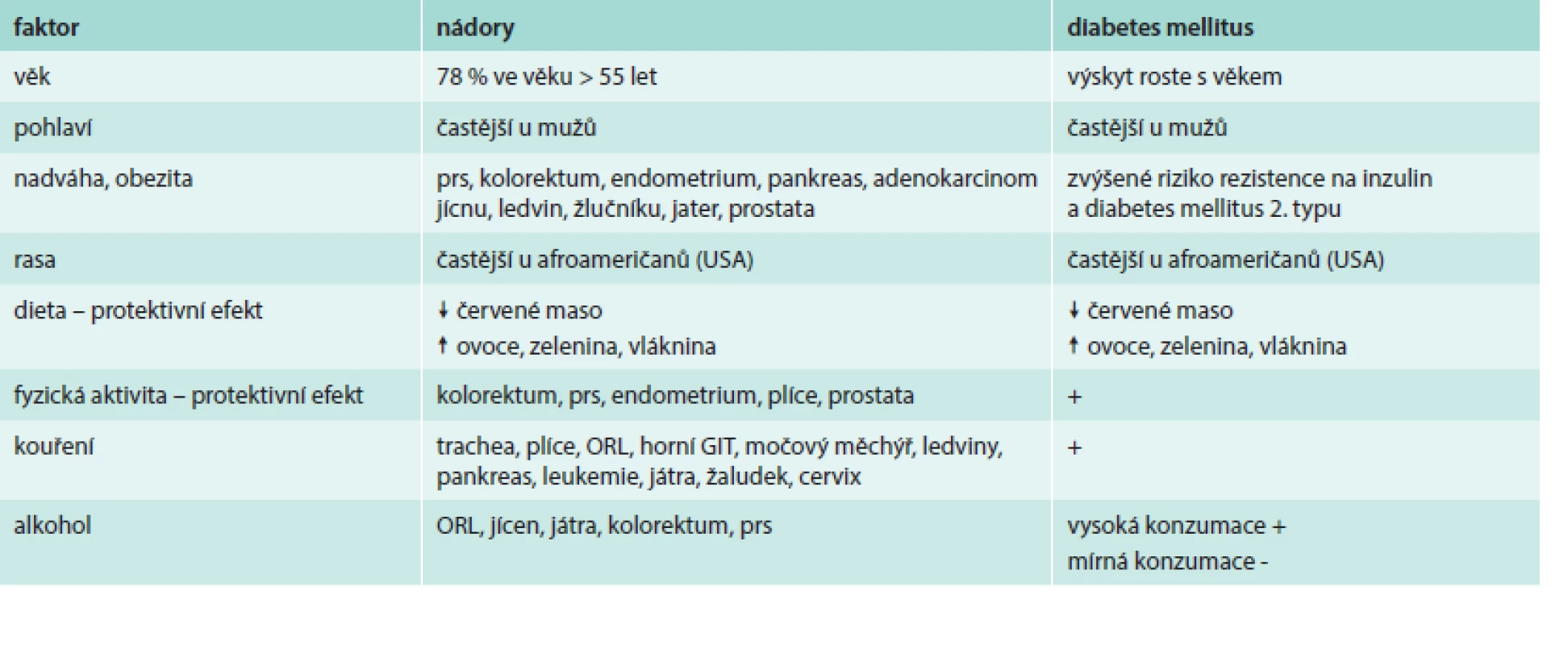
Vztah mezi diabetem a nádory zahrnuje řadu mechanizmů (hyperinzulinemie, hyperglykemie, oxidativní stres, chronický zánět, faktory spojené s obezitou, vliv diabetických komplikací).
Kancerogeneze je vícestupňový proces, tradičně se dělí na iniciaci – ireverzibilní první krok vedoucí k malignímu zvratu buňky, promoce – stimulace růstu, progrese – vzrůstající agresivita nádorového fenotypu. Podstatou maligní transformace je aktivace onkogenů a inhibice supresorových genů a reparačních genů zodpovědných za opravu poškozené DNA. Tyto geny se za fyziologických podmínek účastní řízení buněčné proliferace a diferenciace na úrovni extracelulárních signálů, buněčných receptorů, intracelulárních přenašečů signálů a jaderných transkripčních faktorů. Porucha těchto regulací může mít kancerogenní efekt.
Hyperinzulinemie
Diabetes 2. typu je charakterizován inzulinovou rezistencí a hyperinzulinemií. Teprve později dochází k redukci sekrece inzulinu, která vede k progresivní hyperglykemii. Buňky s onkogenním potenciálem mohou být vystaveny elevovaným hladinám inzulinu po mnoho let a kancerogenní riziko může být přítomno již ve fázi prediabetu. Diabetici 1. typu jsou vystaveni vyšší expozici inzulinu podávaného léčebně. Exogenní inzulin se dostává k periferním tkáním v 2–5násobné koncentraci, než je fyziologická. Podobný efekt na hyperinzulinemii mají léky zvyšující hladiny cirkulujícího inzulinu včetně inzulinových analog a látek podporujících sekreci inzulinu. Hyperinzulinemie je spojena se zvýšením hladiny cirkulujícího insulin-like grow faktoru (IGF). Inzulin má jak metabolický, tak mitogenní efekt, který je zprostředkován vazbou na inzulinový receptor (IR) a příbuzný receptor pro IGF typu 1 (IGF-1R). Vazba inzulinu nebo IGF na příslušný receptor aktivuje vícečetné signální dráhy, které stimulují proliferaci, inhibují apoptózu, potencují invazi a metastazování. Většina nádorových buněk má zvýšené množství IR ve dvou formách, A a B. Především vazba inzulinu na receptor IR A, který v nádorových buňkách převažuje, vede k aktivaci růstu nádorové tkáně. Hyperinzulinemie může podporovat kancerogenezi nepřímo efektem na hladinu IGF. Inzulin redukuje jaterní produkci IGF vázajícího proteinu (IGF binding protein) a dochází k vzestupu hladin volného cirkulujícího bioaktivního IGF se silným mitogenním a antiapoptotickým účinkem. Hyperinzulinemie rovněž snižuje jaterní syntézu proteinu vázajícího pohlavní hormony, což vede k vzestupu biologicky aktivního estrogenu, spojeným s vyšším rizikem nádorů prsu a endometria. Vysoké hladiny inzulinu rovněž způsobují zvýšenou expresi leptinu, který zvyšuje expresi VEGF a nádorovou neoangiogenezi [12].
Hyperglykemie
Většina nádorových buněk produkuje energii glykolýzou následovanou fermentací kyseliny mléčné i v přítomnosti kyslíku namísto oxidativní fosforylace probíhající v normálních buňkách. Tento jev byl nazván aerobní glykolýza neboli také Warburgův efekt. Vyprodukovaná energie a meziprodukty jsou nádorovými buňkami využívány pro syntézu nových makromolekul. Jedná se o aktivní proces řízený onkogeny a nádorovými supresorovými geny. Maligní rychle proliferující nádorové buňky mají intenzitu glykolýzy 10–100krát vyšší v porovnání s normálními buňkami. Vysoký příjem glukózy nádorovými buňkami je principem pozitronové emisní tomografie s 18F-fluorodeoxyglukózou. Vysoké hladiny glukózy teoreticky protěžují aerobní glykolýzu a nádorové buňky. Nicméně moderní studie prokázaly, že nádory spotřebovávají velké množství glukózy nezávisle na její hladině v krvi [13]. Recentní metaanalýza u pacientů s diabetem 2. typu nepotvrdila asociaci mezi kompenzací diabetu a mírou rizika zhoubného nádoru a úmrtí na něj [14]. Její výsledky však nejsou přijímány bez výhrad. Ve své studii Yang et al evidovali o 18 % vyšší riziko nádoru pro vzestup glykogenovaného hemoglobinu (HbA1c) o každé 1 % [15]. Hyperglykemie může být nezávislým rizikovým faktorem pro vznik nádoru či dokonce pouze markerem kauzálních procesů vedoucích ke kancerogenezi. Hyperglykemie může také snižovat efektivitu imunitního systému a ovlivňovat reakci na oxidativní stres. Teprve další studie ukáží vztah mezi inzulinem a glukózou při vzniku a vývoji nádorového bujení.
Chronický zánět a oxidativní stres
Deregulovaný metabolizmus při špatně kontrolovaném diabetu způsobuje permanentní proinflamatorní stav provázený zvýšenými hladinami IL6, TNFα, C reaktivního proteinu a jiných markerů chronického zánětu. Zánětem indukované reaktivní formy kyslíku mohou poškozovat buněčnou DNA, proteiny a lipidy, což přímo či nepřímo přispívá k maligní buněčné transformaci [16,17]. Role chronického zánětu v podpoře nádorového růstu je podpořena pozorováním, že nesteroidní antirevmatika redukují riziko některých typů nádorů (např. karcinomu tlustého střeva). Není prokázáno, že samotný zánět je dostačující pro iniciaci kancerogeneze, ale zánět dozajista podporuje nádorovou progresi. Asociace mezi zánětem a nádorem je zprostředkována inflamatorními cytokiny a transkripčními faktory, jako je nukleární faktor κB (NF-κB) a přenašeč buněčných signálů a transkripční aktivátor STAT [18]. Tyto zánětlivé mediátory ovlivňují proliferaci a přežívání maligních buněk, podporují neoangiogenezi a metastazování a modifikují odezvu na hormony nebo cytostatika.
Mechanizmy vlivu diabetu na nádory v jednotlivých lokalizacích
Játra
Epidemiologické studie prokázaly, že nejvyšší riziko představuje diabetes pro hepatocelulární karcinom. Játra jsou exponována vysokým koncentracím endogenního inzulinu cestou portální žíly. Hyperinzulinemie stimuluje produkci IGF1, což dále zvyšuje buněčnou proliferaci a inhibuje apoptózu v játrech. U diabetických pacientů se vyskytuje také častěji jaterní steatóza, hepatitida a cirhóza, což jsou známé rizikové faktory hepatocelulárního karcinomu. Inzulinová rezistence stimuluje řadu proinflamatorních cytokinů, a tak podporuje rozvoj jaterní steatózy, zánětu a nakonec i karcinomu. Kauzální závislost popsali Jee et al [19], když prokázali, že hladina glykemie a riziko jaterního karcinomu na sobě závisí. Kromě toho hyperglykemie indukuje uvolňování TNFα a IL6 u pacientů s jaterní steatózou, a tak podporuje vznik nádoru.
Diabetes je také spojen se zvýšeným výskytem žlučových kamenů, které představují rizikový faktor pro nádory žlučových cest.
Pankreas
Karcinom pankreatu je u diabetických pacientů 2–3krát častější než u nediabetiků. Je nutné odlišit situaci, kdy přítomnost diabetu vede ke vzniku karcinomu, od diabetu, který vzniká sekundárně jako důsledek poškození parenchymu nádorem. Hyperglykemie a diabetes vzniklé po 45–50 letech věku bez pozitivní rodinné anamnézy by měly být důvodem k vyšetření pankreatu [20]. Nicméně studie, které vyloučily sekundární diabetes vzniklý jako následek karcinomu pankreatu (zahrnovaly pouze pacienty, kteří měli diagnostikovaný diabetes 1–5 let před diagnózou nebo úmrtím na pankreatický karcinom), potvrdily, že diabetes zvyšuje riziko pankreatického karcinomu [12]. Vysvětlením je patrně expozice pankreatických buněk velmi vysokým dávkám inzulinu v důsledku těsné blízkosti sekrečních buněk.
Kolorektální karcinom
Riziko kolorektálního karcinomu je u diabetiků asi 1,2–1,3krát vyšší než u nediabetiků, a to i po korekcích na jiné přispívající faktory, jako je obezita. K vyššímu riziku karcinomu přispívá kromě hyperinzulinemie a IGF1 také zpomalení střevní motility u diabetiků a delší expozice sliznice potenciálním kancerogenům [21].
Nádory prsu a gynekologické nádory
Zvýšené riziko karcinomu prsu a endometria u diabetických pacientek se vysvětluje zvýšením hladin bioaktivních estrogenů, což je způsobeno hyperinzulinemií inhibovanou produkcí pohlavní hormony vázajícího globulinu [22,23].
Nádory ledvin a močového měchýře
Vyšší riziko nádorů ledvin a močového měchýře u diabetiků je patrně důsledkem diabetické nefropatie s poruchou renálních funkcí, častých infekcí močových cest, hypertenze a antihypertenzivní medikace [24].
Karcinom prostaty
Riziko karcinomu prostaty je u diabetiků nižší než u kontrolní populace, relativní riziko je 0,81–0,89. Možnou příčinou je snížení hladin testosteronu u diabetických pacientů. Dále je známo, že polymorfizmy v genu HNF1B, které jsou spojeny se zvýšeným rizikem diabetu, mají zároveň protektivní účinek na karcinom prostaty [25].
Léčba diabetu 2. typu a její vliv na nádory
Léky užívané v léčbě diabetu lze rozdělit do 3 hlavních skupin: inzulin a analoga inzulinu, stimulátory sekrece inzulinu (deriváty sulfonylurey a inkretiny) a inzulinové senzitizéry (biguanidy a tiazolidindiony).
Řada studií dokazuje, že terapií indukovaná hyperinzulinemie (exogenní inzulin a jeho analoga, stimulátory produkce inzulinu) zvyšují riziko zhoubných nádorů [26] a také 2–4krát mortalitu na nádorová onemocnění [27]. Pravděpodobně rovněž existuje závislost rizika karcinomu, dávky a doby léčby [28]. Výsledky některých studií [29] vedly k podezření, že inzulinová analoga, především inzulin glarin, mohou vést ke zvýšení rizika nádorů v porovnání s humánními inzuliny, patrně zprostředkovanému přes IGF1R signalizaci. Nicméně velká populační studie vycházející ze skotské národní klinické databáze diabetu vyšší incidenci nádorů u pacientů léčených inzulinem glargin zpochybnila [30] a v současné době nejsou důkazy, že by inzulin glargin zvyšoval riziko karcinomu v porovnání s humánním inzulinem.
Jiná situace je u 3. skupiny antidiabetik, která účinkují jako inzulinové senzitizéry. Tyto látky zvyšují citlivost na inzulin, snižují hyperinzulinemii a její prokancerogenní efekt. Zvláštní pozornost se v současné době věnuje metforminu. Metformin je dobře tolerovaný lék, nevede k hypoglykemii, má kardiovaskulární protektivní efekt, příznivý vliv na metabolizmus lipidů a redukci obezity. Několik epidemiologických studií prokázalo snížení rizika u diabetických pacientů léčených metforminem. Tento efekt byl popsán u několika typů nádorů, včetně tlustého střeva, pankreatu a ovarií. Ve velké studii provedené v UK porovnávající výskyt nádorů u diabetických pacientů léčených inzulinem glarin, dlouhodobým humánním inzulinem, bifazickým inzulinovým analogem, humánním bifázickým analogem a metforminem byl metformin asociován se snížením rizika nádorů tlustého střeva a pankreatu. Tento efekt nebyl pozorován u nádorů prsu a prostaty. Přidání metforminu k inzulinovým režimům redukovalo riziko karcinomu o 50 %. Každý rok podávání exogenního inzulinu byl spojen se zvýšením rizika nádoru o 20 % [26]. V kanadské studii [31] bylo u pacientů s metforminem pozorováno snížení rizika karcinomu v porovnání s pacienty léčenými sulfonylureou. V souhrnu, podle publikovaných studií diabetičtí pacienti léčení metforminem mají o 25–40 % méně zhoubných nádorů v porovnání s pacienty léčenými léky zvyšujícími hladinu inzulinu, tj. inzulinem, jeho analogy a deriváty sulfonylurey [32]. Metformin je rovněž spojen se snížením mortality na nádorová onemocnění [27,33,34], a to jak při podání před diagnózou zhoubného nádoru, tak po stanovení jeho diagnózy [35]. Diabetičtí pacienti s karcinomem prsu léčení metforminem měli vyšší počet úplných patologických odezev na předoperační chemoterapii [36]. V metaanalýze publikované Noto et al byl metformin u diabetiků spojen se snížením incidence nádorů a úmrtnosti na ně [37]. Byl popsán vztah mezi dávkou metforminu a redukcí rizika karcinomů [33]. Analýza s korekcemi na věk, pohlaví, BMI, trvání diabetu, HbA1c, kouření a užití derivátů sulfonylurey a inzulinu prokázala snížení rizika nádorů s relativním rizikem 0,43 (0,23–0,80) u pacientů užívajících metformin a každé zvýšení dávky metforminu o 1 g bylo provázeno relativním rizikem 0,58 (0,36–0,93).
Protinádorový účinek metforminu je komplexní povahy. V in vitro studiích metformin prokázal antiproliferační efekt na buněčné linie nádorů prsu, tlustého střeva, ovarií, pankreatu, plic a prostaty, vedl k selektivnímu usmrcování kmenových nádorových buněk, k zástavě buněčného cyklu v G 0/1 nebo S fázi a ke snížení exprese HER2neu a EGFR. Na molekulární úrovni metformin aktivuje signální dráhy AMPK v závislosti na aktivaci kinázy LKB1 a inhibuje mTOR. Konečným výsledkem je inhibice buněčné proliferace, ev. indukce apoptózy [38]. Vedle přímého protinádorového účinku vykazuje metformin účinek nepřímý, vázaný na snížení hladiny inzulinu a glykemie. Metformin (a také tiazolidindiony) redukují oxidativní stres a chronický zánět, které se podílejí na nádorové progresi.
Metformin je v současné době studován i u onkologických pacientů bez diabetu (karcinom prostaty, prsu, endometria a pankreatu). Předmětem testování je i využití metforminu v chemoprevenci prekanceróz a léčbě minimální reziduální nemoci [39,40].
Antikancerogenní efekt byl prokázán i u tiazolidindionů (TZD), nicméně počet studií je zatím omezený [41,42].
Implikace pro klinickou praxi
Pacienti s diabetem jsou ohroženi rizikem vzniku některých typů zhoubných nádorů. Primární prevencí obou onemocnění je zdravá dieta, fyzická aktivita a redukce váhy, omezení konzumace alkoholu a zanechání kouření. Tyto faktory současně zlepšují prognózu jak diabetu, tak nádoru. Při péči o diabetické pacienty je třeba mít zvýšené riziko s diabetem spojených nádorů na paměti a indikovat příslušná screeningová vyšetření: mamografii, koloskopii, USG břicha a gynekologické vyšetření.
Zvýšená pozornost se musí věnovat léčbě diabetu onkologických pacientů. Byť výsledky studií vlivu glykemie na riziko vzniku nádoru a jeho prognózu jsou nejednoznačné, současná doporučení zdůrazňují nutnost její důsledné kontroly. Hyperglykemie je spojena s negativním ovlivněním imunitního systému, oxidativním stresem a diabetickými komplikacemi, které limitují onkologickou léčbu. Onkologická léčba je sama o sobě stres, který diabetes zhoršuje. Časté užití kortikoidů u onkologických pacientů bývá spojeno s dekompenzací diabetu. Diabetes rovněž zvyšuje komplikace onkologické léčby. V recentní studii diabetičtí pacienti léčení vysokodávkovanou radioterapií měli signifikantně vyšší incidenci genitouretrální toxicity [43].
Podle dosavadních poznatků se zdá, že je metformin spojen se snížením rizika nádorů a exogenní inzulin nebo stimulátory sekrece inzulinu se zvýšením rizika. Nicméně dle současných doporučení riziko nádoru nehraje při volbě diabetické léčby u standardních pacientů majoritní roli, typ antidiabetické léčby by měl být důkladně zvážen u pacientů s vysokým rizikem některých typů nádorů [44]. Mortalita na kardiovaskulární onemocnění je u diabetických pacientů častější než mortalita na zhoubné nádory.
prof. MUDr. Jiří Petera, Ph.D.
petera@fnhk.cz
Klinika onkologie a radioterapie LF UK a FN, Hradec Králové
www.fnhk.cz
Doručeno do redakce 28. 8. 2014
Přijato po recenzi 17. 9. 2014
Zdroje
1. Lopez AD, Mathers CD, Ezzati M et al. Global and regional burden of disease and risk factors, 2001: systematic analysis of population health data. Lancet 2006; 367(9524): 1747–1757.
2. National Diabetes Fact Sheet: General information and national estimates on diabetes in the United States, 2007. Centers for disease control and prevention: Atlanta, GA 2008. Dostupné z WWW: <http://www.cdc.gov/diabetes/pubs/pdf/ndfs_2007.pdf>.
3. Noto H, Tsujimoto T, Sasazuki T et al. Significantly increased risk of cancer in patients with diabetes mellitus: a systematic review and meta-analysis. Endocr Pract 2011; 17(4): 616–628.
4. Noto H, Goto A, Tsujimoto T et al. Latest insights into the risk of cancer in diabetes. J Diabetes Investig 2013; 4(3): 225–232.
5. Barone BB, Yeh HC, Snyder CF et al. Long term all cause mortality in cancer patients with preexisting diabetes mellitus: a systematic review and meta-analysis. JAMA 2008; 300(23): 2754–2764.
6. Meyerhardt JA, Catalano PJ, Haller DG et al. Impact of diabetes mellitus on outcomes in patients with colon cancer. J Clin Oncol 2003; 21(3): 433–440.
7. Inoue M, Iwasaki M, Otani T et al. Diabetes mellitus and the risk of cancer: results from a large-scale population-based cohort study in Japan. Arch Intern Med 2006; 166(17): 1871–1877.
8. Stattin P, Björ O, Ferrari P et al. Prospective study of hyperglycemia and cancer risk. Diabetes Care 2007; 30(3): 561–567.
9. Rapp K, Schroeder J, Klenk J et al. Fasting blood glucose and cancer risk in a cohort of more than 140 000 adults in Austria. Diabetologia 2006; 49(5): 945–952.
10. Green A, Jensesn OM. Frequency of cancer among insulin-treated diabetic patients in Denmark. Diabetologia 1985; 28(3): 128–130.
11. Zendehdel K, Nyrén O, Őstenson CG et al. Cancer incidence in patients with type 1 diabetes mellitus: a population-based cohort study in Sweden. J Natl Cancer Inst 2003; 95(23): 1797–1800.
12. Sciacca L, Vigneri R, Tumminia A et al. Clinical and molecular mechanisms favoring cancer initiaion and progression in diabetic patients. Nutr Metab Cardiovasc Dis 2013; 23(9): 808–815.
13. Taubes G. Cancer research. Unraveling the obesity – cancer connection. Science 2012; 335 (6064): 28, 30–32.
14. Johnson JA, Bowker SL. Intensive glycaemic control and risk in type 2 diabetes: a metaanalysis of major trials. Diabetologia 2011; 54(1): 25–31.
15. Yang X, Ko GT, Wy H et al. Associations of hyperglycaemia and insulin usage with the risk of cancer in type 2 diabetes: the Hong Kong Diabetes Registry. Diabetes 2010; 59(5): 1254–1260.
16. Wu Y, Zhou BP. Inflammation: a driving force speeds cancer metastasis. Cell Cycle 2009; 8(20): 3267–3273.
17. Mantovani A, Allavena P, Sica A et at. Cancer-related inflammation. Nature 2008; 454 (7203): 436–444.
18. Kasem S. NF-kappaB function as a tumour promoter in inflammation-associated cancer. Nature 2004; 431(7007): 461–466.
19. Jee SH, Ohrr H, Sull JW et al. Fasting serum glucose level and cancer risk in Korean men and women. JAMA 2005; 293(2): 194–202.
20. Vigneri P, Frasca F, Sciacca L et al. Diabetes and cancer. Endocr Relat Cancer 2009; 16(4): 1103–1123.
21. Wong P, Weiner MG, Hwang WT et al. Insulin therapy and colorectal adenomas in patients with diabetes mellitus. Cancer Epidemiol Biomarkers Prev 2012; 21(10): 1833–1840.
22. Zhang ZH, Su PY, Hao JH et al. The role in preexisting diabetes mellitus on incidence and mortality of endometrial cancer: a meta-analysis of prospective cohort studies. Int J Gynecol Cancer 2013; 23(2): 234–303.
23. James RE, Lukanova A, Dossus L et al. Postmenopausal serum sex steroids and risk of hormone recepro-positive and -negative breast cancer: a nested case-control study. Cancer Prev Res (Phila) 2011; 4(10): 1626–1653.
24. Sipahi I, Debanne SM, Rowland DY et al. Angiotensin-receptor blockade and a risk of cancer: meta-analysis of randomized controlled trials. Lancet Oncology 2010; 11(7): 627–636.
25. Frayling TM, Colhoun H, Florez JC. A genetic link between type 2 diabetes and prostate cancer. Diabetologia 2008; 51(10): 1757–1760.
26. Currie CJ, Poole CD, Gale EA. The influence of glucose-lowering therapies on cancer risk in type 2 diabetes. Diabetologia 2009; 52(9): 1766–1777.
27. Baur DM, Klotsche J, Hamvik OP et al. Type 2 diabetes mellitus and medication for type 2 diabetes mellitus are associated with risk for and mortality from cancer in a German primary care cohort. Metabolism 2011; 60(10): 1363–1371.
28. Mannucci E, Monami M, Balzi D et al. Doses of insulin and its analogues and cancer occurrence in insulin treated type 2 diabetic patients. Diabetes Care 2010; 33(9): 1997–2003.
29. Hemkens LG, Grouven U, Bender R et al. Risk of malignancies in patients with diabetes treated with human insulin or insulin analogues: a cohort study. Diabetologia 2009; 52(9): 1732–1754.
30. Colhoun HM. SDRN Epidemiology Group. Use of insuline glargine and cancer incidence in Scotland: a study form the Scottish Diabetes Research Notwork Epidemiology Group. Diabetologia 2009; 52(9): 1755–1765.
31. Bowker SL, Majumdar SR, Veugelers P et al. Increased cancer-related mortality for patients with type 2 diabetes who use sulfonylureas or insulin. Diabetes Care 2006; 29(2): 254–258.
32. Taubes G. Cancer Research. Cancer preention with a diabetes pill? Science 2012; 335(6064): 29.
33. Landman GW, Kleefstra N, Van Hateren KJ et al. Metformin associated with lower cancer mortality in type 2 diabetes: ZODIAC-16. Diabetes Care 2010; 33(2): 322–326.
34. He X, Esteva FJ, Ensor J et al. Metformin and thiazolidinediones are associated with improved breast cancer-specific survival of diabetic women with HER2+ breast cancer. Ann Oncol 2011; 23(7): 1771–1780.
35. Currie CJ, Poole CD, Jenkins-Jones S et al. Mortality after incident cancer in people with and without type 2 diabetes: impact of metformin on survival. Diabetes care 2002; 35(2): 299–304.
36. Jiralerspong S, Palla SL, Giordano SH et al. Metformin and pathologic complete responses to neoadjuvant chemotherapy in diabetic patients with breast cancer. J Clin Oncol 2009; 27(20): 3297–3302.
37. Noto H, Goto A, Tsujimoto T et al. Cancer risk in diabetic patients treated with metformin: a systematic review and meta-analysis. PLoS ONE 2012; 7(3): e33411. Dostupné z DOI: <http://doi: 10.1371/journal.pone.0033411>.
38. McFarland MS, Cripps R Diabetes mellitus and increased risk of cancer: focus on metformin and the insulin analogs. Pharmacotherapy 2010; 30(11): 1159–1178.
39. Tesařová P. Metformin – nová hvězda onkologické léčby? Onkologie 2012; 6(2): 82–84.
40. Tesařová P. Diabetes mellitus a zhoubný nádor. Onkologie 2011; 5(3): 163–168.
41. Govindarajan, Ratnasinghe L, Simmons DL et al. Thiazolidinediones and the risk of lung, prostate and colon cancer in patients with diabetes. J Clin Oncol 2007; 25(12): 1476–1481.
42. Kahn SE, Haffner SM, Heise MA et al. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N Engl J Med 2006; 355 : 2427–2443.
43. Kalakota K, Liauw SL. Toxicity after external beam radiotherapy for prostate cancer: an analysis of late morbidity in men with diabetes mellitus. Urology 2013; 81(6): 1196–1201.
44. Giovannucci E, Harlan DFM, Archer MC et al. Diabetes and cancer: a consensus report. Diabetes Care 2010; 33(7): 1674–1685.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo Suppl 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Dispenzarizace nemocných po léčbě karcinomu prsu, kolorekta a prostaty
- Diferenciální diagnostika eozinofilie
- Vývoj a současná funkčnost informační základny české onkologické péče
- Moje setkávání s profesorem MUDr. Jiřím Vorlíčkem, CSc.
- O bolesti trochu jinak
- Nové antibiotiká: potrebujeme nové molekuly, alebo nové stratégie?
- Geriatrický nemocný v onkologii
- Nové náhledy na roli lidského papilomaviru v léčbě nádorů hlavy a krku
- Ph-negativní myeloproliferativní onemocnění s trombocytemií ve světle účinku léčby přípravkem Thromboreductin® v datech registru ke konci roku 2013
- Diabetes mellitus a zhoubné nádory
- Paliativní medicína a dobrá smrt
- Testikulární zhoubné nádory – jsme snad u konce cesty?
- Klinické hodnocení nových léčiv u vzácných diagnóz v onkologii – současná situace v Evropě a u nás
- Paliativní péče a chronické srdeční selhání
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Diferenciální diagnostika eozinofilie
- Paliativní medicína a dobrá smrt
- Dispenzarizace nemocných po léčbě karcinomu prsu, kolorekta a prostaty
- Ph-negativní myeloproliferativní onemocnění s trombocytemií ve světle účinku léčby přípravkem Thromboreductin® v datech registru ke konci roku 2013
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



