-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCo nabízí dnešní medicína, když selže diagnostika karcinomu ledviny ve stadiu lokalizovaném na orgán?
WHAT POSSIBILITIES ARE CURRENTLY AVAILABLE AFTER RENAL CARCINOMA (ORGAN CONFINED) DIAGNOSTICS FAILURE?
Targeted therapy has recently become the skeleton of metastatic renal carcinoma treatment. The major agens for metastatic renal cancer treatment include sunitinib, temsirolimus, pazopanib and bevacizumab/INF as the first line therapy, and everolimus as the second line therapy (after VEGF-TKI inhibitor) and sorafenib (after cytokine therapy); however the optimal sequence of the individual medicaments has not been defined. All the medicaments are associated with specific side effects, therefore before initiating the treatment it is necessary to consider the clinical conditions of the patient, all comorbidities and the toxicity profile of given agens.
Key words:
metastatic renal carcinomatargeted therapy
Autoři: J. Katolická
Působiště autorů: Onkologicko-chirurgické oddělení FN u svaté Anny, Brno
Vyšlo v časopise: Urol List 2011; 9(4): 39-42
Souhrn
Základem léčby metastatického karcinomu ledviny se v posledních letech stala cílená léčba. Sunitinib, temsirolimus, pazopanib, bevacizumab/INFα v 1. linii, everolimus v 2. linii po léčbě inhibitorem VEGF-TKI a sorafenib po léčbě cytokinem jsou zásadní medikamenty v léčbě metastatického renálního karcinomu, jejích optimální sekvence ale není přesně definovaná. Každý z preparátů má své specifické nežádoucí účinky, proto je potřeba před zahájením léčby zvážit klinický stav pacienta, přidružené nemoci a toxicitu zvoleného léku.
Klíčová slova:
metastatický renální karcinom, cílená terapieV léčbě metastatického renálního karcinomu (mRCC) se v minulosti uplatňovala imunoterapie nebo systémová chemoterapie. Obě modality byly ale ve většině případů neúčinné. Základem léčby metastatického karcinomu ledviny se v posledních pěti letech stala cílená léčba, která nejen v řadě klinických studií, ale následně i běžné klinické praxi potvrdila svůj léčebný potenciál. Klinické trialy fáze III prokázaly účinnost tyrozinkinázových inhibitorů (TKI) sorafenibu, sunitinibu, pazopanibu, VEGF inhibitoru bevacizumabu a inhibitorů kinázy mTOR (mammaliantargetofrapamycin) temsirolimu a everolimu.
Velmi důležitým kritériem pro léčbu pokročilých a metastatických nádorů ledvin je rozdělení pacientů do rizikových skupin podle prognostických faktorů, které byly vytvořeny v MemorialSloan-Kettering-Cancer Center (MSKCC). Celý model hodnocení nízké, střední a vysoké míry rizika je založen na celkovém stavu pacienta (KPS < 80 %), koncentraci hemoglobinu (pod dolní hranicí normy), hladině sérového LDH (> 1,5 násobek horní hranice normy), sérového kalcia (> 10 mg/dl) a odstupu od stanovení diagnózy (< 12 měsíců). U pacientů bez přítomnosti těchto faktorů je riziko nízké a prognóza příznivá, nemocní s přítomností dvou a více faktorů patří do rizika středního, přítomnost tří a více faktorů znamená zařazení do skupiny s vysokým rizikem a špatnou prognózou.
Sunitinib (Sutent) v současné době představuje základ léčby metastatického světlobuněčného karcinomu ledviny v 1. linii pro pacienty s nízkým a středním rizikem [1]. Studie fáze III srovnávala efektivitu a bezpečnost podání sunitinibu ve srovnání s interferonem alfa (INFα) u nepředléčených nemocných ve skupině s dobrou nebo střední prognózou podle MSKCC. Medián přežití bez progrese onemocnění (PFS) ve skupině se sunitibem byl 11 měsíců (95% CI 11–13), v rameni s INFα 5 měsíců (95% CI 4–6), což je dvakrát delší doba. Medián PFS byl u sunitinibu delší napříč všemi prognostickými skupinami. Celkem bylo v rameni se sunitinibem zaznamenáno 47 % objektivních odpovědí, v rameni s INFα jich bylo 12 % (p < 0,001). Celková doba přežití v rameni se sunitinibem byla 26,4 měsíců ve srovnání s 21,8 měsíci u ramene s INFα. Další subanalýzy prokázaly, že při zkříženém podání, kdy 25 pacientů z ramene s INFα užívalo následně sunitinib, přežívalo 26,4 měsíce, kdežto nemocní na INFα pouze 20 měsíců, p = 0,036. Pokud byli nemocní léčeni pouze první linií léčby bez další následné terapie, byl rozdíl v celkovém přežití mezi sunitinibem a INFα ještě výraznější (28,1 vs 14,1 měsíce, HR 0,647, 95% CI 0,483–0,870; p = 0,003). Pozitivní odpověď na léčbu sunitinibem lze předvídat pomocí markerů, kterými jsou výskyt hypertenze a hand-foot syndromu (HFS), které patří mezi nejčastější nežádoucí účinky při léčbě tyrozinkinázovými inhibitory. Hypertenze, kdy byl podáván sunitinib, byla spojena s vyšší klinickou účinností léčby [2], je potřeba ji kontrolovat již od zahájení terapie a adekvátně léčit, ne snižovat dávky sunitinibu. Přežití bez progrese onemocnění bylo signifikantně delší u pacientů s vyšším systolickým (sTK) i diastolickým tlakem (dTK) ve srovnání s pacienty s normálními tlaky (sTK 12,5 vs 2,5 měsíce; p < 0,001, dTK 13,4 vs 5,3 měsíce; p < 0,0001). Prediktivní význam hand-foot syndromu byl vyhodnocen z retrospektivní analýzy dat pacientů z pěti klinických studií (n = 770) v 1. a 2. linii léčby metastatického karcinomu ledviny [3]. Nemocní, u kterých se během terapie sunitinibem objevil hand-foot syndrom, měli statisticky významně delší PFS a celkovou dobu přežití (OS) než ti, u kterých k rozvoji hand-foot syndromu nedošlo (PFS 14,3 vs 8,3 měsíce; p < 0,0001, OS 38,2 vs 18,9 měsíce; p < 0,0001).
Sorafenib (Nexavar) je prvním inhibitorem tyrozinkináz užívaným v terapii metastatického renálního karcinomu. [4]. V III. fázi klinického hodnocení byl u mRCC testován ve studii TARGET (n = 903). Ve druhé linii bylo sorafenibem léčeno 56 % nemocných a ve třetí linii léčby 34 %. Primárním cílem bylo celkové přežití, sekundárním ukazatelem přežití bez progrese onemocnění. Sorafenib v dávce 400 mg dvakrát denně p.o. prokázal významně vyšší účinek na PFS oproti placebu (25 vs 12 týdnů, HR = 0,48; 95% CI 0,32–0,73) a snížil úmrtnost ve srovnání s placebem o 39 % (95% CI 0,54–0,94; p = 0,02). Parciální objektivní léčebné odpovědi bylo dosaženo u 10 % nemocných léčených sorafenibem vs 2 % při podávání placeba, p < 0,001. Celkově sorafenib prodloužil v porovnání s placebem střední dobu přežití o 23 %; 19,3 vs 15,9 měsíce (HR = 0,77; 95% CI 0,63 – 0,95; p = 0,02). V rámci studie TARGET bylo provedeno hodnocení kvality života (QoL), které prokázalo, že sorafenib ve srovnání s placebem kvalitu života takto léčených pacientů nezhoršuje, naopak má pozitivní vliv na vybrané parametry QoL u nemocných s mRCC: radost ze života (p = 0,0219), kašel (p < 0,0001), kratší dech (p < 0,0312), obavy ze zhoršení zdravotního stavu (p = 0,0009), horečka (p = 0,0016).
Bevacizumab (Avastin) INFα byl hodnocen ve velkých prospektivních klinických studiích. Studie AVOREN je randomizovanou, dvojitě zaslepenou a placebem kontrolovanou studií fáze III na 649 nemocných s metastatickým karcinomem ledviny [5]. Byla porovnávána léčba INFα v kombinaci s placebem a léčba INFα spolu s bevacizumabem. Nemocní byli stratifikováni dle rizikových skupin s dobrou, střední a špatnou prognózou. INFα byl podáván 3× týdně v dávce 9 MIU s.c. maximálně 52 týdnů. Bevacizumab v dávce 10 mg/kg 1× za 14 dní byl aplikován do progrese onemocnění. Primárním cílem studie bylo stanovení doby celkového přežití a sekundárními cíli bylo stanovení doby přežití bez progrese onemocnění, četnost celkové odpovědi nádoru a tolerance léčby. Doba do progrese byla ve skupině s bevacizumabem významně prodloužena na 10,2 vs 5,4 měsíce (HR 0,63, 95% CI 0,52–0,75; p = 0,0001). Celková četnost odpovědí byla ve skupině s bevacizumabem významně zvýšena, a to téměř na trojnásobek oproti standardní léčbě v kontrolním rameni 31,4 vs 12,8 % (p = 0,0001). Ve studii AVOREN byl hodnocen léčebný přínos kombinace INFα s bevacizumabem u jednotlivých prognostických skupin dle MSKCC. Doba přežití bez progrese onemocnění byla u skupiny s dobrou prognózou 12,9 vs 7,6 měsíce, u skupiny se střední prognózou 10,2 vs 4,5 měsíce a u skupiny se špatnou prognózou 2,2 vs 2,1 měsíce. Z léčby kombinací INFα a bevacizumab měla největší prospěch skupina s dobrou a střední prognózou. V případě zaznamenání výrazných nežádoucích účinků byla dávka INFα snížena, čímž došlo k ústupu toxicity bez vlivu na efektivitu terapie. Podobné výsledky s prodloužením PFS u skupiny s nízkým a středním rizikem byly zaznamenány také v další studii CALGB-90206. Při sekvenční léčbě inhibitory tyrozinkináz použitých následně po kombinaci bevacizumab + INFα lze dosáhnout mediánu přežití 38,6 měsíce.
Posledním se zaregistrovaných inhibitorů TKI je pazopanib (Votrient) hodnocen ve studii fáze III VEG105192 u pacientů s lokálně pokročilým nebo metastazujícím renálním karcinomem, kteří byli rozděleni do dvou ramen, pazopanib dávce 800 mg jednou denně vs placebo [6]. Primárním cílem studie bylo zhodnocení přežití bez progrese onemocnění, sekundárním cílem bylo celkové přežití, doba trvání odpovědi. Většina pacientů byla ve skupině s nízkým (39 %) nebo středním rizikem (54 %) podle MSKCC. U skupiny léčené pazopanibem bylo dosaženo mediánu 9,2 měsíce přežití bez progrese vs 4,2 měsíce u ramene s placebem, p < 0,001. Dosažená celková odpověď u pazopanibu byla 30 % vs3 % u skupiny s placebem, p < 0,001. U nepředléčených nemocných bylo dosaženo přežití bez progrese 11,1 měsíců pro pazopanib vs 2,8 měsícům u placeba, p < 0,001. U předléčených cytokiny byla délka PFS 7,4 měsíce vs 4,2 měsíce ve prospěch pazopanibu, p < 0,001.
Temsirolimus (Torisel) patřící do skupiny mTOR inhibitorů byl hodnocen v randomizované studii fáze III (Global ARCC trial – A Globat Trial forAdvancedRenal Cell Carcinoma) [7]. Pacienti byli rovnoměrně randomizováni do tří ramen, A: monoterapie INFα v eskalaci na 18 MIU s.c. třikrát týdně, B: temsirolimus 25 mg i.v., C: temsirolimus 15 mg/týden i.v. s INFα 6 MIU s.c. třikrát týdně. Do studie byli zařazováni nepředléčení pacienti s generalizovaným onemocněním a negativními prognostickými rysy. Studie si stanovila jako primární cíl hodnocení doby celkového přežití. Celkem bylo do studie zařazeno 626 pacientů. Z celkového počtu zařazených nemocných ≥ 3 rizikové faktory nakonec mělo 94 % zařazených respondentů. V ramenech INFα v monoterapii, temsirolimus v monoterapii a kombinace INFα s temsirolimem byly zaznamenány objektivní odpovědi v 7 %, 9 % a 11 % případů, klinický benefit (kompletní remise + parciální remise + stabilizace onemocnění ≥ 16 týdnů) nastal ve 29 %, 46 % a 41 % případů. V jednotlivých výše uvedených ramenech bylo dosaženo mediánu doby do progrese onemocnění: 3,1, 5,5 a 4,7 měsíců. Medián celkového přežití v rameni s INFα byl 7,3 měsíců, s temsirolimem v monoterapii 10,9 měsíců a s INFα aplikovaným s temsirolimem 8,4 měsíců. V rameni, ve kterém byl podáván temsirolimus v monoterapii, nastalo u 49 % respondentů zlepšení mediánu celkového přežití ve srovnání s ramenem s INFα, čímž bylo potvrzeno dosažení primárního cíle studie. V rameni s kombinovanou léčbou došlo v mediánu celkového přežití pouze k 15% zlepšení.
Everolimus (Afinitor) je selektivní inhibitor mTOR (mammaliantargetofrapamycin), jeho efektivita u metastazujícího karcinomu ledviny byla hodnocena v multicentrické, randomizované, dvojitě slepé studii RECORD-1 fáze III porovnávající everolimus p.o. v dávce 10 mg za den a placebo u pacientů s progresí onemocnění při antiangiogenní léčbě tyrozinkinázovými inhibitory nebo po ní. Do studie byli zařazeni dospělí pacienti s mRCC se světlebuněčnou složkou, u kterých došlo k progresi onemocnění po předchozí léčbě tyrozinkinázovými inhibitory sunitinibem, sorafenibem nebo oběma těmito léky podávanými postupně, přičemž byla povolena také předchozí léčba bevacizumabem a cytokiny. Jednalo se o tzv. cross-over design, tj. že pacienti v placebové větvi, u kterých došlo k progresi onemocnění, byli převáděni na léčbu everolimem. Celkově bylo randomizováno 416 pacientů v poměru 2 : 1 buď do skupiny léčené everolimem (n = 272), nebo do skupiny užívající placebo (n = 138). Primárním cílem bylo přežití bez progrese onemocnění, sekundární cíle studie zahrnovaly míru objektivní odpovědi, celkové přežívání, bezpečnost léčby, kvalitu života a symptomy související s onemocněním. PFS byl statisticky významně delší u pacientů léčených everolimem oproti pacientům užívajícím placebo: 4,9 měsíce vs 1,9 měsíce se statisticky významným 67% snížením rizika progrese nebo úmrtí (HR = 0,33; 95% CI 0,25; 0,43; p < 0,0001).Šestiměsíční míra přežití bez progrese onemocnění byla 36 % ve větvi léčené everolimem a 9 % v placebové větvi. Prospěch z léčby everolimem byl zaznamenán ve všech podskupinách pacientů, které byly definovány podle MSKCC kritérií, předchozí léčby, věku a pohlaví. Pacienti předléčení jedním inhibitorem TKI měli při následné léčbě everolimem delší medián PFS než pacienti předléčení dvěma inhibitory tyrozinkináz (5,4 měsíce vs 3,8 měsíce). Potvrzené objektivní odpovědi nádoru byly pozorovány u 2 % pacientů léčených everolimem, zatímco u pacientů užívajících placebo nebyla zaznamenána žádná odpověď. Stabilizace onemocnění byla zaznamenaná u 67 % pacientů léčených everolimem. Vzhledem ke cross-over designu nebyl zaznamenán statisticky významný rozdíl v celkovém přežití (everolimus: 14,8 měsíců vs placebo: 14,4 měsíce; HR = 0,87; 95% CI 0,65; 1,17; p = 0,177) [8].
JAKÝ JE TEDY ALGORITMUS LÉČBY METASTATICKÉHO RENÁLNÍHO KARCINOMU? (TAB. 1)
Nežádoucí účinky cílené terapie
Cílená léčba bývá provázena řadou nežádoucích účinků, i když je obecně lépe tolerovaná než chemoterapie. Léčba inhibitory tyrozinkinázy je obecně nejčastěji provázená hand-foot syndromem, mukositidou, neutropenií, anémií, únavou a hypertenzí. Kombinace cytokinu a bevacizumabu také rizikem perforace gastrointestinálního traktu, krvácení, trombembolické nemoci, proteinurií a anorexií. Pro mTOR inhibitory jsou typické pneumonitidy. Každý z preparátů má své specifické nežádoucí účinky, proto je potřeba před zahájením léčby zvážit klinický stav pacienta, přidružené nemoci a toxicitu zvoleného léku.
Tab. 1. Doporučení National Comprehensive Cancer Network (NCCN) k léčbě metastatického renálního karcinomu. 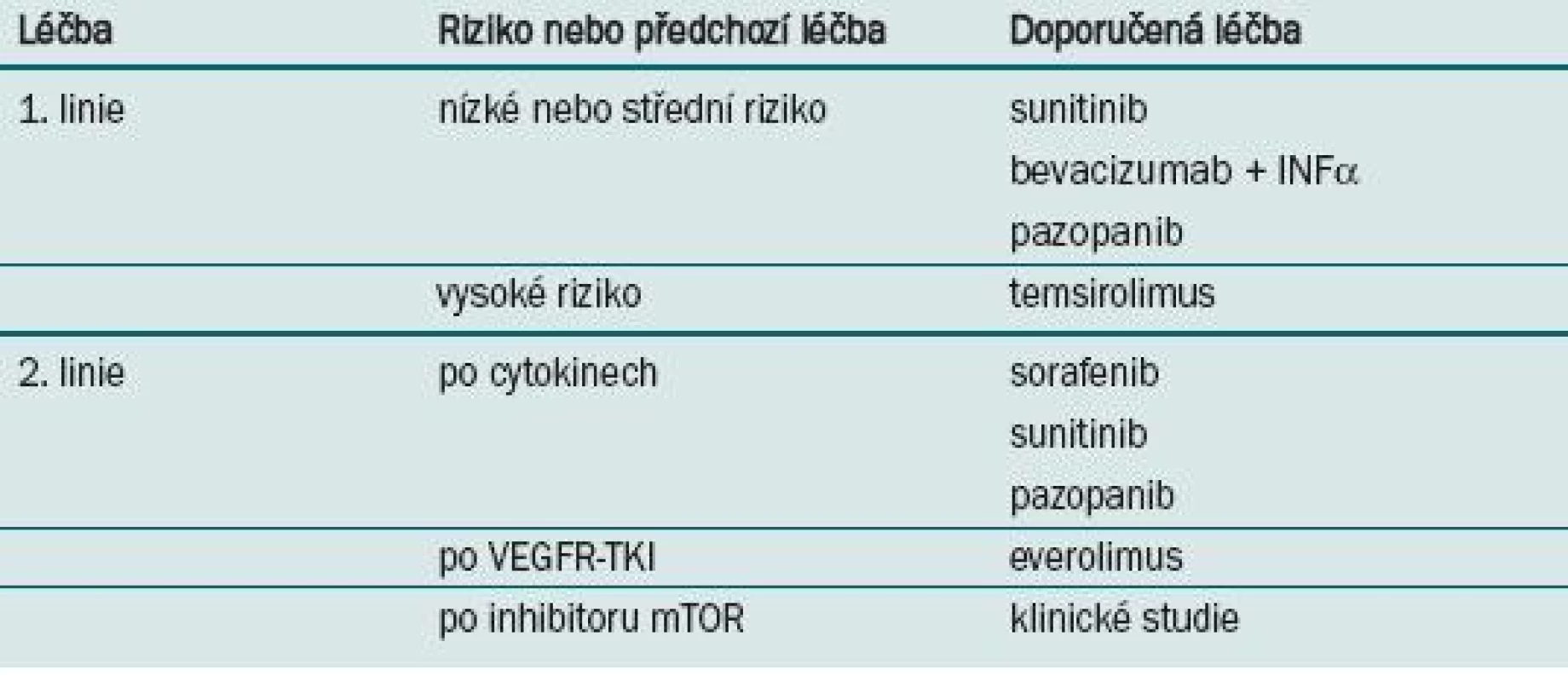
Prospěch pacienta z léčby je zásadní při rozhodování o léčbě metastatického renálního karcinomu. Vzhledem k nákladům na cílenou terapii byla data ze studií fáze II a III se sunitinibem, sorafenibem, temsirolimem a bevacizumabem plus INF& v 1. linii léčby metastatického renálního karcinomu zpracována k posouzení tzv. cost-effectiveness (poměr mezi účinností, cenou, nežádoucími účinky a kvalitou života pacienta). Závěry ekonomických analýz provedených v USA, Švédsku a Španělsku shledaly náklady na sunitinib nižší než bevacizumab s INF& a ostatními testovanými preparáty. Také National Institute for Health and Clinical Excellence (NICE) ve Velké Británii doporučil sunitinib z ekonomického hlediska do 1. linie léčby metastatického renálního karcinomu [9].
Otázkou stále zůstává, jak postupovat po selhání léčby 1. linie. Možností, jak prodloužit přežití bez progrese onemocnění a pravděpodobně i celkové přežití pacientů s metastatickým renálním karcinomem, je sekvenční terapie. Několik retrospektivních studií hodnotilo sekvenční podání inhibitorů tyrozinkinázy (TKI) sunitinib po sorafenibu a naopak. Byla zaznamenána neúplná rezistence mezi sunitinibem a sorafenibem. V retrospektivní studii bylo 68 nemocných po sorafenibu léčeno sunitinibem a u 22 nemocných byl po sunitinibu podán sorafenib. Doba bez progrese onemocnění představovala 25 a 17 týdnů pro sunitinib a sorafenib podaný jako TKI ve 2. linii, celkový medián doby podávání terapie pak byl 61, resp. 49 týdnů pro sekvenci sorafenib – sunitinib, resp. sunitinib – sorafenib. Tuto sekvenci dále zkoumá studie fáze III pod názvem SWITCH. Zatím jediná randomizovaná studie fáze III, která hodnotila působení everolimu v léčbě II. a III. linie, byla již zmiňovaná studie RECORD-1. Pacienti refrakterní jak na sunitinib, tak na sorafenib měli medián doby bez progrese onemocnění 4,9 měsíce v rameni s everolimem vs 1,8 měsíce pro nemocné léčené pouze placebem. To je důvod, proč by everolimus měl být považován za léčebný standard pro léčbu u metastatického renálního karcinomu po selhání léčby VEGF-TKI inhibitory. Everolimus je zatím jediným lékem, u kterého byla prokázána účinnost ve druhé a dalších liniích léčby metastatického karcinomu ledviny po selhání předchozí léčby tyrozinkinázovými inhibitory [10].
ZÁVĚR
Sunitinib, temsirolimus, pazopanib, bevacizumab/INFα v 1. linii, everolimus v 2. linii po léčbě inhibitorem VEGF-TKI a sorafenib po léčbě cytokinem jsou zásadní medikamenty v léčbě metastatického renálního karcinomu, jejich optimální sekvence ale není přesně definovaná. Není pochyb o tom, že léčba tak „zákeřného“ onemocnění, jakým je renální karcinom, v posledních letech sice zaznamenala výrazný posun, je ale potřeba mít na mysli, že u metastatického onemocnění se stále jedná o léčbu paliativní a kvalita života pacienta je to, na co bychom neměli zapomínat.
MUDr. Jana Katolická
Onkologicko-chirurgické oddělení FN u svaté Anny, Brno
Pekařská 53/55, 656 91 Brno
jana.katolicka@fnusa.cz
Zdroje
1. Zama IN, Hutson TE, Elson P et al. Sunitinib rechallange in metastatic renal cell carcinoma patients. Cancer 2010; 116(23): 5400–5406.
2. Rini BI, Cohen DP, Lu DR et al. Hypertension (HTN) as a biomarker of efficacy in patients (pts) with metastatic renal carcinoma (mRCC) treated with sunitinib. 2010 ASCO Genitourinary Cancers Symposium, abstract 312.
3. Michaelson MD, Cohen DP, Li S et al. Hand-foot syndrome (HFS) as a potential biomarker of efficacy in patients (pts) with metastatic renal carcinoma (mRCC) treated with sunitinib (SU). 2011 ASCO Genitourinary Cancer Symposium, abstract 1320.
4. Escudier B, Eisen T, Stadler WM et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N Engl J Med 2007; 356(2): 125–134.
5. Escudier B, Bellmunt J, Negrier S et al. Phase III trial of bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma (AVOREN): final analysis of overal survival. J ClinOncol 2010; 28(13): 144–150.
6. Sternberg CN, Davis ID, Mardiak J et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J ClinOncol 2010; 28(6): 1061–1068.
7. Hudes G, Carducci M, Tomczak P et al. Global ARCC Trial. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl Med 2007; 356 : 2271–2281.
8. Motzer R, Escudier B, Oudard S et al. Phase 3 trial of everolimus for metastatic renal cell carcinoma – final results and analysis of prognostic factors. Cancer 2010; 116(18): 4256–4265.
9. National Institute for Health and Clinical Excellence. Final appraisal determination – sunitinib for the first-line treatment of advanced and/or metastatic renal cell carcinoma. 2004.
10. Puzanov I. Sekvenční terapie renálního karcinomu. Farmakoterapie 2011; 7(2): 192–199.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2011 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Nefron šetřící operace bez zasvorkování renálního hilu
- Minimálně invazivní laparoskopická a roboticky asistovaná parciální resekce ledviny: stručná historie a přehled
- Laparoskopická a robotická heminefrektomie a ureteroureterostomie v rámci léčby zdvojeného vývodného systému horních cest močových
- Chirurgická léčba lokálně pokročilého karcinomu ledviny s nádorovým trombem v žilním řečišti T3b, T3c
- Co nabízí dnešní medicína, když selže diagnostika karcinomu ledviny ve stadiu lokalizovaném na orgán?
- Možnosti predikce karcinomu prostaty pomocí PCA3
- Možnosti klinické aplikace kombinované léčby benigní hyperplazie prostaty
- Indikace a výsledky ablace tumoru ledviny
-
EAU Guidelines pro diagnostiku a léčbu uroteliálního karcinomu horních cest močových
aktualizace 2011 - Úvodník
- Diagnostické možnosti časného zjištění nádorů ledvin, role nádorových markerů při stanovení dalšího postupu
- EAU Guidelines pro řešení močové inkontinence
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Možnosti predikce karcinomu prostaty pomocí PCA3
- Diagnostické možnosti časného zjištění nádorů ledvin, role nádorových markerů při stanovení dalšího postupu
- Chirurgická léčba lokálně pokročilého karcinomu ledviny s nádorovým trombem v žilním řečišti T3b, T3c
- Laparoskopická a robotická heminefrektomie a ureteroureterostomie v rámci léčby zdvojeného vývodného systému horních cest močových
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



