-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
PIPAC – přehled metody a první použití v České republice
PIPAC – overview of the method and first use in the Czech Republic
PIPAC is a new technique for intra-abdominal administration of aerosol chemotherapy in a gaseous environment (capnoperitoneum). It can be indicated for peritoneal spread of various origins, most commonly ovarian cancer, stomach cancer and colorectal cancer. Due to its mini-invasiveness, the application can be repeated.
The article provides a brief overview of current views of PIPAC and describes the first experience with PIPAC in the Czech Republic.
Keywords:
peritoneal carcinomatosis – PIPAC – HIPEC
Autoři: D. Hoskovec 1; Z. Krška 1; M. Vočka 2; P. Dytrych 1
Působiště autorů: I. chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze 1; Onkologická klinika 1. lékařské fakulty Univerzity Karlovy a Všeobecná fakultní nemocnice v Praze 2
Vyšlo v časopise: Rozhl. Chir., 2020, roč. 99, č. 12, s. 529-533.
Kategorie: Souhrnné sdělení
Souhrn
PIPAC je nová technika intraabdominálního podání chemoterapie formou aerosolu v plynném prostředí (kapnoperitoneu). Může být indikována u peritoneálního rozsevu různého origa, nejčastěji ovariálního karcinomu, karcinomu žaludku a kolorektálního karcinomu. Vzhledem k miniinvazivitě se může aplikace opakovat.
Článek podává krátký přehled současných pohledů na PIPAC a první zkušenosti s touto metodou v ČR.
Klíčová slova:
peritoneální karcinomatóza – PIPAC – HIPEC
Úvod
Peritoneální karcinomatóza je heterogenní onemocnění s velmi špatnou prognózou. Objevuje se s variabilní četností u různých onkologických diagnóz – u ovariálního karcinomu ve 40–50 %, karcinomu žaludku 15–50 %, kolorektálního karcinomu 5–25 %. Není neobvyklá ani u jiných intraabdominálních, ale i extraabdominálních malignit (nádory biliopankreatického systému, tenkého střeva, mammy ad.) [1,2]. Výskyt peritoneální karcinomatózy znamenal obvykle inkurabilní onemocnění a efekt konvenčně podávané chemoterapie je limitován existencí plazma peritoneální bariéry, která brání průniku cytostatik do dutiny peritoneální. PIPAC (Pressurized Intra Peritoneal Aerosol Chemotherapy) je relativně nová technika k aplikaci cytostatika intraperitoneálně. V současné době (srpen 2020) se při zadání hesla PIPAC v Pubmedu objeví 175 článků.
Technika PIPAC byla vypracována prof. M. Reymondem v Německu. První použití PIPAC v klinické praxi je z roku 2011 (5. 11.) a bylo publikováno v roce 2014 [2]. Autoři popsali použití PIPAC u tří pacientů s peritoneální karcinomatózou na podkladě karcinomu žaludku, kolorektálního karcinomu a ovariálního karcinomu. Od té doby je PIPAC užíván stále častěji k paliativní terapii peritoneální karcinomatózy, ale také je zde snaha „neoadjuvantní“ aplikace k redukci postižení peritonea a následné potenciálně kurativní cytoredukční operace (dále CRS) doplněné hypertermickou intraoperační chemoterapií (dále HIPEC). Metoda se rychle rozšířila a v roce 2018 bylo minimálně 100 center ve 30 zemích [3]. Kromě PIPAC se také (zatím vzácně) používá PITAC (Pressurized Intra Thoracic Aerosol Chemotherapy), k ovlivnění maligních pleurálních efuzí.
PIPAC
Principem metody je aplikace vysoce koncentrovaného cytostatického aerosolu v plynném prostředí (kapnoperitoneu) (Obr 1).
Obr. 1. Princip PIPAC [9]
Fig. 1: Principle of PIPAC [9]![Princip PIPAC [9]<br>
Fig. 1: Principle of PIPAC [9]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/98a73520ca3f680a5fc6384a66b624ce.png)
Potenciální výhody PIPAC (oproti jiným cestám podání cytostatik jak intraperitoneálně, včetně HIPEC, tak intravenózně) [2,4]:
lepší distribuce v peritoneální dutině,
hlubší penetrace cytostatika do tumorózní tkáně,
vyšší koncentrace cytostatika po skončení aplikace,
vyšší biologická aktivita,
snížení průniku cytostatika mimo peritoneální dutinu,
miniinvazivní metoda,
možnost opakování.
Popsané komplikace PIPAC [4]:
peroperační
perforace střeva
krvácení
léze břišní stěny
pooperační
prolongovaný ileus
ascites
perforace střeva (pozdní)
peritonitida
flegmóna břišní stěny
systémová toxicita
Komplikace jsou popisovány v 0–12 % [4].
Metoda je považována za bezpečnou jak pro pacienta, tak pro personál operačních sálů, kde opakovaně nebyla prokázána kontaminace povrchů oblečení ani rukavic operační skupiny. Navíc na sále v průběhu vlastní aplikace by neměl být přítomný žádný personál (z důvodu možné nehody, nikoliv rizika kontaminace při standardně probíhající proceduře) [5].
Indikací k použití metody PIPAC může být intraperitoneální rozsev různých tumorů, nejčastěji přichází v úvahu karcinom ovaria, žaludku, nádory hepatobiliopankreatického systému, maligní mezoteliom, kolorektální karcinom.
Kontraindikacemi jsou krátká očekávaná doba přežití, porucha průchodnosti GIT vyžadující totální parenterální nutrici, rozsáhlý ascites. PIPAC je také kontraindikován u výkonů, kde je současně nutnost sutury/anastomózy GIT. Relativní kontraindikací jsou extraperitoneální metastázy, trombóza portální žíly, špatný performance status. Za relativní kontraindikaci může být také považována předchozí cytoredukční chirurgie doplněná HIPEC.
Obvykle používaná cytostatika jsou cisplatina 7,5 mg/m2 v kombinaci s doxorubicinem 1,5 mg/m2 u většiny diagnóz, u kolorektálního karcinomu Oxaliplatina 92 mg/m2 [2–7].
PIPAC může být aplikován opakovaně, s intervalem 4–8 týdnů, buď v kombinaci s chemoterapií, nebo samostatně. Výkon se provádí laparoskopicky ze 2 portů – kamerový a pracovní. Po revizi dutiny břišní se pracovním portem zavede aplikátor (nebulizér CAPNOPEN® (Reger Medizintechnik, GmbH, Villingendorf, Germany) (Obr. 2) a vysokotlakou angiopumpou se aplikuje aerosol cytostatika. Po 30 minutách působení cytostatika dojde ke zrušení kapnoperitonea a ukončení operace. Materiál k aplikaci je jednorázový a nevýhodou je jeho vysoká cena (cca 65 000 Kč). Pro srovnání jedna dávka Avastinu, který se podává i v paliativní léčbě kolorektálního karcinomu v intervalu 2–3 týdnů, je cca 50 000 Kč.
Obr. 2. Capnopen [10]
Fig. 2: Capnopen [10]![Capnopen [10]<br>
Fig. 2: Capnopen [10]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/16ac407cd9a6f2f68ea5aadf6e6ca49d.png)
Alyami ve svém review z roku 2019 uvádí 838 pacientů s celkem 1810 PIPAC procedurami. Nejčastější indikace byly ovariální karcinom (41 %), karcinom žaludku (22 %), kolorektální karcinom (12 %), mezoteliom (7 %). 17 % bylo ostatních diagnóz [6].
Klinická odpověď je popisována u 62–88 % pacientů s ovariálním karcinomem, 50–91 % u karcinomu žaludku, 71–83 % u kolorektálního karcinomu a 67–75 % u peritoneálního mezoteliomu. Hodnocené parametry klinické odpovědi se liší v různých studiích – ústup ascitu, regrese dle zobrazovacích vyšetření, RECIST skóre, regrese peritoneálního postižení hodnocená PCI (Peritoneal cancer index), histologická regrese, délka přežití ad. [4,6].
Zároveň u 17,8 % pacientů s různými diagnózami opakovaný PIPAC vedl k dostatečně redukci peritoneální karcinomatózy a umožnil následný „radikální“ cytoredukční výkon doplněný HIPEC [7].
K hodnocení regrese nálezu při opakovaných aplikacích, kromě PCI, je navržen PRGS (Peritoneal regression grading score) (Tab. 1, Obr. 3) [8].
Tab. 1. Skóre regrese peritoneálních metastáz [8]
Tab. 1: Peritoneal regression grading score [8]![Skóre regrese peritoneálních metastáz [8]<br>
Tab. 1: Peritoneal regression grading score [8]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/a2958c760469f3c17f7a7da184e5bd21.png)
Obr. 3. Grafické znázornění PRGS [8]
Fig. 3: Schematic illustration of PRGS [8]![Grafické znázornění PRGS [8]<br>
Fig. 3: Schematic illustration of PRGS [8]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3636ea990eb12d09b13e760760abb802.png)
V současné době probíhá celá řada studií zaměřených na PIPAC v různých indikacích jak stran diagnóz, tak timingu a cíle PIPAC. Jsou zkoušeny různé modifikace techniky. Přehled těchto studií a modifikací přesahuje zaměření tohoto informačního článku.
Vlastní zkušenosti
Metoda PIPAC je od ledna 2020 k dispozici ve VFN – 1. chirurgická klinika. Poprvé jsme PIPAC použili ve VFN (a v ČR) 23. 1. 2020 u pacienta s karcinomem žaludku a peritoneálním rozsevem po předchozí chemoterapii a neoadjuvantně aplikovaném HIPEC (2×) v roce 2019 (Obr. 4–7). Peritoneální rozsev byl stacionární, PIPAC proběhl bez obtíží, pooperační rekonvalescence byla krátká, dimise 4. pooperační den. Při následném pokusu o plánovaný re PIPAC o 6 týdnů později ale nebylo možné získat dostatečný prostor v dutině břišní, od další intraperitoneální aplikace jsme upustili a nemocnému byla navržena paliativní chemoterapie.
Obr. 4. Vysokotlaká pumpa k aplikace PIPAC
Fig. 4: High pressure pump (working position)
Obr. 5. Displej vysokotlaké pumpy
Fig. 5: Display of the high pressure pump
Obr. 6. Capnopen v dutině břišní
Fig. 6: Capnopen in the abdominal cavity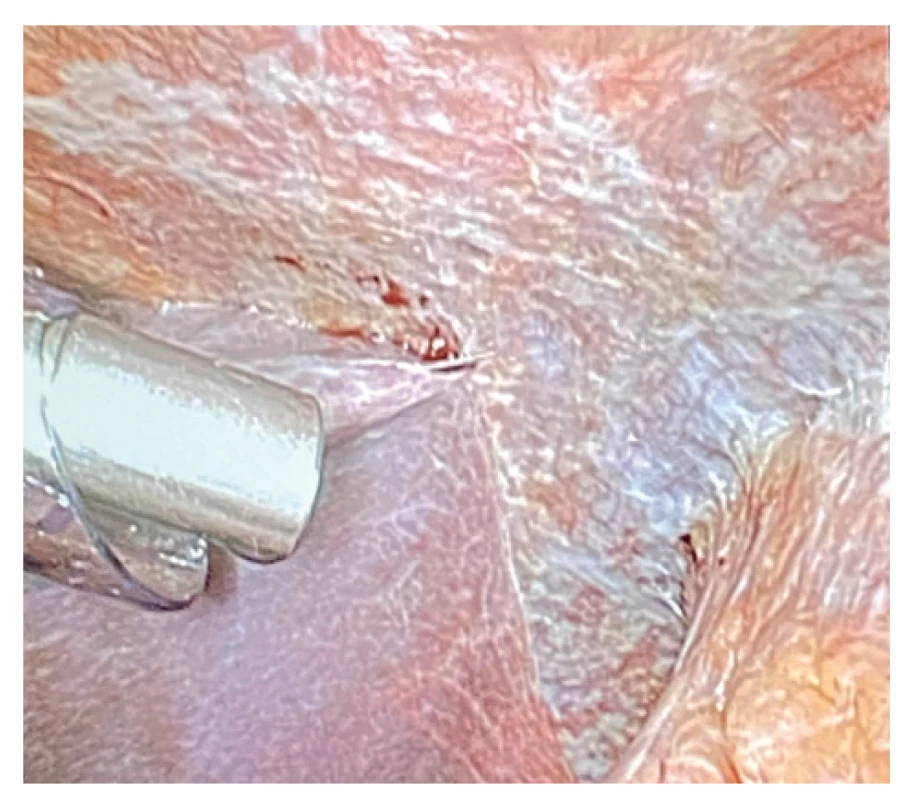
Obr. 7. Produkovaný aerosol v průběhu PIPAC
Fig. 7: Aerosol during PIPAC procedure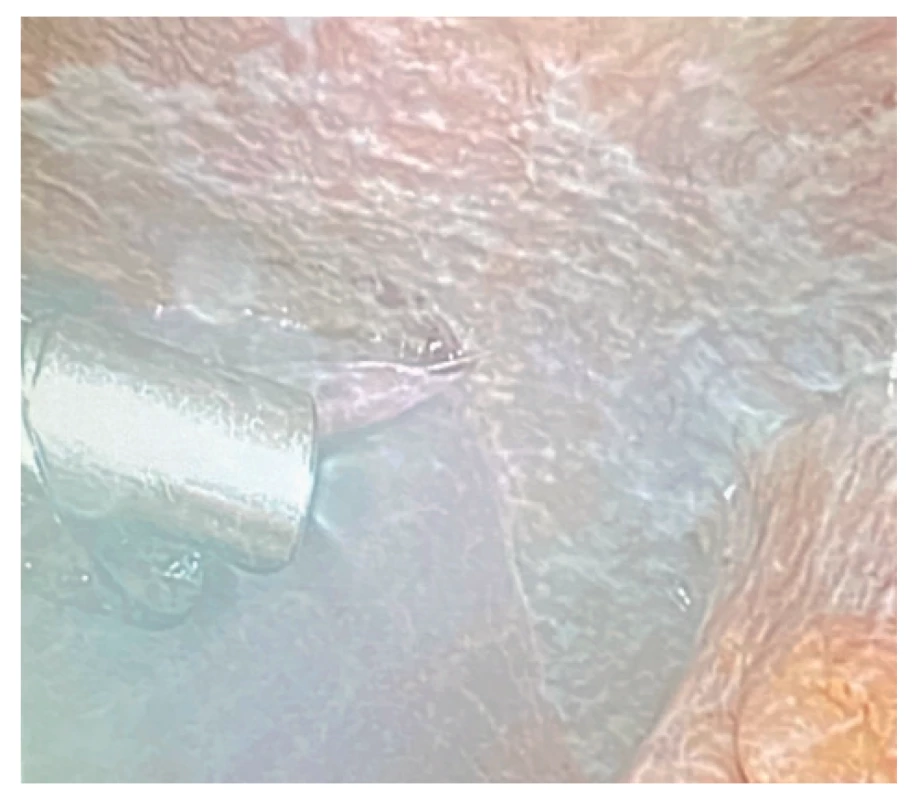
Jako indikační kritérium k aplikaci PIPAC používáme rozsah karcinomatózy hodnocený PCI – karcinom žaludku PCI více než 10, kolorektální karcinom PCI více než 15, ovariální karcinom s PCI nad 18. Při nižších hodnotách PCI vždy zvažujeme CRS + HIPEC.
Celkem jsme PIPAC v období 2020/1 až 2020/8 aplikovali 8× u čtyř nemocných (včetně výše uvedeného prvního pacienta) (Tab. 2). U dvou z nich je plánováno pokračování v terapii. PIPAC byl ve všech případech kombinován se standardní onkologickou terapií.
Tab. 2. PIPAC – naše zkušenosti
Tab. 2: PIPAC – our experience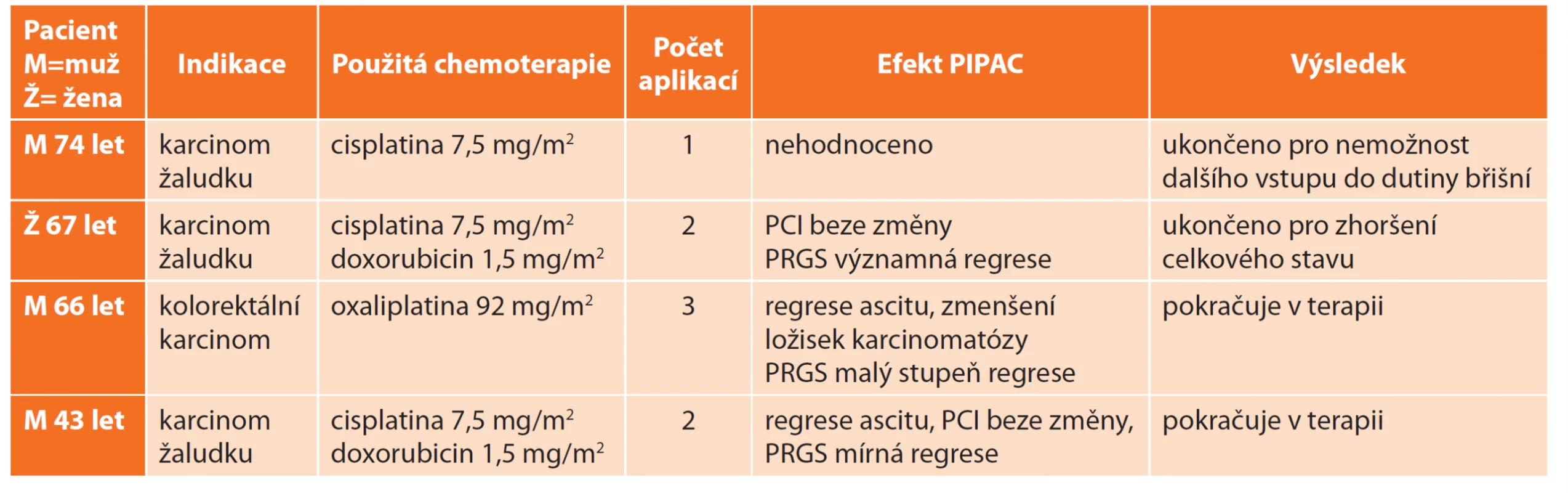
U všech nemocných proběhla aplikace bez komplikací s krátkou pooperační rekonvalescencí a dimisí 3.−4. pooperační den.
Závěr
PIPAC je potenciálně nadějnou metodou k ovlivnění peritoneální karcinomatózy, kde z různých důvodů není indikován HIPEC (rozsah onemocnění, celkový stav pacienta, základní onkologická diagnóza). Jako racionální se zdá použití PIPAC při vyšších hodnotách PCI, kde přínos CRS a HIPEC je minimální. PIPAC lze použít i u nádorů, kde běžně CRS a HIPEC neindikujeme (biliopankreatické nádory). Cílem aplikace může být paliativní léčba, ale i neoadjuvantní s cílem dosáhnout regrese nálezu, který umožní budoucí CRS + HIPEC.
Do budoucna se rýsuje i možnost snížení nákladů na spotřební materiál, protože firma Skala Medica (výrobce a dodavatel přístrojů pro HIPEC) vyvíjí vlastní aerosolovou aplikační sondu.
Podpořeno RVO VFN 64165, Progres Q25.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
doc. MUDr. David Hoskovec, Ph.D.
I. chirurgická klinika 1. LF UK a VFN v Praze
U Nemocnice 2
128 00 Praha 2
e-mail: david.hoskovec@vfn.cz
Zdroje
- Krška Z, Hoskovec D, Petruželka L. Chirurgická onkologie. Praha, Grada 2014. ISBN: 978-80-247-4284-7.
- Solass W, Kerb R, Mürdter T, et al. Intraperitoneal chemotherapy of peritoneal carcinomatosis using pressurized aerosol as an alternative to liquid solution: first evidence for efficacy. Ann Surg Oncol. 2014;21(2):553–559. doi: 10.1245/s10434-013-3213-1.
- Nowacki M, Zegarski W: The scientific report from the first pressurized intraperitoneal aerosol chemotherapy (PIPAC) procedures performed in the eastern part of Central Europe. J Int Med Res. 2018;46(9):3748–3758. doi: 10.1177/0300060518778637.
- Katdare N, Prabhu R, Mishra S, et al. Pressurized Intraperitoneal Aerosol Chemotherapy (PIPAC): Initial experience from Indian centers and a review of literature. Indian J Surg Oncol. 2019;10(1):24–30. doi: 10.1007/s13193-018-0771-5.
- Ndaw S, Hanser O, Kenepekian V, et al. Occupational exposure to platinum drugs during intraperitoneal chemotherapy. Biomonitoring and surface contamination. Toxicol Lett. 2018;298 : 171–176. doi: 10.1016/j.toxlet.2018.05.031.
- Alyami M, Hübner M, Grass F, et al. Pressurised intraperitoneal aerosol chemotherapy: rationale, evidence, and potential indications. Lancet Oncol. 2019;20(7):e368–e377. doi: 10.1016/S1470-2045(19)30318-3.
- Alyami M, Mercier F, Siebert M, et al. Unresectable peritoneal metastasis treated by pressurized intraperitoneal aerosol chemotherapy (PIPAC) leading to cytoreductive surgery and hyperthermic intraperitoneal chemotherapy. Eur J Surg Oncol. 2019 pii: S0748–7983(19)30522-0. doi: 10.1016/j.ejso.2019.06.028. [Epub ahead of print].
- Solass W, et al. Peritoneal sampling and histological assessment of therapeutic response in peritoneal metastasis: proposal of the Peritoneal Regression Grading Score (PRGS). Pleura and Peritoneum 2016;1,2 : 99–107. doi:10.1515/pp-2016-0011.
- Nadiradze G, Horvath P, Sautkin Y, et al. Overcoming drug resistance by taking advantage of physical principles: Pressurized Intraperitoneal Aerosol Chemotherapy (PIPAC). Cancers (Basel) 2019;12(1). pii: E34. doi: 10.3390/cancers12010034.
- https://www.technischweekblad.nl/nieuws/injectiemotor-voor-de-ok.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek P.F. 2021Článek Začátky mladého chirurga
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2020 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- P.F. 2021
- Ženy a muži v české, převážně lůžkové chirurgii
- Onkochirurgie v České republice
- PIPAC – přehled metody a první použití v České republice
- Technické modifikace přerušení apendixu při laparoskopické apendektomii
- Kombinace ERAS a miniinvazivní chirurgie v léčbě karcinomu rekta – krátkodobé výsledky
- Wunderlichův syndrom u pacientky se sporadickými bilaterálními angiomyolipomy
- Anus perinei ventralis v dospělosti – kazuistika
- Vysoká amputácia dolnej končatiny pre infikovaný sekundárny lymfedém − kazuistika
- Začátky mladého chirurga
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- PIPAC – přehled metody a první použití v České republice
- Anus perinei ventralis v dospělosti – kazuistika
- Vysoká amputácia dolnej končatiny pre infikovaný sekundárny lymfedém − kazuistika
- Začátky mladého chirurga
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



