-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Změny velikosti pravého a falešného lumen ve viscerálním segmentu po endovaskulární léčbě disekcí aorty typu B
Changes in the True and False Visceral Segment Lumen Sizes Following Endovascular Treatment of Type B Aortic Dissections
Introduction:
The aim of the study was to assess technical success rates of endovascular procedures in acute and chronic type B aortic dissections and changes in the right (PL) and false (FL) lumen diameters in the visceral segment region during short-term and long-term follow up study periods.Methods:
From 2004 to 2009, the authors performed a prospective study, which included a total of 33 patients with acute and subacute (n = 16; 48.5%) or chronic (n = 17; 51.5%) type B dissections of the descending aorta, with dissections spreading as far as the visceral or infrarenal regions. The patients underwent successful implantations of stent grafts (SG) into the descending aorta. The study group included 7 female and 26 male subjects, at the time of the procedure, their mean age was 59 years, (34–70, the median of 56 y.o.a.). The mean follow up time was 39.3 months (8–68, the median of 41 months). During the study period, one of the patients exited due to another internal disorder, three subjects were converted to open replacements for progressing dilatation of the total diameter in the visceral or subrenal region.The true (PL) and false (FL) lumen diameters were measured at four levels:
above the origin of truncus coeliacus (L 1), between the origin of truncus coeliacus and the origin of a. mesenterica superior (L 2), between the origin of a. mesenterica superior and the origin of aa. renales (L 3) and just distal to the origin of aa. renales (L 4). The measurements were performed 1 and 6 months after SG implantations and at the end of the study period.Results:
The primary entry was successfully sealed in all the study subjects. Significant widening of the true lumen in the region sealed by the stentgraft was recorded in all the subjects, however, the false lumen did not completely disappear in 3 (9%) patients. The false lumen was completely filled with thrombus down to the celiac trunk level (L 1) within one month in 7 (21.2%) patients, within 6 months in 14 (42.4%) subjects and by the end of the study period in 19 (58.6%) patients. The true lumen continued to enlarge at all the measured levels. The most significant enlargement was recorded at L1 during the first postoperative month (the mean change of 5.9 mm). Furthermore, narrowing of the originally patent false lumen was observed as well, with the most significant change at L1 level during the first postoperative month (the mean change of 6.5 mm).
At six months and during the whole follow up study period, further increases in the right lumen diameter and in the total aortic diameter were recorded at all the measured levels. At the same time, the false lumen diameters at all the measured levels continued to narrow, if patent at all.Conclusion:
False lumen thrombosis along the extent of SG was recorded in 30 (91%) patients, SG filled the lumen completely and the false lumen disappeared. The true lumen expanded at all the measured visceral segment levels. The change was most significant during the first postimplantation month, and the true lumen expansions and the false lumen narrowing proceeded over the whole follow up study period, however, the progression was slower. The visceral segment true and false lumen changes will be monitored further.Key words:
dissection B – stentgraft – true lumen – false lumen – visceral segment
Autoři: P. Šedivý; K. El Samman; P. Czinner; T. Mach *; P. Zdráhal; P. Šebesta; D. Pilous
Působiště autorů: Oddělení cévní chirurgie, Nemocnice Na Homolce, Praha, primář doc. MUDr. P. Štádler, Ph. D. ; Radiodiagnostické oddělení, Nemocnice Na Homolce, Praha, primář prof. MUDr. J. Vymazal, DrSc. *
Vyšlo v časopise: Rozhl. Chir., 2011, roč. 90, č. 1, s. 24-30.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Cílem práce bylo sledovat technickou úspěšnost endovaskulárního řešení akutních a chronických aortálních disekcí typu B a zhodnotit změny šířky pravého lumen (PL) a falešného lumen (FL) v oblasti viscerálního segmentu v krátkodobém a dlouhodobém sledování.Metody:
V letech 2004–2009 jsme prospektivně sledovali 33 pacientů s akutní a subakutní (n = 16; 48,5 %) nebo chronickou (n = 17; 51,5 %) disekcí B descendentní aorty s rozsahem disekce až do viscerálního a infrarenálního úseku, u kterých byla provedena úspěšná implantace stentgraftu (SG) do descendentní aorty. Soubor tvoří 7 žen a 26 mužů, průměrný věk v době výkonu byl 59 let (34–70, medián 56 let). Průměrná doba sledování činí 39,3 měsíce (8–68, medián 41 měsíců). Během tohoto období jeden z pacientů zemřel na jiné interní onemocnění, u tří proběhla konverze na otevřenou náhradu pro pokračující dilataci celkového průměru viscerálního nebo subrenálního úseku.Průměry PL a FL jsme měřili ve čtyřech úrovních:
nad odstupem truncus coeliacus (L 1), mezi odstupem truncus coeliacus a odstupem a. mesenterica superior (L 2), mezi odstupem a. mesenterica superior a odstupy aa. renales (L 3) a těsně pod odstupy aa. renales (L 4). Měření byla provedena po 1 a 6 měsících od implantace SG a poté na konci sledovaného období.Výsledky:
Překrytí primárního entry se zdařilo u všech pacientů. V úseku krytém SG došlo u všech osob k výraznému rozšíření PL, přesto FL v celém rozsahu SG u 3 (9%) pacientů zcela nezaniklo. FL až do úrovně tr. coeliacus (L 1) kompletně trombózovalo během 1 měsíce u 7 (21,2 %) nemocných, během 6 měsíců u 14 (42,4 %) a během celého sledovaného období u 19 (58,6 %) pacientů. Ve všech měřených úrovních docházelo ke zvětšování velikosti PL, nejvíce v úrovni L 1 během 1. měsíce (průměrně + 5,9 mm), a ke zmenšování velikosti dosud patentního FL, opět nejvíce v úrovni L 1 během 1. měsíce (průměrně zmenšení o 6,5 mm).
Po 6 měsících i v průběhu celého sledovaného období docházelo k dalšímu mírnému nárůstu velikostí PL a celkového průměru aorty ve všech měřených průměrech, současně se ve všech průměrech FL zmenšovalo, pokud bylo ještě průchodné.Závěr:
K trombóze FL v rozsahu SG došlo u 30 (91 %) pacientů, SG kompletně vyplnil průsvit aorty a FL zcela vymizelo. V oblasti viscerálního segmentu expandovalo PL ve všech měřených úrovních, nejrychleji v průběhu 1. měsíce po implantaci, v dalším průběhu sledování pokračovaly expanze PL a zmenšování FL, ale menší rychlostí. Změny velikostí FL a PL ve viscerálním segmentu budou nadále sledovány.Klíčová slova:
disekce B – stentgraft – pravé lumen – falešné lumen – viscerální segmentÚVOD
Endovaskulární řešení aortálních disekcí typu B se během posledních let ustálilo jako alternativní způsob léčby u pacientů s vysokým operačním rizikem nebo s nepříznivým základním biologickým onemocněním [1–7]. Také u pacientů po úspěšné kardiochirurgické operaci disekce A s přetrvávající disekcí B sestupné a abdominální aorty je endovaskulární postup metodou volby s mnohem menší chirurgickou zátěží pro nemocného [10–12].
Základní patologické diagnózy v této oblasti jsou disekce aortální stěny, penetrující aortální ulkus a akutní intramurální hematom. Zatímco ulceraci a intramurální hematom je technicky snadnější řešit, protože buď neobsahují falešné lumen (FL), nebo je toto lumen neprůtočné [8, 9], u disekce je vyřazení FL obtížnější. Stlačitelnost FL závisí na řadě faktorů, zejména na době trvání disekce, na jejím longitudinálním rozsahu, velikosti průtoku uvnitř FL, na počtu entry a reentry otvorů a na jejich lokalizaci.
Zatímco rychlé vymizení FL v rozsahu zavedeného tubulárního SG v descendentní aortě je již u řady pacientů dokumentováno, jen málo je zatím známo o osudu přetrvávající disekce ve viscerálním segmentu [13].
MATERIÁL A METODA
V letech 2004 až 2009 jsme v Nemocnici na Homolce provedli 36 implantací SG do hrudní aorty pro akutní nebo chronickou disekci B nebo pro akutní intramurální hematom. Endovaskulární řešení jsme volili u pacientů s akutní disekcí B komplikovanou refrakterní hypertenzí, celkovým průměrem disekované aorty nad 55 mm, vysokým operačním rizikem, byla-li anatomická situace pro zavedení stentgraftu příhodná, nebo u nemocných, kteří indikovanou otevřenou operaci odmítli. Zároveň jsme se snažili předejít vzniku neurologických komplikací.
Ze souboru dva pacienti v těsném perioperačním období zemřeli, jeden v důsledku masivní infarsace střevní, jeden pro technický neúspěch endovaskulárního postupu s nutností akutní otevřené konverze. U třetího pacienta jsme po úspěšném vyřešení disekce B v úseku descendentní aorty museli otevřeně provést větvený bypass na truncus coeliacus a a. mesenterica superior pro akutní ischemii. Následně bylo možné sledovat 33 pacientů, u kterých byla přítomna disekce celé descendentní aorty včetně viscerálního a infrarenálního úseku, a u kterých bylo endovaskulární řešení úspěšné. Sedm z nich bylo žen a 26 mužů, průměrné stáří pacientů v době implantace bylo 59 let (34–70, medián 56 let). Demografické údaje obsahuje tabulka 1. Implantovány byly hrudní stentgrafty EndoFit (LeMaitre Vascular Inc., Burlington, MA; n = 19) a TAG (W. L. Gore & Associates, Flagstaff, AZ; n = 14).
Tab. 1. Demografické údaje Tab. 1. Demographic data 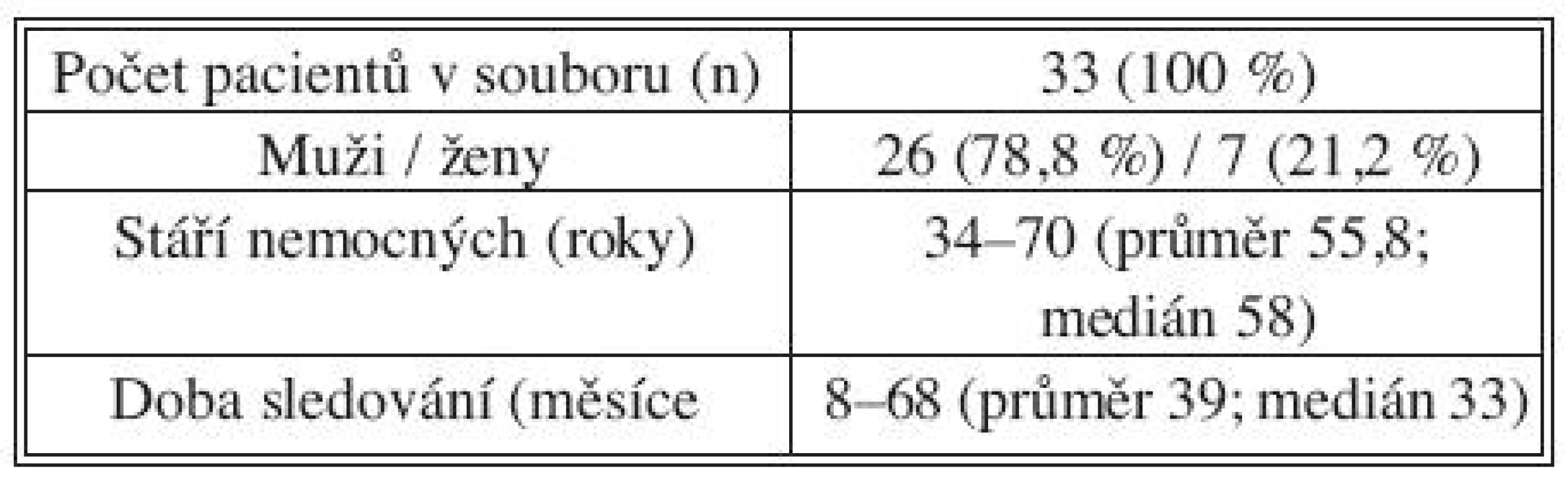
U 16 pacientů (48,5 %) se jednalo o akutní nebo subakutní disekci, v jednom případě (3 %) šlo o intramurální hematom, u 16 pacientů (48,5 %) byla disekce chronická (Tab. 2).
Tab. 2. Diagnóza Tab. 2. Diagnosis 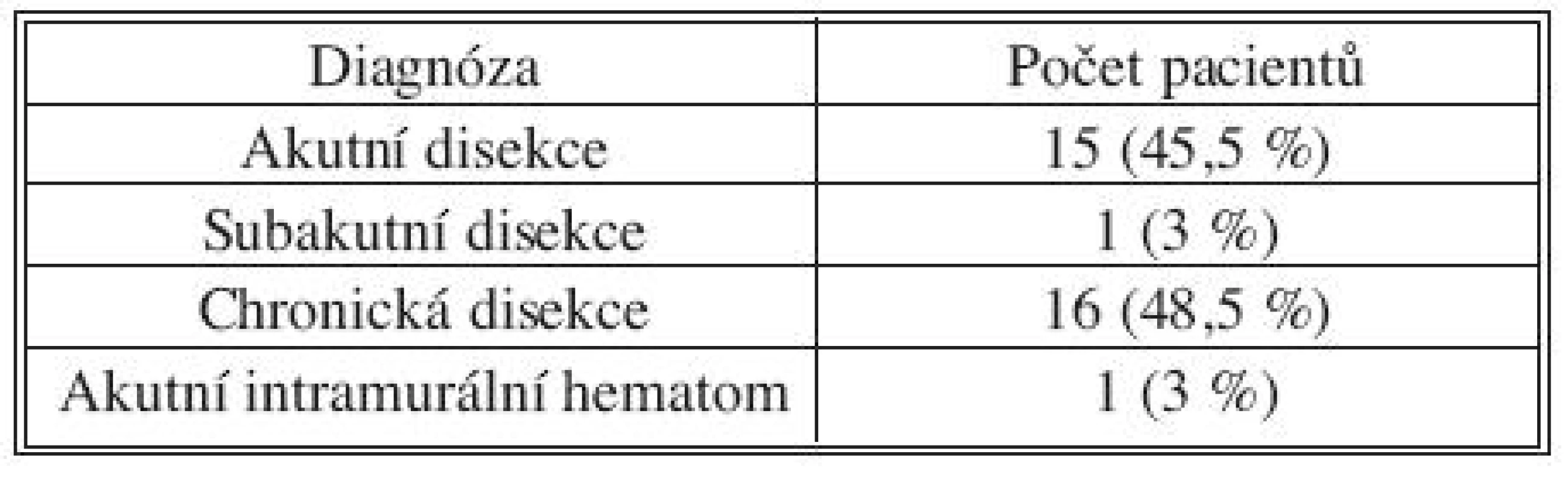
U tří z nich bylo postižení součástí Marfanova syndromu. Průvodním jevem disekce byla u 20 pacientů refrakterní hypertenze, u 10 porucha kontinuity aortálních větví, u 8 pleurální výpotek, ve třech případech šlo o krytou rupturu.
U pacientů s chronickou disekcí jsme výkon indikovali při průkazu rychlého zvětšování průměru aorty nebo při průměru aorty větší než 55 mm.
Všichni pacienti byli vyšetřeni CT nebo NMR angiografií, aby byl zjištěn rozsah disekce a průchodnost interkostálních, viscerálních, lumbálních a pánevních tepen. Peroperačně jsme přesnost proximálního kotvení kontrolovali transezofageální echografií. Následná měření lumin byla prováděna při kontrolních CT angiografiích.
Měřili jsme průměr pravého lumen (PL), FL a celkový průměr aorty ve čtyřech úrovních (Obr. 1): nad odstupem truncus coeliacus (L 1), mezi truncus coeliacus a a. mesenterica superior (L 2), mezi a. mesenterica superior a odstupy aa. renales (L 3) a pod odstupy aa. renales (L 4). Dále jsme sledovali vymizení falešného lumen v rozsahu stentgraftu a přítomnost endoleaku.
Obr. 1. Viscerální aorta – hladiny měření L 1, L 2, L 3 a L 4 Fig. 1. Visceral aorta – measurements at L 1, L 2, L 3 and L 4 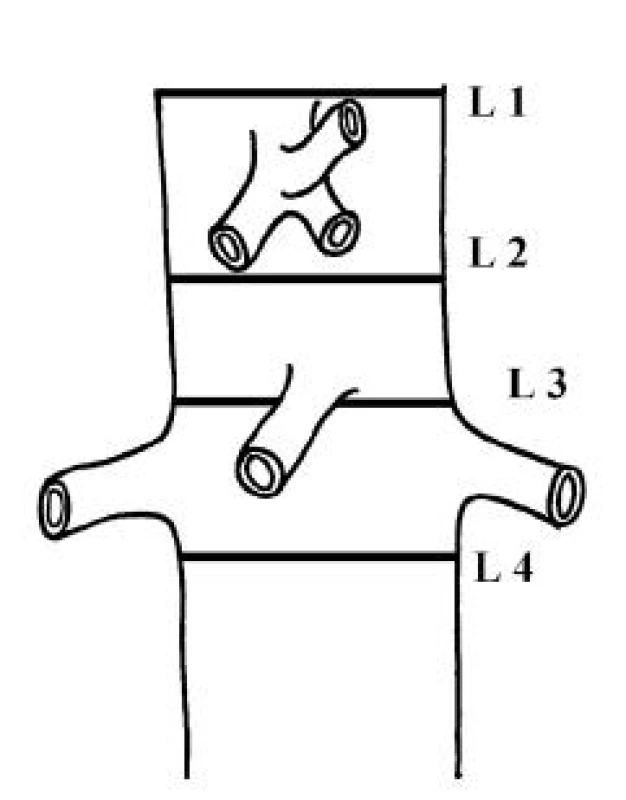
Kontrolní měření byla provedena s odstupem 1 a 6 měsíců od implantace, další intervaly měření byla vždy po 12 měsících. Poslední provedené měření jsme pro potřeby této publikace vyhodnotili jako „měření na konci sledovaného období“.
Abychom dosáhli příznivější kotvící zóny („landing zone“), záměrně jsme u 14 (42,4 %) pacientů překryli levou a. subclavia (AS) nebo větší část aortálního oblouku. Osmkrát byla AS překryta bez následných problémů, ve 3 případech si překrytí vynutilo ve druhé době její časnou nebo pozdní revaskularizaci.
U tří nemocných byl elektivně proveden hybridní výkon, zahrnující přemostění větví oblouku aorty z ascendentní aorty ze sternotomie a následnou implantaci SG s překrytím podstatné části oblouku.
Zpočátku naší činnosti jsme se snažili překrýt pouze proximální část disekované aorty s cílem uzavřít hlavní entry (prvních 10 pacientů). Toto řešení vedlo ke kompletní trombóze FL jen u jednoho z nich a neovlivnilo velikost PL a FL pod distálním ukončením SG. Ve druhé době jsme tedy extendovali u těchto pacientů původní krátké SG dalším segmentem a prodloužili jsme krytou část disekované aorty co nejníže k viscerálnímu segmentu při současném zachování alespoň dvou kaudálních párů interkostálních tepen, pokud byly průchodné. Současně jsme zahájili měření průměrů ve viscerálním segmentu, která jsou základem naší práce. V pozdějším období jsme překrývali ihned při prvním zákroku celou postiženou hrudní aortu až k truncus coeliacus. Pokud jsme prokázali průchodnost některé z posledních dvou párů interkostálních tepen, snažili jsme se tento supraviscerální segment ponechat nekrytý s cílem zabránit vzniku ischemické míšní léze.
Extendovat SG centrálně jsme museli pro proximální endoleak ve 3 případech, u 3 pacientů malý proximální endoleak spontánně vymizel. U sedmi postižených jsme v dalším průběhu implantovali do infrarenálního úseku aorty bifurkační SG a dále sledovali vývoj velikostí obou lumin viscerálního segmentu aorty. Indikací byla v jednom případě ischemie ledviny (hybridní operace s iliko-renálním bypassem) a třikrát významná ischemie dolních končetin (2x pouze SG, 1x hybridní výkon s femoro-femorálním cross-over bypassem).
Doba sledování jednotlivých pacientů činí 8–68 měsíců (průměr 39,3 měsíce, medián 41 měsíců).
Perioperační komplikace
Akutní ischemické potíže z překrytí levé podklíčkové tepny vznikly u dvou pacientů, u jednoho nemocného se tyto potíže objevily s několikaměsíčním odstupem. Ve všech případech byla situace vyřešena otevřenou revaskularizací.
Akutní neurologické komplikace rázu parézy dolních končetin nastaly u 3 (9,1 %) pacientů.
U prvního pacienta se po překrytí celé hrudní aorty až tr. coeliacus ihned rozvinula paréza až plegie PDK, ale hybnost se opět zcela obnovila během 24 hodin po léčbě drenáží mozkomíšního moku, elevaci arteriálního tlaku a po podání kortikoidů. Druhá časná monoparéza pravé dolní končetiny vznikla u jiného pacienta po zavedení následného aortoilického SG, nemocný má přetrvávající obtíže, ale je schopen chůze s berlí. Případ třetího pacienta, kde jsme pro ischemii a parézu dolních končetin vzniklou v delším časovém odstupu po operaci implantovali subrenálně aortouniiliacký SG a provedli extraanatomickou femoro-femorální rekonstrukci, jsme popsali v samostatném sdělení [14].
Pozdní neurologické komplikace rázu neischemické slabosti DK se vyskytly u 2 (6,1 %) pacientů, ale oba pacienti zůstali dobře mobilní s podporou chůze. U jednoho pacienta došlo k pozdnímu rozvoji nelimitujících ischemických klaudikací. U jednoho pacienta jsme před implantací SG provedli robotický iliko-renální bypass.
VÝSLEDKY
Překrytí primárního entry se zdařilo u všech pacientů. Jak se dalo očekávat, v úseku krytém SG došlo u všech pacientů k výraznému rozšíření PL. U některých pacientů přesto FL v celém rozsahu SG zcela nezaniklo. FL až do úrovně tr. coeliacus (L 1) kompletně trombózovalo během 1 měsíce u 7 (21,2 %) nemocných, během 6 měsíců u 14 (42,4 %) a během celého sledovaného období u 19 (58,6 %) pacientů. U tří pacientů byla nutná sekundární intervence s proximální nebo distální extenzí SG. Po kompletaci léčby bylo FL uzavřeno v celém rozsahu SG u 30 (91 %) pacientů. SG u nich kompletně vyplnil PL a falešné lumen zcela zaniklo (Obr. 2, 3).
Obr. 2. SG časně po operaci zcela komprimuje falešné lumen Fig. 2. SG fully compromising the false lumen during early postoperative period 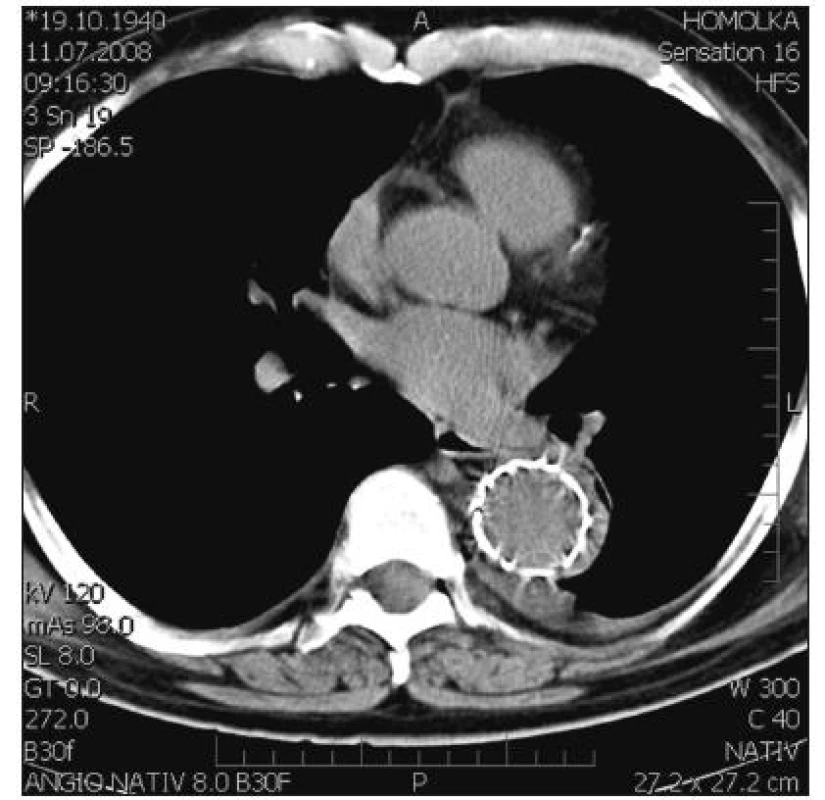
Obr. 3. SG časně po operaci zcela komprimuje falešné lumen Fig. 3. SG fully compromising the false lumen during early postoperative period 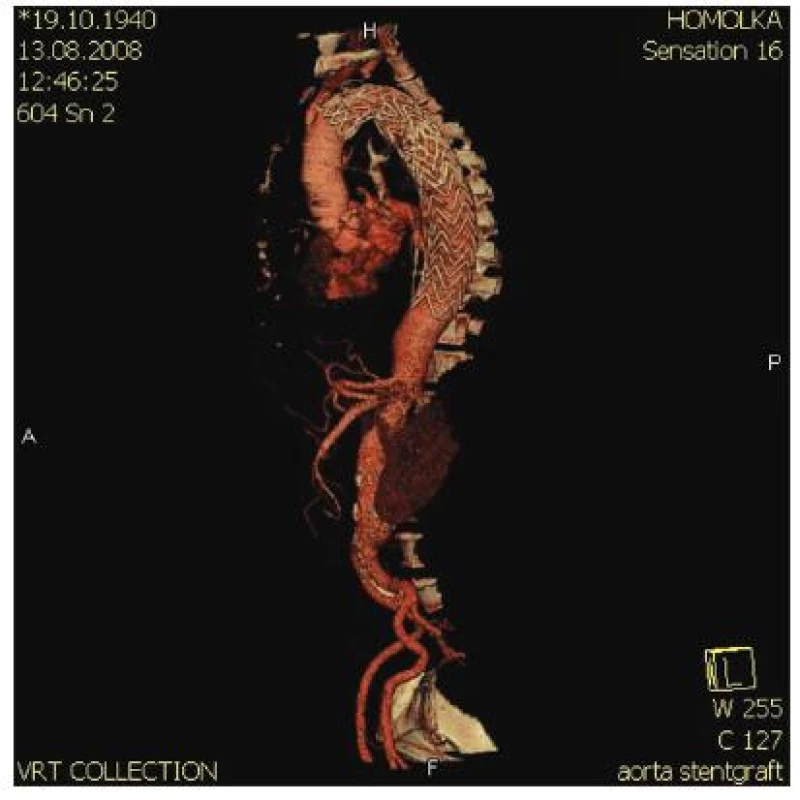
Expanze pravého lumen proběhla u pacientů s akutní i s chronickou disekcí. U jednoho pacienta s chronickou disekcí stále přetrvává retrográdní plnění falešného lumen směrem k průchodné interkostální větvi (Obr. 4a, 4b). Jeden z pacientů během doby sledování zemřel na celkovou sepsi při uroinfekci a pneumonii 32. měsíc po operaci. U 3 pacientů jsme v průběhu sledování přistoupili k otevřenému operačnímu řešení pro nárůst celkového průměru aorty v subrenálním úseku.
Obr. 4. a, b. Retrográdní plnění falešného lumen k průchodné a. intercostalis Fig. 4a, b. Retrograde filling of the false lumen into the patent intercostal artery 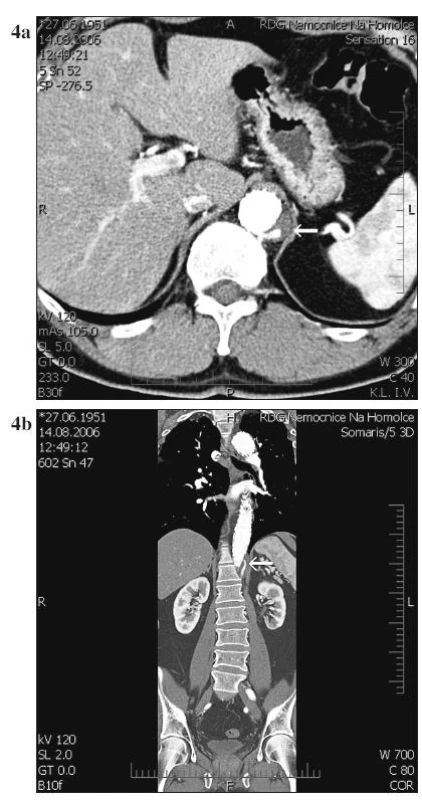
Časné výsledky po 1 měsíci, střednědobé po 6 měsících a dlouhodobé výsledky získané na konci sledovaného období přehledně podávají tabulky 3, 4 a 5 současně s grafy 1–4. Ve všech měřených úrovních docházelo ke zvětšování velikosti PL, nejvíce v úrovni L 1 během 1. měsíce (průměrně + 5,9 mm), a ke zmenšování velikosti dosud patentního FL, opět nejvíce v úrovni L1 během 1. měsíce (průměrně zmenšení o 6,5 mm).
Tab. 3. Změny velikosti PL po 1 měsíci, 6 měsících a na konci sledovaného období Tab. 3. True lumen size changes at Month 1, Month 6 and at the end of the study period 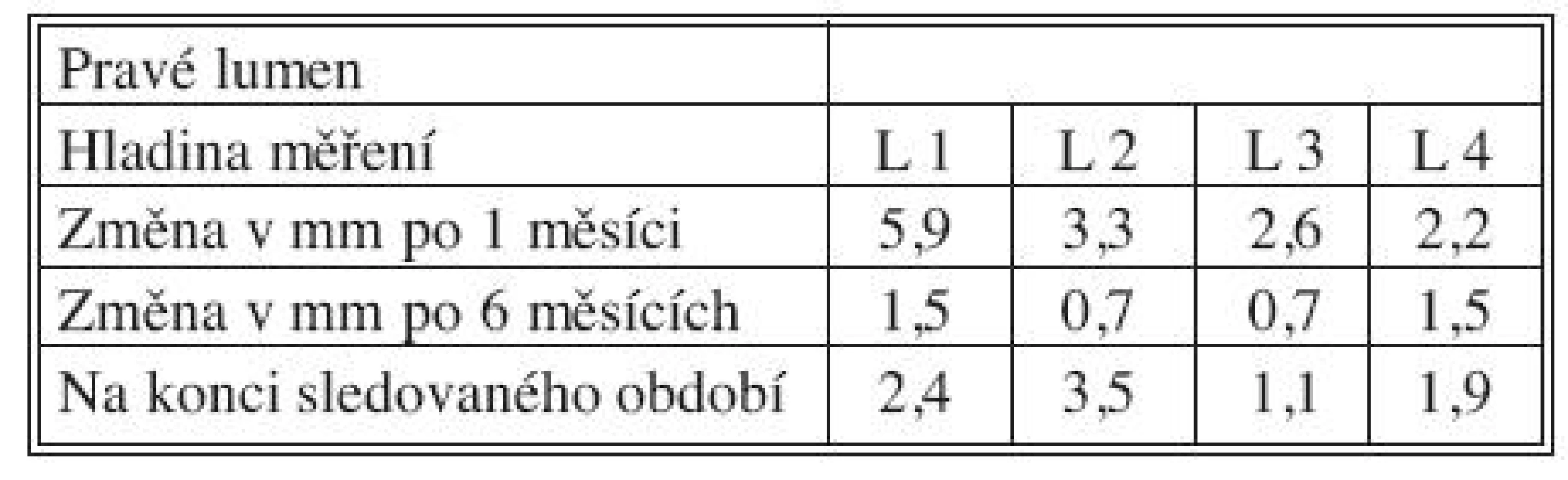
Tab. 4. Změny velikosti FL po 1 měsíci, 6 měsících a na konci sledovaného období Tab. 4. False lumen size changes at Month 1, Month 6 and at the end of the study period 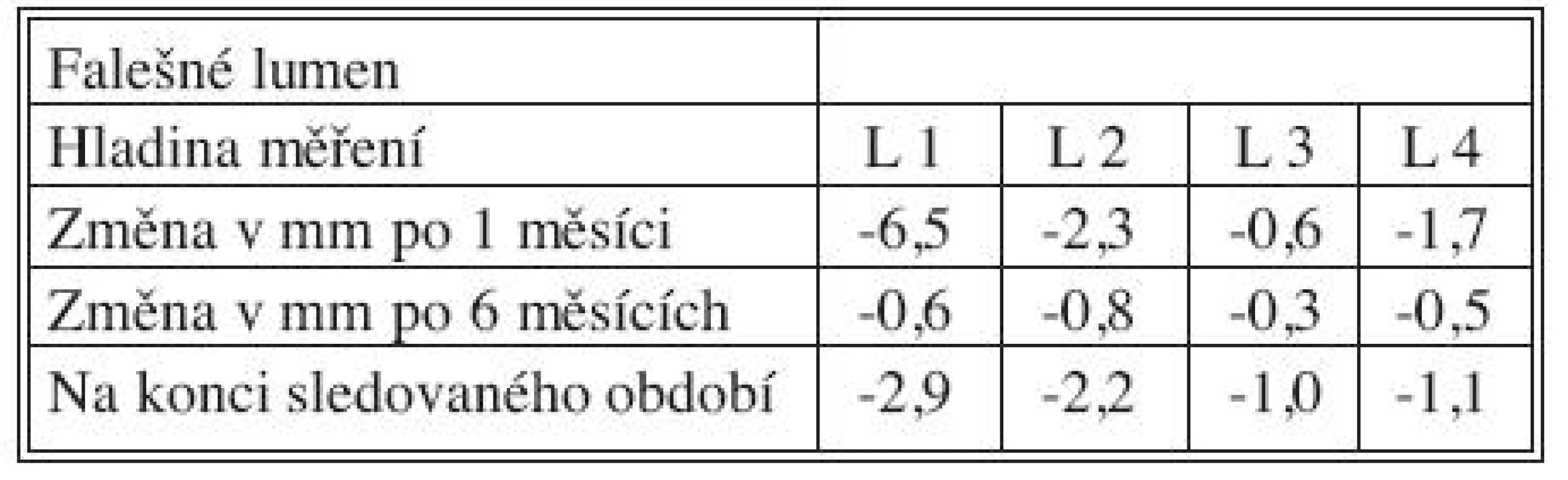
Tab. 5. Změny celkového průměru aorty po 1 měsíci, 6 měsících a na konci sledovaného období Tab. 5. Total aortic diameter changes at Month 1, Month 6 and at the end of the study period 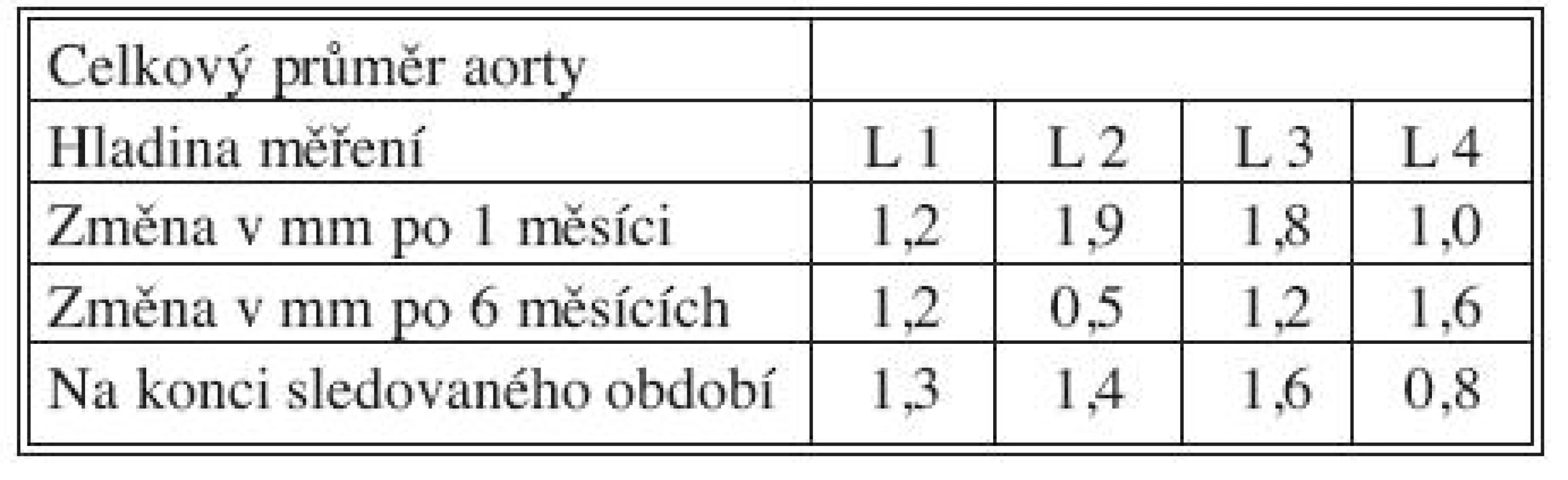
Graf 1. Průměrné změny velikostí jednotlivých lumin v úrovni L 1 Graph 1. Mean changes in the individual lumen sizes at the level of L 1 
Graf 2. Průměrné změny velikostí jednotlivých lumin v úrovni L 2 Graph 2. Mean changes in the individual lumen sizes at the level of L 2 
Graf 3. Průměrné změny velikostí jednotlivých lumin v úrovni L 3 Graph 3. Mean changes in the individual lumen sizes at the level of L 3 
Graf 4. Průměrné změny velikostí jednotlivých lumin v úrovni L 4 Graph 4. Mean changes in the individual lumen sizes at the level of L 4 
Po 6 měsících i při měření na konci sledovaného období docházelo k dalšímu velmi mírnému nárůstu velikostí PL a celkového průměru aorty ve všech měřených průměrech, současně se ve všech průměrech FL zmenšovalo, pokud bylo ještě průchodné. Na obrázku 5 dokumentujeme přetrvávání neexpandujícího FL pod distálním ukončením SG.
Obr. 5. Pod distálním koncem SG má falešné lumen tendenci k dlouhodobému přetrvávání Fig. 5. At the distal end of SG, the false lumen tends to persist over long periods of time 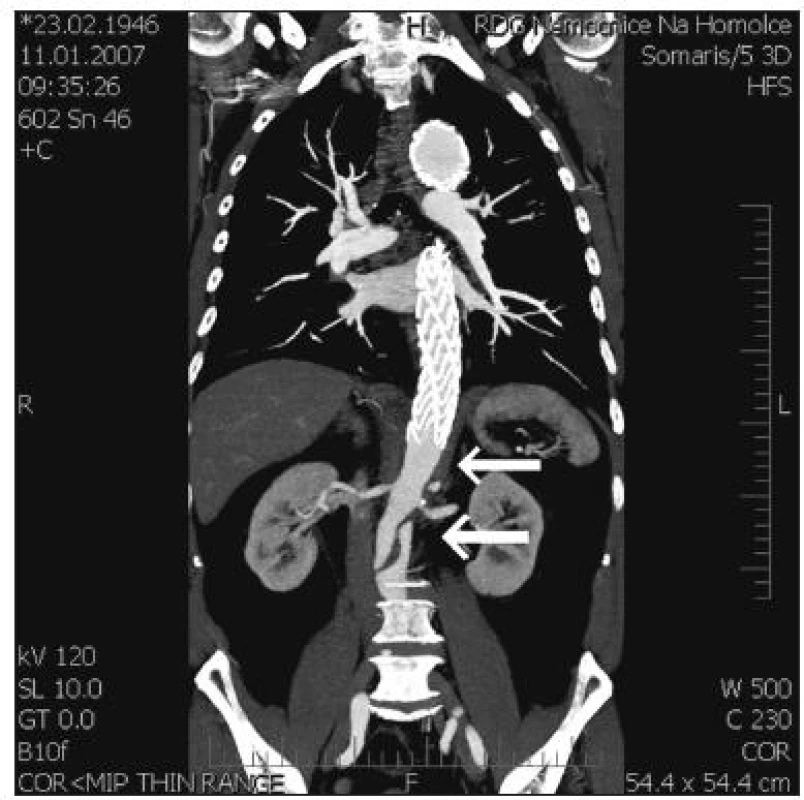
DISKUSE
Implantace SG do disekce B hrudní aorty je účinný a technicky dobře proveditelný výkon s menší zátěží pro pacienta než klasická komplexní operace. Endovaskulární výkon je spojen s výrazně nižší morbiditou a mortalitou [1, 5, 15] a s menším rizikem vzniku neurologických komplikací, protože během výkonu není nutné nakládat na aortu svorku, jsou výrazně menší krevní ztráty a nedochází k epizodám hypotenze [16, 17]. I přes agresivní antihypertenzní terapii je mortalita konzervativní léčby závažná a dlouhodobá prognóza nejistá, neboť významná část pacientů si později vynutí konverzi na operační řešení kvůli expanzi nebo perforaci falešného lumen, rozvoji orgánové ischemie, recidivující bolesti, nebo špatné compliance s antihypertenzní terapií [2, 5, 18–21]. U některých nemocných může dojít k retrográdnímu šíření disekce na oblouk aorty a její vzestupnou část.
Paušálnímu implantování stentgraftu do obou etáží disekované aorty, tedy do hrudní descendentní a současně do infrarenální aorty, brání obavy z rozvoje ischemického postižení míchy. Průchodná a. mammaria int. představuje podstatný kolaterální přítok interkostálních tepen. I při překrytí pouze hrudního úseku disekce je vhodné ponechat nekryté jeden až dva páry supraviscerálních interkostálních tepen, které odstupují zhruba v úseku 10 cm proximálně od tr. coeliacus. Překrytí těchto tepen je zřejmě bezpečnější, jsou-li přítomny intersegmentální kolaterály [12]. Pokud nejsou kaudální interkostální tepny angiograficky prokazatelné, pak je pravděpodobně možné překrýt celou descendentní aortu až těsně k odstupu tr. coeliacus. Obdobně v subrenálním úseku, nejsou-li lumbální tepny viditelné, je zřejmě možno s přijatelnou hladinou rizika implantovat bifurkační SG, pokud je zachována průchodnost vnitřních pánevních tepen.
Bezprostřední neurologické komplikace bývají zpravidla reverzibilní po podávání kortikoidů, drenáži cerebrospinálního moku a elevaci systémového krevního tlaku [11, 22].
Další slibnou možností, jak napomoci extenzi PL a kompresi FL je technika PETTICOAT [23], při které se používá stent o velkém průměru k podpoře extenze PL a zlepšení distální perfuze. Sami jsme tento postup použili u dvou pacientů mimo aktuální soubor.
Změny velikostí FL i PL odpovídají předpokládanému účinku SG. Jeho radiální expanze podporuje extenzi PL na úkor FL, s největším efektem ovšem pouze v rozsahu skeletu SG. Pod distálním kotvením účinek rychle zaniká a falešné lumen může dlouhodobě perzistovat (Obr. 5). V tom se naše výsledky shodují s měřením z jiných pracovišť [13, 24] a s výsledky experimentálních prací na zvířatech [25].
Souhlasíme se závěry Greenberga a spol. [2], že nejslibnějším postupem je řešit disekci B endovaskulárně časně po jejím vzniku. Septum není v té době hypertrofované a je velmi mobilní, FL se ochotně komprimuje a při následných kontrolách stěna aorty těsně konturuje obvod stentgraftu (Obr. 2, 3).
Zjistili jsme, že velikost pravého a falešného lumen ve viscerálním segmentu je implantací stentgraftu nejvíce ovlivněna bezprostředně po výkonu, nicméně efekt přesměrování krevního průtoku do pravého lumen vede k pokračující pomalé expanzi PL a zmenšování FL i v dlouhodobém sledování.
Statisticky validní zhodnocení dlouhodobých změn ve viscerálním segmentu si žádá sledování většího počtu pacientů v delším časovém intervalu.
ZÁVĚR
Velikost PL a FL v oblasti viscerálního segmentu se mění po implantaci SG do disekce hrudní aorty tak, že pravé lumen expanduje a falešné regreduje. Tento trend je nejvýraznější v období po implantaci SG do 1 měsíce. V dalších sledovaných intervalech jsou změny rozměrů obou lumin menší, nicméně sledují stejný trend. Falešné lumen se nejsnáze komprimuje u akutních disekcí. Příčinou přetrvání prográdního nebo retrográdního leaku může být non-compliance hrdla SG nebo perzistence průchodné interkostální tepny (Obr. 4). Tyto situace mohou vyžadovat sekundární intervenci.
MUDr. Petr Šedivý
Nemocnice Na Homolce
Roentgenova 2
150 30 Praha 5
e-mail: petr.sedivy@homolka.cz
Zdroje
1. Stone, D. H., Brewster, D. C., Kwolek, C. J., LaMuraglia, G. M., Conrad, M. F., Chung, T. K., Cambria, R. P. Stent-graft versus open-surgical repair of the thoracic aorta: mid-term results. J. Vasc. Surg., 2006; 44(6): 1188–1197.
2. Greenberg, R., Khwaja, J., Haulon, S., Fulton, G. Aortic dissections: new perspectives and treatment paradigms. Eur. J. Vasc. Endovasc. Surg., 2003; 26(6): 579–586.
3. Kahn, S. L., Dake, M. D. Stent graft management of stable, uncomplicated type B aortic dissection. Perspect. Vasc. Surg. Endovasc. Ther., 2007; 19(2): 162–169.
4. Burks, J. A. Jr., Faries, P. L., Gravereaux, E. C., Hollier, L. H., Marin, M. L. Endovascular repair of thoracic aortic aneurysms: stent-graft fixation across the aortic arch vessels. Ann. Vasc. Surg., 2002; 16(1): 24–28.
5. Eggebrecht, H., Nienaber, C. A., Neuhäuser, M., Baumgart, D., Kische, S., Schmermund, A., Herold, U., Rehders, T. C., Jakob, H. G., Erbel, R. Endovascular stent-graft placement in aortic dissection: a meta-analysis. Eur. Heart J., 2006; 27(4): 489–498.
6. Kasirajan, K. Thoracic endografts: procedural steps, technical pitfalls and how to avoid them. Semin. Vasc. Surg., 2006; 19(1): 3–10.
7. Fattori, R., Nienaber, C. A., Rousseau, H., Beregi, J. P., Heijmen, R., Grabenwöger, M., Piquet, P., Lovato, L., Dabbech, C., Kische, S., Gaxotte, V., Schepens, M., Ehrlich, M., Bartoli, J. M. Talent Thoracic Retrospective Registry. Results of endovascular repair of the thoracic aorta with the Talent Thoracic stent graft: the Talent Thoracic Retrospective Registry. J. Thorac. Cardiovasc. Surg., 2006; 132(2): 332–339.
8. Ford, P. F., Farber, M. A. Role of endovascular therapies in the management of diverse thoracic aortic pathology. Perspect. Vasc. Surg. Endovasc. Ther., 2007; 19(2): 134–143.
9. Attia, C., Villard, J., Boussel, L., Farhat, F., Robin, J., Revel, D., Douek, P. Endovascular repair of localized pathological lesions of the descending thoracic aorta: midterm results. Cardiovasc. Intervent. Radiol., 2007; 30(4): 628–637.
10. Gravereaux, E. C., Faries, P. L., Burks, J. A., Latessa, V., Spielvogel, D., Hollier, L. H., Marin, M. L. Risk of spinal cord ischemia after endograft repair of thoracic aortic aneurysms. J. Vasc. Surg., 2001; 34(6): 997–1003.
11. Khoynezhad, A., Donayre, C. E., Bui, H., Kopchok, G. E., Walot, I., White, R. A. Risk factors of neurologic deficit after thoracic aortic endografting. Ann. Thorac. Surg., 2007; 83(2): S882–889.
12. Schurink, G. W., Nijenhuis, R. J., Backes, W. H., Mess, W., de Haan, M. W., Mochtar, B., Jacobs, M. J. Assessment of spinal cord circulation and function in endovascular treatment of thoracic aortic aneurysma. Ann. Thorac. Surg., 2007; 83(2): S877–881.
13. Schoder, M., Czerny, M., Cejna, M., Rand, T., Stadler, A., Sodeck, G. H., Gottardi, R., Loewe, C., Lammer, J. Endovascular repair of acute type B aortic dissection: long-term follow-up of true and false lumen diameter changes. Ann. Thorac. Surg., 2007; 83(3): 1059–1066.
14. Šedivý, P., Šebesta, P., Mach, T. Akutní endovaskulární řešení disekce hrudní aorty a následné ischemie dolních končetin. Rozhl. Chir., 2008; 87(4): 171–175.
15. Amabile, P., Collart, F., Gariboldi, V., Rollet, G., Bartoli, J. M., Piquet, P. Surgical versus endovascular treatment of traumatic thoracic aortic rupture. J. Vasc. Surg., 2004; 40(5): 873–879.
16. Nienaber, C. A., Rehders, T. C., Ince, H. Interventional strategies for treatment of aortic dissections. J. Cardiovasc. Surg., 2006; 47 : 487–496.
17. Nienaber, C. A., Ince, H., Weber, F., Rehders, T., Petzsch, M., Meinertz, T., Koschyk, D. H. Emergency stent-graft placement in thoracic aortic dissection and evolving rupture. J. Card. Surg., 2003; 18(5): 464–470.
18. Gysi, J., Schaffner, T., Mohacsi, P., Aeschbacher, B., Althaus, U., Carrel, T. Early and late outcome of operated and non-operated acute dissection of the descending aorta. Eur. J. Cardiothorac. Surg., 1997; 11(6): 1163–1169.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2011 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Změny velikosti pravého a falešného lumen ve viscerálním segmentu po endovaskulární léčbě disekcí aorty typu B
- Ischemická kolitída po operáciách pre AAA
- Plazmatické hladiny prozánětlivých cytokinů u aneuryzmatu abdominální aorty
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
- Roboticky asistované cévní rekonstrukce aorto-ilické oblasti
- Vliv infrainguinálních bypassů na dlouhodobou průchodnost pánevních intervencí – význam hybridních výkonů
- Žilní interponát při řešení krvácení z distální anastomózy pedálního bypassu
- Peroperační intraarteriální trombolýza v terapii akutní končetinové ischemie
- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Simultánní karotická endarterektomie a koronární revaskularizace: indikace a výsledky
- Jednoduchá metoda odstranění infikované cévní protézy
- Dva mylné mýty flebologické chirurgie 20. století
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



