-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
SPECT mozku u kognitivních poruch – porovnání s klinickou diagnózou a význam pro klinickou praxi – stále platná možnost?
Brain SPECT in patients with cognitive disorders – comparison with clinical diagnosis and significance for clinical practise – still valid possiblity?
Introduction: The importance of brain perfusion examination using single photon emission computed tomography (SPECT) in the differential diagnosis of cognitive disorders is evaluated in this study.
Methods: For a period of four years a retrospective analysis of the examined patient´s data was performed in order to compare the conclusions of the brain SPECT examination with the clinical diagnosis. 68 patients with clinical diagnoses (33 patients with probable Alzheimer‘s disease (AD), 13 with mild cognitive impairment (MCI) and 22 with other diseases) were divided into 5 groups of perfusion patterns according to the second reading of their brain SPECT images without clinical information: Alzheimer‘s disease (AD – 19 patients), vascular dementia picture (VD – 17), mixed dementia picture (MIX – 18), other perfusion patterns (O – 11) and normal picture (N – 3).
Results: Thirty-three patients with probable Alzheimer’s disease were studied. 87 % of them showed typical image of AD on SPECT scan and half of them showed an image of mixed type dementia. In 13 patients with MCI was found heterogeneous blood perfusion corresponding with miscellaneous population of patients with MCI. In 25 right-handed patients with the SPECT pattern suggestive of AD or MIX, temporoparietal or temporal hypoperfusion was detected in the first examination of these patients on the left in 60 %, on the right in 8 % and bilaterally in 32 % of AD patients. The reliability of the radionuclide (RN) method was assessed by determining the inter (89%) and intrapersonal (87%) agreement of the conclusions of the brain perfusion examination using the SPECT technique.
Conclusion: In addition to supporting of the AD diagnosis, brain SPECT perfusion provides additional information about a possible combination with vascular mechanisms. Heterogeneous patterns correspond to a mixed population of individuals with MCI.
Keywords:
dementia – Alzheimer‘s disease – Cognitive impairment – Single photon emission computed tomography – 99mTc-HMPAO brain SPECT – regional brain perfusion
Autoři: Renata Píchová 1; Aleš Bartoš 2,3; Otto Lang 1
Působiště autorů: Klinika nukleární medicíny 1; Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha 10 2; NÚDZ Klecany u Prahy, ČR 3
Vyšlo v časopise: NuklMed 2022;11:42-48
Kategorie: Původní práce
Souhrn
Úvod: Hodnocení významu vyšetření perfuze mozku pomocí jednofotonové emisní počítačové tomografie (SPECT) v diferenciální diagnostice kognitivních poruch.
Metodika: Za období čtyř let byla provedena retrospektivní analýza dat vyšetřených pacientů s cílem porovnat závěry vyšetření SPECT mozku s klinickou diagnózou. 68 nemocných s klinickými diagnózami (33 pacientů s pravděpodobnou Alzheimerovou nemocí (AD – Alzheimer‘s disease), 13 s mírnou kognitivní poruchou (MCI – mild cognitive impairment) a 22 osob s jinými chorobami) bylo podle druhého čtení jejich SPECT obrazů mozku, bez klinických informací, rozděleno do 5 skupin perfuzních vzorců: obraz Alzheimerovy nemoci (AD – 19 pacientů), obraz vaskulární demence (VD – 17), obraz smíšené demence (MIX – 18), ostatní perfuzní vzorce (O – 11) a normální obraz (N – 3).
Výsledky: Z 33 pacientů s klinicky pravděpodobnou AD mělo na SPECT mozku v 87 % obraz AD, u poloviny z nich byl přítomen nález MIX. U 13 s MCI byly zjištěny heterogenní vzorce mozkové perfuze odpovídající smíšené populaci jedinců s MCI. Sledováním laterality postižení na SPECT obrazech u 25 praváků byla zjištěna převaha výskytu prvních defektů perfuze temporoparietálně nebo temporálně v dominantní hemisféře u většiny pacientů s MIX nebo klinicky pravděpodobnou AD. Spolehlivost radionuklidové (RN) metody byla posuzována stanovením inter - (89 %) a intrapersonální (87 %) shody závěrů vyšetření perfuze mozku technikou SPECT.
Závěr: SPECT mozku přináší, kromě podpory diagnostiky AD, další informaci o možné kombinaci s cévními mechanismy. Heterogenní vzorce odpovídají smíšené populaci jedinců s MCI.
Klíčová slova:
demence – Alzheimerova nemoc – kognitivní poruchy – 99mTc-HMPAO SPECT mozku – regionální perfuze mozku – jednofotonová emisní počítačová tomografie
Úvod
Stále více pacientů s kognitivními poruchami a demencí různé etiologie se vyskytuje ve stárnoucí populaci. Většinou se jedná o primární atroficko-degenerativní příčinu, nejčastěji při Alzheimerově nemoci (AD – 60 %). Další příčinou jsou změny vaskulární (10–20 %), dále smíšené (MIX), zahrnující obě tyto skupiny, a méně častý je výskyt demencí jako sekundární příznak jiného onemocnění. AD je typickým onemocněním vyšších věkových kategorií. Od 65 let se její prevalence v 5letých údobích přibližně zdvojnásobuje. Ve věku 65–70 let postihuje přibližně 1 % obyvatel. Podle definice demence jde o ireverzibilní a progredující organické postižení mozku s nepříznivým ovlivněním pracovní a sociální funkce pacienta. Předpokladem k zahájení adekvátní léčby je tedy nutná časná detekce a správná diagnostika. 1
Naším zájmem bylo zjistit, jak velkou podpůrnou informaci poskytuje SPECT mozkové perfuze v diagnostice AD v běžné rutinní praxi. Cílem bylo porovnat klinickou diagnózu u pacientů s kognitivními poruchami s perfuzními změnami mozku, sledovat lateralitu postižení vzhledem k dominanci hemisfér a posoudit spolehlivost metody při novém intra - a interpersonálním zpracování obrazů se zhodnocením variability závěrů.
Metodika a soubor
Během čtyř let bylo vyšetřeno 68 pacientů s kognitivní poruchou (38 žen, 30 mužů), průměrného věku 68 let v rozmezí 41–87 let.
U 33 pacientů byla diagnostikována pravděpodobná AD podle kritérií NINCDS-ADRDA (MMSE průměr ± SD: 20 ± 5) a u 13 osob shledán MCI bez předchozí znalosti výsledku SPECT mozku. Ostatní pacienti nesplnili požadavky ani jedné z předchozích skupin. 2–4
Perfuzní scintigrafie mozku byla vyšetřena pomocí radiofarmaka hexamethyl-propylen-amin-oxim značeného techneciem (99mTc-HMPAO) aplikovaného i.v. v dávce 550–800 MBq za standardních podmínek (bez vlivu rušivých podnětů). Za 20–30 minut od aplikace radiofarmaka byly zaznamenány obrazy perfuze mozku technikou SPECT na dvouhlavé gamakameře s kolimátory fan-beam, provedena rekonstrukce obrazů iterativní metodou a získány obrazy řezů ve třech rovinách (transverzální, koronární a sagitální) včetně 3D obrazů.
Podle druhého čtení, bez klinických informací, nálezy SPECT vyšetření byly rozděleny do 5 skupin: 1. Alzheimerova nemoc (AD), 2. vaskulární demence (VD), 3. smíšená demence (MIX = AD + VD), 4. ostatní (O), 5. normální (N).
Na základě vlastní zkušenosti s metodou SPECT a literárních údajů 5–10 byla vytvořena pracovní kritéria k třídění SPECT obrazů do následujících skupin:
- perfuzní vzorec AD – hypoperfuze temporální (zejména mediotemporální), temporo-parietální kůry jedno i oboustranně, bez významnější asymetrie bazálních ganglií (BG) (Obr. 1A);
- perfuzní vzorec VD – nejčastěji typu multiinfarktové demence (MID) s nálezem difuzně nehomogenní perfuze mozkové kůry, s drobnými vícečetnými redukcemi a defekty oboustranně, nahodile asymetricky, s postižením i podkorových struktur včetně bazálních ganglií a thalamu, méně často ohraničené ischemie s ložiskovým neurologickým nálezem a s obrazem hypoperfuze odpovídajícímu stavu po cévní mozkové příhodě (Obr. 1B);
- perfuzní vzorec MIX (AD + VD) – tato skupina vznikla na základě našich zkušeností s nálezem difuzně nehomogenní perfuze s maximem redukce perfuze mediotemporoparietálně a s asymetrií BG (Obr. 1C);
- perfuzní vzorec ostatní – patologické nálezy nebylo možné zařadit do žádné z předchozích skupin (frontální hypoperfuze, asymetrie BG, thalamu apod.);
- perfuzní vzorec normální – bez významných patologických perfuzních změn.
Obr. 1. A Ukázkové snímky SPECT perfuze mozku (u pacienta s histopatologicky potvrzenou Alzheimerovou nemocí) s perfuzním vzorcem typickým pro AD – hypoperfuze temporální (zejména mediotemporální), temporo-parietální kůry oboustranně, bez významnější asymetrie bazálních ganglií (BG). 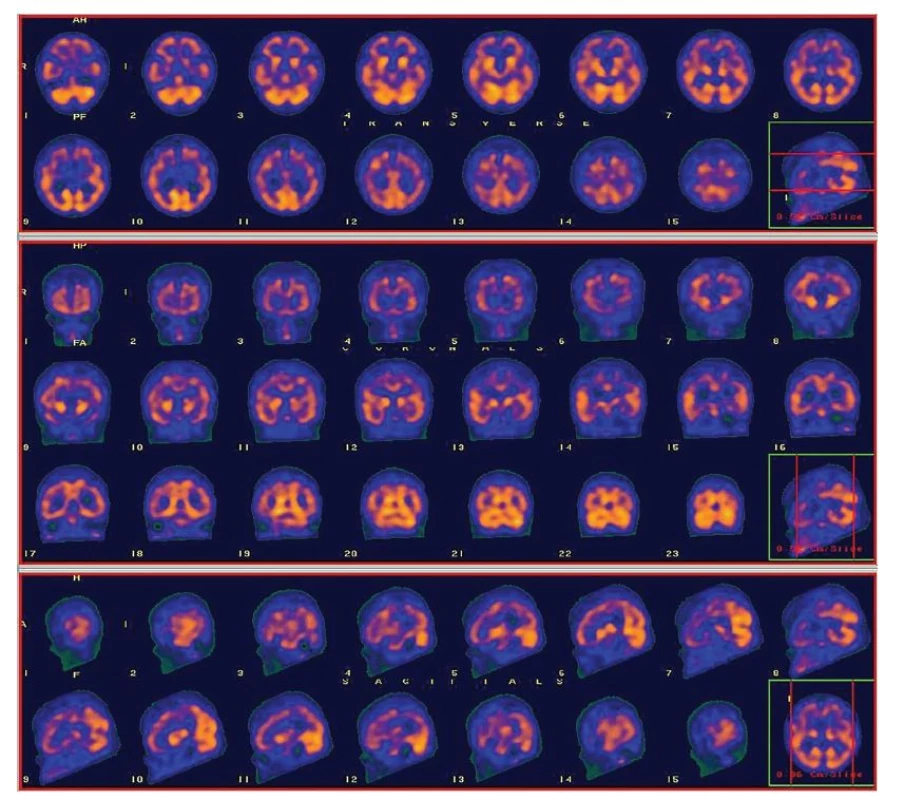
Obr. 1B Ukázkové snímky SPECT perfuze mozku s perfuzním vzorcem typickým pro vaskulární demenci multiinfarktovou – difuzně nehomogenní perfuze mozkové kůry s drobnými vícečetnými redukcemi a defekty oboustranně, nahodile asymetricky, s postižením i podkorových struktur včetně BG a thalamu. Bližší definice perfuzního vzorce je v textu. 
Obr. 1C Ukázkové snímky SPECT perfuze mozku s možným perfuzním vzorcem u histopatologicky potvrzené smíšené demence (VD/MID + AD) – difuzně nehomogenní perfuze s maximem redukce perfuze mediotemporoparietálně a s asymetrií BG. Bližší definice perfuzního vzorce je v textu. 
Ve vztahu k dominanci postižení bylo současně provedeno posuzování laterality postižení u 25 pacientů s nálezem AD a MIX na SPECT obrazech, u kterých se podařila zpětně zjistit dominance hemisféry – praváctví.
Na základě druhého vyhodnocování SPECT obrazů u náhodně vybraných 35 vyšetření byla posuzována spolehlivost SPECT mozku při interindividuálním porovnání a u 79 vyšetření (zahrnuta byla i kontrolní vyšetření pacientů) při intraindividuálním opakovaném hodnocení.
Výsledky
U 68 vyšetřených pacientů bylo rozdělení všech SPECT obrazů perfuze mozku do předem definovaných pěti skupin následující:
Do 1. skupiny AD bylo zařazeno 19 pacientů (10 žen, 9 mužů), tj. 28 %. 2. skupina zahrnovala 17 pacientů s VD (7 žen, 10 mužů), tj. 25 %. Do skupiny se smíšenou formou MIX jsme včlenili 18 pacientů (13 žen, 5 mužů), tj. 26,5 %. 4. skupina byla zastoupena 11 pacienty (6 žen, 5 mužů), kteří neodpovídali zařazením do předchozích skupin (pouze hypoperfuze frontálních laloků, asymetrie BG, thalamu apod.), tj. 16 %. 5. skupinu pacientů s normálními nálezy tvořili 3 pacienti (2 ženy, 1 muž) s perfuzním scanem bez významných patologických odchylek, tj. < 0,5 %. (Graf 1)
Graf 1. Rozdělení pacientů do skupin podle mozkové perfuze technikou SPECT (AD – Alzheimerova nemoc, VD – vaskulární demence, MIX = AD + VD, O – ostatní, N – normální). 
Z celkového počtu 68 vyšetřených bylo s klinicky pravděpodobnou AD 33 pacientů, s diagnózou MCI 13 pacientů a 22 pacientů bylo s jinými chorobami. (Graf 2)
Graf 2. Rozdělení pacientů podle klinické diagnózy (33/68 AD – klinicky pravděpodobná Alzheimerova nemoc, 13/68 MCI – s klinickou diagnózou mírného kognitivního deficitu, 22/68 O – s jinými chorobami). 
Nikdo z pacientů s klinickou AD neměl normální perfuzní vzorec. Čtyři pacienti s MCI, bez klinické diagnózy AD, měli nález na SPECT mozku typický pro AD.
Z 33 pacientů trpících pravděpodobnou AD mělo 87 % na SPECT záznamech obraz AD (s převahou žen). Z nich 15 pacientů (45 %) SPECT-AD, 14 pacientů (42 %) SPECT-MIX, další 4 pacienti (12 %) měli ostatní perfuzní vzorce (2x pouze hypoperfuze frontálních laloků, 2x asymetrie perfuze v bazálních gangliích). (Graf 3)
Graf 3. SPECT obrazy u 33 pacientů s klinicky pravděpodobnou Alzheimerovou nemocí 33/68 – na SPECT perfuzní vzorce: AD u 15 pacientů (46 %), MIX 14 (42 %), O 4 (12 %). 
U 13 pacientů s MCI byly zjištěny vzorce všech 5 kategorií – AD 5 (39 %), MIX 2 (15 %), VD 1 (8 %), O 3 (23 %), N 2 (15 %). (Graf 4)
Graf 4. 13 pacientů s mírným kognitivním postižením (MCI) 13/68 – na SPECT perfuzní vzorce všech 5 kategorií: AD 5 (39 %), MIX 2 (15 %), VD 1 (8 %), O 3 (23 %), N 2 (15 %). 
Posuzování laterality postižení bylo stanoveno u 25 pacientů se SPECT obrazem AD a MIX s převažujícím levostranným SPECT nálezem temporoparietálně nebo temporálně u 15 pacientů (60 %), pravostranné postižení měli 2 (8 %) a oboustranné se objevilo u 8 (32 %) pacientů. U ostatních pacientů s AD nebylo možné zpětně zjistit dominanci ruky.
Shoda výsledků SPECT vyšetření mozku byla při novém intraindividuálním posouzení 87 % a při interindividuálním posouzení 89 %.
Diskuze
Záměrem nových opravených mezinárodních kritérií je zpřesnit rozpoznání AD co nejdříve. Proto základní myšlenkou kritérií je kombinovat již osvědčenou klinickou detekci poruchy epizodické paměti trvající nejméně 6 měsíců s neurobiologickými ukazateli. Mezi ně patří mediotemporální atrofie na magnetické rezonanci mozku, změny v koncentracích určitých bílkovin v mozkomíšním moku a temporoparietální hypometabolismus glukózy na pozitronové emisní tomografii (PET). 4 V rutinní praxi je dostupnější jednofotonová emisní tomografie (SPECT), při které se posuzuje metabolická aktivita neuronů nepřímo na základě změn prokrvení jednotlivých oblastí. 11 Obě vyšetření, jak pozitronová emisní tomografie (PET) 18F-FDG, tak SPECT se ukázala být užitečná k odhalení funkčních alterací, které jsou základem různých neurodegenerativních onemocnění. Ačkoliv se v současné době zaměření radionuklidového zobrazení mozku přesouvá na PET, nižší náklady a širší dostupnost SPECT z něj činí stále platnou alternativu pro studium pacientů s demencí. 12 SPECT se úspěšně používá k diagnostice demencí od 80. let 20. století, zatímco PET se do kliniky dostal v následujícím desetiletí. Úzký vztah mezi perfuzí a neuronálním metabolizmem je dobře zdokumentován jak ve fyziologických podmínkách, tak ve velké většině patologických procesů, což umožňuje identifikaci hypometabolických oblastí prostřednictvím odpovídajícího snížení perfuze mozku pomocí indikátorů průtoku krve (stejný koncept platí pro fMRI). Nejužitečnější roli plní SPECT vyšetření při odlišení AD od demence vaskulární (VD) nebo frontotemporální (FTD). Hypoperfuze v obou předních částech mozku poukazuje na FTD. Podobně se může manifestovat ale i VD, deprese a někdy i pokročilá AD. U VD se postižení nevyhýbá primární senzomotorické kůře. Rovněž podkorové defekty v BG nejsou výjimkou vzhledem k roztroušenosti vícečetných iktů. Naopak u AD zůstává oblast motorické a senzitivní kůry i BG ušetřena. Dokonce i v pokročilejších stádiích AD se na SPECT mozku zastihne zachovaná perfuze v oblastech primární senzomotorické kůry, zrakové kůry, BG, thalamu i mozečku, která nápadně kontrastuje se sníženou aktivitou v postižených oblastech SPECT. Obraz u AD má charakteristickou redukci perfuze v zadní parietální a temporální kůře mozku bez zřetelné alterace occipitální oblasti. V pokročilých stádiích AD byla shledána hypoperfuze i frontální kůry. 2,7,11
Na základě analýzy několikaletých vlastních zkušeností je možné tvrdit, že typickou perfuzní poruchou pro AD je temporální nebo temporoparietální hypoperfuze převážně vlevo. Odpovídá to platné představě, že největší změny u AD nastávají v mediotemporální oblasti, ať už z hlediska klinického, radiologického nebo histopatologického. 13 V našem souboru byla přítomna takto lokalizovaná hypoperfuze u 87 % pacientů s AD.
SPECT a PET jsou funkční zobrazovací modality, které mají nejsilnější vědeckou podporu pro klinické použití u demencí a jsou úspěšně používány již několik desetiletí. Typický vzorec AD na SPECT nebo PET obrazech je charakterizován přítomností bilaterální hypoperfuze nebo hypometabolizmu v temporální, zadní parietální a zadní cingulární kůře se zachováním primární zrakové a senzomotorické kůry, bazálních ganglií, thalamu, mozkového kmene a mozečku. Obecně existuje nižší stupeň frontálního postižení, které se zvyšuje s progresí onemocnění, obvykle šetří motorickou kůru. Přítomnost tohoto vzorce má vysokou diagnostickou přesnost, i když lze vidět i jiné vzorce s asymetrií, dokonce jednostranné nebo s frontálním postižením. 4,14
Obvykle existuje dobrá korelace mezi nálezy SPECT/PET a závažností symptomů. I když za určitých klinických situací (včetně AD s časným nástupem nebo u jedinců s vysokou intelektuální úrovní) může být tento vztah omezenější se změnami, které bývají závažnější v časnějších klinických stádiích onemocnění. Tento jev pravděpodobně souvisí s konceptem kognitivní rezervy. Jedinci s vyšší rezervou jsou schopni vyvinout alternativní strategie pro kompenzaci ztráty funkcí souvisejících s vývojem patologického procesu, což oddaluje nástup příznaků. 15
Systematickým přehledem Dougall et al. hodnotí diagnostickou přesnost 45 studií provedených s HMPAO ve srovnání s klinickou diagnózou (kritéria DSM-III-R a NINCDS-ARDRA) v letech 1988 až 2002. 16 Autoři popsali senzitivitu 77 % a specificitu 89 % pro diagnózu AD ve srovnání s normálními kontrolami, 71 % a 76 % ve srovnání s vaskulární demencí a 72 % a 78 % ve srovnání s frontotemporální demencí, přičemž jako průřezovou klinickou diagnózu použili zlatý standard. Za nejvhodnější zlatý standard pro výzkum je považováno hodnocení histopatologických charakteristik AD. Read et al. uvádějí senzitivitu 93 % pro SPECT ve srovnání se 73 % pro klinickou diagnózu u 27 pacientů, kteří podstoupili pitvu. 17 Bonte a kol. publikoval sérii článků využívajících SPECT, ve kterých se studovaná populace od roku 1993 dále postupně zvyšovala. Závěrečná zpráva z této série v roce 2011 zahrnovala 73 pacientů a vykazovala senzitivitu 94 %, specificitu 85 %, pozitivní prediktivní hodnotu 92 %, negativní prediktivní hodnotu 88 % a přesnost 90 %. 18 Práce Jobst a kol. zahrnovala 104 pacientů s demencí (80 z nich s AD) a uvádí senzitivitu, specificitu a přesnost 89, 80 a 83 %. 19
Je důležité si uvědomit, že některé z těchto studií byly publikovány před více než 20 lety a používaly v té době dostupné zařízení s výkonem pravděpodobně pod současnými standardy v oboru. Od té doby bylo do klinické rutiny začleněno mnoho technických pokroků včetně metod iterativní rekonstrukce (OSEM), korekce rozptylu, korekce útlumu pomocí CT map v hybridním zařízení a obnovy rozlišení. Všechny přispěly ke zlepšení kvality obrazu s pravděpodobným pozitivním dopadem na diagnostický výkon SPECT. El Fakhri a kol. prokázali výhody několika z těchto vylepšení u pacientů s mírnou kognitivní poruchou. 20
Zvláštní význam má potenciál funkčních zobrazovacích technik pro diagnostiku AD v časných stádiích onemocnění, jako je MCI. Identifikace jedinců ve fázi MCI s vysokým rizikem vývoje k AD umožní intervenci v počáteční klinické fázi onemocnění s cílem zpomalit vývoj symptomů a výskyt demence. Přítomnost hypoperfuze na obrazech SPECT nebo hypometabolizmu na PET v zadní parietální kůře, precuneu a zadním gyru cinguli u pacientů s MCI bývá spojována se zvýšeným rizikem progrese do AD. 19,21,22
I když temporální nebo temporoparietální hypoperfuze může být nespecifická, její nález významně zvyšuje diagnostickou přesnost nad samotnou klinickou diagnózou – podporuje možnost AD. Protože SPECT je dostupnější a levnější než PET, dostává se mu alternativně velké pozornosti. 4,23
Další nápovědou AD z obrazu SPECT perfuze mozku může být převažující levostranné postižení v dominantní hemisféře (asi u 2/3 našich pacientů s AD) nebo oboustranná hypoperfuze (asi u 1/3 našich pacientů s AD). Symetrické oboustranné postižení není časté (i když je uváděné jako typické) a vyskytuje se asi u 20 % pacientů s AD. 8 To je v souladu s našimi pozorováními s jednostranným postižením u téměř 70 % pacientů.
Pacienti s MCI vykazovali různé perfuzní vzorce, což odpovídá heterogennímu složení těchto osob z hlediska prognostického. V našem souboru měli 4 pacienti typický obraz SPECT-AD, aniž by trpěli AD. Je velmi pozoruhodné, že po odtajnění klinické diagnózy (nebyla předem známá) se vždy jednalo o pacienty s MCI. Lze předpokládat, že se u nich jedná o počáteční stádium AD, které ještě nevyhovuje mezinárodním kritériím demence. Přesto typická hypoperfuzní porucha pro AD je detekovatelná již nyní.
SPECT mozku poskytuje jednu zajímavou a klinicky těžko odhadovanou informaci o cévních metabolicko-perfuzních změnách, které se vyskytly asi u poloviny pacientů s AD navíc k temporální hypoperfuzi. Je těžké posoudit, zda se cévní změny mozku podílejí na kognitivním deficitu Alzheimerovy nemoci (tedy vlastně smíšená demence) nebo jsou přirozenou součástí stárnutí mozku bez vztahu k neurodegenerativním pochodům u AD. Každopádně se ukazuje, že poruchy prokrvení mozku se vyskytují u některých pacientů s AD. Cévní složka je známa už delší dobu i z histopatologických nálezů. 24 V poslední době se stále více prosazuje spoluúčast cévních mechanismů na patogenezi AD tvořících smíšenou demenci. 25 Přestože současný výskyt alzheimerovských a cévních histopatologických změn u demencí bude častější než „čistá“ AD, ani v nových kritériích AD se opět nevymezuje pojem smíšené demence a pozornost se věnuje jen čisté AD. 4
Předností našeho pozorování je poměrně rozsáhlý soubor osob s kognitivními poruchami vyšetřený technikou SPECT a dlouhodobá úzká spolupráce s klinickým zázemím s možností získávat a hromadit zkušenosti. Nevýhodou této studie je omezený počet pacientů s MCI, chybění histopatologické verifikace diagnóz a malé zastoupení jiných typů demencí než Alzheimerovy.
Závěr
Perfuzní scintigrafie mozku přináší kromě diagnostické podpory AD také informaci o možném spolupodílu cévních změn na kognitivním deficitu. Význam heterogenních vzorců SPECT obrazů odpovídajících smíšené populaci jedinců s MCI je možné zhodnotit až s delším časovým odstupem. U většiny vyšetřených pacientů s pravděpodobnou AD jsme prokázali větší defekty perfuze v dominantní hemisféře. Přes určitou míru subjektivního posuzování SPECT obrazů vykazuje interpretace vysokou míru shody při novém hodnocení stejným nebo jiným posuzovatelem.
Perfuzní scintigrafie mozku sama o sobě diagnózu nestanoví, základem zůstává klinika, může však přispět do diagnostického schématu. Stanovení správné diagnózy umožní včasné zahájení terapie a zpomalení průběhu onemocnění.
Práce byla podpořena výzkumným programem „Neurovědní COOPERATIO Univerzity Karlovy“.
Zdroje
- Topinková E. Jak správně a včas diagnostikovat demence – manuál pro klinickou praxi. Praha, UCB Pharma, s. r. o., 1999
- Newberg AB, Alavi A. Functional neuroimaging in the differential diagnosis of dementia. In Fazekas F, Schmidt R, Alavi A (eds.): Neuroimaging of Normal Aging and Uncommon causes of Dementia. Dordrecht, ICG Publications, 1998, p. 201-223
- Petersen RC, Smith GE, Waring SC et al. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol 1999;56 : 303-308
- Dubois B, Feldman HH, Jacova C et al. Research criteria for the diagnosis of Alzheimer‘s disease: revising the NINCDS-ADRDA criteria. Lancet Neurol 2007;6 : 734-746
- Tien RD, Felsberg GJ, Ferris NJ et al. The dementias: correlation of clinical features, pathophysiology, and neuroradiology. AJR Am J Roentgenol 1993;161 : 245-255
- Rubens AB, Tikofsky RS. Dementia. Cerebral SPECT Imaging 1995;Chapter 6 : 111-113
- Jagust WJ, Johnson KA, Holman BL. SPECT perfusion imaging in the diagnosis of dementia. J Neuroimaging 1995;5 Suppl 1:S45-52
- Ryding E. SPECT measurements of brain function in dementia; a review. Acta Neurol Scand Suppl 1996;168 : 54-58
- Small GW. Differential diagnosis and early detection of dementia. Am J Geriatr Psychiatry 1998;6 : 26-33
- Talbot PR, Lloyd JJ, Snowden JS et al. A clinical role for 99mTc-HMPAO SPECT in the investigation of dementia? J Neurol Neurosurg Psychiatry 1998;64 : 306-313
- Bartoš A, Rusina R, Píchová R et al. Demence v obraze SPECT vyšetření mozku. Praktický lékař 2000;11 : 610-613
- Ferrando R, Damian A. Brain SPECT as a Biomarker of Neurodegeneration in Dementia in the Era of Molecular Imaging: Still a Valid Option? Front. Neurol. 2021 10;12 : 629442. doi: 10,3389 /fneur.2021.629442
- Blennow K, de Leon MJ, Zetterberg H. Alzheimer‘s disease. Lancet 2006;368 : 387-403
- Shimizu S, Hirose D, Hatanaka H et al. Role of neuroimaging as a biomarker for neurodegenerative diseases. Front Neurol 2018;9 : 265. doi: 10.3389/fneur.2018.00265
- Carapelle E, Mundi C, Cassano T et al. Interaction between cognitive reserve and biomarkers in alzheimer disease. Int J Mol Sci 2020;21 : 1–12 doi: 10.3390/ijms21176279
- Dougall NJ. Systematic review of the diagostic accuracy of 99mTc-HMPAO-SPECT in dementia. Am J Geriatr Psychiatry 2004;12 : 554–570 doi: 10.1097 / 00019442-200411000-00002
- Read SL, Miller BL, Mena I et al. SPECT in dementia: clinical and pathological correlation. J Am Geriatr Soc 1995;43 : 1243–1247 doi: 10.1111 / j.1532-5415.1995.tb07400.x
- Bonte FJ, Hynan L, Harris TS et al. TC-99m HMPAO Brain Blood Flow Imaging in the Dementias with Histopathologic Correlation in 73 Patients. Int J Mol Imaging. 2011;2011 : 409101. doi: 10.1155/2011/409101. Epub 2010 Dec 1. PMID: 21490729; PMCID: PMC3065903.
- Dukart J, Mueller K, Villringer A et al. Relationship between imaging biomarkers, age, progression and symptom severity in Alzheimer´s disease. NeuroImage Clin 2013;3 : 84–94 doi: 10.1016 / j.nicl.2013.07.005
- El Fakhri G, Kijewski MF, Albert MS et al. Quantitative SPECT leads to improved performance in discrimination tasks related to prodromal Alzheimer´s disease. J Nucl Med 2004;45 : 2026–2031
- Perani D. FDG PET and cognitive symptoms of dementia. Clin Transl Imaging 2013;1 : 247–260 doi: 10,1007 / s40336-013-0029-8
- Valotassiou V, Malamitsi J, Papatriantafyllou J et al. SPECT and PET imaging in Alzheimer´s disease. Ann Nucl Med 2018;32 : 583–593 doi: 10,1007 / s12149-018-1292-6
- Jagust W, Thisted R, Devous MD, Sr. et al. SPECT perfusion imaging in the diagnosis of Alzheimer’s disease: a clinicalpathologic study. Neurology 2001;56 : 950–956
- Snowdon DA, Greiner LH, Mortimer JA et al. Brain infarction and the clinical expression of Alzheimer disease. The Nun Study. JAMA 1997;277 : 813-817
- Langa KM, Foster NL, Larson EB. Mixed dementia: emerging concepts and therapeutic implications. JAMA 2004;292 : 2901-2908
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2022 Číslo 3- Biochemoterapie agresivního karcinomu rekta – kazuistika z českého prostředí
- MDT Board: unikátní projekt pro lékaře pečující o pacienty s onemocněním plic a dalšími patologiemi v oblasti hrudníku
- Kolorektální karcinom a jeho léčba v pokročilém stadiu dle aktuální Modré knihy ČOS
- Idiopatická plicní fibróza a refluxní choroba: silný vztah plný nejasností
- Konverzní léčba hraničně resekabilních jaterních metastáz kombinací mFOLFOX6 + panitumumab – kazuistika
-
Všechny články tohoto čísla
- Editorial
- SPECT mozku u kognitivních poruch – porovnání s klinickou diagnózou a význam pro klinickou praxi – stále platná možnost?
- Alternativní metody kontroly radiofarmak v Českém lékopise 2017 – Doplňku 2021
- PET pracoviště nemocnice Chomutov
- 43. Pracovní dny Radiofarmaceutické sekce ČSNM, Strážnice
- Ing. Marie Kuprová
- Noví členové společnosti
- Volby do výboru ČSNM
- Nukleární medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- SPECT mozku u kognitivních poruch – porovnání s klinickou diagnózou a význam pro klinickou praxi – stále platná možnost?
- Alternativní metody kontroly radiofarmak v Českém lékopise 2017 – Doplňku 2021
- 43. Pracovní dny Radiofarmaceutické sekce ČSNM, Strážnice
- PET pracoviště nemocnice Chomutov
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



