-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMolekulární určení genotypu izolátů Streptococcus agalactiae s netypovatelným sérotypem, Česká republika, 2008–2020
Molecular genotyping of Streptococcus agalactiae isolates with non-typeable serotype, Czech Republic, 2008–2020
The NRL for Streptococcal Infections performed serotyping of 1038 isolates of Streptococcus agalactiae from 972 patients by the latex agglutination method in 2008–2020.
Forty-three isolates (4.4%) whose serotyping failed were classified as non-typeable. The aim of the present study was to determine the genotype of these non-typeable isolates using multiplex polymerase chain reaction (mPCR). Genotyping was successful in the entire set of 43 non-typeable isolates. The most common genotype was V (41.9%), followed by Ia (20.9%). The isolates serotyped by latex agglutination were predominantly assigned to serotype III (29.2%) and V (26.2%). Complete data were obtained on the prevalence of S. agalactiae serotypes/genotypes in the Czech Republic in 2008–2020. Monitoring the serotype and genotype distribution of the pathogen is a prerequisite for the introduction of a potential vaccine against S. agalactiae into clinical practice.
Keywords:
Streptococcus agalactiae – genotype – serotype
Autoři: S. Vohrnová 1,2
; J. Kozáková 1
Působiště autorů: Národní referenční laboratoř pro streptokokové nákazy, Oddělení bakteriálních vzdušných nákaz, Centrum epidemiologie, a mikrobiologie, Státní zdravotní ústav, Praha 1; 3. lékařská fakulta Univerzity Karlovy, Praha 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 71, 2022, č. 4, s. 203-207
Kategorie: Krátké sdělení
Souhrn
V NRL pro streptokokové nákazy byl v letech 2008–2020 metodou latexové aglutinace určován sérotyp u 1 038 vzorků Streptococcus agalactiae od 972 pacientů. U 43 izolátů (4,4 %) se určení sérotypu nepodařilo a byly označeny jako netypovatelné. Cílem této práce bylo u těchto netypovatelných izolátů určit genotyp metodou multiplexové polymerázové řetězové reakce (mPCR). Genotyp se podařilo určit u celého souboru 43 netypovatelných izolátů. Nejčastěji byl zjištěn genotyp V (41,9 %), následován genotypem Ia (20,9 %). U izolátů s latexaglutinací určeným sérotypem převažoval sérotyp III (29,2 %) a sérotyp V byl z hlediska výskytu na 2. místě (26,2 %). Byla získána kompletní data o výskytu sérotypů/genotypů S. agalactiae v České republice v letech 2008–2020. Monitorování výskytu sérotypů a genotypů je důležitou součástí zavádění případné vakcíny proti S. agalactiae do klinické praxe.
Klíčová slova:
Streptococcus agalactiae – genotyp – sérotyp
ÚVOD
Streptococcus agalactiae (streptokok skupiny B, Group B Strep, GBS) je grampozitivní, kataláza negativní, fakultativně anaerobní opouzdřený kok řadící se do řetízků, vytvářející na krevním agaru beta-hemolýzu, která je obvykle méně výrazná než u Streptococcus pyogenes.
Na povrchu bakterie se nachází skupinově specifický sacharidový antigen, řadící S. agalactiae do skupiny B v systému séroskupin streptokoků podle Lancefieldové [1]. Pouzdro obklopující S. agalactiae je tvořeno polysacharidy, které jsou typově specifické, na základě jejich složení se určuje 10 sérotypů – Ia, Ib, II až IX [2]. S. agalactiae, u kterých nelze určit sérotyp, se nazývají netypovatelné (nontypeable, NT). Polysacharidové pouzdro S. agalactiae zprostředkovává bakterii ochranu před navázáním komplementu, brání opsonizaci a fagocytóze. Kapsulární polysacharidy tak představují nejvýznamnější faktor virulence S. agalactiae a jsou využívány při navrhování vakcín proti tomuto agens [3]. Polysacharidy pouzdra jsou tvořeny opakujícími se strukturami monosacharidů glukózy, galaktózy, kyseliny N-acetylneuraminové a N-acetylglukosaminu, jejichž pořadím je určen sérotyp [4]. U všech sérotypů je polysacharidový řetězec ukončen kyselinou N-acetylneuraminovou (Neu5Ac, kyselina sialová), která zprostředkovává maskování S. agalactiae za humánní buňky, které mají na svém povrchu též vázanou kyselinu N-acetylneuraminovou. Terminální kyselina N-acetylneuraminová dále umožňuje vazbu bakterie na Sia receptory (tzv. Siglecs – Sialic acid-binding immunoglobulin - type lectins) buněk imunitního systému, a tím tlumí imunitní reakci organismu [5]. Genetický podklad tvorby pouzdra S. agalactiae je dán capsule polysaccharide synthesis (cps) operonem. V cps operonu se nachází geny kódující proteiny účastnící se regulačních procesů bakterie, syntézy bakteriálního pouzdra a syntézy kyseliny sialové [6].
Současným standardem v určování sérotypu S. agalactiae je latexaglutinační test. Izolát s netypovatelným sérotypem neaglutinuje s žádným testovacím sérem, případně reaguje pozitivně s více séry. Příčinou netypovatelnosti izolátu je nízká či žádná exprese kapsulárního polysacharidu, která je způsobena alterací či inaktivací tvorby pouzdra různými typy mutací převážně v genech cps [7]. Nejčastější změnou způsobující ztrátu pouzdra je jednobodová mutace, vytvářející v sekvenci nukleotidů cps genu předčasný stop kodon. Dalším důvodem netypovatelnosti izolátu může být výskyt kapsulární strukturální varianty, která nereaguje s žádným nyní dostupným typově specifickým sérem [7, 8].
Pomocí molekulárně genetických metod lze identifikovat části sekvencí genů cps tvořících pouzdro a na základě toho poté určit genotyp. Stejně jako u sérotypů je rozlišováno 10 genotypů – Ia, Ib, II až IX.
Do Národní referenční laboratoře pro streptokokové nákazy (NRL/STR) jsou doručovány izoláty S. agalactiae získané od pacientů se symptomatickým infekčním onemocněním včetně infikovaných kožních defektů, abscesů, sepsí a novorozeneckých sepsí a meningitid a též izoláty od novorozenců s prokázaným nosičstvím S. agalactiae. V NRL/STR je provedeno potvrzení identifikace S. agalactiae a určení sérotypu latexaglutinační reakcí s kapsulárním antigenem. Pokud se takto nepodaří určit sérotyp, jedná se o izolát s pravděpodobně netypovatelným sérotypem a v rámci dalšího dourčení se provádí molekulárně genetické vyšetření genotypu.
MATERIÁL A METODIKA
V této studii jsme se zaměřili na izoláty S. agalactiae, které byly do NRL/STR doručeny v letech 2008–2020. Jednalo se o 1 038 izolátů od 972 pacientů. V několika případech bylo od jednoho pacienta vyšetřeno současně několik vzorků. Tyto duplicitní či triplicitní vzorky byly testovány se shodným výsledným sérotypem, pouze v jednom případě se sérotypy určené u jednoho pacienta lišily. V dalším zpracování dat se vycházelo z dat bez duplicitních vzorků se stejným sérotypem. Izoláty byly získány z infekčních onemocnění i z nosičství.
Z 972 izolátů se u 43 (4,4 %) nepodařilo určit sérotyp latexaglutinačním testem a byly označeny jako netypovatelné. Většina netypovatelných kmenů nereagovala s žádným latexaglutinačním sérem, ve dvou případech kmen reagoval s více séry.
Ze 43 izolátů s netypovatelným sérotypem bylo 29 získáno od žen a 14 od mužů.
V souboru 43 izolátů bylo 12 prokázáno u případů symptomatického infekčního onemocnění. Jednalo se o 6 pacientek ženského pohlaví a 6 pacientů mužského pohlaví, věkové rozložení pacientů bylo 56–85 let, pouze v jednom případě se jednalo o 34letou pacientku po porodu. Z 12 případů symptomatického infekčního onemocnění se v 7 případech jednalo o invazivní onemocnění (invazivita infekce byla stanovena na základě zaslaného materiálu – jednalo se o bakteriální kulturu z žilní krve) a v 5 případech byl izolát získán ze stěru z kožního defektu, z abscesu a z moče, tedy z neinvazivních infekčních onemocnění.
Ze 43 netypovatelných izolátů se v 31 případech jednalo o nosičství, kdy 4 izoláty byly získány od gravidních žen ze stěrů z oblasti pochvy a 27 izolátů bylo získáno převážně z kožních stěrů od 26 novorozenců a od 1 kojence (8 mužského pohlaví a 19 ženského pohlaví).
U 43 izolátů s netypovatelným sérotypem bylo provedeno vyšetření genotypu pomocí metody multiplexové polymerázové řetězové reakce (mPCR).
Izoláty S. agalactiae byly kultivovány na krevním agaru (Oxoid) přes noc při 35–37 °C v normální atmosféře. Dlouhodobě jsou kmeny skladovány v kryozkumavkách (ITEST KRYOBANKA B, ITEST plus s.r.o.) při -70 °C ve sbírce NRL/STR.
Potvrzení správné identifikace S. agalactiae bylo prováděno určením skupinově specifického antigenu pomocí komerční soupravy (Streptococcal grouping kit, Oxoid Diagnostic Reagents).
Sérotyp byl určován komerčním latexaglutinačním testem (ImmuLex Strep-B Kit, Statens Serum Institut, Dánsko).
Izolace DNA izolátů s netypovatelným sérotypem byla provedena pomocí komerční soupravy (QIAamp DNA mini kit, Qiagen).
Určení genotypu u netypovatelných S. agalactiae bylo prováděno metodou multiplexové PCR se zobrazením výsledných amplikonů pomocí gelové elektroforézy. Principem mPCR metody podle Imperi [9] je identifikace sekvencí typických pro jednotlivé genotypy Ia, Ib, II až IX v genech cpsG, cpsI, cpsJ a cpsN, dále se určuje přítomnost genu cpsL, který slouží jako vnitřní pozitivní kontrola správné identifikace S. agalactiae.
VÝSLEDKY A DISKUSE
U celého souboru 43 izolátů S. agalactiae s netypovatelným sérotypem se podařilo určit genotyp. Ve studovaném souboru byl molekulárně geneticky nejčastěji určen genotyp V (18 izolátů), následován genotypem Ia (9) a III (8), 3x byly určeny genotypy Ib a II a 1x genotypy IV a VI.
Ze 7 invazivních izolátů byl určen ve 4 případech genotyp V, 1x byly určeny genotypy Ia, Ib, a II. U izolátů z neinvazivních onemocnění byl 3x určen genotyp V a 1x genotypy Ia a III. Celkem byl genotyp V zjištěn u 7 z 12 izolátů z invazivních i neinvazivních infekčních onemocnění – tabulka 1.
Tab. 1. Izoláty S. agalactiae s netypovatelným sérotypem, Česká republika, 2008–2020
Table 1. S. agalactiae isolates with non-typeable serotype, Czech Republic, 2008–2020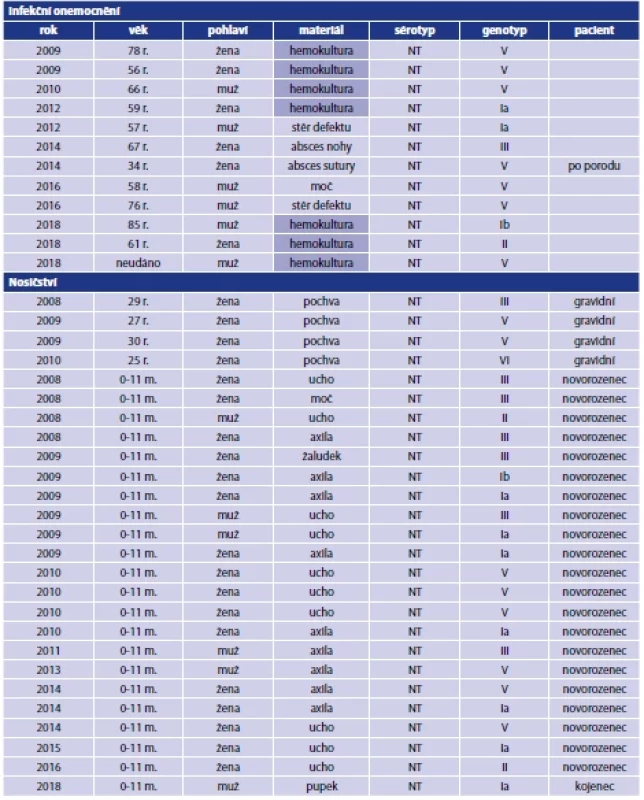

NT – netypovatelný
m. – měsíce
r. – roky
NT – non-typeable
m. – months
r. – yearsV souboru 31 netypovatelných izolátů S. agalactiae prokázaných z nosičství byl nejčastěji určen genotyp V (11 případů), genotyp Ia a III (po 7 případech), po 2 případech genotypy Ib a II a 1x byly určeny genotypy IV a VI.
U 929 izolátů s latexaglutinací určeným sérotypem doručených v letech 2008–2020 byl nejčastěji určen sérotyp III (284 izolátů), následován sérotypem V (255), Ia (125) a II (109), další sérotypy jsou již méně časté – graf 1.
Graf 1. Absolutní počty sérotypů S. agalactiae, absolutní počty genotypů S. agalactiae s netypovatelným sérotypem, ČR, 2008–2020
Figure 1. Absolute numbers of serotypes of S. agalactiae, absolute numbers of genotypes of S. agalactiae with non-typeable serotype, Czech Republic, 2008–2020
NT – netypovatelný izolát
NT – non-typeable serotypeByly získány kompletní výsledky sérotypu/genotypu u všech izolátů S. agalactiae zaslaných do NRL/STR v letech 2008–2020.
Četnost jednotlivých sérotypů vs. genotypů se liší mezi izoláty určenými latexaglutinací a molekulárně geneticky, kdy latexaglutinací nejčastěji určeným sérotypem byl sérotyp III a molekulárně geneticky byl nejčastěji určen genotyp V, následován genotypem Ia. Izoláty s netypovatelným sérotypem a s genotypem V byly poměrově nejčetněji určeny i v dalších studiích [10], důvod tohoto zjištění není zcela jasný, možným vysvětlením je sklon některých linií izolátů S. agalactiae genotypu V ke genetické a antigenní diverzitě [8].
Molekulárně genetické testování izolátů s netypovatelným sérotypem nám zajišťuje stanovení genotypu. Pokud se nepodaří určit genotyp, nelze vyloučit, že by se mohlo jednat o izolát s novým kapsulárním typem.
Zjišťování četnosti jednotlivých sérotypů a monitorování počtu netypovatelných izolátů hraje roli při případném zavádění vakcíny proti S. agalactiae do klinické praxe. Ve vývoji jsou v současnosti polyvalentní vakcíny polysacharidové, které obsahují typově specifické polysacharidy konjugované na proteinový nosič. Dále je ve vývoji proteinová vakcína založená na tvorbě protilátek proti N-terminálním doménám membránových proteinů Rib, AlphaC a Alp 1-3. Proteiny Rib, AlphaC a Alp 1-3 jsou vázány na povrchu téměř všech izolátů S. agalactiae a jejich struktura je převážně homologní napříč izoláty.
Jak je známo ze zkušeností s multivalentními konjugovanými vakcínami proti Streptococcus pneumoniae, typově specifické vakcíny mohou vytvářet selekční tlak na populaci bakterií, což může vést ke zvýhodnění bakterií se sérotypy ve vakcíně neobsaženými a dále bakterií bez pouzderného antigenu. Při případném zavedení polyvalentní polysacharidové vakcíny proti S. agalactiae do klinické praxe tedy nelze vyloučit podobnou situaci tzv. sérotypového replacementu, který vidíme u Streptococcus pneumoniae. Též by mohlo dojít k četnějšímu výskytu S. agalactiae s netypovatelným sérotypem, jehož pouzdro je méně výrazně vytvořeno, či netvoří pouzdro vůbec, a tím by bakterie unikala pozornosti postvakcinačních protilátek.
V rámci prevence invazivních onemocnění vyvolaných S. agalactiae u novorozenců je v České republice doporučeno testovat všechny gravidní ženy na přítomnost S. agalactiae ve stěru z vaginální sliznice a z rekta v 35. až 37. týdnu těhotenství. V případě pozitivního záchytu se rodičce podává antibiotická profylaxe (intrapartum antibiotic prophylaxis, IAP). Profylaxe se zahajuje se začátkem porodní činnosti a pokračuje dále v pravidelných intervalech po dobu trvání porodu. Antibiotikem první volby je penicilin G či ampicilin intravenózní infuzí. Při alergii na penicilin jsou podávány cefalosporiny 1. generace, při anamnéze anafylaktické reakce po penicilinu je indikován klindamycin či vankomycin. IAP se podává i v případě nálezu S. agalactiae v moči gravidní ženy či v případě invazivního onemocnění vyvolaného S. agalactiae u dítěte z předchozí gravidity.
V České republice není zaveden program surveillance invazivních onemocnění vyvolaných S. agalactiae. Do NRL/STR jsou izoláty S. agalactiae z nosičství a invazivních i neinvazivních onemocnění zasílány na bázi dobrovolnosti. Zasílání izolátů do NRL/STR a jejich typizace je významná pro sledování výskytu sérotypů/genotypů v České republice. NRL/STR děkuje všem laboratořím, které izoláty S. agalactiae k typizaci zasílají, a zároveň apeluje na ostatní laboratoře, aby izoláty S. agalactiae především z invazivních onemocnění do NRL/STR zasílaly.
ZÁVĚR
V období 2008–2020 se vyskytlo 43 izolátů S. agalactiae s netypovatelným sérotypem, což představuje 4,4 % ze všech izolátů doručených do NRL/STR. U všech 43 netypovatelných izolátů byl molekulárně geneticky určen genotyp. Nejčastěji byl určen genotyp V (u 41,8 % netypovatelných izolátů), následován genotypem Ia (20,9 %). U izolátů s latexaglutinací určeným sérotypem převažuje sérotyp III (29,2 %) a sérotyp V je z hlediska výskytu na 2. místě (26,2 %).
Netypovatelné izoláty byly získány ze vzorků případů infekčního onemocnění u dospělých a z nosičství u gravidních žen a novorozenců, žádný netypovatelný izolát nebyl původcem infekčního onemocnění novorozence.
V případě zavádění polyvalentní polysacharidové vakcíny proti S. agalactiae do klinické praxe bude třeba zjistit, zda zaváděná vakcína nabízí pokrytí vyskytujících se sérotypů.
Podpořeno MZ ČR – RVO („Státní zdravotní ústav – SZU, 75010330“).
Do redakce došlo dne 13. 1. 2022.
Adresa pro korespondenci:
MUDr. Sandra Vohrnová
Oddělení bakteriálních vzdušných nákaz, CEM
Státní zdravotní ústav
Šrobárova 49/48
100 00 Praha 10
e-mail: sandra.vohrnova@szu.czEpidemiol Mikrobiol Imunol, 2022; 71(4): 203–207
Zdroje
1. Lancefield RC. A Serological Differentiation of Human and Other Groups of Hemolytic Streptococci. The Journal of experimental medicine, 1933;57(4):571–595. doi: 10.1084/jem.57.4.571. PMID: 19870148; PMCID: PMC2132252.
2. Slotved HC, Kong F, Lambertsen L, et al. Serotype IX, a Proposed New Streptococcus agalactiae Serotype. Journal of clinical mikrobiology, 2007;45(9):2929–2936. doi:10.1128/JCM.00117 - 07.
3. Doran KS, Nizet V. Molecular pathogenesis of neonatal group B streptococcal infection: no longer in its infancy. Molecular Microbiology, 2004;54(1):23–31. doi: 10.1111/j.1365 - 2958.2004.04266.x. PMID: 15458402.
4. Cieslewicz MJ, Chaffin D, Glusman G, et al. Structural and genetic diversity of group B streptococcus capsular polysaccharides. Infection and Immunity, 2005;73(5):3096–3103. doi:10.1128/ IAI.73.5.3096-3103.2005.
5. Marques MB, Kasper DL, Pangburn MK, et al. Prevention of C3 deposition by capsular polysaccharide is a virulence mechanism of type III group B streptococci. Infection and Immunity, 1992;60(10):3986–3993. doi: 10.1128/iai.60.10.3986-3993.1992. PMID: 1398910; PMCID: PMC257427.
6. Chaffin DO, Beres SB, Yim HH, et al. The serotype of type Ia and III group B streptococci is determined by the polymerase gene within the polycistronic capsule operon. Journal of Bacteriology, 2000;182(16):4466–4477. doi: 10.1128/JB.182.16.4466 - 4477.2000. PMID: 10913080; PMCID: PMC94618.
7. Rosini R, Campisi E, De Chiara M, et al. Genomic analysis reveals the molecular basis for capsule loss in the group B Streptococcus population. PloS one, 2015;10(5):e0125985. Published 2015 May 6. doi:10.1371/journal.pone.0125985.
8. Ramaswamy SV, Ferrieri P, Flores AE, et al. Molecular characterization of nontypeable group B streptococcus. Journal of clinical mikrobiology, 2006;44(7):2398–2403. doi:10.1128/JCM.02236 - 05.
9. Imperi M, Pataracchia M, Alfarone G, et al. A multiplex PCR assay for the direct identification of the capsular type (Ia to IX) of Streptococcus agalactiae. Journal of Microbiological Methods, 2010;80(2):212–214. doi: 10.1016/j.mimet.2009.11.010. Epub 2009 Dec 1. PMID: 19958797.
10. Slotved HC, Fuursted K, Kavalari ID, et al. Molecular Identification of Invasive Non-typeable Group B Streptococcus Isolates From Denmark (2015 to 2017). Frontiers in cellular and infection mikrobiology, 2021;11 : 571901. Published 2021 Mar 29. doi:10.3389/ fcimb.2021.571901.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek Rejstřík
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2022 Číslo 4- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Prokalcitonin: marker vhodný pro diagnostiku sepse i hodnocení antimikrobiální léčby
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Nosičství Neisseria meningitidis u nastupujících mladých vojenských profesionálů v období pandemie onemocnění covid-19
- Porovnání vývoje epidemiologické situace vybraných sexuálně přenosných infekcí ve třech krajích České republiky v letech 2006–2013
- Molekulární určení genotypu izolátů Streptococcus agalactiae s netypovatelným sérotypem, Česká republika, 2008–2020
- Akutní poškození ledvin s nutností eliminační léčby jako důsledek infekce Clostridioides difficile u 15letého chlapce
- Pečenkovy epidemiologické dny, Plzeň 2022
- 100 let od narození RNDr. Evy Aldové, CSc.
- 100 let od narození doc. MUDr. Josefa Pečenky, DrSc.
- Rejstřík
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nosičství Neisseria meningitidis u nastupujících mladých vojenských profesionálů v období pandemie onemocnění covid-19
- Molekulární určení genotypu izolátů Streptococcus agalactiae s netypovatelným sérotypem, Česká republika, 2008–2020
- Akutní poškození ledvin s nutností eliminační léčby jako důsledek infekce Clostridioides difficile u 15letého chlapce
- Porovnání vývoje epidemiologické situace vybraných sexuálně přenosných infekcí ve třech krajích České republiky v letech 2006–2013
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



