-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCelková léčba atopické dermatitidy – evropské doporučené postupy a současný stav
Systemic Treatment of Atopic Dermatitis – European Guidelines and Current State of Art
Patients with severe atopic dermatitis and their physicians have been waiting for new systemic drugs for a long time. The use of conventional immunosuppressants (corticosteroids, cyclosporine A and off label use of methotrexate, mycophenolate mofetil and azathioprine) is limited due to their long-term low efficacy, cumulative toxicity and side effects. Phototherapy doesn´t represent a long-term therapy option either and moreover, it isn´t as effective as systemic treatment in atopic dermatitis. The need for long-term effective and safe drugs is evident. Biologics, small molecules and other new drugs seem to be promising candidates. As a positive side effect of new drug introduction, the existing systemic drugs are being revisited. This article deals with the conclusions of the European guidelines, clinical profile comparison of methotrexate and cyclosporine A, dupilumab characteristics and perspectives in systemic therapy of atopic dermatitis.
Keywords:
atopic dermatitis – systemic therapy – European guidelines – current situation
Autoři: N. Benáková 1,2
Působiště autorů: Dermatovenerologická klinika 1. LF UK, Praha, přednosta prof. MUDr. Jiří Štork, CSc. 1; Dermato-alergologická ordinace Immuno Flow Praha, vedoucí lékař MUDr. Martin Fuchs 2
Vyšlo v časopise: Čes-slov Derm, 94, 2019, No. 6, p. 223-231
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Pacienti se závažnou atopickou dermatitidou a jejich lékaři dlouho čekali na příchod nových celkových léků. Dosavadní celková imunosupresivní léčba (kortikoidy, cyklosporin A a „off-label use“ metotrexát, mykofenolát mofetil, azathioprin) není pro dlouhodobou léčbu pro svou malou účinnost, a především kumulativní toxicitu a nežádoucí účinky dostačující. Ani fototerapie není léčbou pro dlouhodobé použití a u atopické dermatitidy není stran účinnosti postavena na roveň celkové léčby. Potřeba dlouhodobě účinných a bezpečných léčiv je tedy zřejmá. Na tuto roli kandidují biologika, malé molekuly a další nové léky. Jako vedlejší pozitivní efekt zavádění nových léků, dochází k žádoucí revizi léků stávajících. V článku jsou probrány závěry ze současných evropských doporučených postupů, srovnání léčebného profilu cyklosporinu A a metotrexátu, charakteristika dupilumabu a perspektivy v celkové léčbě atopické dermatitidy.
Klíčová slova:
atopická dermatitida – celková léčba – evropské doporučené postupy – současný stav
ÚVOD
Pacienti se závažnou atopickou dermatitidou a jejich lékaři dlouho čekali na příchod nových celkových léků. Poslední desetiletí bylo ve znamení biologické léčby psoriázy, to současné bude ve znamení atopické dermatitidy. Na rozdíl od psoriázy, kdy se objevila anti-TNF, pak anti IL-17 a nyní anti IL-23 skupina, přichází biologická léčba atopické dermatitidy hned s několika léčebnými skupinami najednou. Do klinické praxe nastupuje jako první dupilumab, biologikum, které si v České republice již řada lékařů a jejich pacientů mohla v rámci klinických studií vyzkoušet. Jako vedlejší pozitivní efekt zavádění nových léků dochází i k žádoucí revizi léků stávajících, což se v případě atopické dermatitidy týká především cyklosporinu A a metotrexátu. V současnosti pracuje na nových lécích pro atopickou dermatitidu přes sedmdesát výrobců (Advent Forum, Berlin 2018). A tak je dalším pozitivním efektem zájem farmaceutického průmyslu o atopickou dermatitidu jako takovou, což je přínosné pro dermatologii, dermatology a jejich pacienty.
Naposledy vyšel podrobný souhrnný článek o atopické dermatitidě v Čs. dermatologii právě před deseti lety [1]. V mezidobí došlo v oblasti základního i klinického výzkumu k zásadnímu pokroku, a do praxe se tak dostávají nové celkové léky z kategorie biologik, malých molekul, H4 antihistaminik a dalších lékových skupin. Také v lokální léčbě dochází k posunu – v klinických studiích jsou lokální léky s malými molekulami, jako jsou inhibitory fosfodiesterázy (PDE4), inhibitory janus kináz (JAK) a agonisté arylhydroxykarbonových receptorů (AhR). Biologika pro lokální léčbu použít nelze, jedná se o velké molekuly, které nemohou přes epidermis dostatečně penetrovat.
Téma atopické dermatitidy je natolik obsáhlé, že se budeme věnovat jen celkové léčbě, a to z pohledu současných evropských doporučených postupů a recentních publikací. Současná doporučení stran lokální terapie, fototerapie a dalších metod jsou zpracována v první části evropských doporučených postupů EDF (European Dermatology Forum) [18]. Značná část je zde věnována též otázkám adherence a edukace pacientů, protože terapeutická edukace může nejen zlepšit výsledky léčby a průběh choroby, ale i zbrzdit atopický pochod. Tomuto tématu byl v Čs. dermatologii ostatně věnován obsáhlý článek již v roce 2015 [2].
MIKROBIOM, HETEROGENITA A KOMORBIDITY
Atopická dermatitida (AD) je velmi častá dermatóza. Jako ostatní atopické choroby i výskyt AD má v populaci narůstající trend, pravděpodobné příčiny nárůstu osvětluje hygienická a hapténová hypotéza. V současnosti se prevalence v Evropě u dětí udává 10–30% a u dospělých pak 2–10% [4, 16]. Zatímco dříve se udávala perzistence z dětského věku do dospělosti okolo 1/3, nyní je to již 1/2 [17]. Nárůst je v populaci dětské, ale i u dospělých, což pro zdravotnické systémy znamená nutnost počítat s AD jako s výraznou kapitolou stran nákladů na léčbu a prevenci.
AD je chronická svědivá zánětlivá dermatóza s hyperreaktivitou kůže, v pozadí je genetická dispozice k dysfunkci kožní bariéry a k neuroimunologické dysbalanci. Abnormity bariérové funkce a imunity jsou vzájemně provázené, takže nelze jednoznačně odlišit, který faktor je primární, příčinný a který je sekundární, následný (teorie inside-out a outside-in). Interakcí genetických (velmi pravděpodobně i epigenetických) a zevních i vnitřních faktorů dochází ke klinické manifestaci AD. Mezi těmito faktory se jako staronový hráč uplatňuje také kožní mikrobiom. Fyziologický, tedy vyvážený a druhově pestrý mikrobiom zabraňuje kolonizaci patogeny a je zásadní pro funkci kožní bariéry. Nejen slizniční, ale i kožní mikrobiom má vliv na vývoj imunitního systému, takže navození zdravé symbiózy v kritickém časovém oknu novorozeneckého období je velmi důležité. Interakce kožních komenzálů, zejména koaguláza negativních stafylokoků, s imunitním systémem totiž moduluje reakce nespecifické i specifické imunity a působí v zásadě imunoregulačně. Odchylný mikrobiom pak umožňuje vznik chorob, jako je atopická dermatitida či bronchiální astma, a ovlivňuje vznik a průběh řady kožních chorob i v dospělosti. U AD není mikrobiom vyvážený a druhově pestrý, dominuje kolonizace kmeny Staphylococcus aureus. Ty řadou komplexních mechanismů působí prozánětlivě a amplifikují atopické abnormity, což vede k jakési patogenetické spirále. Míra kolonizace koreluje i klinicky se závažností choroby. Využití pozitivní funkce mikrobiomu je tématem pro výzkum nových strategií v léčbě AD a dalších dermatóz. Zcela novou éru v léčbě AD pak představuje vývoj nové generace vakcín proti S. aureus, které stimulují jak buněčnou (Th 17 lymfocyty), tak humorální imunitu (tvorba protistafylokokových protilátek) [12].
Manifestace AD je různorodá – heterogenní jak z pohledu morfologie projevů i jejich lokalizace, tak věku vzniku, průběhu či reakce na léčbu. Je to odrazem faktu, že AD je heterogenní choroba již geneticky a etiopatogeneticky. Heterogenita se projevuje i ve výskytu komorbidit. Tento termín a jeho význam je dobře znám z četných přednášek a článků o biologické léčbě psoriázy, kde se, mimo jiné, existencí komorbidit prokazuje systémový charakter zánětu u psoriázy. Systémový charakter zánětu u AD však není třeba prokazovat, protože je dobře znám již desítky let a projevuje se dalšími atopickými chorobami. Atopické komorbidity, jako jsou bronchiální astma, alergická rhinokonjunktivitida, potravinová alergie, ale i méně známé jednotky, jako je chronická rhinosinusitida s nazálními polypy či eozinofilní ezofagitida, se mohou u jedince postupně objevovat v rámci tzv. atopického pochodu.
Pacienti s AD mají často souběžně i kožní komorbidity, jako je kontaktní alergie, alopecia areata, vitiligo aj. S výzkumem nových léčiv se objektivizují ale i další, neatopické komorbidity AD, a to především z oblasti neuropsychiatrických chorob, především deprese. Lékaři by po nich měli aktivně pátrat, neboť účinná léčba AD může snižovat riziko rozvoje těchto tíživých a léčebně nákladných komorbidit. Současné průzkumy naznačují i vztah k obezitě, některým autoimunitním chorobám, kardiovaskulárním onemocněním a lymfomům – jejich relevanci bude ale třeba prokázat na velkých souborech pacientů [11].
HODNOCENÍ ZÁVAŽNOSTI A VOLBA LÉČBY
Volba léčby jak lokální, tak celkové, se řídí podle závažnosti AD. Závažnost je dána nejen rozsahem a intenzitou AD, ale i průběhem, lokalizací (postižení partií omezujících práceschopnost a soběstačnost či psychosociálně hendikepujících), reakcí na léčbu, tolerancí léčby, komplikacemi, komorbiditami a také ovlivněním kvality života. Důsledky jsou zdravotní, psychosociální i ekonomické. Dopady se týkají nejen pacienta, ale i jeho rodiny a blízkých – např. prof. Maurer (Charité Berlin) hovoří výstižně o „greater patient“. Dopad choroby na život pacienta s AD má kumulativní charakter – má vliv na průběh jeho života, jeho vzdělání, zaměstnání, šance na trhu práce, příjmy rodiny atp.
Zvláštní postavení při posuzování závažnosti AD má pruritus. Vede k výrazným poruchám spánku s následným snížením výkonnosti a dalšími sociálními, psychickými a psychosomatickými důsledky. Ač je to subjektivní příznak, musí být součástí celkového zhodnocení závažnosti choroby [19]. Obdobnou významnost má pruritus např. u chronické urtikárie, kde je zásadním hodnoticím kritériem závažnosti choroby a volby léčby, včetně biologické, a tak by tomu mělo být i u AD.
Pro hodnocení závažnosti AD existují různé skórovací systémy – k nejčastějším patří IGA (Investigator Global Assessment), PGA (Physician Global Assessment), EASI (Eczema Area and Severity Index) aj., ale pruritus v nich kromě SCORADu (Score of Atopic Dermatitis) není zastoupen. A tak se situace řeší různými kombinacemi s odděleným skórováním pruritu (např. skóre Peak Pruritus NRS – Numerical Rating Scale). Přitom pruritus koreluje lépe s aktivitou AD než rozsah a intenzita morfologických projevů AD. Systematickým pátráním se zjistilo 62 různých objektivních metod hodnoticích závažnost AD [8]. Rozdílnost a nejednotnost v používání skórovacích systémů v klinických studiích je také příčinou obtížné komparability výsledků, což je dost zásadní fakt. Existují i regionální rozdíly – v USA se nejvíce používá IGA, v Evropě a Asii pak SCORAD. V současnosti de facto neexistuje jedna univerzálně akceptovaná definice závažnosti AD a ani jednotný, natož standardizovaný, nástroj pro její hodnocení. Pro hodnocení efektu léčby (ne závažnosti) je v současnosti za nejvíce validní a spolehlivý nástroj považováno skóre EASI [8].
Odborníci se shodují na konstatování, že stávající skórovací systémy jsou svým charakterem statické a nevypovídají nic o průběhu AD [5]. V budoucnu patrně přibudou dynamičtější skóre, která budou lépe objektivizovat intenzitu choroby včetně pruritu. Na vývoji optimálního hodnoticího nástroje pracuje řada skupin, v Evropě např. projekt HOME (lékaři, pacienti, farmaceutický průmysl [18]. AD je stran průběhu velmi proměnlivá, takže na významu nabývá také průběžné měření aktivity choroby, včetně kvality života, samotným pacientem „doma“ (patient reported outcomes – PRO) pomocí různých dotazníků a nástrojů.
Jakkoliv je skórování v praxi časově náročné a nepopulární, je objektivizace závažnosti AD pro celkovou léčbu nezbytná – pro volbu léčby, hodnocení poměrů účinnosti, nákladnosti, rizik atp. Obvykle se používají kombinace skóre rozsahu (BSA – Body Surface Area), intenzity (EASI – Eczema Area and Severity Index) a skóre kvality života (DLQI – Dermatology Life Quality Index).
Učebnicově se AD dělí na tři skupiny závažnosti: mírnou, středně těžkou a těžkou. Vyjádřeno např. ve skóre EASI jsou to intervaly < 7,7–21, > 22, u skóre SCORAD > 25, 25–50, > 50. V praxi se používá také dělení AD jen na dvě skupiny závažnosti k odlišení volby léčby lokální od léčby celkové, podobně jako u psoriázy a ostatně i dalších chorob. Mírná až středně těžká AD by měla být dostatečně zvládnutelná léčbou lokální, zatímco středně těžká až těžká AD vyžaduje i léčbu celkovou [8]. Evropské doporučené postupy [19] rozlišují čtyři stupně léčby („stupňovitá léčba“), kde se volba léčby odvíjí podle závažnosti průběhu. První tři stupně zahrnují léčbu lokální, čtvrtý pak léčbu celkovou (tab. 1).
Tab. 1. Stupňovitá léčba 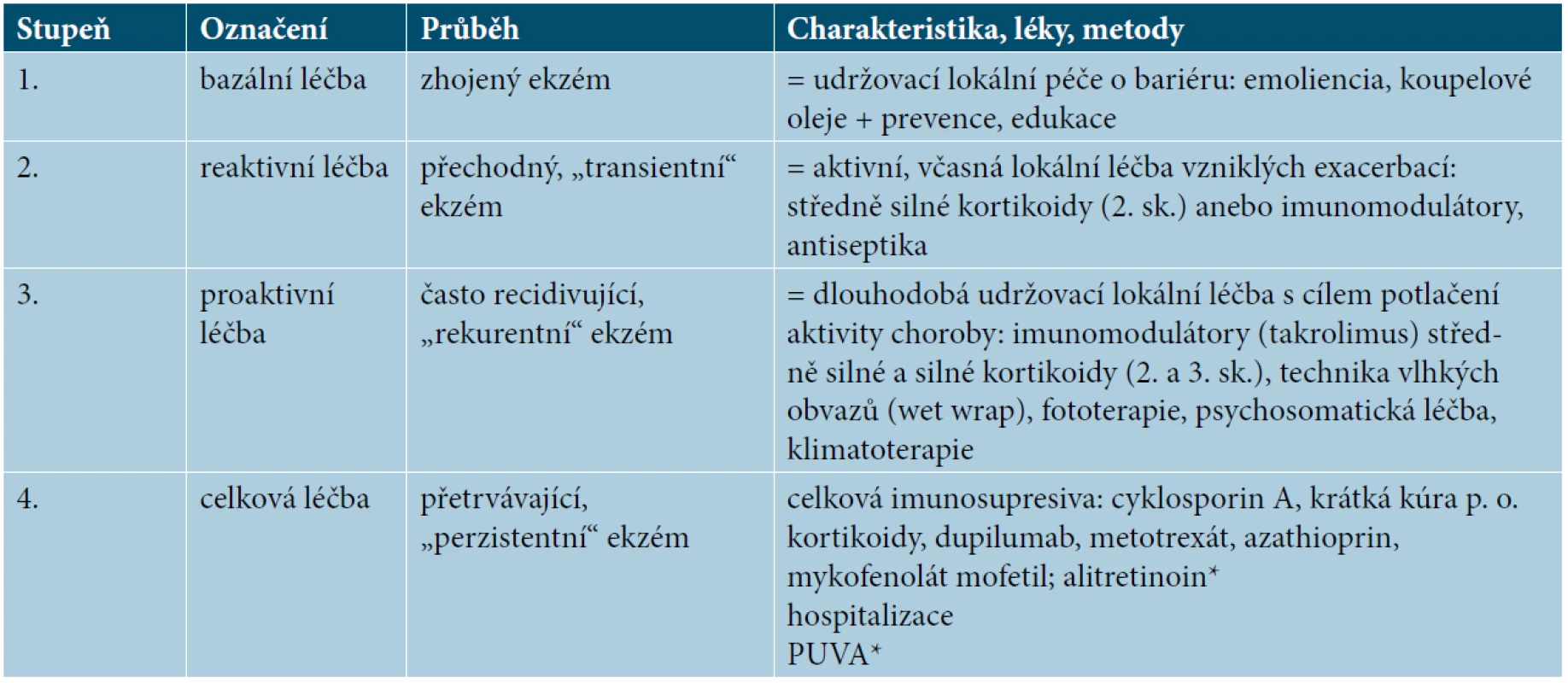
(upraveno podle Wollenberga [19])
*V ČR t. č. nedostupné (Oxsoralen, tbl. pro PUVA terapii není na trhu, alitretinoin již není registrovaný).Odhaduje se, že těžkou AD trpí celkově cca 10 % pacientů [5, 17], v populaci dospělých ekzematiků je toto procento patrně vyšší, resp. středně těžká až těžká AD se vyskytuje až u 1/3 dospělých [16]. V dětské populaci je prevalence těžké AD patrně nižší než u dospělých, např. ve Velké Británii trpí na středně těžkou až těžkou AD 16 % dětí [9].
I přes vysokou prevalenci jsou léčebné možnosti pro pacienty se středně těžkou až těžkou AD omezené. Celkové kortikoidy, cyklosporin A a metotrexát lze vzhledem k profilu jejich nežádoucích účinků používat jen krátkodobě; mykofenolát mofetil a azathioprin připadají v úvahu, až když selžou všechny dosavadní možnosti. Fototerapie je obecně nevhodná u akutních a iritabilních pacientů, určité uplatnění nachází u chronických, lichenifikovaných forem; je ale časově náročná, nepohodlná, často špatně tolerovaná a nelze ji používat k dlouhodobé kontinuální léčbě. V anglosaské literatuře se pro tuto skupinu výstižně používá termín „difficult to treat patients“. Potřeba dlouhodobě účinných a bezpečných celkových léků pro tyto pacienty je jednoznačná [16].
CELKOVÁ LÉČBA
Indikací celkové léčby jsou těžké, refrakterní případy, kde lokální léčba, případně v kombinaci s fototerapií, nevede k dostatečnému efektu nebo tato léčba není tolerovaná. Fototerapie u atopické dermatitidy není řazena na úroveň systémové léčby (na rozdíl od psoriázy, kde má výraznou účinnost) [19].
Co je vlastně cílem celkové léčby u AD? Podle prof. Wollenberga (Advent Forum, Berlin 2018) je to, obdobně jako u lokální léčby, úleva od příznaků, reparace kožní bariéry a tlumení zánětu; dále pak zvládnutí komorbidit a sekundárních komplikací, minimalizace nežádoucích účinků a maximalizace výsledku celkové léčby, včetně psychického stavu, tedy stabilizace choroby až zhojení projevů. K tomu přistupuje i edukace a podpora pacienta.
CELKOVÁ LÉČBA KONVENČNÍMI IMUNOSUPRESIVY
V celkové léčbě AD jsou zásadními léky imunosupresiva, resp. protizánětlivé léky zasahující méně či více selektivně do imunopatogeneze AD (tab. 2). Role jiných celkových léků a metod má charakter doplňující (antihistaminika, antibiotika a další), podrobnější informace jsou v literatuře [2, 3, 19].
Tab. 2. Celkové léky pro léčbu atopické dermatitidy 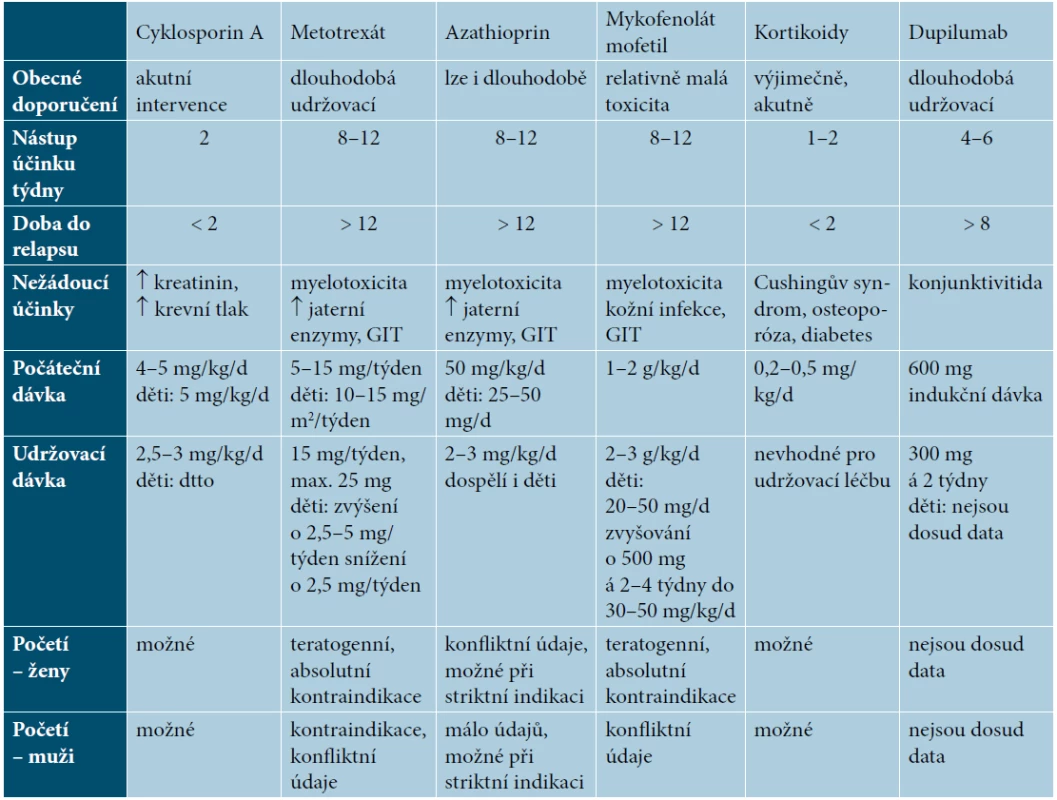
(upraveno podle Wollenberga [19]) Konvenční imunosupresiva mají kumulativně toxické účinky, lze je tedy stran bezpečnosti používat k dlouhodobé léčbě jen omezeně. Nezbytností je pravidelné laboratorní a klinické monitorování. Ani jejich účinnost, krátkodobá i dlouhodobá, není uspokojivá, často dochází k ukončení léčby ne pro nežádoucí účinky, ale pro neúčinnost (krátké setrvání na léku – drug survival). Dlouhodobě bezpečné a solidně účinné celkové léky byly dosud nenaplněnou potřebou. Jako slibné léky přicházejí nyní biologika a malé molekuly typu inhibitorů janus kináz (JAK), které působí selektivněji a mají i lepší bezpečnostní profil.
Důvodem neúčinnosti může být také špatná adherence, ke které dochází nejen u lokální, ale i u celkové léčby, často v důsledku „únavy z léčby“. U chronických chorob obecně se non-adherence pohybuje v rozmezí 30–40 %. Adherenci k léčbě může výrazně zlepšit edukace jak ústní, tak písemná. K ní patří též písemný léčebný plán, který je vhodný zejména u nových pacientů, při změně terapie či při terapii složité, komplikované – jak to doporučuje prof. Palerová z Chicaga (Advent Forum, Berlin 2018).
Jediným registrovaným imunosupresivem k léčbě AD u dospělých v České republice a ve většině evropských zemí je cyklosporin A. Ostatní imunosupresiva se pohybují v kategorii „off label use“, což v USA platí i pro cyklosporin A. Ve Velké Británii je často používaný azathioprin [8], dokonce častěji než cyklosporin A [9], v ostatních Evropských zemích je v pořadí až za metotrexátem [5, 6]. Pomyslnou první linii představuje tedy cyklosporin A, v řadě zemí i metotrexát [5, 10 ]. Celkové kortikoidy jsou vyhrazeny pro případy urgence, krátce, maximálně jeden týden jako záchranná terapie nebo jako přemosťovací léčba k jiné plánované celkové léčbě u dospělých. U dětí je třeba celkovou kortikoidní léčbu zvažovat ještě opatrněji [19]. Až v další linii jsou azathioprin a mykofenolát mofetil, protože nemají takový poměr účinnosti k bezpečnosti jako metotrexát. Obecně jsou konvenční imunosupresiva zatížena nežádoucími účinky, především dlouhodobými, a proto je třeba pečlivě posoudit poměr rizik uvažované léčby ku prospěchu pro pacienta.
Při plánování zahájení celkové léčby se napřed doporučuje ještě zvážit terapeutický pokus s intenzivní, optimalizovanou lokální léčbou [15]. Jedná se v podstatě o hledání rezerv v lokální léčbě, ale i zrevidování stávajícího vyšetřovacího a léčebného postupu a edukace, zhodnocení dlouhodobé závažnosti choroby, posouzení komorbidit a kontraindikací uvažované celkové léčby, včetně plánovaného početí a posouzení preferencí a očekávání pacienta – je třeba tedy uvažovanou celkovou léčbu s pacientem detailněji prodiskutovat.
Podrobně byla celková léčba probrána v Čs. dermatologii v souhrnném článku v roce 2009 [1], proto se u konvenčních imunosupresiv zaměříme na resumé evropských doporučení EDF (European Dermatology Forum) a nová data. Aktualizované informace o dermatologické léčbě cyklosporinem A a metotrexátem jsou dostupné v odborné literatuře věnující se současné celkové léčbě psoriázy. Jejich bezpečnostní profil se u AD nezdá být odlišný.
Cyklosporin A je indikován u chronické, těžké AD u dospělých, kontinuální léčba by neměla přesáhnout dva roky. Pečlivé monitorování potenciálních nežádoucích účinků, klinické a laboratorní, je nezbytnou podmínkou léčby. U dětí a dospívajících je indikován u refrakterních případů či u těžkého průběhu. Doba trvání léčby se řídí podle klinické účinnosti a snášenlivosti léku. Používají se jak krátkodobé, tak dlouhodobé režimy. Časté nežádoucí účinky (zejména nefrotoxicita a hypertenze) jsou překážkou pro dlouhodobější léčbu. Obvykle se doporučuje interval léčby 3–6 měsíců. K ukončení léčby či převedení na jiný systémový lék by se mělo přistoupit po dvou letech léčby; řada pacientů však snáší i dlouhodobější léčbu nízkými dávkami. Na úvod se doporučuje začít dávkou 5 mg/kg/den, rozdělenou do dvou denních dávek. Po dosažení klinického efektu pak s dávkou klesat o 0,5–1 mg/kg ve 2týdenních intervalech. Klesání závisí na klinické účinnosti, v jednotlivých případech je při dlouhodobé kontinuální léčbě žádoucí používat nejnižší, ještě dostatečně účinnou dávku. Intermitentní léčba, např. jako víkendová terapie, je u některých pacientů účinná a má z hlediska bezpečnosti žádoucí nižší kumulativní dávku léku. U dětí a dospívajících pacientů se doporučuje individualizovaný dávkovací režim. Běžně není třeba rutinně stanovovat sérologické hladiny léku. Stran vakcinace se doporučuje lék přechodně ukončit dva týdny před plánovaným očkováním. S odstupem 4–6 týdnů po očkování je možné v léčbě cyklosporinem A znovu pokračovat. Lék lze při zvážení poměru prospěchu k rizikům a těsného klinického a laboratorního monitorování použít i v graviditě. Kombinovaná léčba cyklosporinem A společně s fototerapií se nedoporučuje. Obecně by pacienti léčení cyklosporinem Aměli používat účinnou fotoprotekci [19]. Cyklosporin A, podobně jako celkové kortikoidy, má relapsy po ukončení léčby u 50–90 % pacientů [Thomas Bieber, Advent Forum, Berlín 2018].
Metotrexát se může použít (off-label use) pro léčbu AD u dospělých i dětí. Režim dávkování je obdobný nebo mírně nižší než u psoriázy. U dětí se ukazuje, že metotrexát v dávce 7,5 mg týdně je po 12 týdnech léčby hodnocený prostřednictvím skóre SCORAD stejně účinný jako cyklosporin A v dávce 2,5 mg/kg/den [19]. Metotrexát je teratogenní, takže ženy, ale i muži ve fertilním věku musí během léčby a nyní 6 měsíců po jejím ukončení (dříve býval odstup kratší) používat účinnou antikoncepci. Metotrexát ovlivňuje spermatogenezi a oogenezi. Tyto účinky jsou po ukončení léčby ve většině případů reverzibilní. Dávkování u AD je imunosupresivní (< 30 mg týdně), ne cytostatické, takže i bezpečnostní opatření v neonkologických indikacích se od onkologických indikací liší, což se promítlo i do české harmonizace Souhrnu údajů o léku (SPC) s evropskou lékovou legislativou – viz databáze léků (www.sukl.cz).
Azathioprin lze použít off-label u dospělých s AD, kde není cyklosporin A účinný nebo je kontraindikovaný. Lze ho použít u dětí, k dispozici je ale jen jedna malá klinická studie. Pacienti musí být napřed vyšetřeni na přítomnost polymorfismů thiopurin metyltransferázy (TPMT) kvůli riziku závažné kostní toxicity. Počáteční dávka se doporučuje v rozmezí 1–3 mg/kg/den. Alternativně lze u dospělých začít dávkou 50 mg/den a pomalu ji zvyšovat za těsného monitorování krevního obrazu a jaterních testů. U gravidních žen by se azathioprin neměl používat, resp. naprosto výjimečně. Azathioprin se nemá kombinovat s fototerapií, je třeba používat velmi účinnou fotoprotekci [19].
Mykofenolát mofetil je registrovaný v řadě evropských zemí pro léčbu systémového lupus erytematosus a při prevenci rejekce transplantátu. Lze ho použít u dospělých s AD v dávce až 3 g/den, v případě, že cyklosporin A není účinný nebo je kontraindikovaný. Lze ho použít i u dětí a dospívajících, u nich ale nejsou k dispozici randomizované klinické studie. Mykofenolát mofetil i natrium mykofenolát jsou teratogenní, takže ženy i muži ve fertilním věku musí během léčby používat účinnou antikoncepci [19].
S nástupem biologik se revidují i současné konvenční imunosupresivní léky, současné práce se zaměřují zejména na srovnávání cyklosporinu A a metotrexátu, protože doporučené postupy návrhy na pořadí jejich volby neposkytují. Volba immunosupresiva se liší nejen mezi zeměmi, ale i individuálně mezi lékaři – v závislosti na preferencích, zkušenostech, zvyklostech, nákladnosti a dostupnosti daného léku. V holandském průzkumu se např. zjistilo, že nejčastěji předepisovaným imunosupresivem je u AD metotrexát; při podrobnější analýze se ukázalo, že na univerzitních pracovištích je první volbou cyklosporin A, zatímco v menších, regionálních nemocnicích a v terénu je to spíše metotrexát [5].
Krátkodobá účinnost obou těchto léčiv (12.–24. týden) je hodnocena jen jako 50% [13, 14, 19]. Obecně je účinnost maximální dávky cyklosporinu A, tj. 5 mg/kg/den obdobná účinnosti metotrexátu v dávce 25 mg týdně [7]. Je logické, že po ukončení léčby imunosupresivy dojde k exacerbaci choroby, což odpovídá známému konceptu subklinického, latentního zánětu, který je přítomný i ve zhojené, nepostižené kůži (abnormální cytokinový profil v nelezionální kůži a systémová aktivace imunity). Objevují se proto i práce, mapující a srovnávající tzv. post drug survival [10] – parametr, který daleko lépe reflektuje průběh choroby a v praxi potřebnou délku remise či stabilizace choroby. Oba léky se v léčebném profilu u AD liší:
- Cyklosporin A má rychlejší nástup účinku – okolo 2 týdnů oproti metotrexátu 8–12 týdnů. V dávce 2,5 mg/den je cyklosporin A v 24. týdnu účinnější než metotrexát v dávce 15 mg/týdně.
- Metotrexát má ale lepší setrvání na léčbě, „drug survival“ (23 měsíců oproti 8 měsícům u cyklosporinu A) a i delší dobu do relapsu – nutnost zahájení další celkové léčby po ukončení léčby předchozí (post drug survival), metotrexát 12 měsíců versus 2 měsíce u cyklosporinu A [10]. Z pohledu obou těchto parametrů hodnocení má metotrexát lepší dlouhodobý klinický profil, což je zajímavý podnět pro klinický výzkum a léčbu [10].
Metotrexát má při srovnání s azathioprinem také delší medián v parametru drug survival (28,8 měsíců versus 11,5 měsíců) [6]. Metotrexát má obecně u AD nedoceněný potenciál a bude mu jistě věnována velká pozornost, podobně jako tomu bylo u biologické léčby psoriázy. V současnosti probíhá v Británii u dětí velká randomizovaná, multicentrická studie, srovnávající metotrexát versus cyklosporin A stran účinnosti, bezpečnosti a nákladnosti léčby u těžké atopické dermatitidy [9]. Studie má léčebnou část po 36 týdnů a následné sledování v období dalších 24 týdnů. Získaná relevantní data by, v pozitivním případě, umožnila zařadit metotrexát do kategorie „on-label use“. Používaný protokol léčby může sloužit dermatologům na klinických i dalších pracovištích jako vhodný a po formální stránce velmi dobře propracovaný vzor. Podobně jako u jiných imunologicky zprostředkovaných chorob (psoriáza, nově supurativní hidradenitida, standardně revmatoidní artritida, Crohnova choroba aj.) je velmi pravděpodobné, že metotrexát najde uplatnění i v kombinované léčbě s biologiky a malými molekulami.
Přesné údaje o procentu pacientů s AD léčených konvenčními imunosupresivy nejsou k dispozici, takováto databáze či registr v ČR dosud neexistuje. Můžeme ale usuzovat analogicky, jako tomu bylo u psoriázy před zavedením biologik, a to nejen v ČR, ale i v Evropě. Tedy, že těžcí pacienti s AD jsou pravděpodobně nedostatečně léčeni celkovými imunosupresivy a že zde existuje určitá „podléčenost“. Na mezinárodní konferenci věnované atopické dermatitidě Advent Forum v Berlíně v roce 2018 zaznělo v této souvislosti z úst prof. Thomase Biebera konstatování, že těžká atopická dermatitida je pod nedostatečnou kontrolou přibližně v 60 % případů. Pro zlepšení situace lze kromě postgraduálního vzdělávání dermatologů (a zlepšení úhrad péče o těžké pacienty zdravotními pojišťovnami) spatřovat další potenciál v zainteresování alergologů do systémové léčby těžké AD, jako je tomu např. v USA [3]. Navíc je velmi pravděpodobné, že biologika z klinických studií u AD budou hledat své uplatnění i v čistě alergologických indikacích, takže mezioborová spolupráce se přímo nabízí. Celková léčba AD skýtá perspektivně řadu zajímavých léků z kategorie biologik i malých molekul, resp. cílených syntetických molekul, které jsou již zkoušeny v rámci klinických studií (viz tab. 3).
Tab. 3. Biologika a malé molekuly v léčbě atopické dermatitidy (2019) 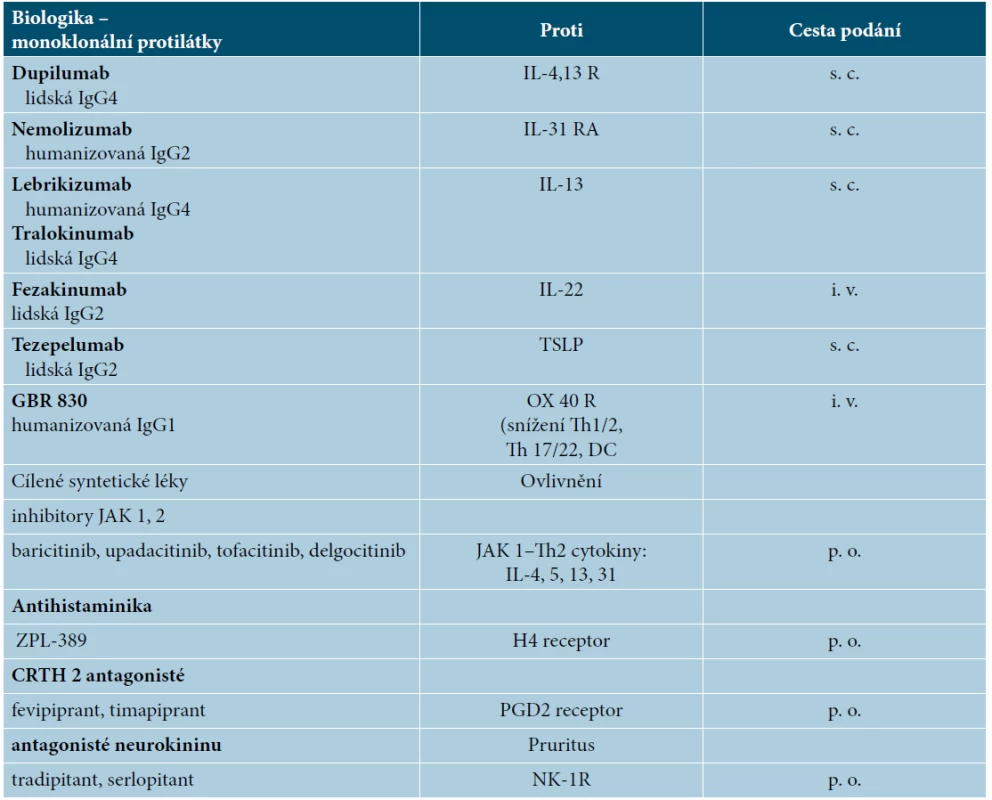
Legenda: IL – interleukin, R – receptor, JAK – janus kinázy, TSLP – thymický stromální lymfopoetin, DC – dendritické buňky, CRTH2 – receptor pro PGD2 (chemoattractant receptor homologous molecule expressed on Th2 lymphocytes), PGD2 – prostaglandin D2, NK-1R – receptor pro neurokinin 1 CELKOVÁ LÉČBA BIOLOGIKY
Biologika představují zcela novou skupinu v léčbě AD. Dermatologové již znají biologika přes 10 let, a to z léčby psoriázy, chronické urtikárie a maligního melanomu. Jedná se o biotechnologicky vyráběné léky, u AD cílí na zmírnění zánětu prostřednictvím snížení množství, aktivace či funkce imunitních buněk nebo cytokinů či relevantních protilátek [19]. Jedná se ale o naprosto odlišné skupiny, zaměřené na jiné cytokiny než u psoriázy (viz tab. 2), což souvisí s odlišnou etiopatogenezí AD.
Prvním biologikem uváděným do praxe je dupilumab. Je to plně lidská monoklonální protilátka proti alfa řetězci receptoru pro IL-4 a IL-13. Nejedná se tedy o imunosupresivum, ale spíše o lék modifikující chorobu (disease modyfying drug, DMD) [19]. Mechanismy účinku vycházejí z patologických dějů, které zvýšené hladiny IL-4 a 13 a imunitní reakce Th2 typu u AD způsobují. Dupilumab působí nejen protizánětlivě, ale z výsledků studií vyplývá, že normalizuje i poruchy bariéry a mikrobiomu [16]. Studie s dupilumabem probíhají i u dalších atopických chorob, jako jsou bronchiální astma, chronická rhinosinusitida s nazálními polypy a eozinofilní ezofagitida.
Dupilumab pod názvem Dupixent® byl v Evropě registrován již v roce 2017, v České republice v roce 2018. Indikací je léčba středně těžké až těžké AD u dospělých, kteří jsou vhodnými kandidáty na systémovou terapii [21]. Středně těžká až těžká AD je v současnosti konsenzuálně charakterizovaná prostřednictvím skóre IGA ≥ 3, EASI ≥16 a BSA ≥ 10 %. Dupilumab patří mezi léky první linie, který je v algoritmu volby celkového léku postavený na roveň cyklosporinu A. Kandidátem celkové terapie je pacient, kde lokální léčba kortikoidy anebo lokálními imunomodulátory, případně ani v kombinaci s fototerapií, nevede k dostatečnému efektu nebo není tolerována.
Úhrada ze zdravotního pojištění je podmíněna jako obvykle přísnějšími indikačními kritérii, než jsou v SPC léku: „Dupilumab je hrazen dospělým pacientům s těžkou formou atopické dermatitidy po selhání (nedostatečné účinnosti) alespoň jednoho ze způsobů konvenční systémové imunosupresivní terapie (s výjimkou kortikosteroidů) nebo u pacientů, kteří systémovou terapií nemohou být léčeni z důvodu intolerance nebo kontraindikace. Úspěšnost terapie se vyhodnotí po 16 a po 24 týdnech od zahájení léčby a dále nejméně každých 24 týdnů, a bude ukončena v těchto případech:
- nedosažení nejméně EASI-50 v týdnu 16,
- nedosažení nejméně EASI-75 v týdnu 24,
- v případě výskytu nezvládnutelných nežádoucích účinků,
- při nedostatečné adherenci k terapii,
- při poklesu účinnosti pod EASI-50 při dvou po sobě následujících kontrolách.“
Preskripce je vázána na centra biologické léčby a léčbu musí vést lékař zkušený v diagnostice a léčbě těžké AD. Každopádně je lékem volby v situaci, kdy léčba cyklosporinem A není účinná či tolerovaná nebo ji nelze použít z důvodů kontraindikací či lékových interakcí.
Před léčbou a v jejím průběhu nejsou podle současných údajů zapotřebí nějaká speciální laboratorní či jiná vyšetření. V praxi bude pochopitelně základní screening vhodný. V průběhu léčby se provádí klinické monitorování eventuálně nežádoucích účinků – viz dále.
Kontraindikacemi jsou alergie na účinnou látku, parazitární onemocnění (blokování signální dráhy IL-4/13 snižuje protiparazitání imunitní odpověď). Gravidita a laktace jsou relativními kontraindikacemi, studie na zvířatech sice nenaznačují reprodukční toxicitu, ale údaje o použití léku u těhotných a kojících žen jsou omezené [21].
Léčba se zahajuje jednou indukční dávkou 600 mg s. c. do dvou různých míst (1 amp = 300 mg) v oblasti břicha či stehna, při aplikaci jinou osobou i do paže. Pak následuje udržovací léčba dávkou 300 mg s. c. á 2 týdny. Dávka není závislá na věku, hmotnosti či funkci ledvin či jater. Nástup účinku lze pozorovat již za dva týdny, plný efekt se obvykle dostavuje v průběhu 12–16 týdnů a udržuje se u většiny pacientů s kontinuální léčbou i přes rok (drug survival). Neutralizační protilátky proti léku s dopadem na snížení účinnosti se podle studií vyskytují v méně jak 0,1 %. Velmi dobrá účinnost a i bezpečnost se prokázala řadou klinických studií. Účinnost vyjádřená v 75% zlepšení skóre EASI dosáhlo po 4 měsících 68,9 % pacientů, po 8 měsících 65,2 % pacientů. Zlepšení pruritu dosáhlo ve skóre NRS 56,6 % a 57 % pacientů. Zlepšení kvality života ve skóre DLQI o 4 a více bodů dosáhlo 81 % a 80 % pacientů (studie Chronos). Pro posouzení účinnosti je rozhodujícím momentem 16. týden léčby – pokud nenastane dostatečný účinek, nemá pokračování v léčbě velký smysl. Pacienti reagující částečným zlepšením se ale mohou při pokračování léčby ještě dále zlepšovat, jedná se o tzv. slow responders. Pohled na účinnost odpovídající reálné praxi poskytují výsledky studie Liberty AD Café – jednalo se o těžké pacienty, u kterých byla předchozí léčba cyklosporinem A neúčinná či netolerovaná pro nežádoucí účinky. Tito pacienti měli povolenou souběžnou lokální léčbu kortikoidy. Skóre EASI 75 dosáhlo v 16. týdnu 62,6 % pacientů léčených dupilumabem (300 mg s. c. á 2 týdny) oproti 29,6 % pacientů ve skupině placebo + lokální kortikoidy [21].
Lék je určen pro dlouhodobou kontinuální léčbu. V udržovací fázi se preferuje kontinuální léčba se stabilní dávkou; ekonomicky motivované modifikace ve smyslu snížení dávky či prodloužení intervalu aplikace nejsou vhodné – jedná se o velmi těžké pacienty, a tudíž dochází ke snížení kontroly nad chorobou, obvykle v průběhu osmi týdnů. Nejedná se však o rebound fenomén, ale relaps choroby. Po přerušení léčby pro nemoc, nežádoucí účinky atp. má znovuzahájení léčby („retreatment“) stejně dobrou účinnost jako předchozí léčba [21].
Při malé účinnosti či snížení účinnosti v průběhu léčby připadá teoreticky v úvahu kombinovaná léčba (především metotrexát), ale zatím je v tomto ohledu k dispozici málo údajů. Kombinovaná léčba s emoliencii a podle potřeby i lokálními kortikoidy či lokálními imunomodulátory je vhodná a prověřená.
Nežádoucí účinky pozorované ve studiích měly obdobnou incidenci jako u placeba, byly nezávažné povahy, mírné až střední intenzity. Nejčastěji se jedná o reakce v místě vpichu, podobně jako u ostatních, opakovaně podávaných s. c. léčiv. Dále jsou to konjunktivitida, blefaritida a herpes simplex v obličeji [16, 21].
Konjunktivitida (alergická, infekční, atopická anebo nespecifická) se zdá být pro AD do jisté míry příznačná (incidence ve studiích 5–28%). Dupilumab se totiž používá ve studiích i v léčbě jiných chorob, např. těžkého bronchiálního astmatu, a tam se konjunktivitida vyskytuje méně často než u AD. Mechanismus není znám, předpokládá se vliv blokace IL-13 na konjunktivální buňky, a tím i negativní změny ve složení slz. Před zahájením léčby se proto doporučuje cílená anamnéza na oční potíže a pak i oftalmologické vyšetření, pa-cienti musí být v tomto ohledu těsněji sledováni. Atopici s velmi těžkou AD, anamnézou předchozích konjunktivitid (a nízkými hladinami léku) mají totiž vyšší riziko jejich vzniku při léčbě dupilumabem než ostatní. K jejich zvládnutí se doporučuje lokální léčba kortikoidem ve formě očních kapek, optimálně 0,1% fluorometholonem (má nejlepší bezpečnostní profil), případně lokálním imunomodulátorem 0,03% takrolimem v oční masti (magistraliter) nebo lokálním imunosupresivem 1% cyklosporinem v očních kapkách (magistraliter) [20]. Uvažuje se i o preventivním používání umělých slz před léčbou a v jejím průběhu. Většina konjunktivitid je mírné až střední intenzity a není důvodem k ukončení léčby [21].
Očkování neživými či inaktivovanými vakcínami lze při léčbě dupilumabem provádět. Očkování živými vakcínami nebylo studováno, proto je v případech nutnosti podání živé vakcíny třeba zvážit poměr prospěchu k rizikům.
Dupilumab představuje slibný celkový lék pro léčbu těžkých případů AD. Má rychlý a výrazný nástup účinku, který přetrvává i při udržovací léčbě. Oproti dosavadním celkovým lékům umožňuje dlouhodobou kontrolu nad chorobou díky dobré účinnosti a bezpečnosti. Pro podrobnější poznání jeho dlouhodobého profilu účinnosti a bezpečnosti je zapotřebí dlouhodobějšího klinického sledování, studie s léčbou nad jeden rok probíhají. Reálná praxe ukáže, jaké vzácnější nežádoucí účinky se mohou objevit (např. u astmatu se v americkém SPC objevuje systémová eozinofilní granulomatóza s polyangitidou).
Zatím je dupilumab registrován pro léčbu dospělých. Studie u dětí a dospívajících (6–18 let), jakož i malých dětí (6 měsíců až 6 let) probíhají. V březnu 2019 oznámila americká FDA schválení dupilumabu ve věkové kategorii 12–17 let. Bezpečnostní profil se zatím zdá být stejně dobrý jako u dospělých [16].
ZÁVĚR
V celkové léčbě atopické dermatitidy se konečně objevují nové účinnější a především bezpečnější léky. Nástup biologik do celkové léčby atopické dermatitidy označuje řada autorů za revoluční, prvním biologikem uváděným do praxe je dupilumab. Základní i klinický výzkum přináší mnoho poznatků a nástup nových skupin léků je skutečně průlomový.
Vedlejším pozitivním efektem zavádění nových léků je i trend k revizi léků stávajících, především cyklosporinu A a metotrexátu. Klinická praxe ukáže, zda v úporných případech (nedostatečná účinnost, ztráta účinnosti v průběhu léčby) bude možno použít i kombinace konvenčních imunosupresiv s biologiky a dalšími novými léky, popř. jejich využití pro sekvenční strategie indukční a udržovací léčby.
Nejen zavádění nových léků, ale i jiné strategie, jako je identifikace klinických subtypů, fenotypů a endotypů atopické dermatitidy, povedou v budoucnu k lepším výsledkům léčby díky možnosti stratifikace a personalizace léčby. Také farmakogenomika by mohla zlepšit účinnost prostřednictvím predikce optimálního celkového léku pro konkrétního pacienta. A konečně i modulace kožního mikrobiomu či vývoj moderní generace protistafylokových vakcín představují potenciálně zcela novou éru v léčbě atopické dermatitidy.
Těžká atopická dermatitida je obtížná pro pacienta i jeho lékaře. I u celkové léčby je zásadní komplexnost v prevenci, léčbě a přístupu lékaře k pacientovi. Péče o kůži emoliencii, správné používání lokálních kortikoidů a imunomodulátorů (a výhledově dalších lokálních léčiv), prevence spouštěčů a adherence pacienta jsou a budou i u celkové léčby nadále významnými faktory pro dlouhodobý průběh choroby. Dlouhodobě účinná celková léčba má pak potenciál zasáhnout zásadnějším způsobem do zábrany vzniku či progrese atopického pochodu.
Zavádění biologik a malých molekul, revize stávajících imunosupresiv a i další pokrok jsou pro pacienty s těžkou atopickou dermatitidou příslibem – příslibem normalizace jejich života i života jejich blízkých.
Do redakce došlo dne 9. 8. 2019.
Adresa pro korespondenci:
MUDr. Nina Benáková, Ph.D.
Immunoflow s.r.o.,
Rychnovská 651
199 00 Praha 9
e-mail: nina.benakova@email.cz
Zdroje
1. BENÁKOVÁ, N. Atopická dermatitida v roce 2009. Čs Derm, 2009, 84(2), p. 65–68.
2. BENÁKOVÁ, N. Terapeutická edukace. Čs Derm, 2015, 90(1), p. 4–10.
3. EICHENFELD, L. F., AHLUWALIA, J., WALDMANN, A. et al. Current guidelines for the evaluation and management of atopic dermatitis: a comparison of the Joint Task Force practice parameter and American Academy of Dermatology guidelines. JAACI, 2017, 139(4), p. 49–57.
4. ELMARIAH, S. B., LERNER, E. A. The missing link between itch and inflammation in atopic dermatitis. Cell, 2013, 155(2), p. 267–269.
5. GARRITSEN, F. M., van den HEUVEL, J. M., BRUINZEEL-KOOMEN, C. A. F. M. et al. Use of oral immunosuppressive drugs in the treatment of AD in Netherlands. JEADV, 2018, 32(8), p. 1336–1342.
6. GERBENS, L. A. A., HAMANN, S. A. S., BROUWER, M.W.D. et al. Methotrexate and azathioprin for severe atopic dermatitis. Br J Dermatol, 2018, 178(6), p. 1288–1296.
7. GOUJON, C., VIGUIER, M., STAUMONT-SALLÉ, D. et al. Methotrexate versus cyclosporine A in adults with moderate-to-severe atopic dermatitis: a phase III randomized noninferiority trial. J Allergy Clin Immunol Pract, 2018, 6(2), p. 562–589.
8. CHOPRA, R.,VAKHARIA, P. P., SIMPSON, E.L. et al. Severity assessment for inclusion criteria and baseline severity evaluation of atopic dermatitis clinical trials: a systematic review. JEADV, 2017, 31(11), p. 1890–1899.
9. IRVINE, A. D., BEATTLE, J. P., BARON, S. et al. A randomized controlled trial protokol assesing the effectiveness, safety and cost-effectiveness of methotrexate vs. ciclosporin in the treatment of severe atopic eczema in children. Br J Dermatol, 2018, 179(6), p. 1297–1306.
10. LAW PING MAN, S., BOUZILLÉ, G., BENETON, N. et al. Drug survival and postdrug survival of first line immunosuppressive treatments for atopic dermatitis: comparison between methotrexate and cyclosporine. JEADV, 2018, 32(8), p. 1327–1335.
11. PALER, A.S., JAWORSKI, J. C., SIMPSON, E. L. et al. Major comorbidities of atopic dermatitis: beyond allergic disorders. Am J Clin Dermatol, 2018, 19(6), p. 821–838.
12. PALER, A. S., KONG, H. H., SEED, P. et al. The microbiome in patients with atopic dermatitis. JAACI, 2019, 143(1), p. 26–35.
13. ROEKEVISCH, E., SPULS, P. I., KUESTER, D. et al. Efficacy and safety of systemic treatments for moderate-to-severe atopic dermatitis: a systematic review. J Allergy Clin Immunol, 2014, 133(2), p. 429–438.
14. SHAFT, van der, J., POLITIEK, K., REEK van den, JMPA. et al. Drug survival for ciclosporin A in a long--term daily practice cohort of adult patients with atopic dermatitis. Br J Dermatol, 2015,172(6), p. 1621–1627.
15. SIMPSON, E. L. et al. When does AD warrant systemic therapy ? JAAD, 2017, 77(4), p. 623–633.
16. VANGIPURAM, R., TYRING, S.K. Dupilumab for Moderate-to-Severe Atopic Dermatitis. Skin Therapy Letter, 2017, 22(6), p. 1–4.
17. WEIDINGER, S., NOVAK, N. Atopic Dermatitis. Lancet, 2016, 387(1023), p. 1109–1122.
18. WOLLENBERG, A. BARBAROT, S., BIEBER, T. et al. Consensus-based European guidelines for treatment of atopic eczema (dermatitis) in adults and children: part I. JEADV, 2018, 32(5), p. 657–682.
19. WOLLENBERG, A., BARBAROT, S., BIEBER, T. et al. Consensus-based European guidelines for treatment of atopic eczema (dermatitis) in adults and children: part II. JEADV, 2018, 32(5), p. 850–878.
20. WOLLENBERG, A. et al. Conjunctivitis occurring in atopic dermatitis patients treated with dupilumab – clinical characteristics and treatment. J Allergy Clin Immunol Pract, 2018, 6(5), p. 1778–1780.
21. Souhrn údajů o léku (SPC) Dupixent. Dostupné na www: www.sukl.cz.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2019 Číslo 6- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
-
Všechny články tohoto čísla
- Celková léčba atopické dermatitidy – evropské doporučené postupy a současný stav
- Kontrolní test
- Morbus Dowling-Degos a morbus Galli-Galli. Popis případu
- Růžová papula na lýtku
- Spitzoidní nádory – diagnosticky obtížné situace. Série případů
- Svědění konečníku
- Zápis ze schůze výboru Praha 12. 9. 2019
- Co zaznělo na 13. konferenci Akné a obličejové dermatózy
-
Některé poznatky z 28. kongresu Evropské akademie dermatovenerologie (EADV)
Madrid 9.–12. 10. 2019 - Odborné akce 2020
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Svědění konečníku
- Spitzoidní nádory – diagnosticky obtížné situace. Série případů
- Celková léčba atopické dermatitidy – evropské doporučené postupy a současný stav
- Růžová papula na lýtku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



