-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDoporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu nealkoholové tukové choroby jater
Autoři: Brůha R. 1; Dvořák K. 2; Tomáš Fejfar 3
; Šmíd V. 1; Pavel Trunečka 4
Působiště autorů: IV. interní klinika – klinika gastroenterologie a hepatologie 1. LF UK a VFN v Praze 1; Oddělení gastroenterologie a hepatologie, Krajská nemocnice Liberec a. s., Nemocnice Liberec 2; II. interní gastroenterologická klinika LF UK a FN Hradec Králové 3; Transplantcentrum, IKEM, Praha 4
Vyšlo v časopise: Gastroent Hepatol 2020; 74(2): 103-110
Kategorie: Hepatologie: doporučené postupy
doi: https://doi.org/10.14735/amgh2020103Nealkoholová tuková choroba jater (NAFLD – non-alcoholic fatty liver disease) zahrnuje spektrum patologických stavů od prosté jaterní steatózy přes nealkoholovou steatohepatitidu (NASH), různý stupeň fibrózy až po jaterní cirhózu se všemi jejími komplikacemi vč. portální hypertenze a hepatocelulárního karcinomu [1]. NAFLD se dnes považuje za jaterní manifestaci metabolického syndromu.
Definice
Onemocnění NAFLD je definováno přítomností jaterní steatózy (zjištěné zobrazovacími metodami nebo histologicky) a vyloučením jiných příčin sekundární akumulace tuku v játrech, jako jsou nadměrná konzumace alkoholu, užívání určitých léků či vrozené metabolické choroby [2]. U většiny pacientů souvisí NAFLD s výskytem metabolického syndromu (tab. 1) či jeho jednotlivých komponent (centrální obezita, diabetes mellitus 2. typu (DM2), dyslipidemie a arteriální hypertenze). NAFLD lze rozdělit podle histologického nálezu na prostou steatózu (tukové inkluze ve > 5 % hepatocytů při histologickém vyšetření) a NASH (kromě steatózy jsou přítomny zánětlivé změny a známky poškození hepatocytů – balonová degenerace hepatocytů – a dále může, ale nemusí být přítomna zánětlivá infiltrace a jaterní fibróza). Ve fázi cirhózy může tuk z hepatocytů postupně mizet (tzv. vyhaslý NASH) a diagnóza je pak postavena na anamnestických údajích a klinických souvislostech.
Tab. 1. Diagnostická kritéria metabolického syndromu (nutná tři kritéria z následujících pěti).
Tab. 1. Diagnostic criteria of metabolic syndrome (three criteria out of five required).
Existuje mnoho defi nic metabolického syndromu; současné klinické praxi se nejvíce blíží defi nice založená na konsenzu mezinárodních společností z roku 2009 [89]. Diagnóza metabolického syndromu je daná přítomnosti libovolných tři z uvedených pěti podmínek. Epidemiologie
Dnes nejčastějším chronickým jaterním onemocněním ve vyspělých zemích s prevalencí mezi 17 a 46 % v dospělé populaci je NAFLD [3]. Jeho prevalence v evropské populaci se pohybuje okolo 25 %. Předpokládaná incidence NAFLD v západních zemích je 28 na 1 tisíc obyvatel/ rok [4]. Výskyt NAFLD těsně souvisí s výskytem obezity (především viscerálního typu) a DM2. U pacientů s těžkou obezitou se NAFLD vyskytuje ve > 80 % [5], u pacientů s DM2 až v 75 % [6]. Určit přesnou prevalenci NASH je obtížnější, neboť její přesná diagnóza je možná pouze histologicky. Předpokládaná prevalence NASH v evropské populaci je pravděpodobně mezi 1,5 a 6,5 % [7]. Asi jedna čtvrtina pacientů s NASH má v době diagnózy pokročilou fibrózu a 10–15 % má již cirhózu. Cirhóza, dříve označovaná jako kryptogenní, souvisí z větší části právě s NASH. Cirhóza na podkladě NASH je dnes druhou až třetí nejčastější indikací k transplantaci jater (LTx – liver transplantation). Prevalence ani incidence NAFLD/ NASH v ČR není známa, k dispozici jsou dosud jen data z jednoho pracoviště, kde u nemocných s DM2 byla přítomnost NAFLD popsána u 79 % a přítomnost ultrasonografických známek fibrózy či cirhózy u 13 % pacientů s DM2 [6].
Vývoj NAFLD a vztah k jiným chorobám
Patofyziologický mechanizmus vedoucí ke vzniku NAFLD a k následující progresi do NASH je multifaktoriální. Účastní se ho genetické a epigenetické faktory, faktory zevního prostředí, vysoký kalorický příjem, nevhodné složení stravy a nízká fyzická aktivita. Základním mechanizmem spojujícím metabolický syndrom a NAFLD je nepoměr mezi příjmem a výdejem energie vedoucí k akumulaci tuku nejen v tukové tkáni, ale i v orgánech, které k tomu nejsou určeny (játra, svaly, omentum, pankreas). NAFLD lze považovat za multisystémové onemocnění, které se většinou nevyskytuje samostatně, ale provází další chorobné stavy. Přítomnost NAFLD je nezávislým rizikovým faktorem vzniku DM2 [8]. U jedinců s již přítomným DM2 je NAFLD významným rizikovým faktorem pro hospitalizace i úmrtí z jaterních příčin [9] a pravděpodobně zvyšuje riziko vzniku mimojaterních nádorů – např. neoplazií kolorekta 1,87–3,08× [10]. NASH zvyšuje riziko mortality na jaterní choroby 10× [11], mortality na kardiovaskulární onemocnění 2,1×, celkové mortality 2,3× [12].
Dostupná data ukazují, že zlepšení jaterní steatózy u pacientů s NAFLD snižuje riziko vzniku DM2 [13]. NAFLD je též spjato se zvýšeným rizikem kardiovaskulárních onemocnění [14]. Není však zřejmé, zda zlepšení jaterní steatózy sníží též následné riziko kardiovaskulárních onemocnění, i když některá data ukazují, že snížení kardiovaskulárního rizika při léčbě statiny je výraznější u těch pacientů, kteří vstupně měli vyšší jaterní testy, a tím pravděpodobně i NAFLD [15,16].
Prostá jaterní steatóza představuje menší riziko budoucích jaterních komplikací [17]. Riziko pro vznik fibrózy a vývoj do cirhózy je spjato především s přítomností NASH [11]. Vývoj do fáze cirhózy většinou trvá více desetiletí. U pacientů s NASH dojde ke zhoršení fibrózy o 1 stupeň za 7 let, u pacientů s NAFLD bez známek NASH je interval změny fibrózy o 1 stupeň 14 let a delší. Mezi rizikové faktory pro vznik NASH a rychlou progresi fibrózy patří především věk > 50 let, obezita, inzulínová rezistence, DM2, arteriální hypertenze, zvýšená hladina feritinu a především genetické vlivy. Na základě celogenomových asociačních studií bylo detekováno několik kandidátních genů, jejichž určité varianty jsou spjaty s rizikem vzniku NAFLD, NASH, fibrózy a progrese do cirhózy [18], nebo mají naopak protektivní vliv [19]. Z pohledu rizika vývoje NAFLD hraje největší roli gen PNPLA3, jehož varianta rs738409 C>G p.I148M je nejsilnějším genetickým faktorem spjatým s rizikem NAFLD [20]. Dalšími geny, jejichž určité varianty se mohou podílet na vývoji NAFLD, jsou: TM6SF2 (rs58542926 C>T p.E167K), MBOAT7 (rs641738 C>T) a GCKR (rs1260326 C>T p.446L) [21,22]. Z výsledků celogenomových asociačních studií také vyplývá, že geneticky podložené riziko vzniku a nepříznivého vývoje NAFLD není stejné pro celou populaci, ale je významně potencováno přítomností obezity [23]. Interakce mezi genetickou dispozicí a přítomností dalších rizikových faktorů, jako je obezita, tak nejspíše hraje zásadní roli ve vývoji NAFLD.
Screening NAFLD v rizikových skupinách
Společný dokument Evropské asociace pro studium jater (EASL), Evropské asociace pro studium diabetu (EASD) a Evropské asociace pro studium obezity (EASO) z roku 2016 [1] obsahuje doporučení provádět screening NAFLD u pacientů s metabolickými riziky, tj. s DM2 a/ nebo obezitou (obr. 1). Tento postup se však dosud neopírá o data, která by prokazovala nákladovou efektivitu takového přístupu. Tuto skutečnost konstatuje nejnovější doporučený postup Americké asociace pro studium jaterních chorob (AASLD) [2].
Obr. 1. Screening NAFLD/NASH u pacientů s metabolickými rizikovými faktory.
Fig. 1. Screening of NAFLD/NASH in patients with metabolic risk factors.
NAFLD – nealkoholová tuková choroba jater, ALT – alaninaminotransferáza, AST – aspartátaminotransferáza, GGT – gammaglutamyltransferáza, NASH – nealkoholová steatohepatitida Naopak platí, že všichni pacienti s NAFLD (i náhodně zjištěnou) musí být vyšetřeni z pohledu rizika diabetu, dyslipidemie, arteriální hypertenze a kardiovaskulárních onemocnění.
V případě screeningu NAFLD v rizikových skupinách by mělo být provedeno ultrazvukové vyšetření jater. Vyšetření jaterních aminotransferáz není v detekci NAFLD postačující. V případě nedostupnosti ultrazvukového vyšetření jsou alternativou v detekci steatózy různé indexy či sérové markery (např. fatty liver index (FLI)). V případě zjištění steatózy by pak měla být provedena některá z metod hodnotících fibrózu (jaterní elastografie, NAFLD Fibrosis Score, ELF test aj.).
Diagnóza
Diagnóza NAFLD vyžaduje vyloučení jiných možných příčin jaterního postižení – především požívání nadměrného množství alkoholu (za nadměrné množství alkoholu se považuje > 140 g/ týden u žen a 210 g/ týden u mužů), chronických virových hepatitid B a C, autoimunitního postižení, polékového poškození a metabolických chorob (Wilsonova choroba, hemochromatóza, porfyrie, deficit α1-antitrypsinu).
Nejvýznamnějším klinickým projevem NAFLD je únava, která může být výrazná (podobná únavě pacientů u primární biliární cholangitidy) a nemusí souviset s aktivitou onemocnění. Dalším běžným příznakem bývá tlak v pravém podžebří. Až u poloviny pacientů je NAFLD klinicky němá a diagnostikuje se na základně náhodně zjištěné elevace aminotransferáz nebo sonografického nálezu. U většiny pacientů je diagnostikována v 5. nebo 6. dekádě života, ale lze ji dnes nalézt i u mladých osob a u dětí. Při fyzikálním vyšetření má asi 75 % pacientů s NAFLD hepatomegalii, jinak ve fyzikálním nálezu většinou dominují příznaky komorbidit (obezita, hypertenze). Vždy je třeba posoudit základní antropometrii, tj. alespoň stanovit body mass index (BMI) a změřit obvod pasu.
V laboratorním vyšetření lze nalézt vyšší hodnoty aminotransferáz, ale je prokázáno, že až polovina pacientů ve všech stadiích NAFLD/ NASH vč. pokročilé fibrózy a cirhózy může mít jaterní testy zcela normální či kolísající kolem normy. Pokud je elevace aminotransferáz přítomna, pak je alaninaminotransferáza (ALT) obvykle vyšší než aspartátaminotransferáza (AST) a typická je též elevace gammaglutamyltransferázy (GGT), která může být výrazná.
Diagnóza jednotlivých vývojových fází NAFLD je založená na výsledcích zobrazovacích vyšetření či různých indexech zahrnujících laboratorní a klinické parametry.
Nejběžnější diagnostickou metodou steatózy jater je ultrazvukové vyšetření [24], přesnější kvantifikaci jaterní steatózy lze získat pomocí metody CAP (controlled attenuation parameter) implementované do přístroje FibroScan®. Zlatým standardem v neinvazivním hodnocení steatózy je magnetická rezonanční spektroskopie, která umožňuje přesnou kvantifikaci obsahu tuku v játrech. Přítomnost jaterní steatózy lze posoudit také výpočtem tzv. FLI, který zahrnuje hmotnost, výšku, obvod pasu pacienta a sérové hodnoty GGT a triglyceridů (TAG) [25]. Význam tohoto indexu může být především ve screeningu steatózy v rizikových skupinách pacientů.
Diagnóza NASH je naopak možná pouze na základě jaterní biopsie (tab. 2), i když se v poslední době objevují neinvazivní vyšetření (sérové markery), které by mohly biopsii nahradit. Pro histologické hodnocení NASH se používá histologické skóre NAS (NAFLD activity score) [26] založené na původním hodnocení histologického nálezu dle autorů Kleiner et al [27].
Tab. 2. Histologické hodnocení NASH podle NASH CRN.
Tab. 2. NASH histological evaluation according to NASH CRN.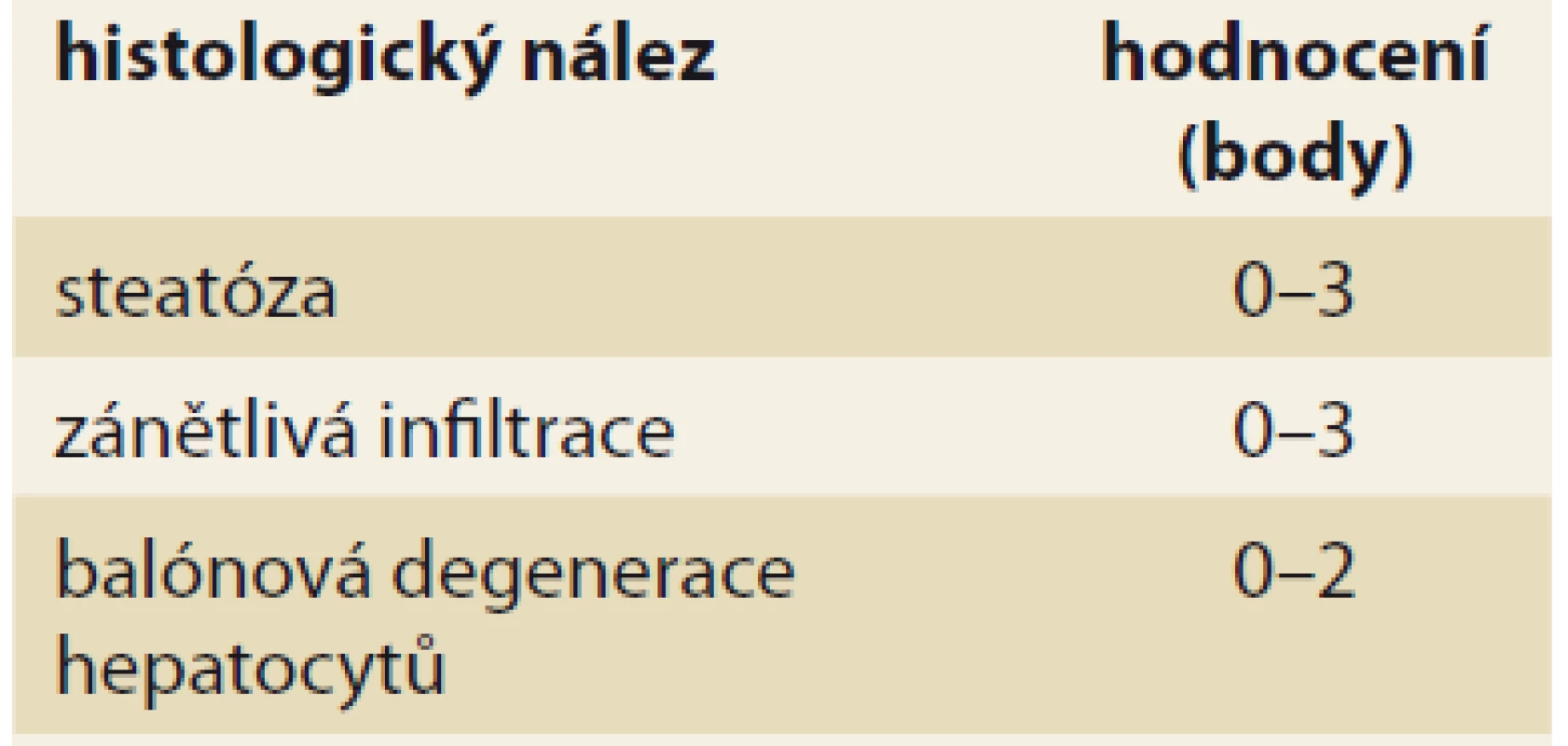
Maximální počet bodů je 8; diagnóza NASH vyžaduje ≥ 4 body a z toho nejméně 1 bod za balónovou degeneraci hepatocytů [26].
NASH – nealkoholová steatohepatitida, NASH CRN – nonalcoholic steatohepatitis clinical research networkStupeň fibrózy lze v dnešní době hodnotit pomocí neinvazivních vyšetření. Nejvíce zkušeností je s využitím metod založených na ultrazvukovém měření tuhosti jaterní tkáně (FibroScan®, pSWE, 2D-SWE). Lze též využít některé indexy hodnotící buď kombinaci nespecifických parametrů souvisejících s přítomností jaterní fibrózy, či přímo parametry účastnící se procesu fibrotizace [28]. Z veřejně dostupných vzorců jsou to např. NAFLD Fibrosis Score [29,30] nebo FIB-4 [31]. Ideální využití těchto vyšetření může být ve screeningu pokročilé fibrózy u osob s rizikovými metabolickými faktory. Z komerčně dostupných testů lze využít např. ELF skóre [32], Fibrotest® aj.
Jaterní biopsie by u pacientů s NAFLD měla být provedena za těchto situací:
- pokud není diagnóza jistá a zvažuje se i jiné jaterní onemocnění (jako např. autoimunitní hepatitida nebo metabolické onemocnění jater);
- u pacientů, u kterých histologická diagnóza NASH změní léčebný postup (např. agresivní léčba obezity/ bariatrická chirurgie nebo farmakoterapie u pacientů s fibrózou diagnostikovanou neinvazivními postupy);
- pokud je podezření na pokročilou fibrózu či počínající cirhózu a výsledky neinvazivních vyšetření jsou nejednoznačné;
- u pacientů, kteří nemají metabolický syndrom a diagnóza NAFLD se zvažuje.
Léčba
Léčba NAFLD zahrnuje:
- identifikaci pacientů indikovaných k léčbě;
- vlastní léčebná opatření realizovaná hepatologem.
Pacienti s prostou steatózou nevyžadují dle současných názorů [1,2] žádnou léčbu cílenou na játra a měli by být důsledně léčeni z pohledu přidružených chorob patřících většinou k metabolickému syndromu: diabetu, hypertenze, dyslipidemie a především obezity. Základním opatřením u takových pacientů je změna dietních návyků a změna životního stylu.
K léčbě cílené na játra by měli být dle doporučení EASL [1] i AASLD [2] indikováni pacienti s histologicky prokázaným NASH a současně přítomnou fibrózou druhého či vyššího stupně nebo s mírnou fibrózou a vysokým rizikem její progrese (vyšší věk, přítomnost diabetu, metabolického syndromu, zvýšená aktivita ALT, vysoká nekroinflamatorní aktivita při histologickém vyšetření).
Dosud nejvýznamnější a nejúčinnější terapeutickou metodou NAFLD je komplexní změna životního stylu. Zahrnuje tři základní kroky:
- dietní opatření;
- zvýšenou fyzickou aktivitu;
- celkovou změnu přístupu k životu (behaviorální změny).
Hlavní dietní opatření představuje změna složení stravy ve prospěch zavedení tzv. středomořské diety se všemi jejími aspekty – nízkým celkovým obsahem tuků, vysokým podílem polynenasycených mastných kyselin (především omega-3), dostatkem zeleniny, vlákniny atd. [33,34]. Současně tato dieta obsahuje minimální podíl průmyslově upravených látek, především tuků a cukrů (AGE – advanced glycation end products). AGE jsou spojovány s rozvojem diabetu i jiných metabolických (civilizačních) chorob [35]. Stejně tak někteří autoři připisují význam prostředí, v němž je tato dieta konzumována (typicky společný delší oběd/ večeře v klidném, nejlépe rodinném prostředí u jednoho stolu). Pozitivní vliv složení středomořské diety lze pozorovat, i pokud pacient neakceptuje celkovou kalorickou restrikci, která je pro tuto dietu typická. Velmi podstatný a často mylně podceňovaný význam mají cukry (glukóza, fruktóza, sacharóza atd.), nejčastěji přidávané do cukrovinek a slazených či ovocných nápojů. Existuje přímý vztah mezi konzumací těchto látek a rozvojem NAFLD [36,37], kdy jejich negativní dopad bývá umocněn především při vysokém celkovém energetickém příjmu jedince. Význam má také časová distribuce stravy během dne vč. „mlsání“ (příjmu vysoce kalorických pokrmů mimo hlavní jídla), které je jednoznačně asociováno s rozvojem NAFLD [38]. Často bývá diskutována otázka konzumace kávy. Je nejspíše spojena s nižším rizikem vzniku metabolického syndromu, redukcí oxidačního stresu a dle některých studií také míry ztukovatění jater nebo nižším rizikem vzniku hepatocelulárního karcinomu (HCC – hepatocelular carcinoma) [39]. Nicméně jasné doporučení ke konzumaci kávy lze dát pouze s jistou dávkou opatrnosti. Velmi diskutován je význam alkoholu ve vývoji NAFLD. Existují studie prokazující prospěšný vliv střídmé konzumace alkoholu na vývoj NAFLD. Tato data se však týkají pouze velmi mírné konzumace vína (< 10 g alkoholu/ den), nikoli ostatních alkoholických nápojů [40], a konzumaci alkoholu bychom pacientům s NAFLD doporučovat neměli. V pokročilých fázích NAFLD je navíc konzumace alkoholu jednoznačně škodlivá [41]. Otázku příjmu dalších mikronutrientů (vč. vitaminů, antioxidantů a dalších látek) lze zahrnout do doporučení dostatečného příjmu zeleniny a ovoce při adekvátním celkovém energetickém příjmu. Vliv vitaminu E je diskutován níže.
Asociace mezi vznikem NAFLD a nízkou fyzickou aktivitou je jednoznačně prokázána [42,43]. Cvičení ve smyslu plánované a systematicky prováděné fyzické aktivity je jedním ze základních bodů terapie NAFLD. Z výsledků četných studií vyplývá, že nezáleží na druhu pohybu (aerobní pohyb, posilování atd.), stejně jako není nejdůležitější samotná redukce tělesné hmotnosti [44]. Již prostý nárůst fyzické aktivity bez poklesu BMI vede k redukci tuku v játrech o 20–30 %. Za dostatečnou míru fyzické aktivity bývá považováno cca 200–300 min týdně. Již 3 a více hod sezení během dne je asociováno s vyšší mortalitou [45] i bez ohledu na míru fyzické aktivity, a to ve vztahu k rozvoji metabolického syndromu, obezitě a DM2. Za významný faktor je považována nejen celková doba sezení, ale také počet a frekvence přestávek. Jejich zvýšený počet pozitivně ovlivňuje metabolizmus glukózy, TAG a dalších parametrů [46]. Sedavý způsob života je navíc asociován se sklonem k příjmu nevhodné stravy a k mlsání [38].
Podaří-li se nastolit výše uvedené změny životního stylu, vedou tato komplexní opatření již během 2–6 měsíců k prokazatelnému zlepšení jaterních testů (ALT, AST, GGT), k redukci koncentrace TAG v játrech, ke zlepšení parametrů metabolizmu cukrů (lačná glykemie, inzulinová senzitivita) [47,48] a významnému zlepšení mikroskopických známek NAFLD/ NASH (steatóza, zánět, balonová degenerace hepatocytů, fibróza) [49]. Pozitivní efekt těchto opatření prokazují také studie zabývající se jejich příznivým vlivem na obezitu, kardiovaskulární rizika a mimojaterní malignity [50]. Pokud dojde k přerušení cvičení, pozitivní dopady se ztrácejí. V klinických studiích se požadovaného snížení hmotnosti o 7 % podaří dosáhnout asi polovině jedinců, v běžné klinické praxi budou výsledky pravděpodobně horší.
Máme-li efekt snížení tělesné hmotnosti kvantifikovat, setkáváme se nejčastěji se dvěma „milníky“:
- redukce o cca 5 % vede ke zlepšení jaterní steatózy, poklesu aminotransferáz a dalších biochemických parametrů (TAG, glykemie, glykovaný hemoglobin) [51];
- redukce o > 10 % přináší také zlepšení histologického nálezu vč. fibrózy [52,53].
Současná doporučení tak proto uvádějí jako cíl redukci tělesné hmotnosti o 7–10 % [1]. Rizikové skupiny pacientů s NAFLD – tedy jedinci s DM2 a obezitou (BMI > 35) – by měly k dosažení nejlepšího možného výsledku redukovat svou hmotnost min. o 10 %. Jakým způsobem bude redukce hmotnosti dosaženo, není podstatné (vč. bariatrické chirurgie, farmakologické léčby obezity atd.). Bylo prokázáno, že redukce hmotnosti po bariatrickém zákroku vede ke zlepšení parametrů NAFLD vč. známek NASH i fibrózy [54]. Efekt na zlepšení zánětlivých změn byl patrný i po 5 letech od výkonu, dlouhodobé zlepšení fibrózy však prokázáno nebylo [55].
Při snaze o zavedení režimových opatření u pacientů s NAFLD je zapotřebí počítat s faktem, že tito jedinci hůře přijímají a dodržují principy tzv. zdravého životního stylu a mají nižší motivaci si tyto principy osvojit. Nejúčinnější je péče v rámci multidisciplinární týmu, kdy je pacient sledován lékařem, nutričním terapeutem, psychologem a instruktorem cvičení či fyzioterapeutem. Tento postup je však v klinické praxi obtížně dosažitelný a jako nejdůležitější opatření se jeví pravidelný a relativně častý kontakt s ošetřujícím lékařem. Ten zvyšuje šanci na udržení nastolených dietních i pohybových změn. Výhodou je zkušenost lékaře s behaviorální terapií.
Velkým problémem (přesahujícím rámec doporučení) je pak výskyt NAFLD v dětském věku. Implementace výše uvedených doporučení by měla směřovat také do pediatrické populace, kde musí být zaštítěna příslušnými institucemi a směřována k prevenci.
Cílem farmakoterapie, stejně jako režimových a dietních opatření, je ovlivnit zejména zánětlivé změny poškozující hepatocyty a zabránit vzniku a progresi jaterní fibrózy.
V současné době neexistuje žádný preparát určený přímo pro léčbu NASH. Velmi důležitou součástí péče o nemocné s NASH je tedy správná terapie jednotlivých komponent metabolického syndromu.
U nemocných s arteriální hypertenzí, při zohlednění dalších indikací a kontraindikací, je vhodnou volbou léčba AT1 antagonisty (telmisartan, irbesartan), pro které existují data prokazující pozitivní ovlivnění také dalších složek metabolického syndromu [56] i snížení rizika jaterní fibrózy [57,58].
Léčba dyslipidemie se řídí platnými doporučeními [59]. Použití statinů jako léků první linie je u této skupiny nemocných i při vyšší aktivitě aminotransferáz bezpečné [1,2]. V některých studiích byl navíc prokázán jejich pozitivní efekt na snížení jaterních testů [15]. V případě významné elevace triacylglycerolů jsou možnou léčbou do kombinace fibráty, které jako PPARα agonisté také zřejmě pozitivně ovlivňují i další složky metabolického syndromu.
O cílené farmakologické léčbě NASH bychom měli uvažovat u pacientů, kteří jsou ve vyšším riziku progrese jaterního onemocnění (DM2, metabolický syndrom, trvale zvýšená hodnota ALT, vysoká aktivita zánětu v histologii) nebo mají již významnou jaterní fibrózu (≥ F2) a současně mají histologicky ověřenou diagnózu NASH [1,2]. Na základě známých patofyziologických mechanizmů může být cílem léčby zlepšení inzulinové senzitivity s úpravou narušené regulace tukového a glycidového metabolizmu, přímé ovlivnění metabolizmu hepatocytu, zánětlivých procesů i přímé působení na jaterní fibroprodukci. V posledních letech proběhly a probíhají studie s řadou léčiv cílících na tyto patofyziologické mechanizmy. Patří mezi ně zejména léky ze skupiny PPAR agonistů, inkretiny, FXR agonisté, antioxidanty, inhibitory lipogeneze, imunomodulační léky, modulátory střevního mikrobiomu a farmaka přímo ovlivňující jaterní fibrogenezi.
Podle současných dat mohou mít pacienti s histologicky ověřenou diagnózou NASH [1,2] prospěch z podávání dvou léků: PPARγ agonisty pioglitazonu nebo vitaminu E (RRR-α-tokoferol) [1,2,60,61]. Oba preparáty byly hodnoceny v několika randomizovaných studiích. Nejvýznamnější data pocházejí z multicentrické mezinárodní studie s > 240 pacienty s názvem PIVENS [62], srovnávající vliv pioglitazonu (30 mg/ den), vitaminu E(800 IU/ den) a placeba na histologické i laboratorní změny u nemocných s NASH bez diabetu. Vitamin E vedl ve srovnání s placebem ke zlepšení histologických změn steatohepatidy (primární cíl studie, 43 vs. 19 %). Pioglitazon ve srovnání s placebem vedl ke snížení steatózy i zánětlivých změn v jaterní biopsii (34 vs. 19 %) a ke snížení inzulinové rezistence. Příznivý vliv pioglitazonu na jaterní histologii u pacientů s NASH byl prokázán i u diabetiků [63]. Naproti tomu data o pozitivním efektu vitaminu E u nemocných s NASH a DM v současné době chybí, a proto podávání vitaminu E u této skupiny nemocných doporučit nelze [1,2].
Oba léky mají i svá rizika a případná léčba pioglitazonem, vitaminem E nebo kombinací by měla být individuálně zvážena u pacientů, kteří jsou nejvíce ohroženi vznikem cirhózy. U nemocných léčených pioglitazonem lze jako negativní efekt očekávat mírný vzestup hmotnosti [1,2,26]. U žen byl v souvislosti s dlouhodobou léčbou pioglitazonem pozorován i zvýšený výskyt osteoporózy [64]. V případě léčby je proto doporučeno sledování kostního metabolizmu. Naproti tomu někdy zmiňovaný vyšší výskyt karcinomu močového měchýře ve větších populačních studiích jednoznačně potvrzen nebyl [2,65]. Podávání pioglitazonu v léčbě NASH je v současné době léčbou mimo indikační kritéria v souhrnném údaji o léčivém přípravku (off-label), se všemi administrativními důsledky.
U mužů léčených vysokými dávkami vitaminu E (400 IU) déle než 5 let je uváděno mírně zvýšené riziko vzniku karcinomu prostaty (HR 1,17; 99% CI 1,004–1,36) [66]. Na míru rizika má vliv ale i genetická variabilita v metabolizmu vitaminu E a selenu [67]. U mužů nad 50 let je třeba tato data při zvažování dlouhodobé léčby zohlednit.
Obecně platí, že v případě zahájení léčby jedním i druhým preparátem nebo kombinací je nutné efekt léčby do 6 měsíců zhodnotit a neefektivní léčbu, která nevede ke snížení aktivity aminotransferáz, s ohledem k možným nežádoucím účinkům případně včas ukončit. U žádného jiného běžně dostupného preparátu nebyl dosud dostatečně prokázán efekt na zlepšení histologických změn v játrech. Existují studie ukazující efekt již zmíněných statinů na snížení jaterních testů, efekt PUFA (polyunsaturated fatty acids) na snížení obsahu tuku v játrech či zlepšení jaterních testů. Výsledky podávání kyseliny ursodeoxycholové u pacientů s NASH jsou zatím nejednoznačné [1,2].
Ve fázi klinických hodnocení je řada zcela nových preparátů. Ve fázi III klinického zkoušení je nyní agonista FXR receptoru – kyselina obeticholová. Tento preparát v klinické studii fáze IIb (studie FLINT) při podávání po dobu 72 týdnů vedl k signifikantnímu snížení zánětlivých změn i jaterní fibrózy [68]. Ve fázi III je i duální PPAR α/ δ agonista elafibranor (GFT 505), který též v předchozích studiích prokázal efekt na snížení zánětu bez zhoršení jaterní fibrózy [69], stejně jako GLP-1 agonista liraglutid, ASK-1 inhibitor selonsertib a cenicriviroc ovlivňující zánětlivou kaskádu blokádou CCR2/ CCR5 receptorů. Dalšími zkoušenými látkami jsou i nová molekula s antioxidačním působením metadoxin, dále LOXL-2 protilátky, mezi něž patří simtuzamab, a v diabetologii známé a používané DPP-IV inhibitory, kam patří např. sitagliptin.
Výsledky těchto studií budou známy v letech 2019–2021 a lze očekávat, že alespoň některé z nich se postupně zařadí do klinické praxe [70]. V současné době nelze ale žádný z těchto preparátů pro farmakoterapii doporučit ani v off-label podání.
Při zvažování léčby je třeba vzít v úvahu i přirozený vývoj NASH. V průběhu 5letého sledování může dojít cca u 20 % pacientů k regresi fibrózy, zatímco téměř u 40 % pacientů dojde k progresi fibrotických změn. Nejdůležitějším faktorem, který je spjat s ústupem fibrotických změn, je redukce hmotnosti (či alespoň udržení původní hmotnosti) v průběhu sledování.
Cirhóza na podkladě NAFLD – specifika léčby, transplantace jater a hepatocelulární karcinom (P. Trunečka)
Péče o pacienty s komplikacemi jaterní cirhózy vzniklé na základě NAFLD se podstatně neliší od péče o pacienty s cirhózou jiné etiologie. Odlišností může být vyšší věk pacientů s NAFLD cirhózou a téměř konstantní přítomnost diabetu, obezity a častější výskyt kardiovaskulárních onemocnění i selhání ledvin. Léčba těchto komorbidit vyžaduje mezioborovou spolupráci.
Jaterní cirhóza při NAFLD je spjata s rizikem HCC podobně jako cirhóza jiné etiologie. Samotná obezita zvyšuje riziko vzniku HCC přibližně 2× [71], podobně jako DM [72] a některé genetické faktory svázané s výskytem NAFLD. Nosičství polymorfizmu genu PNPLA3 (rs738409 c444C>G) zvyšuje násobně riziko vzniku HCC, a to nezávisle na DM a obezitě [73]. Zdá se, že HCC je častější i v necirhotických játrech pacientů s NAFLD než u jiných jaterních chorob [74]. V kohortě 611 pacientů s HCC byly u 145 případů s NAFLD nalezeny nádory větší, častěji s infiltrativním růstem, a byly diagnostikovány méně často na základě screeningu. U 50 % z nich se vyskytly v játrech bez jaterní cirhózy [75]. Z recentní analýzy publikovaných studií činí incidence HCC u pacientů s NAFLD jaterní cirhózou 6,7 a 15 % po 5 a 10 letech sledování, u pacientů bez cirhózy pak 2,7 % za 10 let nebo 23 na 100 tisíc pacientských let [76].
Doporučení ke screeningu HCC u cirhotických pacientů s NAFLD se neliší od screeningu u cirhózy jiné etiologie, tj. provedení ultrazvukového vyšetření každých 6 měsíců. Lze si představit, že s ohledem k habitu většiny nemocných bude výtěžnost sonografického vyšetření nižší. K případnému doporučení screeningu HCC u pacientů s NAFLD bez přítomnosti cirhózy není v současnosti dostatek dat a nejspíše není indikován a patrně též není realizovatelný s ohledem k rozsahu rizikové populace [77].
Léčba HCC u pacientů s NAFLD se řídí obvyklými pravidly, masivní steatóza jater může komplikovat jaterní resekci [78], časté komorbidity pak LTx (viz níže).
Komplikace jaterní cirhózy vzniklé na podkladě NAFLD vč. HCC jsou v současnosti druhou až třetí nejčastější indikací k LTx a jejich podíl narůstá [79,80]. Zásady indikačního procesu se u nemocných s NAFLD příliš neliší od jaterní cirhózy jiné etiologie. Pacient je indikován k LTx jen tehdy, je-li jaterním onemocněním významně ohrožen a lze-liočekávat příznivý dlouhodobý efekt transplantační léčby. Za minimální benefit LTx se většinou považuje dosažení 50% pravděpodobnosti 5letého přežití po LTx. Dlouhodobé výsledky u pacientů po transplantaci pro cirhózu na podkladě NAFLD jsou obdobné jako u ostatních jaterních chorob: 1-, 3-, a 5leté přežití příjemce dosahuje 84, 75 a 70 %, resp. přežití štěpu dosahuje 81, 71 a 63 %, i když za cenu vyšší utilizace zdrojů [81]. Vlastní transplantační výkon komplikují především časté komorbidity běžné u morbidně obézních pacientů s metabolickým syndromem. Řada programů odmítala LTx u pacientů s BMI > 40 (kg/ m2), posouzení tíže obezity u nemocných s ascitem však může být obtížné. Přesná hranice pro odmítnutí pacienta z důvodu obezity stanovena není [82,83]. U pacientů na čekací listině i po LTx je nutno počítat s vyšším výskytem komplikací (ischemická choroba srdeční, DM, hypertenze, renální insuficience). Koronárním příhodám v peri - a potransplantačním období lze předejít revaskularizačním výkonem před zařazením na čekací listinu. Výskyt onemocnění ledvin je u těchto pacientů častý a NASH je v současnosti vedoucí indikací ke kombinované transplantaci jater a ledvin [84].
Vývoj steatózy v transplantovaném štěpu je běžný, postihuje až 50 % příjemců, NASH de novo se vyskytuje asi u 7–10 % nemocných. Rekurence NASH po transplantaci pro cirhózu na podkladě NAFLD nebo kryptogenní cirhózu je častá, vyskytne se u nadpoloviční většiny případů do 5 let [85]. Dietní a režimová opatření v prevenci a léčbě recidivy NASH jsou v této skupině pacientů málo účinná. V některých programech se proto provádí LTx v jedné době s některým z výkonů bariatrické chirurgie, nejčastěji rukávovou gastrektomií (sleeve gastrectomy) [86,87]. Tento postup v současnosti není v ČR dostupný, je však možno výkon provést po transplantaci.
Narůstající výskyt NAFLD má rovněž nepříznivý vliv na dárcovství orgánů. Steatotický jaterní štěp je po transplantaci spojen s vyšším výskytem komplikací po transplantaci, především primární afunkcí či opožděným rozvojem funkce. Použití dárcovského orgánu se steatózou je často odmítáno. Nárůst incidence NAFLD tak bude omezovat dostupnost transplantace a zhoršovat prognózu i pacientů s ostatními jaterními chorobami [88].
Závěr
Onemocnění NAFLD je nejčastější chronickou jaterní chorobou na světě a je hlavní příčinou s játry spojené morbidity a mortality. Pacienti s NAFLD však umírají v první řadě na kardiovaskulární choroby a také na nádorová onemocnění. Jaterní komplikace tvoří až třetí nejčastější příčinu úmrtí. Pro prognózu pacienta je klíčová přítomnost NASH. Po přítomnosti NAFLD by se mělo pátrat u všech pacientů s metabolickými rizikovými faktory. Naopak u všech pacientů s náhodně zjištěnou steatózou musí být proveden screening kardiovaskulárních onemocnění, poruch metabolizmu glukózy, lipidového metabolizmu a zhodnocení možné přítomnosti jaterní fibrózy některou z neinvazivních metod. Léčebné postupy závisí na stupni jaterního postižení a v každém případě mají zahrnovat režimová opatření.
Literatura je dostupná na www.csgh.info.
Schváleno výborem České hepatologické společnosti ČLS JEP dne 27. 5. 2019.
prof. MUDr. Radan Brůha, CSc.
IV. interní klinika – klinika gastroenterologie a hepatologie
1. LF UK a VFN v Praze
U Nemocnice 499/2
128 08 Praha 2
Appendix
NAFLD doporučení – souhrn
NAFLD je nejčastějším chronickým jaterním onemocněním současnosti ve vyspělých zemích s prevalencí kolem 25 % v obecné populaci, v rizikových skupinách (diabetici 2. typu, obézní) okolo 75 %. NAFLD je považováno za jaterní manifestaci metabolického syndromu a zahrnuje celé spektrum postižení, od prosté jaterní steatózy přes NASH až po pokročilou jaterní fibrózu, resp. cirhózu, spojenou s rizikem rozvoje portální hypertenze a/ nebo HCC.
NASH představuje riziko progrese jaterní fibrózy, která je nejpodstatnějším prognostickým faktorem. NAFLD představuje také zvýšené riziko kardiovaskulárních a onkologických onemocnění.
Stanovení diagnózy NAFLD vyžaduje vyloučení nadměrného pití alkoholu a ostatních chronických jaterních chorob. Nejběžnější zobrazovací metodou pro detekci steatózy jater je sonografie, stupeň jaterní fibrózy je možné hodnotit elastografickými metodami nebo výpočtem indexů (NAFLD Fibrosis Score, FIB-4). Diagnóza NASH je možná pouze histologicky (jaterní biopsie).
Pacienti s NAFLD musí být vyšetřeni také ohledně rizika diabetu, dyslipidemie, arteriální hypertenze a kardiovaskulárních onemocnění (tab. A1).
Tab. A1. Screening kardiovaskulárních chorob a diabetu u pacientů s nealkoholovou tukovou chorobou jater.
Tab. A1. Screening for cardiovascular disease and diabetes in patients with non-alcoholic fatty liver disease.
Terapie zahrnuje změnu životního stylu s redukcí hmotnosti a zvýšením fyzické aktivity (tab. A2), odpovídající léčbu komorbidit (arteriální hypertenze, diabetes, dyslipidemie). U nemocných s histologicky prokázanou diagnózou NASH ve vysokém riziku progrese můžeme zvážit off-label podání pioglitazonu nebo u nediabetiků léčbu vitaminem E. Jiná prokazatelně účinná farmakoterapie NAFLD/ NASH není zatím dostupná. Obézní pacienti mohou být také vhodnými kandidáty bariatrické chirurgie. Transplantace jater je u NAFLD pacientů indikována dle standardních kritérií.
Tab. A2. Terapie nealkoholové tukové choroby jater – komplexní režimová opatření.
Tab. A2. Therapy of non-alcoholic fatty liver disease – complex regime measures.
NAFLD – nealkoholová tuková choroba jater
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2020 Číslo 2- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Editorial
- Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu nealkoholové tukové choroby jater
- Infekcie u pacientov hospitalizovaných s pokročilým chronickým ochorením pečene (cirhóza) – skúsenosti jedného centra
- De novo nealkoholová tuková choroba pečene po transplantácii pečene – diagnostikovaná pomocou magnetickej rezonancie
- Doporučení pro léčbu idiopatických střevních zánětů v době pandemie covid-19
- Odporúčania slovenskej Pracovnej skupiny pre IBD pri SGS pre liečbu biosimilárnymi anti-TNF biologikami u dospelých a detských pacientov
- Endoskopická drenáž infikované ohraničené pankreatické nekrózy s komplikovaným průběhem – kazuistika
- Čtyřleté zkušenosti s monitorováním farmakokinetiky infliximabu a adalimumabu u pacientů s idiopatickými střevními záněty
- Vedolizumab v léčbě Crohnovy choroby ve světle nových poznatků
- Laserová litotripse zaklíněného biliárního konkrementu v tlustém střevě
- Anderson-Fabryho choroba a postižení gastrointestinálního traktu
- Gastroenterologie a gastrointestinální endoskopie v podmínkách pandemie viru SARS-CoV-2
- Devadesátiny doc. MU Dr. Miloše Sedláčkové, CSc.
- Životní jubileum As. MU Dr. Hany Dvořákové, CSc.
- Komentář k článku: Caha M, Politová P, Vlk R et al. Překvapivá příčina úmrtí pacienta s krvácením do horního trávicího traktu. Gastroent Hepatol 2020; 74(1): 50–53. doi: 10.14735/ amgh202050.
-
Novel Pancreatic Developmentsprof. Peter Layer – Gastro Update Europe 2019, Budapest
Nové poznatky o pankreatu -
Biliopancreatic endoscopy
prof. Marco Bruno – Gastro Update Europe 2019, Budapest - Nové poznatky ve střevní endoskopii
- Výběr z mezinárodních časopisů
- Kreditovaný autodidaktický test
- Covid-19 a játra
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Covid-19 a játra
- Endoskopická drenáž infikované ohraničené pankreatické nekrózy s komplikovaným průběhem – kazuistika
- Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu nealkoholové tukové choroby jater
- Doporučení pro léčbu idiopatických střevních zánětů v době pandemie covid-19
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



