-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Štúdium lokálnych anestetík – časť 193*
Štúdium vplyvu teploty a prídavku soli na micelizáciu heptakaíniumperchlorátu vo vodnom prostredí
Study of local anesthetics. Part 193.
Study of temperature and salt-induced micellization of hepatacainium perchlorate in aqueous solutionThe critical micellar concentration of heptacainium perchlorate in aqueous NaCl solutions with different concentrations was determined by the spectrophotometric method in the UV region of the spectrum at the temperature range of t = 5–35 °C and pH ≈ 4.5–5.0. The dependence of cmc on temperature T turned out to be of U-shaped. The cmc decreases to a certain minimum and then increases with the temperature. The influence of sodium chloride on the critical micellar concentration was studied. A gentle increase in cmc is seen for increasing concentration of aqueous NaCl solution (up to 0.3 mol/l), but vice versa a rapid decrease in cmc is observed from 0.4 mol/l concentration of NaCl solution. The influence of perchlorate against the chloride ion on the critical micellar concentration was also studied.
Key words:
local anaesthetics – heptacainium perchlorate – sodium chloride – critical micellar concentration – micellization – spectrophotometry
Autoři: J. Gališinová; J. Čižmárik; F. Andriamainty; I. Malík
Působiště autorů: Farmaceutická fakulta Univerzity Komenského v Bratislave, Katedra farmaceutickej chémie
Vyšlo v časopise: Čes. slov. Farm., 2010; 59, 272-276
Kategorie: Původní práce
Souhrn
Kritická micelová koncentrácia heptakaíniumperchlorátu vo vodnom prostredí chloridu sodného s rôznou koncentráciou bola stanovená spektrofotometrickou metódou v UV oblasti spektra v teplotnom intervale t = 5–35 °C a pri pH ≈ 4,5–5,0. Závislosť ln (cmc) od teploty mala tvar „U“ („U-shaped“). Hodnoty cmc s teplotou najprv klesajú po určité minimum a potom rastú. Sledoval sa vplyv prídavku NaCl na kritickú micelovú koncentráciu. Tá so zvyšujúcou sa koncentráciou vodného roztoku NaCl rastie po 0,3 mol/l a potom začne klesať. Zároveň sa sledoval vplyv chloristanového oproti chloridovému aniónu na kritickú micelovú koncentráciu.
Kľúčové slová:
lokálne anestetiká – heptakaíniumperchlorát – chlorid sodný – kritická micelová koncentrácia – micelizácia – spektrofotometriaÚvod
Dôležitou vlastnosťou amfifilných molekúl je ich spontánna asociácia v roztoku, tvorba miciel, vezikúl, membrán. Tento proces hrá dôležitú úlohu v mnohých systémoch – od biologických až po technické aplikácie. Rovnako ako tvorba priestorovej štruktúry bielkovín či nukleových kyselín je aj tento proces asociácie riadený hydrofóbnymi a inými typmi interakcíí, ako sú napríklad nekovalentné „solute-solute“ a „solute-solvent“ interakcie 1).
Micelizáciu vodných roztokov iónových tenzidov okrem hydrofóbnych interakcií značne ovplyvňujú aj elektrostatické interakcie medzi ionizovanými hlavičkami tenzidu v micele a ich interakcie s okolitými protiiónmi a molekulami vody.
V rámci výskumu a vývoja liečiv zo skupiny bázických esterov fenylkarbámových kyselín sa v poslednej dobe kladie dôraz na štúdium vlastností micelových roztokov týchto iónových tenzidov a štúdium vplyvu rôznych faktorov na proces micelizácie. Predmetom štúdia je vplyv teploty, prídavku aditív (organických aj anorganických) či vplyv samotnej štruktúry liečiva na kritickú micelovú koncentráciu a na ďalšie parametre, akými sú ΔG°, ΔH° a ΔS°.
V predkladanej práci sme sa preto zamerali na štúdium vplyvu teploty a prídavku NaCl rôznych koncentrácií na micelizáciu heptakaíniumperchlorátu vo vodnom prostredí a jeho porovnanie s hepatakaíniumchloridom.
POKUSNÁ ČASŤ
Študované látky a prístroje
Študovanou látkou bolo lokálne anestetikum heptakaíniumperchlorát, chemicky N-[2-(2-heptyloxyfenyl-karbamoyloxy)-etyl]-piperidíniumperchlorát, ktorý bol pripravený na Katedre farmaceutickej chémie FaF UK v Bratislave.
Prístroje
Spectrofotometer HP 8452 A Diode Array (Hewlett Packard, Nemecko); analytické váhy (WA 33 typ PRL T A 13/1, Techma Robot, Poľsko); pH meter (Portamess 943 pH, Elekronische Messgeräte GmbH Co., Nemecko); Termostat (Veb ML W Prüfgerate-Werk Medingen/Sity/, Nemecko).
Pracovný postup
Zásobný roztok 1,0 mol/l sme pripravili rozpúšťaním heptakaíniumperchlorátu vo vodnom roztoku chloridu sodného pri izbovej teplote.
Z tohto zásobného roztoku sme pripravili série roztokov s klesajúcou koncentráciou riedením 0,1 mol/l, 0,2 mol/l, 0,3 mol/l, 0,4 mol/l a 1 mol/l roztokov chloridu sodného.
Obr. 1. Heptakaíniumperchlorát 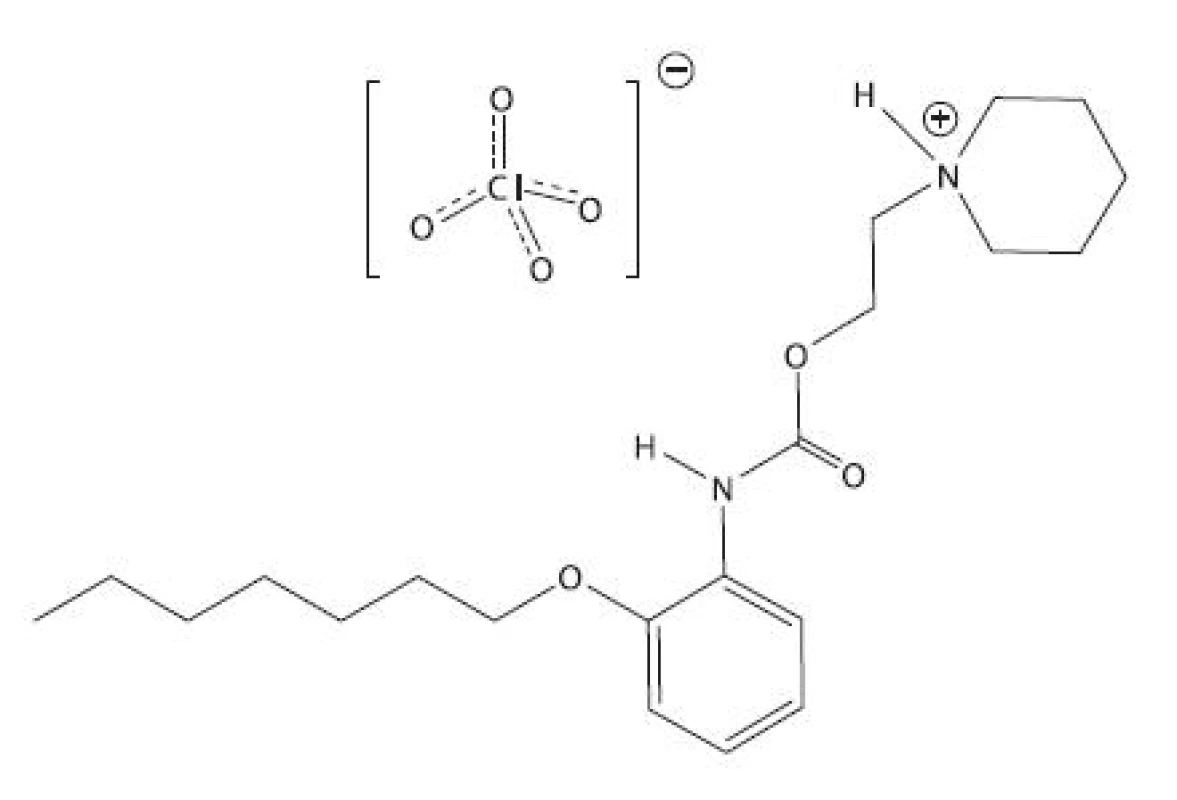
Pri každej koncentrácii sme pri teplotách 5 °C, 10 °C, 15 °C, 20 °C, 25 °C, 30 °C a 35 °C merali absorbanciu jednotlivých roztokov pri λmax = 234 nm oproti zodpovedajúcemu porovnávaciemu roztoku (príslušný roztok chloridu sodného).
VÝSLEDKY A DISKUSIA
V práci sme sledovali priebeh závislosti absorbancie (A) od koncentrácie (c) heptakaíniumperchlorátu vo vodných roztokoch chloridu sodného s koncentráciami 0,1 mol/l, 0,2 mol/l, 0,3 mol/l, 0,4 mol/l a 1 mol/l v teplotnom intervale 5 °C až 35 °C pri pH ≈ 4,5–5,0. Absorbancie boli merané pri vlnovej dĺžke λmax = 234 nm v ultrafialovej oblasti spektra oproti odpovedajúcemu porovnávaciemu roztoku.
Pre ilustráciu uvádzame závislosť absorbancie (A) od koncentrácie (c) pre heptakaíniumperchlorát pri teplote 15 °C vo vodných roztokoch chloridu sodného s koncentráciou 0,1 mol/l (obr. 2). Závislosť A = f (c) má rovnaký priebeh pri meraných roztokoch aj pri ďalších teplotách.
Obr. 2. Závislosť absorbancie A od koncentrácie c (mol/l) v 0,1 mol/l roztoku NaCl pri teplote 15 °C 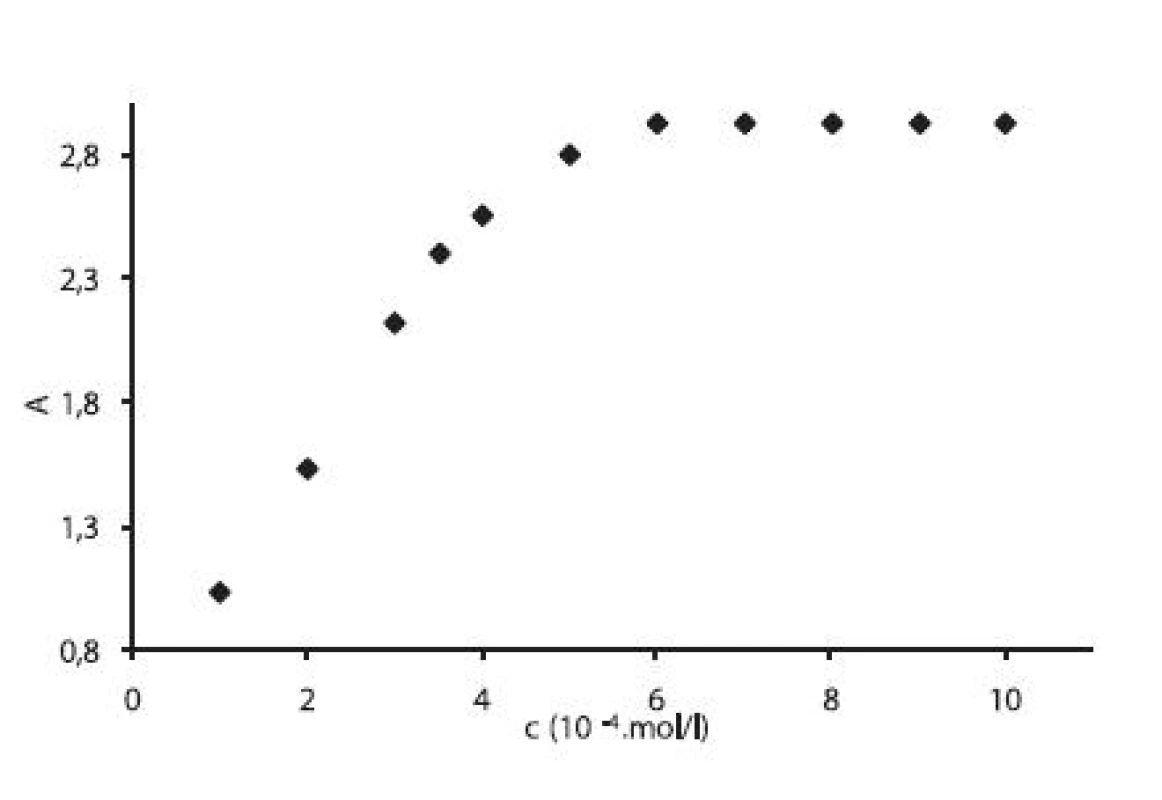
Hodnotu cmc sme určili ako priesečník dvoch extrapolovaných kriviek, ktoré interpretovali závislosť absorbancie (A) ako funkciu koncentrácie (c) 2). Na extrapoláciu kriviek sme použili komerčný program Origin Pro. Zistili sme, že hodnoty cmc sa pohybovali v rozmedzí od 3,67.10-4 mol/l do 5,45.10-4 mol/l.
Hodnoty cmc a ln (cmc) v závislosti od T sú zaznamenané v tabuľkách 1 až 5. Priebeh závislosti ln (cmc) od teploty T pri rozličných koncentráciách roztokov NaCl znázorňuje obrázok 3. Táto závislosť má tvar „U“ („U-shaped“). Hodnoty boli fitované polynómom druhého stupňa.
Tab. 1. Zistené hodnoty cmc a ln (cmc) meranej látky v 0,1 mol/l roztoku NaCl 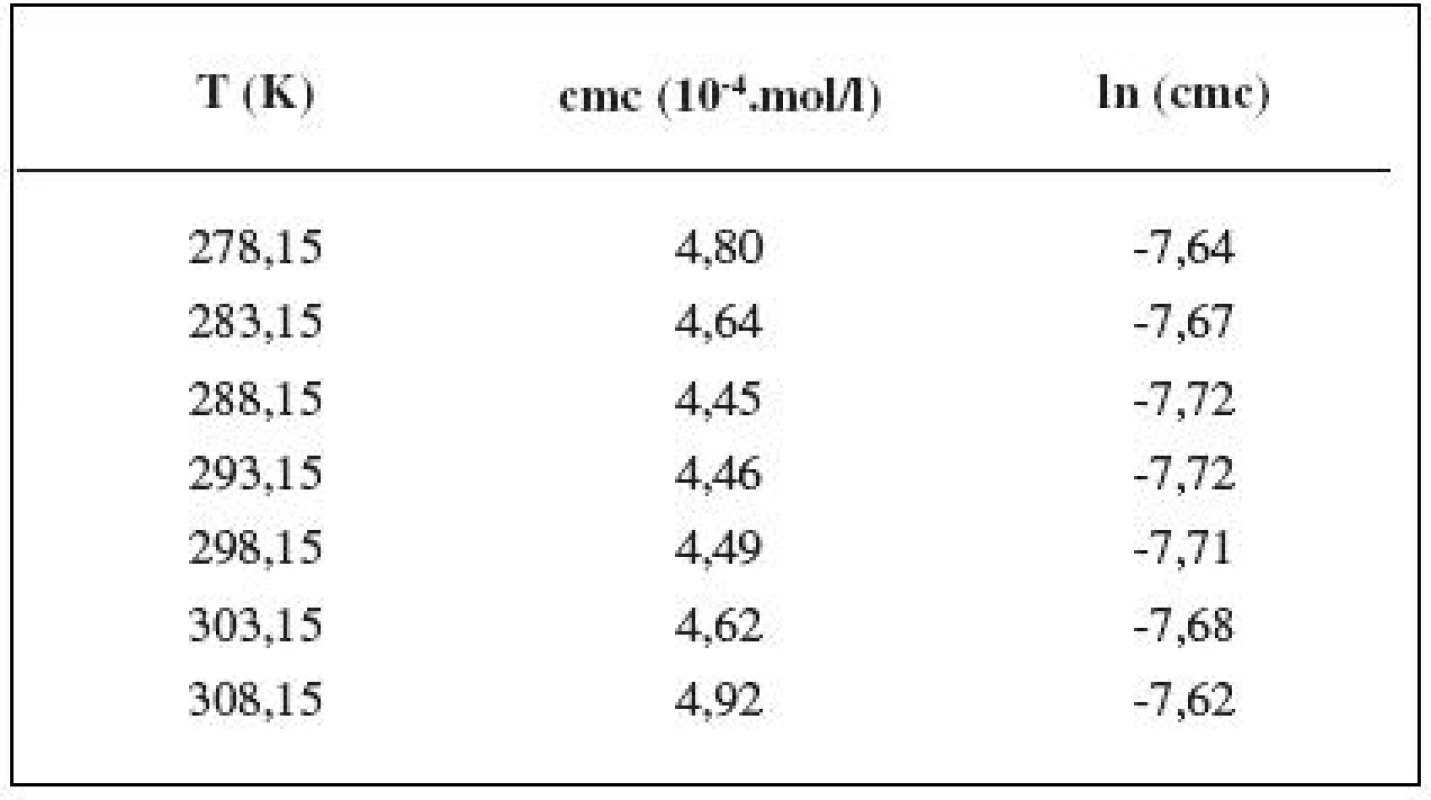
Tab. 2. Zistené hodnoty cmc a ln (cmc) meranej látky v 0,2 mol/l roztoku NaCl 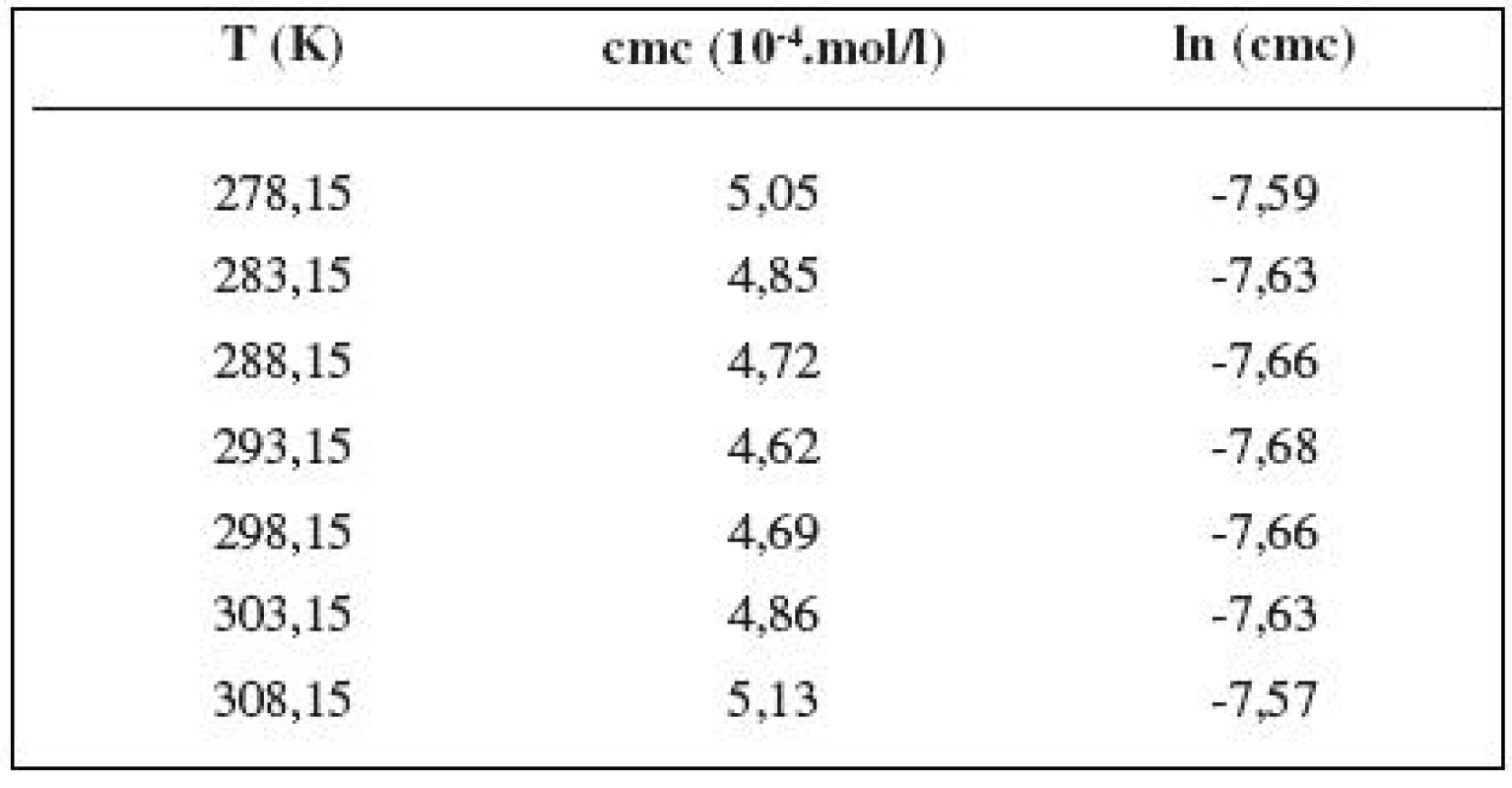
Tab. 3. Zistené hodnoty cmc a ln (cmc) meranej látky v 0,3 mol/l roztoku NaCl 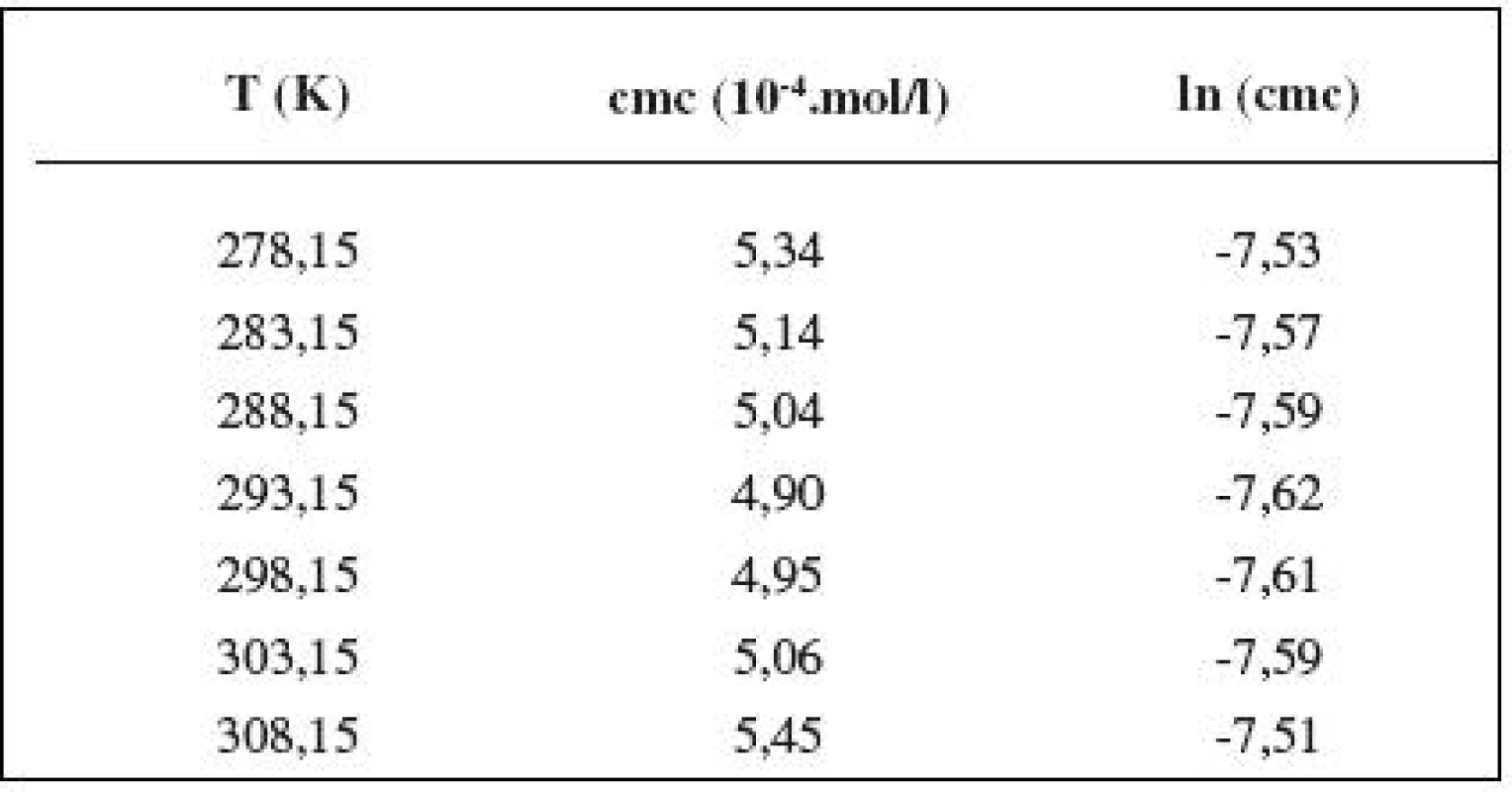
Tab. 4. Zistené hodnoty cmc a ln (cmc) meranej látky v 0,4 mol/l roztoku NaCl 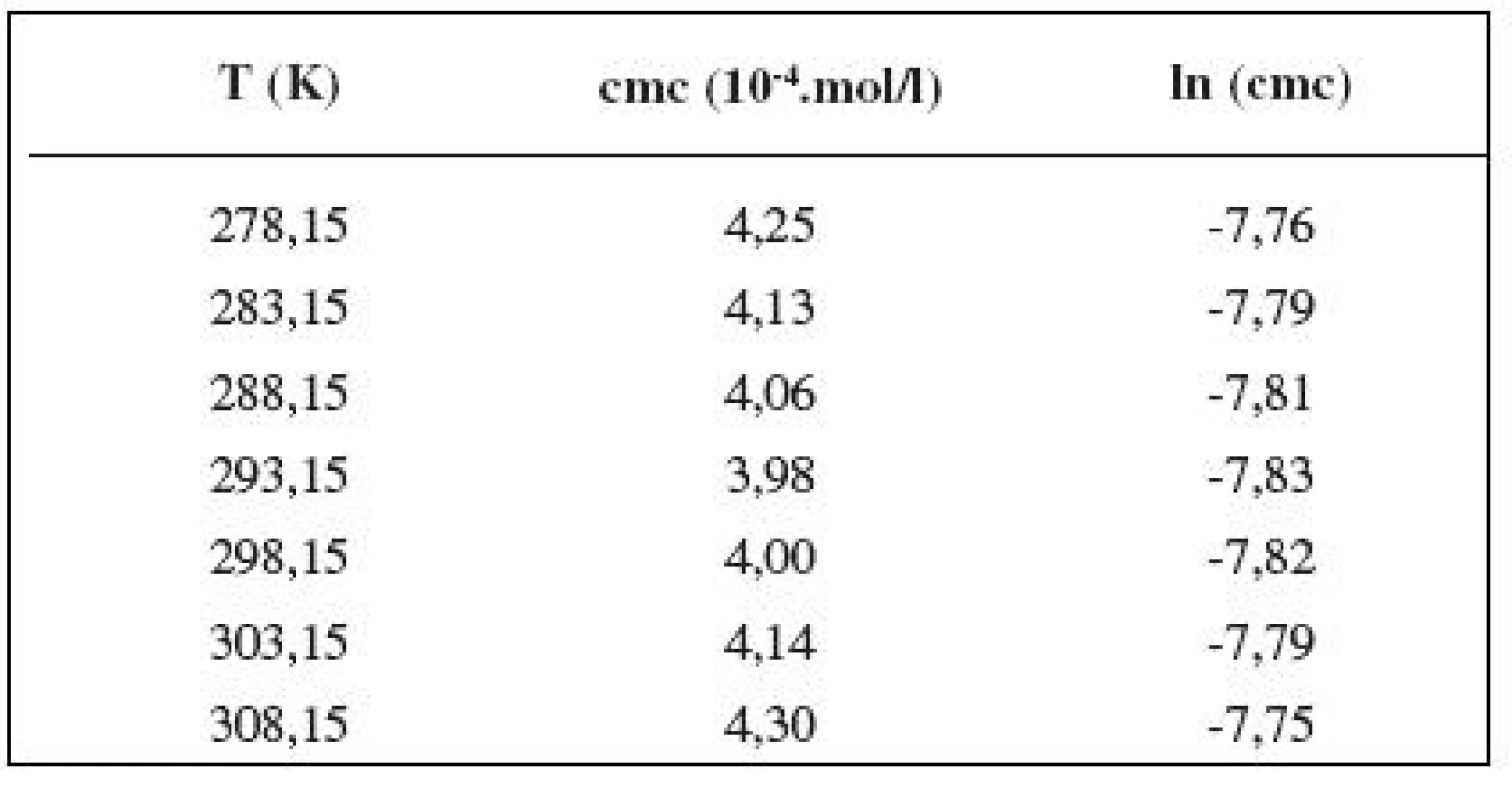
Tab. 5. Zistené hodnoty cmc a ln (cmc) meranej látky v 1 mol/l roztoku NaCl 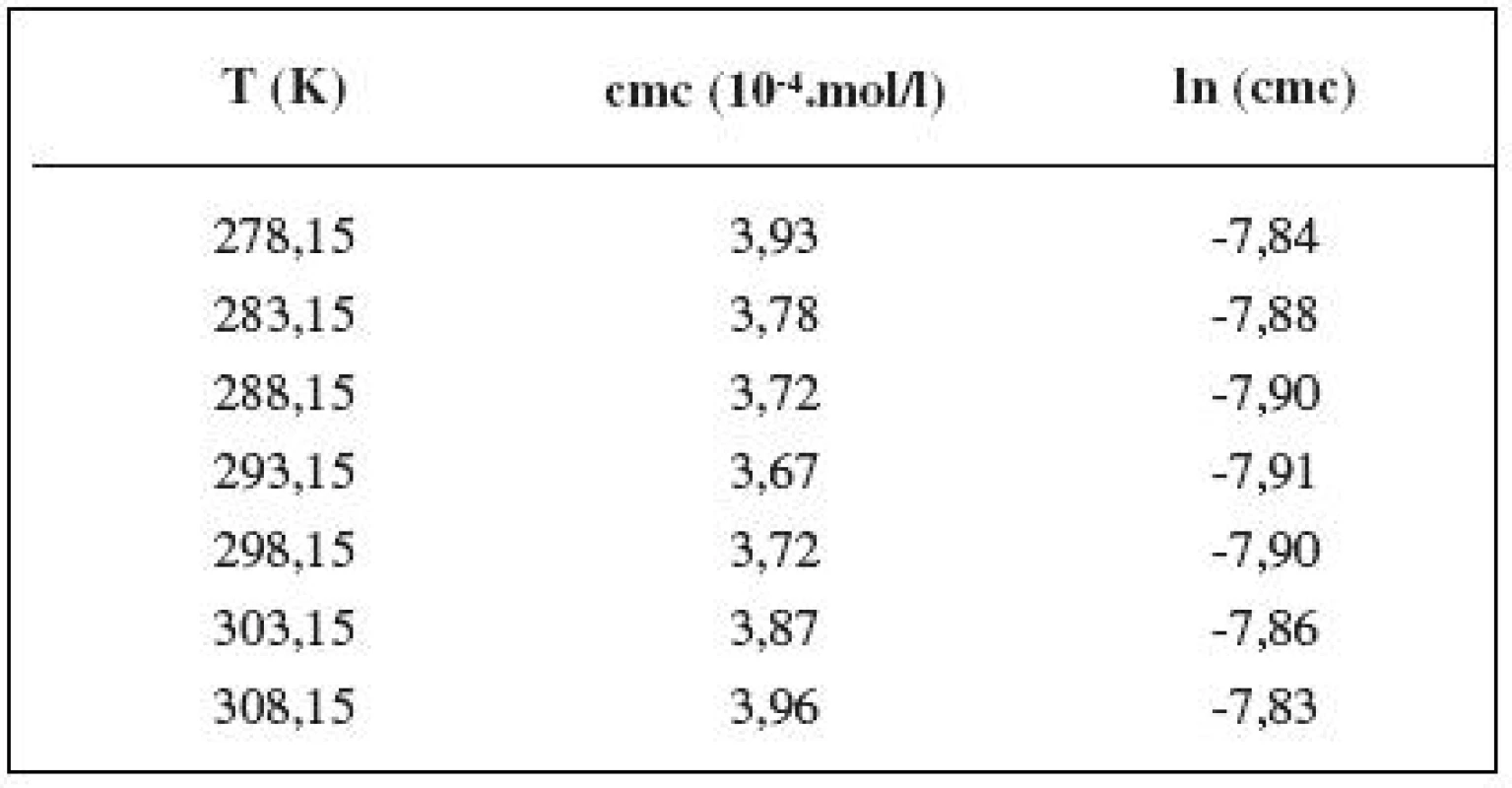
Obr. 3. Závislosť ln (cmc) od T (K) pri rôznych koncentráciách roztokov NaCl študovanej látky 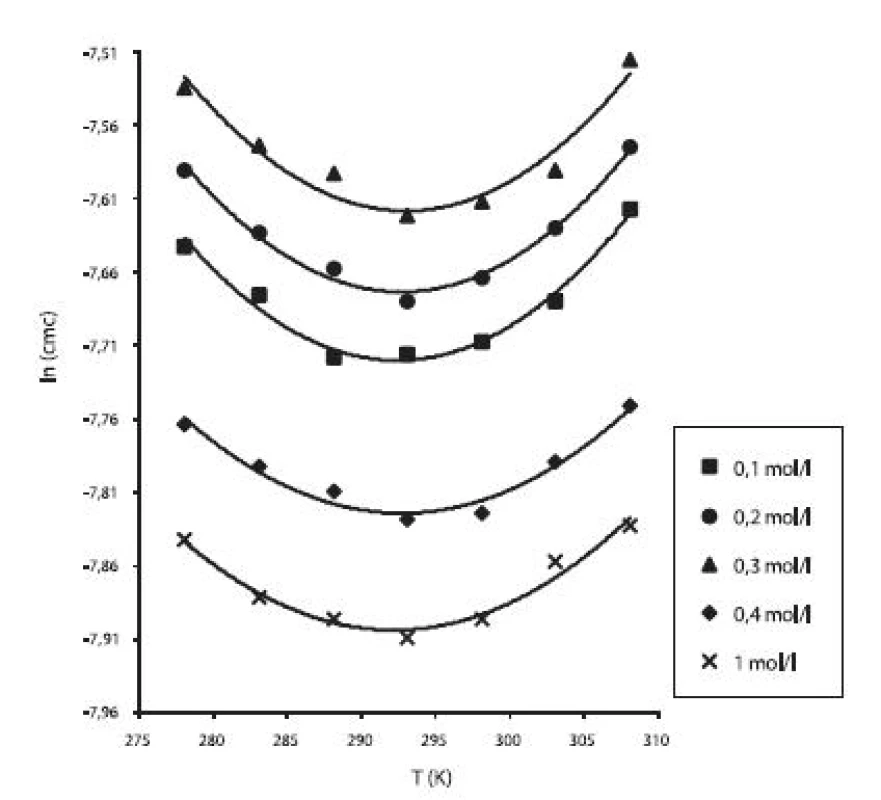
Polynomické rovnice (y = ln (cmc) = A + B.x + C.x2) a koeficienty determinácie (R2) látky heptakaíniumperchlorát v 0,1 mol/l až 1 mol/l vodnom roztoku chloridu sodného boli nasledovné:
y = 26,885 – 0,237 x + 0,0004 x2; R2 = 0,97(0,1 mol/l roztok NaCl)
y = 27,277 – 0,239 x + 0,0004 x2; R2 = 0,98(0,2 mol/l roztok NaCl)
y = 27,471 – 0,239 x + 0,0004 x2; R2 = 0,93(0,3 mol/l roztok NaCl)
y = 18,384 – 0,179 x + 0,0003 x2; R2 = 0,96(0,4 mol/l roztok NaCl)
y = 18,068 – 0,178 x + 0,0003 x2; R2 = 0,96(1,0 mol/l roztok NaCl)
Pre ilustráciu závislosti kritickej micelovej koncentrácie od koncentrácie roztokov chloridu sodného sme zostrojili graf (obr. 4), ktorý znázorňuje túto závislosť pri teplotách 278,15 K a 283,15 K. Rovnaký priebeh závislosti bol pozorovaný aj pri ďalších meraných teplotách.
Obr. 4. Závislosť cmc (mol/l) od koncentrácie roztoku NaCl pri teplote 278,15 a 283,15 K 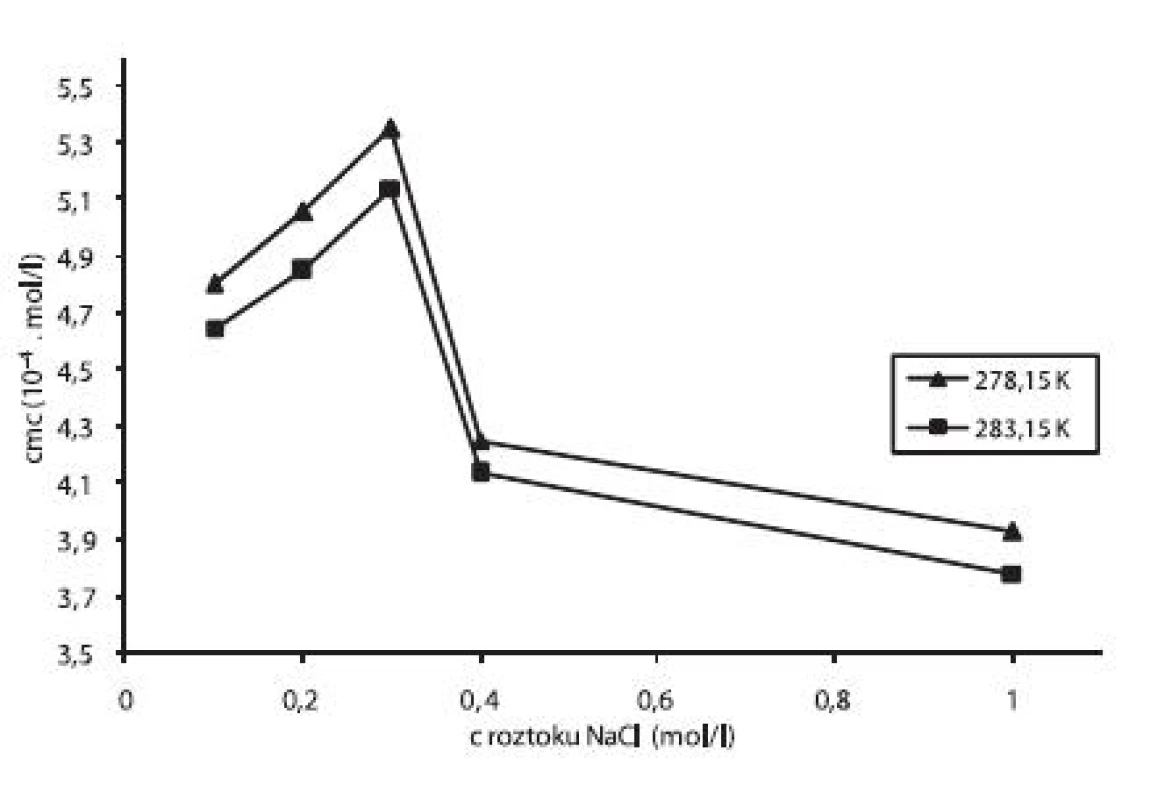
Hodnota cmc, resp. ln (cmc) s teplotou klesala po určitú teplotu T* a potom cmc stúpala (tab. 6). Predpokladáme, že tento postupný pokles cmc je zapríčinený desolvatačným procesom prebiehajúcim na koncovej časti postranného reťazca. V minime cmc (c*cmc) nastal zlom, po ktorom bol pozorovaný nárast cmc, čo je pravdepodobne spôsobené agregáciou uhľovodíkového reťazca a vytvorením miciel 3).
Tab. 6. Hodnoty c*<sub>cmc</sub> a T* pre heptakaíniumperchlorát v jednotlivých roztokoch chloridu sodného 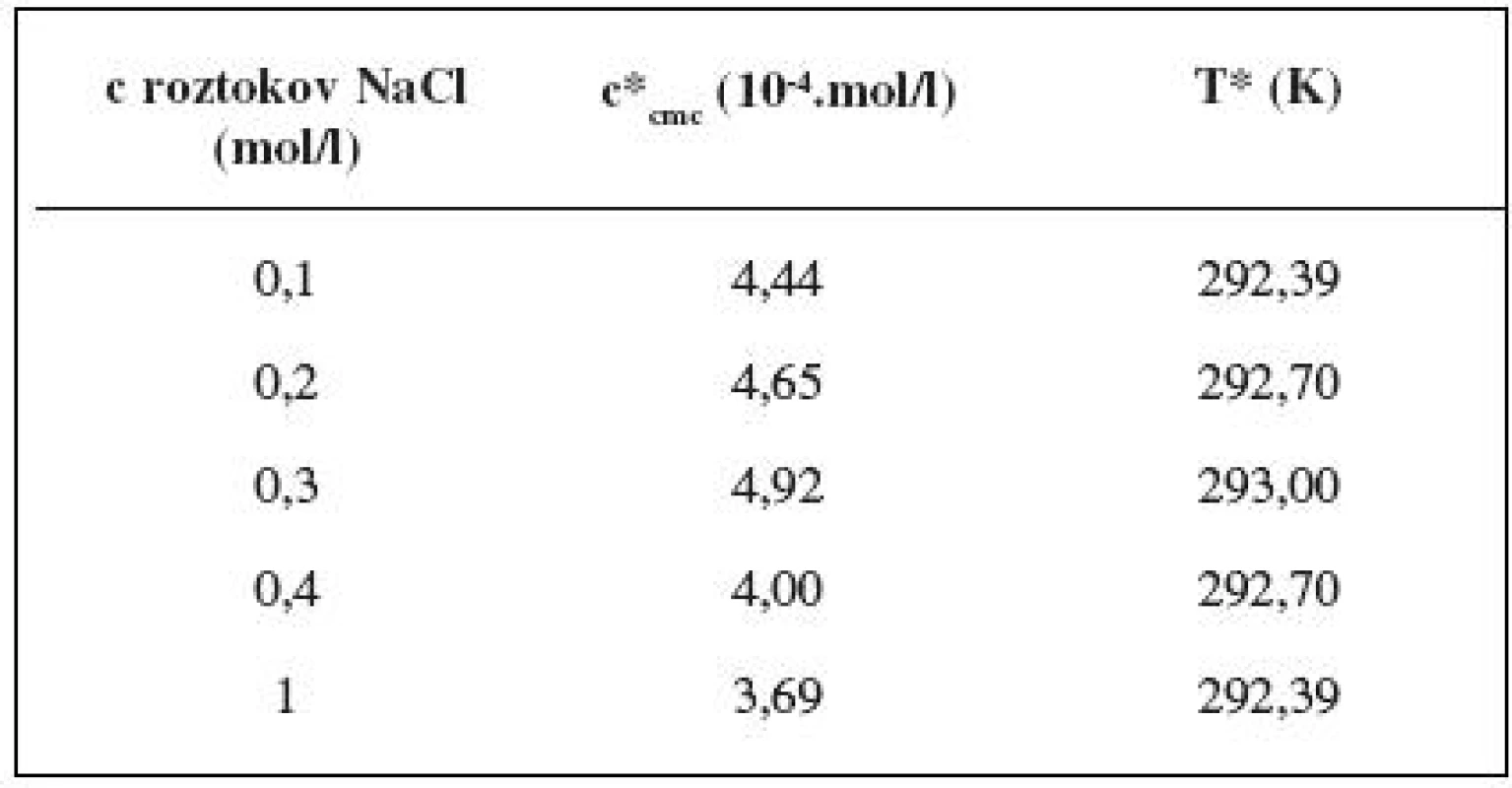
Okrem vplyvu teploty sme v práci sledovali aj vplyv chloridu sodného ako elektrolytového prídavku na kritickú micelovú koncentráciu. Prídavok soli, ktorý s tenzidom nereaguje, podporuje micelizáciu a znižuje cmc hlavne iónových tenzidov 4). Vysvetľuje sa to vplyvom iónovej sily a tiež väzbou protiiónov na iónovú skupinu tenzidu 5). Túto skutočnosť potvrdzujú viaceré štúdie 6–11). Výsledkom je, že cmc heptakaíniumperchlorátu pri všetkých koncentráciách vodného roztoku NaCl (tab. 1 až 5) bola nižšia v porovnaní s cmc heptakaíniumperchlorátu vo vodnom prostredí (cmc sa pohybovala v rozmedzí 4,90.10-4 mol/l až 5,55.10-4 mol/l) 12), teda chlorid sodný ako elektrolytový prídavok podporuje micelizáciu.
Hájková 12) sledovala vplyv chloristanového aniónu na kritickú micelovú koncentráciu, kde porovnávala hodnoty cmc heptakaíniumperchlorátu s hodnotami cmc heptakaíniumchloridu vo vodnom prostredí 13).
Výsledkom bolo, že anión ClO4 - oproti Cl- posúva hodnoty kritickej micelovej koncentrácie k vyšším hodnotám. Z toho vyplýva, že anión ClO4- nepodporuje micelizáciu. Aj v našej práci sme dospeli k rovnakému záveru. Tento dej je pravdepodobne spôsobený relatívne väčším van der Waalsovým polomerom chloristanového aniónu oproti chloridovému aniónu.
Vplyv rôznych van der Waalsových polomerov protiiónov na proces micelizácie iónových tenzidov sa skúmal aj v ďalších prácach. Andriamainty a kolektív 14) sa zamerali na vplyv NaBr na cmc heptakaíniumchloridu. Hodnoty cmc roztokov látok v 0,1 mol/l NaBr a 0,2 mol/l NaBr boli vyššie ako hodnoty cmc roztokov látok v destilovanej vode 13). Nepodporovanie micelizácie (oproti destilovanej vode) bolo pravdepodobne spôsobené relatívne väčším van der Waalsovým polomerom bromidového aniónu oproti chloridovému 6, 8, 9) či fluoridovému aniónu 7, 10, 11), ktoré naopak micelizáciu podporujú (obr. 5).
Obr. 5. Schematický nákres iónov s ich van der Waalsovými polomermi <sup>15)</sup> 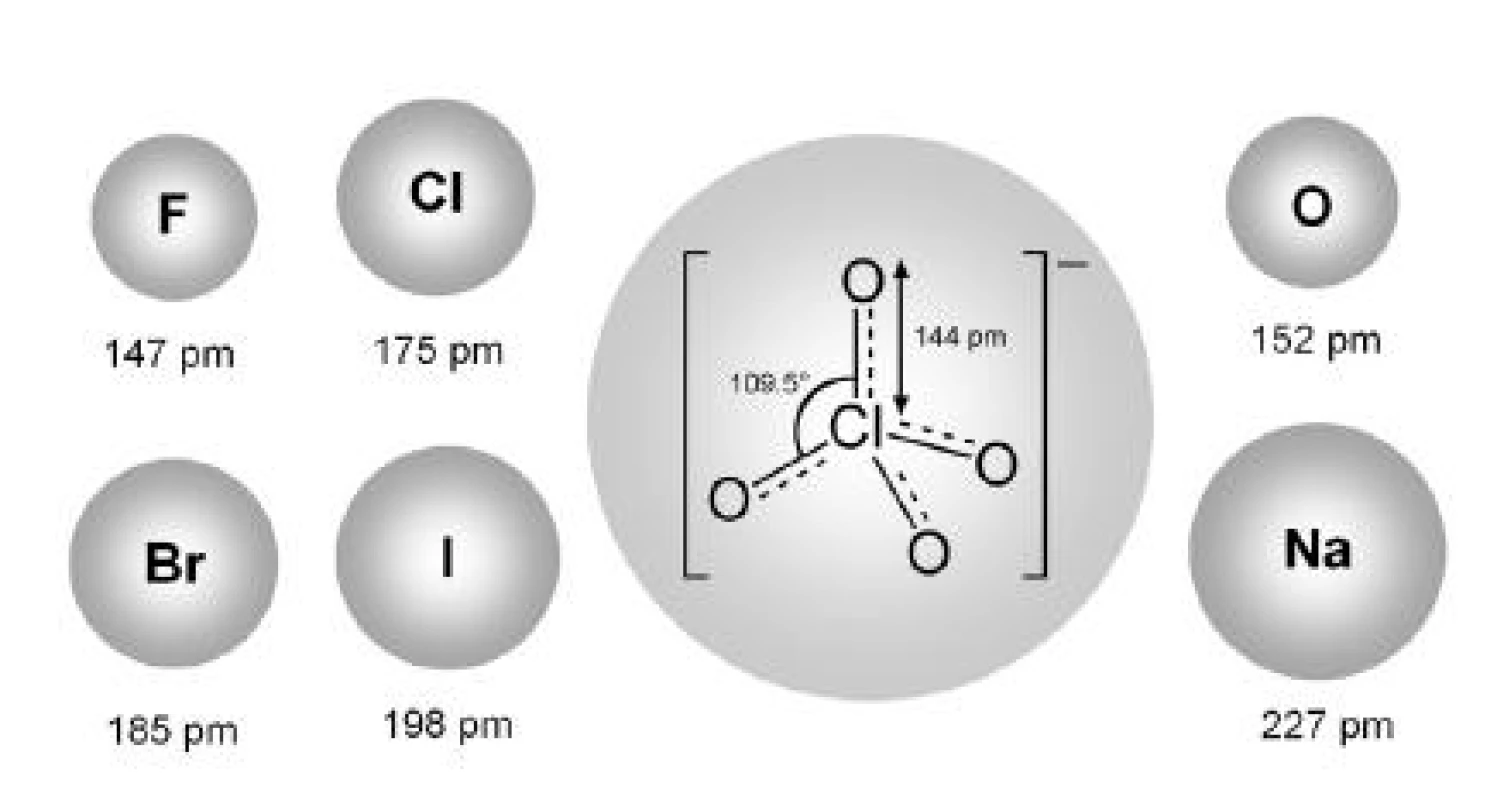
Ďalej sme v našej práci študovali vzájomný vplyv chloristanového aniónu a prídavku chloridu sodného na kritickú micelovú koncentráciu. Výsledkom bolo, že cmc heptakaíniumperchlorátu stúpala od koncentrácie 0,1 mol/l po 0,3 mol/l roztoku NaCl a potom prudko klesala po koncentráciu 1 mol/l. Pravdepodobne nižšie koncentrácie NaCl menej podporujú tvorbu miciel ako vyššie koncentrácie. Predpokladáme, že chloristanový anión svojou veľkosťou bráni prenikaniu chloridových iónov k polárnym hlavičkám tenzidu, čím by sa znížila sila repulzie medzi nimi, a tým by sa podporila tvorba miciel. Cl- ióny vo vyššej koncentrácii (0,4–1 mol/l) podporujú vznik miciel. Avšak pri vysokých koncentráciách chloridu sodného (2 mol/l a vyššie) dochádza k vysoľovaniu tenzidu.
Došlo 21. října 2010 / Přijato 20. listopadu 2010
Adresa pre korešpondenciu:
PharmDr. Jana Gališinová
Katedra farmaceutickej chémie FaF UK
Odbojárov 10, 832 32 Bratislava, Slovenská republika
e-mail: jana.galisinova@gmail.com
Zdroje
1. Tanford, C.: The Hydrophobic Effect. New York: Wiley 1980.
2. Ščukin, E. D., Percov, A. V., Amelinová, E. A.: Koloidní chemie. 1. vyd. Praha: Academia 1990; 303–333.
3. Chen, L.-J., Lin, S.-Y., Huang, C.-C.: J. Phys. Chem., 1998; 102, 4350–4356.
4. Chalabala, M. a kol.: Technologie léků. Praha: Galén 1997; 66–261.
5. Gaillon, L., Lelievre, J., Mayfree, A., Gabouriand, R.: C. R. Acad. Sci. Paris, 1995; 320, 607.
6. Andriamainty, F., Čižmárik, J., Mariščáková, Z.: Čes. slov. Farm., 2002; 51, 154–156.
7. Andriamainty, F., Čižmárik, J., Malík, I.: Acta Facult. Pharm. Univ. Comenianae 2009; 56, 31–38.
8. Andriamainty, F., Čižmárik, J.: Farm. Obzor, 2004; 73,100–102.
9. Arbetová, R.: Diplomová práca, FaF UK, Bratislava 2006.
10. Krammer, M.: Diplomová práca, FaF UK, Bratislava 2008.
11. Mikle, M.: Diplomová práca, FaF UK, Bratislava 2008.
12. Hájková, K.: Diplomová práca, FaF UK, Bratislava 2009.
13. Andriamainty, F., Čižmárik, J.: Pharmazie, 2003; 58, 440–441.
14. Andriamainty, F., Čižmárik, J., Malík, I.: Čes. slov. Farm., 2008; 57, 260–264.
15. Perchlorate Testing. Columbia Analytical Services. http://www.caslab.com/Perchlorate-Testing/ (2010).
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2010 Číslo 6- Přerušovaný půst může mít významná zdravotní rizika
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Orálně dispergovatelné lékové formy a technologie jejich výroby
- Používání humánních hromadně vyráběných léčivých přípravků ve veterinární praxi v České republice
- Studium procesu homogenizace práškových směsí s využitím NIR spektroskopie
-
Štúdium lokálnych anestetík – časť 193*
Štúdium vplyvu teploty a prídavku soli na micelizáciu heptakaíniumperchlorátu vo vodnom prostredí -
Štúdium lokálnych anestetík – časť 192
Formulácia lidokaínu do gélov s protizápalovým účinkom - K dějinám lékárny Milosrdných bratří ve Skalici do roku 1919
- Z činnosti farmaceutických společností
- Doc. RNDr. Mária Stankovičová, CSc., ocenená Weberovou cenou SFS
- Autorský a věcný rejstřík
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Orálně dispergovatelné lékové formy a technologie jejich výroby
- Studium procesu homogenizace práškových směsí s využitím NIR spektroskopie
- K dějinám lékárny Milosrdných bratří ve Skalici do roku 1919
- Používání humánních hromadně vyráběných léčivých přípravků ve veterinární praxi v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



