-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPokroky v léčbě karcinomu děložního hrdla – 3D plánování HDR brachyterapie pomocí CT/MR
The Progress in the Treatment of Cervical Cancer – 3D Brachytherapy CT/MR-based Planning
Brachytherapy plays a major role in the therapeutic management of patiens with cervix cancer. The rapid dose fall-off provide a very high dose to the tumor, while relative sparing bladder, rektum, sigmoid and small bowel. The CT/MR-based planning provides better information on target and organ volumes and dose-volumes histograms in contrast to radiography-based planning, that provides doses only at selected points.
Key words:
3D brachytherapy, cervical cancer, radiotherapy.
Autoři: M. Doležel 1,2; J. Vaňásek 1; K. Odrážka 1,2; M. Tichý 3
Působiště autorů: KOC Pardubická krajská nemocnice a. s., Multiscan s. r. o. 1; Katedra radiační onkologie IPVZ 2; PGO Pardubická krajská nemocnice a. s. 3
Vyšlo v časopise: Ceska Gynekol 2008; 73(3): 144-149
Souhrn
Brachyterapie má v léčbě pacientek s karcinomem děložního hrdla významnou roli. Prudký pokles dávky umožňuje aplikovat velice vysokou dávku do tumoru při relativním šetřením močového měchýře, rekta, sigmatu a tenkého střeva. 3D brachyterapie založená na plánování z CT či MR přináší lepší informaci o cílovém objemu, rizikových orgánech a DVH na rozdíl od konvenční brachyterapie založené na plánování z rtg snímků, která uvádí dávku pouze v určitých bodech.
Klíčová slova:
3D brachyterapie, karcinom děložního hrdla, radioterapie.ÚVOD
Karcinom děložního hrdla je 7. nejčastějším maligním onemocněním žen. V České republice bylo v roce 2004 hlášeno 1033 nových případů (19,7 / 100 000 žen), ve stejném roce na tuto diagnózu zemřelo 394 žen (7,5 ze 100 000 žen) [5].
Radioterapie se uplatňuje v léčbě již více než 100 let. První dokumentovaná aplikace radia (Ra) byla provedena v roce 1903 a první vyléčená pacientka byla prezentována v roce 1913. V současnosti je radikální radioterapie metodou volby u pacientek s časným stadiem onemocnění (I-IIA) a za potenciace s chemoterapií zlatým standardem u lokálně pokročilých stadií.
Brachyterapie (BRT) je nedílnou součástí radikální radiační léčby karcinomu děložního hrdla. Tato skutečnost je dána faktem, že lokoregionální kontrola u pacientek signifikantně koreluje s přežitím [2, 11], přičemž několik studií prokázalo signifikantně lepší lokoregionální kontrolu kombinované radioterapie (teleterapie + brachyterapie) ve srovnání se samotným zevním ozářením [7, 8].
BRACHYTERAPIE
Brachyterapie je charakterizována vysokou dávkou záření v blízkosti zdroje s prudkým poklesem do okolí. Tato schopnost umožňuje aplikovat do limitovaného objemu (děloha s přilehlou paracervikální oblastí) výrazně větší dávku ve srovnání se zevním ozářením ve významně kratším čase než při frakcionované teleterapii. Prudký spád dávky navíc vede k šetření okolních zdravých tkání (močový měchýř a rektum). Podle zdroje se brachyterapie rozděluje na BRT s nízkým dávkovým příkonem (LDR: 0,2-2 Gy/h), BRT se středním dávkovým příkonem (MDR: 2-12Gy/h) a BRT s vysokým dávkovým příkonem (HDR: více než 12Gy/h).
Při brachyterapii hraje velikost dávkového příkonu významnou roli. Základní radiobiologické dogma stanovené na základě in vitro studií tvrdí, že při vyšších hodnotách dávkového příkonu je míra redukce dávky nutná ke snížení pozdní toxicity okolních rizikových orgánů daleko větší než redukce dávky nutná k identické lokální kontrole tumoru [11]. Terapeutický poměr (poměr lokální kontroly k množství komplikací) stoupá s klesajícím dávkovým příkonem. To znamená, že zvýšení dávkového příkonu vede ke zvýšení pozdní toxicity v daleko větší míře než ke zvýšení lokální kontroly. S těmito teoretickými předpoklady ovšem nesouhlasily výsledky většiny rozsáhlých retrospektivních klinických pozorování, která při relativně vysokých dávkách na frakci u HDR brachyterapie popisovaly stejné nebo menší množství pozdních komplikací při srovnání s LDR brachyterapií. Příčinou tohoto nesouladu by mohl být poločas reparace pozdě reagujících tkání. Ten je podle recentních radiobiologických dat významně delší, než se dříve předpokládalo (4-5 hodin). To s sebou přináší samozřejmě významné konsekvence. Při použití lineárně kvadratického modelu totiž můžeme teoreticky prokázat, že činí-li poločas reparace pozdě reagujících tkání více než 2,5 hodiny při poločasu reparace tumoru 1,5 h, stává se LDR radiobiologicky nevýhodnější ve srovnání s HDR.
Typickým představitelem zdroje pro LDR brachyterapii je radium, jehož poločas rozpadu je 1620 let a doba nutná k dosažení potřebné dávky se pohybuje mezi 24-72 hodinami v závislosti na frakcionaci zevního ozáření. V posledních několika desetiletích se rozšiřuje používání HDR zdrojů. Jejich výhodou je větší komfort pro pacientky související s kratší dobou ozáření a menšími aplikátory, radiační ochrana zdravotního personálu, schopnost optimalizovat dávku při plánování a možnost ambulantní péče. HDR přístroje používají zpravidla 192Ir o vysoké nominální aktivitě (370 GBq) formou automatického afterloadingu, jehož princip spočívá v odděleném zavádění aplikátorů a vlastní iradiace. Modelování rozložení dávky je umožněno pobytem zdroje v přesně definovaných pozicích, kdy zdroj setrvává vždy určitou dobu v jednotlivých pozicích aplikátoru („stepping source“). Vzdálenost mezi jednotlivými pozicemi lze nastavit, přičemž doba setrvání zdroje v určených pozicích je dána ozařovacím plánem. Aplikace trvá řádově minuty a zpravidla se několikrát opakuje s odstupem 1-7 dnů.
APLIKACE
U HDR BRT stejně jako u moderních afterloadingových LDR, respektive MDR BRT probíhá zavedení aplikátorů do dutiny děložní a poševních kleneb odděleně od iradiace. Provádí se ve spinální či celkové anestezii. Po gynekologickém vyšetření se nejdříve zavede močový katétr, jehož balonek se naplní 7 cm3 rtg-kontrastního roztoku. Za pomoci vaginálních zrcadel uchopíme do cervikálních kleští cervikální labium a hysterometrem změříme velikost děložní dutiny. Zavedeme intrauterinní sondu a následně vaginální aplikátory, které k intrauterinnímu aplikátoru zafixujeme. Pro dislokaci rekta resp. močového měchýře zavádíme do pochvy rentgenkontrastní gázu. Některá pracoviště používají k odtažení konečníku od aplikátorů rektální retraktory. Nakonec zavedeme rektální rourku, kterou aplikujeme rtg-kontrastní roztok k topografickému znázornění rekta. Optimální inzerce aplikátorů a zvolení vhodného aplikátoru je rozhodující pro výslednou lokální kontrolu a potenciální komplikace. V současnosti je k dispozici velké množství komerčně vyráběných aplikátorů - aplikátory s ovoidy, ring (prstencové) aplikátory či mould aplikátory (individuálně vytvořené aplikátory pomocí intrakavitární muláže).
SPECIFIKACE DÁVKY
Pařížská a Stockholmská škola užívaly ke stanovení dávky záření u brachyterapie s nízkým dávkovým příkonem v první polovině minulého století miligramhodiny, tj. množství použitého radia x doba aplikace.
Manchesterská technika přinesla do specifikace dávky na svou dobu revoluční změnu zavedením bodu A, do něhož dávku definovala. Tento bod se nacházel v průsečíku přímek, z nich jedna ležela 2 cm nad ovoidy a druhá 2 cm laterálně od intrauterinní sondy. Bod A neodpovídal lokalizaci tumoru, ale byl stanoven jako oblast, kde hrozí významné poškození okolních zdravých tkání – místo křížení a. uterina s ureterem. V současnosti konvenční plánování LDR i HDR brachyterapie nejčastěji využívá ortogonální rekonstrukce 2 na sebe kolmých projekcí pomocí 2 rtg snímků či C-ramene s digitálním přenosem dat (viz obr. 1 a 2). Dávka je specifikována do bodu A a ICRU referenčních bodů pro kritické orgány, které představuje rektum a močový měchýř (viz obr. 3) [6]. Dávková distribuce ve výsledném plánu je tak určená pouze několika body v prostoru (viz obr. 4).
Obr. 1. Uterovaginální aplikátor na předozadním RTG snímku při konvenčním plánování brachyterapie 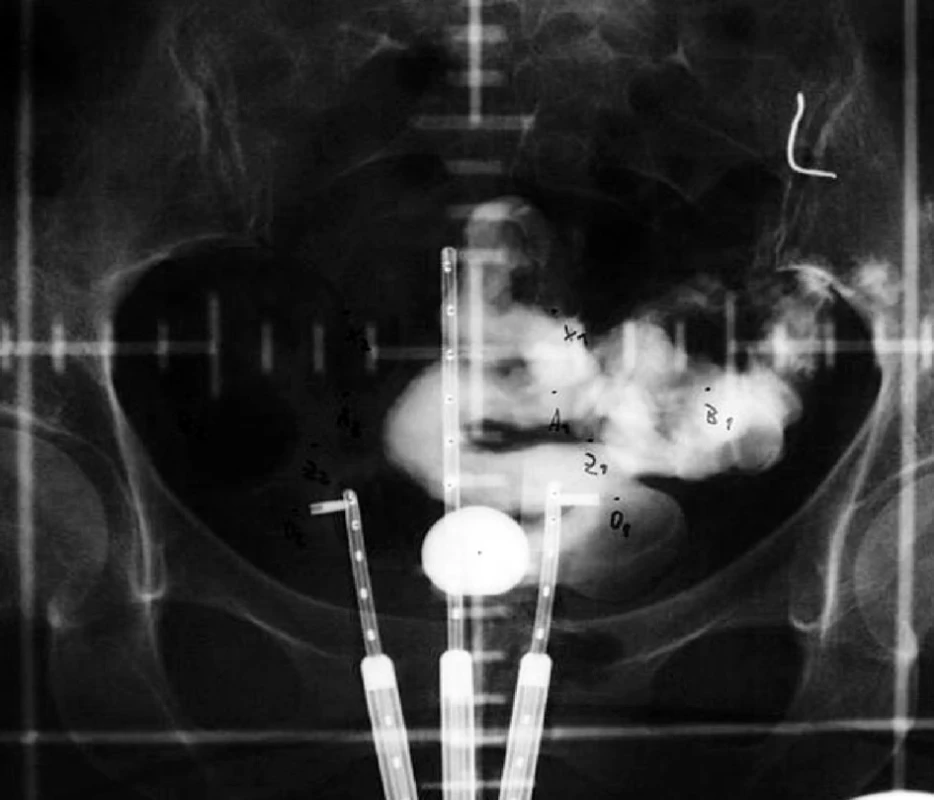
Obr. 2. Uterovaginální aplikátor s referenčními body pro rizikové orgány na bočním RTG snímku při konvenčním plánování brachyterapie 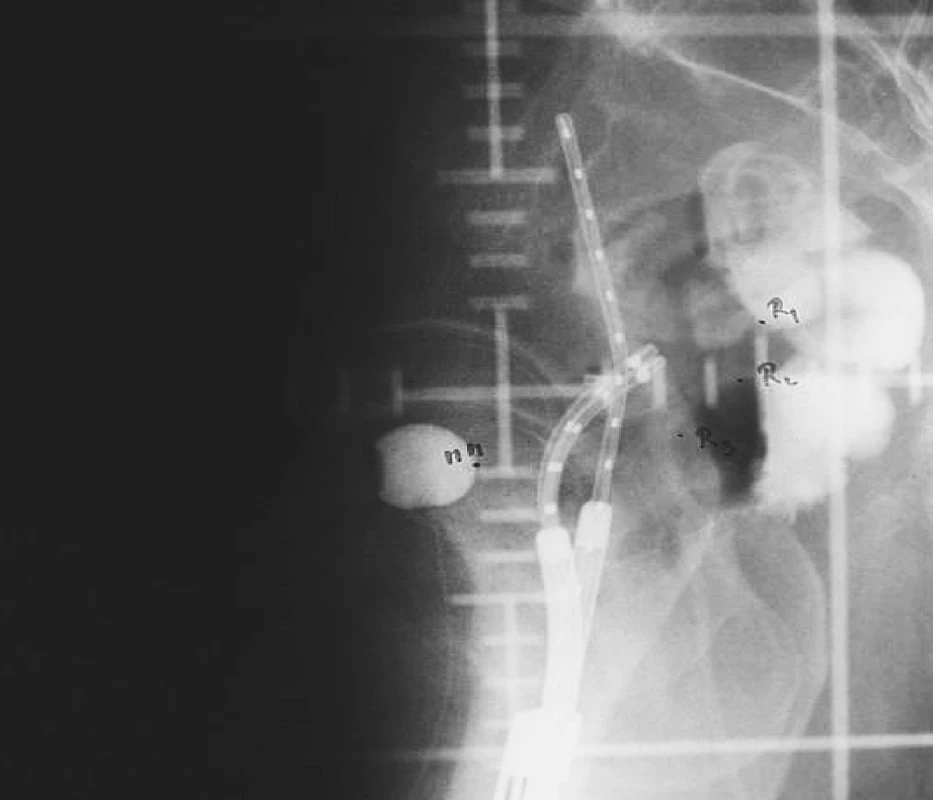
Obr. 3. Specifikace referenčních bodů pro rektum a močový měchýř dle doporučení ICRU N.38 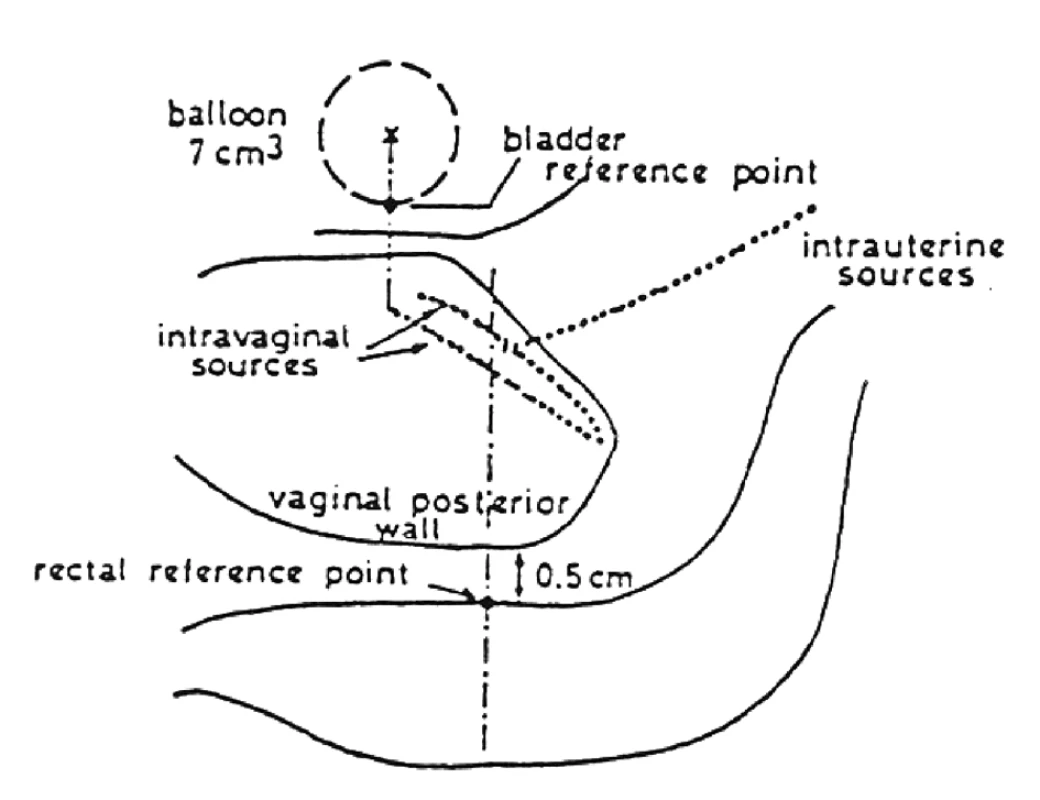
Obr. 4. Dávková distribuce v předozadním pohledu při konvenčním plánování brachyterapie 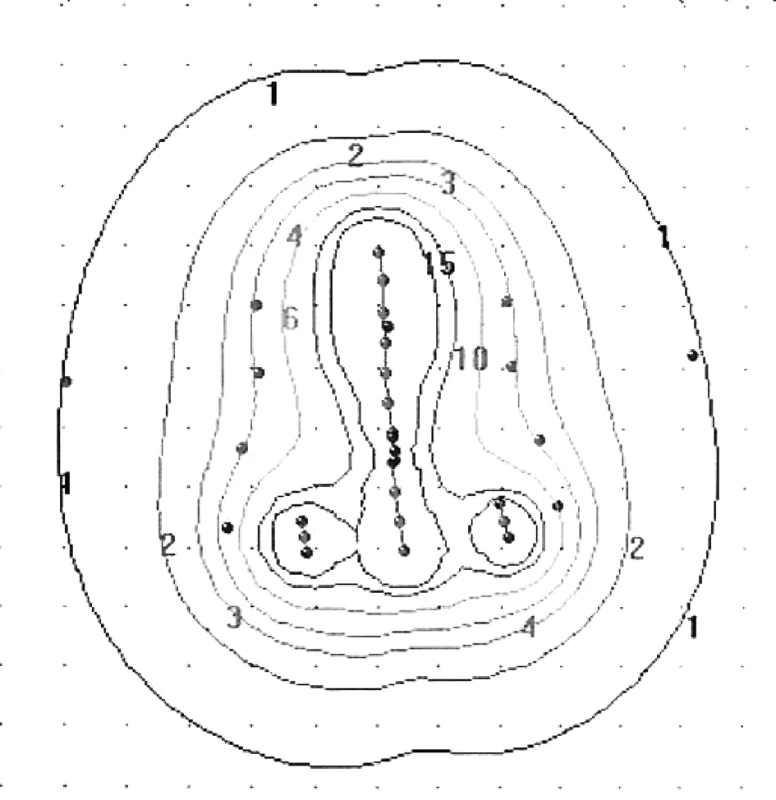
Je zřejmé, že bod A v žádném případě nereflektuje rozsah a uložení karcinomu [13]. Tato skutečnost může vést jednak k poddávkování tumoru či zbytečnému radiačnímu zatížení okolních tkání. Navíc specifikace referenčních bodů rizikových orgánů (zejména u močového měchýře) nekoreluje s maximální dávkou v orgánu a vznikem pozdních komplikací [1, 3].
3D BRACHYTERAPIE
3D plánovací programy využívají série CT obrazů a plánují rozložení dávky záření v prostoru. Plánovací systém je schopen konvertovat pracovní jednotky CT (Hounsfieldovy jednotky) na elektronovou denzitu. Pro objemovou kalkulaci dávky existují různé algoritmy, které zohledňují nehomogenitu tkání (různou elektronovou denzitu měkkých tkání, vzduchu, kostí). Plánovací systém umožňuje konturování oblastí zájmu. Optimalizace plánu se provádí po vyhodnocení objemových histogramů (dose-volume histogram DVH), které znázorňují expozici cílového objemu a rizikových orgánů způsobem, kdy je v grafu vyjádřen vztah mezi objemem orgánu nebo cílové struktury a velikostí dávky záření (viz obr. 6). Vývoj CT/MR kompatibilních aplikátorů vedl k rozvoji 3D plánování i v brachyterapii karcinomu děložního hrdla, při kterém se používají data z CT a MR řezů. První užití MR v plánování brachyterapie bylo publikováno v roce 1992, kdy Schoeppel prezentoval zkušenosti s konturací tumoru pomocí MR [14]. V roce 1998 bylo plánování 3D brachyterapie za využití magnetické rezonance zavedeno do klinické praxe v Univerzitní nemocnici ve Vídni.
Obr. 5. Rozložení dávky ve formě DVH (dose-volume histogramu) při 3D brachyterapii 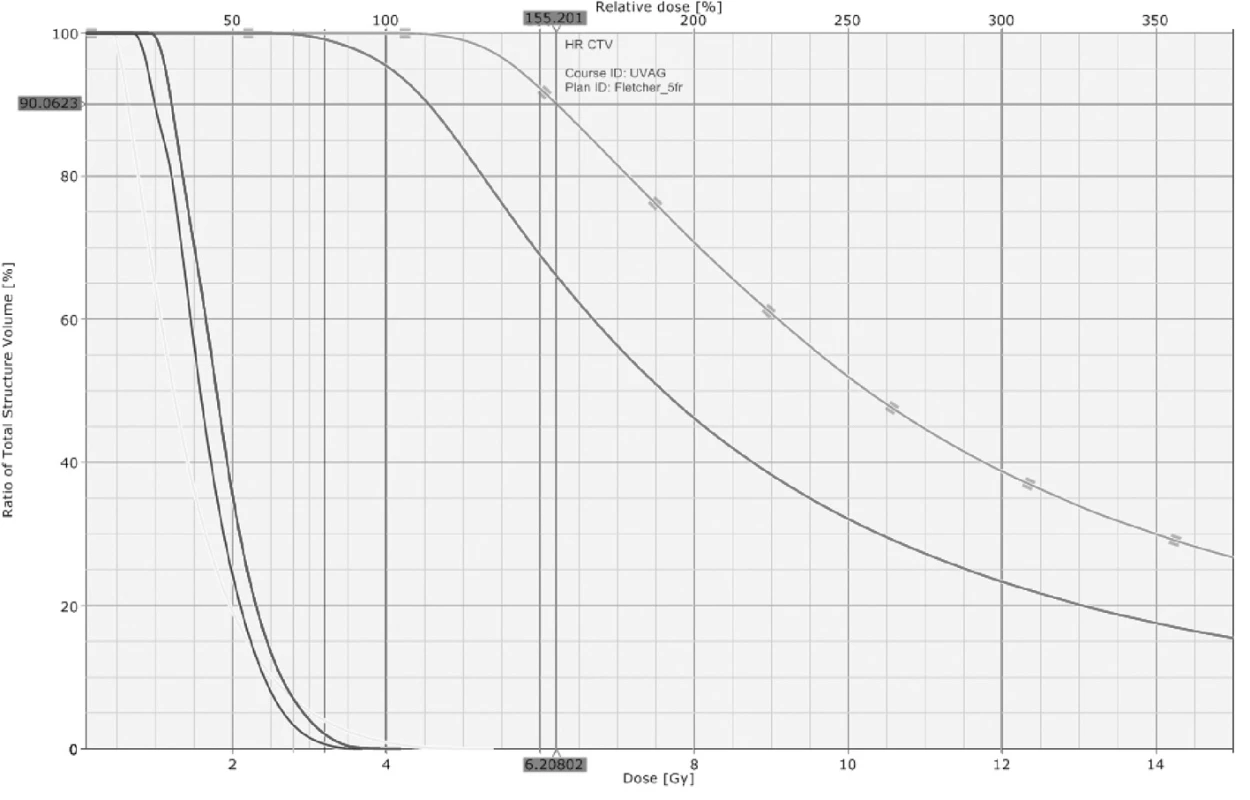
Užití CT a MR obrazů umožňuje přesné stanovení cílových objemů (GTV, CTV) a konturaci rizikových orgánů (močový měchýř, rektum, sigma) s následnou cílenou optimalizací plánů s ohledem na 3D topografii [3, 9, 12, 13]. CT obraz nám ozřejmí topografii aplikátorů a rizikových orgánů (viz obr. 5). Dávku v močovém měchýři i v rektu díky tomu můžeme ovlivnit ne v několika bodech (jako při plánování z rtg snímků), ale v celém objemu. Velkým přínosem brachyterapie založené na plánování z CT/MR je možnost konturace sigmatu, které ICRU No.38 zcela opomíjí, jelikož při konvenčním plánování nelze spolehlivě vizualizovat. Přitom se postižení sigmatu podílí na chronické gastrointestinální postradiační toxicitě téměř 50 %. CT obraz bohužel není přínosný při lokalizaci vlastního tumoru. Ten je dobře patrný na T2 sekvencích MR jako hypersignální útvar (viz obr. 7).
Obr. 6. Vizualizace rozložení dávky ve 3 rovinách při 3D brachyterapii 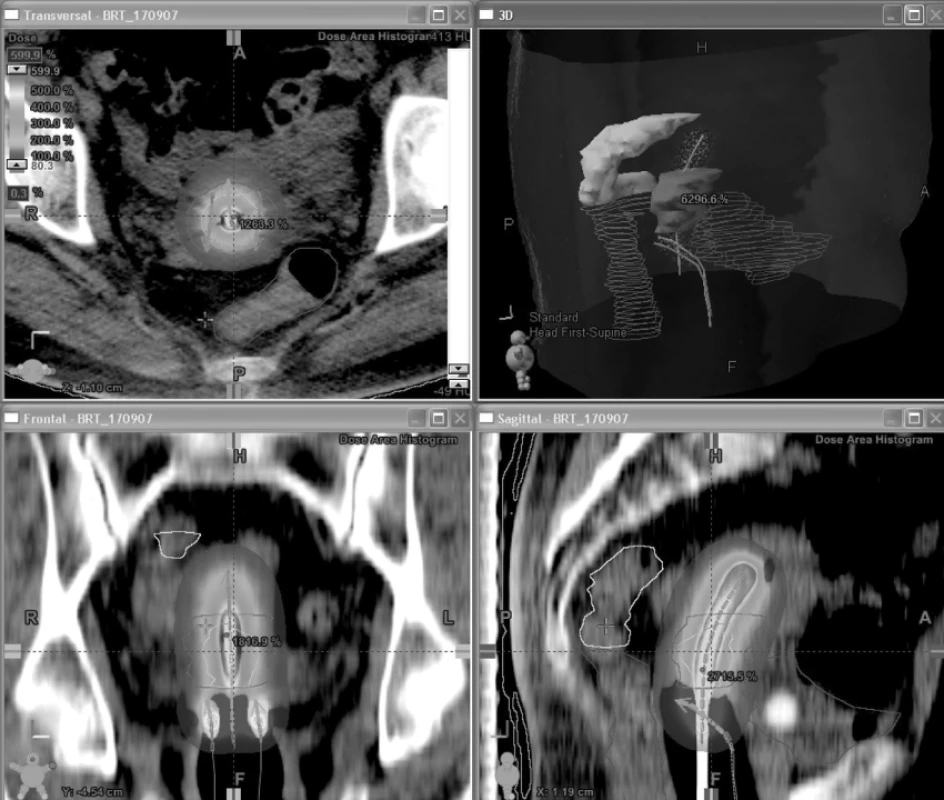
Obr. 7. Karcinom děložního hrdla a dávková distribuce při 3D plánování v transverzální rovině na CT a MR 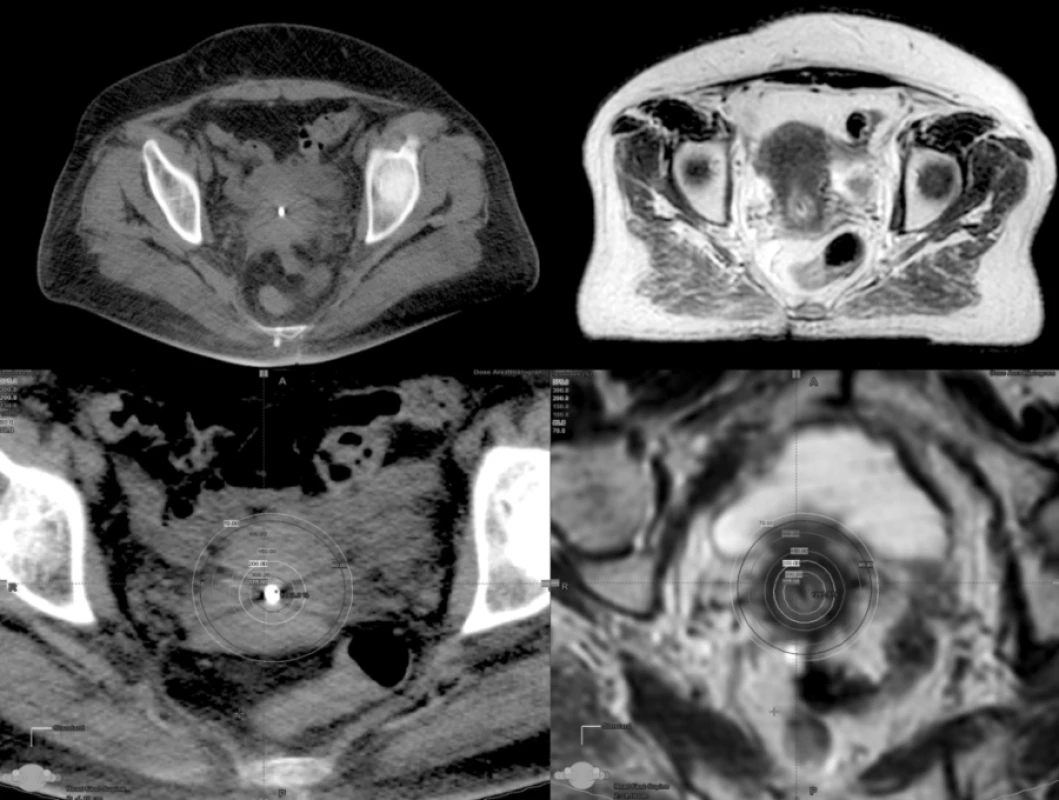
Vzhledem ke skutečnosti, že MR není standardním vybavením radioterapeutických pracovišt, je možno provést tzv. fúzi obrazu MR s plánovacím CT. Při ní použijeme MR pánve provedenou po ukončení teleterapie a CT řezy získané při jednotlivých BRT aplikacích. Fúzi provádíme se snahou o maximální shodu v oblasti děložního hrdla. CT obrazů využijeme ke konturaci rizikových orgánů a lokalizaci aplikátorů, MR v T2 sekvencích využijeme k zakreslení tumoru. Díky přesné znalosti topografie tumoru je možno ve většině případů individuálně plán upravit tak, abychom cíleně eskalovali dávku v oblasti tumoru a současně šetřili rektum, sigma a močový měchýř.
Vliv zobrazovacích metod na výsledný plán se zaměřením na konformitu cílového objemu a míru zatížení rizikových orgánů prezentoval Shin [13]. Pötter recentně publikoval pozitivní vliv 3D brachyterapie využívající k plánování MR na lokoregionální kontrolu i celkové přežití [9].Největší klinický přínos byl (nepočítaje redukci toxicity) ve zlepšené lokální kontrole i celkovém přežití u pacientek s tumory nad 5 cm. U těchto nemocných byl rozdíl statisticky signifikantní, přestože celý soubor měl pouze 145 nemocných. Jde o nálezy, u kterých specifikace dávky do virtuálního bodu A vede k poddávkování tumoru.
Gynaecological (GYN) GEC-ESTRO Working Group vydala v roce 2005 doporučení pro 3D brachyterapii týkající se stanovení cílových objemů [4]. Umožnila nalézt společný koncept a terminologii pro rozdílné klinické přístupy a užívané zdroje záření (LDR, HDR i PDR).
Doporučuje rozlišení High Risk Clinical Target Volume a Intermediate Risk Clinical Target Volume:
„High Risk“ Clinical Target Volume (HR CTV)
HR CTV je oblast největšího rizika lokální recidivy, tedy reziduální makroskopická nemoc v době brachyterapie. Zahrnuje vlastní tumor (GTV), celý cervix a extracervikální porci tumoru v době brachyterapie.
„Intermediate Risk“ Clinical Target Volume (IR CTV)
IR CTV odpovídá původnímu rozsahu tumoru v době diagnózy. Jde tedy o reziduální mikroskopickou nemoc odpovídající v ICRU No 38 oblasti LD 60 Gy. Zahrnuje High Risk CTV s lemem 5-15 mm podle lokalizace tumoru, potenciálního šíření, regrese nemoci a léčebné strategie.
Užití 3D brachyterapie přineslo změny i do specifikace dávky. Mimo obligátního bodu A jsou udávány rovněž parametry PD, D100 a D90 pro GTV, HRCTV i IRCTV a D0.1cc, D1cc a D2cc pro rizikové orgány (rektum, močový měchýř, sigmoideum). Dávku je vhodné uvádět i ekvivalentní formě EQD2, odpovídající dávce při konvenční frakcionaci 2 Gy/den při 5 frakcích za týden, k možnému součtu s dávkou z teleterapie [10].
- D100 – minimální dávka obsažená ve 100 % objemu;
- D90 – minimální dávka obsažená ve 90 % objemu;
- D0.1cc – minimální dávka obsažená v 0.1 cm3 objemu;
- D1cc – minimální dávka obsažená v 1 cm3 objemu;
- D2cc – minimální dávka obsažená v 2 cm3 objemu;
- PD - předepsaná dávka.
Metodika plánování 3D brachyterapie
Pacientky po vstupním vyšetření (včetně MR) absolvují chemoradioterapii pánve LD 45 Gy a 1,8 Gy v 25 frakcích za potenciace cisDDP weekly 40 mg/m2. Po ukončení zevního ozáření provedeme kontrolní MR pánve, které využijeme k fúzi s CT řezy získanými při jednotlivých BRT aplikacích. Fúzi provádíme se snahou o maximální shodu v oblasti děložního hrdla. Data z počítačové tomografie použijeme ke konturaci rizikových orgánů (rektum, sigma, močový měchýř) a lokalizaci sondy s ovoidy, data z magnetické rezonance v T2 sekvencích využijeme k zakreslení cílového objemu GTV, HR CTV a IR CTV. Při plánovaní je naší snahou optimalizovat výsledný plán tak, aby kumulativní ekvivalentní D90 HR CTV z teleterapie a 6 frakcí brachyterapie byla 80-85 Gyαβ10 při minimálním zatížení rizikových orgánů. Pacientky s lokálně pokročilým karcinomem, u kterých nedojde po chemoradioterapii pánve k významné léčebné odpovědi, absolvují dozáření makroskopické nemoci v oblasti parametrií či pánevních uzlin formou zevního ozáření s krytím rizikových orgánů.
ZÁVĚR
Plánování pomocí CT a MR umožňuje vizualizaci hrdla, těla děložního, pochvy, lymfatických uzlin, rizikových orgánů a zejména tumoru ve všech rovinách. Dovoluje individuální stanovení GTV a CTV dle skutečného rozsahu tumoru. 3D brachyterapie založená na plánování pomocí CT/MR tak přináší v léčbě karcinomu děložního hrdla ve srovnání s konvenčním plánováním možnost cílené eskalace dávky na oblast tumoru s významným šetřením rizikových orgánů.
MUDr. Martin Doležel
KOC
Pardubická krajská nemocnice a.s.
Multiscan s.r.o.
532 03 Pardubice
Zdroje
1. Barillot, I., Horiot, J., Maingon, P., et al. Maximum and mean Bladder dose defined from ultrasonography: Comparison with the ICRU reference in gynaecological brachytherapy. Radiother Oncol, 1994, 30, p. 231-238.
2. Devlin, P. Brachytherapy: Applications and techniques. Philadelphia, 2007.
3. Fellner, C., Pötter, R., Knocke, T., et al. Comparison of radiography-and computed tomography-based treatment planning in cervix cancer in brachytherapy with specific attention to some quality assurance aspects. Radiother Oncol, 2001, 58, p. 53–62.
4. Haie-Meder, C., Potter, R., Van Limbergen, E., et al. Recommendations from Gynaecological (GYN) GEC-ESTRO Working Group(I): Concepts and terms in 3D image based 3D treatment planning in cervix cancer brachytherapy with emphasis on MRI assessment of GTV and CTV. Radiother Oncol, 2005, 74, p. 235-245.
5. Incidence nádorů v ČR 2007. Praha: ÚZIS ČR, NOR ČR, 2007.
6. International Commissionon Radiation Units and Measurements (ICRU). Dose and volume specification for reporting intracavitary therapy in gynaecology. ICRU report 38. Bethesda, 1985.
7. Lanciano, R., Martz, K., Coia, L., et al. Tumor and treatment factors improving outcome in stage III-B cervix cancer. IJROBP, 1991, 28, p. 95-100.
8. Montana, G., Fowler, W., Varia, M., et al. Carcinoma of the cervix, stage III. Results of radiation therapy. Cancer, 1986, 57, p. 148-154.
9. Pötter, R., Dimopoulos, J., Georg, P., et al. Clinical impact of MRI assisted dose volume adaptation and dose escalation in brachytherapy of locally advanced cervix cancer. Radiother Oncol, 2007, 83, p. 148-155.
10. Pötter, R., Haie-Meder, C., Van Limbergen, E., et al. Recommendations from gynaecological (GYN) GEC ESTRO working group(II): concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy -3D dose volume parameters and aspects of 3D image-based anatomy, radiationphysics, radiobiology. Radiother Oncol, 2006, 78, p. 67–77.
11. Perez, C., Brady, L., Halperin, E. Principles and Practice of Radiation Oncology. 4th Ed. Philadelphia, 2004.
12. The GEC ESTRO Handbook of Brachytherapy, Ed. Gerbaulet, A., Potter, R., Mazeron, J.J., et al. 2003.
13. Shin, K., Kim, T., Cho, J., et al. CT-guded intracavitary radiotherapy for cervical cancer: Comparison of conventional Point A plan with clinical target volume-based 3D plan using dose-volume parameters. IJROBP, 2006, 64, p. 197-204.
14. Schoeppel, S., Ellis, J., LaVigne, M., et al. Magnetic rezonance imaging during intracavitary gynecologic brachytherapy. IJROBP, 1992, 23, p. 169-174.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2008 Číslo 3- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Význam PET v radioterapii karcinomu děložního hrdla – výsledky pilotní studie
- Chemorezistence/chemosenzitivita ovariálního karcinomu – kazuistika
- Pokroky v léčbě karcinomu děložního hrdla – 3D plánování HDR brachyterapie pomocí CT/MR
- Neinvazivní detekce gonozomálních DNA sekvencí v plazmě gravidních žen s využitím kapilární elektroforézy
- Předčasný odtok plodové vody a Ureaplasma urealyticum
- Možnosti screeningu Downova syndromu v České republice
- Přežívání dětí narozených s vrozenou vadou v průběhu 1. roku života
- Prenatální diagnostika vybraných typů vrozených vad v České republice: 1994 - 2006
- Rekurentní vulvovaginální kandidóza – současný stav problematiky a léčebné možnosti
- Současné poznatky o etiopatogenezi děložních myomů
- Sklerozující stromální tumor – vzácný gonadostromální nádor ovaria
- Poporodní netraumatická zlomenina křížové kosti: kazuistika a biomechanické poznámky
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Předčasný odtok plodové vody a Ureaplasma urealyticum
- Poporodní netraumatická zlomenina křížové kosti: kazuistika a biomechanické poznámky
- Sklerozující stromální tumor – vzácný gonadostromální nádor ovaria
- Současné poznatky o etiopatogenezi děložních myomů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



