-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné možnosti léčby anémie spojené s myelodysplastickým syndromem s nižším rizikem
19. 4. 2023
Loni publikovaný přehledový článek francouzských autorů se věnuje aktuálním terapeutickým možnostem u anémie spojené s myelodysplastickým syndromem (MDS) s nižším rizikem.
Úvod
V současné době je stále více pozornosti věnováno možnostem léčby anémie při myelodysplastickém syndromu s nižším rizikem u refrakterních pacientů nebo těch se ztrátou odpovědi na erytropoezu stimulující látky (ESA). Nedávno byl v indikaci léčby anémie provázející MDS s prstenčitými sideroblasty, která je refrakterní na ESA, registrován luspatercept. Zjištěn byl přínos lenalidomidu z hlediska obnovy erytropoezy po přidání k ESA u pacientů s MDS s nižším rizikem bez delece 5q, kteří jsou závislí na transfuzích po selhání ESA v porovnání se samotným lenalidomidem. Identifikace dalších prognosticky nepříznivých faktorů by mohla pomoci určit skupinu nemocných, u nichž může být přínosem azacitidin. Zkoumány jsou i další terapeutické možnosti přidávané k EPO jako inhibitory telomerázy, stabilizátory hypoxických inducibilních faktorů (HIF) a látky modifikující metabolismus železa.
InzerceMDS s nižším rizikem
MDS je heterogenní skupina klonálních poruch hematopoetických buněk. Vyskytuje se převážně ve vysokém věku a je charakterizován neefektivní hematopoézou vedoucí k cytopenii, jež je v kontrastu s hypercelularitou kostní dřeně. MDS provází riziko transformace do akutní myeloidní leukémie (AML, asi ve 30 % případů).
Terapie se odvíjí od skóre rizika stanoveného pomocí revidovaného systému IPSS (International Prognostic Scoring System). U pacientů s MDS s nižším rizikem je hlavním cílem léčby řešení cytopenií, protože riziko transformace do AML je relativně nízké. Cíle léčby zahrnují také zvýšení/udržení kvality života a prodloužení přežití. Léčba by vzhledem k vysokému věku pacientů měla mít co nejnižší toxicitu. Nejčastější cytopenií u MDS s nižším rizikem je anémie, která postihuje přes 80 % pacientů. Léčba zahrnuje opakované transfuze červené krevní řady, ale stále více se uplatňují ESA.
Aktuální možnosti terapie
Transfuze
Častým terapeutickým postupem u MDS s nízkým rizikem, zejména po selhání ESA, jsou opakované transfuze erytrocytů. Jejich dlouhodobé podávání s sebou ovšem nese nevýhody, jako je určité riziko infekce, hemolýzy nebo přetížení cirkulace. Proto je snahou korigovat anémii u těchto nemocných léčivy zvyšujícími tvorbu erytrocytů. Opakované transfuze jsou rovněž spojené s potřebou chelatační terapie z důvodu nadměrné saturace transferinu a přítomnosti volného labilního železa v plazmě, které může vést k dysfunkci srdce, jater a pankreatu a také k progresi onemocnění. Doporučeno je monitorování hladiny ferritinu, obvykle s prahovou hodnotou pro zahájení chelatační léčby 1000 ng/ml, která je ale stále diskutována.
Erytropoezu stimulující látky
Podávání ESA zjevně neovlivňuje progresi MDS s nižším rizikem ani riziko transformace do AML. U pacientů s odpovědí na léčbu ale prodlužuje přežití. ESA byly v EU schváleny v indikaci MDS s nižším rizikem na základě studií EPOANE, ve které vedl epoetin alfa k dosažení odpovědi (HI‐E − hematologické zlepšení červené krevní řady) u 31,8 % pacientů (oproti 4,4 % s placebem), a ARCADE, v níž byla léčba darbepoetinem spojena s dosažením HI‐E u 14,7 % pacientů (vs. 0 % u placeba) a s poklesem podílu pacientů závislých na transfuzích z 59 na 26 %.
V současné době jsou k dispozici biosimilární přípravky s epoetinem alfa a beta, které vykazují plnou bioekvivalenci. Studie ukazují podíl 30–60 % odpovědí na léčbu těmito přípravky v dávce 10 000–20 000 j. 3× týdně (zvýšení hladiny hemoglobinu a nezávislost na transfuzích) u MDS s nižším rizikem, přičemž při dávkování 60 000 j. 1× týdně je podíl odpovědí podobný a kvalita života pacientů vyšší. Darbepoetin alfa je glykovaný derivát rekombinantního erytropoetinu s dlouhodobějším účinkem. V dávce 300 μg 1× týdně vedl k odpovědi na léčbu v 63 %. Většina odpovědí byla pozorována během prvních 12 týdnů, někdy i později a medián trvání odpovědi byl zhruba 2 roky. Podle nových kritérií z roku 2018 se HI-E a závislost na transfuzích hodnotí až po 16–24 týdnech, nikoliv po 8.
Lepší odpověď na ESA vykazují pacienti bez předchozí transfuzní léčby (podíl odpovědí 66 vs. 37 %) a také pacienti s časnějším zahájením léčby ESA do 6 měsíců po stanovení diagnózy (podíl odpovědí 76 vs. 46 %). Mezi hlavní prediktory odpovědi na ESA patří rovněž míra závislosti na transfuzích (s hranicí 2 jednotky erymasy za měsíc) a hladina endogenního erytropoetinu (s hranicí 500 IU/l). Tvoří skóre (0–2), které určuje 74%, 23% nebo 7% pravděpodobnost odpovědi na ESA u pacientů s MDS. Nižší šance na odpověď a kratší délka odpovědi je zaznamenána u pacientů s MDS s nízkým rizikem, kteří mají deleci 5q. V poslední době lze k predikci odpovědi na ESA využít další 2 faktory – skóre RED a poměr hepcidin : ferritin.
Terapeutické možnosti při ztrátě odpovědi na ESA
Primární refrakternost na ESA, tj. absence odpovědi po 8–12 týdnech, se vyskytuje přibližně u poloviny pacientů s MDS a k sekundární rezistenci na tuto léčbu, tj. ztrátě odpovědi (v mediánu po 2 letech) dochází u 26 % nemocných.
Lenalidomid
Lenalidomid byl nejprve používán k léčbě pacientů s MDS s delecí 5q, u nichž eliminoval nebo snižoval potřebu transfuzí v 67, respektive 76 %. Poté byl hodnocen u pacientů s MDS s nižším rizikem závislých na transfuzích bez delece 5q, kteří vykázali refrakternost nebo nemohli dostávat ESA. Lenalidomid vedl k dosažení nezávislosti na transfuzích u 27 % z nich, přičemž u podskupiny pacientů s hladinou endogenního erytropoetinu < 100 IU/l, kteří dříve užívali ESA, činil tento podíl 42,5 %. Za prediktor odpovědi na lenalidomid tedy dnes nelze považovat žádnou somatickou mutaci.
Přínos lenalidomidu z hlediska obnovy erytropoezy byl také zjištěn po jeho přidání k ESA u pacientů s MDS s nižším rizikem bez delece 5q závislých na transfuzích po selhání ESA v porovnání se samotným lenalidomidem. Po 4 cyklech dosáhl podíl odpovědí 23,1 % se samotným lenalidomidem a 39,4 % při kombinaci lenalidomid + EPO beta, s mediánem trvání odpovědi 15–18 měsíců. Významný rozdíl nebyl zjištěn z hlediska dosažení nezávislosti na transfuzích (13,8 vs. 24,2 %).
Za zmínku ale stojí hematologická toxicita této léčby zahrnující 62 % pacientů s neutropenií a 36 % s trombocytopenií stupně 3–4, což znamenalo snížení dávky u 40 % pacientů.
Demethylační látky
5‐azacitidin podávaný po dobu 5 dní samotný nebo po přidání k ESA (60 000 IU/týden) dosáhl srovnatelného podílu léčebných odpovědí (16–18 %) při významné toxicitě. Perorální azacitidin u pacientů s MDS s nízkým rizikem, anémií závislou na transfuzích a trombocytopenií významně zvýšil šanci na dosažní nezávislosti na transfuzích a zvýšil počet erytrocytů i trombocytů, ale v souvislosti s jeho podáváním se objevila předčasná úmrtí. Nemusí tedy být vhodný u všech typů pacientů.
Luspatercept
Novou terapeutickou možností u anémie spojené s MDS jsou látky, které vykazují antagonistický účinek na aktivinové receptory. Luspatercept podávaný s.c. 1× za 3 týdny byl schválen na základě výsledků studie MEDALIST k léčbě dospělých pacientů s anémií závislou na transfuzích v důsledku MDS s prstenčitými sideroblasty velmi nízkého, nízkého a středního rizika, kteří vykázali nedostatečnou léčebnou odpověď na ESA nebo pro tuto terapii nejsou způsobilí. Tito pacienti jsou přetíženi železem ještě před dosažením závislosti na transfuzích a terapeutické možnosti u nich chybějí. U 90 % z nich je zjištěna mutace SF3B1. Ve studii MEDALIST dosáhli pacienti s luspaterceptem nezávislosti na transfuzích erytrocytů ve 38 % případů v porovnání s 13 % na placebu.
Chelatační terapie
Deferasirox u MDS s nižším rizikem prokázal in vitro ochranu progenitorových buněk červené krevní řady před apoptózou, příznivý vliv na jejich proliferaci a potlačení zánětlivého charakteru mikroprostředí. Probíhá klinická studie, která hodnotí deferasirox v nízké dávce u pacientů s MDS s nižším rizikem a rezistencí na léčbu ESA nebo po relapsu při této léčbě.
Imetelstat
U MDS s nižším rizikem byl hodnocen také inhibitor telomerázy imetelstat. Ve studii fáze II prokázal dosažení nezávislosti na transfuzích u 37 % pacientů po 8 týdnech a u 23 % po 24 týdnech s mediánem trvání odpovědi 86 týdnů. Jeho nevýhodou je však cytopenický efekt na ostatní krevní řady.
Roxadustat
Roxadustat podporuje erytropoezu zvýšením endogenního erytropoetinu. Stabilizuje hypoxické inducibilní faktory (HIF), čímž zvyšuje počet receptorů pro erytropoetin v kostní dřeni a zlepšuje metabolismus železa a jeho biologickou dostupnost. Původně byl vyvinut pro léčbu anémie u chronického renálního onemocnění nebo při dialýze. Ve studii MATTERHORN u pacientů s MDS s nižším rizikem vedl k dosažení nezávislosti na transfuzích v 37,5 % případů po 28 a 52 týdnech a k 50% snížení potřeby transfuzí u 54,2 % pacientů po 28 týdnech a 58,3 % po 52 týdnech.
Alogenní transplantace hematopoetických buněk
U pacientů s MDS s nižším rizikem je využití této metody stále kontroverzní.
Obr. Různé mechanismy účinku využívané v léčbě anémie
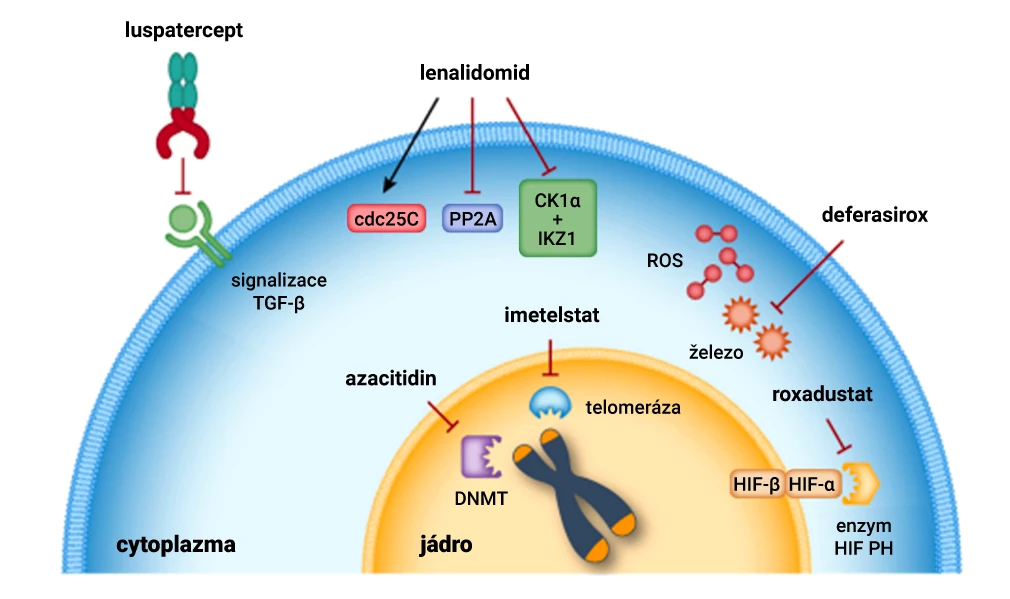
Pozn.: Cdc25C – cell division cycle 25C (fosfatáza regulující buněčný cyklus); CK1α – kaseinkináza 1α; DNMT – DNA methyltransferáza; HIF – hypoxické inducibilní faktory; IKZ – Ikaros family zinc finger protein (transkripční faktor regulující vývoj imunitních buněk); PH – prolylhydroxyláza; PP2A – proteinfosfatáza 2A; ROS – reaktivní formy kyslíku; TGF-β – transformující růstový faktor beta.
(zza)
Zdroj: Meunier M., Park S. Lower-risk myelodysplastic syndromes: current treatment options for anemia. EJHaem 2022 Aug 12; 3 (4): 1091−1099, doi: 10.1002/jha2.523.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Hematologie a transfuzní lékařství Praktické lékařství pro dospělé
Nejčtenější tento týden- AUDIO: (Jak) je možné prodloužit si život?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Koordinátoři onkologické péče zkrátí pacientům cestu systémem. Jak to bude fungovat v praxi?
- 4× stručně ke zpřesnění diagnostiky civilizačních chorob – „jednohubky“ z klinického výzkumu 2026/5
- Původní český test ALBA pro odhalení mírných kognitivních deficitů získal certifikaci MZ ČR
Mohlo by vás zajímat- Zvýšené krvácivé tendence u přenašeček hemofilie A
- Kazuistika: Neobvyklá příčina prodlouženého APPT u SLE – získaná hemofilie a lupus antikoagulans
- Sport nemění u zdravých mužů skóre HJHS
- Ekonomický význam léčby krvácení u pacientů s inhibitorem pomocí rFVIIa
- Dentální extrakce u hemofiliků
- Rizikové faktory pro rozvoj inhibitorů u dětí s hemofilií – výsledky kohortové studie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



