-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výskyt osteoporózy u pacientov na substitučnej liečbe hypokorticizmu u Addisonovej choroby
Introduction: Patients with primary adrenal insufficiency receive long – term glucocorticoid replacement therapy, which may cause osteoporosis
Aim of the study: The aim of the study was to assess the effect of glucocorticoid replacement therapy in patients with Addison´s disease on bone mineral density (BMD), parameters of calcium – phosphate (Ca-P) metabolism as well as on bone turneover markers.
Patients and methods: The study group consisted of 46 patients with Addison´s disease (12men, 17 pre - and 17 postmenopausal women, the control group consisted of 44 healthy individuals (8 men, 16 prepre - and 16 postmenopausal women). Ca-P metabolism parameters, bone turnover markers and adrenal hormones were examined in all groups. BMD was measured by dual-energy X-ray absorptiometry in the lumbar spine (BMD lumb) and forearm (BMDfore).
Results: We did not confirm an increased prevalence of osteoporosis and osteopenia in patients with Addison´s disease. BMD values did not correlate with hydrocortisone (HCT) doses, HCT doses calculated on body weight and body surface area as well as with duration of substitution treatment. Patients with daily HCT doses > 25 mg had significantly lower BMD in lumbar spine compared with patients with daily HCT doses ≤ 25 mg. In study group we observed decreased levels of adrenal androgens, in women also estradiol. Decreased level of serum calcium and increased level of osteocalcin, bone alkaline phosphatase, 25 - hydroxyvitamin D were present in women with Addison´s disease. RANKL/OPG ratio was higher in patients with Addison´s disease compared with controls.
Conclusion: Glucocorticoid replacement therapy is not a significant risk factor for development of osteoporosis in patients with Addison’ disease, because this therapy only physiologically replaces endogenous cortisol deficiency. An increased RANKL / OPG ratio may indicate a relative lack of OPG. It is possible that female patients, despite adequate substitution, have an increased bone turnover and a relatively higher risk of decrease in BMD. Potential risks are higher doses of glucocorticoid replacement therapy (HCT > 25 mg daily) and a typical steroid constellation (decreased adrenocortical androgens DHEA and DHEAS and in women also estradiol).
Keywords:
osteoporosis – bone mineral density – Addison’s disease – glucocorticoid replacement therapy
Autoři: Peter Vaňuga; Ivana Ságová
Působiště autorů: Národný endokrinologický a diabetologický ústav, Ľubochňa
Vyšlo v časopise: Vnitř Lék 2021; 67(5): 264-269
Kategorie: Hlavní téma
Souhrn
Úvod: Pacienti s primárnou adrenálnou insuficienciou vyžadujú dlhodobú glukokortikoidnú substitučnú liečbu, ktorá môže byť príčinou vzniku osteoporózy.
Cieľ práce: Cieľom práce bolo posúdenie vplyvu glukokortikoidnej substitučnej liečby na kostnú denzitu (BMD), parametre kalciovo-fosfátového (Ca-P) metabolizmu ako aj vybrané kostné markery. Pacienti a metódy: Študijnú skupinu tvorilo 46 pacientov s Addisonovou chorobou (12 mužov, 17 pre - a 17 postmenopauzálnych žien), kontrolnú skupinu tvorilo 44 zdravých jedincov (8 mužov, 16 pre - a 16 postmenopauzálnych žien). U všetkých boli vyšetrené parametre Ca-P metabolizmu, kostné markery a nadobličkové hormóny. BMD bola stanovená metódou DXA v oblasti lumbálnej chrbtice (BMDlumb) a v oblasti predlaktia (BMDfore).
Výsledky: Nepotvrdili sme zvýšenú prevalenciu osteoporózy resp. osteopénie u pacientov s Adisonovou chorobou. Hodnoty BMD nekorelovali s dávkami hydrokortizónu (HCT), dávkami HCT kalkulovanými na telesnú hmotnosť a telesný povrch ako aj s dĺžkou trvania substitučnej liečby. Pacienti s dennou dávkou HCT > 25 mg mali signifikantne nižšiu BMD v lumbálnej oblasti oproti skupine liečenej s dennou dávkou HCT ≤ 25 mg. V študijnej skupine sme zaznamenali znížené hladiny adrenálnych androgénov, u žien aj estradiolu. U žien s Addisonovou chorobou bola prítomná znížená hladina sérového kalcia a zvýšená hladina osteokalcínu, kostného izoenzýmu alkalickej fosfatáty ako aj 25-hydroxyvitamínu D. U pacientov s Addisonovou chorobou bol potvrdený zvýšený pomer RANKL/OPG v porovnaní s kontrolnou skupinou.
Záver: Glukokortikoidná substitučná liečba nie je významným rizikovým faktorom zvýšenej prevalencie osteoporózy u pacientov s Addisonovou chorobou, nakoľko len fyziologicky nahrádza deficit endogénneho kortizolu. Zvýšený pomer RANKL/ OPG môže svedčiť pre relatívny nedostatok OPG. Možno tak predpokladať, že pacienti ženského pohlavia majú napriek adekvátnej substitúcii zvýšený kostný obrat, a tým aj relatívne vyššie riziko znižovania BMD. Potenciálne riziko predstavujú vyššie dávky glukokortikoidnej substitučnej terapie (HCT v dávke > 25 mg denne) a typická konštelácia steroidov (znížené adrenokortikálne androgény DHEA a DHEAS, u žien aj estradiol).
Klíčová slova:
osteoporóza – Addisonova choroba – glukokortikoidná substitučná terapia – kostná denzita
Úvod
Primárna adrenálna insuficiencia (Addisonova choroba) je zriedkavé ochorenie, ktoré je spôsobené najčastejšie autoimunitnou deštrukciou kôry nadobličiek. Liečba Addisonovej choroby (AD) pozostáva zo substitučnej liečby mineralokortikoidmi a glukokortikoidmi, substitúcia glukokortikoidmi často prevyšuje ich fyziologickú produkciu v nadobličkách (1, 2). Súčasná terapia AD využíva rôzne generické glukokortikoidy (hydrokortizón, dexametazón, prednizón) bez štandardného liečebného režimu. Kortizolémia pri perorálnej substitučnej liečbe hydrokortizónom prudko stúpa na suprafyziologické hladiny po podaní s následným prudkým poklesom v priebehu niekoľkých hodín, čím dochádza k eliminácii fyziologického cirkadiánneho rytmu kortizolu (3). Možnosťou liečby u pacientov s AD je Chronocort – prípravok s riadeným uvoľnovaním hydrokortizónu podávaný 2× denne (ráno a večer) s napodobnením cirkadiánneho rytmu kortizolu, účinný aj na kontrolu nadbytku androgénov (4). Štúdie preukázali zhoršenie zdravotného stavu a kvality života u pacientov s Addisonovou chorobou, čo naznačuje, že substitučná liečba nie je optimálna (5–7). Glukokortikoidy urýchľujú stratu kostnej hmoty inhibíciou osteoblastov, aktiváciou osteoklastov a inhibíciou intestinálnej resorbcie vápnika závislej od vitamínu D. U pacientov s Addisonovou chorobou je prítomný aj deficit androgénov, čo predstavuje ďalší rizikový faktor pre vznik osteoporózy. V patogenéze osteoporózy pri Addisonovej chorobe sa môžu uplatňovať aj zmeny v systéme RANK/RANKL (receptor aktivátor nukleárneho faktora kappa B / receptor aktivátor nukleárneho faktora kappa B ligand) a osteoprotegerín (OPG) (8). OPG a RANKL sú proteíny odvodené od osteoblastov, kľúčové pre reguláciu kostnej hmoty. RANKL stimuluje resorpciu kostí zvyšovaním diferenciácie, aktivácie a prežitia osteoklastov. OPG je návnadový receptor pre RANKL inhibujúci resorpciu kostí. Doposiaľ nemáme dostatočné množstvo informácií ohľadne individuálnej náchylnosti a jej význame v patogenéze glukokortikoidmi indukovanej osteoporózy a to aj u pacientov s Addisonovou chorobou. Jedno-nukleotidové polymorfizmy v génoch riadiace metabolizmus aj účinok glukokortikoidov môžu byť zodpovedné za túto náchylnosť. Glukokortikoidy predstavujú substráty pre efluxný transmembránový transposrtér P-glykoproteínu (kódovaný na ATP-binding cassette B1 (ABCB1) génu) (9–11). Polymorfizmy v tomto géne sú spájané so zmenenými farmakokinetickými a farmakodynamickými vlastnosťami mnohých liekov (12–15). Polymorfizmus rs1045642 v efluxnom transportéri P-glykoproteínu je spojený s BMD u pacientov s Addisonovou chorobou a môže byť dôležitý pre náchylnosť na osteoporózu vyvolanú glukokortikoidmi (15). Hoci vysoké dávky steroidov sú známym rizikovým faktorom pre vznik osteoporózy, štúdie zaoberajúce sa kostnou denzitou (BMD) u hypoadrenálnych pacientov na substitučnej kortikoterapii sú nejednoznačné (16–20). Taktiež hodnotenie markerov kostného obratu neposkytlo jednoznačný pohľad na špecifické vlastnosti kostného obratu u týchto pacientov (21–25). Na túto tému bolo doposiaľ realizované nedostatočné množstvo štúdií. V našej štúdii realizovanej v NEDU Ľubochňa sme posudzovali vplyv substitučnej glukokortikoidnej liečby u pacientov s Addisonovou chorobou na BMD, parametre kalciovo – fosfátového metabolizmu ako aj na markery kostného obratu.
Pacienti a metódy
Študijnú skupinu tvorilo 46 pacientov (12 mužov, 17 žien v reprodukčnom veku a 17 postmenopauzálnych žien) s Addisonovou chorobou. Vekový priemer sledovanej skupiny bol 48,2 ± 8,8 roka (vekové rozpätie od 24 do 67 rokov). Diagnóza Addisonovej choroby bola u pacientov stanovená na základe kombinácie typického klinického obrazu a konštelácie laboratórnych parametrov. Etiologicky bola v 45 prípadoch podkladom ochorenia autoimunitná adrenalitída, v 1 prípade X-viazaná adrenoleukodystrofia. Priemerná dĺžka trvania ochorenia bola 9,8 ± 6,1 roka. Pacienti s Addisonovou chorobou boli na adekvátnej substitučnej liečbe mineralokortikoidmi a glukokortikoidmi. Do štúdie boli zaradení iba pacienti so stabilizovanými dávkami HCT, bez podozrenia na incompliance, poddávkovanie, resp. overdozáž substitučnej liečby HCT (dáta neuvádzané). Okrem substitučnej liečby hypokorticizmu 22 pacientov zároveň užívalo levotyroxín ako substitučnú liečbu primárnej hypotyreózy; tri pacientky mali hormonálnu substitučnú terapiu. Vylúčení boli pacienti so súčasnou pozitivitou autoprotilátok proti parietálnym bunkám a/alebo histologicky potvrdenou chronickou atrofickou gastritídou, resp. pozitivitou autoprotilátok proti tkanivovej transglutamináze a/alebo histologicky diagnostikovanou celiakiou. Priemerná denná dávka HCT podávaného ako substitučná liečba bola 23,9 ± 8,3 mg (s rozmedzím od 5 do 45 mg), priemerná denná dávka kalkulovaná na telesný povrch pacientov bola 14,7 ± 4,8 mg/m2. Podľa celkovej dennej dávky HCT sme pacientov rozdelili do dvoch podskupín: skupinu s dávkou HCT ≤ 25 mg (n = 29; z toho 1 muž) a skupinu s dávkou HCT > 25 mg (n = 17; z toho 11 mužov). Kontrolnú skupinu tvorilo 44 jedincov (8 mužov, 36 žien) s vekovým priemerom 48,0 ± 6,2 roka (vekové rozpätie od 29 do 61 rokov). U žiadneho z kontrolných subjektov nebolo anamnesticky zistené žiadne ochorenie ani liečba ovplyvňujúca kostný metabolizmus, klinicky a hormonálne boli vylúčené endokrinopatie. Pacienti a jedinci kontrolnej skupiny sa nelíšili výskytom nepatologických fraktúr. Nezaznamenali sme údaj o patologickej (osteoporotickej) zlomenine. Vzhľadom na retrospektívnu analýzu dát pacientov štúdia nevyžadovala súhlas lokálnej etickej komisie; všetci jedinci kontrolného súboru podpísali informovaný súhlas. U všetkých pacientov s Addisonovou chorobou ako aj u kontrolnej skupiny boli realizované laboratórne vyšetrenia zo vzoriek krvi odobratých ráno nalačno o 8.00. Vyšetrené parametre boli následovné: kalcium a fosfor v sére (sCa, sPh), intaktný parathormón (PTH-I), 25-hydroxyvitamín D (25OH-vitamín D), kostné markery – kostný izoenzým alkalickej fosfatázy (OSTA), osteokalcín (OCA), RANKL, osteoprotegerín (OPG, celkový testosterón (TT), estradiol (E2), 17-hydroxyprogesterón (17OH-P), dehydroepiandrosterón (DHEA) a jeho sulfát (DHEAS). Odbery krvi na stanovenie hladiny plazmatického kortizolu (FP) u pacientov s Addisonovou chorobou boli odoberané 2 hodiny po užití hydrokortizónu. U kontrolnej skupiny bol vyšetrený plazmatický kortizol (FP) o 8.00 nalačno. Okrem toho bol stanovený aj voľný močový kortizol za 24 hodín (FM). Všetky sledované biochemické a hormonálne parametre boli stanovené v centrálnom laboratóriu. Kvantitatívne stanovenie sCa a sPh bolo prevedené metódou fotometrie na prístroji Architect ci 8200 (A). Kostný izoenzým alkalickej fosfatázy (OSTA) bol stanovený rádioimunometricky na prístroji Stratec Gama Counter SR 300 (RIA). Stanovenie FP bolo realizované imunoanalýzou, ktorá využíva fluorescenčnú polarizáciu (FPIA – Fluorescence Polarization Imunoassay) na prístroji Abbot Axym System (Ax). E2 a TT boli stanovené metódou chemiluminiscenčnej imunoanalýzy na mikročasticiach (CMIA – Chemiluminiscent Microparticle Imunoassay) na prístroji Architect ci 8200. Androgény a ostávajúce markery kostného obratu sme stanovili enzýmovou imunoanalýzou na mikrodoštičkách (EIA – Enzyme Imunoassay) na prístroji Elisa Tecan Miniswift (E). Vyšetrovacie kity pre stanovenie laboratórnych parametrov na prístroji Architect ci 8200 boli od firmy Abbott Laboratories (USA), ostatné od DRG Instruments GmbH (Nemecko). BMD (g/cm2) v oblasti predlaktia nedominantnej končatiny (BMDfore) a v oblasti lumbálnej chrbtice (BMDlumb) bola stanovená metódou duálnej emisnej röntgenovej absorpciometrie (DXA) prístrojom Osteocore firmy MediLink. Nameraná kostná denzita bola podľa kritérií WHO v zmysle hodnotenia T skóre klasifikovaná ako pásmo osteoporózy (T skóre < –2,5 SD), osteopénie (T skóre v rozpätí –1 ,0 až –2,5 SD), resp. ako normálny nález (T skóre > –1,0 SD). Pri štatistickej analýze boli použité štandartné štatistické metodiky pre hodnotenie štatistickej významnosti (t-test, Mann-Whitneyho test) a korelácie (Spearmannov test), výpočty boli realizované počítačovým programom Sigma Stat v 2.01.
Výsledky
Pri dávkovo stabilizovanej a adekvátnej substitučnej liečbe HCT bola priemerná bazálna hodnota plazmatického kortizolu stanovená o 08.00 hod. u všetkých pacientov v norme (515 ± 128 nmol/l), v norme boli aj hladiny voľného močového kortizolu stanoveného vo vzorke z celodenne zbieraného moču (278 ± 120 nmol/24 hod) – t. j. korekcia hypokorticizmu bola adekvátna a nebola zistená štatistická odchýlka od hodnôt kontrolného súboru. Tyreoidálny status všetkých pacientov užívajúcich levotyroxín bol bez odchýlky, tj. v pásme eutyreózy. Z celkového počtu 46 pacientov s Addisonovou chorobou bolo u 14 (30,4 %) z nich zistený normálny denzitometrický nález, u 27 pacientov (58,7 %) bola potvrdená osteopénia, v 5 prípadov (10,9 %) osteoporóza. Tieto výsledky sa nelíšili od zastúpenia nálezov nezníženej kostnej hustoty (14 prípadov; 31,8 %), osteopénie (25; 56,8 %), resp. osteoporózy (5; 11,4 %) v kontrolnom súbore. U žien sledovanej skupiny bol normálny nález ozrejmený v 11 prípadoch (32,4 %), osteopénia v 20 prípadoch (58,8 %) a osteoporóza u 3 pacientiek (8,8 %); u mužov boli nálezy nezníženej denzity, osteopénie a osteoporózy konštatované u troch (25 %), siedmych (58,3 %), resp. dvoch pacientov (16,7 %). Porovnanie početného zastúpenia denzitometrických nálezov v zmysle nezníženej kostnej hustoty, osteopénie a osteoporózy v podskupinách premenopauzálnych a postmenopauzálnych žien sledovanej skupiny a kontrolného súboru je uvedené v tab. 1. Priemerné hodnoty BMDlumb a BMDfore u pacientov s hypokorticizmom boli bez signifikantného rozdielu oproti hodnotám kontrolného súboru (BMDlumb 0,902 ± 0,130 g/cm2 vs. BMDlumb 0,871 ± 0,127 g/cm2; p > 0,05), resp. BMDfore 0,344 ± 0,070 g/cm2 u pacientov vs. BMDfore 0,343 ± 0,050 g/cm2 u kontrol; p > 0,05). Z vyšetrených steroidov sme zistili signifikantne znížené hladiny E2 u žien s hypokorticizmom a to nielen v postmenopauze (p = 0,011), ale aj v premenopauze (p = 0,031). Ženy mali signifikantne znížené hladiny TT, 17OH-P, DHEA a DHEAS. U mužských pacientov s hypokorticizmom boli signifikantne znížené sérové hladiny 17OH-P, DHEA a DHEAS, hodnoty TT a E2 sa nelíšili od hladín týchto hormónov u mužov kontrolnej skupiny (tab. 2). Vyšetrením parametrov Ca-Ph metabolizmu a kostných markerov boli ozrejmené signifikantne znížené hladiny sCa, zvýšené hladiny 25-OH-vitamínu D, OCA a OSTA u žien s hypokorticizmom a OCA u mužov. Ostatné sledované parametre (sPh, PTH-I, RANKL a OPG) boli v porovnaní s kontrolným súborom bez štatisticky významnej zmeny (tab. 3). Priemerná hodnota RANKL bola u pacientov s Addisonovou chorobou zvýšená iba nesignifikantne, avšak pomer RANKL/OPG bol u žien ako aj mužov s hypokorticizmom oproti kontrolnej skupine výrazne vyšší (ženy 3,10 vs. 2,57, p < 0,01; resp. muži 3,62 vs. 1,93, p < 0,001) (tab. 3). U podskupiny pacientov s dennou dávkou HCT > 25 mg bola BMDlumb nižšia a štatisticky významne sa líšila od BMDlumb pacientov s dávkou ≤ 25 mg HCT denne (0,943 ± 0,162 g/cm2 vs. 0,832 ± 0,153 g/cm2, p < 0,05). Aj samotný výskyt osteoporózy (17,6 % : 6,9 %) bol u podskupiny pacientov s dávkou HCT > 25 mg denne nápadne percentuálne vyšší, a to na úkor normálnych nálezov (23,5 % : 34,5 %); zastúpenie pacientov s kostnou denzitou v pásme osteopénie bolo u oboch skupín identické (58,8 % : 58,6 %). Nezistili sme koreláciu hodnôt kostných markerov s dávkou GK substitučnej liečby, ani s dĺžkou jej užívania. Dávka HCT korelovala s telesným povrchom pacientov (r = 0,44, p < 0,001) (Obr. 1), nedokázali sme však vzťah medzi BMD a dávkou HCT v mg (Obr. 2), resp. dávkou HCT prepočítanou na kg telesnej hmotnosti. Nepreukázali sme žiadnu závislosť BMD od dĺžky podávania substitučnej liečby (Obr. 3). Po rozdelení sledovanej skupiny na 5-ročné obdobia užívania liečby boli počty pacientov s nálezmi osteoporózy/osteopénie/nezníženej kostnej hustoty takmer identické – v skupine pacientov liečených < 5 rokov 1/7/7, u pacientov liečených 5–9 rokov 1/7/2, u pacientov liečených 10–15 rokov 1/8/3, resp. u pacientov liečených ≥ 15 rokov 1/5/2.
Tab. 1. Porovnanie početného zastúpenia denzitometrických nálezov nezníženej kostnej hustoty, osteopénie a osteoporózy u žien sledovanej skupiny a kontrolného súboru 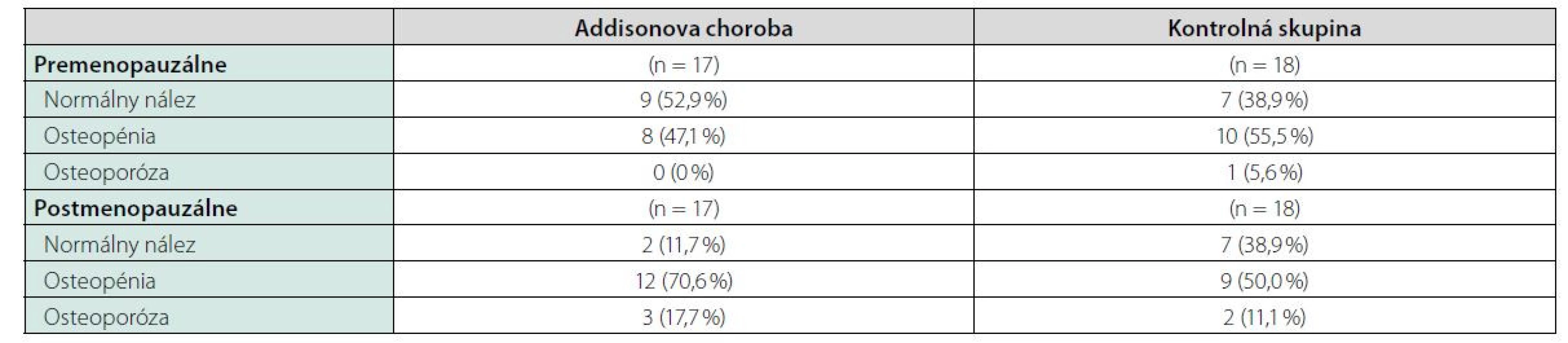
Tab. 2. Hodnoty steroidných hormónov u mužov u žien sledovanej skupiny a kontrolného súboru 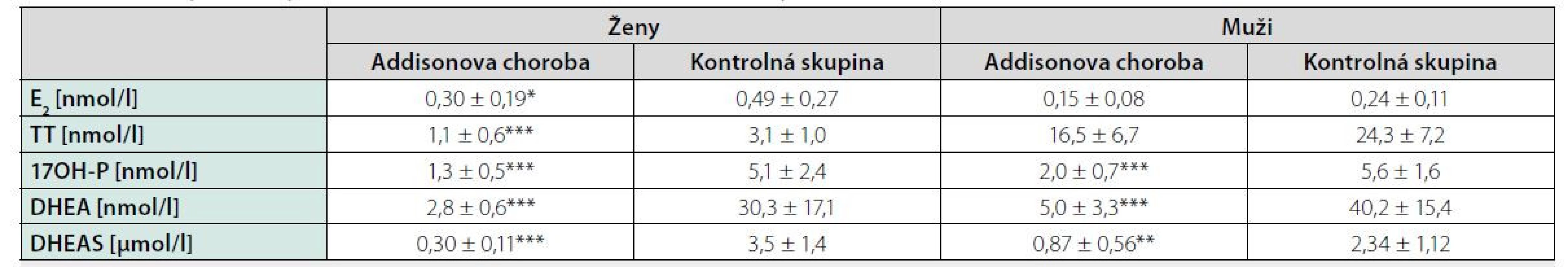
Vysvetlivky: E2 – estradiol; TT – celkový testosterón; 17OH-P – 17-hydroxyprogesterón; DHEA – dehydroepiandrosterón; DHEAS – dehydroepiandrosterón-sulfát; x – priemer; SD – smerodatná odchýlka; * p < 0.05; ** p < 0.01; *** p < 0.001; výsledky vyznačené tučne predstavujú hodnoty pod dolnou hranicou referenčnej normy Tab. 3. Hodnoty steroidných hormónov u mužov a žien sledovanej skupiny a kontrolného súboru 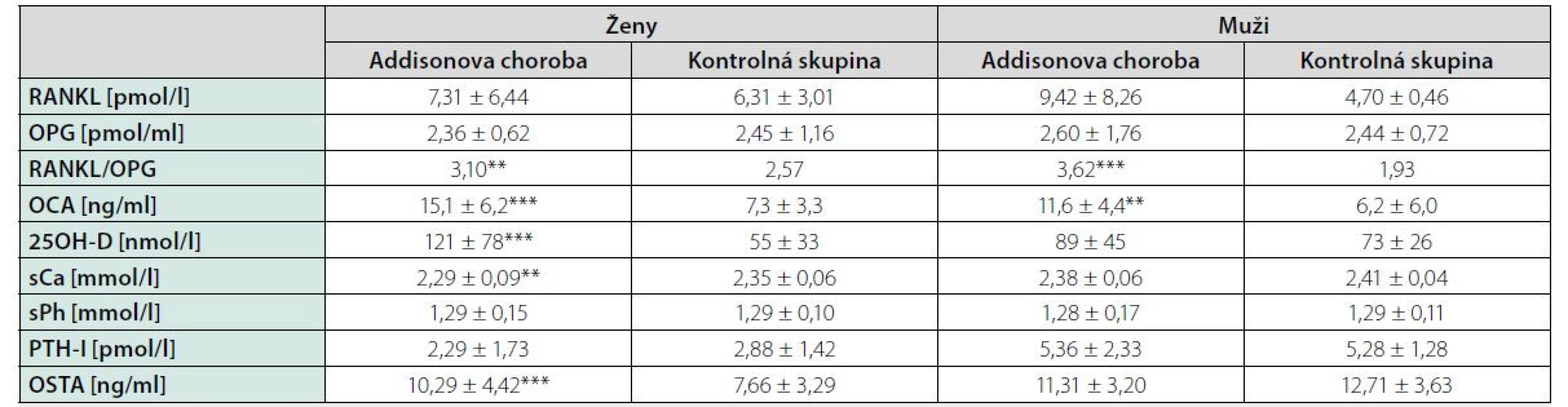
Vysvetlivky: RANKL – ligand aktivátora receptoru nukleárneho faktora κ B; OPG – osteoprotegerín; OCA – osteokalcín; 25OH-vitamín D – 25-hydroxyvitamín D; sCa – sérové kalcium; sPhos – sérový fosfor; PTH-I – intaktný parathormón; OSTA – kostný izoenzým alkalickej fosfatázy; * p < 0.05; ** p < 0.01; *** p < 0.001 Obr. 1. Korelácia dávky hydrokortizonu s telesným povrchom pacientov 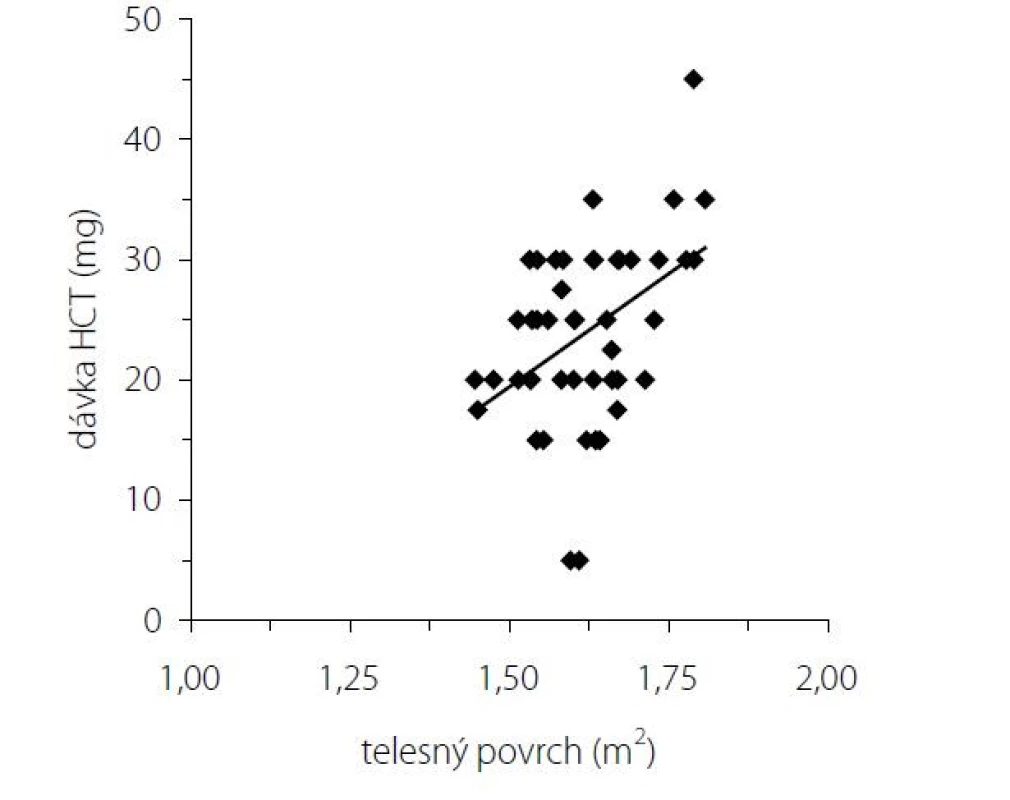
Obr. 2. BMD v lumbálnej oblasti v závislosti od dávky hydrokortizonu 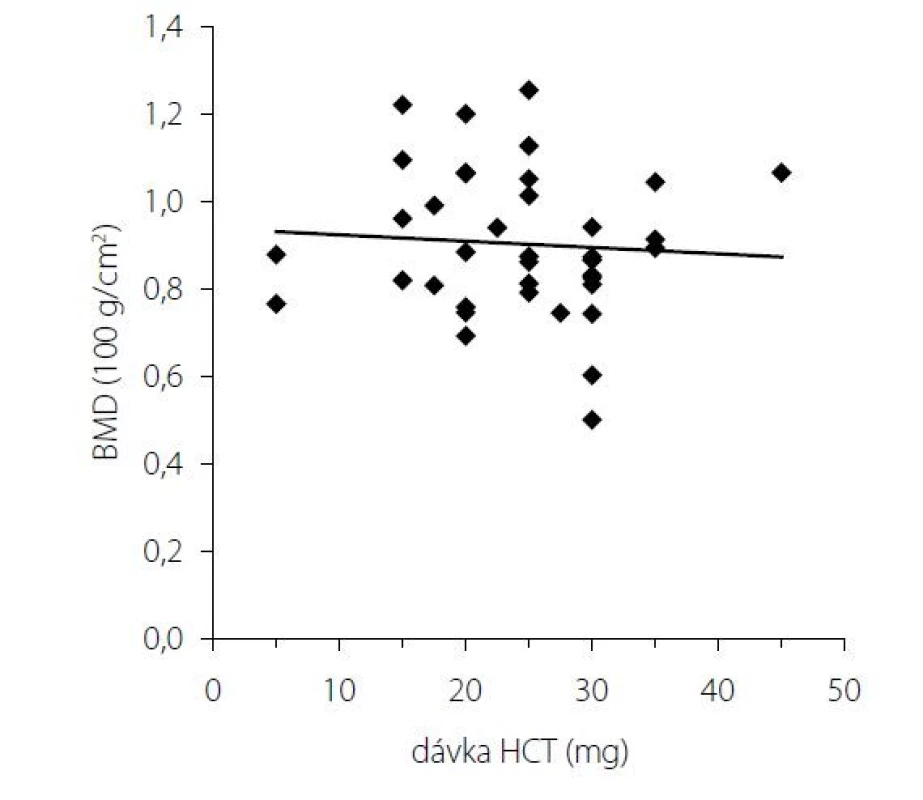
Obr. 3. BMD v lumbálnej oblasti v závislosti od dĺžky trvania substitučnej liečby hydrokortizonom 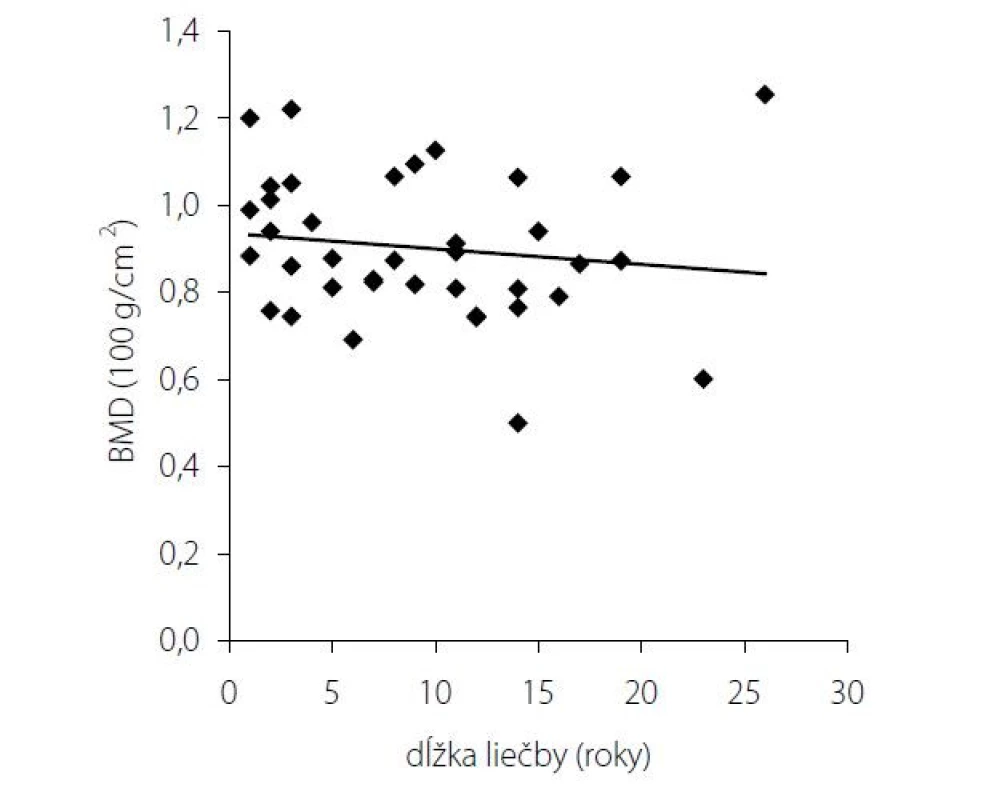
Diskusia
V našej štúdii sme posudzovali vplyv substitučnej glukokortikoidnej liečby u pacientov s Addisonovou chorobou na kostnú denzitu, markery kostného obratu ako aj na parametre kalciovo – fosfátového metabolizmu. Nepotvrdili sme zvýšenú prevalanciu osteoporózy resp. osteopénie u pacientov s Addisonovou chorobou na substitučnej glukokortikoidnej liečbe v porovnaní s kontrolnou skupinou. Doposiaľ realizované štúdie nám nedávajú jednoznačné závery. Väčšina z týchto štúdií bola obmedzená malým počtom pacientov a vykazovali nekonzistentné nálezy medzi BMD, trvaním ochorenia, typom ako aj dennou dávkou glukokortikoidov. Niektoré preukázali zníženú BMD u všetkých pacientov s Addisonovou chorobou (26), niektoré u žien po menopauze (27, 28) alebo iba u mužov (29, 30), zatiaľ čo ďalšie nepotvrdili rozdiely medzi pohlaviami (31, 32). V najväčšej retrospektívnej štúdií Lovasa s kolektívom na celkovo 292 pacientoch s Addisonovou chorobou boli potvrdené signifikantne znížené BMD na krčku stehennej kosti a v lumbálnej oblasti v porovnaní so zdravými jedincami (5). Hlavnou nevýhodou predchádzajúcich štúdií boli pomerne vysoké dávky glukokortikoidov (30 mg HC denne), ktoré boli ++++ podávané týmto pacientom. V našej štúdii mali pacienti s dennou dávkou HCT > 25 mg signifikantne nižšiu BMD v lumbálnej oblasti oproti skupine liečenej s dennou dávkou HCT ≤ 25 mg. Nepreukázali sme závislosť medzi hodnotami BMD a dávkami HCT ako aj koreláciu medzi BMD a dĺžkou trvania ochorenia. V štúdií Zellisena a kolektívu bola potvrdená lineárna závislosť medzi dávkou HCT a hodnotami BMD (33). Na druhej strane v štúdii Chikadu s kolektívom táto závislosť nebola potvrdená (34). Z parametrov kalciovo-fosfátového metabolizmu sme zaznamenali zníženú hladinu sérového kalcia u pacientov s Addisonovou chorobou v porovnaní so zdravými kontrolami, čo dávame do súvislosti s účinkom exogénne podávaných glukokortikoidov spoločne s deficitom estrogénov. Spomedzi vyšetrených markerov kostného obratu mali pacienti s Addisonovou chorobou zvýšený osteokalcín (OCA) ako aj kostný izoenzým alkalickej fosfatázy (OSTA), čo svedčí pre zvýšený kostný obrat u týchto pacientov. Nebol zachytený signifikantný rozdiel medzi hladinami RANKL a OPG medzi pacientami s Addisonovou chorobou a kontrolným súborom. Zaznamenali sme však signifikantne zvýšený pomer RANKL/OPG v porovnaní s kontrolou, čo svedčí pre relatívny nedostatok OPG. Štúdie hodnotiace markery kostného obratu neposkytli jednoznačný pohľad na špecifické vlastnosti kostného obratu u týchto pacientov. Štúdie in vitro potvrdili supresívny efekt glukokortikoidov na syntézu OPG (35). Avšak v štúdii kolektívu Fichna a spol. bola potvrdená zvýšená hladina OPG u pacientov s Addisonovou chorobou na subtitučnej kortikoterapii (3). Podľa niektorých klinických údajov navyše vedie krátkodobá systémová liečba glukokortikoidmi k rýchlemu poklesu OPG v sére počas prvých týždňov liečby, bez zmien sérových hladín vápnika, parathormónu (PTH)a alkalickej fosfatázy ALP (36). Viaceré štúdie u pacientov s Cushingovým syndrómom (teda nadprodukciou kortizolu) potvrdili zvýšené hladiny OPG (37–39). Niektorí autori preto popisujú bimodálne správanie OPG v reakcii na prebytok glukokortikoidov: rýchly počiatočný pokles OPG, ktorý odráža supresívny účinok na osteoblasty s nasledným kompenzačným dlhotrvajúcim zvýšením syntézy OPG na ochranu kosti pred škodlivým vplyvom steroidov (39). To by bolo v súlade so skorým závažným znížením BMD v prvých mesiacoch systémovej liečby glukokortikoidmi a oveľa pomalším poklesom kostnej hmoty pozorovaným v neskoršom období (40). V súlade s očakávaním sa u pacientov s Addisonovou chorobou potvrdili signifikantne znížené hladiny androgénov v porovnaní s kontrolnou skupinou. U oboch pohlaví boli znížené najmä hladiny adrenokortikálnych steroidov – DHEA,DHEAS. Signifikantne nižšie hladiny estrogénov u žien v študijnej skupine je možné dávať do priamej súvislosti s adrenálnou insuficienciou. Tvorba estrogénov pri ovariálnej insuficiencii je závislá od činnosti nadobličiek – androgény sa menia na estrogen účinkom aromatázy: testosterón sa mení na estradiol, androstendión na estrón. V prípade hypokorticizmu je uvedená konverzia minimálna, a teda deficit estrogénov sa môže prehlbovať. Testesterón je hlavným sexuálnym steroidom u mužov. Nepozorovali sme pokles hladín testosterónu u mužských pacientov s hypokorticizmom, nakoľko dominantná tvorba testosterónu je v pohlavných žľazách. Nedostatok androgénov môže byť príčinou vzniku osteoporózy u pacientov Addisonovou chorobou.Predpokladá sa, že malé množstvá androgénov adrenálneho pôvodu môžu hrať úlohu pri udržiavaní kostnej hmoty (41). Účinky substitúcie jedného z adrenálnych androgénov dehydroepiandrosterónu (DHEA) na BMD u pacientov s Addisonovou chorobou boli nejednoznačné (42, 43). Bola zaznamenaná korelácia medzi zníženou BMD a nízkymi hladinami cirkulujúceho DHEA u pacientov s hypopituitarizmom (44), žien pred a po menopauze (45) a pacientov s osteoporózou indukovanou glukokortikoidmi (46). Po dlhodobej (12 mesiacov) substitučnej liečbe DHEA sa u pacientov s AD sa BMD mierne zvýšila na krčku stehennej kosti, ale nie na iných miestach (47). Dalo by sa očakávať, že účinky nadobličkových androgénov budú oveľa výraznejšie u žien s AD ako u mužov, a to z dôvodu podstatne silnejšieho účinku testosterónu v porovnaní s adrenálnymi androgénmi na pevnosť kostí u mužov. Skutočnosť, že ženy s diagnostikovanou AD < 50 rokov (pred menopauzou) mali vyššie relatívne riziko zlomeniny bedrového kĺbu ako ženy s diagnostikovanou > 50 rokov (po menopauze) bez rozdielu viditeľného u mužov, môže naznačovať, že nedostatok nadobličkových androgénov u žien s AD je viac dôležitý, ako sa doteraz myslelo (47). Je dôležité zdôrazniť, že tieto korelácie neznamenajú príčinnú súvislosť. V budúcnosti bude potrebné zistiť kauzalitu týchto súvislostí, z toho vyplýva aj potreba ďalších prospektívnych štúdií na väčších súboroch pacientov.
Záver
V našej štúdii sme nepotvrdili zvýšenú prevalenciu osteoporózy resp. osteopénie u pacientov s Addisonovou chorobou na subtitučnej glukokortikoidnej liečbe. Hodnoty kostnej denzity nekorelovali s dávkami HCT ani s dĺžkou trvania liečby. Potenciálne riziko predstavujú vyššie dávky glukokortikoidnej substitučnej terapie (HCT v dávke > 25 mg denne) a typická konštelácia steroidov (znížené adrenokortikálne androgény DHEA a DHEAS, u žien aj estradiol). Zvýšený pomer RANKL/OPG môže svedčiť pre relatívny nedostatok OPG. Možno tak predpokladať, že pacienti ženského pohlavia majú napriek adekvátnej substitúcii zvýšený kostný obrat, a tým aj relatívne vyššie riziko znižovania BMD.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Peter Vaňuga, PhD.
Národný endokrinologický a diabetologický ústav, Ľubochňa 144, 034 91 Ľubochňa
Cit. zkr: Vnitř Lék 2021; 67(5): 264–269
Článek přijat redakcí: 4. 6. 2021
Článek přijat po recenzích: 9. 7. 2021
Zdroje
1. Arlt W. The approach to the adult with newly diagnosed adrenal insufficiency. J Clin Endocrinol Metab 2009; 94 : 1059–1067.
2. Crown A, Lightman S. Why is the management of glucocorticoid deficiency still controversial: a review of the literature. Clin Endocrinol (Oxf) 2005; 63 : 483–492.
3. Fichna M, Zurawek M, Fichna P, Fryczynska M et al. Increased serum osteoprotegerin in patients with primary adrenal insufficiency receiving conventional hydrocortisone substitution 2012; 63 : 677–682.
4. Chronocort® Phase 3 and Safety Extension Study results published in JCEM | Investor or Media Relations | Diurnal | Dedicated to developing hormone therapeutics, 2021. Dostupné na:www.diurnal.co.uk.
5. Lovas K, Gjesdal CG, Christensen M et al. Glucocorticoid replacement therapy and pharmacogenetics in Addison’s disease: effects on bone. Eur J Endocrinol 2009; 160 : 993–1002.
6. Peacey SR, Guo C-Y, Robinson AM et al. Glucocorticoid replacement therapy: are patients over treated and does it matter? Clin Endocrinol 1997; 46 : 255–261.
7. Koetz KR, Ventz S, Diederich S, Quinkler M. Bone mineral density is not significantly reduced in adult patients on lowdose glucocorticoid replacement therapy. J Clin Endocrinol Metab 2012; 97 : 85–92.
8. Hofbauer LC, Schoppet M. Clinical implications of the osteoprotegerin/RANKL/RANK system for bone and vascular disease. JAMA 2004; 292 : 490–495.
9. Karssen AM, Meijer OC, Van Der Sandt IC, Lucassen PJ, De Lange EC, De Boer AG & De Kloet ER. Multidrug resistance P-glycoprotein hampers the access of cortisol but not of corticosterone to mouse and human brain. Endocrinology 2001; 142 : 2686–2694.
10. Yates CR, Chang C, Kearbey JD, Yasuda K, Schuetz EG, Miller DD, Dalton JT & Swaan PW. Structural determinants of P-glycoproteinmediated transport of glucocorticoids. Pharmaceutical Research 2003; 20 : 1794–1803.
11. Pariante CM. The role of multi-drug resistance P-glycoprotein in glucocorticoid function: studies in animals and relevance in humans. European Journal of Pharmacology 2008; 583 : 263–271.
12. Marzolini C, Paus E, Buclin T, Kim RB. Polymorphisms in human MDR1 (P-glycoprotein): recent advances and clinical relevance. Clinical Pharmacology and Therapeutics 2004; 75 : 13–33.
13. Sakaeda T. MDR1 genotype-related pharmacokinetics: fact or fiction? Drug Metabolism and Pharmacokinetics 2005; 20 : 391–414.
14. Kimchi-Sarfaty C, Oh JM, Kim IW, Sauna ZE, Calcagno AM, Ambudkar SV & Gottesman MM. A ‘silent’ polymorphism in the MDR1 gene changes substrate specificity. Science 2007; 315 : 525–528.
15. Salama NN, Yang Z, Bui T & Ho RJ. MDR1 haplotypes significantly minimize intracellular uptake and transcellular P-gp substrate transport in recombinant LLC-PK1 cells. Journal of Pharmaceutical Sciences 2006; 95 : 2293–2308.
16. Guo CY, Weetman AP, Eastell RBone turnover and bone mineral density in patients with congenital adrenal hyperplasia. Clin Endocrinol (Oxf) 1996; 45 : 535–541.
17. Stikkelbroeck NM, Oyen WJ, van der Wilt GJ, Hermus AR, Otten BJ. Normal bone mineral density and lean body mass, but increased fat mass, in young adult patients with congenital adrenal hyperplasia. J Clin Endocrinol Metab 2003; 88 : 1036–1042.
18. Girgis R, Winter JS. The effects of glucocorticoid replacement therapy on growth, bone mineral density, and bone turnover markers in children with congenital adrenal hyperplasia. J Clin Endocrnol Metab 1997; 82 : 3926–3929.
19. Christiansen P, Mølgaard C, Muller J. Normal bone mineral content in young adults with congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Horm Res2004; 61 : 133–136.
20. Hagenfeldt K, Martin Ritze´n E, Ringertz H, Helleday J, Carlstrom K. Bone mass and body composition of adult women with J Clin Endocrinol Metab 2012; 97(1): 85–92.
21. Valero MA, Leon M, Ruiz Valdepenas MP et al. Bone density and turnover in Addison’s disease: effect of glucocorticoid treatment. Bone Miner 1994; 26 : 9–17.
22. Sasaki N, Kusano E, Ando Y, Tsuda E, Asano Y. Glucocorticoid decreases circulating osteoprotegerin (OPG): possible mechanism for glucocorticoid induced osteoporosis. Nephrol Dial Transplant 2001; 16 : 479–482.
23. Ueland T, Bollerslev J, Godang K, Muller F, Froland SS, Aukrust P. Increased serum osteoprotegerin in disorders characterized by persistent immune activation or glucocorticoid excess – possible role in bone homeostasis. Eur J Endocrinol 2001; 145 : 685–690.
24. Abdallah BM, Stilgren LS, Nissen N, Kassem M, Jorgensen HR, Abrahamsen B. Increased RANKL/OPG mRNA ratio in iliac bone biopsies from women with hip fractures. Calcif Tissue Int 2005; 76 : 90–97.
25. Hofbauer LC, Hicok KC, Chen D, Khosla S. Regulation of osteoprotegerin production by androgens and anti-androgens in human osteoblastic lineage cells. Eur J Endocrinol 2001; 147 : 269–273.
26. Heureux F, Maiter D, Boutsen Y, Devogelaer JP, Jamart J, Donckier J. Evaluation of corticosteroid replacement therapy and its effect on bones in Addison’s disease. Ann Endocrinol (Paris) 2000; 61 : 179–183.
27. Devogelaer JP, Crabbe´ J, Nagant de Deuxchaisnes C. Bone mineral density in Addison’s disease: evidence for an effect of adrenal androgens on bone mass. BrMed J (Clin Res Ed) 1987; 294 : 798–800.
28. ValeroMA, LeonM, Ruiz Valdepen˜ asMP, Larrodera L, LopezMB, Papapietro K, Jara A, Hawkins F. Bone density and turnover in Addison’s disease: effect of glucocorticoid treatment. Bone Miner 1994; 26 : 9–17.
29. Zelissen PM, Croughs RJ, van Rijk PP, Raymakers JA. Effect of glucocorticoid replacement therapy on bone mineral density in patients with Addison disease. Ann Intern Med 1994; 120 : 207–210.
30. Braatvedt GD, Joyce M, Evans M, Clearwater J, Reid IR.Bone mineral density in patients with treated Addison’s disease. Osteoporos Int 1999; 10 : 435–440.
31. Jo´ dar E, Valdepen˜ as MP, Martinez G, Jara A, Hawkins F.Long-term follow-up of bone mineral density in Addison’s disease. Clin Endocrinol (Oxf) 2003; 58 : 617–620.
32. Arlt W, Rosenthal C, Hahner S, Allolio B. Quality of glucocorticoid replacement in adrenal insufficiency: clinical assessment vs. timed serum cortisol measurements. Clin Endocrinol (Oxf) 2006; 64 : 384–389.
33. Zelissen PM, Croughs RJ, van Rijk PP, Raymakers JA. Effect of glucocorticoid replacement therapy on bone mineral density in patients with Addison disease. Ann Intern Med 1994; 120 : 207–210.
34. Chikada N, Imaki T, Hotta M, Sato K, Takano K. An assessment of bone mineral density in patient with Addison’s disease and isolated ACTH deficiency treated with glucocorticoid. Endocr J 2004; 51 : 355–360.
35. Hofbauer LC, Gori F, Riggs BL et al. Stimulation of osteoprotegerin ligand and inhibition of osteoprotegerin production by glucocorticoids in human osteoblastic lineage cells: potential paracrine mechanisms of glucocorticoidinduced osteoporosis. Endocrinology 1999; 140 : 4382–438.
36. Sasaki N, Kusano E, Ando Y, Tsuda E, Asano Y. Glucocorticoid decreases circulating osteoprotegerin (OPG): possible mechanism for glucocorticoid induced osteoporosis. Nephrol Dial Transplant 2001; 16 : 479–482.
37. Ueland T, Bollerslev J, Godang K, Muller F, Froland SS, Aukrust P. Increased serum osteoprotegerin in disorders characterized by persistent immune activation or glucocorticoid excess – possible role in bone homeostasis. Eur J Endocrinol 2001; 145 : 685–690.
38. Dovio A, Allasino B, Palmas E, et al. Increased osteoprotegerin levels in Cushing’s syndrome are associated with an adverse cardiovascular risk profile. J Clin Endocrinol Metab 2007; 92 : 1803–1808.
39. Camozzi V, Sanguin F, Albigier N et al. Persistent increase of osteoprotegerin levels after cortisol normalization in patients with Cushing’s syndrome. Eur J Endocrinol 2010; 162 : 85–90.
40. LoCascio V, Bonucci E, Imbimbo B et al. Bone loss in response to long-term glucocorticoid therapy. Bone Miner 1990; 8 : 39–51.
41. Devogelaer JP, Crabbe J, Nagant de Deuxchaisnes C. Bone mineral density in Addison’s disease: evidence for an effect of adrenal androgens on bone mass. Br Med J (Clin Res Ed) 1987; 294 : 798–800.
42. Arlt W, Callies F, van Vlijmen JC et al. Dehydroepiandrosterone replacement in women with adrenal insufficiency. N Engl J Med 1999; 341 : 1013–1020.
43. Lovas K, Gebre-Medhin G, Trovik TS et al. Replacement of dehydroepiandrosterone in adrenal failure: no benefit for subjective health status and sexuality in a 9-month, randomized, parallel group clinical trial. J Clin Endocrinol Metab 2003; 88 : 1112–1118.
44. Miller KK, Biller BM, Hier J, Arena E, Klibanski A. Androgens and bone density in women with hypopituitarism. J Clin Endocrinol Metab2002; 87 : 2770–2776.
45. Osmanagaoglu MA, Okumus B, Osmanagaoglu T, Bozkaya H. The relationship between serum dehydroepiandrosterone sulfate concentration and bone mineral density, lipids, and hormone replacement therapy in premenopausal and postmenopausal women. JWomens Health(Larchmt) 2004; 13 : 993–999.
46. Hampson G, Bhargava N, Cheung J, Vaja S, Seed PT, Fogelman I. Low circulating estradiol and adrenal androgens concentrations in men on glucocorticoids: a potential contributory factor in steroid-induced osteoporosis.Metabolism 2002; 51 : 1458–1462.
47. Gurnell EM, Hunt PJ, Curran SE et al. Long-term DHEA replacemen in primary adrenal insufficiency: a randomized, controlled trial. J Clin Endocrinol Metab 2008; 93 : 400–409.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Endokrinológia, zaostrené na osteoporózu
- Kostní nemoc při selhání ledvin – renální i non-renální komponenta
- Výskyt osteoporózy u pacientov na substitučnej liečbe hypokorticizmu u Addisonovej choroby
- Osteoporóza u mužů: podceňovaná a neléčená
- Osteoporóza u premenopauzálnych žien
- Osteoporóza u pacientov s diabetes mellitus
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Role zánětu a imunity u aterosklerózy a možné způsoby jejich ovlivnění
- Karcinoidový syndróm – diagnostika a manažment
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Osteoporóza u premenopauzálnych žien
- Vzácné trombotické komplikace vyvolané vakcinací proti SARS-CoV-2
- Karcinoidový syndróm – diagnostika a manažment
- Osteoporóza u mužů: podceňovaná a neléčená
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



