-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAterogenní dyslipidemie typické pro metabolický syndrom
Atherogenic dyslipidemia typical for metabolic syndrome
Atherogenic dyslipidemias plays an important role in determining the cardiovascular risk. In these patients, insulin resistance is responsible for overproduction and secretion of atherogenic very low density lipoprotein. In addition, insulin resistance promotes the production of small dense low-density lipoprotein (LDL) and reduces high-density lipoprotein (HDL) production. Cardiovascular disease remains a leading cause of morbidity and mortality in these patients. The most European guidelines for the management of dyslipidemias recommend the goal values of LDL-c for moderate cardiovascular risk < 2.6 mmol/l (patients < 50 years with diabetes duration < 10 years, without other risk factors), for high-risk < 1.8 mmol/l and > 50% lowering (patients with diabetes mellitus type 2 without target organ damage, with diabetes duration > 10 years or another additional risk factor), and for very-high-risk < 1.4 mmol/l a > 50% lowering (diabetes with target organ damage, or at least three major risk factors). Moreover in the patients with recurrent atherothrombotic event within two years from the first event with maximal tolerated statin and ezetimibe is the goal LDL-c < 1.0 mmol/l. The secondary goal mainly in hypertriglyceridemia is non-HDL-C, the goal is 0,8 mmol/l higher than recommended goal LDL-C in defined risk category. The monitoring of apoB is also recommended, the goals in the very-high-risk patients are < 0.65 g/l, in high-risk < 0.8 g/l and in moderate-risk < 1.0 g/l. Triglycerides > 1.7 mmol/l and HDL-C < 1.0 mmol/l in man and < 1.2 mmol/l in woman are the risk modulators, but not the therapeutic goals. Both these parameters are included in the goals of non-HDL-C or apolipoprotein B. Statins are the first line of LDL-lowering therapy in atherogenic dyslipidemia and combined therapy with ezetimibe and statins could be useful in very high cardiovascular risk subjects. Furthermore, the effect of a fibrate as an add-on treatment to a statin could improve the lipid profile in individuals with high TG and low HDL cholesterol. Regarding new therapies, recent data from phase III trials show that proprotein convertase subtilisin/kexin type 9 (PCSK9) inhibitors considerably decrease LDL cholesterol. Thus, they may be useful in patients with concomitant risk diseases or conditions, recurrent cardiovascular events, and elevated LDL cholesterol after second drug administration in addition to maximal statin dose or statin intolerance. Other hypolipidemic therapies with the potential of favorable influencing of atherogenic dyslipidemia are being developed.
Keywords:
Atherosclerosis – LDL-cholesterol – diabetes mellitus – cardiovascular disease – metabolic syndrom – Hypercholesterolemia – cardiovascular risk
Autoři: Vladimír Bláha; Jakub Víšek; Martina Lášticová
Působiště autorů: III. interní gerontometabolická klinika Lékařské fakulty UK a Fakultní nemocnice Hradec Králové
Vyšlo v časopise: Vnitř Lék 2020; 66(1): 15-20
Kategorie: Hlavní téma
Souhrn
Aterogenní dyslipidemie rozhodujícím způsobem ovlivňuje kardiovaskulární riziko postižených jedinců. V její patofyziologii se uplatňuje inzulinová rezistence, která vyvolává nadprodukci aterogenních lipoproteinů o velmi nízké hustotě (very low density lipoprotein, VLDL), a dále podporuje tvorbu malých denzních částic o nízké hustotě (low-density lipoprotein, LDL) a snižuje tvorbu částic o vysoké hustotě (high-density lipoprotein, HDL). Pacienti s inzulinovou rezistencí, a zejména jedinci s diabetes mellitus 2. typu patří do kategorie vysokého kardiovaskulárního rizika. Recentní evropská doporučení uvádějí jako cílové hodnoty LDL cholesterolemií (LDL-C) pro střední kardiovaskulární riziko < 2,6 mmol/l (diabetes mellitus 2. typu do 50 let věku) s trváním diabetu < 10 let, bez dalších rizikových faktorů, pro vysoké riziko < 1,8 mmol/l a > 50% snížení (pacienti s diabetem bez orgánového poškození, s dobou trvání diabetu > 10 let nebo s dalším rizikovým faktorem), a pro velmi vysoké riziko < 1,4 mmol/l a > 50% snížení (diabetes orgánovým postižením). Navíc u nemocných s rekurentní aterotrombotickou příhodou do dvou let od první události při terapii maximální tolerovanou dávkou statinu a ezetimibem je doporučeno snížení LDL cholesterolu < 1,0 mmol/l. Sekundárním cílem zejména u osob s hypertriglyceridemií je non-HDL-C, jehož cílová hodnota je o 0,8 mmol/l vyšší než doporučený cíl pro LDL-C v dané rizikové kategorii. Podobně používáme i sledování hodnoty apoB, jehož koncentrace u velmi vysoce rizikových osob má být snížena na hodnotu < 0,65 g/l, v kategorii vysokého rizika < 0,8 g/l a u osob se středně zvýšeným rizikem < 1,0 g/l. Hladiny triglyceridů > 1,7 mmol/l a koncentrace HDL-C < 1,0 mmol/l u mužů a < 1,2 mmol/l u žen jsou sice dále považovány za důležité modulátory rizika, ne však za léčebné cíle. Oba tyto parametry zohledňuje cílová hodnota non-HDL-C či apolipoproteinu B. Inhibitory 3 hydroxy 3 methylglutaryl reduktázy (statiny) jsou u aterogenní dyslipidemie lékem první volby ke snížení LDL cholesterolu. Do kombinace používáme ezetimib a statin, zejména u vysoce rizikových pacientů. U jedinců s vysokou hladinou triacylglycerolů a nízkým HDL cholesterolem se mohou příznivě uplatnit deriváty kyseliny fibroové (fibráty). Novými hypolipidemiky v léčbě aterogenních dyslipidemií jsou inhibitory proproteinových konvertáz subtilisin/kexin typ 9 (PCSK9). Signifikantně snižují LDL cholesterolemii, a u diabetiků s dyslipidemií, rekurentním výskytem kardiovaskulárních příhod a přetrvávající zvýšenou LDL cholesterolemií představují další hypolipidemikum do kombinace s maximálně tolerovanou dávkou statinu. Ve vývoji jsou také další nová hypolipidemika s potenciálem příznivého ovlivnění aterogenní dyslipidemie.
Klíčová slova:
ateroskleróza – metabolický syndrom – diabetes mellitus – hypercholesterolemie – kardiovaskulární onemocnění – kardiovaskulární riziko – LDL-cholesterol
Úvod
Pro jedince s inzulinovou rezistencí, jako např. u pacientů s abdominální obezitou, metabolickým syndromem a diabetes mellitus 2. typu, je charakteristická specifická dyslipidemie, která u nich přispívá ke zvýšení rizika aterosklerotického kardiovaskulárního onemocnění. Tato dyslipidemie je charakterizována hypertriglyceridemií, změnou proporce částic low-density lipoproteinů (LDL) z větších s menší hustotou směrem k menším s větší hustotou, snížením počtu high-density lipoprotein (HDL) částic, zvýšením remnantních lipoproteinů (vznikajících v játrech, resp. ve střevě) a postprandiální hyperlipidemií. Změny označujeme jako komplex aterogenní dyslipidemie (1). U jedinců s diabetes mellitus 2. typu je riziko aterosklerotického kardiovaskulárního onemocnění zvýšené 2–4krát a podmiňuje z 80 % mortalitu diabetiků (2). Dosahování normoglykemie při léčbě diabetes mellitus 2. typu má pro ovlivnění rizika aterosklerotického kardiovaskulárního onemocnění jen omezený význam (3). Proto je velká pozornost věnována snaze optimalizovat lipidový profil.
Abnormality v tvorbě i odbourávání lipoproteinových částic u aterogenní dyslipidemie
Za normálních okolností pronikají lipidy získané potravou transportem nebo difuzí do enterocytů, kde z nich vznikají velké na triglyceridy bohaté lipoproteiny – chylomikrony (viz obrázek 1).
Obr. 1. Abnormality v tvorbě i odbourávání lipoproteinových částic u aterogenní dyslipidemie 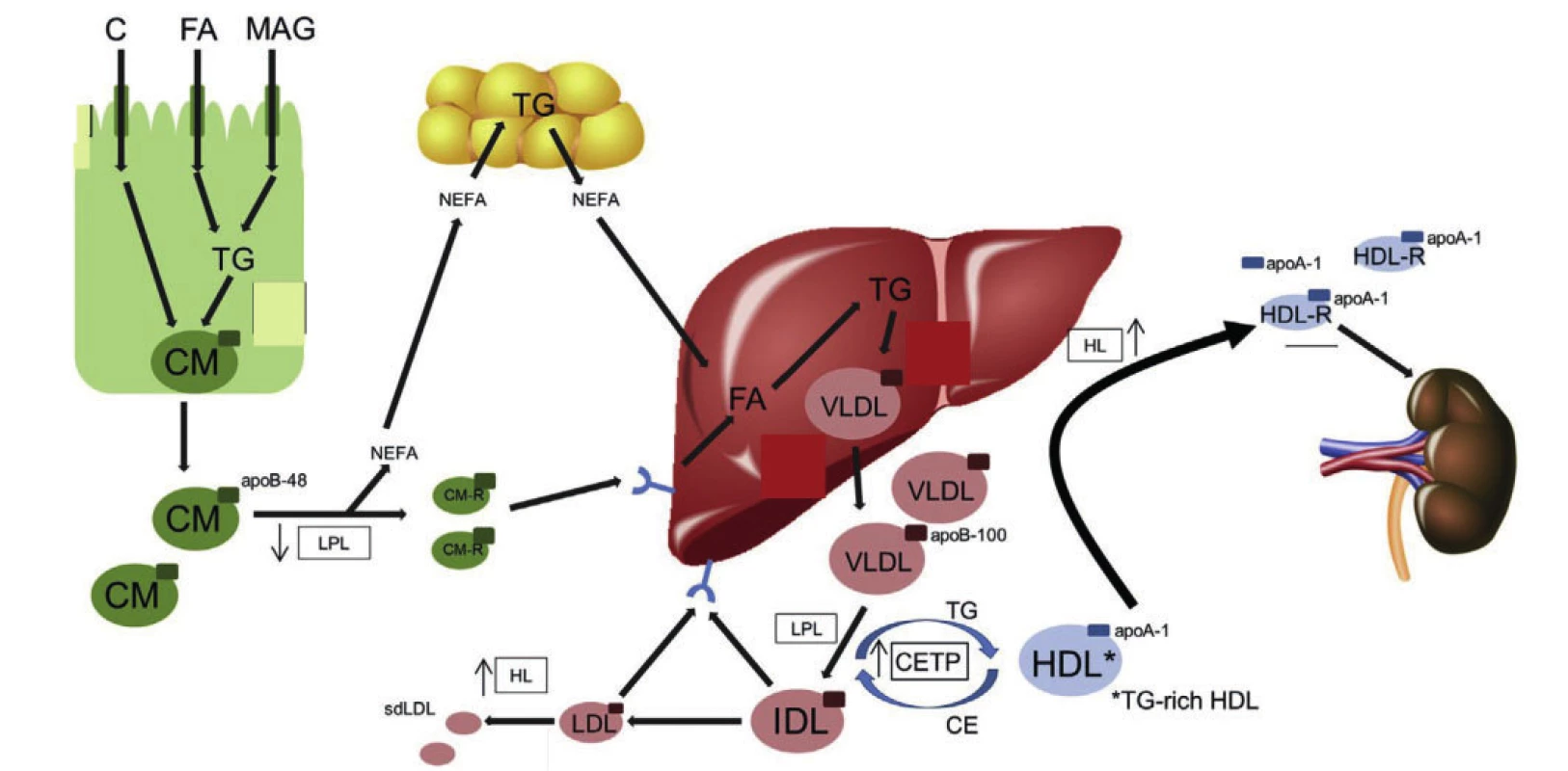
Legenda: apo – apolipoprotein; C – cholesterol; CETP – cholesteryl ester transfer protein; CM – chylomicron; CM-R – chylomicron remnant; DGAT – diacylglycerol acyltransferase 1; FA – fatty acid; HDL – highdensity lipoprotein; HDL-R – high-density lipoprotein remnant; HL – hepatic lipase; IDL – intermediate density lipoprotein; LDL – low-density lipoprotein; LPL – lipoprotein lipase; MAG – monoacyl glycerol; MTP – microsomal triglyceride transfer protein; NEFA – nonesterified fatty acid; PCSK9 – proprotein convertase subtilisin/kexin type 9; sdLDL – small dense low-density lipoprotein; TG – triglyceride; VLDL – very low-density lipoprotein. Upraveno podle (4) V rámci inzulinové rezistence včetně diabetes mellitus 2. typu dochází k řadě abnormalit v tvorbě i odbourávání lipoproteinových částic (5). Za prvé byla při inzulinové rezistenci a diabetes mellitus 2. typu popsána také inzulinová rezistence ve střevě a játrech, která zhoršuje schopnost inzulinu akutně suprimovat sekreci chylomikronů a VLDL částic. Dochází tak ke zvýšení množství cirkulujících mastných kyselin, při současně zhoršené schopnosti tukové tkáně vychytávat mastné kyseliny a při zhoršené inzulinové supresi lipolýzy v tukové tkáni. Zvyšuje se tvorba a sekrece částic bohatých na triglyceridy (6). Vyšší počet částic bohatých na triglyceridy v cirkulaci převyšuje kapacitu clearance činností lipoproteinové lipázy, dochází k jejich zpomalenému odbourávání což dále přispívá k dyslipidemii a vzniku většího počtu remnantních lipoproteinových částic, které jsou aterogenní (7). Diabetes a hypertriglyceridemie jsou také spojeny se zvýšením poměru apoC-II I apoC-II, což snižuje aktivitu lipoproteinové lipázy a clearance remnantních částic. Sekundárně dochází ke snížení a změně ve složení HDL částic, částečně v důsledku zvýšení CETP zprostředkované výměně neutrálních lipidů mezi HDL částicemi a částicemi bohatými na triglyceridy (chylomikrony a VLDL), a HDL částice se obohacují o triglyceridy (8). HDL částice bohaté na triglyceridy jsou preferenčním substrátem pro jaterní lipázu, a při následné lipolýze dochází ke vzniku remnantních HDL částic a na tuky chudých apoA-I, které jsou z cirkulace eliminovány glomerulární filtrací v ledvinách. Podobným mechanismem vede CETP zprostředkované obohacování LDL částic triglyceridy a lipolýza LDL částic jaterní lipázou ke zvýšení počtu malých denzních LDL částic, které jsou více aterogenní než větší LDL částice (9). K akumulaci malých denzních LDL částic dochází při zvýšení koncentrace triglyceridů v plazmě nad 1,5 mmol/l.
Dietní a režimová opatření v léčbě aterogenní dyslipidemie
Dietní a režimová opatření v léčbě aterogenní dyslipidemie zahrnují zanechání kouření, zdravou dietu a přiměřenou pohybovou aktivitu. Pokud je to vhodné, je primárním cílem často snížení hmotnosti pomocí sníženého kalorického příjmu a zvýšením energetického výdeje. V sub analýzách studie PREDIMED (PREvención con DIeta MEDiterránea) byl sledován vliv konsumpce cukrem a umělými sladidly slazených nápojů na vznik metabolického syndromu. Studie prokázala, že konzumace více než pěti porcí takových nápojů denně riziko metabolického syndromu zvyšuje o 43 %, resp. 74 % (10). V další subanalýze studie PREDIMED bylo prokázáno, že zvýšená konzumace červeného masa a masných výrobků z červeného masa zvyšuje riziko metabolického syndromu o 23 %, resp. 46 %, zatímco nahrazení jinými potravinami bohatými na proteiny (bílé maso – ryby, drůbež, vejce, luštěniny) riziko metabolického syndromu snižuje (11).
Ačkoliv dietní a režimová opatření navodí zlepšení glukózové homeostázy a dyslipidemie, nemáme k dispozici žádná data z klinických studií, která by prokázala současné snížení výskytu kardiovaskulárních příhod. V metaanalýze významu aerobního cvičení u diabetiků v sedmi randomizovaných a kontrolovaných studiích došlo vlivem cvičení k 5% snížení LDL cholesterolu, které by mělo být ekvivalentní 8,5% redukci kardiovaskulárního rizika, tj. že snížení LDL-cholesterolu o 1 % snižuje koronární riziko o 1,7 % (12). Úspěšnost nejrůznějších dietních režimů, které mají vést k redukci nadváhy a ke zlepšení lipidogramu glukózové homeostázy u pacientů s diabetem, zůstává kontroverzní. Izokalorická dieta s nízkým obsahem sacharidů (43 % vs. 55 % celkového příjmu energie) ve srovnání s nízkotučnou dietou (27 % vs. 39 % celkového příjmu energie) měla větší vliv na redukci tukové tkáně během 16týdenního sledování (13). Ještě výraznější restrikce příjmu sacharidů na 14 % celkového příjmu energie společně se zvýšeným příjmem nesaturovaných a snížením příjmem saturovaných tuků zlepšovala glukózovou hemoeostázu, HDL cholesterol triglyceridemii během 16týdenní intervence, ve srovnání s vysokosacharidovou dietou (53 % celkového příjmu energie) (14). Jakákoliv hypokalorická dieta bez rozdílu vedla po 12měsíční intervenci k podobnému snížení tělesné hmotnosti a hemoglobinu A1c (15). Ve studii Steno-2 study se 160 diabetiky s mikroalbuminurií vedl dietní režim, cvičení a farmakologická intervence k většímu zlepšení kontroly glykemie a lipidogramu, ale také ke snížení kardiovaskulárních úmrtí nebo příhod ve srovnání s konvenční léčbou (16). Naproti tomu ve studii Look AHEAD (Action for Health in Diabetes), navzdory intenzivní intervenci životního stylu, kdy pacienti dosáhli snížení nadváhy, zlepšení glykemie a lipidogramu, nebyl prokázán žádný kardiovaskulární benefit během sledování v délce 9,6 let (17). Zdá se tedy, že ke zlepšení kardiovaskulární prognózy je u většiny diabetiků 2. typu nutná vedle dietních a režimových opatření další intervence, včetně léčby farmaky.
Farmakoterapie aterogenní dyslipidemie
Recentní evropská doporučení uvádějí jako cílové hodnoty LDL-c pro střední kardiovaskulární riziko < 2,6 mmol/l (diabetes mellitus 2. typu do 50 let věku) s trváním diabetu < 10 let, bez dalších rizikových faktorů, pro vysoké riziko < 1,8 mmol/l a > 50% snížení (pacienti s diabetem bez orgánového poškození, s dobou trvání diabetu > 10 let nebo s dalším rizikovým faktorem), a pro velmi vysoké riziko < 1,4 mmol/l a > 50% snížení (diabetes s orgánovým postižením). Navíc u nemocných s rekurentní aterotrombotickou příhodou do dvou let od první události při terapii maximální tolerovanou dávkou statinu a ezetimibem je doporučeno snížení LDL-C < 1,0 mmol/l (18). Sekundárním cílem zejména u osob s hypertriglyceridemií je non-HDL-C, jehož cílová hodnota je o 0,8 mmol/l vyšší než doporučený cíl pro LDL-C v dané rizikové kategorii. Podobně používáme i sledování hodnoty apoB, jehož koncentrace u velmi vysoce rizikových osob má být snížena na hodnotu < 0,65 g/l, v kategorii vysokého rizika < 0,8 g/l a u osob se středně zvýšeným rizikem < 1,0 g/l. Hladiny triglyceridů > 1,7 mmol/l a koncentrace HDL -C < 1,0 mmol/l u mužů a < 1,2 mmol/l u žen jsou sice dále považovány za důležité modulátory rizika, ne však za léčebné cíle. Oba tyto parametry zohledňuje cílová hodnota non-HDL-C či apolipoproteinu B.
Statiny jsou doporučovány jako hypolipidemika první volby jak u pacientů s izolovanou elevací LDL-C, tak u pacientů s aterogenní dyslipidemií. Jsou účinné i u jedinců s/bez elevace triglyceridů, s/bez snížení HDL-cholesterolu nebo s/bez metabolického syndromu (19).
Pacienti s inzulinovou rezistencí, a zejména jedinci s diabetes mellitus 2. typu patří do kategorie vysokého kardiovaskulárního rizika (18), které se u nich manifestuje o 15 let dříve než u jedinců bez diabetu – u žen dle kanadské studie v 54,3 letech, u mužů v 47,9 letech (20). Proto je léčba statiny doporučována diabetikům starším 40 let, při trváním diabetu > 15 let nad 30 let věku, nebo tehdy, když je přítomna klinicky signifikantní ateroskleróza či mikrovaskulární postižení (21).
Pokud nedosáhneme terapeutických cílů navýšením dávky statinů, máme další možnosti léčby. Prvním lékem do kombinace bude inhibitor intestinální absorpce cholesterolu ezetimib, který je celkově velmi dobře tolerován. V klinické studii The Improved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT) byl aditivní pokles LDL-cholesterolu ve skupině pacientů po akutním koronárním syndromu spojen se snížením výskytu aterosklerotických kardiovaskulárních onemocnění při léčbě kombinací ezetimibu (10 mg denně) se simvastatinem ve střední dávce (40 mg denně), ve srovnání s monoterapií simvastatinem (22). Kombinovaná léčba simvastatinem a ezetimibem vedla k významnější redukci primárních cílů studie (úmrtí z kardiovaskulárních příčin, hospitalizace z důvodu nestabilní anginy pectoris, infarkt myokardu, koronární revaskularizaci nebo cévní mozková příhoda u diabetiků (hazard ratio 0,86 [95% konfidenční interval 0,78–0,94]) než u nediabetiků (hazard ratio 0,98 [95% konfidenční interval, 0,91–1,04], p < 0,023).
Sekvestranty žlučových kyselin také vedou ke snížení výskytu aterosklerotických kardiovaskulárních příhod (23), ale pacienti je obvykle špatně tolerují, a proto nejsou užívány příliš často.
Fibráty (tj. gemfibrozil, fenofibrát a bezafibrát) aktivují PPAR-alfa (peroxisome proliferator-activated receptor alpha) a modulují lipidogram vícečetnými metabolickými pochody. Gemfibrozil u nás není dostupný, prakticky dostupný je pouze fenofibrát. Protože fibráty významně snižují triglyceridemii a vedou k mírnému zvýšení HDL-cholesterolu, mohou být ideálním hypolipidemikem v léčbě aterogenní dyslipidemie, nicméně klinické studie s fibráty přinesly smíšené a obvykle rozporuplné výsledky (24). Jedním z hlavních rysů těchto studií, a pravděpodobně také důvodem, proč byly výsledky nejednoznačné je to, že pacienti nebyli selektováni co do výskytu aterogenní dyslipidemie. V současné době je hlavní indikací k léčbě fibráty výrazná hypertriglyceridemie (tj. plazmatické triglyceridy > 10 mmol/l) u jedinců v riziku vzniku akutní pankreatitidy. Fibráty nedoporučujeme jako lék do kombinace se statiny v případě jen mírné hypertriglyceridemie. Ačkoliv máme jen málo přímých důkazů z velkých klinických studií, post hoc analýzy naznačují, že jedinci s triglyceridemií > 2,3 mmol/l mohou mít z kombinované léčby statin-fibrát prospěch (25). Současná doporučení EAS/ESC doporučují u vysoce rizikových nemocných s hypertriglyceridemií > 2,3 mmol/l jako lék první volby ke snížení rizika aterosklerotického kardiovaskulárního onemocnění zvolit statin. U vysoce a velmi vysoce rizikových nemocných s triglyceridemií 1,5–5,6 mmol/l i při léčbě statiny by mělo byt zváženo přidání omega-3 mastných kyselin (ikosapent ethyl 2×2 g denně). U osob s přetrvávající hladinou triglyceridů > 2,3 mmol/l při dosažení LDL-C cíle může být zváženo přidání fenofibrát k zavedené terapii statinem (18).
Niacin byl po mnoho let využíván v léčbě hyperlipidemií před nástupem éry statinů, a jeho pozitivní účinky dokládala řada menších klinických studií, dokladujících snížení aterosklerotického kardiovaskulárního rizika u statin-naivních pacientů (26). Nicméně dvě relativně recentní velké klinické studie s niacinem s prodlouženou dobou účinku (27, 28) neprokázaly aditivní snížení aterosklerotického kardiovaskulárního rizika, byly provázeny řadou nežádoucích účinků a předznamenaly ukončení využívání niacinu jako hypolipidemika při snaze snížit aterosklerotické kardiovaskulární riziko.
Alternativou do kombinované léčby jsou monoklonální protilátky inhibující PCSK9 (proproteinové konvertázy pro subtilisin-kexin typu 9). Inhibitory PCSK9 jsou regulátory clearance LDL částic, které fungují na úrovni receptorů pro LDL cholesterol a posilují odstraňování LDL cholesterolu z cirkulace. Studie FOURIER (The Further Cardiovascular Outcomes Research With PCSK9 Inhibition in Subjects With Elevated Risk) u pacientů s aterosklerotickým kardiovaskulárním onemocněním prokázala absolutní snížení primárních cílů o 1,5 % (komplex úmrtí z kardiovaskulárních příčin, infarkt myokardu, cévní mozková příhoda, hospitalizace pro nestabilní anginu pectoris nebo koronární revaskularizace) při mediánu léčby 26 měsíců a léčbě evolocumabem v kombinaci se statiny (29). Léčba evolokumabem je bezpečná u pacientů s i bez diabetu, není spojena se vzestupem glykemie nebo vznikem nového diabetu a vede k signifikantnímu snížení kardiovaskulárních příhod u jedinců s diabetem i bez diabetu. Absolutní snížení rizika je u diabetiků dokonce vyšší, protože mají zároveň vyšší vstupní riziko. Informace o účinku alirokumabu u pacientů s aterogenní dyslipidemií v rámci diabetes mellitus přinesly studie ODYSSEY DM-INSULIN (30) a DM-DYSLIPIDEMIA (31). Tyto studie fáze 3 b a 4 zkoumaly efekt alirokumabu u jedinců s diabetes mellitus. Ve studii DM-INSULIN byla hodnocena účinnost a bezpečnost současné léčby dvěmi biologicky účinnými injekčně podávanými látkami (alirokumab a inzulin) u diabetiků 1. a 2. typu s hypercholesterolemií léčených inzulinem ve vysokém kardiovaskulárním riziku a stabilní maximálně tolerovanou dávkou statinu s/bez další hypolipidemické léčby. Studie DM-DYSLIPIDEMIA hodnotila účinnost a bezpečnost alirokumabu proti standardní léčbě hypolipidemiky (ezetimib, fenofibrát, omega-3 mastné kyseliny nebo kyselina nikotinová) u pacientů s diabetem 2. typu a smíšenou dyslipidemií ve vysokém kardiovaskulárním riziku, při současné stabilní maximálně tolerované léčbě statinem s/bez další hypolipidemické léčby; tato studie jako první hodnotila také jako primární cíl změny v koncentraci non-HDL cholesterolem při léčbě inhibitorem PCSK9. Obě studie, jak ODYSSEY DM-INSULIN (28) a DM-DYSLIPIDEMIA (29), prokázaly účinnost (snížení LDL cholesterolemie o 48–61 %) a bezpečnost léčby alirokumabem také v populaci diabetiků, podobně, jako tomu bylo u nediabetiků v předchozích studiích. Podle post-hoc analýzy došlo také k významnému snížení výskytu kardiovaskulárních příhod (Tab. 1) (32).
Tab. 1. Přehled post-hoc analýz z hlavních randomizovaných klinických studií (RCT) s PCSK9 inhibitory u diabetiků 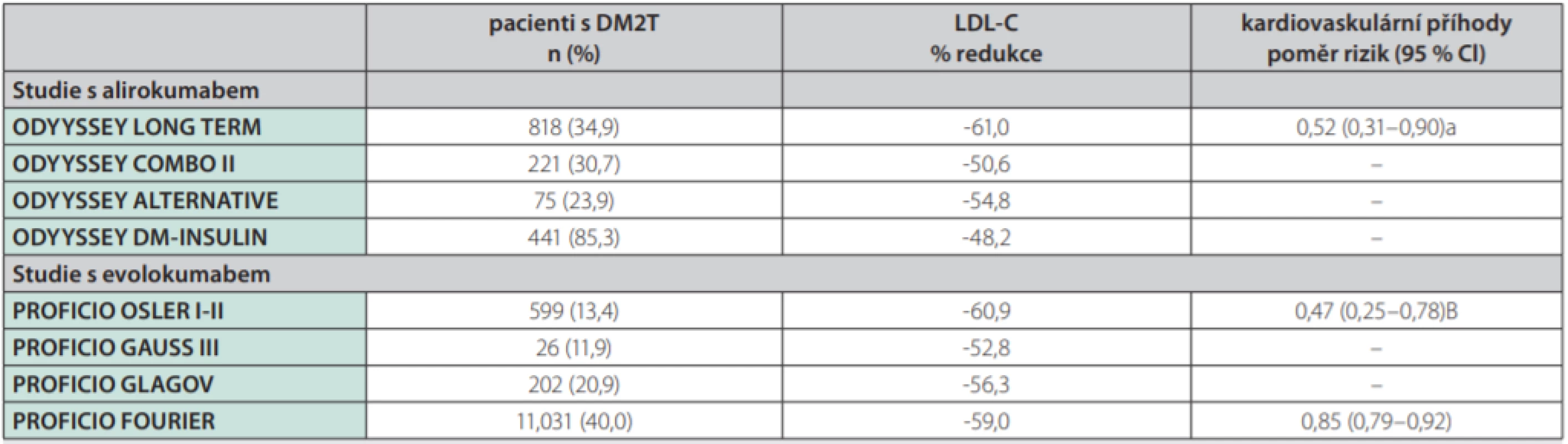
PCSK9 – proproteinové konvertázy subtilisin/kexin typ 9, DMT2 – diabetes mellitus 2. typu, LDL – low-density lipoprotein, CI – confidence interval Upraveno podle (32). V klinickém využití či vývoji jsou další inovativní hypolipidemika s potenciálem ovlivnění aterogenní dyslipidemie – antisense oligonukleotidy (ASO), event. další biologika (4). Patří mezi ně např. mipomersen, ASO zaměřený na produkci lipoproteinů apoB-100. Mipomersen je v současné době rezervován k léčbě homozygotní familiární hypercholesterolemie a nemá jiné povolené indikace. MTP (microsomal triglyceride transfer protein) je klíčový enzym v syntéze jaterních VLDL a střevních chylomikronů, přenášející triglyceridy a jiné neutrální lipidy na nově syntetizované částice apoB. Perorálně podávaný lomitapid, MTP inhibitor, má schválenou indikaci k léčbě homozygotní familiární hypercholesterolemie. Navíc je účinný více než mipomersen v léčbě těžké hypertriglyceridemie, ale je velice nepravděpodobné, zejména s ohledem na velmi vysokou cenu, že bude pro takovou indikaci povolen. Další inovativní léčiva, která ovlivňují produkci lipoproteinů, jsou inhibitory enzymů důležitých v syntéze triglyceridů. Patří sem monoacylglycerol acyltransferása (MGAT) a diacylglycerol acyltransferása (DGAT). V experimentální modelu jsou zkoumány ASO, inhibující isoformy DGAT1 (pradigastat) či MGAT2. Další možností, na kterou se klinický vývoj zaměřuje, je možnost ovlivnění clearance lipoproteinů. Jedná se např. o apoC-III ASO volanesorsen, který byl testován ve studii COMPASS (Cardiovascular Outcomes for People Using Anticoagulation Stratgies trial) (33). Angiopoietin -like proteiny ANGPTL3 a ANGPTL4 jsou inhibitory lipoproteinové lipázy lokálně tvořené v tukové tkáni, srdci a kosterním svalu. Evinakumab je potom monoklonální protilátka proti ANGPTL3 a léčba vede ke snížení triglyceridemie primárně redukcí apoB -obsahujících lipoproteinů, ale také ke snížení LDL cholesterolu. Evinakumab nebo ANGPTL3 ASO dosud nebyly testovány v léčbě diabetické dyslipidemie (4).
Řadu nových poznatků a možností v léčbě aterogenní dyslipidemie přináší také celá plejáda moderních antidiabetik. Jejich rozbor je však námětem na samostatnou publikaci, a proto ho nyní neuvádíme.
Souhrn
K léčebnému ovlivnění aterogenní dyslipidemie s cílem prevence aterosklerotických kardiovaskulárních onemocnění u jedinců s inzulinovou rezistencí, obezitou, metabolickým syndromem či diabetes mellitus 2. typu je v současné době k dispozici řada postupů. Pilířem je snaha o modifikaci životního stylu a diety, ale v řadě, ne-li ve většině případů taková opatření sama o sobě nestačí ke korekci aterogenní dyslipidemie. Ačkoliv není aterogenní dyslipidemie primárně charakteristická zvýšením LDL cholesterolu, je k dispozici řada důkazů z randomizovaných klinických studií, která předurčují statiny jako hypolipidemika první volby u většiny pacientů, kromě jedinců s výraznou hypertriglyceridemií a rizikem vzniku akutní pankreatitidy. Fibráty patří nadále mezi vhodná hypolipidemika do kombinace. Jejich projektivní vliv při současné léčbě statiny bude však nutné ověřit v předem definované populaci pacientů s aterogenní dyslipidemií. V současné době je k dispozici řada inovativních slibných hypolipidemik. Na základě analýzy jedinců s přirozenými genetickými mutacemi mají potenciál k ovlivnění aterosklerotických kardiovaskulárních onemocnění. Také již probíhají prospektivní klinické studie, které mají za cíl ověřit nejen bezpečnost a účinnost, ale také klinický efekt takových léčiv. Klinické studie s inovativními hypolipidemiky tak vytvářejí platformu k jejich využití v léčbě aterogenní dyslipidemie v budoucnosti.
Práce byla podporována výzkumnými projekty AZV ČR č. 17-28882 A, 17-31754 A, Progres Q40 LF UK Hradec Králové.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Vladimír Blaha, CSc.,
III. interní gerontometabolická klinika Lékařské fakulty UK a Fakultní nemocnice,
Sokolská 581,
500 05 Hradec Králové
Cit. zkr: Vnitř Lék 2020; 66(1): 15–20
Článek přijat redakcí: 2. 12. 2019
Článek přijat k publikaci: 3. 1. 2020
Zdroje
1. Xiao C, Dash S, Morgantini C, Hegele RA, Lewis GF. Pharmacological targeting of the atherogenic dyslipidemia complex: the next frontier in CVD prevention beyond lowering LDL cholesterol. Diabetes 2016; 65 : 1767–1778.
2. Dunn FL. Management of dyslipidemia in people with type 2 diabetes mellitus. Rev Endocr Metab Disord 2010; 11 : 41–51.
3. Hayward RA, Reaven PD, Wiitala WL, et al. Follow-up of glycemic control and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015; 372 : 2197–2206.
4. Stahel P, Xiao C, Hegele RA, Lewis GF. The Atherogenic Dyslipidemia Complex and Novel Approaches to Cardiovascular Disease Prevention in Diabetes. Canadian Journal of Cardiology 34 (2018) 595–604.
5. Adeli K, Sacco J, Farr S, Xiao C, Lewis GF. Dyslipidemia of obesity and diabetes. In: Biochemistry of Lipids, Lipoproteins and Membranes. 6th ed. Amsterdam, the Netherlands: Elsevier, 2015 : 549–573.
6. Dash S, Xiao C, Morgantini C, Lewis GF. New insights into the regulation of chylomicron production. Annu Rev Nutr 2015; 35 : 265–294.
7. Krauss RM. All low-density lipoprotein particles are not created equal. Arterioscler Thromb Vasc Biol 2014; 34 : 959–961.
8. Lewis GF, Rader DJ. New insights into the regulation of HDL metabolism and reverse cholesterol transport. Circ Res 2005; 96 : 1221–1232.
9. Krauss RM. Lipids and lipoproteins in patients with type 2 diabetes. Diabetes Care 2004; 27 : 1496–504.
10. Ferreira-Pêgo C, Babio N, Bes-Rastrollo M et al. PREDIMED Investigators. Frequent Consumption of Sugar - and Artifi cially Sweetened Beverages and Natural and Bottled Fruit Juices Is Associated with an Increased Risk of Metabolic Syndrome in a Mediterranean Population at High Cardiovascular Disease Risk. J Nutr. 2016; 146(8): 1528–1536.
11. Becerra -Tomás N, Babio N, Martínez -González MÁ et al. Replacing red meat and processed red meat for white meat, fi sh, legumes or eggs is associated with lower risk of incidence of metabolic syndrome. Clin Nutr. 2016; 35(6): 1442–1449.
12. Kelley GA, Kelley KS. Eff ects of aerobic exercise on lipids and lipoproteins in adults with type 2 diabetes: a meta -analysis of randomizedcontrolled trials. Public Health 2007; 121 : 643–655.
13. Gower BA, Goss AM. A lower -carbohydrate, higher-fat diet reduces abdominal and intermuscular fat and increases insulin sensitivity in adults at risk of type 2 diabetes. J Nutr 2015; 145 : 177S–83S.
14. Tay J, Luscombe -Marsh ND, Thompson CH et al. A very lowcarbohydrate, low-saturated fat diet for type 2 diabetes management: a randomized trial. Diabetes Care 2014; 37 : 2909–2918.
15. Wycherley TP, Thompson CH, Buckley JD et al. Long -term eff ects of weight loss with a very -low carbohydrate, low saturated fat diet on fl ow mediated dilatation in patients with type 2 diabetes: a randomised controlled trial. Atherosclerosis 2016; 252 : 28–31.
16. Gaede P, Lund -Andersen H, Parving HH, Pedersen O. Eff ect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008; 358 : 580–591.
17. The Look AHEAD Research Group. Cardiovascular eff ects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 2013; 369 : 145–154.
18. Mach F, Baigent C, Catapano AL et al. [ESC Scientifi c Document Group]. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modifi cation to reduce cardiovascular risk. Eur Heart J 2019; pii: ehz455.
19. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high -risk individuals: a randomised placebo-controlled trial. Lancet 2002;360 : 7–22.
20. Booth GL, Kapral MK, Fung K, Tu JV. Relation between age and cardiovascular disease in men and women with diabetes compared with non-diabetic people: a population-based retrospective cohort study. Lancet 2006; 368 : 29–36.
21. Anderson TJ, Gregoire J, Pearson GJ et al. 2016 Canadian Cardiovascular Society guidelines for the management of dyslipidemia for the prevention of cardiovascular disease in the adult. Can J Cardiol 2016; 32 : 1263–1282.
22. Cannon CP, Blazing MA, Giugliano RP et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372 : 2387–2397.
23. The Lipid Research Clinics Coronary Primary Prevention Trial Results: I. Reduction in incidence of coronary heart disease. JAMA 1984; 251 : 351–364.
24. Jun M, Foote C, Lv J et al. Eff ects of fi brates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet 2010; 375 : 1875–1884.
25. Elam MB, Ginsberg HN, Lovato LC et al. Association of fenofi brate therapy with long -term cardiovascular risk in statin-treated patients with type 2 diabetes. JAMA Cardiol 2017; 2 : 370–380.
26. Brown BG, Zhao XQ. Nicotinic acid, alone and in combinations, for reduction of cardiovascular risk. Am J Cardiol 2008; 101: S58–62.
27. The HPS2-THRIVE Collaborative Group. Eff ects of extended -release niacin with laropiprant in high-risk patients. N Engl J Med 2014; 371 : 203–212.
28. The AIM -HIGH Investigators. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med 2011; 365 : 2255–2267.
29. Sabatine MS, Giugliano RP, Keech AC et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017; 376 : 1713–1722.
30. Leiter LA, Cariou B, Muller -Wieland D et al. Effi cacy and safety of alirocumab in insulin - -treated individuals with type 1 or type 2 diabetes and high cardiovascular risk: the ODYSSEY DM -INSULIN randomized trial. Diabetes Obes Metab. 2017; 19 : 1781–1792
31. Ray KK, Leiter LA, Mulle -Wieland D et al. Alirocumab vs usual lipid -lowering care as add -on to statin therapy in individuals with type 2 diabetes and mixed dyslipidaemia: the ODYSSEY DM DYSLIPIDEMIA randomized trial. Diabetes Obes Metab. 2018; 20 : 1479–1489.
32. Cicali R, Di Pino A, Ferrari V, Urbano F, Piro S, Rabuazzo AM, Purrello F. New treatment options for lipid-lowering therapy in subjects with type 2 diabetes. Acta Diabetologica (2018); 55 : 209–218.
33. Gouni -Berthold I, Alexander V, Digenio A et al. Apolipoprotein C -III inhibition with volanesorsen in patients with hypertriglyceridemia (COMPASS): a randomized, double-blind, placebo-controlled trial. J Clin Lipidol 2017; 11 : 794–795.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Ve spojení a jednotě je sílaČlánek Autoimunitní hepatitida
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 1- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Léčba hypertenze u metabolického syndromu – update 2019
- Aterogenní dyslipidemie typické pro metabolický syndrom
- Diabetes mellitus 2. typu v praxi – balancování mezi rezistencí a sekrecí
- Hepatotoxicita indukovaná bodybuilding suplementami
- Ve spojení a jednotě je síla
- Chronický stres, psychická nepohoda a deprese zvyšují četnost infekčních, autoimunitních, ale i maligních nemocí
- Autoimunitní hepatitida
- Sarkopenická obezita – aktuální přehled problematiky
- Dvacet let cesty nefrologa do hlubin toxicity fosforu
- Infarkt myokardu u pacienta s metabolickým syndromem a prokázaným syndromem obstrukční spánkové apnoe
- K čemu lze využít výsledek vyšetření koncentrace celkového cholesterolu?
- Monitorovanie a individualizácia liečby inhibítormi P2Y12 ADP receptorov
- Několik poznámek ze čtení posledních doporučených postupů pro léčbu DLP verze 2019
- Prevalence a rizikové faktory T buňkami zprostředkované rejekce u pacientů po transplantaci jater od zemřelého dárce – retrospektivní studie v desetiletém období
- Úskalí v diagnostice srdeční amyloidózy a možnosti terapie
- Bolesti a deformace dolní čelisti – projev fibrózní dysplazie čelisti
- Hlavní téma: Metabolický syndrom
- Založení profesního spolku SAI – sdružení ambulantních internistů, z. s.
- Odešel velký člověk a lékař prof. MUDr. Vítězslav Kolek, DrSc., FCCP
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Sarkopenická obezita – aktuální přehled problematiky
- Chronický stres, psychická nepohoda a deprese zvyšují četnost infekčních, autoimunitních, ale i maligních nemocí
- Odešel velký člověk a lékař prof. MUDr. Vítězslav Kolek, DrSc., FCCP
- Autoimunitní hepatitida
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



