-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMožnosti diagnostiky lidských polyomavirů v klinické praxi
Diagnostic options for human polyomaviruses in clinical practice
The members of the viral family Polyomavirae are widespread in the human population. According to serological studies, almost all adults are infected with at least one of this group of viruses. The primary infection usually occurs in childhood without any clinical signs, and after the primary infection, the viruses establish a persistent infection accompanied by occasional reactivation and shedding of the virus. These viruses often reactivate in immunosuppressed individuals, but only in a minority of these patients, the reactivation results in disease development. This biological property of human polyomaviruses makes laboratory diagnosis considerably difficult. The paper provides an overview of methods for diagnosing human polyomaviruses, which are commonly used for screening, and methods that are still validated by research but have the potential to improve detection and to identify patients at risk of developing diseases associated with polyomavirus infection.
Keywords:
human polyomaviruses – direct detection of polyomaviruses – indirect detection – diagnosis of selected human polyomaviruses – BK and JC polyomavirus diagnosis – MCPyV diagnosis
Autoři: M. Saláková
Působiště autorů: Katedra genetiky a mikrobiologie, Přírodovědecká fakulta, Univerzita Karlova, Praha
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 70, 2021, č. 3, s. 178-188
Kategorie: Souhrnné sdělení
Souhrn
Zástupci virové čeledě Polyomavirae jsou v lidské populaci hojně rozšířeni. Podle sérologických studií jsou téměř všichni dospělí jedinci infikováni nejméně jedním zástupcem této skupiny virů. K primární infekci dochází většinou v dětství bez jakýchkoli klinických příznaků a po primární infekci viry ustavují perzistentní infekci doprovázenou příležitostnou replikací a vylučováním viru. U imunosuprimovaných jedinců dochází k častým reaktivacím, které pak pouze u některých pacientů způsobující komplikace. Tato vlastnost lidských polyomavirů značně ztěžuje laboratorní diagnostiku. V příspěvku jsou uvedeny metody diagnostiky lidských polyomavirů, které se běžně používají pro screening, a metody, které jsou zatím ve stadiu studií, ale mají potenciál zlepšit či zpřesnit vyšetření a identifikovat pacienty v riziku vzniku onemocnění asociovaná s polyomavirovou infekcí.
Klíčová slova:
lidské polyomaviry – přímé metody detekce polyomavirů – nepřímá detekce – diagnostika vybraných lidských polyomavirů – diagnostika BK a JC polyomaviru – diagnostika MCPyV
1. LIDSKÉ POLYOMAVIRY
Polyomaviry představují v současné době jednu z nejvíce se rozšiřujících čeledí vzhledem k počtu nově objevených druhů izolovaných z širokého spektra hostitelů včetně člověka, lidoopů a dalších savců, ptáků i ryb. Do roku 2007 byli známi pouze dva lidští zástupci polyomavirů: BK a JC polyomavirus (BKPyV a JCPyV). Tyto polyomaviry byly objeveny v roce 1971 a pojmenované podle iniciál pacientů, u kterých byli objeveni [1, 2]. Po roce 2007 bylo objeveno dvanáct dalších lidských polyomavirů (HPyVs) pomocí moderních molekulárních technik (tab. 1): Ki polyomavirus (KIPyV) [3], WU polyomavirus (WUPyV) [4], Merkel cell polyomavirus (MCPyV) [5], Human polyomavirus 6 a 7 (HPyV6 a HPyV7) [6], Trichodys - plasia spinulosa-associated polyomavirus (TSPyV) [7], Human polyomavirus 9 (HPyV9) [8], Malawi polyomavirus (MWPyV) [9], STL polyomavirus (STLPyV) [10], HPyV12 [11], New Jersey polyomavirus-2013 (NJPyV) [12] a Lyon IARC polyomavirus (LIPyV) [13]. Mezinárodní komise pro taxonomii virů ICTV (the International Committee on Taxonomy of Viruses) v roce 2016 rozhodla o rozdělení čeledě Polyomaviridae do čtyř samostatných rodů podle sekvenční podobnosti virových proteinů: Alpha-, Beta-, Gammaa Deltapolyomavirus, přičemž MCPyV, HPyV9 a 12 a NJPyV patří do prvního rodu Alphapolyomavirus, BKPyV, JCPyV, KI a WU polyomavirus do rodu Betapolyomavirus a zbytek lidských polyomavirů tvoří rod Deltapolyomavirus [14]. Poslední objevený LIPyV v této klasifikaci zatím nefiguruje.
Tab. 1. Přehled všech lidských polyomavirů*
Table 1. List of human polyomaviruses**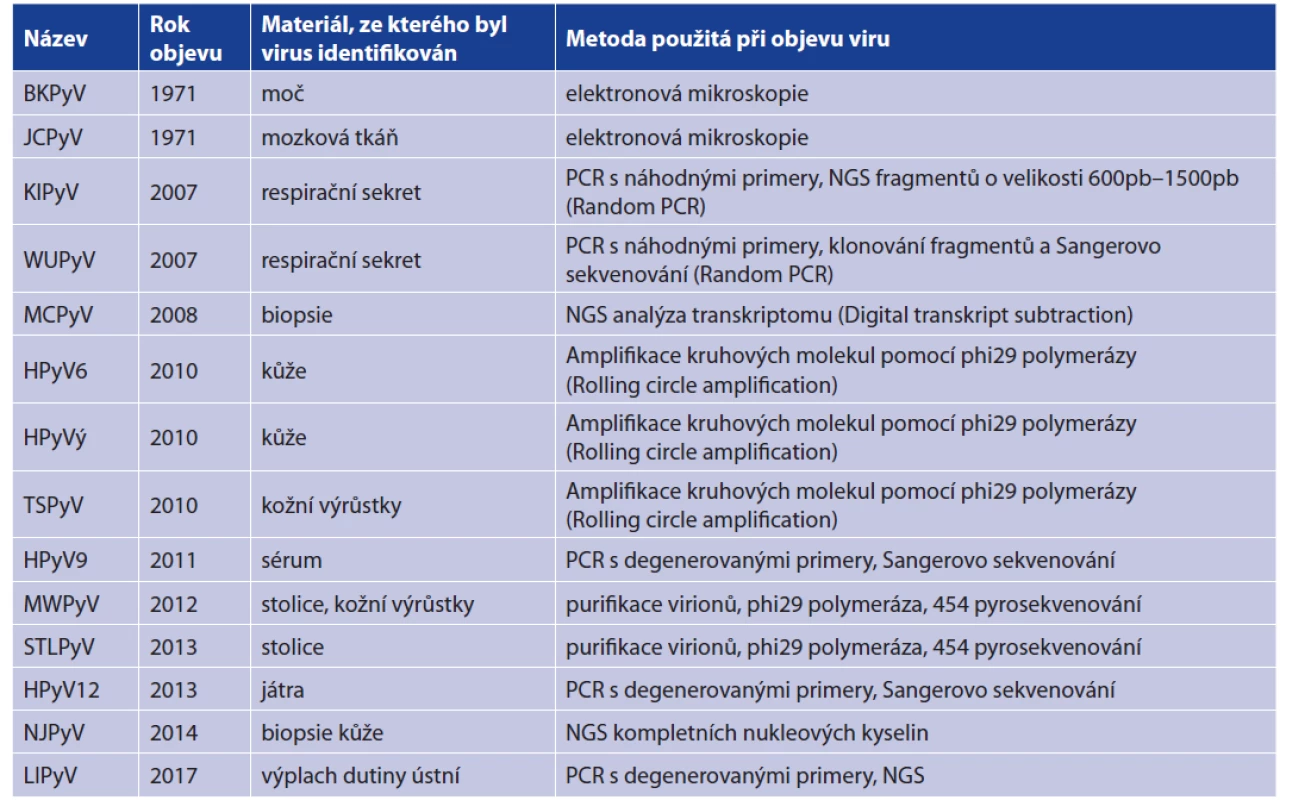
*S upřesněním, v jakém materiálu byl virus prvně identifikován a pomocí jakých molekulárně-biologických metod.
**With the indication of the sample from which each virus was first identified and of the molecular biological method used for its identification.Polyomaviry jsou malé neobalené DNA viry s ikosahedrální kapsidou o velikosti 40–45 nm v průměru a dvouřetězcovým kruhovým genomem o velikosti asi 5 kb. Genom je členěn na tři oblasti: časnou oblast kódující nestrukturní proteiny, pozdní oblast kódující kapsidové proteiny VP a nekódující oblast (non-coding control region – NCCR). Časná oblast kóduje nádorové antigeny, velký T antigen (LTAg) a malý T antigen (stAg). Tyto proteiny vznikají alternativním sestřihem virové pre-mRNA. Pozdní oblast kóduje kapsidové proteiny VP1, VP2 a VP3. T antigeny jsou exprimovány v průběhu časné fáze životního cyklu viru a jsou zapojeny v regulaci virové transkripce a replikace, zatímco kapsidové proteiny jsou produkovány během pozdní fáze infekce [15]. Některé savčí polyomaviry kódují ještě další časné proteiny. Polyomaviry hlodavců kódují střední T antigen (MTAg), který vzniká rozdílným sestřihem mRNA časné virové oblasti a je nezbytný pro transformaci buněk. U MCPyV a také u TSPyV byl popsán protein ALTO, který je exprimován z alternativního čtecího rámce pro velký TAg a je podobný strukturou a pravděpodobně i funkcí MTAg. V pozdní oblasti může být kódován i agnoprotein, nezbytný pro uvolňování viru z buňky.
Infekce polyomaviry je velmi častá a vede k celoživotní přetrvávající asymptomatické perzistenci viru. Po infekci dojde k vytvoření specifických protilátek, především proti hlavnímu kapsidovému proteinu VP1. Prevalence HPyV specifických protilátek v séru zdravých dárců krve České republiky se pohybuje od 32 % do 88 %. Nejvíce zastoupené protilátky jsou protilátky proti HPyV6 (88,2 %), dále proti MWPyV (84,2 %), BKPyV (68,7 %), HPyV7 (65,7 %), MCPyV (63,4 %), TSPyV (63,2 %), KIPyV (58 %), JCPyV (56,6 %) a nejnižší prevalence byla zjištěna pro HPyV9 (31,6 %) [16, 17]. Výsledky prevalence specifických protilátek v České republice jsou srovnatelné s výsledky jiných studií z Evropy a Spojených států amerických [18, 19]. V naší studii jsme protilátky proti MCPyV, JCPyV a BKPyV nalezli i u dětí ve věku 6 let a výše. Výskyt protilátek proti MCPyV a JCPyV byl nejvyšší ve skupině jedinců starších 59 let, zatímco výskyt protilátek proti BKPyV byl nejvyšší u osob ve věku 10–19 let a 20–29 let [17]. Protilátky proti ostatním polyomavirům jsme již testovali pouze u dospělé populace. Séropozitivita zůstala stabilní ve všech vyšetřovaných věkových skupinách, případně došlo pouze k mírnému růstu v souvislosti s vyšším věkem [16].
Charakteristickým rysem polyomavirů je, že výskyt onemocnění spojených s infekcí polyomaviry je, na rozdíl od přítomnosti protilátek, velmi vzácný. Předpokládá se, že virus po masivní virémii vstupuje do stavu perzistence a úspěšně se vyhýbá imunitnímu systému. Místo a molekulární podstata této virové perzistence není ještě zcela prozkoumána a pravděpodobně se mezi jednotlivými polyomaviry liší. Jedním z možných míst perzistence jsou buňky ledvin a močové trubice a/nebo patrové mandle [20–22]. Pro stav perzistence je charakteristická nízká či úplně chybějící replikace viru, případně občasná krátká asymptomatická aktivace. Tak je tomu například u JCPyV infekce v ledvinách a občasné virurie způsobené snížením imunitní odpovědi v průběhu třetího trimestru u těhotných žen nebo u starších osob [23]. Patologický stav způsobuje reaktivace polyomavirů, tj. opětovné zahájení masivní replikace viru. K takovéto reaktivaci polyomavirů dochází u imunosuprimovaných jedinců, a to jak u jedinců podstupujících imunosupresivní léčbu, tak i pacientů s autoimunitním onemocněním nebo HIV infekcí. BKPyV virus způsobuje u imunosuprimovaných pacientů po transplantaci ledvin nefropatii asociovanou s polyomavirovou infekcí (BKVAN) nebo méně uretrální stenózu a u pacientů po transplantaci krvetvorných buněk hemoragickou cystitidu (HC), méně častěji také BKVAN s následnou renální dysfunkcí. Progresivní multifokální leukoencefalopatie (PML), demyelizační onemocnění centrální nervové soustavy způsobené virem JCPyV, se vyskytuje u jedinců se silně potlačenou imunitní odpovědí, a to zejména u pacientů s HIV/AIDS. Onemocnění se ale také stále více objevuje u pacientů s roztroušenou sklerózou podstupujících imunomodulační léčbu. Virus TSPyV způsobuje onemocnění Trichodysplasia spinulosa, velmi vzácné kožní onemocnění u pacientů po transplantaci orgánů [7]. Polyomavirus MCPyV je etiologickým agens vzácného kožního nádoru karcinomu z Merkelových buněk (MCC), který se vyskytuje především u starších jedinců [5]. Dalšími rizikovými faktory tohoto onemocnění jsou, kromě věku, expozice UV, pohlaví, rasa a imunosuprese. Role dalších polyomavirů v patogenezi není ještě zcela známa. HPyV6 a HPyV7 jsou pravděpodobně spojeny se vzácnými, svědivými kožními vyrážkami objevujícími se u imunosuprimovaných pacientů [24–26].
Polyomaviry mají díky produkci nádorových T antigenů (LTAg, MTAg, stAg) onkogenní potenciál, který je dán schopností T antigenu vázat tumor suprimující proteiny pRb a p53, a zasahovat do oprav DNA, apoptózy, buněčné transkripce, degradace proteinů, aktivity telomerázy, imunitního systému a zánětlivých reakcí a stimulaci angiogeneze a migraci buněk. Podobně jako opičí polyomavirus SV40, tak i BKPyV a JCPyV indukují tumorogenezi v experimentálních myších a buněčných modelech. Jejich role v lidských nádorech však nebyla nikdy dostatečně prokázána. Polyomavirus MCPyV tak zůstává jediným lidským polyomavirem, který prokazatelně způsobuje lidský nádor. Přibližně 80 % MCC je pozitivní na MCPyV, který je integrovaný do hostitelského genomu a kóduje zkrácenou formu LTAg schopnou vázat a inaktivovat pRB [27]. V České republice jsme při retrospektivní analýze 35 pacientů s MCC detekovali MCPyV DNA u 72 % vzorků (nepublikovaná data).
2. METODY DETEKCE LIDSKÝCH POLYOMAVIRŮ
Diagnostika lidských polyomavirů je založena především na přímém průkazu virů. K přímé detekci virové DNA se v praxi nejvíce používají amplifikační metody stanovující virovou nálož. Stanovení virové nálože je z hlediska diagnostiky lidských polyomavirů nejdůležitějším ukazatelem masivní reaktivace viru a tím rizika vzniku onemocnění asociovaného s určitým typem lidského polyomaviru či určení příčiny onemocnění. Dalšími metodami přímé detekce lidských polyomavirů, které se občas také používají, jsou elektronová mikroskopie a imunohistochemie. Nepřímá detekce HPyV, tedy detekce HPyV specifických protilátek, je pak velmi důležitá v případě posouzení rizika onemocnění u pacientů s roztroušenou sklerózou podstupujících biologickou léčbu.
2. 1. Přímé metody detekce polyomavirů
První klasická PCR pro detekci BK a JC polyomaviru byla vytvořena a otestována v roce 1989 a jednalo se o reakci pomocí primerů amplifikujících jedinečnou oblast T antigenu obou virů s následným rozlišením BKPyV a JCPyV pomocí hybridizace se specifickými próbami nebo restrikční analýzou s citlivostí 10–100 kopií [28]. První kvalitativní metody PCR byly ale brzy nahrazeny kvantitativními metodami. Takovou je PCR v reálném čase pro stanovení virové nálože (quantitative PCR – qPCR). Termín „virová nálož“ (v angličtině viral load) se poprvé objevil v článku Jonase Salka publikovaném v časopise Nature v roce 1987, ve kterém autor navrhuje, že virovou nálož u HIV-1 pozitivních jedinců lze snížit posílením imunitní odpovědi proti viru, což by vedlo ke snížení nemocnosti, úmrtnosti a přenosu viru [29]. Kvantifikace viru je v poslední době používána jako rychlá metoda detekce virové nálože, která hraje důležitou roli při rozhodování o způsobu léčby pacientů. Stanovuje se jako počet kopií na mililitr tělní tekutiny nebo v počtu mezinárodních jednotek na mililitr tělní tekutiny, v tkáni potom jako počet kopií na buňku. I když má použití metod qPCR v diagnostice lidských polyomavirů nesporné výhody, je velmi důležitá optimalizace metod, protože mezi různými testy qPCR byla popsána vysoká variabilita. Tato variabilita má několik příčin: výběr různých oblastí virového genomu pro návrh primerů a prób včetně velikosti amplikonu, způsob detekce virové DNA, rozdílnost reagencií, metoda extrakce DNA, výběr referenčního materiálu pro stanovení křivky a/ nebo různé typy materiálu (plazma nebo plná krev, fixovaná tkáň). Výběr standardů se ukázal jako nejvýznamnějším zdrojem variability mezi jednotlivými testy, laboratořemi i v jedné laboratoři. Stanovení virové nálože je zatíženo také nepřesnostmi ze strany pacienta, jako např. kolísání virové nálože během dne, prodleva mezi replikací viru a vylučováním [30–31]. Vlivem vysoké citlivosti testů založených na PCR lze detekovat i velmi nízký počet kopií viru, což nemusí mít klinický význam v daném vzorku. Tato vysoká citlivost je také doprovázena rizikem falešných pozitivit v důsledku amplifikace virových sekvencí z nesouvisejících tkání a buněk v testovaném vzorku. Správné nastavení mezní hodnoty je proto nutné pro rozlišení mezi přirozeně proběhlou kolonizací lidského těla a onemocněním. Pro snížení variability mezi laboratorními testy Světová zdravotnická organizace (World Health Organization, WHO) ve spolupráci s Národním ústavem pro biologické standardy a kontroly (National Institute for Biological Standards and Control, NIBSC), vytvořila mezinárodně uznávané referenční materiály, tzv. mezinárodní standardy (IS), pro testy založené na amplifikaci virové DNA pro detekci BKPyV [32] a JCPyV [33]. IS jsou standardy měření s definovanou hodnotou koncentrace. Jsou to lyofilizované virové genomy charakterizované multicentrickými studiemi v mezinárodních jednotkách na mililitr, které umožňují srovnání výsledků mezi různými testy a různými laboratořemi [34]. Předpokládá se, že tyto standardy se využívají jako kalibrátory pro komerční testy a stejně tak jsou určeny i pro laboratoře s vlastními detekčními metodami. WHO mezinárodní standardy jsou připravovány pasážováním viru v buněčných kulturách, při této přípravě může dojít k implementaci mutací do virové sekvence. Díky sekvenaci nové generace (Illumina MiSeq) byly v mezinárodních WHO standardech objeveny různé varianty viru, z nichž některé obsahují delece v genu pro T antigen. To vede k rozdílným výsledkům ve stanovení počtu kopií při použití primerů/ prób amplifikujících oblast T-antigenu a VP genů [35, 36]. BKPyV standard byl proto sekvenován také Sangerovou metodou sekvenace a jeho složení je veřejně přístupné v databázi NCBI (https://www.ncbi.nlm.nih. gov/), a lze tak zjistit, jak budou primery/próby nasedat a zda to může ovlivnit qPCR [37]. S detailní znalostí sekvence IS lze pak tyto standardy používat. Stanovení virové nálože by mělo v laboratoři probíhat vždy stejně, s neměnnou metodou izolace vzorku a qPCR.
Pro absolutní kvantifikaci virové nálože bez nutnosti přípravy standardní křivky lze použít digitální PCR (dPCR). dPCR je metoda PCR, při které je klinický vzorek rozdělen do velkého množství oddělených prostorů (jamička na destičce, čip, kapka olejové emulze – droplet). V těchto oddělených prostorech dochází k samostatné amplifikaci jedné molekuly DNA. Pozitivní výsledek je odečítán v absolutních číslech pomocí fluorescence ze všech jednotlivých oddělených prostor. Metoda dPCR je však finančně i časově náročná, nicméně se jedná o možnou alternativu ke qPCR, především pro vzorky, kde je nezbytné detekovat i nízké virové nálože. Například u pacientů s PML byl detekční limit JCPyV pro qPCR v mozkomíšní tekutině a séru 200 kopií viru na 1 ml, u droplet dPCR pak mnohem nižší, a to 30 kopií viru na 1 ml [38, 39].
Metody cytologie, imunohistochemie a elektronové mikroskopie jsou jedny z nejstarších vyšetřovacích metod v klinické praxi. Pro infekci BKPyV v moči jsou charakteristická inkluzní tělíska ve vylučovaných buňkách, tzv. decoy buňky [1], které lze identifikovat cytologickým zabarvením buněk. Podobná inkluzní tělíska lze také pozorovat v oligodendrocytech infikovaných JCPyV během patologického vyšetření mozku po smrti pacienta. Pro detekci virů v uvolněných epitelových buňkách v moči se používala metoda nepřímé imunofluorescence pomocí králičí protilátky proti SV40, která váže virové kapsidové proteiny VP1 JCPyV a BKPyV, konjugované s fluorescenčně značenou sekundární protilátkou. Tato metoda je však málo citlivá a je velmi časově náročná. Imunohistochemie, tj. přímá detekce virových proteinů pomocí značené protilátky, se používá pro potvrzení histologické analýzy onemocnění, zvláště u BKVAN. Výhodou imunohistochemie je detekce virového proteinu přímo v tkáni, nevýhodou metody je nízká citlivost detekce a náročná analýza zatížená řadou chyb. Pro výchozí identifikaci polyomavirů je využitelná elektronová mikroskopie, rychlá diagnostická metoda schopná rozlišit široké spektrum virů na základě různé morfologie a velikosti částic v celé řadě různých klinických materiálů. Metoda však neumožňuje přesné určení druhu polyomaviru. BK virus a JC virus lze identifikovat pomocí specifických buněčných kultur, kde oba viry vytváří cytopatický efekt. BKPyV tvoří cytopatický efekt na Vero buňkách odvozených z ledvinných buněk kočkodana obecného [1]. Některé izoláty lze ale kultivovat pouze pomocí renálních proximálních tubulárních epitelových buněk (RPTE), na lidských endotelových buňkách (HUV-EC-C) [40] nebo 293TT lidských embryonálních buňkách [41]. JC virus lze kultivovat na lidských primárních fetálních gliových buňkách (PHFG) [42], lidských embryonálních buňkách [43] nebo lidské neuroblastomové buněčné linii IMR - -32 [44]. Kultivace obecně je však časově velmi náročná a některé virové izoláty BKPyV a JCPyV nelze pomocí tkáňových kultur detekovat. Pro ostatní polyomaviry nejsou známy buněčné linie, u kterých viry způsobují cytopatický efekt.
Detekce virových RNA, které by mohly představovat výhodu detekce aktivní virové infekce, jsou zatím ve stadiu studií. Existuje jen velmi málo publikací detekujících virovou mRNA v klinických vzorcích. Pro detekci virové mRNA je vhodnější LTAg mRNA, u které probíhá sestřih, a lze tak jednoduše odlišit virovou RNA od DNA. V tkáni mozku HIV pozitivních pacientů s diagnózou PML byla detekována mRNA LT antigenu ve všech vzorkách, stAg mRNA pak jen v některých vzorkách v závislosti na rozvoji syndromu získaného selhání imunity [45]. BKPyV RNA byla nalezena ve všech biopsiích ledvin pacientů po transplantaci pozitivních na BKPyV DNA, což ukazuje na aktivní virovou infekci v transplantované ledvině [45]. V klinické praxi ale není vždy dostupný materiál vhodný pro vyšetření mRNA. Nejlepším materiálem je čerstvá tkáň odebraná do speciálního média, použít lze také tkáň zalitou v parafínu. RNA izolovaná z parafínových řezů však může být degradovaná, což je třeba vzít do úvahy pro detekci. Velmi důležité je také vždy ošetřit, aby ve vzorku po izolaci RNA nebyla kontaminace DNA. Přítomnost kontaminované DNA, především v případě stanovení virové VP1 mRNA, kde nelze použít primery situované do oblasti sestřihových míst, může vést k falešně pozitivním výsledkům [47].
Potenciál pro monitorování aktivní polyomavirové infekce mají virové miRNA. Polyomaviry kódují dvě miRNA: HPyV‐miR‐B1‐5p, tak i HPyV‐miR‐B1‐3p. Funkce těchto miRNA je u všech polyomavirů stejná, negativně kontrolují expresi virového proteinu LT antigenu, který má hlavní funkci jako iniciátor virové replikace a také inhibují expresi buněčných proteinů, které se podílejí na protivirové obraně buňky. Virové miRNA kontrolují virovou replikaci především v pozdějších fázích virové infekce [48]. Sekvence miRNA jsou dobře konzervované, diagnostické testy založené na miRNA by neměly být ovlivněny polymorfismy v sekvenci viru, jako je to možné ve virových genech cílených v obvyklých testech PCR založených na DNA detekci.
2. 2. Nepřímá detekce
Detekce protilátek proti polyomavirům není vhodná pro diagnostiku infekce vzhledem k vysoké séroprevalenci v populaci. Ve studii Kamminga z roku 2018, ve které sledovali séroprevalenci u zdravých jedinců, a to proti všem 14 lidským polyomavirům, detekovali protilátky nejméně proti čtyřem virům u většiny testovaných vzorků [49]. Přítomnost protilátek v krvi nemá ochranný účinek proti reaktivaci či onemocnění [50]. Pro imunitní odpověď proti virové infekci jsou důležité virus neutralizační protilátky (VNT), které se specificky vážou na povrch kapsidy, a tím brání vazbě viru na receptor buněk. Pokud ale dojde k mutaci vazebného místa virové kapsidy, VNT protilátky nejsou schopné se navázat a virus může „utéct“ imunitní kontrole [51, 52]. Studie prokázaly, že hladiny protilátek do jisté míry kopírují virovou replikaci. V současné době se proto velmi intenzivně řeší otázka, zda je možné hladinu protilátek využít ke stanovení rizika reaktivace viru a následného onemocnění [53, 54].
Většina sérologických testů je založená na detekci protilátek proti hlavnímu kapsidovému proteinu VP1. Jen několik málo skupin detekuje protilátky proti časnému LT proteinu či minoritním kapsidovým proteinům VP2 a VP3. Velmi často se protilátky detekují v ELISA (enzyme linked immunosorbent assays) testu, ve kterém se používají tzv. virus like particules (VLP), viru podobné partikule, které se vážou přímo na dno destiček, ve kterých test probíhá. VLP jsou vytvořeny z VP1 proteinů, které se samovolně skládají do struktur virových kapsid o 72 kapsomerách. Pro tvorbu VLP nejsou potřeba minoritní proteiny. Oproti virovým čás - ticím neobsahují virovou DNA. VLP se připravují v bakulovirovém expresním systému, v kvasinkách, nebo v lidské buněčné linii 293TT. Dále se v testech používají i samotné virové proteiny připravené rekombinantními technikami exprese proteinů nebo syntézou in vitro. Rekombinantními metodami, např. transformací E. coli, připravené antigeny mohou mít na sebe navázané různé peptidové kotvy, které umožní lepší izolaci proteinu a vazbu na plastové destičky, ve kterých testy probíhají. Nejčastěji se používá virový protein fúzovaný s N-terminální glutathion S-transferázou (GST) [55]. V ELISA testu lze jako antigen také použít krátké kapsidové peptidy VP1 o velikosti 17–18 aminokyselin syntetizované in vitro, nazývané mimotopy, které jsou vybrané na základě počítačové analýzy imunogenních oblastí virového proteinu a které mohou vytvářet stabilní sekundární strukturu [56]. Peptidy představují jednoduchý, dobře dostupný, a čistý antigen pro detekci protilátek, což by mohlo snížit variabilitu sérologických testů. Nicméně, vzhledem k jejich malé velikosti, nelze vyloučit zkříženou reaktivitu v důsledku nesprávné konformace peptidu a nižší citlivosti testu v důsledku nedostatečné vazby peptid-protilátka [57].
ELISA test je nejvíce rozšířeným testem pro detekci protilátek proti lidským polyomavirům. Jednotlivé ELISA testy se mezi laboratořemi liší v použitém ředění séra, výpočtem výsledku a hraničními hodnotami pozitivity a také přípravou antigenu. ELISA test umožňuje detekci pouze jednoho typu protilátky v reakci. Naproti tomu „bead-based assay“ (např. Luminex technologie (xMAP)) umožňuje souběžné stanovení více proteinů v jedné reakci díky vazbě antigenů na polystyrenové kuličky, které fungují nejenom jako nosič různých antigenů, ale i jako nosič fluorescenční značky. Pozitivní výsledky jsou odečítány průtokovou cytometrií na základě velikosti kuliček a fluorescenčního signálu.
Zatím jediný test, který detekuje VNT protilátky je test založený na bázi tzv. pseudovirionů (PsV), které jsou specifické pro jednotlivé polyomaviry. PsV jsou syntetizovány v buňkách (např. 293TT, RPEC) po transfekci plazmidy, které nesou geny pro všechny kapsidové proteiny společně s plazmidem kódujícím reportérový gen (GFP, Gaussia luciferáza). Ten je zabalen do virové obálky, kterou kapsidové proteiny vytvoří. PsV se pak kultivují s testovaným sérem v různých ředěních a směs se poté přidá k buňkám. Pokud jsou v sérech přítomny specifické neutralizační protilátky, zablokují vazbu PsV na buněčné receptory a v buňkách nedojde k syntéze reportérového proteinu. Protilátkami zprostředkovaná neutralizace je proto definována redukcí aktivity reportérového genu [51]. Test detekce VNT na bázi PsV je velmi citlivý a přesný. Tato metoda je ale bohužel velmi náročná, vyžaduje zkušené pracovníky a dobře vybavenou laboratoř na úrovni BSL2. Není proto vhodná pro klinickou diagnostiku.
Hemaglutinačně-inhibiční test (HIT) je ze všech používaných testů nejjednodušší a nejrychlejší. Využívá schopnosti virů vázat kyselinu sialovou na povrchu erytrocytů, a tím je aglutinovat. V případě inkubace virového antigenu s pacientským sérem, které obsahuje protilátky, dojde k vytvoření komplexu antigen-protilátka a tento komplex brání aglutinaci erytrocytů. Test je však ve srovnání s předchozími méně citlivý a přesný, proto se v klinice a ani ve výzkumu nepoužívá. Hamilton et al. srovnávali HIT s ELISA testem pro detekci protilátek proti BKPyV a JCPyV v souboru 114 jedinců, v obou testech byly získány shodné výsledky, nicméně ELISA test detekoval mnohem vyšší titry protilátek [58]. Jako antigeny byly v obou testech použity nativní viriony produkované v buněčných liniích.
Kromě přítomnosti specifických protilátek jsou pro imunitní odpověď organismu důležité virově specifické T buňky. Monitorování specifické T buněčné imunity může predikovat zvýšené riziko reaktivace lidských polyomavirů u imunosuprimovaných jedinců, a může tak být metodou blízké budoucnosti. Stanovení virově specifických T lymfocytů lze provést pomocí metody ELISPOT (Enzyme-linked ImmunoSpot Assay) nebo pomocí průtokové cytometrie, která dokáže navíc rozlišit CD4 a CD8 T lymfocyty. ELISPOT je metoda detekce T lymfocytů, které reagují na přítomnost virového antigenu produkcí určitého cytokinu. Nejčastěji se stanovuje produkce interferonu gama pomocí ELISPOT readeru. Další možnou metodou je cytotoxický test, který stanovuje radioaktivní chrom uvolněný z buněk působením aktivovaných cytotoxických T lymfocytů. Dosavadní data ukazují, že kvantita a funkce virově specifických T lymfocytů inverzně koreluje s virovou replikací.
3. DIAGNOSTIKA VYBRANÝCH LIDSKÝCH POLYOMAVIRŮ
Při detekci lidských polyomavirů v klinické praxi je vždy třeba brát v potaz důvody testování klinických vzorků. Dalším důležitým faktorem je také to, jaké testy se pro detekci používají, především jaká je jejich klinická a analytická citlivost a specificita. Screeningové a diagnostické metody jsou neustále evaluovány rozsáhlými studiemi, na jejichž základě pak dochází k novým doporučením, které mění či zpřísňují stávající postupy (viz BKPyV). Také se testuje použití nových markerů virové replikace, aby se zpřesnila citlivost a specifita s cílem zachytit časnou reaktivaci viru a vyhodnotit rizika vzniku onemocnění, popř. zpřesnit diagnostiku s ohledem na léčbu pacientů.
3. 1. Diagnostika BK polyomaviru
Onemocnění asociované s BKPyV se vyskytuje převážně u pacientů po transplantaci ledvin a u pacientů po transplantaci hematopoetických kmenových buněk. U pacientů po transplantaci dalších solidních orgánů se žádné onemocnění, jako je BKPyV asociovaná nefropatie či hemoragická cystitida, neobjevuje. Velmi vzácně jsou s infekcí BKPyV spojené izolované případy karcinomu močového měchýře, encefalopatie, záněty nosní sliznice, plic a trávicí trubice. Reaktivace BKPyV může také hrát roli v patogenezi autoimunitního onemocnění systémového lupus erythematodes (SLE) [59].
Reaktivace BKPyV u imunosuprimovaných pacientů po transplantaci ledvin může způsobit BKPyV asociovanou nefropatii (BKVAN), které postihuje 1–10 % pacientů. Klinicky se onemocnění projevuje intersticiální nefritidou, která je v případě pozdní diagnózy obtížně léčitelná a může vést k trvalému poškození funkce ledvin nebo selhání štěpu v prvních letech po transplantaci [60]. Definitivní diagnóza BKVAN je provedena na základě histologického nálezu biopsie transplantované ledviny. Charakteristickým znakem histologického vyšetření je infiltrace tkáně zánětlivými buňkami, přítomnost plazmatických buněk, nekróza tubulárního epitelu a přítomnost intranukleárních inkluzních tělísek, které značí reakci tkáně na replikaci BKPyV [61]. Podobný obrázek lze ale zaměnit také s akutní rejekcí, proto se také používá imunohistochemie s barvením protilátkou proti SV40, která váže LTAg BKPyV. Histologické vyšetření má omezenou citlivost a může být falešně negativní v 10–30 % případů pozitivních na BKPyV v krvi, a to z důvodu odběru biopsie brzy po nástupu virémie, pouze lokální přítomností zánětu a také může ve vzorku chybět medulární tubulární tkáň, která je více infikovaná virem [62].
V minulosti byla prvním diagnostickým testem reaktivace BKPyV cytologie moče a identifikace „decoy cell“, která měla ale velmi nízkou pozitivní prediktivní hodnotu (5–29 %) a vysokou variabilitu [62]. V současné době je riziko vzniku BKVAN u pacientů po transplantaci ledvin hodnoceno na základě detekce BKPyV DNA pomocí qPCR. U zdravých séropozitivních dárců krve není BKPyV DNA pomocí qPCR detekovatelná v plazmě, pouze v moči asi u 7 % jedinců, a to v nízké virové náloži, která je menší než 104 kopií viru na 1 ml [63]. Podobná prevalence je i u dárců a příjemců ledvin před transplantací. U pacientů po transplantaci ledvin je virová nálož v moči podstatně vyšší a reaktivace viru v důsledku imunosuprese vede k detekci viru v plazmě asi u 25 % příjemců s virovou náloží 104 kopií a více viru na 1 ml [64]. Rozsáhlé studie stanovily jako rizikovou hladinu pro rozvoj BKVAN 104 kopií viru na 1 ml v plazmě a/nebo 107 kopií viru na 1 ml v moči, přičemž v praxi se více používá stanovení virové nálože v plazmě [62].
Podle doporučení skupiny KDIGO (Kidney Disease Improving Global Outcomes) a Evropských doporučení z roku 2014 pro péči o pacienty po trasplantaci ledvin (KTR), by měli být pacienti po transplantaci ledvin pravidelně testováni na přítomnost BKPyV DNA v plazmě nebo moči k identifikaci zvýšeného rizika BKVAN měsíčně během 6 měsíců a dále po 3 měsících do jednoho roku a 6 měsících do dvou let po transplantaci. Setrvalá hladina BKPyV viremie nad hranicí 104 kopií na 1 ml je definována jako „riziková“ pro vznik BKVAN [65], Americká společnost pro transplantace (The Infectious Diseases Community of Practice of the American Society of Transplantation) ve své poslední publikaci doporučuje, aby se testovala přítomnost BKPyV DNA v plazmě měsíčně v prvních 9 měsících po transplantaci a následně 3měsíční screening až 2 roky po transplantaci, pro případnou terapeutickou intervenci u pacientů KTR s přítomností BKPyV DNA [60]. To je výrazné rozšíření testování oproti předchozím doporučením především na základě rozsáhlých klinických studií, které ukazují 20–30 % případů reaktivace BKPyV DNA po 6 měsících po transplantaci a 18 % po 1 roce u dospělých pacientů [66, 67]. Nicméně, při nesprávném nastavené qPCR při současné doporučující hranici BKPyV virémie ≥ 104 kopií na 1 ml může dojít k podcenění výsledků stanovení virové nálože a vyššímu riziku vzniku onemocnění bez včasné intervence.
Pro pacienty po HSCT není doporučen žádný screening, jako je tomu u KTR. Test se doporučuje pouze u symptomatických jedinců při hematurii a cystitidě jako doplňující test k vyloučení jiné etiologie HC. U více než 80 % pacientů se objevuje BKPyV virurie s virovou náloží nad hranicí 107 kopií viru na 1 ml, u 5–20 % se vyvine onemocnění, které podstatně zhoršuje kvalitu života a prodlužuje pobyt v nemocnici, pravděpodobně však nevede k úmrtí pacientů. U symptomatických pacientů je doporučeno následné pravidelné testování krve po dobu trvání obtíži, jako riziková je virová nálož v plazmě ≥ 104 kopií na 1 ml. Testování asymptomatických pacientů není v současné době doporučeno, protože není žádná preemptivní terapie [68].
Další molekulární metody detekce BKPyV jsou zatím pouze ve stadiu testování a nejsou uvedeny v doporučeních pro screening pacientů, nicméně první studie ukazují možnost použití těchto metod po důkladné validaci v rozsáhlých klinických studiích.
Studie, které sledují miRNA u pacientů po transplantaci ledvin ukazují, že množství miRNA bkv-miR-B1-5p a bkv-miR-B1-3p koreluje s virovou náloží [69–71]. Vyšší hladina miRNA BKV-miR-B1-5p koreluje s vyšší hladinou virové DNA moči a vývoje BKVAN, a to jak celkové množství BKPyV miRNA bkv-miR-B1-5p v moči, tak i specificky miRNA testovaná pouze v exozomech izolovaných z moče [72].
Možnost využití sérologických testů ukazují výsledky příjemců ledviny s vysokým titrem protilátek, kteří mají nižší riziko virémie BKPyV ve srovnání s příjemci s nízkým titrem protilátek [54]. Dále mají pacienti po transplantaci ledvin zvýšené riziko rozvoje virémie BKPyV po transplantaci ledvin dárce s vysokou hladinou protilátek BKPyV, což patrně reflektuje virovou nálož BKPyV štěpu [73].
U pacientů po transplantaci ledvin je v současné době nejvíce prostudované použití metody ELISPOT nebo průtokové cytometrie pro stanovení specifické T buněčné imunitní odpovědi. Studie reaktivace BKPyV u dospělých pacientů po transplantaci ledvin ukázala, že zvýšení BKPyV specifické buněčné imunity je doprovázeno snížením virové nálože až k jejímu vymizení [74]. Na druhou stranu, při snížení funkce či dokonce ztrátě BKPyV specifických T lymfocytů v období po transplantaci dochází ke zvýšení rizika virové replikace. Costa et al. pozorovali epizody reaktivace BKPyV pouze u pacientů se ztrátou funkce BKPyV specifických T lymfocytů [75]. U dětí s nízkou hladinou < 0,5 buněk/ ml BKPyV specifických CD4+ T buněk a < 0,1 buněk/ml BKPyV specifických CD8+ T buněk měřených průtokovou cytometrií přetrvávala virémie po dlouhou dobu a bylo nutné u těchto pacientů snížit množství imunosupresiv. U dětí s hladinou specifických T buněk vyšší, než uvedené hodnoty byla reaktivace BKPyV pouze krátkodobá a nebylo nutné měnit léčbu [76]. Tyto studie ukazují, že stanovení virově specifických T buněk je užitečným nástrojem v managementu pacientů po transplantaci ledvin. U pacientů s předpokládanou BKVAN by mohlo pomoct v hodnocení rizika vývoje komplikací, tj. u pacientů s předpokládanou BKVAN s nízkou hladinou čí ztrátou virově specifických T buněk by byla nutná redukce imunosupresiv, u pacientů s vysokou hladinou by nebyla nutná změna léčby.
3. 2. Diagnostika JC polyomaviru
JCPyV je původcem vzácného demyelizačního onemocnění centrální nervové soustavy, progresivní multifokální leukoencefalopatie (PML). JCPyV infikuje a způsobuje lyzi oligodendrocytů, buněk, které jsou v mozku zodpovědné za produkci myelinu, a také astrocytů, které jsou důležité pro celou řadu procesů v CNS. Onemocnění bylo prvně popsáno v roce 1958 u pacienta s chronickou lymfocytární leukemií. Od roku 1982 se toto onemocnění sporadicky vyskytuje také u pacientů s HIV. Po zavedení biologické léčby v roce 2005 jako léku 2. volby pro pacienty s vysoce aktivní roztroušenou sklerózou (RS) se toto onemocnění objevuje i u těchto pacientů. Do ukončení rozsáhlé studie v lednu 2014 s léčivem Tysabri (natalizumab) bylo onemocnění PML identifikováno u 430 pacientů ze skupiny 12 000 pacientů s RS léčených Tysabri, s úmrtností 20 až 25 % (Tysabri safety update 2014). Definitivní diagnóza PML může být stanovena na základě histologie biopsie mozku [77]. Diagnóza onemocnění je založena na třech základních kritériích: neurologické a/nebo psychické změny, typické léze v mozku na zobrazení z magnetické rezonance (MR) a detekci JCPyV v mozkomíšním moku. Pokud jsou přítomné klinické příznaky nebo charakteristické obrazy na MR a je detekována virová DNA v mozkomíšním moku, onemocnění je označeno jako pravděpodobná PML [38].
Metoda qPCR je velmi citlivá metoda detekce JCPyV v mozkomíšním moku u pacientů s charakteristickými neurologickými a morfologickými změnami (citlivost > 95 %) [38]. Screening mozkomíšního moku u jedinců s rizikem PML bez klinických příznaků a charakteristického obrazu MR nepřináší žádnou výhodu v diagnostice PML, protože nízká virová nálož JCPyV DNA může být detekována jak u pacientů s RS, tak i u zdravých jedinců [78]. Swinnen et al. se ve své retrospektivní studii z roku 2019 zabývali virovou náloží v mozkomíšním moku u pacientů s PML a určili jako rizikovou hladinu viru v mozkomíšním moku vyšší než 103 kopií viru na ml [79]. Jedná se zatím o jedinou takovouto studii, a proto pro definitivní potvrzení je potřeba další výzkum. U pacientů s rizikem PML je velmi důležité používat pro detekci JCPyV primery amplifikující časnou oblast T antigenu nebo oblast kódující kapsidový VP1 protein navržené tak, aby detekovaly všechny genotypy a varianty JCPyV přítomné u pacientů s PML [80]. U těchto pacientů se totiž nachází odlišné formy JCPyV, první forma označovaná jako archetyp obsahuje segmenty -a, -b, -c, -d, -e a -f v NCCR oblasti, které jsou zodpovědné za regulaci časné a pozdní virové transkripce a replikace. Tato forma viru je vylučována močí zdravých jedinců a je přenosná na dalšího jedince. Další formy nekódující oblasti JCPyV značované také jako „prototyp“ nebo neurotropní forma asociovaná s PML obsahující celou řadu mutací, duplikací a delecí jednotlivých segmentů a také mutace v genu pro VP1 [81]. Tyto formy dávají viru výhodu při replikaci a také je u nich zvýšená exprese časné oblasti virového genomu [82]. Detekce neurotropních forem JCPyV by mohly pomoct při včasné diagnostice PML.
Další klinické materiály jako je plazma a moč se pro diagnózu PML pomocí detekce JCPyV DNA nepoužívají. JCPyV virémie v těchto vzorcích je velmi vzácná, u pacientů s RS se prevalence pohybuje v rozmezí 0,2 až 2,6 % [83, 84] a nebyla nalezena asociace virové nálože s PML. U 400 zdravých dárců nebyla JCPyV DNA nalezena v plazmě vůbec [62]. JCPyV virurie je mnohem častější, objevuje se asi u 19 % zdravých jedinců s virovou náloží v průměru 104 kopií viru na 1 ml moči. Vždy se jedná o krátké epizody, které brzy odezní [62]. Pozitivní prediktivní hodnota detekce u jedinců s rizikem PML je velmi nízká [78].
Sérologická analýza přítomnosti protilátek proti JCPyV není vhodná pro diagnózu PML vzhledem k vysoké prevalenci v populaci. Používá se ale u RS pacientů léčených přípravkem Tysabri pro stratifikaci rizika vzniku PML. U pacientů s RS léčených přípravkem Tysabri byl validován ELISA test s dvoustupňovou konfirmací výsledku (Stratify a/nebo Stratify DxSelect) ke stanovení rizika vzniku PML [85–88]. Toto vyšetření je doporučeno před zahájením léčby, nebo pokud není u pacienta, jemuž je přípravek již podáván, znám jeho sérostatus, tak i v průběhu léčby. U pacientů s negativními výsledky se doporučuje test každých 6 měsíců opakovat kvůli případné sérokonverzi. U anti-JCPyV pozitivního pacienta, výsledek stanovení indexu protilátek ≤ 0,9 znamená velmi nízké riziko vývoje PML, vysoké titry > 1,5 zvyšují riziko PML [88]. U pacientů s nízkou hodnotou indexu, kteří v minulosti nebyli léčeni imunosupresivy, se také doporučuje opakované vyšetření každých 6 měsíců po dobu 2 let léčby. U pacientů s léčbou Tysabri déle než 2 roky nebo u pacientů s vysokou hladinou protilátek je pak doporučené pravidelné kontrolní vyšetření MR mozku každé 3–6 měsíců (EMA Tysabri PML Update, 2017).
Přítomnost JCPyV specifických T lymfocytů u pacientů s PML také výrazně zlepšuje klinický obraz a prodlužuje přežití těchto pacientů [89, 90]. Tyto studie byly provedeny cytotoxickým testem založeným na uvolňování radioaktivního chromu z buněk prezentujících na svém povrchu virové peptidy, metodou velmi náročnou na provedení a nevhodnou pro běžnou klinickou diagnostiku. Stejně jako u BKPyV byly také provedeny studie u HIV pacientů a pacientů s RS podstupujících biologickou léčbu s využitím detekce virové miRNA pro stanovení rizika vývoje PML, žádné ale zatím jednoznačně vhodnost stanovení nepotvrdily [91].
3. 3. Diagnostika MCPyV
Karcinom z Merkelových buněk představuje rychle rostoucí nádor na kůži exponované UV záření, především u starších a imunosuprimovaných jedinců. Jedná se o velmi agresivní nádor s 5letým přežíváním okolo 40 % [92]. Incidence tohoto nádoru je 0,7 na 100 000 obyvatel, během posledních let však dochází k dramatickému nárůstu onemocnění. V USA vzrostla incidence mezi lety 2000–2013 o 95 % [93]. Jedná se o nádor s častými lokálními rekurencemi po chirurgickém odstranění nádoru, onemocnění je také často spojeno s postižením regionálních uzlin a také vznikem vzdálených metastáz. Většina případů MCC je způsobena integrací MCPyV do lidského genomu, menší část MCC nádorů je způsobena velkým množstvím mutací buněčné DNA, které jsou charakteristické pro poškození UV zářením a nacházejí se také např. u melanomů.
Diagnostika nádoru je velmi složitá a vzhledem k nenápadnému klinickému obrazu může docházet k pozdní diagnóze. Velmi vzácně se může vyskytnout případ karcinomu z Merkelových buněk s postižením lymfatické uzliny bez identifikovaného nádoru na kůži (unknown primary Merkel cell carcinoma, UPMCC). Tyto případy, stejně tak jako nemelanomové kožní nádory, popř. metastáze dalších neuroendokrinních nádorů ztěžují diagnostiku MCC. Karcinom je diagnostikován na základě klinického obrazu a histologického vyšetření, které odhaluje infiltraci dermis nebo hypodermis proliferujícími nádorovými buňkami s vlastnostmi neuroendokrinního karcinomu. Ke konečné diagnóze se používá kromě klinického obrazu imunohistochemické vyšetření, a to pozitivita na cytokeratin 20, dalším vodítkem je negativita na thyroidní transkripční faktor 1 (TTF-1). Tyto dva markery jsou v současné době považovány za hlavní markery MCC. Kromě nich se také používají neuroendokrinní markery chromogranin A, neuron-specifickou enolázu a synaptophysin, stejně tak epiteliální markery jako cytokeratin AE1/AE3 [92]. Detekce MCPyV, která se zatím v rutinní diagnostice nepoužívá, je v případě nejasného imunohistochemického obrazu či netypického případu velmi užitečným nástrojem. Nejběžnějšími metodami je detekce MCPyV DNA pomocí qPCR z DNA izolované z nádorů nebo imunohistochemické barvení MCPyV LTAg pomocí komerčně dostupné monoklonální protilátky CM2B4 (LT; CM2B4; Santa Cruz. Biotechnology, Dallas, TX, USA). U vzorků MCC je stanovena kritická hladina ≥ 1 kopie viru na buňku v ideálním případě, kdy jsou ve vzorku přítomny pouze nádorové buňky, pokud tkáň obsahuje i nenádorové buňky a stroma jsou pozitivní i vzorky s virovou náloži ≥ 0,01 kopie viru na buňku. V případě nižší virové nálože je virus součástí běžné kožní mikroflóry, a to až u 40 % zdravých jedinců bez známek jakéhokoliv onemocnění, proto je velmi důležité přesné stanovení virové nálože ve vzorku (nepublikovaná data).
4. ZÁVĚR
Polyomaviry jsou v lidské populaci všudypřítomné. Po primární infekci ustavují perzistentní infekci s občasnou krátkodobou reaktivací. Tato reaktivace je patrně spojena se sníženou imunitní odpovědí, protože k ní dochází více u starších jedinců a těhotných žen. K vývoji onemocnění spojené s polyomavirovou infekcí dochází pouze u imunosuprimovaných jedinců, a to jen u některých z nich. Těžiště současné diagnostiky lidských polyomavirů je u pacientů po transplantaci ledvin a s RS podstupujících biologickou léčbu k včasnému odhalení reaktivace, a tím možnosti včasné intervence před samotným onemocněním. Raná stadia reaktivace a progrese onemocnění jsou na rozdíl od pozdějších stadií reverzibilní. Zavedení pravidelného monitorování BKPyV u příjemců ledvin a okamžitý preventivní terapeutický zásah mělo okamžitý dopad na snížení počtu ztrát štěpu [62]. Ke snížení PML u HIV – pozitivních jedinců došlo po zavedení aktivní protivirové terapie (HAART), která zlepšuje funkci imunitního systému. U pacientů s RS podstupujících biologickou léčbu pravidelné testování na přítomnost protilátek proti JCPyV a sledování změn v hladinách protilátek vedlo k redukci incidence PML o 2–3 % (Tysabrihcp.com. “Tysabri safety: a well-established profile.” https://www. tysabrihcp.com/en_us/home/efficacy-safety/pml-risk. html). I když jsou k dispozici citlivé metody detekce lidských polyomavirů, jejich pozitivní prediktivní hodnota onemocnění není vysoká, pro BKVAN dosahuje v závislosti na studii hodnotu 30–50 % [94, 95]. Důvodem této nízké hodnoty jsou poměrně časté případy reaktivace viru bez onemocnění, vývoj onemocnění i u jedince, který nesplnil kritické hodnoty detekce nebo nesprávné nastavení laboratorních metod. Ke zlepšení situace diagnostiky pomocí qPCR jistě pomohou mezinárodní standardy WHO, velmi důležité je také pravidelné monitorování pomocí externího hodnocení kvality. Další metody, které jsou zatím ve stadiu testování, jako je detekce virové miRNA, stanovení buněčné imunity, či množství protilátek, mohou po validaci v klinické praxi přispět ke zlepšení identifikace rizikových pacientů, a tím k včasné medicínské intervenci, která zabrání propuknutí onemocnění. Metody qPCR detekce dalších polyomavirů, jako je MCPyV, HPyV 6, 7 a/nebo TSPyV, mohou v případě nejasného mikroskopického obrazu a imunohistochemického průkazu znaků pomoci v diagnostice kožních lézí a malignit. Vzhledem k vzrůstající incidenci onemocnění MCC je třeba toto vyšetření zařadit do běžné klinické praxe.
Grantová podpora
Tato práce byla vytvořena za finanční podpory grantu 17-29992A AZV MZ.
Do redakce došlo dne 12. 10. 2020.
Adresa pro korespondenci:
RNDr. Martina Saláková, Ph.D.
Katedra genetiky a mikrobiologie, PřF UK
Biotechnologické a biomedicínské centrum Akademie věd a Univerzity Karlovy ve Vesci (Biocev)
Průmyslová 595
252 50 Vestec
e-mail: martina.salakova@natur.cuni.cz
Zdroje
1. Gardner SD, Field AM, Coleman DV, Hulme B. New human papovavirus (B.K.) isolated from urine after renal transplantation. Lancet, 1971;1 : 1253–1257.
2. Padgett BL, Walker DL, ZuRhein GM, et al. Cultivation of papova - like virus from human brain with progressive multifocal leucoencephalopathy. Lancet, 1971;1 : 1257–1260.
3. Allander T, Andreasson K, Gupta S, et al. Identification of a third human polyomavirus. J Virol, 2007;81 : 4130–4136.
4. Gaynor AM, Nissen MD, Whiley DM, et al. Identification of a novel polyomavirus from patients with acute respiratory tract infections. PLoS Pathog, 2007;3:e64.
5. Feng H, Shuda M, Chang Y, Moore PS. Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science, 2008;319 : 1096–1100.
6. Schowalter RM, Pastrana DV, Pumphrey KA, et al. Merkel cell polyomavirus and two previously unknown polyomaviruses are chronically shed from human skin. Cell Host Microbe, 2010;7 : 509–515.
7. van der Meijden E, Janssens RW, Lauber C, et al. Discovery of a new human polyomavirus associated with trichodysplasia spinulosa in an immunocompromized patient. PLoS Pathog, 2010;6:e1001024.
8. Scuda N, Hofmann J, Calvignac-Spencer S, et al. A novel human polyomavirus closely related to the african green monkey-derived lymphotropic polyomavirus. J Virol, 2011;85 : 4586–4590.
9. Siebrasse EA, Pastrana DV, Nguyen NL, et al. WU polyomavirus in respiratory epithelial cells from lung transplant patient with Job syndrome. Emerg Infect Dis, 2015;21 : 103–106.
10. Lim ES, Reyes A, Antonio M, et al. Discovery of STL polyomavirus, a polyomavirus of ancestral recombinant origin that encodes a unique T antigen by alternative splicing. Virology, 2013;436 : 295–303.
11. Korup S, Rietscher J, Calvignac-Spencer S, et al. Identification of a novel human polyomavirus in organs of the gastrointestinal tract. PLoS One, 2013;8:e58021.
12. Mishra N, Pereira M, Rhodes RH, et al. Identification of a novel polyomavirus in a pancreatic transplant recipient with retinal blindness and vasculitic myopathy. J Infect Dis, 2014;210 : 1595 – 1599.
13. Gheit T, Dutta S, Oliver J, et al. Isolation and characterization of a novel putative human polyomavirus. Virology, 2017;506 : 45 – 54.
14. Calvignac-Spencer S, Feltkamp MC, Daugherty MD, et al. A taxonomy update for the family Polyomaviridae. Arch Virol, 2016;161 : 1739–1750.
15. Imperiale MJ, Major EO, et al. Polyomaviruses. In: Knipe DM, Howley PM, editors. Fields virology. Fifth Edition. Philadelphia: Lippincott, Williams & Wilkins; 2007. pp 2263–2298.
16. Sroller V, Hamsikova E, Ludvikova V, et al. Seroprevalence rates of HPyV6, HPyV7, TSPyV, HPyV9, MWPyV and KIPyV polyomaviruses among the healthy blood donors. J Med Virol, 2016;88 : 1254 – 1261.
17. Sroller V, Hamsikova E, Ludvikova V, et al. Seroprevalence rates of BKV, JCV, and MCPyV polyomaviruses in the general Czech Republic population. J Med Virol, 2014; 86 : 1560–1568.
18. van der Meijden E, Bialasiewicz S, Rockett RJ, et al. Different serologic behavior of MCPyV, TSPyV, HPyV6, HPyV7 and HPyV9 polyomaviruses found on the skin. PLoS One, 2013;8:e81078.
19. Nicol JT, Robinot R, Carpentier A, et al. Age-specific seroprevalences of merkel cell polyomavirus, human polyomaviruses 6, 7, and 9, and trichodysplasia spinulosa-associated polyomavirus. Clin Vaccine Immunol, 2013;20 : 363–368.
20. Chesters PM, Heritage J, McCance DJ. Persistence of DNA sequences of BK virus and JC virus in normal human tissues and in diseased tissues. J Infect Dis, 1983;147 : 676–684.
21. Salakova M, Koslabova E, Vojtechova Z, et al. Detection of human polyomaviruses MCPyV, HPyV6, and HPyV7 in malignant and non-malignant tonsillar tissues. J Med Virol, 2016;88 : 695 – 702.
22. Sadeghi M, Wang Y, Ramqvist T, et al. Multiplex detection in tonsillar tissue of all known human polyomaviruses. BMC Infect Dis, 2017;17 : 409.
23. Knowles WA, Pillay D, Johnson MA, et al. Prevalence of longterm BK and JC excretion in HIV-infected adults and lack of correlation with serological markers. J Med Virol, 1999;59 : 474–479.
24. Schrama D, Groesser L, Ugurel S, et al. Presence of human polyomavirus 6 in mutation-specific BRAF inhibitor-induced epithelial proliferations. JAMA Dermatol, 2014;150 : 1180–1186.
25. Ho J, Jedrych JJ, Feng H, et al. Human polyomavirus 7-associated pruritic rash and viremia in transplant recipients. J Infect Dis, 2015;211 : 1560–1565.
26. Nguyen KD, Lee EE, Yue Y, et al. Human polyomavirus 6 and 7 are associated with pruritic and dyskeratotic dermatoses. J Am Acad Dermatol, 2017;76 : 932–940.
27. Chang Y, Moore PS. Merkel cell carcinoma: a virus-induced human cancer. Annu Rev Pathol, 2012;7 : 123–144.
28. Arthur RR, Dagostin S, Shah KV. Detection of BK virus and JC virus in urine and brain tissue by the polymerase chain reaction. J Clin Microbiol, 1989;27 : 1174–1179.
29. Salk J. Prospects for the control of AIDS by immunizing seropositive individuals. Nature, 1987;327 : 473–476.
30. Sueur C, Solis M, Meddeb M, et al. Toward standardization of BK virus monitoring: evaluation of the BK virus R-gene kit for quantification of BK viral load in urine, whole-blood, and plasma specimens. J Clin Microbiol, 2014;52 : 4298–4304.
31. Hayden RT, Sun Y, Tang L, et al. Progress in Quantitative Viral Load Testing: Variability and Impact of the WHO Quantitative International Standards. J Clin Microbiol, 2017;55 : 423–430.
32. Govind S, Hockley J, Morris C. Collaborative study to establish the 1st WHO international standard for BKV DNA for nucleic acid amplification technique (NAT)-based assays. WHO ECBS Report 2015: WHO/BS/2015.2270. Dostupné na www: http:// www.who.int/biologicals/expert_committee/BS2270_Establishment_ BKV_DNA_1st_WHO_IS.pdf (Accessed January 2017).
33. Govind S, Hockley J, Morris C. Collaborative study to establish the 1st WHO international standard for JCV DNA for nucleic acid amplification technique (NAT)-based assays. WHO ECBS Report 2015: WHO/BS/2015.2259. Dostupné na www: http:// www.who.int/biologicals/expert_committee/BS2259_Establishment_ JCV_DNA_1st_WHO_IS.pdf (Accessed January 2017).
34. Govind S, Hockley J, Morris C, Almond N. The development and establishment of the 1st WHO BKV International Standard for nucleic acid based techniques. Biologicals, 2019;60 : 75–84.
35. Bateman AC, Greninger AL, Atienza EE, et al. Quantification of BK Virus Standards by Quantitative Real-Time PCR and Droplet Digital PCR Is Confounded by Multiple Virus Populations in the WHO BKV International Standard. Clin Chem, 2017;63 : 761–769.
36. Greninger AL, Bateman AC, Atienza EE, et al. Copy Number Heterogeneity of JC Virus Standards. J Clin Microbiol, 2017;55 : 824 – 831.
37. Jenkins A, Govind S, Morris C, Berry N. Complete Genome Sequence of Original Material Used To Derive the WHO International Standard for Human Polyomavirus BK DNA. Microbiol Resour Announc, 2019;8: e00911–19.
38. Berger JR, Aksamit AJ, Clifford DB, et al. PML diagnostic criteria: consensus statement from the AAN Neuroinfectious Disease Section. Neurology, 2013;80 : 1430–1438.
39. Giovannelli I, Ciccone N, Vaggelli G, et al. Utility of droplet digital PCR for the quantitative detection of polyomavirus JC in clinical samples. J Clin Virol, 2016;82 : 70–75.
40. Hanssen RC, Hansen H, Traavik T. Human endothelial cells allow passage of an archetypal BK virus (BKV) strain – a tool for cultivation and functional studies of natural BKV strains. Arch Virol, 2005;150 : 1449–1458.
41. Olsen GH, Hirsch HH, Rinaldo CH. Functional analysis of polyomavirus BK non-coding control region quasispecies from kidney transplant recipients. J Med Virol, 2009;81 : 1959–1967.
42. Knowles WA, Sasnauskas K. Comparison of cell culture-grown JC virus (primary human fetal glial cells and the JCI cell line) and recombinant JCV VP1 as antigen for the detection of anti-JCV antibody by haemagglutination inhibition. J Virol Methods, 2003;109 : 47–54.
43. Miyamura T, Yoshiike K, Takemoto KK. Characterization of JC papovavirus adapted to growth in human embryonic kidney cells. J Virol, 1980;35 : 498–504.
44. Akatani K, Imai M, Kimura M, et al. Propagation of JC virus in human neuroblastoma cell line IMR-32. J Med Virol, 1994;43 : 13–19.
45. Ishaq M, Stoner GL. Differential expression of mRNAs for JC virus large and small tumor antigens in brain tissues from progressive multifocal leukoencephalopathy patients with and without AIDS. Proc Natl Acad Sci U S A, 1994;91 : 8283–8287.
46. Schmid H, Nitschko H, Gerth J, et al. Polyomavirus DNA and RNA detection in renal allograft biopsies: results from a European multicenter study. Transplantation, 2005;80 : 600–604.
47. Hirsch HH. VP1 messenger RNA levels in urine for diagnosing BK virus nephropathy? Transplantation, 2003;75 : 2160.
48. Imperiale MJ. Polyomavirus miRNAs: the beginning. Curr Opin Virol, 2014;7 : 29–32.
49. Kamminga S, van der Meijden E, Feltkamp MCW, Zaaijer HL. Seroprevalence of fourteen human polyomaviruses determined in blood donors. PLoS One, 2018;13:e0206273.
50. Comoli P, Cioni M, Basso S, et al. Immunity to Polyomavirus BK Infection: Immune Monitoring to Regulate the Balance between Risk of BKV Nephropathy and Induction of Alloimmunity. Clin Dev Immunol, 2013;256923.
51. Pastrana DV, Brennan DC, Cuburu N, et al. Neutralization serotyping of BK polyomavirus infection in kidney transplant recipients. PLoS Pathog, 2012;8:e1002650.
52. Ray U, Cinque P, Gerevini S, et al. JC polyomavirus mutants escape antibody-mediated neutralization. Sci Transl Med, 2015;7 : 306ra151.
53. Ginevri F, Azzi A, Hirsch HH, et al. Prospective monitoring of polyomavirus BK replication and impact of pre-emptive intervention in pediatric kidney recipients. Am J Transplant, 2007;7 : 2727–2735.
54. Bohl DL, Brennan DC, Ryschkewitsch C, et al. BK virus antibody titers and intensity of infections after renal transplantation. J Clin Virol, 2008;43 : 184–189.
55. Kean JM, Rao S, Wang M, Garcea RL. Seroepidemiology of human polyomaviruses. PLoS Pathog, 2009;5:e1000363.
56. Pietrobon S, Bononi I, Mazzoni E, et al. Specific IgG Antibodies React to Mimotopes of BK Polyomavirus, a Small DNA Tumor Virus, in Healthy Adult Sera. Front Immunol, 2017;8 : 236.
57. Leinikki P, Lehtinen M, Hyoty H, et al. Synthetic peptides as diagnostic tools in virology. Adv Virus Res, 1993;42 : 149–186.
58. Hamilton RS, Gravell M, Major EO. Comparison of antibody titers determined by hemagglutination inhibition and enzyme immunoassay for JC virus and BK virus. J Clin Microbiol, 2000;38 : 105 – 109.
59. Gupta N, Nguyen CQ, Modica RF, et al. BK viruria and viremia in children with systemic lupus erythematosus. Pediatr Rheumatol Online J, 2017;11 : 21.
60. Hirsch HH, Randhawa PS. BK polyomavirus in solid organ transplantation - Guidelines from the American Society of Transplantation Infectious Diseases Community of Practice. Clin Transplant, 2019;33:e13528.
61. Drachenberg CB, Papadimitriou JC, Hirsch HH, et al. Histological patterns of polyomavirus nephropathy: correlation with graft outcome and viral load. Am J Transplant, 2004;4 : 2082–2092.
62. Hirsch HH, Randhawa P. BK polyomavirus in solid organ transplantation. Am J Transplant, 2013;13 Suppl 4 : 179–188.
63. Egli A, Infanti L, Dumoulin A, et al. Prevalence of polyomavirus BK and JC infection and replication in 400 healthy blood donors. J Infect Dis, 2009;199 : 837–846.
64. Girmanova E, Brabcova I, Bandur S, et al. A prospective longitudinal study of BK virus infection in 120 Czech renal transplant recipients. J Med Virol, 2011;83 : 1395–1400.
65. Hirsch HH, Randhawa P. BK virus in solid organ transplant recipients. Am J Transplant, 2009;9 Suppl 4:S136–146.
66. Schachtner T, Babel N, Reinke P. Different risk factor profiles distinguish early-onset from late-onset BKV-replication. Transpl Int, 2015;28 : 1081–1091.
67. Imlay H, Whitaker K, Fisher CE, Limaye AP. Clinical characteristics and outcomes of late-onset BK virus nephropathy in kidney and kidney-pancreas transplant recipients. Transpl Infect Dis, 2018;20:e12928.
68. Cesaro S, Dalianis T, Hanssen RC, et al. ECIL guidelines for the prevention, diagnosis and treatment of BK polyomavirus-associated haemorrhagic cystitis in haematopoietic stem cell transplant recipients. J Antimicrob Chemother, 2018;73 : 12 – 21.
69. Li JY, McNicholas K, Yong TY, et al. BK virus encoded microRNAs are present in blood of renal transplant recipients with BK viral nephropathy. Am J Transplant, 2014;14 : 1183–1190.
70. Virtanen E, Seppala H, Helantera I, et al. BK polyomavirus microRNA expression and sequence variation in polyomavirus-associated nephropathy. J Clin Virol, 2018;102 : 70–76.
71. Huang Y, Zeng G, Randhawa PS. Detection of BKV encoded mature MicroRNAs in kidney transplant patients: Clinical and biologic insights. J Clin Virol, 2019;119 : 6–10.
72. Kim MH, Lee YH, Seo JW, et al. Urinary exosomal viral microRNA as a marker of BK virus nephropathy in kidney transplant recipients. PLoS One, 2017;12:e0190068.
73. Wunderink HF, van der Meijden E, van der Blij-de Brouwer CS, et al. Pretransplantation Donor-Recipient Pair Seroreactivity Against BK Polyomavirus Predicts Viremia and Nephropathy After Kidney Transplantation. Am J Transplant, 2017;17 : 161 – 172.
74. Binggeli S, Egli A, Schaub S, et al. Polyomavirus BK-specific cellular immune response to VP1 and large T-antigen in kidney transplant recipients. Am J Transplant, 2007;7 : 1131–1139.
75. Costa C, Mantovani S, Piceghello A, et al. Evaluation of polyomavirus BK cellular immune response by an ELISpot assay and relation to viral replication in kidney transplant recipients. New Microbiol, 2014;37 : 219–223.
76. Ahlenstiel-Grunow T, Sester M, Sester U, et al. BK Polyomavirus - specific T Cells as a Diagnostic and Prognostic Marker for BK Polyomavirus Infections After Pediatric Kidney Transplantation. Transplantation, 2020;104(11):2393–2402.
77. Dong-Si T, Richman S, Wattjes MP, et al. Outcome and survival of asymptomatic PML in natalizumab-treated MS patients. Ann Clin Transl Neurol, 2014;1 : 755–764.
78. Iacobaeus E, Ryschkewitsch C, Gravell M, et al. Analysis of cerebrospinal fluid and cerebrospinal fluid cells from patients with multiple sclerosis for detection of JC virus DNA. Mult Scler, 2009;15 : 28–35.
79. Swinnen B, Saegeman V, Beuselinck K, et al. Predictive value of JC virus PCR in cerebrospinal fluid in the diagnosis of PML. Diagn Microbiol Infect Dis, 2019;95 : 114859.
80. Dumoulin A, Hirsch HH. Reevaluating and optimizing polyomavirus BK and JC real-time PCR assays to detect rare sequence polymorphisms. J Clin Microbiol, 2011;49 : 1382–1388.
81. Yogo Y, Sugimoto C. The archetype concept and regulatory region rearrangement. In: Khalili K, Stoner GL, editors. Human polyomaviruses. Wiley-Liss; New York; 2001. pp. 127–148.
82. Gosert R, Kardas P, Major EO, Hirsch HH. Rearranged JC virus noncoding control regions found in progressive multifocal leukoencephalopathy patient samples increase virus early gene expression and replication rate. J Virol, 2010;84 : 10448–10456.
83. Rudick RA, O‘Connor PW, Polman CH, et al. Assessment of JC virus DNA in blood and urine from natalizumab-treated patients. Ann Neurol, 2010;68 : 304–310.
84. Warnke C, Adams O, Hartung HP, Kieseier BC. Assessment of JC virus DNA in blood and urine from natalizumab-treated patients. Ann Neurol, 2011;69 : 215–216.
85. Gorelik L, Lerner M, Bixler S, et al. Anti-JC virus antibodies: implications for PML risk stratification. Ann Neurol, 2010;68 : 295–303.
86. Plavina T, Berman M, Njenga M, et al. Multi-site analytical validation of an assay to detect anti-JCV antibodies in human serum and plasma. J Clin Virol, 2012;53 : 65–71.
87. Lee P, Plavina T, Castro A, et al. A second-generation ELISA (STRATIFY JCVTM, DxSelectaTM) for detection of JC virus antibodies in human serum and plasma to support progressive multifocal leukoencephalopathy risk stratification. J Clin Virol, 2013;57 : 141–146.
88. Plavina T, Subramanyam M, Bloomgren G, et al. Anti-JC virus antibody levels in serum or plasma further define risk of natalizumab - associated progressive multifocal leukoencephalopathy. Ann Neurol, 2014;76 : 802–812.
89. Koralnik IJ, Du Pasquier RA, Letvin NL. JC virus-specific cytotoxic T lymphocytes in individuals with progressive multifocal leukoencephalopathy. J Virol, 2001;75 : 3483–3487.
90. Marzocchetti A, Tompkins T, Clifford DB, et al. Determinants of survival in progressive multifocal leukoencephalopathy. Neurology, 2009;73 : 1551–1558.
91. White MK, Sariyer IK, Gordon J, et al. Diagnostic assays for polyomavirus JC and progressive multifocal leukoencephalopathy. Rev Med Virol, 2016;26 : 102–114.
92. LeBoit PE, Burg G, Weedon D, Sarasin A. Pathology and Genetics of Skin Tumours WHO Classification of Tumours, 4rd Edition, 11th volume.
93. Paulson KG, Park SY, Vandeven NA, et al. Merkel cell carcinoma: Current US incidence and projected increases based on changing demographics. J Am Acad Dermatol, 2018;78 : 457–463.
94. Hirsch HH, Knowles W, Dickenmann M, et al. Prospective study of polyomavirus type BK replication and nephropathy in renal - transplant recipients. N Engl J Med, 2002;347 : 488–496.
95. Viscount HB, Eid AJ, Espy MJ, et al. Polyomavirus polymerase chain reaction as a surrogate marker of polyomavirus-associated nephropathy. Transplantation, 2007;84 : 340–345.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2021 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Prokalcitonin: marker vhodný pro diagnostiku sepse i hodnocení antimikrobiální léčby
- Autoinflamatorní onemocnění: prognózu zlepšuje včasná diagnostika a protizánětlivá terapie
- Infekční komplikace virových respiračních infekcí – sekundární bakteriální a aspergilové pneumonie
-
Všechny články tohoto čísla
- Pokud by byla k dispozici vakcína proti covid-19, chtěli byste být očkováni? A jste očkováni proti chřipce a jiným nemocem? Průzkum mezi studenty vysokých škol v době nouzového stavu
- Citlivost testů antigenu SARS-CoV-2 z hlediska testování ve velkém měřítku
- Evaluation of tuberculosis diagnostic tools, with extending MODS assay use to second line susceptibility testing
- Detailní molekulární charakterizace izolátů Neisseria meningitidis metodou sekvenace celého genomu (WGS), Česká republika, 2010–2019
- Možnosti diagnostiky lidských polyomavirů v klinické praxi
- Co víme a stále nevíme o klíšťové encefalitidě?
- Autozápalový proces v patogenéze generalizovanej pustulárnej psoriázy a perspektívy jej cielenej liečby
- Epidemiologie, rizikové faktory a možnosti prevence akutních leukemií
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Epidemiologie, rizikové faktory a možnosti prevence akutních leukemií
- Co víme a stále nevíme o klíšťové encefalitidě?
- Možnosti diagnostiky lidských polyomavirů v klinické praxi
- Autozápalový proces v patogenéze generalizovanej pustulárnej psoriázy a perspektívy jej cielenej liečby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



