-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Atopická dermatitida: současná doporučení pro diagnostiku a léčbu. Část I.
Atopic Dermatitis: Current Guidelines for Diagnosis and Treatment. Part I.
Atopic dermatitis is a chronic, intensively itchy disease affecting children and adults that requires intensive local and often systemic treatment. It has a varied clinical picture and is accompanied by number of different comorbidities. The choice of treatment method depends on the age of the patient, the severity of the disease and associated diseases. In Part I, the authors summarize current knowledge about diagnosis, comorbidities, appropriate examinations, assessment of the severity of atopic dermatitis, principles of skin care, basic and anti-inflammatory local treatment, antipruritic treatment and treatment of infectious complications.
Keywords:
diagnosis – comorbidities – atopic dermatitis – assessment of the severity of atopic dermatitis – principles of skin care – basic and antiinflammatory topical treatment – antipruritic and antiinfective therapy
Autoři: A. Machovcová 1; P. Cetkovská 2; M. Kojanová 3; J. Fialová 3; I. Karlová 4; E. Březinová 5; R. Litvik 6; M. Salavec 7; S. Gkalpakiotis 8
Působiště autorů: Dermatovenerologické oddělení FN Motol Praha, primářka MUDr. Alena Machovcová, Ph. D., MBA 1; Dermatovenerologická klinika LF UK a FN Plzeň, přednosta MUDr. Jan Říčař, Ph. D. 2; Dermatovenerologická klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Jiří Štork, CSc. 3; Klinika chorob kožních a pohlavních LF UP a FN Olomouc, přednosta odb. as. MUDr. Martin Tichý, Ph. D. 4; I. dermatovenerologická klinika LF MU a FN u sv. Anny, Brno, přednostka prof. MUDr. Hana Jedličková, Ph. D. 5; Kožní oddělení FN Ostrava, primářka MUDr. Yvetta Vantuchová, Ph. D. 6; Klinika nemocí kožních a pohlavních LF UK a FN Hradec Králové, přednosta doc. MUDr. Miloslav Salavec, CSc. 7; Dermatovenerologická klinika 3. LF UK a FNKV Praha, přednosta prof. MUDr. Petr Arenberger, DrSc., MBA 8
Vyšlo v časopise: Čes-slov Derm, 98, 2023, No. 2, p. 50-76
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Atopická dermatitida je chronické, intenzivně svědící onemocnění postihující dětí i dospělé, jež vyžaduje intenzivní lokální a často i celkovou léčbu. Má pestrý klinický obraz a je doprovázena řadou různých komorbidit. Výběr léčebné metody závisí na věku pacienta, závažnosti onemocnění a přidružených chorobách. Autoři v části I shrnují současné poznatky o diagnostice, komorbiditách, vhodných vyšetřeních, hodnocení závažnosti atopické dermatitidy, zásady péče o kůži, lokální léčbu základní a protizánětlivou, léčbu antipruriginózní a léčbu infekčních komplikací.
Klíčová slova:
diagnostika – komorbidity – atopická dermatitida – hodnocení závažnosti atopické dermatitidy – zásady péče o kůži – lokální léčba základní a protizánětlivá – léčba antipruriginózní – léčba infekčních komplikací
Diagnostika, komorbidity, vyšetření, hodnocení závažnosti, zásady péče,
lokální léčba základní a protizánětlivá, léčba antipruriginózní, léčba
protiinfekčníÚVOD
Atopická dermatitida (AD) je často se vyskytující zánětlivá svědivá dermatóza, která postihuje děti i dospělé. Typický je chronický nebo recidivující průběh, intenzivní svědění a xeróza kůže. Průběh onemocnění je individuální a těžko předvídatelný.
EPIDEMIOLOGIE
Atopická dermatitida postihuje celosvětově více než 20 % dětí a 2–8 % dospělé populace. Většinou se manifestuje v dětském věku, vznik v prvním roce života se udává u 60–85 % dětí, do 5 let života u více než 85 % případů, avšak AD se může objevit v jakémkoliv věku. Spontánní remise se udávají u dětí starších 5 let ve 40–60 %, pokud jsou projevy mírné. Asi u 20 % pacientů AD ustoupí do doby dospívání, u třetiny případů dochází k perzistenci projevů do dospělosti, kde může přejít do podoby ekzému na rukou. De novo se v dospělém věku AD diagnostikuje asi ve třetině případů [61, 86]. Rezistentní bývají případy nemocných s mutací genu pro filagrin. Nepříznivými prognostickými faktory pro vývoj AD jsou generalizovaný ekzém v dětství, asociace s alergickou rýmou a/nebo astmatem, AD u rodičů, časný vznik AD a vysoké hladiny IgE protilátek. AD se často manifestuje jako první z ostatních atopických chorob (alergická rinokonjunktivitida, potravinová alergie, astma bronchiale) [10, 61, 86, 89].
ETIOPATOGENEZE
Atopická dermatitida je heterogenní onemocnění. Jde o multifaktoriální onemocnění a klinické projevy jsou výsledkem interakce mezi geny a podněty negenetickými. Na základě genetické dispozice se objevuje dysfunkce kožní bariéry a neuroimunologická dysbalance [38]. Dokumentována byla asociace s geny FLG, SPINK5, RANTES, TLR, IL-4 a IL-4R, IL-5, IL-6, IL-13, IL-18, či RUNX1 [3, 39]. Homeostáza stratum corneum je závislá na proteinu filagrinu a na jeho metabolismu [39, 71]. Tento protein hraje zásadní roli při kontrole epidermálních ztrát vody (tzv. transepidermal water loss – TEWL). Porucha bariérové funkce kůže u AD je důsledkem abnormalit stratum corneum a abnormálního metabolismu lipidů (zejména ceramidů) a narušené tvorby inhibitorů proteáz a strukturálních proteinů (především filagrinu), ale i poruch nespecifické imunity kůže a dysbiózy. Epidermis hraje důležitou roli při bariérové funkci kůže, její těsné intercelulární spoje regulují pohyb látek do zevního prostředí [38]. Při poruše kožní bariéry se zvyšuje dráždivost kůže vůči nespecifickým vlivům (kožní hyperreaktivita) a stoupá pravděpodobnost senzibilizace a vyvolání zánětu [39, 76]. Narušená kožní bariéra usnadňuje průnik alergenů do kůže, ty navozují imunitní odpověď zprostředkovanou Th2 (T helper) lymfocyty a jsou doprovázené uvolňováním prozánětlivých cytokinů (interleukinů – IL) IL-4, IL-5 a IL-13 [39, 59]. Epidermální keratinocyty produkují IL-33, IL-25 a thymický stromální lymfopoetin (TSLP), které podporují migraci Th2 lymfocytů do lézí. Při Th2 imunitní odpovědi se zvyšuje tvorba alergen-specifických IgE protilátek, po jejichž navázání na vysokoafinní receptor pro IgE (FcεRI) na povrchu Langerhansových a žírných buněk dochází k uvolnění dalších cytokinů a mediátorů. Aktivované dendritické buňky stimulují migraci Th22 lymfocytů do kůže a tyto buňky uvolňují IL-22 a indukují epidermální akantózu. V chronické fázi onemocnění se uplatňují Th1 lymfocyty [39, 58]. Významným rysem AD je pruritus. V kožních lézích dochází k uvolňování řady substancí (pruritogenů) včetně IL-4/13, IL-31, TSLP, které působí na nervová zakončení a navozují svědění. Následné škrábání zhoršuje projevy AD [38, 40, 42, 50]. V udržení kožní homeostázy hraje důležitou roli kožní mikrobiom. Kolonizace kůže Staphylococcus aureus (St. aureus) a Malassezia sp. (u 90 % jedinců) vede k dysbióze. Stafylokoky mají např. za následek produkci superantigenů, které stimulují Th17 odpověď s následnou produkcí IL-17, který podle některých autorů hraje roli v patogenezi AD [1, 39, 48].
DIAGNOSTIKA
Atopická dermatitida se diagnostikuje na základě klinických symptomů, k dispozici zatím není žádný specifický laboratorní biomarker, který by stanovil diagnózu AD. Aktuální výzkum se zaměřuje na patogenezi AD s cílem najít biomarkery, jež budou schopné potvrdit diagnózu a rozlišit jednotlivé fenotypy AD (tzn. intrinsická vs. extrinsická AD, AD u dětí, AD asijské populace apod.). Zatím je možné diagnostikovat AD pouze na základě symptomů, klinického obrazu a vyloučením jiných diagnóz (tab. 1, 2) [10, 31, 39, 61, 80]. Přibližně u 80 % nemocných s AD jsou přítomné zvýšené hladiny celkových nebo alergen-specifických IgE protilátek, senzibilizace na alergeny zevního prostředí (potravinové, inhalační) a další atopická onemocnění – astma bronchiale, alergická rinokonjunktivitida (tzv. IgE-asociovaná či extrinsická AD), asi 20 % pacientů nemá pří tomnou senzibilizaci na exogenní alergeny a pacienti nemají přidružená atopická onemocnění (tzv. non-IgE - -asociovaná či intrinsická AD) [39, 61]. Často je přítomna periferní eozinofilie. Počet eozinofilů se zvyšuje s tíží AD, a lze je tak považovat za marker progrese onemocnění. Ještě silněji korelují s progresí AD zvýšené hladiny chemokinu TARC (thymus and activation regulated chemokine) [10, 39, 61, 80, 86].
Tab. 1. Diagnostická kritéria AD podle Hanifin a Rajka [31] ![Diagnostická kritéria AD podle Hanifin a Rajka [31]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/0f849aa3a22da823e9f3a7725b57cd55.png)
Tab. 2. Diagnostická kritéria pro AD 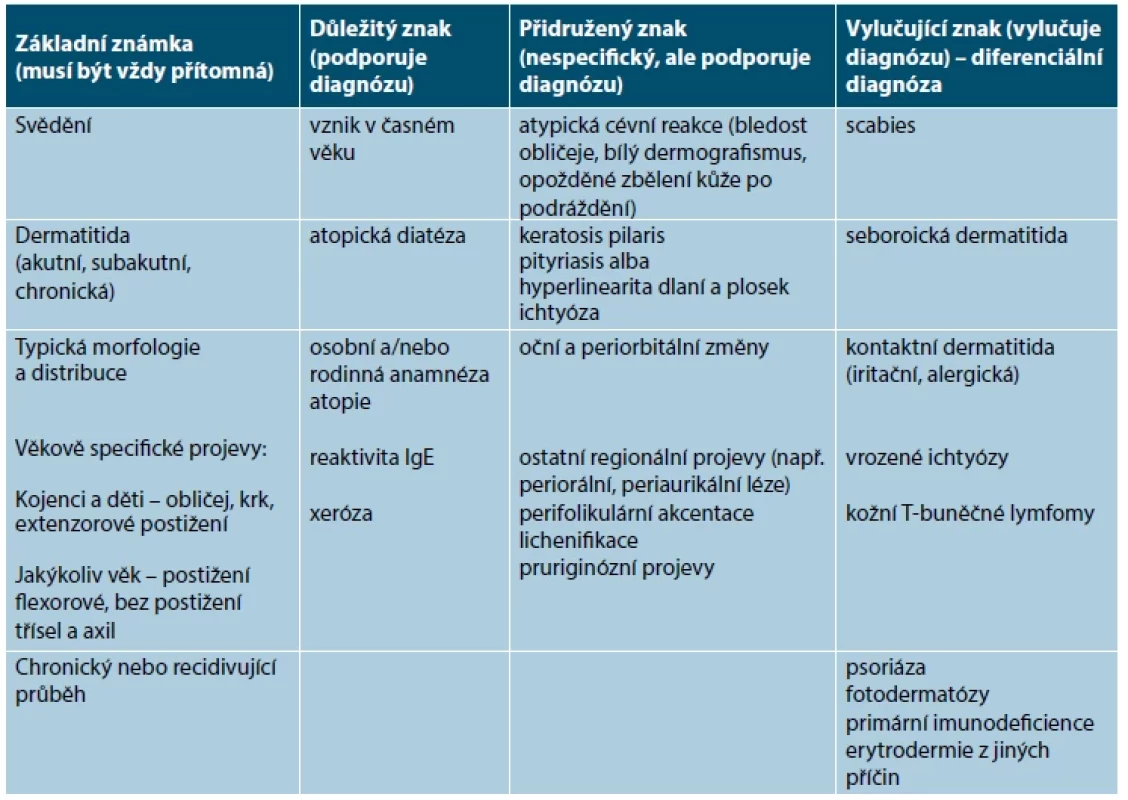
(upraveno podle [10]) KLINICKÝ OBRAZ
Projevy AD jsou velmi variabilní a mění se v závislosti na věku pacienta. K hlavním charakteristikám klinického obrazu patří typická lokalizace – postižení obličeje a extenzorů u kojenců a dětí, postižení a následná lichenifikace flexurálních krajin u dětí, dospívajících a dospělých (většinou symetricky), chronický či recidivující průběh onemocnění a intenzivní pruritus [9, 11, 39, 61, 62].
FORMY ATOPICKÉ DERMATITIDY
(rozdělení podle věku)
Kojenecká forma začíná zpravidla v prvních měsících života. Projevy bývají lokalizovány symetricky na tvářích a čele, je možná progrese na celý obličej, krk, do kštice či na ušní boltce, projevy mohou být i v plenkové lokalizaci. Morfologicky se jedná o svědivé papuly a vezikuly, s tendencí ke splývání do erytémových ložisek. Typické bývá i mokvání a povrch lézí se pokrývá krustoskvamami žluté barvy po zaschnutí. Projevy silně svědí a v důsledku škrábání dochází k impetiginizaci projevů. Kůže je suchá, jemně se olupuje a v záhybových oblastech se mohou tvořit ragády. Výjimečně může dojít k erytrodermii. V průběhu prvního roku života je možné definitivní zhojení, ale často se projevy vrací a u části pacientů přetrvávají do dětského věku [9, 39, 61, 62].
Dětská forma postihuje batolata a malé děti, může trvat až do dospívání. Charakter ekzémových projevů se mění, ustupuje exsudace a proces se stává chronickým. Predilekční lokalizací jsou kromě obličeje i krk, flexorové partie končetin, hřbety rukou, nárty, hýždě, zadní strana stehen. Typická je lichenifikace a výrazné hluboké kožní rýhy. Kůže očních víček bývá tmavší a zhrubělá a dochází ke zdvojení záhybu pod očima (Dennieho-Morganiho infraorbitální řasa). Často dochází k impetiginizaci projevů. Střídají se remise s exacerbacemi. Do 9 let projevy AD ustoupí asi u 80 % pacientů [9, 39, 61, 62].
Adolescentní forma má u dospívajících typickou symetrickou, flexurální lokalizaci (loketní a podkolenní jamky), zápěstí, nárty, krk a šíje. Typická je lichenifikace projevů, které jsou často exkoriované. Barva atopické kůže je převážně hnědošedá. Mizí laterální partie obočí (Hertoghovo znamení). Vlasy jsou suché, bez lesku, někdy dochází až k jejich prořídnutí. Typické jsou lesklé nehty v důsledku neustálého škrábání [9, 39, 61, 62].
Dospělá forma se může vyskytnout i u pacientů, kteří dříve AD nikdy netrpěli. Obvykle však předchází kojenecká a/nebo dětská forma, popř. astma či projevy inhalační alergie. Klinický obraz může být totožný jako u dospívajících nebo je omezen na některé lokalizace (frustní formy). Pruriginózní forma je charakterizována pruriginózními uzlíky a silným svěděním. U dospělých může mít různý rozsah včetně projevů generalizovaných, popř. erytrodermie [9, 39, 61, 62, 80].
Existují i tzv. minimální (lokalizované) varianty AD, mezi které patří ekzémové projevy na víčkách, exfoliativní cheilitida, projevy retroaurikulární s ragádou, ekzémové projevy na prsních bradavkách nebo genitálu, pulpitis sicca, juvenilní plantární dermatóza a další. Mezi morfologické varianty AD se řadí varianty folikulární, numulární, papulózně-lichenoidní, dyshidrotická a další [61].
KOMORBIDITY A KOMPLIKACE ATOPICKÉ DERMATITIDY
Asociace AD s ostatními atopickými a alergickými chorobami je dlouhodobě známá a některé jsou součástí diagnostických kritérií AD. Mezi ostatní komorbidity AD patří oční choroby a další. Recentní studie prokázaly souvislost AD s autoimunitními, metabolickými, kardiovaskulárními a psychiatrickými chorobami. Spojitost AD s přidruženými chorobami se předpokládá multifaktoriální. Některé komorbidity jsou důsledkem chronického zánětu jiné mají podobnou patofyziologickou dráhu, jako má samotné onemocnění [15, 66, 67, 80]. Dermatolog by měl být dobře obeznámený s komorbiditami AD, aby mohl pacienta co nejdříve odeslat na vyšetření k příslušnému specialistovi.
Atopické a alergické komorbidity
Mezi typické atopické komorbidity patří bronchiální astma, alergická rinokonjunktivitida a potravinová alergie, méně známá je eozinofilní ezofagitida [15, 61, 66]. Prevalence astmatu u pacientů s AD je kolem 24,8 % a pacienti s AD mají 3krát vyšší riziko vzniku astmatu ve srovnání s běžnou populací. Prediktory rozvoje astmatu zahrnují těžší formu AD, nižší věk, nižší stupeň vzdělání a nízký socioekonomický status [15, 66]. Potravinová alergie je úzce spojena s AD, u dospělých s AD se odhaduje kolem 11 %, prevalence se liší mezi různými studiemi [61]. Existuje vztah mezi tíží AD a IgE zprostředkovanou potravinovou alergií. Stejně jako u astmatu nacházíme potravinovou alergii častěji u pacientů s těžší formou AD [15, 61, 66, 80]. Alergická rinokonjunktivitida je častou komorbiditou AD, podle některých studií jí trpí 82,2–89,2 % pacientů [61]. Eozinofilní ezofagitida je chronické, imunitně zprostředkované onemocnění jícnu, které je charakterizované symptomy souvisejícími s dysfunkcí jícnu a histologickým nálezem zánětu s převládajícími eozinofily. U dospělých a dospívajících se projevuje dysfagií, regurgitací, pocitem váznoucího sousta, bolestí na hrudi a pyrózou (často nereagující na antacida), zatímco u mladších dětí převažují příznaky gastroezofageálního refluxu, bolesti břicha a potíže s krmením [15, 24].
Oční komorbidity
Pacienti s AD mají vyšší riziko různých očních komplikací. Známá je atopická keratokonjunktivitida, ale pacienti s AD trpí i blefaritidou, keratokonem, glaukomem, kataraktou nebo odchlípením sítnice. Mnoho z nich může mít za následek trvalé poškození zraku, pokud není diagnostikováno včas. Blefaritida, zánět okrajů očních víček, je u pacientů s AD převážně bakteriálního původu. Atopická keratokonjunktivitida je neinfekční komplexní zánětlivé onemocnění rohovky a spojivky s prevalencí 25–42 % u pacientů s AD. Rizikovým faktorem pro rozvoj glaukomu zjišťovaného častěji u pacientů s AD je aplikace lokálních kortikosteroidů do očního okolí. Pro keratokonus je charakteristické konické vyklenování a ztenčování rohovky centrálně nebo paracentrálně. Vyskytuje se u 18–41 % pacientů s AD a výskyt stoupá s tíží projevů. Katarakta postihuje 8–25 % pacientů s AD včetně adolescentů a dospělých mladého věku. Etiologie katarakty u pacientů s AD je nejasná. Předpokládá se, že souvisí se závažností AD, lokalizací projevů AD na obličeji, přítomností chronického zánětu s opakovaným škrábáním, mnutím obličeje a v neposlední řadě hraje roli i genetická predispozice [7, 15, 28]. Odchlípení sítnice je vážnou komplikací a může se vyskytnout u jedinců mladších 35 let [15, 80].
Kardiovaskulární a metabolické komorbidity
Systémový zánět, který zvyšuje riziko aterosklerózy, je jasným rizikovým faktorem pro vznik kardiovaskulárních (KV) chorob a systémová protizánětlivá léčba snižuje riziko vzniku těchto příhod. Ty korelují se známkami Th2 zánětu v kůži a krvi pacientů s AD a tito pacienti mají zvýšené hladiny proteinů asociovaných s rizikem KV chorob. Riziko KV chorob zvyšují obecně poruchy spánku, kouření, nadváha, alkohol a nežádoucí účinky některých systémových léčiv (systémové kortikosteroidy a cyklosporin). Ve studiích se popisuje asociace mezi dospělou AD, obezitou (v 36 %) a dyslipidemií (v 13 %) a naopak bylo u AD zjištěno nižší riziko diabetu, zejména 2. typu [15]. U pacientů s těžkou formou AD lze pozorovat mírně zvýšený výskyt hypertenze, infarktu myokardu, cévní mozkové příhody a srdečního selhání [15, 66, 67], ale asociace není tak silná jako u psoriázy, a proto pravidelný screening těchto chorob není nutný [15, 80].
Kostní komorbidity
AD je spojena se zvýšeným rizikem rozvoje osteoporózy. Riziko zlomenin stoupá se závažností AD. Chronický systémový zánět vede k narušenému kostnímu metabolismu a může docházet ke zvýšeným ztrátám kosti, pravděpodobně v důsledku deficitu (hypovitaminóze) vitaminu D. Kvůli osteoporóze je u závažné AD dvojnásobné riziko zlomenin páteře, o 66 % je vyšší riziko zlomenin pánve a o polovinu je vyšší riziko zlomenin kyčle. Systémové kortikosteroidy patří mezi rizikovou léčbu ve vztahu k osteoporóze a vzniku zlomenin, za rizikové je nutné považovat podávání ≥ 3 měsíce při denní dávce prednisonu ≥ 7,5 mg [15].
Psychiatrické komorbidity
Pacienty s AD trápí svědění, sociální izolace, mají sníženou kvalitu života a narušený spánek. AD je proto spojena ve vyšší míře s depresemi, úzkostmi a sebevražednými myšlenkami. Bylo zjištěno, že 1 z 5 pacientů s AD (20,1 %) trpí depresemi, zatímco v populaci bez AD je výskyt deprese 14,8 % [15, 52]. Trpí jimi častěji pacienti se středně těžkou až těžkou AD. Příznaky deprese zlepšuje účinná systémová léčba AD. Podobné výsledky platí pro úzkostné stavy a sebevražedné myšlenky. V případě dokonaných sebevražd data nejsou jednotná [15, 66, 80].
Imunitně zprostředkované choroby
Systémový zánět u AD může vysvětlovat vazbu AD s různými autoimunitními chorobami. Z dánské studie vyplynulo, že AD je asociována s 2,5krát vyšší pravděpodobností se vznikem autoimunitního onemocnění a má 3,5krát vyšší pravděpodobnost výskytu dvou a více autoimunitních onemocnění. Alopecia areata ve spojení s AD se vyskytla ve zmíněné studii ve 26,3 % a závažná AD předvídá horší prognózu alopecie jak ve vztahu k odpovědi na léčbu, tak v celkové prognóze. AD je spojována s vyšší pravděpodobností vzniku totální nebo univerzální alopecie. Kromě akutní kopřivky se prokázala klinicky relevantní asociace mezi AD a chronickou kopřivkou [15].
Infekční komplikace
U pacientů s AD jsou časté infekce bakteriální, virové, mykotické. Dysfunkce kožní bariéry, dysregulace kožního imunitního systému a dysbióza (včetně abnormit antimikrobiálních peptidů) zvyšují riziko kožních infekcí u pacientů s AD [61, 73]. Častá je asociace AD se stafylokokovými kožními infekcemi. Eczema herpeticatum/ herpeticum je závažná, život ohrožující komplikace AD a infekce virem herpes simplex se vyskytuje více než dvojnásobně u pacientů s AD, vzácněji jsou pacienti postiženi eczema verrucatum nebo eczema molluscatum [15, 61]. Tyto infekce se častěji vyskytují u pacientů se špatně kompenzovanou AD a data ukazují, že úspěšná léčba snižuje výskyt těchto infekcí a snižuje kolonizaci Staphylococcus. aureus [6, 12, 35].
VYŠETŘENÍ
Pro stanovení diagnózy AD není aktuálně k dispozici žádný specifický laboratorní marker, který by spolehlivě odlišil AD od jiných chorob. Klinickou diagnózu AD je možné opřít o některá vyšetření. Vyšetřování se provádí především pro detekci spouštěčů a komorbidit.
Laboratorní vyšetření
Celkové IgE protilátky
Asi u 20 % pacientů s AD není zvýšená sérová hladina IgE protilátek. Zvýšené hodnoty vyjadřují spíše atopickou diatézu než krátkodobou aktivitu onemocnění. Vysoké hladiny celkových IgE protilátek mohou být prediktivním faktorem pro závažnější průběh onemocnění, ne však zcela spolehlivým, protože někteří jedinci se závažnými projevy mají normální hodnoty IgE protilátek. Ty mohou být naopak zvýšené u řady dalších neatopických onemocnění (např. parazitóz, nádorů, autoimunitních onemocnění). Sledování hladiny IgE není doporučeno pro rutinní sledování závažnosti onemocnění, ale u závažných forem AD mohou být indikátorem dlouhodobé léčebné odpovědi, kdy hladina IgE protilátek klesá [19, 20, 39].
Specifické IgE protilátky na inhalační a potravinové alergeny
Pozitivita specifických IgE není pro AD diagnostická [19, 38, 39] – viz alergologické vyšetření.
Počet eozinofilů v periferní krvi
Periferní eozinofilie u pacientů s AD má větší výpovědní hodnotu ve srovnání s ostatními alergickými chorobami (bronchiální astma, alergická rýma). Počet periferních eozinofilů stoupá s tíží choroby a může být laboratorní známkou progrese onemocnění [38, 39].
Sérová laktátdehydrogenáza (LDH)
Laktátdehydrogenáza je zvýšená u řady závažných případů AD. Hladina se zvyšuje důsledkem poškození tkáně kožním zánětem a může sloužit jako známka progrese onemocnění. Po zklidnění zánětu dochází k normalizaci hodnot. V případě přetrvávání vyšších hodnot LDH by měla být diferenciálně diagnosticky zvažována jiná onemocnění, která vedou ke tkáňovému poškození, zejména nádorová [38, 39].
Sérový chemokin TARC (thymus and activation regulated chemokine, TARC/CCL17)
TARC je ligand chemokinového receptoru CCR4, který indukuje migraci Th2 lymfocytů. Sérové hodnoty se zvyšují v závislosti na závažnosti projevů AD a odráží spolehlivěji progresi onemocnění. Elevace koreluje s aktivitou onemocnění více než hladina celkových IgE protilátek, hladina LDH či eozinofilie. Hodnoty jsou obecně vyšší u malých dětí, zejména u dětí mladších 2 let [38, 39].
Sérový SCCA (Serum Synamous Cell Carcinoma Antigen, SCCA1 a SCCA2)
SCCA jsou proteiny patřící do skupiny inhibitorů serinových proteáz tvořených epitelovými buňkami. Sérový SCCA2 je považován za citlivý marker progrese choroby, který nevykazuje variace ve vztahu k věku a předpokládá se, že bude užitečným ukazatelem v klinické praxi [38, 39].
ALERGOLOGICKÉ VYŠETŘENÍ
Potravinové alergie
Potravinová alergie se vyskytuje až u 1/3 dětí se středně těžkou a těžkou AD, méně často u dospělých. Nejčastějšími alergeny jsou bílkoviny kravského mléka, slepičí vejce, arašídy, pšeničná mouka, sója, ořechy, ryby a mořské plody. U dětí se postupem času vyvíjí tolerance na běžné potravinové alergeny, zatímco potravinové alergie, které se vyvinou v dospělosti, obvykle přetrvávají. Existují zkřížené potravinové a pylové alergie, např. při prokázané alergii na pyly břízy mohou pacienti reagovat na jablka, celer a lískové ořechy. Eliminační diety se nedoporučují, mohou být škodlivé, nutná je však eliminace potraviny s prokázanou klinickou relevancí [64, 81, 86, 89]. U dětí je vhodná opatrná, postupná reexpozice podle instrukcí alergologa, protože při setrvalé eliminaci základních potravin hrozí nejen perzistence potravinové alergie do dospělosti, ale i její nárůst. Senzibilizaci na potraviny lze prokázat in vivo testy (kožními prick testy – SPT, prick-prick testy) a in vitro testy (sérové hladiny specifických IgE protilátek). Pozitivita SPT je typická pro časný typ imunologické reakce, ale nemusí korelovat s klinickou odpovědí. Podle rychlosti nástupu a charakteru projevů se rozlišují tři typy reakcí. U časného typu reakce (zprostředkované IgE protilátkami), dochází ke vzniku příznaků do dvou hodin po požití alergenu. Hlavními kožními projevy jsou erytém, kopřivka, angioedém a pruritus. Současně dochází k rozvoji příznaků gastrointestinálních, respiračních, kardiovaskulárních, typických pro anafylaktický typ reakce. U některých dětí se může po dalších 6–10 hodinách vyvinout morbiliformní exantém přetrvávající několik hodin jako pozdní část IgE zprostředkované imunitní odpovědi. Pro pozdní, ekzémový typ reakce je charakteristický vznik ekzémových ložisek v predilekčních lokalizacích za 6–48 hodin po požití alergenu. Až u 40 % dětí se mohou oba typy imunologických reakcí kombinovat [61, 63, 79]. SPT s potravinovými alergeny se doporučují u dětí do 5 let se středně závažnou až závažnou AD, která přetrvává navzdory optimální péči i lokální terapii, výhradně při podezření na potravinovou alergii a je v režii imunoalergologa. Testování specifických IgE protilátek je vhodné, pokud SPT nelze použít, např. u urticaria factitia, kožní hyporeaktivity způsobené UV zářením, užíváním některých léků (celkové kortikosteroidy, imunosupresivní léky) nebo při nespolupráci malých dětí. Hodnoty specifických IgE protilátek umožňují kvantitativní hodnocení senzibilizace a pomáhají odhadnout pravděpodobnost rizika klinické reakce. Reaktivita SPT na potraviny klesá během prvních sedmi let, zatímco specifické IgE protilátky proti potravinovým alergenům se zvyšují. Vyšetření potravinové alergie provádějí imunoalergologové. Důležité je vždy pečlivé vyhodnocení provedených laboratorních vyšetření a z nich vyplývající následná relevantní doporučení. Spolehlivou metodou k prokázání potravinové alergie je zaslepený, placebem kontrolovaný potravinový expoziční test, který je ale jen výjimečně používaný. V běžné praxi obvykle stačí vyloučení a znovuzavedení určité potraviny na základě anamnézy. Orální provokace potravinou může vyvolat časnou reakci nebo ekzémovou pozdní reakci. Asi u 45 % orálních provokačních potravinových testů se objevují oba typy reakcí, zatímco u 12 % testů dojde pouze ke zhoršení ekzému. Anamnestické údaje mají nízkou prediktivní hodnotu pro pozdní reakce vyvolané orálním testem (30 %) na rozdíl od 80 % relevance pro časné reakce. Eliminační dieta pro AD musí být založena na pečlivé anamnéze s následnou eliminací a znovuzavedením podezřelé potraviny nebo na orální potravinové provokaci, a naopak by neměla být založena na senzibilizaci typu I zjištěné krevními testy nebo SPT [19, 38, 61, 79, 86, 89].
Inhalační alergie
Aeroalergeny mohou vyvolat exacerbaci projevů u senzibilizovaných pacientů, což se vysvětluje zvýšenou permeabilitou kůže pro inhalační alergeny v důsledku narušené kožní bariéry. Pacienti s AD jsou obvykle senzibilizováni na roztoče, pyly stromů, travin, bylin, plísně a zvířecí srst, přičemž přecitlivělost na inhalační alergeny stoupá s věkem.
Hlavními aeroalergeny vyvolávající relapsy AD jsou roztoči domácího prachu (především Dermatophagoides pteronyssinus a D. farinae). Jejich enzymatická aktivita prohlubuje dysfunkci kožní bariéry u pacientů s AD. Roztoči jsou typickými alergeny vnitřních prostor, zejména se vyskytují v ložnicích (v lůžkovinách, matracích). Běžné úklidové techniky mají minimální vliv na snížení množství roztočů v matracích, nicméně snížením počtu roztočů v lůžkách (např. nošením speciálních pyžam, používáním speciálních protiroztočových povlaků matrací a lůžkovin) došlo ke zlepšení projevů AD [64, 86, 90]. Pyly ve venkovním vzduchu mohou vyvolat relaps AD. Vyvarování se venkovním aeroalergenům je za běžných podmínek obtížné, řešením mohou být pylové filtry v klimatizačních jednotkách a jejich pravidelná výměna [61, 64, 81, 86, 89, 90]. V minulosti doporučované vyloučení kontaktu pacientů s AD s domácími zvířaty, protože mohou vést ke zhoršení projevů AD, již není aktuální. V současné době se nedoporučuje pouze expozice epiteliím kočičí srsti, která je nadále považována za rizikový faktor [86, 90]. K dispozici nejsou důkazy o zvýšeném riziku AD u dětí, které jsou v kontaktu se psy. Současné studie naznačují, že kontakt se psy může mít protektivní účinky pravděpodobně díky expozici nepatogenním mikrobům. Pouze pokud se prokáže senzibilizace na psí srst, musí být kontakt se psy vyloučený [86, 90]. Rutinní diagnostika zahrnuje stanovení hladin specifických IgE protilátek a/nebo provedení SPT, přičemž pozitivita specifických IgE není pro AD diagnostická. Často se pozoruje nespecifická senzibilizace a výskyt pozitivních specifických IgE protilátek nebývá v případě exacerbací dermatitidy kauzální. V interpretaci vztahu mezi alergeny a symptomy je důležitá anamnéza [19, 61, 86, 90].
Atopické epikutánní testy (APT) s inhalačními a/ nebo potravinovými alergeny se používají k posouzení imunologické reakce pozdního typu u AD. Jsou považovány za více specifické, ale méně senzitivní než SPT nebo specifické IgE protilátky. Testy mají různou míru pozitivity (15–100%) podle použitých materiálů a metod. Mohou detekovat senzibilizaci u „intrinsických“ (non IgE) forem AD u pacientů s negativními SPT [61]. Jejich hlavní nevýhodou je variabilita metod, různá interpretace výsledků a nedostatek komerčně vyráběných alergenů [19, 61]. Suspektní potravinový alergen (rozpuštěný ve fyziologickém roztoku v 10% koncentraci) je aplikován formou epikutánního testu na zdravou kůži na 24–48 hodin. Alternativou je použití náplastí s velkými testovacími komorami s potravinami na dobu 48–72 hodin. Standardizované testy s inhalačními nebo potravinovými alergeny nejsou k dispozici [61, 86].
Kontaktní senzibilizace a alergická kontaktní dermatitida u AD
Kontaktní senzibilizace je detekována u 40–65 % pacientů s AD. Rizikem je dlouhodobá a opakovaná aplikace různých extern a zvýšená propustnost kožní bariéry. Nejčastějšími kontaktními alergeny u pacientů s AD jsou složky zevních přípravků (vonné komponenty, emulgátory, konzervační látky), neomycin, případně i kortikosteroidní externa [30, 61, 86]. Přípravky s obsahem proteinů (např. výtažky z ovsa) a další součásti emoliencií nejsou u dětí mladších 2 let vhodné a nedoporučují se. Senzibilizaci na rostliny čeledi Compositae (složnokvěté) je nutné vyloučit při závažných projevech na obličeji v letních měsících. Epikutánní testy (minimálně s evropskou základní sadou) je nutné provést u pacientů s torpidními projevy AD nereagujícími na běžnou léčbu, zejména na rukou či v obličeji a také s postižením v atypických lokalizacích nebo zhoršením bez známé příčiny. S rizikem kontaktní senzibilizace souvisí zejména volba povolání. Pacienti s AD musí pečlivě volit zaměstnání, nevhodné profese jsou např. kadeřník/kadeřnice, mechanik/mechanička, pekař/pekařka, kuchař/kuchařka, práce ve zdravotnictví aj. [61, 64, 81, 86, 89].
OČNÍ VYŠETŘENÍ
Pacienti s očními obtížemi nebo rizikovými faktory by měli být vyšetřeni oftalmologem. Včasná diagnóza a léčba očních komplikací má zásadní význam pro prevenci zhoršení, případně ztráty zraku [34].
PLICNÍ VYŠETŘENÍ
Pacienti s AD mají vyšší riziko vývoje astmatu nebo chronické obstrukční plicní nemoci (CHOPN) ve srovnání s pacienty bez AD, proto je u pacientů s respiračními potížemi vhodné plicní vyšetření [22].
PROBATORNÍ EXCIZE
Při nejasnosti diagnózy, popř. při přetrvávání projevů i při intenzivní léčbě, je nutné provedení probatorní excize k ověření diagnózy, a především k vyloučení primárního kožního lymfomu z T lymfocytů [19, 61].
HODNOCENÍ ZÁVAŽNOSTI ATOPICKÉ DERMATITIDY
Po stanovení klinické diagnózy je výběr léčebné metody závislý na závažnosti onemocnění. Pro management léčby každého individuálního pacienta je důležité hodnocení rozsahu a charakteristiky projevů (tzn. intenzita erytému, přítomnost papul, popř. mokvání a krust, výskyt exkoriací, stupeň lichenifikace, klinické známky bakteriální superinfekce). Otázky na subjektivní potíže pacienta (intenzita svědění, kvalita spánku, vliv na běžné denní aktivity) jsou nezbytné k posouzení vlivu onemocnění na život konkrétního pacienta [10, 19, 39, 80].
Mezi validované skórovací škály patří SCORAD (Scoring of Atopic Dermatitis), PO-SCORAD (Patient - -oriented SCORAD), EASI (Eczema Area and Severity Index), BSA (Body Surface Area), POEM (Patient-Oriented Eczema Measure), ADCT (Atopic Dermatitis Control Tool) a DLQI (Dermatologic Life Quality Index) a vIGA - -AD (Validated Investigator Global Assessment for Atopic Dermatitis). Mezi nevalidované škály se řadí IGA (Investigator Global Assessment), NRS (Numeric Rating Scale) a další škály (tab. 3) [10, 19, 80, 86].
Tab. 3. Hodnotící škály atopické dermatitidy 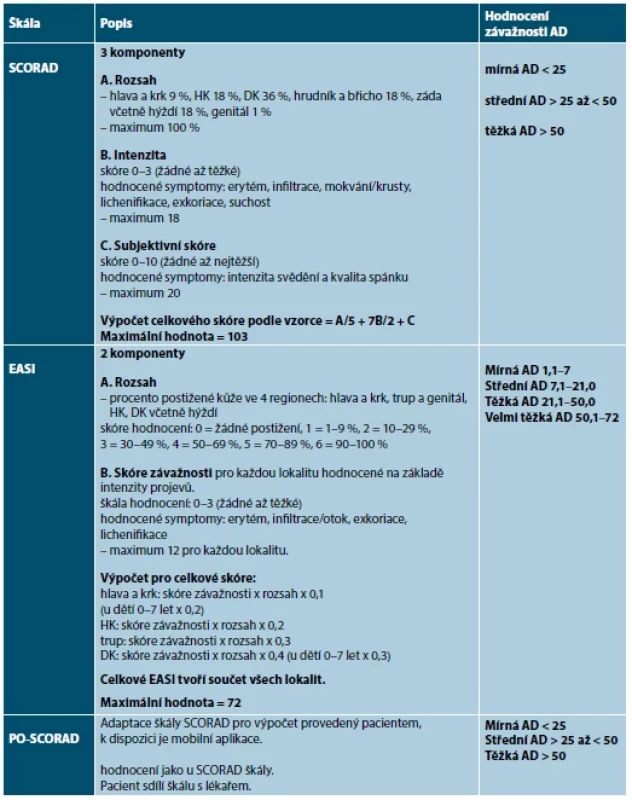

Použité zkratky: AD – atopická dermatitida, DK – dolní končetiny, HK – horní končetiny, SCORAD – Scoring of Atopic Dermatitis, EASI – Eczema Area and Severity Index, PO-SCORAD – Patient-oriented Scoring of Atopic Dermatitis, IGA – Investigator Global Assessment, POEM – Patient-Oriented Eczema Measure, DLQI – Dermatologic Life Quality Index, ADCT – Atopic Dermatitis Control Tool, NRS – Numeric Rating Scale Index SCORAD komplexně vyjadřuje tíži AD a je složen ze tří částí (A, B, C). Hodnotí objektivní známky AD, tedy rozsah postižení kůže (A) a závažnost projevů (B), a současně subjektivní příznaky – svědění a spánek (C). Skóre SCORAD > 50 svědčí pro těžkou AD, SCORAD > 25 až < 50 středně těžkou AD a skóre SCORAD < 25 značí mírnou AD. Maximální hodnota skóre SCORAD je 103. Hodnota A (rozsah postižení) odpovídá BSA [10, 19, 80, 86].
Škála PO-SCORAD umožňuje subjektivní hodnocení závažnosti AD pacientem pomocí mobilní aplikace, hodnocení je nezávislé na lékaři. Výsledky pacient poskytuje lékaři, přičemž dobře korelují se SCORAD indexem [93].
Škála EASI se skládá ze dvou částí a objektivně hodnotí rozsah postižení (procento postižení kůže) na čtyřech lokalitách na těle (hlava a krk, trup, horní končetiny a dolní končetiny včetně hýždí) a závažnost projevů pro každou oblast těla. Celkové maximální EASI skóre je 72. Mírná AD má EASI < 7, střední 7,1–21, těžká AD 21,1–50, velmi těžká 50,1–72 [10, 19, 80, 86].
Škála IGA jednoduše stanovuje celkovou závažnost AD objektivním hodnocením reprezentativních projevů (erytém, indurace/papuly a/nebo mokvání nebo krusty) na škále 0 až 4 či 5 (0 – zhojen, 1 – téměř zhojen, 2 – mírné postižení, 3 – středně těžké postižení, 4 – těžké postižení, 5 – velmi těžké postižení) [10, 23].
K posouzení vlivu onemocnění na kvalitu života pacientů se využívá validovaný dotazník DLQI. Obsahuje deset otázek týkajících se pacientova vnímání vlivu onemocnění na kvalitu života v posledním týdnu. Otázky se týkají vlivu onemocnění a efektu léčby na fyzické, psychické i sociální aspekty života. Maximální hodnota dotazníku DLQI je 30 [10, 19, 80, 86].
Dotazník POEM hodnotí intenzitu a četnost výskytu sedmi subjektivních příznaků (svědění, kvalita spánku, suchost kůže, olupování, mokvání, krvácení, výskyt ragád) v posledních sedmi dnech (rozsah 0–4). Maximální hodnota dotazníku POEM je 28 [10, 19, 80, 86].
Validovaný dotazník ke zvládání atopické dermatitidy ADCT hodnotí potíže pacienta za poslední týden. Slouží k dlouhodobé kontrole onemocnění. Maximální skóre je 24. Hodnota ≥ 7 znamená, že AD není dobře zvládána léčbou [80].
Pruritus-NRS slouží k hodnocení intenzity svědění pacientem na 10stupňové škále, maximální hodnota je 10. Podobně spánek-NRS hodnotí vliv AD na spánek pacienta [10, 19, 80, 86].
DOPORUČENÍ K LÉČBĚ ATOPICKÉ DERMATITIDY
Dále uváděná doporučení nemohou být považována za komplexní návod zajišťující úspěšnou léčbu v jednotlivých situacích. Práce nenahrazuje souhrny údajů o léčivých přípravcích (SPC). Vědecké informace týkající se celkové léčby neustále přibývají, proto je naším cílem zajistit recentní doporučení v době publikace a čtenáři jsou laskavě žádáni o sledování nových vědeckých poznatků a z toho vyplývajících upřesnění pokynů. Doporučení budou průběžně autory s ohledem na vývoj poznatků v biologické a cílené léčbě pravidelně upravována, doplňována a aktualizována.
CÍLE LÉČBY
Cílem léčby AD je kompletní zhojení projevů AD nebo praktické zhojení, kdy jsou přítomné jen minimální projevy AD (IGA 0/1), které nenarušují běžné denní aktivity. Dalším cílem je dlouhodobé udržení tohoto stavu bez častých akutních exacerbací [16, 38]. Definování léčebných cílů a systémová léčba budou podrobněji rozvedeny v II. části.
ZÁSADY PÉČE
Léčebná opatření u AD se skládají ze všeobecných opatření (nespecifických i specifických), ze základní péče o kůži, která se spolupodílí na krátkodobém i dlouhodobém efektu léčby a má kortikosteroidy šetřící účinek [2, 64, 81, 86, 89, 90]. Nezbytné je vyšetření a eliminace všech známých spouštěcích (exacerbujících) faktorů. Diagnostika individuálních spouštěcích faktorů AD bývá náročná.
Provokační faktory
Dráždivé chemické látky a fyzikální vlivy mohou výrazně komplikovat průběh nemoci [86, 90]. Přehled spouštěcích faktorů a režimových opatření je uveden v tabulce 4.
Tab. 4. Seznam spouštěcích faktorů a rady pro pacienty s atopickou dermatitidou 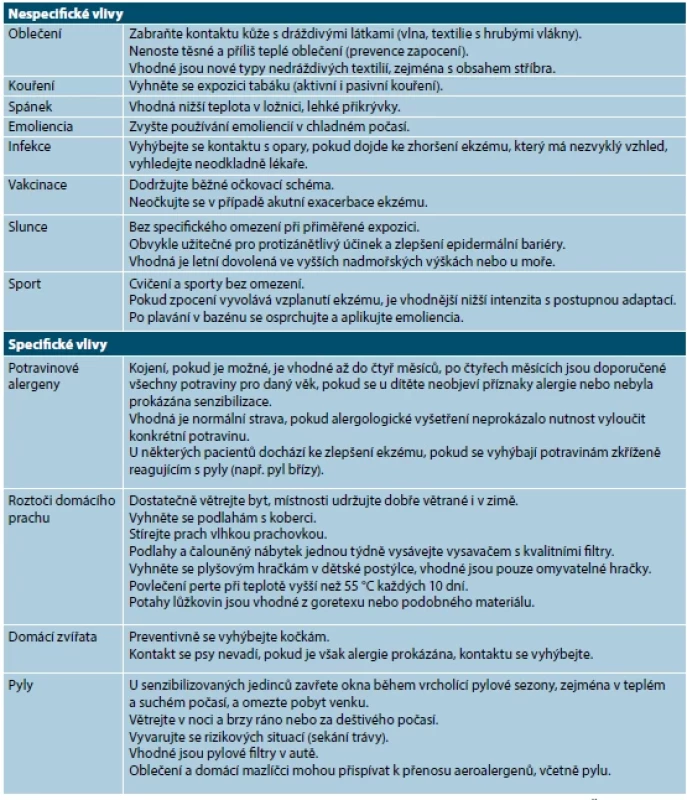
(upraveno podle [64, 86, 88, 89]) Specifické provokační vlivy [86, 90] byly podrobně probrány a jsou součástí alergologického vyšetření, které provádí a výsledky by měl vyhodnotit zkušený alergolog.
OPATŘENÍ V PRIMÁRNÍ PREVENCI ATOPICKÉ DERMATITIDY
K použití probiotik (inaktivované bakterie) a prebiotik (vláknina, která může podporovat růst určitých bakterií ve střevě) v primární prevenci AD jsou publikována nejednotná data [1, 86, 90]. Nicméně metaanalýza 21 studií [4] naznačila, že podávání probiotik v těhotenství a při kojení by mohlo být účinným opatřením pro snížení rizika výskytu AD u dětí [4, 90]. Nebyl prokázán vliv esenciálních mastných kyselin, emoliencií, vitaminů či stopových prvků na AD a podle evropského konsenzu se nedoporučuje v primární prevenci AD žádná dieta ani změna životního stylu, neboť kvalita dat není dostatečná [80, 81, 89, 90].
EDUKACE A VÝCHOVNÉ PROGRAMY
Pacienty či jejich rodiče/blízké je nutné opakovaně poučovat o povaze onemocnění, spouštěcích faktorech exacerbací, strategii léčby, způsobu aplikace léčiv a nutnosti pravidelné aplikace emoliencií, jejichž význam je nutné opakovaně zdůrazňovat [39, 61, 64, 90]. K tomuto účelu byly vytvořeny různé edukační programy, jež shrnují doporučení různých odborníků (dermatologů, pediatrů, alergologů, imunologů, psychologů, výživových poradců) [39, 61, 64, 90]. V České republice jsou pro pacienty k dispozici tištěné informace ve formě pacientských letáků či příruček, informací a odkazů na internetu nebo osobní konzultace [54, 92]. Zapojení do edukačních programů je vhodné u dětí a u pacientů se středně těžkou až těžkou AD. Nemocný jedinec, především dítě, negativně ovlivňuje fungování celé rodiny. V těchto závažných případech jsou přínosné různé psychoterapeutické metody – kognitivně-behaviorální terapie, autogenní trénink, relaxační techniky [38, 61, 72, 80, 86, 90]. Základem úspěchu léčby je spolupráce pacienta a jeho důvěra v lékaře. Lékař nebo jiný vyškolený zdravotnický pracovník by měl podrobně a srozumitelně seznámit pacienta a jeho rodinu s dostupnými léčebnými postupy a umožnit mu spolurozhodování o léčbě.
LÉČBA ATOPICKÉ DERMATITIDY
Lokální léčba základní
Do základní lokální léčby řadíme mytí, koupele a aplikaci emoliencií. Péče o kůži je zásadní pro všechny stupně závažnosti onemocnění. Léčba musí být dlouhodobě účinná a bezpečná.
Koupele a očista atopické kůže jsou nezbytnou součástí základní lokální léčby. Kůži atopiků je nutné mýt jemně a šetrně, cílem je odstranit krusty a eliminovat případnou bakteriální kolonizaci či kontaminaci. Mycí prostředky nesmí dráždit a musí mít nízký senzibilizační potenciál (bez parfemace, emulgátorů apod.). Lze použít přípravky s obsahem nedráždivých antiseptik, protože účinek antiseptika se pro krátkou dobu působení neuplatní a aspekt mechanické očisty je důležitější [26, 90]. Odstranění odumřelého keratinu mohou usnadnit solné koupele, a to především u pacientů s ichtyotickou kůží nebo u impetiginizovaných projevů [43, 38, 39, 90]. Přidávání chlornanu sodného do koupele podle recentních studií neprokázalo vyšší účinnost ve vztahu ke koupeli ve vodě bez přísad ve vztahu k tíži AD, ale umožnilo snížení aplikace lokálních steroidů a použití antibiotik [6, 37,39, 86, 90]. Koupelové oleje omezují dehydrataci epidermis a měly by se do koupele přidávat poslední 2 minuty koupání [64, 72, 81, 84, 86, 90]. Doba koupele, popř. sprchy se doporučuje krátká (5–10 minut). Pokud koupel trvá příliš dlouho a voda se následně odpaří z kůže, dochází k výrazným transepidermálním ztrátám vody a prohloubení suchosti. Je proto nutno aplikovat emoliencia ihned po koupeli. Rozdíly v koupání dvakrát týdně nebo každý den s ohledem na závažnost AD se neprokázaly, a proto se, pokud je zajištěna hydratace kůže po koupeli, doporučuje se pravidelné koupání nebo lépe sprchování vlažnou vodou bez omezení při používání jemných, povrchově aktivních a změkčujících mycích přípravků (např. koupelové oleje apod.) [41, 90]. Nejdůležitějším aspektem při mytí kůže u AD je vyhýbání se agresivním detergentům a alkalickým mýdlům [70, 86, 90].
Metoda vlhkých zábalů (wet-wrap dressing terapie) je vhodná pro pacienty s akutními projevy, s mokvajícími a erodovanými projevy a přispívá k rychlému zklidnění kůže u těchto pacientů, kteří často netolerují standardní lokální léčbu. Technika vlhkého zábalu spočívá v aplikaci jedné vrstvy vlhké, na kterou se aplikuje druhá suchá vrstva. Vlhký zábal se provádí do zasušení/zklidnění mokvajících projevů [26, 90]. Funguje na principu semiokluze, čímž se zvyšuje penetrace účinné látky a snižuje vysychání kůže, navíc obvaz poskytuje mechanickou ochranu před škrábáním. Tyto zábaly se aplikují většinou na několik hodin po dobu několika dní po sobě. Vzhledem ke zvýšené absorpci látek je nutné myslet na systémové účinky do zábalu aplikovaných léčiv [20, 70, 89, 90]. Emoliencia Emoliencia jsou základní součást léčby AD. Tato léčba je definována jako každodenní lokální aplikace vehikul, která neobsahují účinné látky.
Emoliencia
jsou zásadní jak v udržovací terapii, tak v prevenci exacerbací u všech pacientů a každodenní aplikace emoliencií prodlužuje dobu remise [36]. Klinické studie prokázaly kortikosteroidy šetřící účinek emoliencií [39, 61, 89, 90]. Emoliencia obsahují fyziologické lipidy (esenciální mastné kyseliny, fosfolipidy, ceramidy, cholesterol), humektanty (podporují hydrataci stratum corneum – urea, glycerol) a okludanty (snižují odpařování vody z kůže – vazelína). Pokud emoliencia obsahují ve svých texturách ceramidy v kombinaci s jinými hygroskopickými látkami (např. N-steatorylfytosfingozin, 5% urea, laktát), jejichž syntéza je u atopiků snížená, dochází k opětovné obnově kožní bariéry jak na anatomické úrovni, tak na úrovni funkční [13, 90]. Volíme emoliencia s minimálním iritačním, resp. senzibilizačním potenciálem a s minimálním množstvím ingrediencí [61]. Výběr emoliencia závisí na individuálních preferencích pacienta. Emoliencia zlepšují a obnovují porušenou kožní bariéru, zabraňují ztrátám vody z horních vrstev kůže, zlepšují kapacitu vázat vodu v kůži a přímo vodu dodávají do suchých vrstev kůže (hydratují, zvláčňují a promašťují). Nejúčinnější je aplikace emoliencií do ještě vlhké pokožky po sprše nebo koupeli, bezprostředně po jemném osušení kůže [90]. Doporučuje se používat je tak často, aby byla zajištěna dostatečná hydratace kůže. Minimální je aplikace dvakrát denně a vhodná jsou emoliencia obsahující hydrofilní složku (např. 5% ureu). Pro odhad aplikovaného množství se používá pravidlo bříška prstu (fingertip unit). Je to množství vytlačené z tuby o průměru 5 mm na poslední článek ukazováku/prstu (~ 0,5 g). Toto je adekvátní množství, které pokryje plochu dvou dospělých dlaní (přibližně 2 % povrchu těla dospělé osoby) [61, 70, 81, 86, 90]. Množství emoliencia k aplikaci je vysoké, až 100 g u malých dětí a více než 500 g u dospělých za týden [86, 90].
U kojenců urea může kůži dráždit, a proto se emoliencia s obsahem močoviny nemají používat u kojenců; u batolat je možné použití v nižší koncentraci [88]. Glycerol je lépe tolerovaný pro nižší pálivý efekt. Propylenglykol má vyšší iritační potenciál, u dětí mladších 2 let se z důvodu toxicity nedoporučuje používat [86]. Emoliencia obsahující tanin a/nebo ichtamol (zejména ve formě pasty) mohou být užitečným doplňkem základní léčby, zejména u mírnějších forem AD, a jsou alternativou léčby v případě kortikofobie pacientů/rodičů [69, 70, 86, 90]. Používání čistých olejů (např. kokosový olej, olivový olej apod.) místo emolientních emulzí vysušuje kůži, zvyšuje transepidermální ztráty vody, a proto se jejich aplikace u atopiků nedoporučuje [70, 81, 86, 90].
Emoliencia s aktivní látkou, tzv. emoliencia plus, obsahují aktivní látky (např. antiflogistické, antipruriginózní, antibakteriální substance), ale nespadají do kategorie lokálního léčiva. Přípravky obsahují např. tanin, ichtamol, saponiny, flavonoidy (lichochalcon A) a riboflavonoidy z extraktu ovsa (bez proteinů), bakteriální lyzáty (Aquaphilus dolomiae, Vitreoscilla filiformis) nebo syntetické deriváty mentolu (menthoxypropanediol) [90]. Zlepšují projevy AD a příznivě ovlivňují kožní mikrobiom atopické kůže [70, 86, 90]. Použití emoliencií s antipruriginózními substancemi (glycin, I-modulia) může přerušit bludný kruh svědění a škrábání [49]. Ve výzkumu jsou nová emoliencia s obsahem antimikrobiálních peptidů, která obsahují rekombinantní lidský beta defenzin-2 (hβD-2) [78].
Dosud není jednoznačně prozkoumán vliv emoliencií v prevenci AD. Některé studie uvádí snížení výskytu AD každodenním používáním zvláčňujících krémů od narození u novorozenců, kteří mají vysoké riziko rozvoje AD. Jiné studie tyto účinky emoliencií nepotvrdily [36, 61, 68, 90] – Doporučení 1.
Doporučení 1. Lokální léčba základní
- Frekvenci koupelí/sprchování není nutné omezovat, doba koupele je 3–5 minut.
- Aplikace emoliencia do vlhké kůže (3–5 minut po umytí nebo koupeli) je nutná (technika „namočit a utěstnit “).
- Pravidelné používání jakéhokoliv emoliencia má kortikosteroidy šetřící účinek u všech forem AD.
- Pravidelné používání přípravků zvyšujících bariérovou funkci kůže je vhodné.
- Emoliencia je nutné aplikovat v adekvátním množství (minimálně 30 g/den nebo 250 g/týden, resp. 1 kg/měsíc pro dospělého pacienta).
- Výběr emoliencia je individuální, závisí na preferencích pacienta. • Během zimních měsíců je vhodné používat emoliencia s vyšším obsahem lipidů.
- Emoliencia obsahující proteinové nebo rostlinné výtažky, konzervační látky, parfemaci, emulgátory se nedoporučují pro riziko kontaktní senzibilizace.
(upraveno podle [2, 86, 89, 90])
LOKÁLNÍ LÉČBA PROTIZÁNĚTLIVÁ
Všeobecné principy
Lokální protizánětlivá léčba je zcela zásadní v léčbě AD. K léčbě se využívají lokální kortikosteroidy (TCS), lokální imunomodulátory (inhibitory kalcineurinu – TIM), lokální inhibitory fosfodiesterázy (PDE) a lokální inhibitory Janusových kináz (JAK). Lokální protizánětlivá léčba je postavena na třech základních principech: na dostatečně účinné (potentní) protizánětlivé molekule, její dostatečné dávce a na správné technice aplikace léčiva [14, 39, 61, 86, 89, 90]. Lokální protizánětlivé molekuly jsou dostupné v nejrůznějších galenických formách a vlastní volba galenické formy má značný vliv na výsledný efekt léčby. Lokální protizánětlivá léčba by měla být vždy aplikována na hydratovanou kůži, zejména pokud se používá mastný základ [89, 90]. Lokální léčba je časově náročná, minimální čas na jedno celotělové ošetření je 30 minut.
Léčba vlhkými zábaly s TCS
Jedná se o krizovou intervenční léčbu u akutních mokvajících a erodovaných projevů, které netolerují standardní lokální léčbu. Vlhké zábaly s vhodnými ředěnými TCS (1 : 3 u TCS třídy II a 1 : 5 pro třídu III) aplikované maximálně několik dnů (cca 3 dny) na méně citlivé partie a krátkodobě umožní zvýšit účinnost léčby a urychlit zhojení lézí u těžkých forem a/nebo refrakterních forem AD. Léčbu je nutné individualizovat, opatrnost je nutná u malých dětí. Tento typ léčby ale není standardizován [20, 70, 81, 86, 89].
Reaktivní a proaktivní léčba
Tradiční protizánětlivá lokální léčba je aplikována na kůži s projevy AD a je ukončena v okamžiku, kdy vymizí viditelné projevy AD (reaktivní léčba). Koncept proaktivní léčby vychází z kombinované dlouhodobé aplikace lokální protizánětlivé léčby (většinou 2krát týdně) na původní již zhojená ložiska s emolienciem, které je libovolně aplikováno na celé tělo, a to nejméně 2krát denně. Jedná se o aplikaci na již zhojená, kritická místa, tj. na místa, kde je ekzém torpidní a/nebo velmi často recidivuje. Proaktivní léčebný režim může být zahájený až po úspěšném zaléčení akutních projevů AD reaktivní protizánětlivou léčbou. K proaktivní léčbě AD dětí i dospělých se využívají TCS nebo TIM. Délka trvání proaktivní léčby se řídí tíží onemocnění a perzistencí projevů onemocnění [70, 81, 83, 85, 87, 89, 90].
Lokální kortikosteroidy
Lokální kortikosteroidy jsou první linie protizánětlivé léčby AD [86, 89, 90]. Podle klinické účinnosti se lokální kortikosteroidy dělí do čtyř skupin [47]: slabé (skupina I), středně silné (skupina II), silné (skupina III) a velmi silné (skupina IV) – tabulky 5a, 5b, 5c [47, 61,86, 89]. Při volbě TCS se musí zvážit síla kortikosteroidního přípravku a jeho galenická forma, věk pacienta, velikost ošetřované plochy, ošetřovaná lokalita a použité vehikulum [47]. Všeobecně jsou účinnější TCS, které jsou obsaženy ve vehikulech s vyšším obsahem lipidů [86, 89, 90]. U mírných projevů je doporučené aplikované množství za měsíc 15 g u kojenců, 30 g u dětí a 60–90 g u dospělých a dostačuje aplikace TCS 2–3krát týdně. Toto aplikované měsíční množství, dokonce i silných TCS nebývá doprovázeno nežádoucími účinky lokálními ani systémovými [86, 90]. Velmi silné a silné TCS (skupina III a IV) mají četné nežádoucí účinky (viz níže). Děti by měly být léčeny slabšími kortikosteroidy (skupina I a II), stejně jako oblast kolem očí, obličej, intertriginózní oblasti a genitál [20, 39, 61, 47, 86, 89, 90].
Tab. 5a. Rozdělení lokálních kortikosteroidů, přehled dostupných originálních přípravků v ČR [94] ![Tab. 5a. Rozdělení lokálních kortikosteroidů, přehled dostupných originálních přípravků v ČR [94]](https://pl-master.mdcdn.cz/media/image_pdf/44bb5cb792125a0970aac7ca7f96312c.png?version=1687036222)
Tab. 5b. Lokální kortikosteroidy kombinované s antimikrobiálními látkami, přehled dostupných přípravků v ČR [94] ![Tab. 5b. Lokální kortikosteroidy kombinované s antimikrobiálními látkami, přehled dostupných přípravků v ČR [94]](https://pl-master.mdcdn.cz/media/image_pdf/8aad690ed2432e92706c97a02fcc3ffb.png?version=1687036255)
Tab. 5c. Lokální kortikosteroidy k magistraliter receptuře, přehled dostupných látek v Č 
(upraveno podle [69]) Účinnost lokálních kortikosteroidů
TCS se používají ve všech fázích onemocnění u všech věkových skupin. Ačkoli jsou TCS široce a běžně používány, existuje pouze několik dvojitě zaslepených, placebem kontrolovaných studií zkoumajících jejich dlouhodobé používání (metylprednisolon aceponát, flutikason propionát) [86, 90]. Při léčbě akutní fáze onemocnění se nejčastěji aplikují 1krát denně večer po dobu 3–5 dnů [89, 90]. Aplikace 1krát denně je stejně účinná jako aplikace 2krát denně [20, 26, 47, 86, 89, 90]. Proaktivní léčba TCS (2krát týdně) snižuje riziko relapsu AD u dětí i dospělých [8, 20, 53, 86, 89, 90].
Bezpečnost lokálních kortikosteroidů
Při dlouhodobé aplikaci TCS dochází ke ztrátě účinnosti, následnému zhoršení AD a iatrogenně navozeným nežádoucím účinkům, které se manifestují převážně atrofií kůže, danou ztenčením epidermis a ovlivněním syntézy kolagenu v dermis, dále pak striemi, teleangiektaziemi (rubeosis steroidica), jizvením (pseudocicatrices stellaires), projevy na krku „dirty neck“ (cutis punctata linearis colli), ekchymózami, hypertrichózou a dalšími projevy. U kojenců se projevují iatrogenním Cushingovým syndromem nebo v plenkové krajině granuloma gluteale infantum [47, 61]. TCS mají přímý negativní účinek na kožní bariéru ovlivněním exprese genů proteáz stratum corneum. U pacientů léčených TCS dochází ke sníženému obsahu intercelulárních lipidových lamel ve stratum corneum a ke zvýšeným hodnotám TEWL. Dlouhodobá léčba TCS v orbitální oblasti může způsobit rozvoj steroidního glaukomu, katarakty, periorbitální steroidní dermatitidy, steroidní akné, popř. steroidní rosacey [20, 61,86, 89]. U dětí může vzhledem k 3krát většímu poměru tělesného povrchu ke hmotnosti dojít ke vzniku systémových nežádoucích účinků [47, 61, 60]. Aplikuje me je v době zhoršení a k překonání kritických obtíží. Léčbu zahajujeme silnějšími nebo středně silnými preparáty po nezbytně nutnou dobu do zlepšení, pak aplikujeme preparáty slabší (sestupná či odstupňovaná léčba) či redukujeme frekvenci aplikace (ústupová léčba). V léčbě chronické AD využíváme režimu proaktivní terapie (podle klinických studií je nejdelší doba sledování 20 týdnů) nebo intervalové terapie, kdy se TCS aplikují na kůži obvykle 1krát denně tři dny po sobě a ty jsou pak následovány tří - až čtyřdenní nesteroidní léčbou [20, 61, 83, 85, 86, 89].
Kortikofobie
Kortikofobie je častým fenoménem, až 84 % pacientů s AD odmítá léčbu TCS či se této léčby bojí [29]. Důvodem jsou nežádoucí účinky a neúčinnost v minulosti používaných TCS. Pacienti s kortikofobií více selhávají na léčbě [29] – Doporučení 2.
Doporučení 2. Léčba lokálními kortikosteroidy
- TCS jsou protizánětlivou léčbou první linie u AD, zejména v léčbě akutních vzplanutí AD.
- Ředěné TCS mohou být použité krátkodobě v okluzivním podání (wet-wrap dressing), což zvyšuje jejich účinnost.
- Léčba TCS nenahrazuje aplikaci emoliencia: spolu s TCS se musí vždy aplikovat tolerované nebo vybrané emoliencium pro kortikosteroidy šetřící účinek (snížení rizika nežádoucích účinků při léčbě lokálními kortikosteroidy) a vlastní reparaci kožní bariéry.
- Proaktivní léčba TCS 2krát týdně dlouhodobě snižuje množství relapsů AD.
- Proaktivní léčba s TCS může být bezpečně používaná po dobu 20 týdnů, což je nejdelší doba sledování v rámci klinických studií.
- Pacientům s kortikofobií by měl být opakovaně vysvětlen efekt léčby TCS s cílem zvýšit adherenci k léčbě a vyvarovat se podléčení.
- Současná aplikace lokálních kortikosteroidů a lokálních imunomodulátorů nezvyšuje jejich účinnost. (upraveno podle [83, 85, 86, 89])
Lokální imunomodulárory (takrolimus, pimekrolimus)
Všeobecné principy
Lokální imunomodulátory (TIM - 0,03% a 0,1% takrolimus v masti, 1% pimekrolimus v krému) se používají v léčbě AD u dětí i dospělých [61, 75, 86, 89, 90]. Takrolimus (makrolidový lakton) a pimekrolimus (derivát askomycinu) se váží na receptor (makrofilin-12) a poté dochází k vazbě a inhibici kalcineurinu s následnou blokádou produkce nejrůznějších prozánětlivých cytokinů. Vazba pimekrolimu na makrofilin-12 je třikrát nižší než u takrolimu. Proto je pimekrolimus určen k léčbě mírné a středně těžké AD u pacientů od 3 měsíců věku [44], takrolimus je určen k léčbě středně těžké a těžké atopické dermatitidy u pacientů od 2 let věku [63, 75]. Protizánětlivý účinek TIM je podobný účinku TCS III. třídy [82, 90].
Účinnost lokálních imunomodulátorů
Účinnost TIM byla opakovaně prokázána mnohými klinickými studiemi. Bezpečnostní profil obou léků je podobný. Všechny farmakokinetické studie prokazují minimální systémovou absorpci [83, 86, 89, 90]. TIM jsou účinné, bezpečné, využívají se k léčbě akutních i chronických projevů AD. Mají rychlý nástup účinku, dobře a rychle odstraňují svědění, tlumí zánětlivou reakci v kůži a nemají nežádoucí účinky TCS. Vhodné jsou především k dlouhodobé kontrole AD v proaktivním režimu léčby u dětí i dospělých [75, 83, 85].
Bezpečnost lokálních imunomodulátorů
Byla studována zejména dlouhodobá bezpečnost TIM (desetileté používání takrolimu a pětileté používání pimekrolimu) a klinické studie prokázaly jejich účinnost a bezpečnost (v krátkodobém i dlouhodobém podávání) [44, 61, 75, 89, 90]. Klinické studie prokázaly, že TIM, na rozdíl od TCS, neovlivňují syntézu dermálního kolagenu, a proto po jejich aplikaci nehrozí rozvoj atrofie [6, 57, 60, 61, 90]. Proto jsou léčbou 1. linie senzitivních oblastí (periokulární a periorální oblast, oblast genitálu), a to v krátkodobých i dlouhodobých léčebných režimech [60, 61, 75, 84, 90]. Nejčastějším nežádoucím účinkem je přechodný pocit tepla, brnění a pálení v místě aplikace během prvních dnů užívání. Tyto projevy se objevují asi za 5 minut po aplikaci a mohou přetrvávat až jednu hodinu. Intenzita a délka trvání těchto nežádoucích účinků se zpravidla snižuje během několika dnů léčby. Tyto nežádoucí účinky jsou častější u takrolimu než u pimekrolimu a u některých léčených pacientů jsou takové intenzity, že vedou k ukončení léčby [20, 61, 86, 90]. Specifickým nežádoucím účinkem TIM je alkoholová intolerance, která se projevuje erytémem obličeje po požití i malého množství alkoholu. Tuto reakci může snížit podání 500 mg kyseliny acetylsalicylové asi 30 minut před konzumací alkoholu [21, 89]. U pacientů léčených TIM nebyla prokázána zvýšená incidence bakteriálních ani virových infekcí kůže, naopak byla zaznamenána snížená kolonizace kůže S. aureus u pacientů s AD léčených takrolimem [84]. Klinická ani preklinická data neprokázala zvýšené riziko kožních lymfomů nebo jiných kožních nádorů [5]. Těžká forma AD jako taková může představovat riziko rozvoje kožního lymfomu [86, 89]. U pacientů léčených TIM je doporučena účinná širokospektrální fotoprotekce [86, 89] – Doporučení 3.
Doporučení 3. Léčba TIM
- TIM jsou účinnou léčbou v lokální léčbě AD po TCS: takrolimus je účinnější než pimekrolimus.
- TIM nejsou vhodné ke zvládání akutních vzplanutí, iniciální léčba akutního vzplanutí je s TCS, následuje léčba TIM.
- TIM jsou indikovány k aplikaci na rizikové lokality (obličej, krk, intertriginózní partie, anogenitální oblast), kde dlouhodobá léčba TCS je nevhodná.
- Proaktivní léčba 2krát týdně takrolimem na zhojená ložiska redukuje relapsy AD.
- Před aplikací a po aplikaci TIM by kůže neměla být promazána emolienciem (zhoršená penetrace velké molekuly TIM přes vrstvu emoliencia).
- U pacientů léčených TIM je doporučena účinná fotoprotekce. • Současná aplikace TCS a TIM efekt léčby nezvyšuje a nemá žádnou přidanou hodnotu.
- TIM nejsou vhodná v těhotenství, během kojení. (upraveno podle [61, 75, 83, 86, 89, 90])
Lokální inhibitory fosfodiesterázy
Krisaborol je nesteroidní molekula určená k lokální léčbě mírných a středně závažných forem AD u pacientů starších 2 let. Jedná se o inhibitor fosfodiesterázy 4 (PDE-4), který zabraňuje degradaci cyklického adenosinmonofosfátu (c-AMP) na adenosinmonofosfát (AMP). Mast s obsahem 2% krisaborolu se aplikuje 2krát denně v tenké vrstvě a vykazuje klinickou účinnost srovnatelnou se středně účinnými TCS. Mezi nežádoucí účinky léčby krisaborolem patří pocity pálení kůže v místě aplikace přípravku. Krisaborol v masti je v Evropě registrovaný k léčbě AD. Právě probíhá klinické zkoušení dalších lokálně aplikovaných PDE v léčbě AD [86, 89, 90, 95].
Lokální inhibitory Janusových kináz (JAK)
Byly publikovány slibné výsledky s lokálně aplikovaným 2% tofacitinibem, 1,5%, resp. 0,5% ruxolitinibem. Momentálně jsou v klinických studiích další inhibitory JAK k lokálnímu použití (např. delgocitinib, cerdulatinib, brepocitinib [86, 90].
FOTOTERAPIE
Příznivý efekt působení slunečního záření na klinické projevy AD dokládá zkušenost, že se v letních měsících výrazně zlepší, případně se zhojí tři čtvrtiny pacientů s mírnou a středně závažnou AD. U 9 % pacientů zůstává stav AD nezměněný a u malé skupiny pacientů naopak dochází k exacerbaci AD vlivem slunečního záření [32, 33, 61, 63, 86]. Ultrafialové záření má na kůži účinky imunomodulační, imunosupresivní, protizánětlivé, protisvědivé, zlepšuje kožní bariéru a současně má účinky antimikrobiální, protože snižuje bakteriální kolonizaci kůže S. aureus a může přispět ke snížení celkového množství lokálně aplikovaných léčiv, včetně steroidů na kůži [17, 61, 86]. Fototerapie je vhodná pro léčbu chronických, lichenifikovaných a svědících projevů středního rozsahu, není indikována u akutních vzplanutí. Při indikaci fototerapie je nutné se řídit kožním fototypem, vyloučit případné kožní nádory. Dávka záření by měla vycházet ze stanovení minimální erytémové dávky. Nevýhodou fototerapie je časová náročnost a často místní nedostupnost. Určité specifické lokalizace, např. silně ochlupená kůže či kožní záhyby, nejsou fototerapií efektivně léčeny [32, 33, 55, 61, 63, 86].
Fototerapie u AD využívá úzkospektré UVB záření (NB-UVB, vlnová délka 311–313 nm) (tab. 6a, 6b), širokospektré UVB záření (BB-UVB, vlnová délka 280–320 nm (tab. 7a, 7b), UVA1 záření (vlnová délka 340–400 nm) [25, 32, 33, 45, 55, 61, 63, 86]. Monochromatický excimerový laser vlnové délky 308 nm rozšiřuje terapeutické možnosti u pacientů s lokalizovanými a na terapii rezistentními projevy např. u psoriázy, ale k léčbě AD se nedoporučuje [46, 91]. Úzkospektré UVB záření je preferováno před užitím širokospektrého UVB, které vykazuje vyšší erytemogenní potenciál. Je vhodné u chronických mírných forem AD v kombinaci s lokální léčbou [61]. NB-UVB se obvykle provádí 2–3krát týdně, dávku je možné zvyšovat při každém sezení, pokud je tolerována [61, 86].
Tab. 6a. Doporučení pro dávkování NB-UVB 
(upraveno podle [63])
Použité zkratky
MED – minimální erytémové dávky, NB-UVB – úzkospektré UVB zářeníTab. 6b. Úprava dávky NB-UVB po přerušení léčby 
(upraveno dle 63)
Použité zkratky
NB-UVB – úzkospektré UVB zářeníTab. 7a. Doporučení pro dávkování BB-UVB 
(upraveno podle [63])
Použité zkratky
BB-UVB – širokospektré UVB záření, MED – minimální erytémová dávkaTab. 7b. Úprava dávky BB-UVB po přerušení léčby Přerušení léčby po dobu Úprava dávky 
(upraveno podle [63])
Použité zkratky
BB-UVB – širokospektré UVB zářeníUVA1 je indikováno u závažnějších forem AD [25, 32, 61, 63] a jeho terapeutický efekt je závislý na dávce. Nízké dávky UVA1 (< 30 J/cm2) jsou méně účinné než UVB, střední a vysoké dávky UVA1 mají obdobný efekt jako úzkospektré UVB [44, 61]. Existuje však menší skupina pacientů s AD, kteří netolerují úzkospektré UVB, mohou ale mít vynikající klinickou odpověď na širokospektré UVB [55]. NB-UVB a UVA1 fototerapie mají srovnatelnou účinnost a snášenlivost. Hlavní léčebnou možností z fototerapie v Evropě zůstává NB-UVB [25, 32, 33, 61, 63]. Střednědávkované UVA1 záření je vhodnější pro akutní fáze onemocnění.
Fototerapie není vhodná při podávání některých léků (antibiotika tetracyklinového typu, chinoliny, sulfonamidy, při užívání nebo lokální aplikaci nesteroidních antirevmatik a antiflogistik, užívání metotrexátu, retinoidů, amiodaronu, hydrochlorothiazidu, fibrátů, furosemidu, antiepileptik a dalších léků). Mezi absolutní kontraindikace fototerapie patří xeroderma pigmentosum a lupus erythematodes, mezi relativní kontraindikace se řadí fotodermatózy v anamnéze (např. chronická aktinická dermatitida, solární kopřivka), maligní melanom nebo nemelanomové kožní nádory v anamnéze, mnohočetné melanocytární névy, radioterapie v anamnéze a stav po transplantaci solidního orgánu na imunosupresivní léčbě [61]. Během fototerapie je nutné dodržovat tato bezpečnostní opatření: nošení ochranných brýlí s UV filtrem (prevence konjunktivitidy a keratitidy), ochrana obličeje (pokud není ošetření obličeje součástí léčby), přípravky s UV filtrem (sun protection factor – SPF 50+) nebo oděvem (maskou). Nezbytná je i ochrana genitálu (pokud není ošetření genitálu součástí léčby) spodním prádlem a pacienti se musí vyvarovat expozice přírodnímu slunci [25, 32, 33, 61, 63, 86].
Doporučuje se série minimálně 10–15 sezení, maximálně 20–25 ošetření [61]. Nedosažení EASI 75 po sérii ošetření při souběžné lokální léčbě je nutné považovat za selhání léčby, stejně jako relaps onemocnění do 3 měsíců po ukončení léčby. Léčbu je nutné přerušit při vzniku erytému a upravit dávku (viz tabulka 7b). Při zhoršení stavu nebo při vzniku intolerance (např. solární kopřivka, klaustrofobie) je nutné léčbu ukončit. V současné době opakované kúry a udržovací léčba fototerapií se nedoporučuje [87].
Helioterapie – AD je možné příznivě ovlivnit i slunečním zářením (helioterapie). Využívá přírodní zdroje za kontrolovaných podmínek. Jde o součást klimatoterapie v nízkých nadmořských výškách s UVA (Mrtvé moře) nebo ve vysokých nadmořských výškách s UVB (např. Davos) [61]. Expozice slunečnímu záření musí být pozvolná. Helioterapie současně zlepšuje balanci vitaminu D zvýšením koncentrace sérového kalcidiolu a podílí se na hojení projevů AD [77]. Kombinovaně se helioterapie používá v balneoterapii.
Thalassoterapie (thalassa – moře) je terapeutické využití mořské vody, mořských produktů (např. mořské řasy, mořské bahno), či pobytu u moře k ovlivnění projevů AD. Metoda TOMESA (Totes Meer Salz) využívá kombinaci synchronního léčebného působení NB-UVB fototerapie a balneoterapie s užitím speciálního solného roztoku, který imituje složení soli Mrtvého moře. Solná koupel má keratolytický účinek, ovlivňuje řadu zánětlivých mediátorů a zvýšenou hydratací podporuje účinky ultrafialového záření [86].
Všechny typy UV fototerapie mohou být spojeny s vyšším rizikem vývoje kožních karcinomů, katarakty a předčasného stárnutí (photoaging) kůže. Dosud žádná klinická studie nepotvrdila vyšší incidenci nemelanomových kožních nádorů (NMSC) v souvislosti s NB - -UVB, UVA1 fototerapií [61, 86] – Doporučení 4 a 5.
Doporučení 4.
- Střednědávkovaná UVA1 a NB-UVB fototerapie jsou doporučované k léčbě AD u dospělých pacientů.
- NB-UVB se upřednostňuje před BB-UVB terapií AD. • Současná léčba s TCS je možná v průběhu fototerapie.
- NB-UVB fototerapie u dětí se středně těžkou AD je možná od 6 let v případě, že AD není zvládána intenzivní lokální léčbou. Předpokladem je dobrá tolerance, nepřítomnost kontraindikací, spolupráce dítěte.
- NB-UVB se obvykle provádí 2–3krát týdně, dávku je možné zvyšovat při každém sezení, pokud je tolerována.
- Zhodnocení stavu a efektu léčby se provádí obvykle po 10–15 ošetřeních.
- Nedosažení EASI 75 po sérii ošetření (maximálně 20 až 25 ošetření) se považuje za selhání léčby.
- Relaps onemocnění do 3 měsíců se považuje za selhání fototerapie.
- Opakování fototerapie je možné nejdříve po 12 měsících od předcházející fototerapie, udržovací léčba či prolongované cykly se nedoporučují.
- Léčbu je nutné přerušit při vzniku erytému a upravit dávku (viz tab. 6c, 7b).
- Při zhoršení stavu nebo při vzniku intolerance (např. solární kopřivka, klaustrofobie) je nutné léčbu ukončit. (upraveno podle [61, 861, 89])
Doporučení 5. Bezpečnostní opatření během fototerapie
- Ochranné brýle s UV filtrem (prevence konjunktivitidy a keratitidy).
- Ochrana obličeje (pokud nejsou projevy na obličeji vhodné k fototerapii) přípravky s UV filtrem (SPF 50+) nebo oděvem (maskou).
- Ochrana genitálu (pokud nejsou projevy onemocnění na genitálu) spodním prádlem.
- Je nutné vyvarovat se expozici přírodnímu slunci. (upraveno podle [86, 89])
ANTIPRURIGINÓZNÍ LÉČBA
Úporné svědění je pacienty hodnoceno jako nejhorší doprovodný symptom AD, který ovlivňuje kvalitu života a významně narušuje kvalitu spánku. Intenzitu svědění zvyšuje následné škrábání (cyklus svědění–škrábání), které současně negativně ovlivňuje kožní bariéru. Snížení intenzity svědění je důležitým léčebným cílem u AD. K redukci svědění je možné použít lokální i celkovou léčbu, popř. jejich kombinaci. Ovlivněním pruritu jako izolovaného symptomu u AD se samostatně zabývalo pouze několik studií [86]. Svědění ovlivňují TCS, celkové kortikosteroidy (SCS), TIM, UV záření a celková léčba. Účinnost hojně předepisovaných antihistaminik (AH) je podle dostupných studií nejednotná a sporná. Protisvědivá léčba u AD je zaměřená jak na potlačení vlastních symptomů, tak na ovlivnění dalších faktorů AD (suchá kůže, lichenifikace, exkoriace, kožní zánět apod.) [74, 86].
Lokální protisvědivá léčba
Lokálně protisvědivé účinky mají kromě TCS a TIM i lokálně aplikovaná antihistaminika nebo inhibitory PDE4 (tab. 8).
Tab. 8. Lokální léčebné možnosti pro svědění u atopické dermatitidy 
(upraveno podle [42])
Použité zkratky: AD – atopická dermatitida, PDE-4 – fosfodiesteráza 4, TCS – lokální kortikosteroidy, TIM – topické kalcineurinové inhibitoryLokální antihistaminika (AH) – lokální doxepin (5% krém) snižuje svědění ovlivněním H1/H2 receptorů, jeho účinek u AD se potvrdil ve třech kontrolovaných studiích. Lokální doxepin není registrován v Evropě pro riziko indukce kontaktní senzibilizace, pokud je aplikace delší než 8 dnů [74, 86].
Agonisté kanabioidních receptorů mají protisvědivý a analgetický účinek. N-palmitoylethanolamin je komerčně dostupný lokální kanabinoid, který snižuje svědění posílením endokanabinoidní signalizace. V otevřené multicentrické studii s 0,3% krémem došlo ke kompletnímu ústupu svědění u 79,3 % účastníků a nutnost aplikace TCS klesla o 62 % [18, 74]).
Lokální anestetika (LA) – benzokain, lidokain, směs prilokainu a lidokainu mají pouze krátkodobé protisvědivé účinky. Účinek polidokanolu je popisován v kombinaci s 5% ureou v sérii kazuistik u dětí s AD, kdy došlo ke zlepšení o 30 % ve srovnání s emolienciem [74, 86]. Krém obsahující ketamin, amitriptylin a lidokain (KAL) snížil u 63 % pacientů intenzitu pruritu [42].
Kapsaicin v náplasti nebo krému znecitlivuje TRPV1 (TRPV1 – transient receptor potential vanilloid 1) kanálky, současně je antagonistou histaminu, PAR2 (proteázou - aktivovaný receptor typu 2) a substance P. Redukce svědění byla popsaná v sériích kazuistik. Nutnost časté aplikace a pocity pálení omezují adherenci pacientů k používání a léčbě a zároveň není vhodný k aplikaci na zánětlivě změněnou kůži pro extrémní bolestivost [74, 86].
Lokálně lze předepsat magistraliter přípravky s protisvědivým účinkem (např. obsahující mentol apod.). Jejich protisvědivý účinek je však krátkodobý a malý [69] – Doporučení 6.
Doporučení 6. Lokální kortikosteroidy snižují pruritus v časné fázi exacerbace AD
- Lokální inhibitory kalcineurinu snižují svědění u AD. • Lokální polidokanol může být použitý k redukci svědění u pacientů s AD.
- Rutinní použití lokálních antihistaminik, lokálních agonistů kanabioidních receptorů nebo lokálních anestetik se nedoporučuje jako adjuvantní protisvědivá léčba u AD.
- Není k dispozici dostatek dat pro doporučení užívání kapsaicinu v léčbě pruritu u pacientů s AD. (upraveno podle [42, 74, 86])
Celková protisvědivá léčba
Perorální antihistaminika (AH) blokující histaminový receptor 1 (H1R) se užívají mnoho let v protisvědivé léčbě. Pro antipruriginózní účinek AH (sedativní i nesedativní) v monoterapii jsou nedostatečné a rozporuplné důkazy vzhledem k nedostatku RCT. Studie většinou prokázaly slabý nebo žádný účinek na svědění [39, 70, 74, 81, 86]. Sedativní AH 1. generace (hydroxyzin, dimetidin, klemastin, bisulepin, dosulepin, promethazin) mohou mít efekt u pacientů se sníženou kvalitou spánku kvůli svědění [86]. Dlouhodobé podávání AH 1. generace (déle než 3 roky) může zvýšit riziko demence [42]. Většina RCT zaměřených na účinnost nesedativních AH 2. generace (loratadin, cetirizin, fexofenadin) prokázala v monoterapii slabý nebo žádný účinek na redukci svědění. Studie u dětí ve věku od 1 do 2 let neprokázala účinek cetirizinu (0,5 mg/kg/den po dobu 18 měsíců) ve srovnání s placebem. Studie s fexofenadinem (120 mg/den po dobu 1 týdne) snížila svědění hodnocené pacientem, efekt však nebyl klinicky signifikantní. Protisvědivý účinek cetirizinu v dávce 20–40 mg denně se přisuzuje spíše sedativnímu účinku při vyšší dávce, nikoli protisvědivému efektu [70, 74, 81]. Nesedativní AH 2. generace nejsou proto doporučována rutinně v monoterapii AD, vhodnější jsou pro jiná alergická onemocnění (kopřivka, mastocytóza, poštípání, plastický dermografismus) nebo k ovlivnění ostatních atopických komorbidit (alergická rinokonjunktivitida, astma). V kombinaci s lokální protizánětlivou léčbou (TCS, TIM) a aplikovanými emoliencii byl podle metaanalýzy s RCT popsán efekt na snížení svědění v 75 %, se současným zlepšením i dalších kožních symptomů [38, 39]. AH se považují za bezpečnou léčbu i v dlouhodobém podávání, hlavní výhodou se jeví úleva od symptomů komorbidit AD nebo i jiných alergických chorob [42, 70, 74, 81, 86].
Blokátory histaminového receptoru 4 (H4R antihistaminika) jsou v klinickém zkoušení se slibnými výsledky [86].
Selektivní inhibitory zpětného vychytávání serotoninu (SSRI) paroxetin a fluvoxamin prokázaly 50% protisvědivý efekt na malém vzorku pacientů s AD a pruritem [42, 50, 63, 86, 89]. Mirtazapin je vhodný u pacientů s AD a nočním zhoršením svědění, mechanismus účinku ovlivňující svědění je nejasný. V kombinaci s gabapentinoidy se jejich protisvědivý účinek potencuje [42].
Gabapentinoidy pravděpodobně snižují centrální nervovou dráždivost, nicméně mechanismus účinku gabapentinu a pregabalinu je nejasný. Lze je užívat v monoterapii nebo v kombinaci s mirtazapinem [42].
Antagonisté opioidních receptorů nalmefen (μ-opioidní antagonista receptoru) a naltrexon prokázaly antipruritický efekt u malého souboru pacientů s AD, pro léčbu pruritu u AD však nejsou registrované [86]. Butorfanol (kombinovaný kappa-agonista opioidního receptoru a μ-antagonista opioidního receptoru) potvrdil snížení intenzity svědění. Přípravek se aplikuje nazálně, má rychlý nástup účinku a nevyvolává závislost [42].
Systémová imunosupresivní, a zejména cílená léčba (biologika, malé molekuly) významně snižuje svědění [42, 86]. Podrobněji budou rozebrány v části II doporučených postupů.
Léčba pruritu v klinických studiích [42] Z lokálních přípravků snižuje svědění u AD tapinarof, dále roflumilast krém (PDE-4 inhibitor), 2% tofacitinib v masti (JAK inhibitor), ruxolitinib krém a delgocitinib mast [42].
Celková léčba pruritu
P2X3 agonista je ionotropní receptor exprimovaný na zakončeních primárních aferentních senzorických neuronů dorzálních ganglií, míchy a mozku, ovlivňuje pocity bolesti, aktuálně probíhají klinické studie u AD – Doporučení 7.
Doporučení 7
- K dispozici není dostatek důkazů pro všeobecné celkové podávání H1R AH 1. a 2. generace k léčbě pruritu u AD v monoterapii bez základní lokální a protizánětlivé léčby AD.
- Krátkodobé podání, intermitentní podání sedativních AH může mít efekt na zlepšení kvality spánku, a tím i zmírnění svědění, ale není náhradou základní lokální léčby AD.
- Dlouhodobé podávání sedativních AH v dětském věku může negativně ovlivnit kvalitu spánku, a proto se jejich podávání nedoporučuje.
- Používání sedativních AH u dětí školního věku může negativně ovlivňovat výkonnost dítěte ve škole, a proto je třeba věnovat pozornost dávce a době podávání.
- Dlouhodobé podávání AH 1. generace (déle než 3 roky) může zvýšit riziko demence.
- Antagonisté opioidních receptorů naltrexon a nalmefen nejsou doporučené pro rutinní léčbu pruritu u AD.
- Selektivní inhibitory zpětného vychytávání serotoninu paroxetin a fluvoxamin nejsou doporučené pro rutinní léčbu pruritu u AD, je možné použít mirtazapin.
(upraveno dle [42, 74, 86, 87]
LÉČBA INFEKCÍ (PROTIINFEKČNÍ LÉČBA)
Pacienti s AD jsou vnímavější ke kožním infekcím různé etiologie (bakteriálním, virovým, mykotickým), riziková může být generalizace projevů a některé infekce jsou život ohrožující. U více než 90 % pacientů s AD je i nepostižená kůže extenzivně kolonizovaná Staphylococcus aureus a správně aplikovaná protizánětlivá lokální léčba může snížit kolonizaci S. aureus. Ztráta diverzity kožního mikrobiomu vlivem kolonizace S. aureus je signifikantně spojena s náhlými vzplanutími (flare) choroby [65, 86, 90].
Antibakteriální léčba
Pravidelné používání syndetů, lokálních antiseptik nebo antibiotik (lokálních či celkových), případně nošení funkčních textilií snižuje kolonizaci S. aureus na atopické kůži. Volba přípravku musí být založena na klinických aspektech. Správná aplikace protizánětlivé lokální léčby (TCS a TCI) zlepšuje funkci kožní bariéry, současně snižuje kolonizaci S. aureus v projevech AD a je spojována s vyšší mikrobiální diverzitou v AD lézích [27].
Koupele s antiseptiky a emoliencia – s obsahem bakteriálních lyzátů byly již zmíněné. Přidávání chlornanu sodného do koupele mezi epizodami vzplanutí naopak neprokázalo jeho vyšší účinnost. Koupele jako takové (s chlornanem sodným/bez chlornanu sodného) jsou proto účinné v redukci kolonizace kůže S. aureus a mohou zlepšovat symptomy onemocnění, a není tudíž důvod je omezovat [33, 65, 70, 81, 86, 90].
Antimikrobiální textilie – funkční prádlo s antimikrobiálními vlastnostmi se nosí buď celých 24 hodin, nebo se obléká na spaní. Textilie uvolňující malé množství iontů stříbra mají mírný antiseptický účinek. Textilie impregnované stříbrem mají určité antimikrobiální vlastnosti, avšak u pacientů s AD bez známek infekce nebyl efekt stříbrem impregnovaných textilií v porovnání s bavlněným prádlem prokázán [33, 65, 70, 81, 86, 90].
Lokální antiseptika a lokální antibiotika snižují kromě S. aureus také ostatní potenciálně užitečné bakterie z kůže. Rizikem aplikace je vznik bakteriální rezistence a indukce kontaktní senzibilizace. Používání antiseptických mýdel nebo přidávání antimikrobiálních látek do zevních extern nemá prokazatelný efekt, pokud se aplikují na atopickou kůži bez klinických známek infekce. Pro pacienty se známkami lokalizované infekce je vhodný lokální mupirocin nebo kyselina fusidová. Doba aplikace lokální léčby je 2krát denně po dobu maximálně 2 týdny [33, 65, 70, 84, 86, 90].
Systémová antibiotika jsou indikovaná výhradně při klinických známkách rozsáhlé bakteriální superinfekce, případně s celkovými příznaky infekce. Vhodná je celková léčba cefalosporiny 1. generace nebo penicilináza rezistentními peniciliny. Doba podávání celkových antibiotik je maximálně dva týdny [33, 51, 65, 70, 81, 86, 90].
Antivirová léčba
Virové infekce se vyskytují častěji u pacientů s AD než u běžné populace.
Infekce virem herpes simplex (eczema herpeticatum/ herpeticum, EH) je akutní život ohrožující virové onemocnění, které se objevuje výhradně u pacientů s AD. Léčba EH spočívá v celkové léčbě antivirotiky (aciklovirem, valaciklovirem, popř. jinými antivirotiky), která má být zahájená okamžitě po stanovení klinické diagnózy. U pacientů s rozsáhlými projevy, se známkami systémového zánětu, u dětí mladších než 1 rok by měla být antivirotika aplikována parenterálně. Převedení na perorální léčbu je možné po zlepšení stavu. Pro mírnější případy je dostatečně efektivní perorální léčba. Lokální léčba antivirotiky nemá dostatečný efekt a nedoporučuje se. Pacientům s recidivujícím EH se doporučuje dlouhodobě léčba antivirotiky, přehodnocení by mělo být po 6–12měsíční léčbě (tab. 9). Léčba TCS není spojena s vyšším rizikem infekcí, zatímco léčba TIM má být v případě výskytu infekce okamžitě přerušená [51, 65, 78].
Tab. 9. Antivirová léčba u atopické dermatitidy 
(upraveno podle [78])
Použité zkratky
IV – intravenózní podáníInfekce poxviry (molluscum contagiosum virus, MCV) – u pacientů s AD dochází k infekci poxviry a diseminaci molusek podporuje škrábání. K léčbě je k dispozici řada volně prodejných lokálních přípravků (např. 10% roztok KOH, kantaridin, tretinoin krém, lokální cidofovir, imiquimod). Fyzikální léčba zahrnuje kryoterapii nebo kyretáž projevů v lokální anestezii. Léčba AD pomocí TCS může pokračovat během MCV infekce, snižuje svědění a tím preventivně zabraňuje autoinokulaci projevů [51, 65, 78].
Infekce Coxsackie viry (eczema coxsackium, EC) – může být zaměněna za EH. Léčba je podpůrná, symptomatická (antipyretika, lokální léčba). Lokální protizánětlivá léčba AD může pokračovat [51, 65, 78].
Antimykotická léčba
Kvasince rodu Malassezia se přičítá patogenetická role u AD. Předpokládá se, že antimykotická léčba může být účinná, zejména u pacientů s ekzémovými projevy na hlavě a krku a detekovatelnými IgE protilátkami proti kvasince Malassezia. Nejčastěji předepisovanými antimykotiky pro pacienty s AD jsou azolová antimykotika (itrakonazol), k lokální léčbě jsou vhodné imidazolové deriváty nebo ciclopiroxolamin [33, 51, 70, 81, 86, 90] – Doporučení 8.
Doporučení 8.
- Krátkodobé podání celkových antibiotik může být zváženo u klinických známek infekce S. aureus.
- Dlouhodobá aplikace lokálních antibiotik se nedoporučuje pro riziko rezistence a senzibilizace.
- Eczema herpeticatum/herpeticum musí být léčeno bez odkladu celkovou antivirovou léčbou.
- Lokální nebo systémová léčba antimykotiky může být účinná u pacientů s AD a projevy na hlavě a krku nebo s doloženou IgE senzibilizací na kvasinku rodu Malassezia.
(upraveno podle [86, 89, 90])
ZÁVĚR
Atopická dermatitida je heterogenní chronické, intenzivně svědící onemocnění, které vyžaduje dodržování režimových opatření, intenzivní lokální a často i celkovou léčbu. Má pestrý klinický obraz a je doprovázena řadou různých komorbidit. Výběr léčebné metody závisí na závažnosti onemocnění a přidružených chorobách. V I. části byly shrnuty recentní dostupné poznatky o režimových opatřeních, vyšetřovacích metodách, lokální léčbě atopické dermatitidy, léčbě pruritu a infekčních komplikací.
Střet zájmů
1AM přednáší pro firmy Abbvie, Amgen, Eli Lilly, LEO Pharma, Novartis, Pfizer, Sanofi, UCB, Pierre Fabre, je investigátorem klinických studií Abbvie, Eli Lilly, UCB, LEO Pharma je členem poradního sboru Abbvie, Allmiral, Eli Lilly, LEO Pharma, Novartis, Pfizer, Sanofi a UCB.
2PC přednáší pro firmy Abbvie, Amgen, Eli Lilly, Janssen - Cilag, LEO Pharma, Novartis, Pfizer, Sanofi, UCB, je investigátorem klinických studií Abbvie, Janssen, Novartis, LEO Pharma, je členem poradního sboru Abbvie, Allmiral, Eli Lilly, LEO Pharma, Novartis, Pfizer, Sanofi a UCB.
3MK přednáší pro firmy Abbvie, Amgen, Eli Lilly, Janssen - Cilag, LEO Pharma, Novartis, Pfizer, Sanofi, UCB, je investigátorem klinických studií Abbvie, Janssen-Cilag, Novartis, LEO Pharma, je členem poradního sboru Abbvie, Allmiral, Eli Lilly, LEO Pharma, Novartis, Pfizer, Sanofi a UCB.
3JF přednáší pro firmy Abbvie, Eli Lilly, Janssen-Cilag, LEO Pharma, Novartis, Sanofi, je subinvestigátorem klinických studií pro firmy Abbvie, Amgen, Janssen, Novartis, LEO Pharma, je členem poradního sboru pro firmy Abbvie, Allmiral, Amgen, Eli Lilly, LEO Pharma, Novartis.
4IK přednáší pro firmy Abbvie, LEO Pharma, Novartis, Sanofi, je investigátorem klinických studií Novartis, Sanofi.
5EB přednáší pro firmy Abbvie, Sanofi, je investigátorem pro klinické studie Galderma, je členem poradního sboru pro firmy Abbvie.
6RL přednáší pro firmy LEO Pharma, Pierre Fabre, Sanofi, je konzultantem firmy Pierre Fabre.
7MS přednáší pro firmy Abbvie, Novartis, Eli Lilly, LEO Pharma, Sanofi, Viatris, Janssen-Cilag a je členem poradního sboru pro firmy Abbvie, Novartis, Eli Lilly, Sanofi, LEO Pharma, Boehringer Ingelheim, UCB Pharma.
8SG přednáší pro firmy Abbvie, Amgen, Eli Lilly, Janssen, LEO Pharma, Novartis, Pfizer, Sanofi, UCB, je investigátorem klinických studií Abbvie, Janssen, Novartis, LEO Pharma, Sanofi, El-lilly, je členem poradního sboru Abbvie, Eli Lilly, LEO Pharma, Novartis, Pfizer, Sanofi a UCB.
Do redakce došlo dne 6. 3. 2023.
Adresa pro korespondenci:
MUDr. Alena Machovcová, Ph.D., MBA
Dermatovenerologické oddělení FN v Motole
V Úvalu 84
150 06 Praha 5KONTROLNÍ TEST
1. Atopická dermatitida (AD) v dospělém věku postihuje:
a) asi 2–8 % populace
b) asi 25 % populace
c) asi 40 % populace
d) každého druhého2. V etiopatogenezi AD se neuplatňuje:
a) genetická predispozice
b) porucha bariérové funkce kůže
c) zánět
d) kontaktní senzibilizace3. Normální hodnoty IgE protilátek (celkových nebo specifických) nacházíme:
a) asi u 10 % pacientů s AD
b) asi u 15 % pacientů s AD
c) asi u 20 % pacientů s AD
d) všichni pacienti s AD mají zvýšené hodnoty IgE protilátek4. Mezi atopické komorbidity u AD nepatří:
a) astma bronchiale
b) alergická rinokonjunktivitida
c) eozinofilní ezofagitida
d) ulcerózní kolitida5. Oční komorbidity u AD jsou:
a) časté
b) vzácné
c) nevyskytují se
d) u každého pacienta s AD6. Mezi validované skórovací škály AD nepatří:
a) IGA
b) EASI
c) SCORAD
d) DLQI7. Alergická kontaktní dermatitida je u pacientů s AD:
a) vzácná
b) vyskytuje se u každého atopika
c) postihuje 40–60 % pacientů s AD
d) u pacientů s AD se nikdy nevyskytuje8. Do základní léčby AD nepatří:
a) koupele a očista kůže
b) aplikace emoliencií
c) emoliencia plus
d) lokální kortikosteroidy9. Pro lokální kortikosteroidy neplatí:
a) jsou léčbou první linie AD
b) nahrazují používání emoliencií
c) aplikují se v proaktivním režimu
d) dlouhodobá aplikace v obličeji vyvolá např.steroidní rosaceu10. Pro topické imunomodulátory neplatí:
a) jsou léčbou první linie AD
b) jsou vhodná pro léčbu akutního vzplanutí AD
c) aplikují se v proaktivním režimu
d) při používání je nutná účinná fotoprotekceSprávným zodpovězením otázek kontrolního testu získáte 2 kredity kontinuálního vzdělávání lékařů ČLK. Správné odpovědi na otázky kontrolního testu budou uveřejněny v příštím čísle časopisu.
Odpovědi posílejte na e-mailovou adresu: kozni@lf1.cuni.cz vždy nejpozději do jednoho měsíce od vydání daného čísla a společně s odpověďmi uveďte svoje evidenční číslo ČLK, SLK (ID).
Odpovědi na otázky kontrolního testu v č.1/2023: Sticová E.: Amyloidózy kůže
Správné odpovědi: 1b, 2c, 3a, 4a, 5a, 6c, 7c, 8b, 9d, 10a.
Zdroje
1. ABRAHAMSSON, T. R., JAKOBSSON, H. E., ANDERSSON, A. F. et al. Low diversity of the gut microbiota in infants with atopic eczema. J. Allergy Clin. Immunol., 2012, 129(2), p. 434–440.
2. AKERSTRÖM, U., REITAMO, S., LANGELAND, T. et al. Comparison of moisturizing creams for the prevention of atopic dermatitis relapse: a randomized double-blind controlled multicentre clinical trial. Acta Derm. Venereol., 2015, 95(5), p. 587–592.
3. AL-SHOBAILI, H. A., AHMED, A. A., ALNOMAIR, A. et al. Molecular genetic of atopic dermatitis: an update. Int. J. Health Sci. (Qassim), 2016, 10(1), p. 96–120.
4. AMALIA, N., ORCHARD, D., FRANCIS, K. L. et al. Systematic review and meta-analysis on the use of probiotic supplementation in pregnant mother, breastfeeding mother and infant for the prevention of atopic dermatitis in children. Australas J. Dermatol., 2020, 61(2), p. 158–173.
5. ARELLANO, F. M., WENTWORTH, C. E., ARANA, A. et al. Risk of lymphoma following exposure to calcineurin inhibitors and topical steroids in patients with atopic dermatitis. J. Invest. Dermatol., 2007, 127(4), p. 808–816.
6. BATH-HEXTALL, F. J., BIRNIE, A. J., RAVENSCROFT, J. C. et al. Interventions to reduce Staphylococcus aureus in the management of atopic eczema: an updated Cochrane review. Br. J. Dermatol., 2010, 163(1), p. 12–26.
7. BECK, K. M., SEITZMAN, G. D., YANG, E. J. et al. Ocular co-morbidities of atopic dermatitis. Part I: Associated ocular diseases. Am. J. Clin. Dermatol, 2019, 20(6), p. 797–805.
8. BERTH-JONES, J., DAMSTRA, R. J., GOLSCH, S. et al. Twice weekly fluticasone propionate added to emollient maintenance treatment to reduce risk of relapse in atopic dermatitis: randomised, double blind, parallel group study. BMJ, 2003, 326(7403), p. 1367.
9. BOLOGNIA, J. L., SCHAEFFER, J. V., DUNCAN, K. O. et al. Dermatology Essentials. Masson: Elsevier, 2014, p. 989. ISBN 978-1-4557-0841-3.
10. BOGUNIEWICZ, M., FONACIER, L., GUTTMAN - -YASSKY, E. et al. Atopic dermatitis yardstick: Practical recommendations for an evolving therapeutic landscape. Ann. Allergy Asthma Immunol., 2018, 120(1), p. 10–22.
11. BRODSKÁ, P. Léčba středně těžkého a těžkého atopického ekzému u dospělých pacientů. Dermatol. Praxi, 2019, 13(1), s. 9–12.
12. CALLEWAERT, C., NAKATSUJI, T., KNIGHT, R. et al. IL-4Rα blockade by dupilumab decreases staphylococcus aureus colonization and increases microbial diversity in atopic dermatitis. J. Invest. Dermatol., 2020, 140(1), p. 191–202.e7.
13. DANBY, S. G., BROWN, K., HIGGS-BAYLISS, T. et al. The effect of an emollient containing urea, ceramide p, and lactate on skin barrier structure and function in older people with dry skin. Skin Pharmacol. Physiol., 2016, 29, p. 135–147.
14. DARSOW, U., WOLLENBERG, A., SIMON, D. et al. ETFAD/ EADV eczema task force 2009 position paper on diagnosis and treatment of atopic dermatitis. J. Eur. Acad. Dermatol. Venereol., 2010, 24, p. 317–328.
15. DAVIS, D. M. R., DRUCKER, A. M., ALIKHAN, A. et al. AAD Guidelines: awareness of comorbidities associated with atopic dermatitis in adults. J. Am. Acad. Dermatol., 2022, 86(6), p. 1335–1336.
16. DE BRUIN-WELLER, M., BIEDERMANN, T., BISSONNETTE, R. et al. Treat-to-target in atopic dermatitis: an international consensus on a set of core decision points for systemic therapies. Acta Derm. Venereol., 2021, 101(2), p. adv00402.
17. DOTTERUD, L. K., WILSGAARD, T., VORLAND, L. H. et al. The effect of UVB radiation on skin microbiota in patients with atopic dermatitis and healthy controls. Int. J. Circumpolar Health, 2008, 67, p. 254–260.
18. EBERLEIN, B., EICKE, C., REINHARDT, H. W. et al. Adjuvant treatment of atopic eczema: assessment of an emollient containing N-palmitoylethanolamine (ATOPA study). J. Eur. Acad. Dermatol. Venereol., 2008, 22(1), p. 73–82.
19. EICHENFIELD, L. F., WYNNIS, L. T., CHAMLIN, S. L. et al. Guidelines of care for the management of atopic dermatitis. Section 1: Diagnosis and assessment of atopic dermatitis. J. Am. Acad. Dermatol., 2014, 70(2), p. 338–351.
20. EICHENFIELD, L. F., TOM, W. L., BERGER, T. G. et al. Guidelines of care for the management of atopic dermatitis: Section 2. Management and treatment of atopic dermatitis with topical therapies. J. Am. Acad. Dermatol., 2014, 71(1), p. 116–132.
21. EICHER, L., KNOP, M., ASZODI, N. et al. A systematic review of factors influencing treatment adherence in chronic inflammatory skin disease – strategies for optimizing treatment outcome. J. Eur. Acad. Dermatol. Venereol., 2019, 33, p. 2253–2263.
22. FATTAHI, F., TEN HACKEN, N. H. T., LÖFDAHL, C. G. et al. Atopy is a risk factor for respiratory symptoms in COPD patients: results from the EUROSCOP. Respiratory Research, 2013, 14(10), p. 2–8.
23. FUTAMURA, M., LESHEM, Y. A., THOMAS, K. S. et al. A systematic review of Investigator Global Assessment (IGA) in atopic dermatitis (AD) trials: Many options, no standards. J. Am. Acad. Dermatol., 2016, 74(2), p. 288–294.
24. FURUTA, G. T., KATZKA, D. A. Eosinophilic esophagitis. N. Engl. J. Med., 2015, 373(17), p. 1640–1648.
25. GAMBICHLER, T., OTHLINGHAUS, N., TOMI, N. S. et al. Medium-dose ultraviolet (UV) A1 vs. narrowband UVB phototherapy in atopic eczema: a randomized crossover study. Br. J. Dermatol., 2009, 160, p. 652–658.
26. GELMETTI, C., WOLLENBERG, A. Atopic dermatitis – all you can do from the outside. Br. J. Dermatol., 2014, 170(Suppl 1), p. 19–24.
27. GONG, J. Q., LIN, L., LIN, T. Skin colonization by Staphylococcus aureus in patients with eczema and atopic dermatitis and relevant combined topical therapy: a double-blind multicentre randomized controlled trial. Br. J. Dermatol., 2006, 155(4), p. 680–687.
28. GOVIND, K., WHANG, K., KHANNA, R. et al. Atopic dermatitis is associated with increased prevalence of multiple ocular comorbidities. J. Allergy Clin. Immunol. Pract., 2019, 7, p. 298–299.
29. HACHEM, M. E., GESUALDO, F., RICCI, G. et al. Topical corticosteroid phobia in parents of pediatric patients with atopic dermatitis: a multicentre survey. Ital. J. Pediatr., 2017, 43(22), p. 1–6.
30. HAMANN, C. R., HAMANN, D., EGEBERG, A. et al. Association between atopic dermatitis and contact sensitization: A systematic review and meta-analysis. J. Am. Acad. Dermatol., 2017, 77(1), p. 70–78.
31. HANIFIN, J. M., RAJKA, G. Diagnostic feature of atopic dermatitis. Acta Derm. Venereol., 1980, 92(Suppl), p. 44–47.
32. HÖNIGSMANN, H. UVB therapy (broadband and narrowband). Last updated: 19 Aug, 2020. Dostupné na www: https://www.uptodate.com/contents/ uvb-therapy-broadband-and-narrowband?
33. HOWE, W., DELLAVALLE, R. P., LEVY, M. L. et al. Treatment of atopic dermatitis (eczema). Last updated: 11 Mar, 2022. Dostupné na www: https://www. uptodate.com/contents/treatment-of-atopic-dermatitis eczema.
34. HSU, J. I., PFLUGFELDER, S. C., KIM, S. J. Ocular complications of atopic dermatitis. Cutis, 2019, 104, p. 189–193.
35. HUANG, J. T., ABRAMS, M., TLOUGAN, B. et al. Treatment of Staphylococcus aureus colonization in atopic dermatitis decreases disease severity. Pediatrics, 2009, 123, p. e808–e814.
36. CHALMERS, J. R., HAINES, R. H., BRADSHAW, L. E. et al. Daily emollient during infancy for prevention of eczema: the BEEP randomised controlled trial. Lancet, 2020, 395(10228), p. 962–972.
37. CHOPRA, R., VAKHARIA, P. P., SACOTTE, R. et al. Efficacy of bleach baths in reducing severity of atopic dermatitis: A systematic review and meta-analysis. Ann. Allergy Asthma Immunol., 2017, 119(5), p. 435–440.
38. KATOH, N., OHYA, Y., IKEDA, M. et al. Clinical practice guidelines for the management of atopic dermatitis 2018. J. Dermatol., 2019, 46(12), p. 1053–1101.
39. KATOH, N., OHYA, Y., IKEDA, M. Clinical practice guidelines for the management of atopic dermatitis 2020. Allergol. Int., 2020, 69, p. 356–369.
40. KIDO-NAKAHARA, M., FURUE, M., ULZII, D. et al. Itch in atopic dermatitis. Immunol. Allergy Clin. North Am., 2017, 37, p. 113–122.
41. KOUTROULIS, I., PETROVA, K., KRATIMENOS, P. et al. Frequency of bathing in the management of atopic dermatitis: to bathe or not to bathe? Clin. Pediatr. (Phila), 2014, 53(7), p. 677–681.
42. LIPMAN, Z. M., LABIB, A., YOSIPOVITCH, G. Current clinical options for the management of itch in atopic dermatitis. Clin. Cosmet. Investig. Dermatol., 2021, 14, p. 959–969.
43. LUDWIG, G. On the topical effect of sea water tub - -baths with and without addition of an oil emulsion. Z. Haut. Geschlechtskr., 1968, 43, p. 683–688.
44. LUGER, T., AUGUSTIN, M., LAMBERT, J. et al. Unmet medical needs in the treatment of atopic dermattis in infants: an expert consensus on safety and efficacy of pimecrolimus. Pediatr Allergy Immunol., 2021, 32, p. 414–424.
45. MAJOIE, I. M., OLDHOFF, J. M., VAN WEELDEN, H. et al. Narrowband ultraviolet B and medium-dose ultraviolet A1 are equally effective in the treatment of moderate to severe atopic dermatitis. J. Am. Acad. Dermatol., 2009, 60, p. 77–84.
46. MAVILIA, L., MORI, M., ROSSI, R. et al. 308 nm monochromatic excimer light in dermatology: personal experience and review of the literature. G. Ital. Dermatol. Venereol., 2008, 143, p. 329–337.
47. MAIBACH, H. I., SURBER, C. Topical corticosteroids. Basel: Karger, 1992, 518 p. ISBN 978-3-8055-5332-2.
48. NAKAJIMA, S., KITOH, A., EGAWA, G. et al. IL-17A as an inducer for Th2 immune responses in murine atopic dermatitis models. J. Invest. Dermatol., 2014, 134, p. 2122–2130.
49. NGUYEN, T., CHOL, B., MAITRE M. et al. Additional pharmacological activity of I-modulia and generation of two newly designed extracts of Aquaphilus dolomiae culture for dermocosmetic actives. J. Eur. Acad. Dermatol. Venereol., 2020, 34(Suppl. 5), p. 27 – 29.
50. OHSAWA, Y., HIRASAWA, N. The role of histamine H1 and H4 receptors in atopic dermatitis: from basic research to clinical study. Allergol. Int., 2014, 63(4), p. 533–542.
51. ONG, P. Y., LEUNG, D. Y. Bacterial and viral infections in atopic dermatitis: a comprehensive review. Clin. Rev. Allergy Immunol., 2016, 51(3), p. 329–337.
52. PATEL, K. R., IMMANENI, S., SINGAM, V. et al. Association between atopic dermatitis, depression, and suicidal ideation: A systematic review and meta - -analysis. J. Am. Acad. Dermatol., 2019, 80(2), p. 402 – 410.
53. PESERICO, A., STADTLER, G., SEBASTIAN, M. et al. Reduction of relapses of atopic dermatitis with methylprednisolone aceponate cream twice weekly in addition to maintenance treatment with emollient: a multicentre, randomized, double-blind, controlled study. Br. J. Dermatol., 2008, 158, p. 801 – 807.
54. PLAINEROVÁ, M. Sestra v roli edukátorky v problematice atopického ekzému u dětí. Bakalářská práce. UP, Fakulta zdravotnických věd, Ústav ošetřovatelství, Olomouc, 2018, 34 s.
55. PUGASHETTI, R., LIM, H. W., KOO, J. Broadband UVB revisited: is the narrowband UVB fad limiting our therapeutic options? J. Dermatolog. Treat., 2010, 21, p. 326–330.
56. QUEILLE-ROUSSEL, C., PAUL, C., DUTEIL, L. et al. The new topical ascomycin derivative SDZ ASM 981 does not induce skin atrophy when applied to normal skin for 4 weeks: a randomized, double-blind controlled study. Br. J. Dermatol., 2001, 144, p. 507–513.
57. REITAMO, S., RISSANEN, J., REMITZ, A. et al. Tacrolimus ointment does not affect collagen synthesis: results of a single-center randomized trial. J. Invest. Dermatol., 1998, 111, p. 396–398.
58. RERKNIMITR, P., OTSUKA, A., NAKASHIMA, C. et al. The etiopathogenesis of atopic dermatitis: barrier disruption, immunological derangement, and pruritus. Inflamm. Regen., 2017, 37, p. 14. doi: 10.1186/ s41232-017-0044-7.
59. ROEDIGER, B., KYLE, R., YIP, K. H. et al. Cutaneous immunosurveillance and regulation of inflammation by group 2 innate lymphoid cells. Nat. Immunol., 2013, 14, p. 564–573.
60. RUZICKA, T., REITAMO, S. Tacrolimus ointment. Berlin Heidelberg: Springer Verlag, 2004, 279 p. ISBN 978-3-662-10209-1.
61. RUZICKA, T., RING, J., PRZYBILLA, B. (eds.). Handbook of Atopic Eczema. 2nd Edition. Berlin Heildelberg New York: Springer Verlag, 2006, 613 p. ISBN 3-540-23133-1.
62. SCHWARTZ, R. Pediatric atopic dermatitis. 2020. Dostupné na www: https://emedicine.medscape. com/article/911574-overview#a4.
63. SIDBURY, R., DAVIS, DM., COHEN, DE. et al. Guidelines of care for the management of atopic dermatitis: Section 3. Management and treatment with phototherapy and systemic agents. J. Am. Acad. Dermatol., 2014, 71, p. 327–349 a.
64. SIDBURY, R., WYNNIS, L. T., BERGMAN, J. N. et al. Guidelines of care for the management of atopic dermatitis Section 4. Prevention of disease flares and use of adjunctive therapies and approaches. J. Am. Acad. Dermatol., 2014, 71, p. 1218–1233 b.
65. SIEGFRIED, E. C., HEBERT, A. A. Diagnosis of atopic dermatitis: mimics, overlaps, and complications. J. Clin. Med., 2015, 4(5), p. 884–917.
66. SILVERBERG, J. I. Comorbidities and the impact of atopic dermatitis. Ann. Allergy Asthma Immunol., 2019, 123(2), p. 144–151.
67. SILVERWOOD, R. J., FORBES, H. J., ABUABARA, K. et al. Severe and predominantly active atopic eczema in adulthood and long term risk of cardiovascular disease: population based cohort study. BMJ, 2018, 23, 361, p. k1786. doi: 10.1136/bmj.k1786.
68. SKJERVEN, H. O., REHBINDER, E. M., VETTUKATTIL, R. et al. Skin emollient and early complementary feeding to prevent infant atopic dermatitis (PreventADALL): a factorial, multicentre, cluster-randomised trial. Lancet, 2020, 395(10228), p. 951–961.
69. SKLENÁŘ, Z. et al. Magistraliter receptura v dermatologii. 1. vyd. Praha: Galén, 2009, 278 s. ISBN 978-80 - 7262-588-8.
70. SPERGEL, J. M., LIO, P. A. Management of severe atopic dermatitis (eczema) in children. Dostupné na www: https://www.uptodate.com/contents/management - of-severe-atopic-dermatitis-eczema-in - -children? Last update: Aug 19 2020.
71. STEINERT, P. M., CANTIERI, J. S., TELLER, D. C. et al. Characterization of a class of cationic proteins that specifically interact with intermediate filaments. Proc. Natl. Acad. Sci. USA, 1981, 78, p. 4097–4101.
72. SUH, D. C., SUNG, J., GAUSE, D. et al. Economic burden of atopic manifestations in patients with atopic dermatitis-analysis of administrative claims. J. Manag. Care Pharm., 2007, 13, p. 778–789.
73. SUN, D., ONG, P. Y. Infectious complications in atopic dermatitis. Immunol. Allergy Clin. North Am., 2017, 37(1), p. 75–93.
74. SUTARIA, N., ADAWI, W., GOLDBERG, R. et al. Itch: Pathogenesis and treatment. J. Am. Acad. Dermatol., 2022, 86, p. 17–34.
75. THACI, D., REITAMO, S., GONZALEZ ENSENAT, M. A. et al. Proactive disease management with 0.03% tacrolimus ointment for children with atopic dermatitis: results of a randomized, multicentre, comparative study. Br. J. Dermatol., 2008, 159, p. 1348 – 1356.
76. THYSSEN, J. P., KEZIC, S. Causes of epidermal filaggrin reduction and their role in the pathogenesis of atopic dermatitis. J. Allergy Clin. Immunol., 2014, 134, p. 792–799.
77. VǞHǞVIHU, K., YLIANTTILA, L., SALMELIN, R. et al. Heliotherapy improves vitamin D balance and atopic dermatitis. Br. J. Dermatol., 2008, 158, p. 1323 – 1328.
78. WANG, V., BOGUNIEWICZ, J., BOGUNIEWICZ, M. et al. The infectious complications of atopic dermatitis. Ann. Allergy Asthma Immunol., 2021, 126(1), p. 3–12.
79. WASSMANN, A., WERFEL, T. Atopic eczema and food allergy. Chem. Immunol. Allergy, 2015, 101, p. 181–190.
80. WESTON, W. L., HOWE, W. Atopic dermatitis (eczema): Pathogenesis, clinical manifestations, and diagnosis. Last updated: Mar 21 2022. Dostupné na www: https://www.uptodate.com/contents/ atopic-dermatitis-eczema-pathogenesis-clinicalmanifestations - and-diagnosis?
81. WESTON, W. L., HOWE, W. Treatment of atopic dermatitis (eczema). Last updated: Jun 13 2022. Dostupné na www: https://www.uptodate.com/ contents/treatment-of-atopic-dermatitis-eczema?
82. WOLLENBERG, A., SHARMA, S., VON BUBNOFF, D. et al. Topical tacrolimus (FK506) leads to profound phenotypic and fubctional alterations of epidermal antigen-presenting dendritic cells in atopic dermatitis. J. Allergy Clin. Immunol., 2001, 107, p. 519–525.
83. WOLLENBERG, A, BIEBER, T. Proactive therapy of atopic dermatitis – an emerging concept. Allergy, 2009, 64, p. 276–278.
84. WOLLENBERG, A., SCHNOPP, C. Evolution of conventional therapy in atopic dermatitis. Immunol. Allergy Clin. North. Am., 2010, 30, p. 351–368.
85. WOLLENBERG, A., EHMANN, L. M. Long term treatment concepts and proactive therapy for atopic eczema. Ann. Dermatol., 2012, 24, p. 253–260.
86. WOLLENBERG, A., BARBAROT, S., BIEBER, T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J. Eur. Acad. Dermatol. Venereol., 2018, 32, p. 657–682a.
87. WOLLENBERG, A., BARBAROT, S., BIEBER, T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J. Eur. Acad. Dermatol. Venereol., 2018, 32(6), p. 850–878b.
88. WOLLENBERG, A., SZEPIETOWSKI, J., TAIEB, A. et al. Corrigendum: Consensus-based European gudelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J. Eur. Acad. Dermatol. Venereol., 2019, 33(7), p. 1436–1436
. 89. WOLLENBERG, A., CHRISTEN-ZACH, S., TAIEB, A. et al. ETFAD/EADV Eczema task force 2020 position paper on diagnosis and treatment of atopic dermatitis in adults and children. J. Eur. Acad. Dermatol. Venereol., 2020, 34(12), p. 2717–2744.
90. WOLLENBERG, A., KINBERGER, M., ARENTS, B. et al. European guideline (EuroGuiDerm) on atopic eczema – part II: non-systemic treatments and treatment recommendations for special AE patient populations. J. Eur. Acad. Dermatol. Venereol., 2022, 36(11), p. 1904–1926.
91. WOLLENSCHLǞGER, I., HERMANN, J., OCKENFELS, H. M. Targeted UVB-308 nm (UVB) therapy with excimer laser in the treatment of atopic dermatitis and other inflammatory dermatoses. Hautarzt, 2009, 60, p. 898–906.
92. www. atopikonline.cz
93. www.fondationeczema.org/en/app-assess-severity - your-eczema-po-scorad.
94. www.sukl.cz
95. YANG, H., WANG, J., ZHANG, X. et al. Application of topical phosphodiesterase 4 inhibitors in mild to moderate atopic dermatitis: a systematic review and meta - analysis. JAMA Dermatol., 2019, 155, p. 585–593.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2023 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- HydroCleanem efektivně hojíme onkologické rány po radioterapii
- Proces hojení ran krok za krokem a co ho může zkomplikovat
-
Všechny články tohoto čísla
- Symetrický, liekmi navodený, intertriginózny a flexurálny exantém. Popis prípadu
- Bulózní projevy na akrálních partiích končetin
- Zápisnica zo zasadania výboru Slovenskej dermatovenerologickej spoločnosti 7. 10. 2022 Bratislava
- Zápis ze schůze výboru ČDS konané dne 2. 2. 2023
- Zápis ze schůze výboru ČDS konané dne 9. 3. 2023
- 26. mítink Evropského dermatologického fóra (EDF) Montreux, 19.–21. 1. 2023
- Odborné akce 2023
- Úvodník
- Atopická dermatitida: současná doporučení pro diagnostiku a léčbu. Část I.
- BIOREP – registr biologické/cílené léčby: Souhrnná zpráva za rok 2022
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Atopická dermatitida: současná doporučení pro diagnostiku a léčbu. Část I.
- Bulózní projevy na akrálních partiích končetin
- BIOREP – registr biologické/cílené léčby: Souhrnná zpráva za rok 2022
- Odborné akce 2023
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



