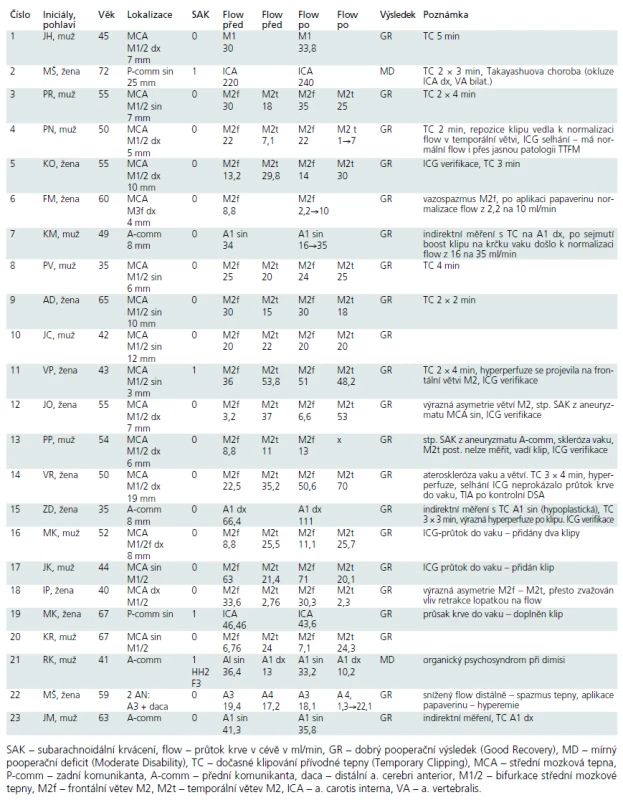
-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat
Quantitative Flowmetry of Parent and Branching Arteries during Surgical Treatment of Cerebral Aneurysma
Aim:
To present own experience with quantitative flow measurement (flowmetry) of parent and branching arteries during surgical treatment of cerebral aneurysms.Material and methods:
Intraoperative flowmetry enables quantitative blood flow measurement in ml/min on the basis of integration of the ultrasound beam transit time difference. Between 1/2011 and 5/2013, quantitative blood flow measurement of parent and branching arteries was performed in 23 patients during cerebral aneurysm surgery. The mean age was 52.1 years (30–73). Incidental aneurysms were present in 19 cases; four patients had subarachnoid hemorrhage (Hunt-Hess I in two and Hunt-Hess II in two). Location: middle cerebral artery aneurysm – 16 patients, anterior communication artery aneurysms – four patients, posterior communication artery aneurysm – two patients, and distal anterior cerebral artery aneurysm – one patient. Size of the aneurysm: small (≤ 7 mm) in 10 patients, middle (8–14 mm) in nine patients, large (15–24 mm) in three patients and giant (≥ 25 mm) in one patient.Results:
Thirty-day postoperative results: good recovery in 21 cases and moderate disability in two cases. No postoperative ischemia was recorded in the group of patients. A significant perioperative blood flow decline was recorded in four patients; this was due to vasospasm in two and the flow normalized after papaverin administration. Clip correction was necessary in two patients (8.7%) followed by normalization of the flow.Conclusions:
Quantitative blood flow measurement contributes to improved perioperative safety in cerebral aneurysms surgery. Role of flowmetry is irreplaceable in detection of parent and45 branching artery stenosis/occlusion.Key words:
cerebral aneurysms – surgical treatment – flowmetry – ischemia
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: V. Přibáň 1; J. Fiedler 2,3; J. Mraček 1; D. Štěpánek 1
Působiště autorů: Neurochirurgické oddělení LF UK a FN Plzeň 1; Neurochirurgické oddělení, Nemocnice České Budějovice a. s. 2; Neurochirurgická klinika LF MU a FN Brno 3
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(1): 70-76
Kategorie: Původní práce
Souhrn
Cíl:
Prezentace vlastních zkušeností s kvantitativním měřením krevního průtoku (flowmetrie) magistrálních tepen při operacích mozkových aneuryzmat.Soubor a metodika:
Intraoperační flowmetrie umožňuje intraoperační kvantitativní stanovení průtoku v měřené cévě v ml/min. V období 1/2011–5/2013 bylo kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat provedeno u 23 pacientů. Průměrný věk činil 52,1 let (30–73). V 19 případech se jednalo o incidentální aneuryzmata, ve čtyřech případech bylo přítomno subarachnoidální krvácení (2krát Hunt-Hess I, 2krát Hunt-Hess II). Lokalizace aneuryzmat: aneuryzma střední mozkové tepny 16krát, přední komunikující tepny 4krát, zadní komunikující tepny 2krát a a. pericallosa jednou. Velikost vaku aneuryzmat: malá (do 7 mm) 10, střední (8–14 mm) devět, velká (15–24 mm) tři a gigantické (nad 25 mm) jedno.Výsledky:
Třicetidenní pooperační výsledky: v 21 případech normální nález a ve dvou případech mírný deficit. V souboru nebyla zaznamenána pooperační ischemie. Patologické intraoperační hodnoty krevního průtoku se vyskytly u čtyř pacientů. Ve dvou případech byl příčinou vazospazmus. Normalizace hodnot průtoku nastala po podání papaverinu. Ve dvou případech (8,7 %) byla provedena korekce polohy klipu s následnou normalizací průtoku.Závěr:
Kvantitativní měření krevního průtoku magistrálních tepen přispívá ke zvýšení perioperační bezpečnosti chirurgie mozkových aneuryzmat. Úloha flowmetrie při detekci stenózy/okluze magistrálních tepen je nezastupitelná.Klíčová slova:
mozková aneuryzmata – chirurgická léčba – flowmetrie – ischemieÚvod
Cílem operace mozkových aneuryzmat je kompletní uzavření krčku aneuryzmatu klipem se současným zachováním průtoku krve v magistrálních tepnách, které mají anatomickou souvislost s aneuryzmatem (tj. v tepně mateřské a tepnách odstupujících). Riziko při operaci je v neúplném uzavření aneuryzmatu s možností recidivy krvácení, v okluzi magistrální tepny klipem a v uzávěru nebo poranění perforátorů. Recidivující krvácení z aneuryzmatu je zatíženo vysokou mortalitou/morbiditou. Okluze nebo stenóza mateřské tepny a odstupujících tepen může vyústit v ischemii v odpovídajícím povodí s následným neurologickým deficitem. Okluze perforátorů může postihnout hluboké struktury mozku – vnitřní kapsulu nebo corona radiata, výsledkem může být opět neurologický deficit. Z těchto důvodů jsou během operací aneuryzmat využívány metody, které jsou schopny detekovat potenciální technickou chybu a poskytují šanci na okamžitou nápravu [1]. Rychlé napravení technické chyby je jediná možnost, jak zabránit trvalému neurologickému deficitu. Přes pokroky v mikrochirurgii bylo na základě časných pooperačních angiografických vyšetření prokázáno, že přetrvávající plnění rezidua krčku nebo celého vaku se vyskytuje ve 4–19 % a okluze/stenóza mateřské tepny nebo tepen odstupujících z vaku v 0,3–12 % [2–5]. Při hodnocení úplnosti uzávěru aneuryzmatu se uplatňuje mikrovaskulární dopplerovská ultrasonografie (MDU) [6,7], ICG videoangiografie [8] a ve speciálních situacích intraoperační angiografie (iDSA) [9–12]. Při posouzení stenózy/okluze magistrální tepny nám výše uvedené metody poskytují pouze kvalitativní informaci ve smyslu, zda je krevní tok přítomen, nebo nepřítomen. Hemodynamicky významná stenóza mateřské tepny nebo větvících se tepen v oblasti aneuryzmatu tak nemusí být pomocí iDSA, MDU, či ICG videoangiografií správně zhodnocena. Výsledkem může pak být pooperační neurologický deficit. Kvantitativní zhodnocení průtoku krve v tepnách nám dává pouze intraoperační flowmetrie (Transit-Time Flow Measurement, TTFM). Na podkladě měření toku v tepnách před aplikací a po ní lze predikovat riziko ischemie v teritoriu monitorované tepny [13]. Autoři v textu prezentují vlastní zkušenosti s intraoperační flowmetrií při operacích mozkových aneuryzmat.
Soubor a metodika
Ultrazvuková flowmetrie (Transit-Time Flow Measurement, TTFM)
Vyšetření flowmetrem umožňuje intraoperační kvantitativní stanovení průtoku v měřené cévě v absolutních hodnotách v ml/min (obr. 1). Přístroj je vybaven sadou perivaskulárních průtokových sond o velikosti 1,5–8 mm. Při vlastním vyšetření jsou vybrány sondy tak, aby odpovídaly průsvitu vyšetřovaných intrakraniálních (1,5; 2 a 3 mm) a extrakraniálních tepen (4, 6 a 8 mm). Intrakraniální perivaskulární sondy mají bajonetový tvar a jejich „krček“ lze deformovat podle potřeby tak, aby nastala anatomická kongruence s průběhem měřené tepny (obr. 2). Tělo perivaskulární sondy obsahuje dva ultrazvukové transducery, na konci sondy je umístěn akustický reflektor. Do okénka mezi transducery a reflektorem se umístí céva, která je předmětem měření. Platí přitom pravidlo, že by tepna měla vyplňovat ze 65–100 % otvor (okénko) na konci sondy (obr. 3). Transducery emitují alternativně ve směru a v protisměru toku krve ultrazvukové paprsky proti sobě pod úhlem 45 stupňů. Paprsky jsou po průchodu cévou odráženy zpět akustickým reflektorem k neemitujímu transduceru. TTFM pracuje na principu srovnání tranzitních časů těchto paprsků pronikajících vyšetřovanou cévou v celém jejím průřezu. Tranzitní čas ultrazvukového paprsku je snížen, pokud míří ve směru proudu a naopak zvýšen, když míří proti proudu krve. Integrací rozdílu těchto veličin je určen průtok cévou v mililitrech za minutu [14]. Hodnota takto zjištěného průtoku je nezávislá na úhlu přiložení, průměru cévy, hematokritu či na turbulencích v cévě [15]. Měření se provádí na tepnách nejprve před zaklipováním aneuryzmatu a následně po aplikaci svorky (obr. 4, 5). Perivaskulární sonda adekvátního průsvitu se nejprve zapojí do přístroje – flowmetru. Následně se sonda přiloží na tepnu a operační pole naplní fyziologickým roztokem. Hodnoty průtoku krve jsou průběžně zaznamenávány na displeji přístroje. Po ustálení hodnot je lze v definovaném časovém úseku nahrát a vytisknout. Jsou tak získány hodnoty průměrného, maximálního a minimálního průtoku krve v ml/min a dále pulzatilní index (PI) (obr. 6, 7). Správná metodika vyšetření je rovněž podpořena akustickým signálem. Rozlišujeme měření direktní a indirektní. Příkladem direktního měření je TTFM u aneuryzmatu střední mozkové tepny v typické lokalizaci bifurkace: měří se průtoky krve v obou odstupujících větvích M2 bazálně a následně po zaklipování. Alternativou je měření průtoku na mateřské tepně M1 (opět před zaklipováním a po něm). Měření průtoku krve může být i indirektní. To se provádí v případě rizika manipulace s tepnami blízko vaku. Příkladem je aneuryzma přední komunikující tepny, u kterého aa. pericallosae (A2) jsou v intimním kontaktu s vakem, a případná manipulace s nimi by mohla přinést zvýšené riziko ruptury vaku. Tak tomu je, pokud míří vak mezi vidlici A2 – horní typ aneuryzmatu přední komunikanty. Měří se proto ipsilaterálně dominantní A1 před zaklipováním a po něm se současně dočasně umístěným klipem na kontralaterální A1. V tomto případě tok krve v ipsilaterální A1 reflektuje celkový průtok v obou A2. Průtok krve v měřených tepnách by měl být po zaklipování stejný nebo obvykle o 20–30 % vyšší než iniciálně. Za zvýšení průtoku je odpovědná hyperemie, která je spojena s aplikací dočasných svorek na magistrální tepny během preparace. Podmínkou adekvátního měření jsou stabilní podmínky během anestezie s důrazem na hodnoty krevního tlaku a hladiny CO2.
Obr. 2. Perivaskulární bajonetovitá mikrosonda. 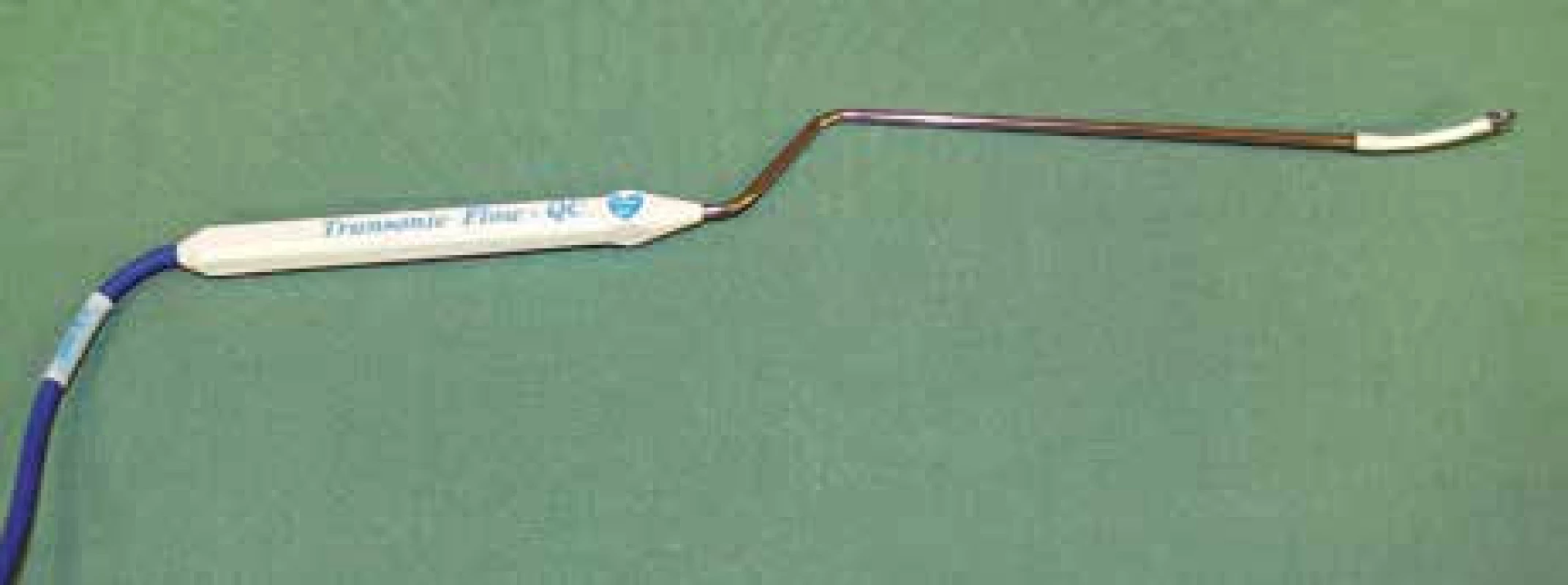
Obr. 3. Detail konce mikrosondy s tvarovatelným „krkem“ a koncovým okénkem, do kterého je při operaci vložena tepna. 
Obr. 4. Měření průtoku krve v temporální větvi M2 před zaklipováním aneuryzmatu. 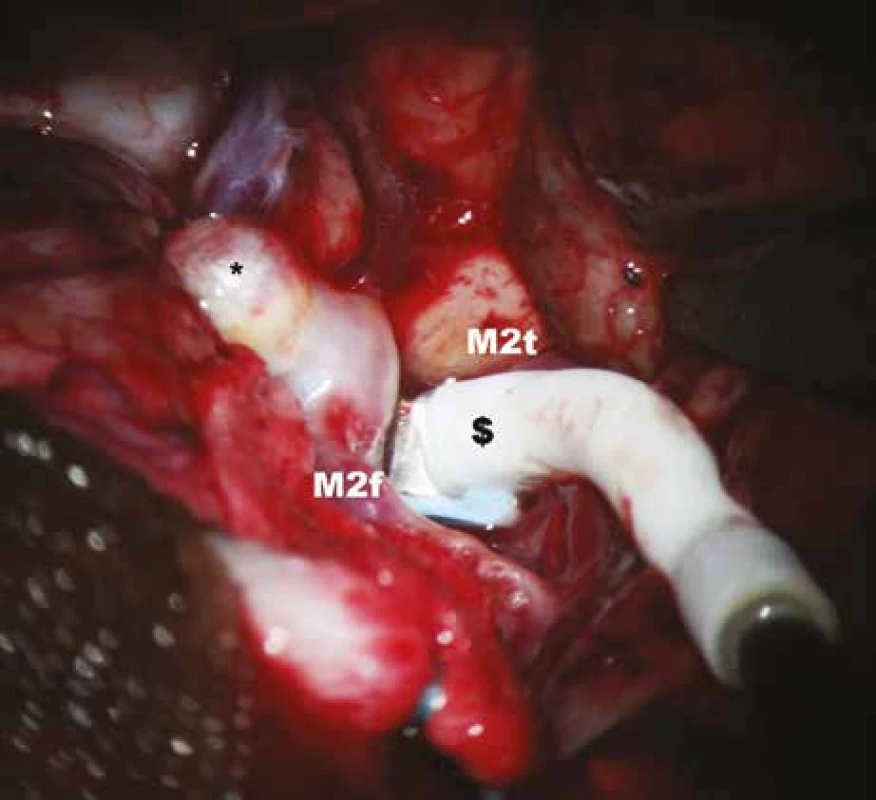
* – aneuryzma, $ – perivaskulární mikrosonda, M2f – frontální větev M2, M2t – temporální větev M2. Obr. 5. Měření průtoku krve v temporální větvi M2 po zaklipováním aneuryzmatu. 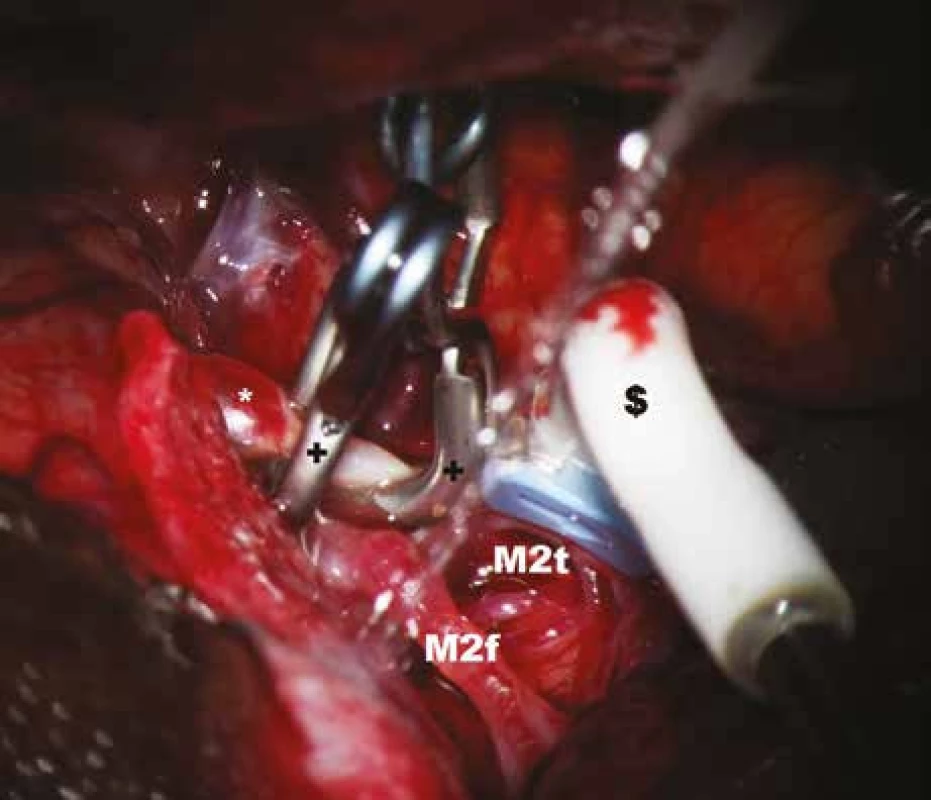
* – aneuryzma, $ – perivaskulární mikrosonda s tvarem krčku, přizpůsobeným průběhu tepny; M2f – frontální větev M2, M2t – temporální větev M2, + – aneuryzmatický klip. Obr. 6. Záznam krevního průtoku v a. temporalis anterior (ATA) před zaklipováním, zachycen průměrný, maximální, minimální průtok a pulzatilní index. 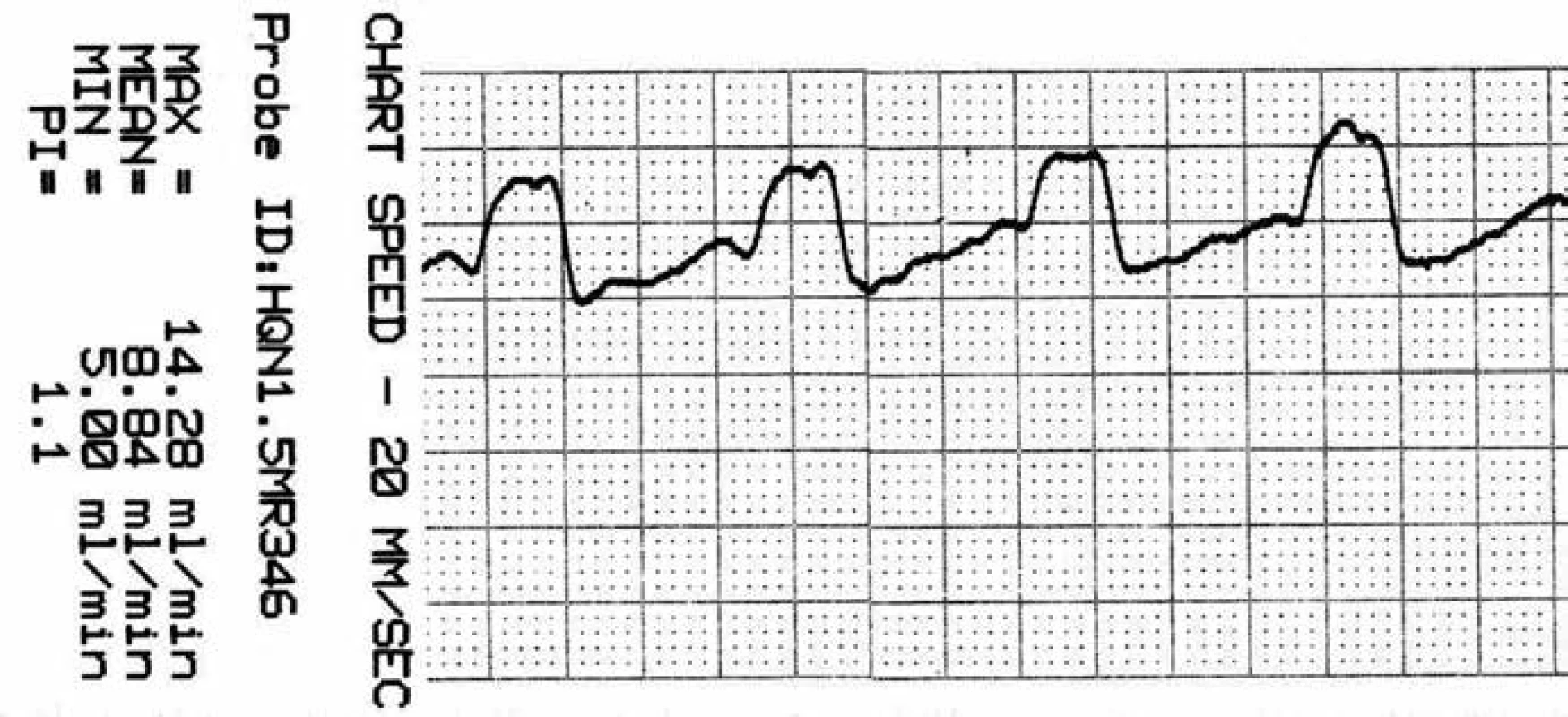
Obr. 7. Záznam krevního průtoku v ATA po zaklipování. 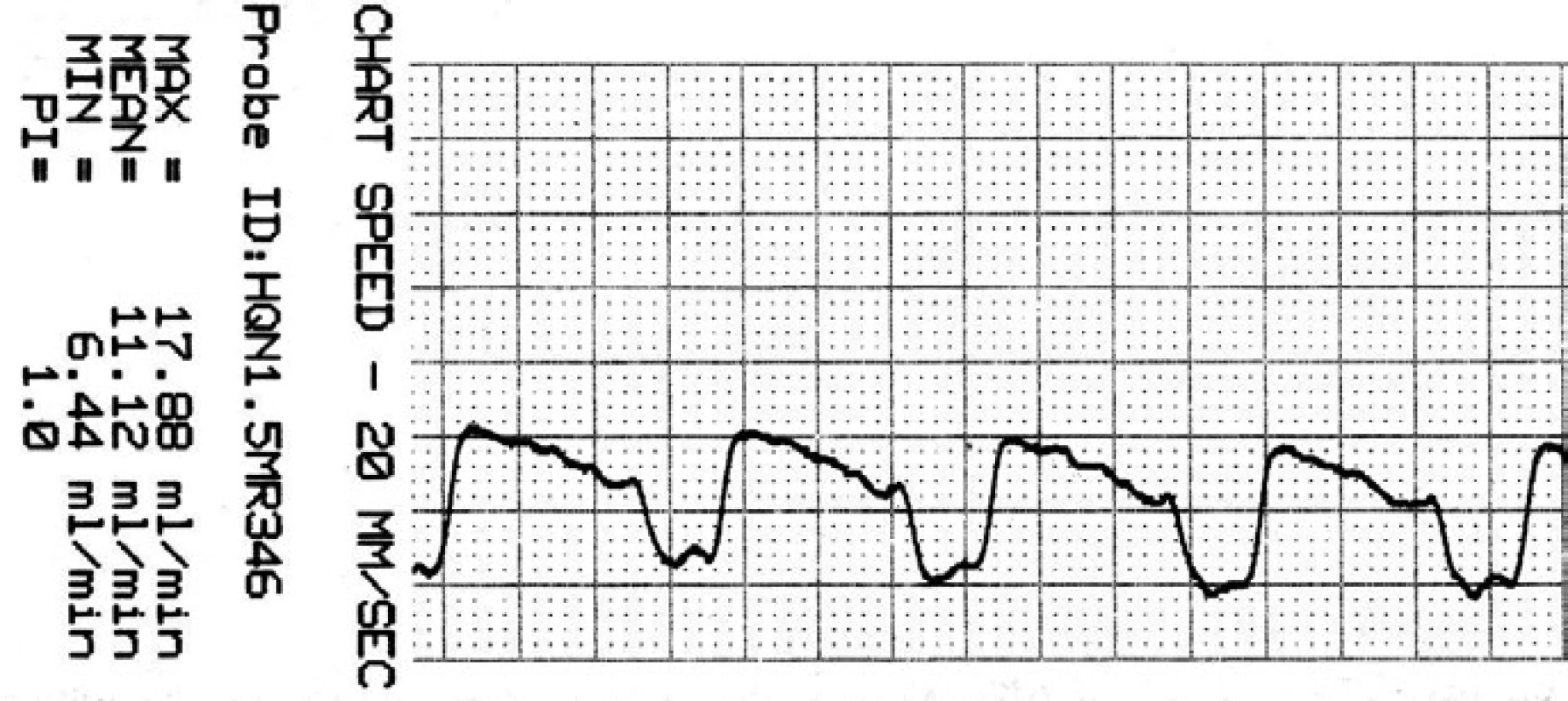
Je přítomna reaktivní hyperperfuze o 25 %. Soubor
V období od ledna 2011 do května 2013 bylo kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat provedeno u 23 pacientů. Mužů bylo 12, žen 11. Průměrný věk činil 52,1 let (30–73). U čtyř pacientů bylo přítomno subarachnoidální krvácení (dvakrát Hunt-Hess I, dvakrát Hunt-Hess II) a u dvou pacientů šlo o incidentální aneuryzmata, která byla identifikována při krvácení výdutě z jiné lokalizace. Nejčastější lokalizací bylo aneuryzma střední mozkové tepny (MCA) – 16 pacientů, dále přední komunikující tepny – čtyři pacienti, zadní komunikující tepny – dva pacienti a arteria pericallosa – jeden pacient. U aneuryzmat MCA šlo ve většině případů o typickou lokalizaci bifurkace M1/2. Výjimkou bylo aneuryzma distální v oblasti frontální větve na úrovni M3. Podle velikosti vaku bylo malých aneuryzmat (do 7 mm) 10, středních (8–14 mm) devět; velká aneryzmata (15–24 mm) byla tři a gigantické (nad 25 mm) jedno. Indirektní měření bylo provedeno u pacientů s aneuryzmatem přední komunikující tepny v souladu s výše uvedenou metodikou: byl změřen průtok krve v dominantní prekomunikální přední mozkové tepně (A1) za současné dočasné okluze kontralaterální A1. Měření bylo provedeno před zaklipováním aneuryzmatu a po něm. V ostatních případech bylo provedeno měření direktní. Na počátku jsme u aneuryzmatu a. cerebri media (MCA) jednou monitorovali průtok krve v hlavním kmeni M1 před zaklipováním a po něm. U všech ostatních aneuryzmat MCA jsme měřili průtok krve v obou větvích M2 po odstupu z vaku. Částečné selhání TTFM monitoringu nastalo jednou: měření průtoku v temporální větvi M2 po zaklipování nebylo možné, resp. bylo spojeno s velkým rizikem cévního poranění. Příčinou byla poloha branží klipu, které mechanicky bránily v přístupu sondy k iniciálnímu segmentu temporální větve M2. ICG videoangiografie byla provedena celkem u 11 pacientů, jelikož zpočátku nebyla součástí protokolu. V současné době je její využití paušální.
Výsledky
Shrnutí výsledků je v tab. 1.
Ve čtyřech případech TTFM prokázala patologické hodnoty. Ve dvou případech pak vedla ke korekci chirurgického přístupu.
Případ 1
Pacient PN (50 let) s neprasklým aneuryzmatem MCA. Krevní průtok před zaklipováním byl na frontální větvi M2 (M2f) 22 ml/min s indexem pulzatility 0,7; na temporální větvi M2 (M2t) byl v této fázi průtok 7,1 ml/min s PI 0,7. Asymetrie průsvitu obou tepen korelovala s objemem průtoku jednotlivých větví, tj. průsvit temporální větve M2 byl zásadně menší.
Nálezy průtoku krve po zaklipování aneuryzmatu byly: M2f 22 ml/min (PI 0,6) M2t 1 ml/min. Hodnota v temporální větvi byla jasně patologická, došlo k poklesu průtoku o 86 % ve srovnání se stavem před zaklipováním. Korekce polohy klipu vedla k normalizaci průtoku krve v M2t na 7 ml/min.
Případ 2
Pacient KM (49 let) s neprasklým aneuryzmatem přední komunikující tepny s hypoplastickou levou A1. Indirektní měření průtoku v pravé A1 s dočasnou okluzí levé A1 prokázalo iniciální průtok krve 34 ml/min. Aneuryzma bylo vyřazeno dvěma klipy směřujícími kolmo na sebe, přičemž menší z nich uzavíral drobné reziduum v oblasti krčku vaku. Monitorování po zaklipování prokázalo průtok krve v pravé A1 16 ml/min (snížení o 47 %). Sejmutí miniklipu vedlo k normalizaci průtoku krve na 35 ml/min. Drobné reziduum vaku bylo obaleno vatičkou s cílem vytvoření jizvy coby prevence růstu a ruptury vaku (wrapping).
Případ 3
Pacientka FM (60 let) s neprasklým distálním aneuryzmatem MCA na frontální větvi M3. Iniciální průtok krve byl 8,8 ml/min (PI 0,7). Po zaklipování došlo k poklesu na 2,24 ml/min (snížení průtoku o 75 %). Přítomný vazospazmus na tepně a přesvědčení operatéra o správnosti polohy klipu vedly nikoliv k repozici, nýbrž k lokálnímu podání papaverinu. Během několika minut nastala normalizace toku krve na 10 ml/min (PI 0,5).
Případ 4
Pacientka MŠ (59 let) s dvěma neprasklými aneuryzmaty na a. pericallosa (první na A3 – typická lokalizace v odstupu a. callosomarginalis, druhé distálněji na rozhraní A4/5). Iniciální průtok na A3 byl 19,4 ml/min (PI 0,6), na A4 17,2ml/min (PI 0,9). Po zaklipování aneuryzmat byly toky na A3 18,1, avšak na A4 jen 1,2 ml/min (pokles od 92,5 %). Pro vazospazmus na tepně distálně od prvního klipu byl podán papaverin s normalizací toku na 22,1 ml/min (PI 0,9).
U žádného z našich pacientů jsme nezaznamenali po operaci klinicky ani graficky ischemii v povodí tepen, které byly předmětem zájmu. Ve dvou případech bylo při propuštění mírné postižení (MD, Moderate Disability) – organický psychosyndrom, ostatní pacienti byli dimitováni v dobrém stavu (GR, Good Recovery).
ICG videoangiografie ve dvou případech prokázala reziduální plnění vaku. Po doplnění klipů opakované vyšetření prokázalo vyřazení aneuryzmatu z cirkulace. Ve dvou případech naopak ICG selhala. Jednou po zaklipování nepronikal kontrast do vaku, ačkoliv následná aspirace vaku vedla ke krvácení a nutnosti přidání dalších čtyř klipů. Ve druhém případě ICG prokázala antegrádní plnění větve M2, nicméně průtok při měření TTFM poklesl do patologických hodnot.
Diskuze
Kvantitativnímu měření průtoku krve v magistrálních tepnách v oblasti aneuryzmatu se dlouhodobě věnuje chicagská skupina reprezentovaná F. Charbelem a S. Amin-Hanjani. Charbel et al zavedli využití perivaskulární mikrosondy na principu TTFM s možností měření průtoku krve u tepen o průsvitu 1 mm [16]. Amin-Hanjani et al prokázali, že snížení průtoku krve v tepnách po zaklipování o více než 25 % je spojeno s jasným rizikem ischemie. Pokles o 50 % pak přináší jistotu iktu [17]. K podobným závěrům došli i další autoři [18,19]. Pokles průtoku o 25 % koreluje se zúžením tepny o 80 % původního průsvitu [20]. V sestavě 106 aneuryzmat u 103 pacientů zaznamenali Amin-Hanjani et al redukci průtoku o ≥ 25 % u 31 případů (33,1 %). U 27 pacientů se průtok po repozici klipu normalizoval. U dvou pacientů vznikla trombóza tepny a u šesti případů nastal reverzibilní spazmus. Třikrát stačilo uvolnění excesivní retrakce mozku a došlo k restituci průtoku. Zjevnou výhodou TTFM je okamžitá identifikace a přesná lokalizace okluze/stenózy magistrální tepny s možností včasné nápravy. Nevýhoda TTFM spočívá v nutnosti preparace v oblasti výdutě a magistrálních tepen ve větším rozsahu pro potřeby měření. To je potenciálně spojeno s větším rizikem operace a přináší několikaminutovu časovou prodlevu během výkonu. Obecnou nevýhodou metody pak je nemožnost identifikovat reziduum vaku a dále nelze hodnotit průtok v tepnách pod 1 mm průsvitu, tedy perforátory [17]. Kombinací s dalšími metodami lze tento hendikep překonat.
Nakayama et al využili TTFM celkem u 25 pacientů. Většina z nich podstoupila EC-IC bypass, u čtyř bylo provedeno klipování aneuryzmat. V jednom případě byli autoři nuceni změnit polohu klipu pro snížení průtoku krve v odstupující větvi M2 [21].
Podobně Fagundes-Pereyra et al ocenili TTFM u velkého komplexního aneuryzmatu MCA [22]. Kirk et al využili TTFM při operacích aneuryzmat, AVM, durálních fistulí a EC-IC bypassů. Operace aneuryzmat byly provedeny v 21 případech. Repozici klipu byli autoři nuceni provést třikrát, tedy ve 14 % [23].
V našem souboru jsme zaznamenali patologické hodnoty TTFM u čtyř pacientů (17,4 %), přičemž chirurgicky reagovat jsme byli nuceni dvakrát (8,7 %).
V prvním případě u aneuryzmatu MCA došlo po zaklipování k poklesu průtoku krve v temporální větvi M2 o 86 %, což zásadně převýšilo „iktový práh“ udávaný na 50 %. ICG videoangiografie přitom prokázala antegrádní plnění této větve kontrastem. Při diskrepanci metod jsme respektovali kvantitativní nález TTFM a provedli repozici klipu. Nález dokumentuje spíše limit metody ICG než její selhání. Zároveň je příkladem nezastupitelné role TTFM.
U druhého pacienta se pak podařilo peroperačně identifikovat patologické hodnoty průtoku při indirektním monitoringu pravé A1. Podle literárních zkušeností by se nález projevil ischemií v oblasti přední mozkové tepny. Včasná operační korekce (sejmutí miniklipu) zabránila iktu.
V dvou případech došlo ke snížení průtoku krve po zaklipování na podkladě vazospazmu. S ohledem na příčinu stavu – vazospazmus – se lze domýšlet, že by nález neměl negativní klinické konsekvence. Je pravděpodobné, že by spazmus odezněl dříve, než by mohla nastat ischemie. Jedná se však pochopitelně o spekulaci. Lokální podání papaverinu vedlo k promptní normalizaci průtoku krevního, dokumentovanou TTFM.
Monitoring TTFM (nemožnost bezpečně měřit na odstupové tepně) selhala v našem souboru v jednom případě. Klipy nám zabránily bezpečně přiložit sondu na temporální větev M2. Spolehli jsme se proto na vizuální vjem v kombinaci s ICG videoangiografií.
V našem souboru převažují aneuryzmata incidentální, lokalizovaná dominantně na a. cerebri media. Pacienti operovaní akutně pro subarachnoidální krvácení jsou z poslední doby. Souvisí to s tím, že autoři získali zkušenost s vlastní technikou TTFM a průběžně mohli ocenit její přednosti. V současné době tedy opouštějí selektivní přístup a subarachnoidální krvácení nepovažují za institucionální „exclusion criteria“. Na druhou stranu využití TTFM právě u aneuryzmat MCA považujeme za kruciální. Vzhledem k složité anatomii v této oblasti je známo, že ischemické komplikace v důsledku stenózy/okluze odstupujících tepen jsou častější než jinde v přední cirkulaci Willisova okruhu [24]. TTFM je proto pro nás u aneuryzmat MCA conditio sine qua non.
Ve shodě s Morcosem se domníváme, že kvantitativní flowmetrie a ICG videoangiografie představuje optimální kombinaci metod k eliminaci peroperačních rizik chirurgie aneuryzmat [25]. V naší sestavě u dvou pacientů (8,7 %) ICG videoangiografie dokumentovala průnik kontrastu do vaku po zasvorkování. Další výhoda této metody je možnost zobrazení perforátorů a eventuálního rezidua vaku. Na druhou stranu TTFM má výhodu v schopnosti kvantifikace průtoku krve. Normální nález ICG na magistrálních tepnách ještě nevylučuje patologický pokles průtoku.
Dobré pooperační výsledky našeho souboru mají několik příčin. Za prvé se jedná o selektivní sestavu pacientů s převahou incidentálních aneuryzmat v dobrém předoperačním stavu. Čtyři pacienti se subarachnoidálním krvácením byli také v dobrém stavu před výkonem (vždy Hunt-Hess I nebo II). Jsme nicméně přesvědčeni, že na dobrých výsledcích má spolupodíl monitoring TTFM. Nejméně ve dvou případech přispěla metoda k zabránění vzniku pooperační ischemie v povodí magistrálních tepen.
Závěr
TTFM představuje velmi užitečnou metodu, která přispívá ke zvýšení perioperační bezpečnosti chirurgie mozkových aneuryzmat.
Úloha TTFM při detekci stenózy/okluze magistrálních tepen je nezastupitelná.
Neschopnost TTFM detekovat reziduální vtok krve do vaku a patentnost perforátorů vyžaduje kombinaci s dalšími metodami.
Autoři doporučují na základě vlastních zkušeností kombinaci TTFM a ICG videoangiografie v prevenci peroperačních komplikací chirurgie mozkových aneuryzmat.
Podpořeno MZ ČR-RVO (Fakultní nemocnice Plzeň – PNPl, 00669806).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 30. 7. 2013
Přijato do tisku: 15. 10. 2013
MUDr. Vladimír Přibáň, Ph.D
Neurochirurgické oddělení
LF UK a FN
Alej Svobody 80
304 60 Plzeň
e-mail: v.priban@centrum.cz
Zdroje
1. Lehecka M, Laakso A, Hernesniemi J. Helsinki Microneurosurgery Basics and Tricks. Helsinki: Druckerei Hohl 2011.
2. Alexander TD, MacDonald RL, Weir B, Kowalczuk A. Intraoperative Angiography in cerebral aneurysms surgery: a prospective study of 100 craniotomies. Neurosurgery 1996; 39(1): 10–18.
3. Drake CG, Allcock JM. Postoperative angiography and the “slipped” clip. J Neurosurg 1973; 39(6): 683–689.
4. Macdonald RL, Wallace MC, Kestle JR. Role of angiography following aneurysm surgery. J Neurosurg 1993; 79(6): 826–832.
5. Rauzinno MJ, Quinn CM, Fischer W jr. Angiography after aneurysm surgery: indications for selective angiography. Surg Neurol 1998; 49(1): 32–41.
6. Bailes JE, Tantuwaya LS, Fukushima T, Schurman GW, Davis D. Intraoperative microvascular Doppler sonography in aneurysm surgery. Neurosurgery 1997; 40(5): 965–972.
7. Neuloh G, Schramm J. Monitoring of motor evoked potentials compared with somatosensory evoked potentials and microvascular Doppler ultrasonography in cerebral aneurysm surgery. J Neurosurg 2004; 100(3): 389–399.
8. Raabe A, Nakaji P, Beck J, Kim LJ, Hsu FP, Kamerman JD et al. Prospective evaluation of surgical microscope-integrated intraoperative near-infrared indocyanine green videoangiography during aneurysm surgery. J Neurosurg 2005; 103(6): 982–989.
9. Martin NA, Bentson J, Vinuela F, Hieshima G, Reicher M, Black K et al. Intraoperative digital subtraction angiography and the surgical treatment of intracranial aneurysms and vascular malformations. J Neurosurg 1990; 73(4): 526–533.
10. Dreyden CP, Moran CJ, Cross DT jr, Sherburn EW, Dacey RG jr. Intracranial anerysms: anatomic factors that predict the usefulness of intraoperative angiography. Radiology 1997; 205(2): 335–339.
11. Origitano TC, Schwartz K, Anderson D, Azar-Kia B, Reichman OH. Optimal clip application and intraoperative angiography for intracranial aneurysms. Surg Neurol 1999; 51(2): 117–128.
12. Katz M, Gologorsky BA, Tsiouris IJ, Wells-Roth D, Mascitelli J, Gobin YP et al. Is routine intraoperative angiography in the surgical treatment of cerebral aneurysms justified? A consecutive series of 147 aneurysms. Neurosurgery 2006; 58(4): 719–727.
13. Amin-Hanjani S, Charbel FT. Flow-assisted surgical technique in cerebrovascular surgery. Surg Neurol 2007; 68 (Suppl 1): S4–S11.
14. Drost CJ. Vessel diameter-independent volume flow measurements using ultrasound. Proc San Diego Biomed Symp 1978; 17 : 299–302.
15. Lundell A, Bergqvist D, Mattsson E, Nilsson B. Volume blood flow measurements with transit time flowmeter: an in vivo and in vitro variability and validation study. Clin Physiol 1993; 13(5): 547–557.
16. Charbel FT, Hoffman WE, Mishra M, Hannigan K, Ausman JI. Role of perivascular ultrasonic micro-flow probe in aneurysm surgery. Neurol Med Chir (Tokyo) 1998; 38 (Suppl): 35–38.
17. Amin-Hanjani S, Meglio G, Gatto R, Bauer A, Charbel FT. The utility of intraoperative blood flow measurement during aneurysm surgery using an ultrasonic perivascular probe. Neurosurgery 2008; 62 (6 Suppl 3): 1346–1353.
18. Eckert B, Thie A, Carvajal M, Groden C, Zeumer H. Predicting hemodynamic ischemia by transcranial Doppler monitoring during therapeutic balloon occlusion test of internal carotid artery. AJNR Am J Neuroradiol 1998; 19(3): 577–582.
19. Jawad K, Miller D, Wyper DJ, Rowan JO. Measurement of CBF and carotid artery pressure compared with cerebral angiography in assessing blood supply after carotid ligation. J Neurosurg 1977; 46(2): 185–196.
20. Spencer MP, Reid JM. Quantitation of carotid stenosis with continuous-wave (C-W) Doppler ultrasound. Stroke 1979; 10(3): 326–330.
21. Nakayama N, Kuroda S, Houkin K, Takikawa S, Abe H. Intraoperative measurement of arterial blood flow using a transit time flowmeter: monitoring of hemodynamic changes during cerebrovascular surgery. Acta Neurochir 2001; 143(1): 17–24.
22. Fagundes-Pereyrea WJ, Hoffman WE, Mishra M, Charbel FT. Clip readjustment in aneurysm surgery after flow evaluation using the ultrasonic perivascular probe. Arq Neuropsiquiatr 2005; 63(2A): 339–344.
23. Kirk HJ, Rao PJ, Seow K, Fuller J, Chandran N, Khurana VG. Intra-operative transit time flowmetry reduces the risk of ischemic neurological deficits in neurosurgery. Br J Neurosurg 2009; 23(1): 40–47.
24. Rinne J, Hernesniemi J, Niskanen M, Vapalahti M. Analysis of 561 patients with 690 middle cerebral artery aneurysms: anatomic and clinical features as correlated to management outcome. Neurosurgery 1995; 8(1): 2–11.
25. Morcos, JJ. Editorial: Indocyanine green videoangiography or intraoperative angiography? J Neurosurg 2013; 118(2): 417–419.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 1- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Generalizovaná úzkostná porucha, její diagnostika a léčba
-
Všechny články tohoto čísla
- Význam elektromyografie v chirurgické rekonstrukci spasticity horní končetiny
- Stiff‑ person syndrom sdružený s myotonickou dystrofií 2. typu – kazuistika
- Parézy hlavových nervů a nekrotizující zánět zevního zvukovodu – dvě kazuistiky
- Úleva od neuropatické bolesti pomocí odvracení pozornosti – kazustika
- Lokální trombolýza u závažné formy trombózy mozkových žil a splavů – dvě kazuistiky
- Navždy prerušená vitalita profesora Daniela Bartka
- Entuziazmus neuropsychiatrie
- Webové okénko
-
Analýza dat v neurologii
XLIII. Grafy usnadňující studium zavádějících faktorů v asociačních studiích – I. Kategoriální data - Možnosti pohybových aktivit u pacientů s roztroušenou sklerózou mozkomíšní
- Upozornění na klasifikační, terminologické a obsahové inovace Mezinárodní klasifikace bolestí hlavy (ICHD-3 beta) pro primární bolesti hlavy
- Je dlouhodobá disabilita u roztroušené sklerózy spojena s difuzní mozkovou patologií nezávislou na relapsech?
- Predikce pooperačního stavu u spondylogenní cervikální myelopatie
- Validita Montrealského kognitivního testu pro detekci mírné kognitivní poruchy u Parkinsonovy nemoci
- Výsledky programu hluboké mozkové stimulace v Olomouci
- Nedostatečná antikoagulační terapie v primární prevenci kardioembolických cévních mozkových příhod – výsledky deskriptivní prevalenční studie
- Hodnocení kvality klinických doporučených postupů České neurologické společnosti ČLS JEP
- Chirurgická léčba hydrocefalu
- Kvantitativní měření krevního průtoku magistrálních tepen při operacích mozkových aneuryzmat
- Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013
- Intraspinální juxtaartikulární cysty bederní páteře
- Komentář ke článku Intraspinální juxtaartikulární cysty bederní páteře autorů Bludovský a spol.
- Mikrochirurgická léčba symptomatických pineálních cyst
- Česká verze Autonomic Scale for Outcomes in Parkinson’s Disease (SCOPA-AUT) – dotazníku k hodnocení přítomnosti a závažnosti příznaků autonomních dysfunkcí u pacientů s Parkinsonovou nemocí
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mikrochirurgická léčba symptomatických pineálních cyst
- Chirurgická léčba hydrocefalu
- Stiff‑ person syndrom sdružený s myotonickou dystrofií 2. typu – kazuistika
- Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání