-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Radiochirurgická léčba kraniofaryngeomů v kombinaci s ostatními stereotaktickými metodami
Radiosurgery of Craniopharyngeomas in Combination with Stereotactic Methods
During 2/96–8/01 18 patients with craniopharyngioma were treated by stereotactic minimally invasive methods in our department at the Na Homolce Hospital and subsequently monitored for at least 5 years. The solid part of the craniopharyngioma was treated using gamma knife radiosurgery, the cystic parts of the tumor were treated with stereotactic aspiration or intracavitary brachytherapy. In a group of 18 patients (5 women, 13 men) treated with radiosurgery, the age varied from 7 to 73 (median 24) years. Fourteen patients underwent open partial resection before stereotactic radiosurgery (three patients were re‑operated), one patient underwent endoscopic partial operation, two patients had a shunt operation for their hydrocephalus, one patient underwent stereotactic biopsy, and one patient underwent external fractionated radiotherapy. The minimum marginal dose was in the range 12 to 35 (median 16) Greys, the median tumor volume was 3650 mm3. The follow up evaluation was 1–104 (median 61) months. Fifteen patients showed clinical improvement, three worsened clinically and died as a result of their tumour. Post‑radiation follow‑up imaging showed a reduction in tumour size in eleven patients (61 %) and no further tumour growth in 5 patients (27 %). One patient was found to have a larger tumour (6 %) 2 years after gamma knife treatment and this patient underwent repeated opened resection but died due to post‑operative complications. One patient had no follow up imaging, because he did not come for check–up, and died 7 months after gamma knife treatment. It is often necessary to apply a multidisciplinary approach in treating craniopharyngioma. If craniopharyngioma cannot be completely removed by means of surgery there are other treatment modalities, including stereotactic radiosurgery, that should be taken into consideration. Our results in a group of 18 patients proved the value of stereotactic radiosurgery as an adjuvant radiation treatment (15 patients), as an alternative to open surgery (3 patients) and the value of intracavitary irradiation radiosurgery (8 patients); in the case of one patient we show that it is possible to verify pathological diagnosis by stereotactic biopsy.
Key words:
craniopharyngioma – stereotactic surgery – intracavitary irradiation radiosurgery – stereotactic biopsy
Autoři: T. Chytka 1; R. Liščák 1; V. Vladyka 1; V. Dbalý 2; P. Štursa 3; Martin Syrůček 4
Působiště autorů: Nemocnice Na Homolce, Praha ; Oddělení stereotaktické a radiační neurochirurgie 1; Neurochirurgické oddělení 2; Radiodiagnostické oddělení 3; Oddělení patologické anatomie 4
Vyšlo v časopise: Cesk Slov Neurol N 2008; 71/104(5): 565-575
Kategorie: Krátké sdělení
Souhrn
V mezidobí 2/1996–8/2001 bylo na našem oddělení v Nemocnici Na Homolce pomocí stereotaktických minimálně invazivních metod včetně stereotaktické radiochirurgie léčeno celkově 18 pacientů s kraniofaryngeomem s následnou minimální dobou sledování pět let. Radiochirurgická léčba byla použita k léčbě solidních částí kraniofaryngeomu, cystické komponenty kraniofaryngeomu byly řešeny stereoaspirací či intrakavitární brachyterapií. V souboru fokálně ozářených 18 pacientů (5 žen, 13 mužů) se věk pohyboval od 7 do 73 let (medián 24 let). Radiochirurgické léčbě u 14 pacientů předcházela otevřená operace (u tří opakovaně), u jednoho pacienta endoskopická parciální resekce, dva pacienti pro hydrocefalus podstoupili zkratovou operaci, u jednoho pacienta předcházela stereobiopsie, u jednoho zevní frakcionovaná radioterapie. Minimální okrajová dávka fokálního záření 12–35 Gy (medián 16 Gy) byla aplikována do tumorózního objemu s mediánem 3 650 mm3 (150–8 700). Po radiochirurgické léčbě celého souboru 18 pacientů s délkou sledování v mediánu 61 měsíců (1–104) se pětiletého sledování nedožili tři pacienti, kteří zemřeli v souvislosti s tumorem v časnějším poradiačním období, 15 pacientů zaznamenalo klinické zlepšení. Poradiační zobrazovací vyšetření prokázala redukci objemu tumoru u 11 nemocných (61 %), stacionární tumor u pěti nemocných (27 %), u jednoho pacienta (6 %) jsme dva roky po ozáření zaznamenali progresi růstu tumoru. Tento pacient podstoupil mikrochirurgickou operaci, avšak v jejím časném komplikujícím pooperačním průběhu zemřel. Jeden pacient (6 %) nebyl graficky vyhodnocen, k zobrazovací kontrole se nedostavil a zemřel sedm měsíců po fokálním ozáření. Léčba kraniofaryngeomů si často vyžádá multidisciplinární přístup a v případě, že u pacienta s kraniofaryngeomem není možno nádor potřebně chirurgicky vyřešit, jsou k dispozici i stereotaktické léčebné metody včetně stereotaktické radiochirurgie. Naše výsledky ukazují v souboru 18 pacientů význam stereotaktické radiochirurgie jako léčby adjuvantní (15 pacientů) či jako alternativy mikrochirurgické resekce (tři pacienti) a význam intrakavitární brachyterapie (osm pacientů), u jednoho nemocného prezentujeme možnost stanovení definitivní diagnózy pomocí stereotaktické biopsie.
Klíčová slova:
kraniofaryngeom – gama nůž – intrakavitární brachyterapie – stereotaktická biopsieÚvod
Kraniofaryngeomy jsou pomalu rostoucí benigní částečně cystické epiteliální nádory odvozené z embryonálních zbytků Rathkeho výchlipky z oblasti předního horního okraje hypofýzy [1–3] nebo ze stopky hypofýzy [23]. U kraniofaryngeomů se rozlišují dvě klinickopatologické formy: adamantinozní typ u mladších nemocných a papilární typ vyskytující se častěji v dospělé populaci [1]. Kraniofaryngeomy představují 3–5 % všech intrakraniálních nádorů [2] a jsou nejčastějšími non‑neuroepiteliálními nádory dětského věku [4,5]. Výskyt dosahuje dvou věkových vrcholů: první vrchol je ve věku 5–14 let [6], 40 % kraniofaryngeomů u dětí se vyskytne mezi 8–12 lety [2], a druhý vrchol je u jedinců starších 50 let [6]. Není převaha žádného pohlaví [2,4,5]. I když kraniofaryngeom vyrůstá z hypofýzy, jeho intraselární lokalizace je vzácná, představuje jenom 5 % [1]. Mnohem častěji se šíří do okolí: supraselárně (20 %), rostrálně (30 %), do oblasti střední jámy (23 %) a na klivus (20 %) [6]. Kraniofaryngeom má tendenci růst i ektopicky, a to nejčastěji v nervus opticus, v pineální oblasti, v klínové kosti, ve faryngu a v mostomozečkovém koutu [6]. Papilární varianta obvykle postihuje třetí komoru [7].
Pro diagnózu adamantinomu je přínosné již rentgenové vyšetření lbi, které ukáže konfiguraci sedla a typické kalcifikace. Počítačová tomografie (CT) je citlivá na detekci kalcifikací (zcela kalcifikované tumory mohou být na magnetické rezonanci – MRI – přehlédnuty), kontrastní CT odliší solidní porci od cystické. Na MRI obraze je cystická komponenta adamantinomů v T1 vážení hyperintenzní, solidní komponenta se zpravidla po podání gadolinia výrazně sytí, stejně jako stěny cysty [2]. Často je adamantinom neostrých kontur a inkorporuje přilehlé cévy [2]. Papilární typ nemá kalcifikace, jeho vzhled je na CT uniformní a na MRI nevykazuje signálové charakteristiky obvyklé u adamantinomů, postkontrastně na T1 váženém obraze výrazně opacifikuje [2,8].
Navzdory tomu, že kraniofaryngeom je benigní nádor, nemocní můžou i opakovaně podstupovat invazivní léčbu, a to zejména když okraje tumoru vrůstají a pevně lnou do přilehlých struktur a nedají se potřebně chirurgicky vyřešit. Pak přicházejí v úvahu i další léčebné modality. Do repertoáru našeho pracoviště u pacientů s touto diagnózou patří u cystické komponenty tumoru možnost intrakavitární brachyterapie či stereoaspirace jejího tekutého obsahu, solidní komponenty kraniofaryngeomu je možno ošetřit gama nožem. Jestliže nepředcházelo potvrzení diagnózy otevřenou operací, můžeme histologickou verifikaci kraniofaryngeomu zajistit i stereotaktickou biopsií.
Metoda
Stereotaktickou radiochirurgii provádíme pomocí Leksellova gama nože model C, verze 4C (Elekta instrument AB, Stockholm), naši techniku jsme jiždetailně publikovali [9,10]. Stereocentraci od roku 1995 provádíme výhradněpomocí MRI (Magnetom expert 1T, Siemens). Ozařování plánujeme na počítačovém systému GammaPlan 5.11 (Elekta instrument AB, Stockholm), který umožňuje plánování současně ve třech rovinách, tvarování izodóz automatickým stíněním odpovídajících zdrojů, stanovení izodózních histogramů a prověření dávky do okolních struktur. Ozařujeme selektivně tkáň zobrazeného tumoru, takže ozářený objem se zpravidla shoduje s objemem i tvarem tumoru.
U 18 nemocných s kraniofaryngeomem jsme při plánování nejčastěji užívali 50% okrajovou izodózu na okraji plánovacího cílového objemu (15 pacientů), dále 70% izodózu (dva pacienti), 45% izodózu (jeden pacient) tak, abychom tvarováním izodózy docílili optimálního využití co nejstrmějšího gradientu dávky. Minimální okrajová dávka do tumoru se pohybovala od 12 do 35 Gray (Gy) – medián 16 Gy, objem tumoru od 150 do 8 700 mm3 (medián 3 650). U 17 pacientů bylo cílené ozáření Leksellovým gama nožem klasicky jednorázové. U jednoho nemocného s reziduálním tumorem, který těsně naléhal v krátkém segmentu na mozkový kmen, jsme vzhledem k vyšší toleranci mozkového kmene na záření při frakcionované radioterapii provedli rozložení okrajové dávky fokálního ozáření 20 Gy do pěti denních frakcí.
Brachyterapie yttriem90 dominuje jako léčebný postup u cystických kraniofaryngeomů, jak se solitární cystou, výjimečně multicystických; tuto techniku jsme rovněž publikovali [11]. Užíváme při ní Leksellův systém: koordinační rám, arkopolární polokruh s jezdcem a punkční jehlu. Stereocentraci provádíme pomocí MRI či CT vyšetření (Siemens Somatom DRH či Siemens Somatom Plus 4),řezy po 3 mm v axiální rovině včetně použití příslušné kontrastní látky a k výpočtům souřadnic cíle a zobrazení přístupové trajektorie používáme SurgiPlan Software. Do cíle, který stanovujeme ve středu cysty, zanoříme punkční kanylu a dle vypočteného objemu cysty prostřednictvím modifikovaného Loevingerova vzorce: A(250 Gy) = 5V/f (A je aktivita yttria90 v MBq, V je objem cysty volumetricky dle MRI/CT a f je objemdependentní faktor zvyšující se od 0–0,5 s rostoucím průměrem cysty) může být přesně stanoveno množství tekutého yttria90, které je třeba do cysty instilovat tak, aby kumulativní dávka na vnitřní secernující povrch cysty byla 250 Gy. Po aplikaci radioizotopu yttria90 je integrita stěny cysty kontrolována gama kamerou v den operace, poté třetí pooperační den. Kontrolujeme, zda nedochází k úniku radioizotopu z cysty. Po aplikaci yttria90 do kraniofaryngeomové cysty dojde k její hyalinní degeneraci, destrukci vystýlajících dlaždicobuněčných epiteliálních buněk, proliferaci fibrózní tkáně a ve stěně cysty k vaskulárním degenerativním změnám. Výsledným efektem bývá svraštění a zmenšení původního objemu cysty. U sedmi pacientů jsme do jejich kraniofaryngeomových cyst aplikovali yttrium90, u jednoho pacienta, u něhož byl vrchlík tumorózní cysty v přímém kontaktu s chiazmatem, jsme intrakavitárně aplikovali cytostatikum bleomycin.
Při stereotaktické aspiraci či stereotaktické biopsii rovněž využíváme Leksellův stereotaktický systém, k aspiraci punkční jehlu a k bioptickému odběru pak dvouplášťovou Sedanovu kanylu o světlosti 2,1 či 2,5 mm. Stereocentraci provádíme pomocí MRI či CT vyšetření (Siemens Somatom DRH či Siemens Somatom Plus 4), řezy po 3 mm v axiální rovině včetně použití příslušné kontrastní látky a k výpočtu souřadnice cíle a zobrazení přístupové trajektorie SurgiPlan Software. Definitivní histologická diagnóza bioptických vzorků byla stanovena na našem oddělení patologické anatomie dle WHO klasifikace [3].
Soubor pacientů (souhrnně demonstruje tab. 1)
V mezidobí 2/1996–8/2001 bylo na našem oddělení v Nemocnici Na Homolce pomocí gama nože a stereotaktických minimálně invazivních metod léčeno 18 pacientů s kraniofaryngeomem s následnou minimální dobou sledování pět let. U 14 pacientů cílenému ozáření Leksellovým gama nožem předcházela otevřená operace (u tří opakovaně), u jednoho pacienta endoskopická parciální resekce, dva pacienti pro hydrocefalus podstoupili zkratovou operaci (z toho jeden pacient měl provedenu Torkildsenovu drenáž a jeden byl po Scarfově operaci III. komory), u jednoho nemocného radiochirurgii předcházela stereotaktická biopsie s histologickým stanovením kraniofaryngeomu, u dvou pacientů byla diagnóza určena cytologií aspirátu získaného stereopunkcí.
V souboru fokálně ozářených 18 pacientů (5 žen, 13 mužů) se věk pohyboval v rozmezí 7–73 let (medián 24 let), Karnofského skóre od 50 do 100 % (medián 85). U 15 pacientů se kraniofaryngeom manifestoval endokrinopatií (u 11 nemocných panhypopituitarizmem, z toho u pěti včetně diabetes insipidus, u čtyř nemocných dysfunkcí adenohypofýzy, v jednom případě byla endokrinopatie spojená s primární amenoreou, v jednom s hypogonadizmem), 12 pacientů vykazovalo poruchu zrakových funkcí (z toho u tří pacientů jsme zaznamenali pouze poruchy perimetru, u dvou zhoršení pouze vizu, u sedmi poruchu perimetru i vizu, u dvou pacientů porucha zraku dospěla až do jednostranné amaurózy, u dvou nemocných byla diplopie). Z postižení hlavových nervů bylo ve dvou případech zaznamenáno postižení odtahovacího nervu, v jednom případě okohybného nervu, jeden pacient vykazoval současný deficit lícního nervu a pravostrannou centrální hemiparézu. Z dalších neurologických příznaků se v devíti případech vyskytla cefalea, dvakrát organický psychosyndrom, jednou imbalance, jednou vertigo. Jednou se objevily kolapsové stavy a jednou inkontinence.
Jako první příznak onemocnění se nejčastěji vyskytly bolesti hlavy (u devíti z 18 pacientů), dále třikrát porucha perimetru, třikrát porucha vizu, dvakrát endokrinopatie a jednou vertigo. Medián doby od vzniku prvních příznaků do stanovení diagnózy činil 36 měsíců (rozmezí 3–372).
Tab. 1. Charakteristika 18 pacientů s kraniofaryngeomem. 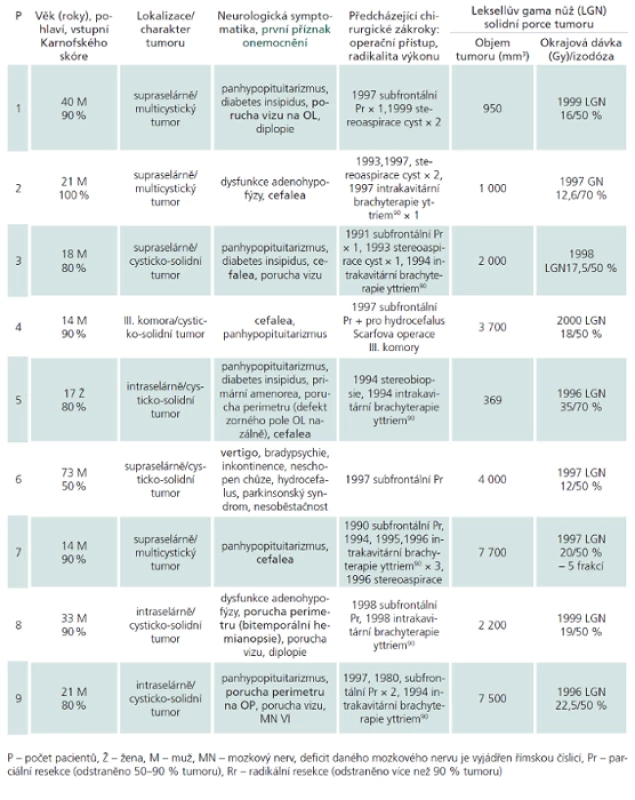
Výsledky
Poradiační klinická odpověd
Během dosavadního poradiačního sledování skupiny fokálně ozářených 18 pacientů s délkou sledování v mediánu 61 měsíců (1–104, pětiletého sledování se nedožili tři pacienti, kteří zemřeli v časnějším poradiačním období) jsme u 15 pacientů mohli hodnotit celkové klinické zlepšení. U 14 klinicky zlepšených nemocných byla endokrinopatie kompenzována při hormonální substituci. Porucha zrakových funkcí u devíti pacientů se zlepšenou celkovou kondicí byla stacionární bez zhoršení předradiačního očního nálezu, u jednoho pacienta se porucha vizu zlepšila, diplopie u dvou pacientů vymizela. Postižení n. VI. se u dvou klinicky zlepšených nemocných částečně upravilo, u pacienta, který vykazoval současný deficit lícního i okohybného nervu a pravostrannou centrální hemiparézu, se paréza MN VII zlepšila, paréza MN III zůstala stacionární, zániková pravostranná symptomatologie se upravila, u všech 15 pacientů se zlepšenou celkovou kondicí se vstupní předradiační další neurologické příznaky zlepšily a nové se neobjevily.
U tří pacientů se po ozáření klinický stav zhoršil a zemřeli, úmrtí těchto pacientů bylo v souvislosti tumorem. U prvního, 43letého nemocného byla dva roky po ozáření pooperačního reziduálního kraniofaryngeomu při zobrazovacím vyšetření detekována recidiva tumoru. Pacient sice podstoupil mikrochirurgickou dekompresivní operaci, avšak v jejím časném komplikovaném pooperačním průběhu zemřel. Ve druhém případě se jednalo o 59letou pacientku s cysticko‑solidním kraniofaryngeomem již po dvou operacích tumoru transsfenoidálním a subfrontálním přístupem s marsupializací cysty. Pro opětovné plnění cysty s propagací proti III. komoře a hydrocefalus byl klinicky u pacientky pozorován organický psychosyndrom, dezorientace, porucha vizu a perimetru, nejistota při chůzi. Stereotakticky bylo evakuováno 13 ml obsahu cysty a ihned následovalo ozáření gama nožem. Po výkonu byla pacientka somnolentní, ale přibližně 12 hod od výkonu došlo ke zhoršování stavu vědomí. CT mozku nezjistilo intrakraniální komplikaci ve smyslu krvácení, jen redislokaci komprimovaných struktur, stav dále progredoval. Nastala zástava dechu, po kardiopulmonální resuscitaci nedošlo k obnově oběhu. Kauza mortis dle pitevního protokolu: insuficientia cordis chronica, hydrocefalus internus. Ve třetím případě šlo o 73letého pacienta se supraselárním kraniofaryngeomem s propagací do III. komory. Pacient byl po otevřené operaci, subfrontálně byla prakticky provedena jen otevřená biopsie, byl doporučen k ozáření gama nožem. Klinicky nesoběstačný, bradypsychický, inkontinentní, neschopen chůze – Karnofského skóre 40 %. V poradiačním období nedošlo ke zlepšení, postupně pokračovalo zhoršování celkové kondice, psychosyndromu, deteriorace a pacient zemřel sedm měsíců po radiochirurgické léčbě.
Poradiační zobrazovací kontrolní (CT, MRI) vyšetření
Během dosavadního sledování skupiny fokálně ozářených 18 pacientů v rozmezí 1–104 měsíců (medián 61) poradiační zobrazovací vyšetření prokázala redukci objemu tumoru u 11 nemocných (61 %), stacionární tumor u pěti nemocných (27 %), u jednoho pacienta (6 %) jsme dva roky po ozáření zaznamenali progresi růstu tumoru, jeden pacient (6 %) nebyl graficky vyhodnocen. Nedostavil se k zobrazovací kontrole, protože zemřel sedm měsíců po fokálním ozáření.
U žádného z fokálně ozářených pacientů nebyly v kritických strukturách (mozkový kmen, optické struktury) pozorovány změny signálních charakteristik svědčící pro pozdní poradiační změny.
Stereotaktická aspirace
Před radiochirurgickou léčbou byly cystické komponenty kraniofaryngeomu řešeny stereoaspirací u 11 pacientů (u dvou opakovaně), u tří pacientů úspěšná stereoaspirace redukující objem cystické komponenty bezprostředně předcházela radiochirurgické léčbě. V poradiačním průběhu byla stereoaspirace použita pro nově vytvořené cysty u dvou pacientů (u jednoho z nich dvakrát). U jednoho pacienta vzhledem k tomu, že se cysta po punkci i po následné intrakavitární brachyterapii v krátkém čase znovu doplnila, byla stereotakticky implantována Rickamova drenáž.
Intrakavitární brachyterapie
U sedmi pacientů jsme do kraniofaryngeomových cyst aplikovali yttrium90 (jeden pacient s multicystickým tumorem měl brachyterapii yttriem90 dokonce pětkrát, z toho třikrát do stejné cysty), u jednoho pacienta byl do cysty aplikován bleomycin. U všech sedmi pacientů léčených intrakavitární brachyterapií yttriem90 jsme nakonec zaznamenali regresi všech léčených cystických komponent, čímž bylo umožněno tumor indikovat k radiochirurgické léčbě gama nožem. Příkladem této kombinované léčby je pacient na obr. 1. U jednoho pacienta, který byl již po otevřené operaci subfrontálním přístupem pro cysticko‑solidní tumor a cysta residuálního tumoru se po opakovaných stereoaspiracích opět doplnila, jsme použili bleomycin k intrakavitární chemoterapii. V dalším průběhu se v krátkém čase cysta znovu doplnila, a proto musela být stereotakticky implantována Rickamova drenáž a obsah cysty byl touto drenáží v průběhu 18 měsíců opakovaně evakuován. Nedošlo k předpokládanému vyhasnutí sekreční aktivity cysty, jen kontrolovanými evakuacemi byl klinický stav pacienta kompenzován bez ohrožení jeho zrakových funkcí. I když reziduální sekreční aktivita cysty i nadále přetrvávala, rozhodli jsme se nakonec po jednorázovém odsátí, kdy cysta zcela zkolabovala, indikovat radiochirurgickou léčbu a šest měsíců poté Rickamovu drenáž explantovat.
Obr. 1. (a–c). MRI snímky. Na T1 váženém postkontrastním koronárním skenu je reziduální intraselární kraniofaryngeom po parciální operaci a reoperaci subfrontálním přístupem a brachyterapii yttriem90 cystické části tumoru u 21letého muže (obr. 1a). Na MRI kontrole 7 (obr. 1b) a 10 let (obr. 1c) po ozáření gama nožem zůstává postupně se zmenšující intraselární cystické reziduum kraniofaryngeomu. Pacient je v dobré celkové kondici, panhypopituitarizmus je kompenzovaný endokrinologickou medikací, kontrolní oční vyšetření neprokazuje žádné zhoršení perimetru, porucha vizu je zlepšena brýlovou korekcí, postižení n. abducens se upravuje. Dosavadní poradiační průběh je příznivý. 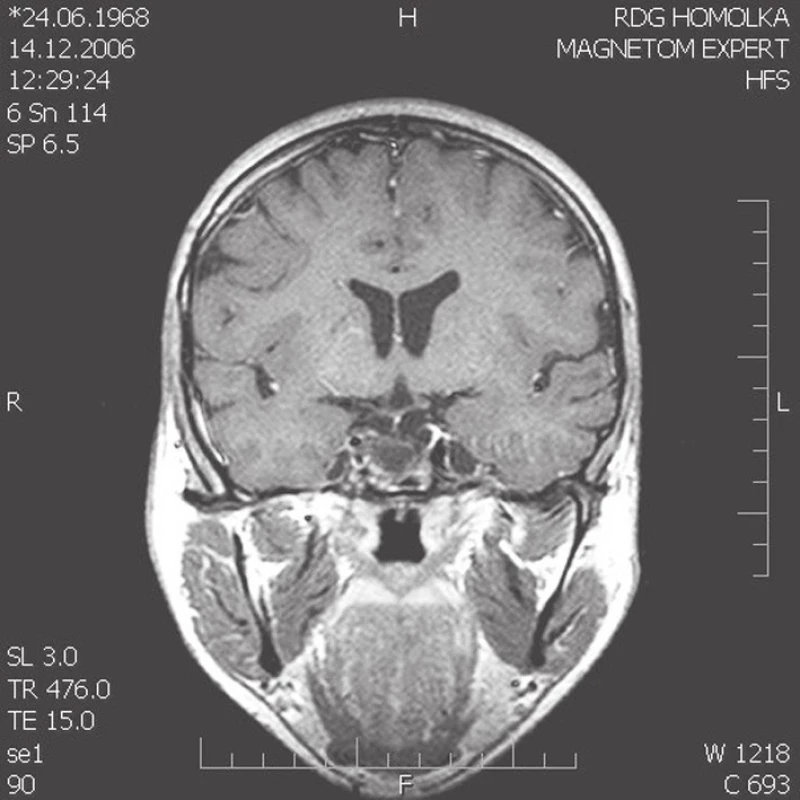
Stereotaktická biopsie
U jedné pacientky jsme k histologické verifikaci nádoru použili stereotaktickou biopsii a diagnostikovali kraniofaryngeom. Následovala léčba cystické komponenty brachyterapií yttriem90 a po regresi cysty pacientka mohla podstoupit radiochirurgickou léčbu.
Diskuze
Léčba kraniofaryngeomů může být svízelná a vyžádat si kombinaci několika léčebných metod. Při léčbě se může uplatnit mikrochirurgická resekce nádoru, frakcionovaná radioterapie, u cystické komponenty tumoru intrakavitární brachyterapie či aspirace cysty, u solidní části tumoru radiochirurgická léčba gama nožem. Léčebný algoritmus je u každého pacienta individuální, schéma, které je blízké i našim doporučením, publikoval Lunsford (schéma1) [12].
Schéma 1. Algoritmus léčby kraniofaryngeomů [12]. ![Schéma 1. Algoritmus léčby kraniofaryngeomů [12].](https://pl-master.mdcdn.cz/media/image/315090787128236d3024241c5c0ae55c.jpg?version=1537793357)
První léčebnou strategií je mikroneurochirurgická resekce. Velké sestavy uvádějí 10leté přežití u 64–96 % pacientů [13–15]. Nejdůležitějším faktorem ovlivňujícím recidivu je rozsah resekce. Pacienti po parciální resekci mají podstatně vyšší riziko recidivy [15,16]. Dalším nepříznivým faktorem je velikost nádoru nad 5 cm [15]. I přes veškerý rozvoj mikroneurochirurgické techniky během posledních let [17–23] snaha o maximální radikalitu u tohoto benigního tumoru může být spojena s těžko akceptovatelnou morbiditou a kraniofaryngeomy zůstávají tumory se zrádným klinickým pooperačním průběhem s velkým rizikem dlouhodobé endokrinologické dependence, vzniku kognitivních dysfunkcí, sníženého intelektu a neurobehaviorálních poruch [24].
Druhou variantou je plánovaná subtotální resekce s následnou zevní frakcionovanou radioterapií k minimalizaci růstové progrese pooperačního rezidua. Radioterapie selární oblasti však v dlouhodobém sledování může mít negativní efekt na endokrinní funkce či optické struktury [25]. Byly popsány i radiací indukované tumory [26]. Po radioterapii může vzácně dojít k maligní transformaci zbytkového adamantinomu do skvamózního karcinomu [27]. I když názor na užitečnost pooperační radioterapie není jednoznačný, někteří autoři zevní frakcionovanou radioterapii po parciální resekci kraniofaryngeomu doporučují [14]. U dětí do 15 let se běžně doporučuje minimální celková dávka do 45 Gy po 1,8 Gy na frakci, u starších nemocných je možné aplikovat s ohledem na toleranci okolních struktur dávky vyšší, standardem je aplikace 50–54 Gy po 1,8–2 Gy na frakci. Někteří autoři publikovali celkově vyšší fyzikální dávku, výrazně však snížili dávku na frakci. Flickinger et al v roce 1990 doporučili k dosažení efektivní lokální kontroly při minimu vedlejších komplikací u kraniofaryngeomů aplikovat zevní frakcionovanou radioterapii po 1,8 Gy na frakci [28], Varlotto et al v roce 2002 doporučili k dosažení šetřícího efektu pro pozdně reagující tkáně (tj. zejména pro optické struktury) snížit dávku na frakci na 1,6–1,7 Gy [29]. U pacientů s kraniofaryngeomem by externí frakcionovaná radioterapie neměla být primární léčebnou strategií [24]. Výše uvedené negativní efekty externí frakcionované radioterapie může redukovat frakcionovaná stereotaktická radioterapie (provádí se především lineárními urychlovači), která je důležitá zejména u dětí [24].
Třetí možností pro léčbu pacientů s kraniofaryngeomem je stereotaktická minimálně invazivní léčba. K stereotaktické léčbě cystických komponent tumoru se používá intrakavitární brachyterapie či evakuační stereoaspirace tekutého obsahu kraniofanygeomových cyst. K léčbě solidních nádorových částí stereotaktická radiochirurgie gama nožem. Je‑li nádor rozsáhlý a radikálně neodstranitelný, věnujeme pozornost jeho cystickým porcím. Narostou‑li do symptomatických rozměrů, lze je stereotakticky atakovat [1]. Intrakavitární brachyterapie byla uvedena Leksellem et al v roce 1951 [30]. Wycis et al [31] prezentovali první zkušenosti s touto léčbou v USA v roce 1954. U cystických kraniofaryngeomů jak s jednou cystou, tak multicystických, kde cystická složka nádoru tvoří často větší objem než jeho solidní část, je výhodné léčbu začít stereotaktickou brachyterapií [32,33]. V USA se k intrakavitární brachyterapii nejčastěji užívá izotop fosfor32 a první zkušenosti pittsburského týmu s touto léčbou u kraniofaryngiomů v roce 1995 uvedli Pollock et al [33]. V Evropě se nejčastěji používá izotop yttrium90 [34]. S intrakavitární brachyterapií kraniofaryngeomů jsou tedy dnes k dispozici již dlouhodobé výsledky. Prasad et al [35] porovnali výsledky 17 autorů z různých světových neurochirurgických center a zjistili, že v dlouhodobém sledování je úspěšnost v redukci cystické komponenty tumoru cca 80%. Podobný efekt, jako má aplikace radioaktivního izotopu, může mít intrakavitární aplikace cytostatika bleomycinu. S touto léčbou jsou však prozatím malé zkušenosti [36,37], a protože bylo popsáno, že aplikace bleomycinu mohla mít za následek těžkou morbiditu [37], naše pracoviště od této metody ustoupilo. Lundsford et al [24] nedoporučují kombinovat zevní frakcionovanou radioterapii a intrakavitární brachyterapii z důvodu vyššího rizika poškození zrakových funkcí. Stereotaktickou aspirací začínáme léčbu u pacientů s cystickým kraniofaryngeomem se supraselárním šířením tumoru zespoda komprimujícím optické chiazma a z toho klinicky rezultující poruchou perimetru či vizu. Pokud se podaří vrchlík tumorózní cysty oddálit od zkřížení optických nervů a velikost solidní složky nádoru splňuje kritéria indikace k ozáření gama nožem, ihned můžeme navázat léčbou radiochirurgickou. Dochází‑li i po opakované stereoaspiraci k doplňování tekutého obsahu cysty, někteří autoři doporučují tumorózní cystu drénovat do podkožního Rickamova či Ommaya rezervoáru [38]. Dle zkušeností pittsburského pracoviště však periodické aspirace přes tento rezervoár spíše stimulovaly aktivitu sekrečních tumorózních buněk, což vedlo k frekventnější potřebě aspirací [24]. Podobnou zkušenost jsme u jednoho pacienta zaznamenali i my.
Cílené ozáření gama nožem zejména díky možnosti aplikovat maximum záření selektivně do objemu tumoru představuje u radiosenzitivních kraniofaryngeomů velmi efektivní radioterapeutickou metodu. Lunsford et al v roce 1994 udávají, že radiochirurgie by měla být rezervována pro relativně malé solidní komponenty kraniofaryngeomu, ne více než 20 mm v nejdelším měřitelném rozměru s dostatečnou (alespoň 3–5 mm) vzdáleností od optických struktur [24]. Moderní verze Leksellova gama nože 4C s AP (Automatic Position) systémem, kterou dnes naše oddělení disponuje, posunuje indikační kritéria a umožňuje nám indikovat k radiochirurgické léčbě kraniofaryngeomy vzdálené i 1 mm od zkřížení optických nervů. První zkušenosti pittsburského týmu s radiochirurgickou léčbou u těchto nádorů v roce 1994 uvedli Lundsford et al [24] a v roce 2001 Chiou et al zhodnotili výsledky téhož pracoviště. V tomto souboru bylo dosaženo redukce ozářeného objemu u 7 z 12 kraniofaryngeomů (medián okrajové dávky 16 Gy) u pacientů s dobou sledování 63 měsíců [39].
Závěr
Při porovnání s výsledky jiných světových pracovišť [24,35,39] náš početně srovnatelný soubor radiochirurgicky léčených nemocných s kraniofaryngeomem dosahuje velmi podobných klinických závěrů. Přestože se nám nepodařilo ve všech případech zabránit nádorové recidivě, radiochirurgie se v dlouhodobém sledování jeví jako hodnotná a efektivní léčba. Podmínkou jsou však pravidelné poradiační zobrazovací i klinické kontroly nemocného, které mohou zajistit potřebu případného doplňujícího léčebného postupu. V případě, že si klinický průběh nemocného nevyžádá častější sledování, poradiační zobrazovací kontroly pacientů s kraniofaryngeomem provádíme v časových intervalech dva, pět a deset let po fokálním ozáření. I z našeho hlediska můžeme dle dosavadních zkušeností s léčbou těchto nádorů konstatovat, že stereotaktické léčebné metody mohou být dosaženou kontrolou nádorového růstu v dlouhodobém sledování velmi vhodnou adjuvantní pooperační léčbou, a to zejména u pacientů s menším nádorem dostatečně vzdáleným od zrakové dráhy.
MUDr. Tomáš Chytka
Oddělení stereotaktické a radiační neurochirurgie
Nemocnice Na Homolce
Roentgenova 2
150 30 Praha 5
e‑mail: tomas.chytka@homolka.cz
Přijato k recenzi: 28. 5. 2007
Přijato do tisku: 15. 7. 2008
Zdroje
1. Náhlovský J. Neurochirurgie. Praha: Galén 2006 : 167–168.
2. Osborn AG. Diagnostic neuroradiology. St Louis: Mosby 1994 : 654–657.
3. Kleihues P, Burger PC, Scheithauer W et al (eds). Histological typing of tumours of the central nervous system. Berlin: Springer-Verlag 1971 : 49–50.
4. Adamson TE, Wiestler OD, Kleihues P, Yaşargil MG. Correlation of clinical and pathological features in surgically treated craniopharyngiomas. J Neurosurg 1990, 73(1): 12–17.
5. Bunin GR, Surawicz TS, Witman PA, Preston-Martin S, Davis F, Bruner JM. The descriptive epidemiology of craniopharyngioma. J Neurosurg 1998; 89(4): 547–551.
6. Kozler P et al. Intrakraniální nádory. Praha: Galén 2007 : 183–185.
7. Thapar K, Kovacz K. Neoplasms of the sellar region. In Bigner DD, McLendon RE, Bruner JM (eds). Russel & Rubistein‘s pathology of tumours of the Nervous system. 6th ed. London: Arnold 1998 : 561–567.
8. Harwood-Nash DC. Neuroimaging of childhood craniopharyngioma. Pediatr Neurosurg 1994 : 21 (Suppl 1): 2–10.
9. Vladyka V, Šubrt O, Liščák R. Radiochirurgie s užitím gama nože. Rozhl Chir 1994; 73 : 348–355.
10. Liščák R, Vladyka V, Šubrt O. Leksellův Gama nůž: radiochirurgický nástroj. Čas Lék čes 1998; 137 : 154–157.
11. Liščák R, Vladyka V, Šubrt O, Novotný J, Masopust J, Šup I. Stereotaktická brachyterapie cystického kraniofaryngeomu pomocí izotopu Yttria90. Cesk Slov Neurol N 1997; 60/93(4): 196–202.
12. Lunsford LD. Stereotactic treatment of craniofaryngioma. Intracavitary irradiation and radiosurgery. Cont Neurosurg 1989; 11(2): 1–6.
13. Rajan B, Ashley S, Gorman C, Jose CC, Horwich A, Bloom HJ, Marsh H et al. Craniopharyngioma – a long‑term results following limited surgery and radiotherapy. Radiother Oncol 1993; 26 : 1–10.
14. Crotty TB, Scheithauer BW, Young WF jr, Davis DH, Schaw EG, Miller GM et al. Papillary craniopharyngioma: a clinicopathological study of 48 cases. J Neurosurg 1995; 83(2): 206–214.
15. Yaşargil MG, Curcic M, Kis M, Siegenthaler G, Teddy PJ, Roth P. Total removal of craniopharyngiomas. Approaches and long‑term results in 144 patients. J Neurosurg 1990; 73(1): 3–11.
16. Weiner HL, Wisoff JH, Rosenberg ME, Kupersmith MJ, Cohen H, Zagzag D et al. Craniopharyngiomas: a clinocopathological analysis of factors predictive of recurrence and functional outcome. Neurosurgery 1994; 35(6): 1001–1010.
17. Baskin DS, Wilson CB. Surgical management of craniopharyngioma. A review of 74 cases. J Neurosurg 1986; 65(1): 227–237.
18. Hoffman HJ, De Silva M, Humphreys RP, Drake JM, Smith ML, Blazer S. Aggresive surgical management of craniopharyngiomas in children. J Neurosurg 1992; 76(1): 47–52.
19. Laws ER jr. Transsphenoidal microsurgery in the management of craniopharyngioma. J Neurosurg 1980; 52(5): 661–666.
20. Regine WF, Kramer S. Pediatric craniopharyngiomas: long term results of combined treatment with surgery and radiation. Int J Radiat Oncol Biol Phys 1992; 24(4): 611–617.
21. Symon L, Sprich W. Radical excision of craniopharyngioma. Results in 20 patients. J Neurosurg 1985; 62(2): 174–181.
22. Trippi AQC, Garner JT, Kassabian JT, Hunter Shelden C. A new approach to inoperable craniopharyngioma. Am J Surg 1969; 118(2): 307–310.
23. Steno J, Malacek M, Bizik I. Tumor-third ventricular relationship in supradiaphragmatic Craniopharyngiomas: correlation of morphological, magnetic resonance imaging, and operative findings. Neurosurgery 2004; 54(5): 1051–1060.
24. Lunsford LD, Pollock BE, Kondziolka DS, Levine G, Flickinger JC. Stereotactic options in the management of craniopharyngioma. Pediatr Neurosurg 1994; 21 (Suppl 1): 90–97.
25. Harris JR, Levene MB. Visual complications following iradiation for pituitary adenomas and craniopharyngiomas. Radiology 1976; 120(1): 167–171.
26. Tsang RW, Laperriere NJ, Simpson WJ, Brierly J, Panzarella T, Smyth HS. Glioma arising after radiation therapy for pituitary adenoma. A report of four patients and estimation of risk. Cancer 1993; 72(7): 2227–2233.
27. Kristopaitis T, Thomas C, Petruzzelli GJ, Lee JM. Malignant craniopharyngioma. Arch Pathol Lab Med 2000; 124(9): 1356–1360.
28. Flickinger JC, Lunsford LD, Singer J, Cano E, Deutsch M. Megavoltage external beam irradiation of craniopharyngiomas: analysis of tumor control and morbidity. Int J Radiat Oncol Biol Phys 1990; 19(1): 117–122.
29. Varlotto JM, Flickinger JC, Kondziolka D, Lunford LD, Deutsch M. External beam irradiation of craniofaryngiomas: long‑term analysis of tumor control and morbidity. Int J Radiat Oncol Biol Phys 2002; 54(2): 492–499.
30. Leksell L, Backlund EO, Johansson L. Treatment of craniopharyngioma. Acta Chir Scand 1967; 133(5): 345–350.
31. Wycis HT, Robbins R, Spiegel-Adolf M, Meszaros J, Spiegel EA. Studies in stereoencephalotomy. III; treatment of cystic craniopharyngioma by injection of radioactive P 32. Confin Neurol 1954; 14(4): 193–202.
32. Backlund EO. Colloidal radioisotopes as part of multi‑modality treatment of craniopharyngiomas. J Neurosurg Sci 1989; 33(1): 95–97.
33. Pollack IF, Lunsford LD, Slamovits TL, Gumerman LW, Levine G, Robonson AG. Stereotaxic intracavitary irradiation for cystic craniopharyngiomas. J Neurosurg 1988; 68(2) 227–233.
34. Voges J, Sturm V, Lehrke R, TreuerH, Gauss C, Berthold F. Cystic craniopha-ryngioma: long‑term results after intracavitarry irradiation with steretactically applied collodial beta‑emitting radiactive sources. Neurosurgery 1997; 40(2): 263–268.
35. Prasad D, Steiner M. Gamma knife surgery for craniopharyngioma. Acta Neurochir (Wien) 1995; 134(3–4): 167–176.
36. Cavalheiro S, Sparapani FV, Franco JO, da Silva MC, Braga FM. Use of bleomycin in intratumoral chemotherapy for cystic craniopharyngioma. J Neurosurg 1996; 84(1): 124–126.
37. Broggi G, Giorgi C, Franzini A, Servello D, Solero CL. Preliminary results of intracavitary treatment of craniopharyngioma with bleomycin. J Neurosurg Sci 1989; 33(1): 145–148.
38. Gutin PH, Klemme WM, Lagger RL, MacKay AR, Pitts LH, Hojobuchi Y. Managenet of unresectable cystic craniopharyngioma by aspiration through an Ommaya reservoar drainage system. J Neurosurg 1980; 52(1): 36–40.
39. Chiou SM, Lunsford LD, Niranjan A, Kondziolka D, Flickinger JC. Stereotactic radiosurgery of residual or recurrent craniopharyngioma, after surgery, with or without radiation therapy. Neuro Oncol 2001; 3(3): 159–166.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2008 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Neurologické poruchy v rámci kritického stavu
- Matrixové metaloproteinázy v patogenezi roztroušené sklerózy
- Současná diagnostika a léčba oligodendrogliomů
- Význam monitorování mozkové aktivity pomocí integrované amplitudy EEG aktivity u novorozenců s časným asfyktickým syndromem
- Pravo/levorukost a preference druhostranné dolní končetiny. Testování laterality a mozečkové dominance
- Traumatické poranění mozku a zlomeniny obličejového skeletu
- Radiochirurgická léčba kraniofaryngeomů v kombinaci s ostatními stereotaktickými metodami
- Kombinované poranění atlasu a čepovce
- Míšní metastáza adenokarcinomu – kazuistika
- Neurosarkoidóza: zriedkavý prípad sarkoidózy krčnej miechy – kazuistika
-
Komentář k práci Mraček J. Intradurální výhřez bederní meziobratlové ploténky manifestující se syndromem kaudy – kazuistika
Věčné téma: výhřez meziobratlové ploténky, tentokrát intradurální - Intradurální výhřez bederní meziobratlové ploténky manifestující se syndromem kaudy – kazuistika
- Mozková gliomatóza – kazuistika
- Webové okénko
-
Analýza dat v neurologii XI.
Úvod do statistického usuzování – velikost účinku - Recenze
- Ne uromuskulární kongres v Brně
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Intradurální výhřez bederní meziobratlové ploténky manifestující se syndromem kaudy – kazuistika
- Současná diagnostika a léčba oligodendrogliomů
- Neurologické poruchy v rámci kritického stavu
- Neurosarkoidóza: zriedkavý prípad sarkoidózy krčnej miechy – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání








