-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBiosimilární léčba v dětské gastroenterologii – současný pohled
Biosimilar treatment in paediatric gastroenterology – current view
Biosimilar drugs (BSD) have been used in the field of gastroenterology since 2013, when the European Medicines Agency approved biosimilar infliximab for the treatment of inflammatory bowel disease (IBD). The view of these drugs has changed significantly in the course of their use. At first, BSDs were used with hesitation, mainly due to the lack of published data on their efficacy and safety and also due to the lack of clinical experience. Over the following years, a number of studies were published that gradually support their importance in the treatment of IBD, and BSDs are now routinely administered to patients naïve to biological treatment, and a number of centres perform switches from the original treatment to a BSD. In paediatrics, a more reserved attitude towards their clinical use persisted for a long time, but with the growing amount of published data, they are also common in clinical practice. This summary article describes the development in the approach of both international and domestic professional societies and physicians-clinicians to the use of BSL and provides references to newly published studies of biosimilar drugs.
Keywords:
paediatrics – Extrapolation – biological treatment – biosimilar drugs – European Medicines Agency – switch
Autoři: Bronský J.
Působiště autorů: Pediatrická klinika 2. LF UK a FN v Motole, Praha
Vyšlo v časopise: Gastroent Hepatol 2022; 76(1): 42-45
Kategorie: IBD: přehledový článek
doi: https://doi.org/10.48095/ccgh202242Souhrn
Biosimilární léčiva (BSL) jsou v oboru gastroenterologie používána od roku 2013, kdy byl schválen Evropskou lékovou agenturou biosimilární infliximab pro léčbu idiopatických střevních onemocnění (IBD). Pohled na tato léčiva se v průběhu jejich používání významně změnil. Nejprve byla BSL používána s velkými rozpaky, zejména z důvodu nedostatku publikovaných údajů o jejich efektivitě a bezpečnosti a také z důvodu nedostatku klinické zkušenosti. V průběhu následujících let byla publikována řada studií, které postupně podporují jejich místo v léčbě IBD a v současné době jsou již BSL běžně podávána pacientům naivním k biologické léčbě a v řadě center je prováděn i tzv. switch z originálního přípravku na BSL. V pediatrii dlouhou dobu přetrvával rezervovanější postoj k jejich klinickému použití, ale s narůstajícím množstvím publikovaných dat se také v pediatrii běžně dostávají do klinické praxe. Tento souhrnný článek popisuje vývoj přístupu jak mezinárodních, tak tuzemských odborných společností i lékařů-kliniků k používání BSL a uvádí odkazy na nově publikované studie biosimilárních léčivých přípravků.
Klíčová slova:
biologická léčba – pediatrie – biosimilární léčiva – evropská léková agentura – switch – extrapolace
Úvodem
Biosimilární léčiva (BSL) používaná v oboru gastroenterologie jsou komplexní proteinové molekuly, které jsou vyrobeny pomocí biotechnologií nebo z přírodních zdrojů a které jsou prokazatelně „dostatečně podobné“ (sufficiently similar) biologickému léku, který byl schválen regulační agenturou. V medicíně jsou BSL obecně používána již velmi dlouhou dobu. Mnoho let před jejich příchodem do gastroenterologie měli s BSL zkušenosti lékaři jiných odborností. Jednalo se např. o biosimilární erytropoetin, genotropin, filgrastin či inzulin [1].
Příchod BSL do gastroenterologické praxe
Prvním BSL schváleným pro léčbu idiopatických střevních onemocnění (IBD) byl v roce 2013 infliximab (IFX). V době jeho schválení Evropskou lékovou agenturou (EMA) vyvolal příchod BSL na trh řadu kontroverzí a vášnivých diskuzí. Zpočátku panovala mezi lékařskou veřejností obava, zda budou BSL stejně účinná a bezpečná jako originální léčivé přípravky. Mezi odbornými společnostmi probíhaly diskuze na tato témata a byla také publikována řada více či méně rezervovaných odborných stanovisek [2–8]. Mezi kontroverzní body patřily otázky, zda lze extrapolovat data mezi různými klinickými indikacemi a věkovými skupinami, zda přechod na BSL uskutečňovat paušálně u všech pacientů nově indikovaných na biologickou léčbu (BL) či jen u selektované skupiny pacientů – a na základě jakých kritérií. Diskutována byla zodpovědnost a role ošetřujícího lékaře při výběru léčby i ekonomické aspekty a role managementu jednotlivých zdravotnických zařízení. Velkou otázkou bylo, zda kromě pacientů naivních k BL zvažovat BSL také u již léčených pacientů (tedy zda je vhodný a možný případný „switch“), řešila se otázka zaměnitelnosti jednotlivých BSL (interchangeability). Otázkou bylo, zda a jakým způsobem informovat pacienta, že bude dostávat BSL, a jak prospektivně a systematicky monitorovat účinnost a případné nežádoucí účinky léčby. V ČR byla tato témata o to naléhavější, že jsme se stali (z důvodu ukončení platnosti patentu originálního IFX) jednou z prvních zemí, kde byla BSL zaváděna (spolu se Slovenskem, Polskem, Maďarskem a dalšími).
Pohled na BSL v pediatrii
S postupem klinické praxe již dnes považujeme řadu výše uvedených otázek za vyřešenou. Přispělo k tomu velké množství dat, která se za poslední desetiletí během používání BSL v gastroenterologii podařilo shromáždit. Pediatrická praxe zůstávala a možná stále zůstává k některým výše uvedeným aspektům konzervativnější než gastroenterologie dospělých, ale i v pediatrii došlo od zavedení BSL k významnému názorovému posunu. Důvodem pro větší opatrnost byly pochyby o přenositelnosti poznatků ze studií na dospělých pacientech do pediatrie a také obavy z možného selhání léčby s nejistotou dalšího postupu vzhledem k omezenému množství BL schválených v pediatrické indikaci. Důraz byl kladen především na bezpečnost dětského pacienta a nutnost ponechání rozhodnutí o léčbě v rukou ošetřujícího lékaře s omezeným důrazem na ekonomické aspekty léčby. Svou roli hrálo i určité právní vakuum v oblasti zavádění BSL do léčebného schématu v ČR. Naopak pro včasné zavedení BSL do běžné klinické praxe svědčilo předpokládané významné snížení finančních nákladů BL s možností nabídnout terapii většímu množství pacientů, podpořené historickou zkušeností z jiných oborů.
První stanoviska odborných společností
První stanovisko mezinárodní odborné společnosti (ECCO – European Crohn’s and Colitis Organisation) z roku 2013 bylo k paušálnímu použití BSL rezervované, zdůrazňovalo nutnost posuzování účinnosti a bezpečnosti BSL v oblasti IBD a nevhodnost provádění paušálního switche z ekonomických důvodů [4]. Pediatrické stanovisko Porto IBD working group Evropské společnosti pro dětskou gastroenterologii, hepatologii a výživu (ESPGHAN) k BSL bylo vydáno v roce 2015 [2]. Závěrem tohoto stanoviska expertů se uvádí, že se vstupem BSL na trh lze očekávat snížení ceny léčby i pro dětské pacienty, ale při extrapolaci dat od dospělých pacientů s revmatoidní artritidou je třeba opatrnosti. Do budoucna bylo doporučeno zavést postmarketingové sledování efektivity, bezpečnosti a imunogenicity BSL. Switch u dětí nebyl podporován [2].
Doporučené postupy v ČR a vývoj mezinárodních doporučení
Problematice BSL se v ČR věnovala klinická doporučení jak pro léčbu dospělých pacientů s IBD [6,7], tak dětských pacientů [8]. Doporučení pro dospělé pacienty uvádí, že: „Dostupné informace v současné době potvrzují shodnou efektivitu a bezpečnost BSL a originálního IFX a rozhodnutí o typu použitého léčiva by mělo být v kompetenci ošetřujícího lékaře,“ [6,7]. Pediatrická doporučení z téhož období jsou konzervativnější a uvádějí, že: „BSL lze v pediatrii použít v indikacích schválených EMA a Státním ústavem pro kontrolu léčiv (SÚKL). Preferováno je použití u pacientů naivních k BL. Switch u pacienta, který je v remisi na originální BL, se nedoporučuje. Důležitý je důsledný monitoring a hlášení nežádoucích účinků BSL. O zahájení terapie BSL rozhoduje ošetřující lékař,“ [8]. Toto stanovisko bylo v souladu s výše citovaným stanoviskem ESPGHAN [2].
Stanovisko ESPGHAN bylo v roce 2019 renovováno na základě nových dat o efektivitě a bezpečnosti BSL [3]. Nově se uvádí, že switch originálního IFX na BSL může být zvážen u dětí s IBD v klinické remisi, nejdříve však po podání alespoň tří indukčních dávek. Mnohonásobné switche (mezi originálním léčivem a BSL nebo mezi více BSL) nejsou podporovány [3]. Také stanovisko ECCO pro dospělé pacienty doznalo změn a nově uvádí, že switch z originálního léčiva na BSL je akceptovatelný. Rezervovaný postoj zůstává k tzv. reverznímu switchi a mnohočetným switchům. Předpokladem pro switch je předchozí podrobná diskuze mezi lékařem a pacientem – dle lokálních doporučení [5].
Nová data z oblasti BSL
V odborné literatuře lze dnes najít řadu vědeckých publikací k tématu BSL – v gastroenterologii obecně se jedná o stovky prací, z toho bezmála 50 je věnováno dětské populaci. Také narůstá množství publikací, jejichž primárním cílem není posouzení efektivity či bezpečnosti BSL v konkrétní klinické situaci [9–33], ale BSL jsou zde používána jako léčiva v rámci obecné klinické studie týkající se BL, a to obvykle z důvodu jejich dobré dostupnosti a příznivé ceny v konkrétním centru. Jedná se např. o porovnání subkutánního a intravenózního IFX (CT-P13) v udržovací léčbě [34] nebo o porovnání step-up a top-down přístupu v použití BL u dětí [35].
Nedávno vydané review italských autorů shrnuje dosavadní poznatky o použití BSL IFX v pediatrii [36]. Bylo nalezeno osm publikací, z nichž čtyři (tři prospektivní a jedna retrospektivní) hodnotily účinnost BSL IFX v indukční fázi. Klinická odpověď BSL dosahuje 86–90 % a remise 67–68 % a je srovnatelná s originálním léčivem. Obdobné výsledky byly publikovány ve čtyřech prospektivních studiích zaměřených na pacienty, u nichž byl proveden switch z originálního IFX na BSL. Nejčastěji popisovanými nežádoucími účinky BSL byly mírné infekty horních cest dýchacích a BSL se zdá stejně bezpečný jako referenční léčivo. Imunogenicita nebyla switchem významně ovlivněna [36].
Současný stav schvalování BSL
Ke konci roku 2021 bylo evidováno celkem 33 BSL k 11 referenčním produktům schváleným americkým Úřadem pro kontrolu léčiv (FDA – Food and Drug Administration) [1], z toho 11 BSL je z oblasti léčby IBD (7x adalimumab – ADA, 4x IFX). V procesu schvalování je však řádově větší množství produktů [37]. V současné době je v ČR v oboru gastroenterologie k dispozici několik BSL vycházejících jak z molekuly ADA, tak IFX (tab. 1). Obvyklá doba od podání žádosti do schválení produktu FDA je 12 měsíců. V roce 2021 byl však FDA schválen pouze jeden nový BSL v oblasti IBD (Yusimry – ADA). Důvodem zpomalení procesu příchodu nových BSL na trh může být současná pandemie covidu-19. Současný farmaceutický výzkum je také významně zaměřen na průkaz efektivity a bezpečnosti opakovaných switchů a zaměnitelnosti (interchangeability). Předpokládané snížení nákladů na léčbu udávané výrobci je 15–57 % v závislosti na referenčním produktu. Nižší cena je důvodem postupně vzrůstajícího podílu BSL na trhu BL. V případě BSL IFX se v USA jednalo o více než 25% podíl na trhu ke konci druhého čtvrtletí 2021 [1]. Podle dotazníkové studie mezi dětskými IBD centry v Evropě a v USA mělo s použitím BSL zkušenosti cca 40 % pracovišť [38]. Recentní italská studie uvádí zkušenost s BSL u 20 z 26 dětských IBD center včetně bohaté zkušenosti se switchem v udržovací fázi léčby [39].
Tab. 1. Seznam biosimilárních léčiv v oboru gastroenterologie (řazeno abecedně, zdroj: AISLP).
Tab. 1. List of biosimilar drugs in the field of gastroenterology (in alphabetical order, source: AISLP).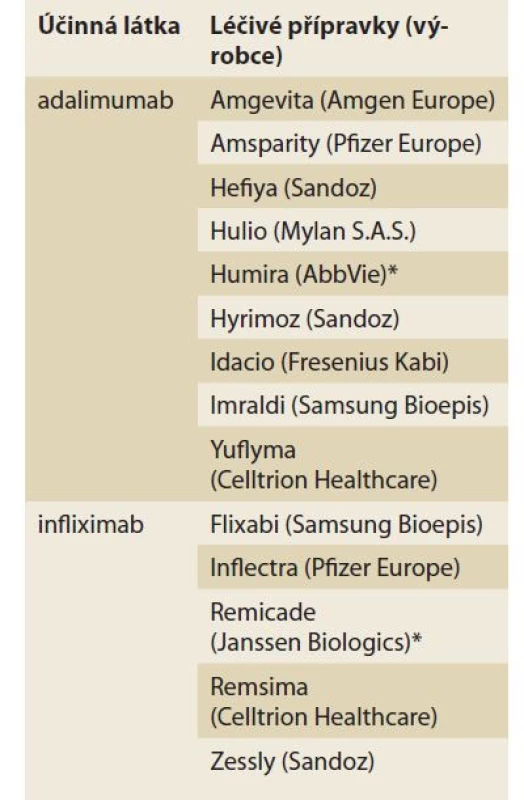
* originální (referenční) přípravek Závěrem
Závěrem lze říci, že od roku 2013, kdy byl schválen první BSL v oblasti gastroenterologie, doznala celá tato oblast významných změn a od počátečního ostýchavého postoje odborné veřejnosti jsme se postupně dostali do situace, kdy je použití BSL zcela běžnou součástí klinické praxe. Dostupná data o efektivitě a bezpečnosti BSL umožňují nasazení BSL u pacienta naivního k biologické léčbě a v řadě zdravotnických zařízení je běžně prováděn switch mezi jednotlivými preparáty. V oblasti dětské gastroenterologie stále převládá rezervovanější přístup, kdy v některých centrech jsou BSL používána u pacientů naivních k BL, ale switch u dětských IBD pacientů v klinické remisi je stále předmětem odborných diskuzí. Je pravděpodobné, že s příchodem nových dat z klinických studií a větších zkušeností s BSL u pediatrických pacientů dojde ke změně stanovisek odborných společností a následně i ke změně klinické praxe ve smyslu širšího použití BSL i v dětské gastroenterologii.
ORCID autora
J. Bronský ORCID 0000-0002-2641-7280.
Doručeno/Submitted: 20. 1. 2022
Přijato/Accepted: 24. 1. 2022
prof. MUDr. Jiří Bronský, Ph.D.
Oddělení dětské gastroenterologie
Pediatrická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
Tento článek vznikl s podporou společnosti Sandoz.
Zdroje
1. Biosimilars 2021 Year in Review [online]. Available from: https: //www.fr.com/biosimilars - 2021-year-in-review/.
2. de Ridder L, Waterman M, Turner D et al. Use of biosimilars in paediatric inflammatory bowel disease: a position statement of the ESPGHAN paediatric IBD porto group. J Pediatr Gastroenterol Nutr 2015; 61 (4): 503–508. doi: 10.1097/MPG.0000000000000903.
3. de Ridder L, Assa A, Bronsky J et al. Use of biosimilars in pediatric inflammatory bowel disease: an updated position statement of the pediatric IBD porto group of ESPGHAN. J Pediatr Gastroenterol Nutr 2019; 68 (1): 144–153. doi: 10.1097/MPG.0000000000002141.
4. Danese S, Gomollon F. Governing board and operational board of ECCO. ECCO position statement: the use of biosimilar medicines in the treatment of inflammatory bowel disease (IBD). J Crohns Colitis 2013; 7 (7): 586–589. doi: 10.1016/j.crohns.2013.03.011.
5. Danese S, Fiorino G, Raine T et al. ECCO position statement on the use of biosimilars for inflammatory bowel disease – an update. J Crohns Colitis 2017; 11 (1): 26–34. doi: 10.1093/ecco-jcc/jjw198.
6. Bortlík M, Ďuricová D, Kohout P et al. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: třetí, aktualizované vydání. Gastroent Hepatol 2016; 70 (1): 11–27. doi: 10.14735/amgh201611.
7. Bortlík M, Ďuricová D, Douda T et al. Doporučení pro podávání biologické léčby pacientům s idiopatickými střevními záněty: čtvrté, aktualizované vydání. Gastroent Hepatol 2019; 73 (1): 11–24. doi: 10.14735/amgh201911.
8. Bronský J, Beránková K, Černá Z et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí – doplněk k 1. vydání. Gastroent Hepatol 2017; 71 (1): 11–18. doi: 10.14735/amgh201711.
9. Haifer C, Srinivasan A, An YK et al. Switching Australian patients with moderate to severe inflammatory bowel disease from originator to biosimilar infliximab: a multicentre, parallel cohort study. Med J Aust 2021; 214 (3): 128–133. doi: 10.5694/mja2.50824.
10. Martínez-Feito A, Bravo-Gallego LY, Hernández-Breijo B et al. Infliximab concentrations in two non-switching cohorts of patients with inflammatory bowel disease: originator vs. biosimilar. Sci Rep 2020; 10 (1): 17099. doi: 10.1038/s41598-020-74235-1.
11. Nikkonen A, Kolho KL. Infliximab and its biosimilar produced similar first-year therapy outcomes in patients with inflammatory bowel disease. Acta Paediatr 2020; 109 (4): 836–841. doi: 10.1111/apa.15026.
12. Kamat N, Kedia S, Ghoshal UC et al. Effectiveness and safety of adalimumab biosimilar in inflammatory bowel disease: a multicenter study. Indian J Gastroenterol 2019; 38 (1): 44–54. doi: 10.1007/s12664-018-0922-1.
13. van Hoeve K, Dreesen E, Hoffman I et al. Efficacy, pharmacokinetics, and immunogenicity is not affected by switching from infliximab originator to a biosimilar in pediatric patients with inflammatory bowel disease. Ther Drug Monit 2019; 41 (3): 317–324. doi: 10.1097/FTD.0000000000000601.
14. Bálint A, Rutka M, Kolar M et al. Infliximab biosimilar CT-P13 therapy is effective in maintaining endoscopic remission in ulcerative colitis – results from multicenter observational cohort. Expert Opin Biol Ther 2018; 18 (11): 1181–1187. doi: 10.1080/14712598.2018.1530758.
15. Armuzzi A, Fiorino G, Variola A et al. The PROSIT cohort of infliximab biosimilar in IBD: a prolonged follow-up on the effectiveness and safety across Italy. Inflamm Bowel Dis 2019; 25 (3): 568–579. doi: 10.1093/ibd/izy264.
16. Gervais L, McLean LL, Wilson ML et al. Switching from originator to biosimilar infliximab in paediatric inflammatory bowel disease is feasible and uneventful. J Pediatr Gastroenterol Nutr 2018; 67 (6): 745–748. doi: 10.1097/MPG.0000000000002091.
17. Smits LJT, van Esch AAJ, Derikx LAAP et al. Drug survival and immunogenicity after switching from remicade to biosimilar CT-P13 in inflammatory bowel disease patients: two-year follow-up of a prospective observational cohort study. Inflamm Bowel Dis 2019; 25 (1): 172–179. doi: 10.1093/ibd/izy227.
18. Høivik ML, Buer LCT, Cvancarova M et al. Switching from originator to biosimilar infliximab – real world data of a prospective 18 months follow-up of a single-centre IBD population. Scand J Gastroenterol 2018; 53 (6): 692–699. doi: 10.1080/00365521.2018.1463391.
19. Chanchlani N, Mortier K, Williams LJ et al. Use of infliximab biosimilar versus originator in a pediatric United Kingdom inflammatory bowel disease induction cohort. J Pediatr Gastroenterol Nutr 2018; 67 (4): 513–519. doi: 10.1097/MPG.0000000000002011.
20. Binkhorst L, Sobels A, Stuyt R et al. Short article: switching to a infliximab biosimilar: short-term results of clinical monitoring in patients with inflammatory bowel disease. Eur J Gastroenterol Hepatol 2018; 30 (7): 699–703. doi: 10.1097/MEG.0000000000001113.
21. Kang B, Lee Y, Lee K et al. Long-term outcomes after switching to CT-P13 in pediatric-onset inflammatory bowel disease: a single-center prospective observational study. Inflamm Bowel Dis 2018; 24 (3): 607–616. doi: 10.1093/ibd/izx047.
22. Farkas K, Rutka M, Ferenci T et al. Infliximab biosimilar CT-P13 therapy is effective and safe in maintaining remission in Crohn‘s disease and ulcerative colitis – experiences from a single center. Expert Opin Biol Ther 2017; 17 (11): 1325–1332. doi: 10.1080/14712598.2017.1363885.
23. Smits LJT, Grelack A, Derikx LAAP et al. Long-term clinical outcomes after switching from Remicade® to biosimilar CT-P13 in inflammatory bowel disease. Dig Dis Sci 2017; 62 (11): 3117–3122. doi: 10.1007/s10620-017-4661-4.
24. Reinisch W, Jahnsen J, Schreiber S et al. Evaluation of the cross-reactivity of antidrug antibodies to CT-P13 and infliximab reference product (Remicade): an analysis using immunoassays tagged with both agents. BioDrugs 2017; 31 (3): 223–237. doi: 10.1007/s40259-017-0219-4.
25. Jahnsen J, Kaasen Jørgensen K. Experience with biosimilar infliximab (Remsima®) in Norway. Dig Dis 2017; 35 (1–2): 83–90. doi: 10.1159/000449088.
26. Razanskaite V, Bettey M, Downey L et al. Biosimilar infliximab in inflammatory bowel disease: outcomes of a managed switching programme. J Crohns Colitis 2017; 11 (6): 690–696. doi: 10.1093/ecco-jcc/jjw216.
27. Fiorino G, Manetti N, Armuzzi A et al. The PROSIT-BIO cohort: a prospective observational study of patients with inflammatory bowel disease treated with infliximab biosimilar. Inflamm Bowel Dis 2017; 23 (2): 233–243. doi: 10.1097/MIB.0000000000000995.
28. Buer LC, Moum BA, Cvancarova M et al. Switching from Remicade® to Remsima® is well tolerated and feasible: a prospective, open-label study. J Crohns Colitis 2017; 11 (3): 297–304. doi: 10.1093/ecco-jcc/jjw166.
29. Farkas K, Rutka M, Golovics PA et al. Efficacy of infliximab biosimilar CT-P13 induction therapy on mucosal healing in ulcerative colitis. J Crohns Colitis 2016; 10 (11): 1273–1278. doi: 10.1093/ecco-jcc/jjw085.
30. Smits LJ, Derikx LA, de Jong DJ et al. Clinical outcomes following a switch from Remicade® to the biosimilar CT-P13 in inflammatory bowel disease patients: a prospective observational cohort study. J Crohns Colitis 2016; 10 (11): 1287–1293. doi: 10.1093/ecco-jcc/jjw087.
31. Keil R, Wasserbauer M, Zádorová Z et al. Clinical monitoring: infliximab biosimilar CT-P13 in the treatment of Crohn‘s disease and ulcerative colitis. Scand J Gastroenterol 2016; 51 (9): 1062–1068. doi: 10.3109/00365521.2016.1149 883.
32. Sieczkowska J, Jarzębicka D, Banaszkiewicz A et al. Switching between infliximab originator and biosimilar in paediatric patients with inflammatory bowel disease. Preliminary observations. J Crohns Colitis 2016; 10 (2): 127–132. doi: 10.1093/ecco-jcc/jjv233.
33. Park SH, Kim YH, Lee JH et al. Post-marketing study of biosimilar infliximab (CT-P13) to evaluate its safety and efficacy in Korea. Expert Rev Gastroenterol Hepatol 2015; 9 (Suppl 1): 35–44. doi: 10.1586/17474124.2015.1091309.
34. Schreiber S, Ben-Horin S, Leszczyszyn J et al. Randomized controlled trial: subcutaneous vs intravenous infliximab CT-P13 maintenance in inflammatory bowel disease. Gastroenterology 2021; 160 (7): 2340–2353. doi: 10.1053/j.gastro.2021.02.068.
35. Jongsma MME, Aardoom MA, Cozijnsen MA et al. First-line treatment with infliximab versus conventional treatment in children with newly diagnosed moderate-to-severe Crohn‘s disease: an open-label multicentre randomised controlled trial. Gut 2022; 71 (1): 34–42. doi: 10.1136/gutjnl-2020-322339.
36. Dipasquale V, Romano C. Biosimilar infliximab in paediatric inflammatory bowel disease: efficacy, immunogenicity and safety. J Clin Pharm Ther 2020; 45 (6): 1228–1234. doi: 10.1111/jcpt.13239.
37. FDA-TRACK: Center for Drug Evaluation & Research – Pre-Approval Safety Review – Biosimilars Dashboard. 2021 [online]. Available from: https: //www.fda.gov/about-fda/fda-track-agency-wide-program-performance/fda-track-center-drug-evaluation-research-pre-approval-safety-review-biosimilars-dashboard.
38. Bronsky J, de Ridder L, Ruemmele FM et al. Diagnostic and therapeutic approach in paediatric inflammatory bowel diseases: results from a clinical practice survey. J Pediatr Gastroenterol Nutr 2019; 68 (5): 676–683. doi: 10.1097/MPG.0000000000002233.
39. Dipasquale V, Martinelli M, Aloi M et al. Real-life use of biosimilars in pediatric inflammatory bowel disease: a nation-wide web survey on behalf of the SIGENP IBD working group. Paediatr Drugs 2022; 24 (1): 57–62. doi: 10.1007/s40272-021-00486-8.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Kvíz z klinické praxeČlánek Perspektivní rok 2022Článek Buďme optimisty!Článek Správná odpověď na kvíz
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2022 Číslo 1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Kvíz z klinické praxe
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
- Perspektivní rok 2022
- Komplikovaný průběh Crohnovy nemoci tenkého střeva u nemocné v osmém decenniu
- Point-of-care metoda měření hladiny infliximabu a adalimumabu u pacientů s idiopatickými střevními záněty na biologické léčbě
- Biosimilární léčba v dětské gastroenterologii – současný pohled
- Bezpečnost biologické léčby vedolizumabem a ustekinumabem podávané v průběhu gravidity pro idiopatický střevní zánět matek – multicentrická retrospektivně-prospektivní observační studie
- Buďme optimisty!
- Remsima SC 120 mg – nová generace biosimilárních léčiv
- Význam domácej parenterálnej výživy v klinickej praxi – vlastné skúsenosti z nášho centra
- Desmoidní fibromatóza jako vzácný nádor mezenteria
- Výběr z mezinárodních časopisů
- Odešla mimořádná osobnost české gastroenterologie – Ivo Skála (17. 12. 1933 – 10. 2. 2022)
- Správná odpověď na kvíz
- Kreditovaný autodidaktický test: IBD
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Desmoidní fibromatóza jako vzácný nádor mezenteria
- Remsima SC 120 mg – nová generace biosimilárních léčiv
- Význam domácej parenterálnej výživy v klinickej praxi – vlastné skúsenosti z nášho centra
- Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



