-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSelhání intravezikální BCG imunoterapie v terapii svalovinu neinvadujících nádorů močového měchýře – současnost a budoucnost léčby
Management of BCG failure in non-muscle-invasive bladder cancer − the present and the future
Bladder neoplasms are still among the most common cancer types in the Czech Republic. Even though the majority (more than 90%) of bladder tumours are of urothelial origin, the group is vastly heterogeneous in terms of biological behaviour and thus also progression of the disease. Adequate adjuvant treatment is the cornerstone of the therapy in high-risk patients for disease recurrence, particularly those with a high risk of progression to a muscle-invasive disease (T2 and higher). Intravesical BCG immunotherapy still remains such a therapy. It is a standard therapy with well-established efficacy as regards the recurrence rate and a reduced risk of progression. Nevertheless, radical cystectomy is recommended in patients in whom this therapy fails. Considering the non-negligible morbidity and mortality associated with this type of surgery, intensive research efforts have been put forth to develop new bladder preserving strategies. This article outlines the main bladder preserving strategies that are currently explored.
Keywords:
Bladder cancer – BCG failure
Autoři: J. Horňák; A. Brisuda; M. Babjuk
Působiště autorů: Urologická klinika 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha
Vyšlo v časopise: Rozhl. Chir., 2022, roč. 101, č. 3, s. 108-113.
Kategorie: Souhrnné sdělení
doi: https://doi.org/10.33699/PIS.2022.101.3.108–113Souhrn
Zhoubné novotvary močového měchýře představují v České republice nadále časté onkologické onemocnění. Ačkoliv se z histologického hlediska jedná ve více než 90 % případů o malignity uroteliálního původu, z hlediska biologického chování, a tedy i dalšího průběhu onemocnění, se naráží na značnou heterogenitu. U podskupiny pacientů s vysokým rizikem častých recidiv a, to především, s vysokým rizikem progrese do svalovinu invadujícího onemocnění (T2 a výše) je imperativem léčby adekvátní adjuvantní terapie. Tu nadále představuje BCG intravezikální imunoterapie. Jedná se o standardní léčbu s prokázaným efektem na četnost recidiv i na snížení rizika progrese onemocnění. V případě jejího selhání je doporučeným postupem radikální cystektomie. Vzhledem k rozsahu operace a z něj vyplývajících trvalých konsekvencí pro pacienta je vyvíjeno značné úsilí směrem k účinným měchýř zachovávajícím postupům. V článku jsou uvedeny hlavní směry, kterými je toto výzkumné úsilí vedeno.
Klíčová slova:
nádory močového měchýře – BCG selhání
Zhoubné novotvary močového měchýře představovaly v České republice v roce 2018, nezapočítáme-li kožní neoplazie, 5. nejčastější maligní onemocnění u mužů a 13. u žen. V absolutních číslech to představuje 2118 nově diagnostikovaných případů. Z tohoto počtu pak v souladu s celosvětovými čísly zhruba 75 % zaujímají povrchové léze, tedy nálezy ohraničené na sliznici (Ta a Tis) a podslizniční vrstvu (T1) [1,2].
Povrchové nádory močové měchýře (NMIBC) pacienta z onkologického hlediska bezprostředně neohrožují na životě, což dokládá vyšší prevalence onemocnění i nižší specifická mortalita v porovnání s invazivními nádory (MIBC) [3]. Specifikum NMIBC však představuje tendence onemocnění recidivovat navzdory adekvátní operační a adjuvantní terapii v podobě transuretrálních resekcí a následných intravezikálních instilací. Udává se, že celkově tak může dojít k recidivě až u 80 % pacientů [4,5]. Druhým znakem onemocnění je možnost jeho progrese, jež je běžně definována jako výskyt recidivy s histologickými znaky MIBC, se všemi z toho vyplívajícími negativními konsekvencemi [6]. Tito pacienti mají současně horší prognózu než jedinci s primárně invazivními nádory [3]. Vzhledem k tomu, že NMIBC představují heterogenní skupinu s širokým spektrem biologického potenciálu, byl ve snaze o predikci průběhu onemocnění zaveden systém stratifikace rizikovosti založený na histologických vlastnostech a dosavadním průběhu onemocnění. Tento systém byl v roce 2021 revidován Evropskou urologickou společností (EAU) a mezi sledované parametry byl přidán i věk pacienta. Pacienti jsou dle pravděpodobnosti progrese rozděleni do čtyř skupin od nízkého rizika až po velmi vysoké [5,3]. K progresi onemocnění během pětiletého průběhu onemocnění tak může dojít u 0,57 % pacientů v nízce rizikové skupině nebo až u 44 % v případě skupiny ve velmi vysokém riziku. V nejrizikovější skupině pak číslo dosahuje během desetiletého průběhu až 59 %. Doporučení stran adjuvantní léčby v podobě intravezikálních instilací respektují toto rozdělení.
Intravezikální BCG imunoterapie
Intravezikální imunoterapie v podobě instalací Bacillus Calmette-Guérin (BCG) byla poprvé v souvislosti s léčbou povrchových nádorů močového měchýře použita Moralesem v 70. letech. Mechanismus účinku není doposud dopodrobna popsán [7]. V současnosti je tato adjuvantní léčba metodou volby v terapii NMIBC u pacientů s vysokým rizikem progrese. V indikovaných případech může být podána i u pacientů se středním rizikem. V takovém případě však může být indikováno i intravezikální podávání cytostatika. V porovnání s cytostatikem však BCG imunoterapie dosahuje dle metaanalýz lepších výsledků nejen v rámci prevence recidiv, ale i v zamezení progrese onemocnění. Tento efekt je navíc dlouhodobý. Šance na progresi byla dle studií redukována až o 27 % během 2,5letého sledování. Efektivita BCG imunoterapie v porovnání s intravezikální chemoterapií je však „vykoupena“ vyšší četností nežádoucích účinků. I za těchto okolností ale k závažným nežádoucím systémovým příznakům dochází v méně než 5 % případů. Stejně jako není doposud zcela znám mechanismus účinku, není jasně stanoveno ani optimální časové či dávkovací schéma aplikací. Již od 70. let je tak léčba postavena na indukční fázi v podobě šesti dávek v týdenních intervalech. Následuje udržovací fáze, která v závislosti na zvyklostech pracoviště, průběhu onemocnění, toleranci léčby pacientem a v neposlední řadě i dostupnosti léku, může trvat 1 až 3 roky. K dosažení optimálního efektu na redukci rizika recidivy i progrese však nesmí být kratší jednoho roku. Časové schéma v případě roční udržovací terapie bývá 3 aplikace v týdenních intervalech 3., 6., a 12. měsíc a dále ev. 18., 24., 30. a 36. měsíc. Tímto postupem se řídíme na našem pracovišti a bývá praktikováno i v rámci randomizovaných studií. Otázkou nadále zůstávají jak vliv jednotlivých kmenů BCG, tak velikost jednotlivých dávek na účinnost terapie. V případě velikosti dávek byly studijně zkoušeny různé režimy s třetinovými i polovičními dávkami, nicméně se nedospělo k přesvědčivým výsledkům, které by byly reflektovány v doporučených postupech EAU. V této souvislosti se zmiňuje i potenciální technická obtížnost ředění plných dávek, které jsou pro klinickou praxi předpřipraveny tak, aby se minimalizovalo riziko kontaminování zdravotníka [3].
Navzdory BCG imunoterapii však může dojít a dochází k recidivám NMIBC. Dle některých studií číslo dosahuje u takto léčených pacientů až 40 %. [8] Opět se i zde naráží na značnou heterogenitu tohoto onemocnění. Doposud nejsou známy faktory, které by dokázaly spolehlivě predikovat úspěšnost léčby. Výzkum se v této oblasti přesouvá na genetickou úroveň. Aktuální data naznačují, že v budoucnu bude potřeba využívat kombinace různých genetických markerů [9]. Ve snaze určit optimální postup léčby v návaznosti na recidivu NMIBC po BCG terapii definovala EAU ve spolupráci s americkým Úřadem pro kontrolu potravin a léčiv (FDA) několik skupin selhání BCG imunoterapie. Zjednodušeně se dá říci, že za selhání jsou obecně brány pouze recidivy vyššího gradu (HG/G3) či progrese do MIBC. Podle doby, kdy k takové recidivě dochází, je pak selhání ještě upřesněno jako BCG – refrakterní (recidiva v průběhu léčby), BCG – relabující (recidiva po ukončení léčby) nebo BCG – unresponsive. BCG – unresponsive skupina zahrnuje všechny BCG – refrakterní případy a i část BCG – relabujících. Navíc je u této skupiny jasně definován minimální počet BCG dávek, které pacient musí obdržet, aby bylo onemocnění takto označeno. I když se takové dělení může zdát na první pohled redundantní, BCG – unresponsive skupina je spjata s vyšším rizikem progrese onemocnění. Zároveň se zdá, že platí i opačné. Tedy, že měchýř zachovávající postupy dosahují lepších onkologických výsledků u BCG – relabujícího onemocnění [3].
Jak tedy postupovat v případě neúspěchu, resp. selhání BCG imunoterapie? EAU doporučené postupy v tomto případě hovoří jasně. Zlatým standardem pro BCG – unresponsive skupinu je časná radikální cystektomie. Všechny ostatní měchýř zachovávající postupy jsou v současnosti pokládány z onkologického hlediska za inferiorní. Odkládání radikální léčby tak může vést ke snížení nádorově specifického přežití. Naopak podstoupí - li pacient časnou radikální cystektomii v době před progresí do MIBC, dosahuje pětileté přežití bez recidivy až 80 % [3,10]. Tímto se nicméně dostáváme do situace, kdy radikální operace s nezanedbatelnou perioperační morbiditou a mortalitou je prováděna pro neinvazivní nádorové onemocnění, které, jak již bylo předesláno v úvodu článku, pacienta bezprostředně neohrožuje na životě. Devadesátidenní mortalita v různých studiích dosahuje rozmezí 2,3–8 % [11]. Často tak může být onkourolog konfrontován se zcela pochopitelným odporem ze strany pacienta, který se s daným onemocněním léčí mnohdy již řadu let. Zároveň může dojít k podcenění situace ze strany lékaře, který dostatečně neozřejmí prognózu onemocnění a může indikovat další intravezikální BCG imunoterapie či vyčkávat s radikálním operačním řešením, obojí s potenciálně závažnými konsekvencemi pro pacienta. V posledních letech se za účelem zdůraznění závažnosti vysoce rizikového NMIBC s oblibou připomíná přirovnání Fergusona. Vysoce rizikový svalovinu neinvadující T1 HG nádor močového měchýře je z hlediska prognózy specifického přežití obdobný jako pokročilý karcinom prostaty s Gleasonovým skóre 10 ve stadiu T3b [12].
Alternativní postupy léčby po selhání BCG imunoterapie
S ohledem na výše zmíněné nadále probíhá řada studií zaměřených na odlišné, měchýř zachovávající terapeutické modality. Pacienti, kteří takovou léčbu podstupují, buď nechtějí, nebo ze zdravotních důvodů nemohou podstoupit náročný operační výkon, jaký radikální cystektomie představuje.
Opakování BCG imunoterapie
Ačkoliv bylo opakovaně zmíněno, že tato léčebná modalita je v případě BCG – unresponsive onemocnění neefektivní, v případě BCG – relabujícího onemocnění se může jednat o možný směr další léčby. Stejně tak může být postupováno v případě recidivy NMIBC nižšího gradu, tedy LG onemocnění, které z definice nesplňuje kritérium pro BCG selhání [3].
Intravezikální chemoterapie
V souvislosti s intravezikálním podáním cytostatika se v indikaci BCG – unresponsive testuje řada molekul či jejich kombinací.
Gemcitabin je cytostatikum, které se již standardně využívá v neoadjuvantních, adjuvantních i paliativních režimech při léčbě MIBC [11]. Již jsou však dostupné výsledky studií s cílem prokázat jeho efektivitu i v případě intravezikální aplikace. Během multicentrické studie SWOG S0353 bylo dosaženo kompletní odpovědi u pacientů, kteří podstoupili BCG imunoterapii v 28 % případů po jednom roce sledování [13]. Di Lorenzo v multicentrické, randomizované, prospektivní studii porovnával efekt intravezikální aplikace gemcitabinu proti BCG imunoterapii u pacientů po proběhlém jednom cyklu BCG imunoterapie. K recidivě onemocnění došlo v 52,5 %, resp. 87,5 % případů [14]. I když se jedná o slibné údaje, dlouhodobé výsledky nejsou k dispozici.
Valrubicin je v současnosti jediný FDA schválený preparát v léčbě carcioma in situ (Tis) u pacientů předléčených pomocí BCG, kteří nemohou podstoupit radikální cystektomii. Studijně bylo dosaženo kompletní odpovědi v šestém měsíci v 18−21 % případů [15,16]. Další multicentrická retrospektivní studie, do které byli zahrnuti i pacienti s jinými formami NMIBC nejen pouze s Tis, však dosáhla kompletní odpovědi v jednom roce pouze u 16,4 % případů. Přitom nežádoucí lokální účinky byly popsány v 49,6 % případů [17].
Další skupinou cytostatik zkoušenou v této indikaci pak představují taxany. Laudano et al. v prospektivní studii využívající intravezikální instilace docetaxelu dosáhli kompletní odpovědi a čtyřletého přežití bez recidivy u 22 % pacientů [18]. Aktualizované výsledky od obdobného kolektivu s rozšířeným souborem pacientů ukazují, že za tříletou dobu sledování bylo bez recidivy onemocnění 25 % pacientů. Pacientům byly podávány i udržovací dávky docetaxelu po dobu devíti měsíců [19,20]. Vyjma docetaxelu je studijně zkoumán i paklitaxel v podobě nanočástic, ve kterých je vázán na albumin. Období jednoho roku bez recidivy bylo v takovém případě dosaženo ve 36 % případů [21].
V neposlední řadě je potřeba zmínit i snahy o kombinování cytostatických preparátů v podobě sekvenční terapie gemcitabinem následovaným docetaxelem nebo mitomycinem C. V případě kombinace s mitomycinem C byl medián doby sledování bez recidivy 15,2 měsíce, přičemž u 10 pacientů, tedy u 37 % z celkového počtu, nedošlo k recidivě onemocnění za dobu sledování s mediánem 22 měsíců [22]. Kombinace gemcitabinu s docetaxelem dosáhla v případě skupiny BCG – unresponsive pacientů dvouletého období bez recidivy u 46 % pacientů [23].
Přístrojově asistované metody intravezikální chemoterapie
Podstatou níže zmíněných metod je zvýšení účinnosti cytostatika během jeho intravezikální instilace pomocí přístrojového vybavení. Tento přístup zvyšuje permeabilitu nádorových buněk, které jsou následně náchylnější k cytostatickému efektu [24].
Chemohypertermie je založena na radiofrekvenčně indukované hypertermii (RITE) v močovém měchýři (Obr. 1). Pro tuto metodu, při které je roztok cytostatika ohříván zářičem inkorporovaným přímo v močovém katétru na teplotu ideálně přes 41 °C, existují zatím nejsilnější data ze všech přístrojově asistovaných metod [3,20,25]. Retrospektivní studie zahrnující 111 pacientů po selhání BCG imunoterapie dosáhla jednoletého a dvouletého přežití bez nemoci v 85 %, resp. 56 % případů. Nežádoucí účinky byly nejčastěji mírného charakteru v podobě spazmů močového měchýře a cystalgií a souhrnně byly přítomny u 45 % pacientů. Zvoleným cytostatikem byl v tomto případě mitomycin C [3]. Arends, et al. v rámci randomizované studie, do které byli zařazeni pacienti ze středně a vysoce rizikové skupiny, dále prokázali superioritu chemohypertermie proti klasické BCG imunoterapii. Během dvouletého sledování nedošlo k recidivě NMIBC u 78,1 % pacientů oproti 64,8 % v případě BCG. Nicméně v tomto případě ne všichni pacienti prodělali BCG imunoterapii. Instilace BCG v době do 48 měsíců před zařazením do studie byla dokonce jedním z vylučujících kritérií pro zařazení. Výsledky je tak nutno brát v této indikaci, tedy selhání BCG imunoterapie s rezervou, protože 95 % zařazených případů bylo BCG naivních [3,20].
Obr. 1. Systém Synergo® na fotce bez napojeného setu s močovým katétrem a nádržkou s cytostatikem
Nádržka se připojuje do chladicího mechanismu uprostřed centrálního panelu. V porovnání se systémy HIVEC® je mnohdy nutné průběžně během aplikace regulovat teplotu cytostatika, ať už zvyšováním výkonu mikrovlnného zářiče, či úpravou rychlosti recirkulace. Veškeré úpravy probíhají přes dotykový displej.
(Foto archiv autora)
Fig. 1: Synergo® system without the single-use set that consists of the urinary catheter and a reservoir containing the cytostatic agent
The reservoir is placed into the cooler in the middle of the central panel. Compared to HIVEC® systems, cytostatic temperature often needs to be regulated during application, either by increasing the microwave power or by adjusting the recirculation velocity. The touchscreen is used to perform all adjustments.
(Photo: Author’s archive)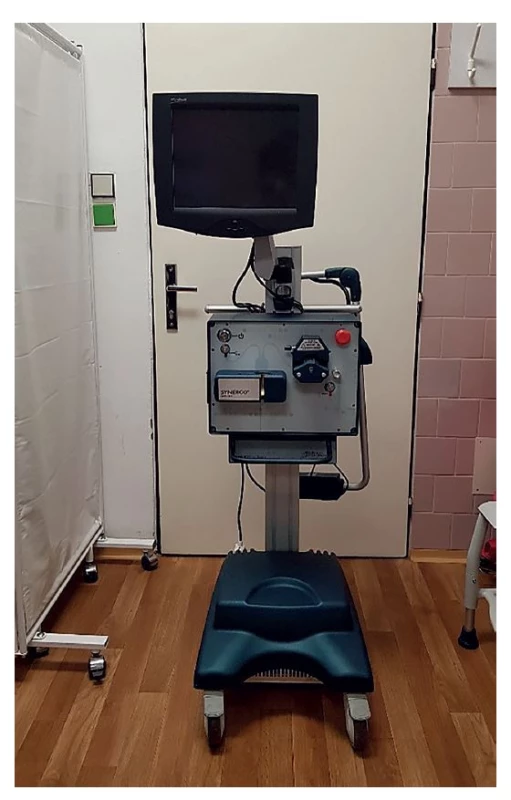
Při hypertermické intravezikální chemoterapii (HIVEC®) je cytostatikum ohříváno mimo močový měchýř a uzavřeným systémem recirkuluje přes zavedený močový katétr mezi ohřívačem a močovým měchýřem (Obr. 2, 3). V prospektivní studii, do které bylo zařazeno celkem 103 pacientů splňujících podmínky BCG selhání či BCG intolerance, byla průměrná doba do recidivy či progrese onemocnění 23 měsíců. Jako cytostatikum se využíval jak mitomycin C, tak epirubicin bez statisticky významného rozdílu na efektivitu léčby. Nicméně léčba epirubicinem byla v porovnání s mitomycinem spjata s frekventnějšími nežádoucími účinky, nejčastěji charakteru urgencí. Z celkového počtu 28 takto léčených pacientů byly méně závažné nežádoucí účinky popsány v 57 % případů [26].
Obr. 2. Systém Combat BRS V5 s napojeným jednorázovým setem
Cytostatikum je ohříváno přístrojem a pumpou vháněno do močového měchýře.
(Foto archiv autora)
Fig. 2: Combat BRS V5 system in use
The cytostatic agent is heated and pumped through the single- -use set into the patient’s bladder via the inserted catheter.
(Photo: Author‘s archive)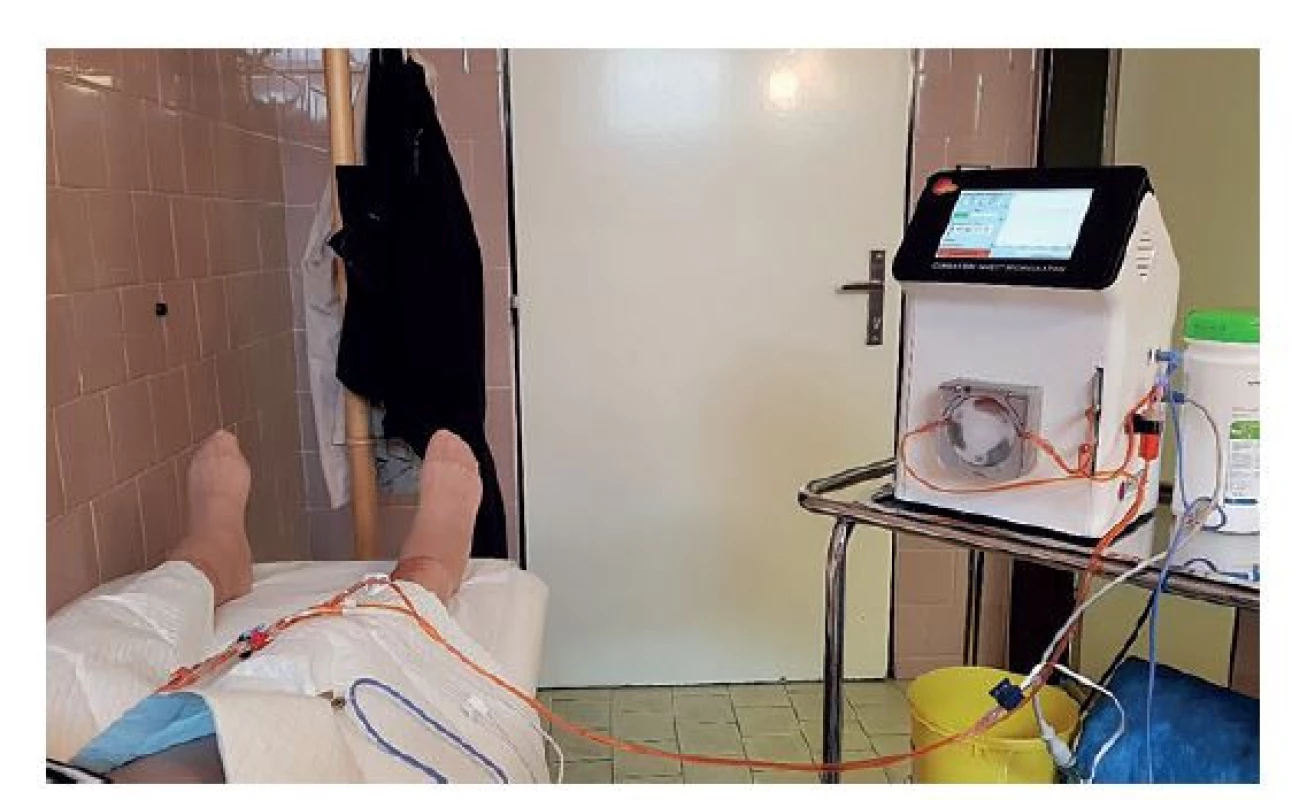
Obr. 3. Ovládací rozhraní systému Combat BRS V5
(Foto archiv autora)
Fig. 3: Interface of the Combat BRS V5 system
(Photo: Author‘s archive)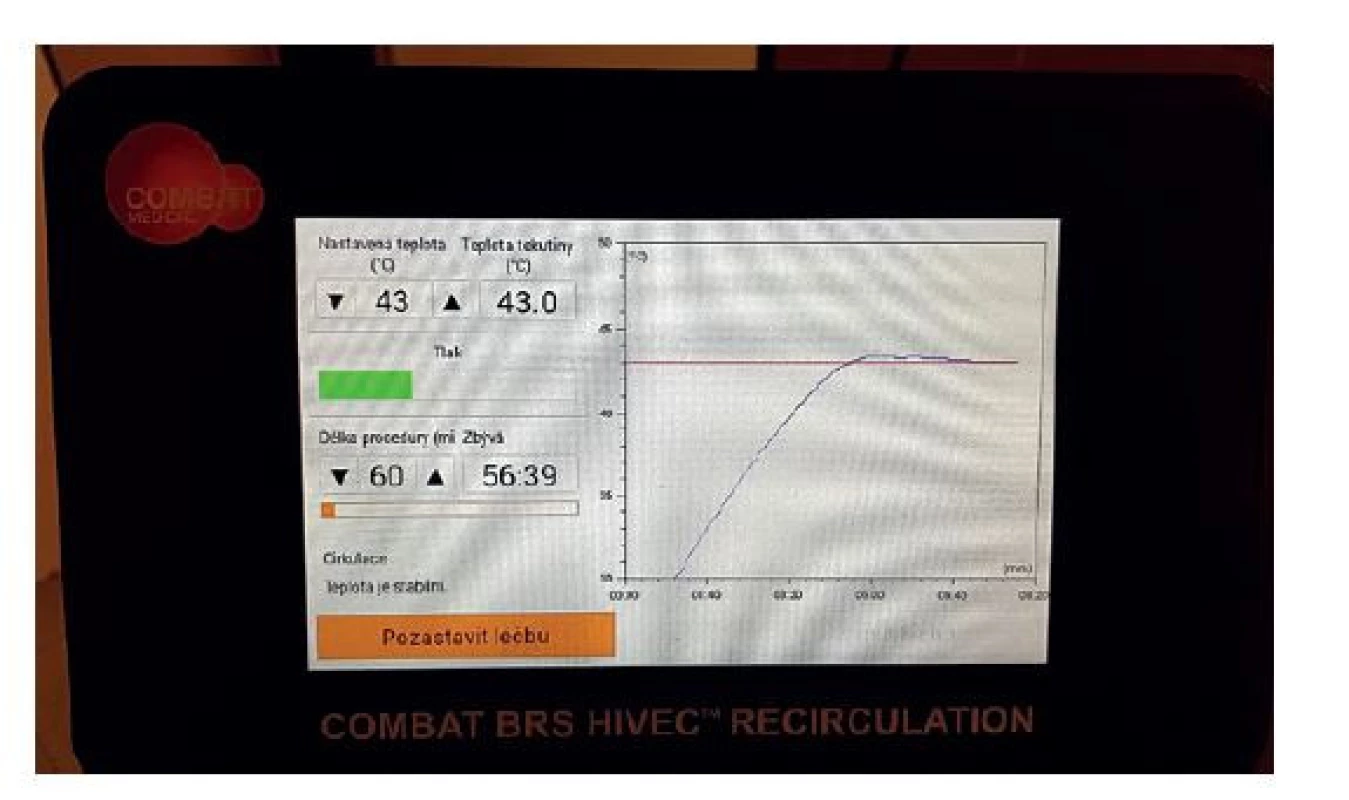
Electromotive drug administration (EMDA) využívá vzniku slabého elektrického proudu mezi elektrodami na močovém katétru a elektrodami přilepenými na tělo pacienta. Cytostatikum tak díky iontoforetickému efektu zvyšuje svou koncentraci ve stěně močového měchýře [27]. Efektivita EMDA byla testována mimo jiné v rámci studie porovnávající efekt BCG imunoterapie v monoterapii vůči sekvenční terapii EMDA s mitomycinem C kombinovanou dohromady s BCG instilacemi. Efekt na skupinu pacientů po selhání BCG imunoterapie byl testován v rámci jedné prospektivní studie zahrnující 26 pacientů. Během sledování s mediánem 36 měsíců nedošlo k HG recidivě u 61,5 % pacientů [20].
Fotodynamická terapie (PDT) je metoda, při které po podání fotosenzitizéru (například kyselina 5-aminolevulová perorálně), který je absorbován nádorovými buňkami, ozařujeme kavitu močového měchýře světlem o specifické vlnové délce. Následně dochází k uvolňování reaktivních forem kyslíku destruujících nádorové buňky [28]. Tento druh léčby byl v malých souborech studijně aplikován i u BCG – refrakterních pacientů [29]. Limitaci prozatím představuje relativně vysoká toxicita léčby zahrnující i případy svrašťování měchýře a hemodynamické nestability v případě pacientů s anamnézou kardiovaskulárního onemocnění [20,29].
Nové terapeutické postupy
Tyto léčebné modality, v angličtině tzv. emerging therapies, představují heterogenní skupinu, u níž výsledky studií naznačují slibný efekt v léčbě NMIBC po selhání BCG imunoterapie [30].
Skupinu tzv. checkpoint inhibitorů představují léky v podobě monoklonálních protilátek proti programmed cell death 1 protein (PD-1) nebo programmed cell death protein ligand (PD-L1). Za normálních okolností interakce mezi těmito molekulami dezaktivuje T-lymfocyty. Některé nádorové buňky mohou na svém povrchu exprimovat PD-L1 a tím aktivně bránit imunitnímu systému proti nim zakročit [31]. Tento druh léčby je již používanou modalitou v případě metastatického urotheliálního karcinomu a FDA schválila pět preparátů v rámci této terapeutické indikace [11,32]. Z výše zmíněného vyplývá, že lepší terapeutickou odpověď po podání checkpoint inhibitorů vykazují pacienti, u kterých dochází ve zvýšené míře k expresi PD-L1. Zajímavou je tak studijně prokázaná zvýšená exprese této molekuly u pacientů po selhání BCG imunoterapie v porovnání s BCG naivními pacienty, 69 % vs. 19 % [33]. Částečně i tímto faktem si tak můžeme vysvětlit schválení pembrolizumabu FDA v léčbě i NMIBC v případě BCG selhání u pacientů, kteří nemohou nebo nechtějí podstoupit radikální cystektomii [56]. Bylo tak učiněno pouze na základě předběžných výsledků studie KEYNOTE - 057 [3,34]. Do této studie bylo zařazeno celkem 96 pacientů klasifikovaných jako BCG – unresponsive. Medián sledování představoval 28 měsíců, kdy kompletní odpovědi bylo za tuto dobu dosaženo ve 41,2 % případů. Medián doby, po kterou tato odpověď trvala, byl 16,2 měsíce. Z celkového počtu 96 pacientů pouze 9 % přerušilo léčbu vlivem nežádoucích účinků. V současnosti probíhá řada dalších studií zkoumajících efekt rozdílných molekul v této indikaci. Patří mezi ně atezolizumab, nivulomab či durvalumab [11,35].
Další nový léčebný přístup představuje genová terapie s využitím virů jako nosičů genetické informace. Studijně již podávaný preparát představuje instiladrin (nadofaragene firadenovec nebo též rAd-IFNα/Syn3). Obsahuje rekombinantní adenovirový vektor, který po intravezikálním podání vede k produkci interferonu alfa-2b v buňkách močového měchýře. Ten následně působí cytotoxicky na nádorové buňky. Výsledky z fáze III prospektivní multicentrické studie ukazují, že z celkového počtu 151 zařazených pacientů klasifikovaných jako BCG – unresponsive bylo u 24,3 % s Tis po jednom roce sledování dosaženo kompletní odpovědi. V případě pacientů s papilárním onemocněním (Ta a T1) bylo toto číslo dokonce 43,8 % [36,37]. Další studijní lék založený na v tomto případě onkolytickém adenoviru přenášejícím informaci pro granulocyt-makrofág-kolonie stimulující faktor představuje CG0070. V současnosti probíhá fáze III s plánem zařazení 110 pacientů po selhání BCG terapie. Ukončení studie se plánuje na rok 2024 [38].
Do výčtu v rámci této skupiny se může zařadit řada dalších inovativních přístupů s molekulami, které byly doposud využívány například v léčbě metastatického uroteliálního karcinomu. Zmiňme například erdafitinib (tyrosinkinázový inhibitor receptoru pro fibroblastový růstový faktor) či vicinium (fúzní molekula obsahující monoklonální protilátku s navázaným exotoxinem bakterie P. aeruginosa) [39,40].
ZÁVĚR
Nádory močového měchýře jsou častým onkologickým onemocněním, jehož léčba a následné sledování v podobě opakovaných endoskopických vyšetření představuje nemalou finanční a časovou zátěž pro zdravotní systém. BCG imunoterapie nadále zůstává zlatým standardem léčby v případě vysoce rizikových pacientů z hlediska progrese onemocnění, které znamená bezprostřední riziko pro nemocného. V případě selhání této léčby jednoznačně přetrvává indikace k radikální cystektomii. Vzhledem k případům, kdy pacient nemůže anebo odmítá podstoupit radikální výkon, a i s ohledem na závažnost takovéto operace je nadále vynakládáno značné úsilí na vývoj nových měchýř zachovávajících postupů. Úspěšnost takto vynaloženého úsilí je doložena postupným inkorporováním nových léčebných modalit do doporučených postupů odborných urologických společností.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Jakub Horňák
Urologická klinika 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: jakub.hornak@fnmotol.cz
Zdroje
1. Novotvary ČR. Praha: Ústav zdravotnických informací a statistiky České republiky. 1989. ISSN 1210-857X.
2. Compérat E, Larré S, Roupret M, et al. Clinicopathological characteristics of urothelial bladder cancer in patients less than 40 years old. Virchows Archiv 2015;466 : 589–594.
3. Babjuk M, Burger M, Compérat E, et al. European Association of Urology Guidelines on non-muscle-invasive bladder cancer (TaT1 and carcinoma in situ) Edn. Presented at the EAU Annual Congress Milan 2021. ISBN 978-94-92671-13-4.
4. Lamm DL. Long-term results of intravesical therapy for superficial bladder cancer. Urol Clin North Am. 1992 Aug;19(3):573−580. doi:10.1016/S0094 - 0143(21)00424-9.
5. Dvořáček J, Babjuk M, Babjuk J. Onkourologie. Praha, Galén 2005. ISBN 80 - 7262-349-4.
6. Lamm D, Persad R, Brausi M, et al. Defining progression in non muscle invasive bladder cancer: it is time for a new, standard definition. J Urol. 2014 Jan;191(1):20−27. doi 10.1016/j.juro.2013.07.102. Epub 2013 Aug 22. PMID: 23973937.
7. Hušek P, Pacovská J, Broďák M. BCG – historie, mechanismus účinku, indikace, účinnost, dávkování. Urologie pro praxi [online] 2019;20(4):157−160. ISSN 12131768. doi:10.36290/uro.2019.069.
8. Witjes JA. Management of BCG failures in superficial bladder cancer: A review. Eur Urol. 2006 May;49(5):790−797. doi:10.1016/j.eururo.2006.01.017. Epub 2006 Jan 24. PMID: 16464532.
9. Zhang N, Jiang G, Liu X, et al. Prediction of bacillus Calmette-Guerin response in patients with bladder cancer after transurethral resection of bladder tumor by using genetic variation based on genomic studies. Biomed Res Int. 2016;2016 : 9859021. doi:10.1155/2016/9859021.
10. Shariat SF, Karakiewicz PI, Palapattu GS, et al. Outcomes of radical cystectomy for transitional cell carcinoma of the bladder: a contemporary series from the Bladder Cancer Research Consortium. J Urol. 2006 Dec;176(6 Pt 1):2414−22; discussion 2422. doi:10.1016/j.juro.2006.08.004. PMID: 17085118.
11. Witjes JA, Bruins HM, Cathomas R, et al. European Association of Urology Guidelines on muscle-invasive and metastatic bladder cancer: Summary of the 2020 Guidelines. Eur Urol. 2021;79 : 82−104. doi:10.1016/j.eururo.2020.03.055.
12. Ferguson JE 3rd, Kamat AM. It‘s all about the perspective: Removing bias when co-managing patients with high-grade T1 bladde rcancer and localized prostate cancer − a competing risks analysis. Urol Oncol. 2018 Feb;36(2):39−42. doi:10.1016/j.urolonc.2017.10.019. Epub 2017 Nov 20. PMID: 29158136.
13. Skinner EC, Goldman B, Sakr WA, et al. SWOG S0353: Phase II trial of intravesical gemcitabine in patients with non muscle invasive bladder cancer and recurrence after 2 prior courses of intravesical bacillus Calmette-Guérin. J Urol. 2013;190 : 1200–1204.
14. Di Lorenzo G, Perdonà S, Damiano R, et al. Gemcitabine versus bacille Calmette - Guérin after initial bacille Calmette - Guérin failure in non-muscle-invasive bladder cancer: a multicenter prospective randomized trial. Cancer 2010 Apr 15;116(8):1893−900. doi:10.1002/ cncr.24914. PMID: 20162706.
15. Steinberg G, Bahnson R, Brosman S, et al. Efficacy and safety of valrubicin for the treatment of bacillus Calmette-Guerin refractory carcinoma in situ of the bladder. The Valrubicin Study Group. J Urol. 2000;163 : 761–767.
16. Dinney CP, Greenberg RE, Steinberg GD. Intravesical valrubicin in patients with bladder carcinoma in situ and contraindication to or failure after bacillus Calmette - Guérin. Urol Oncol 2013;31 : 1635–1642.
17. Cookson MS, Chang SS, Lihou C, et al. Use of intravesical valrubicin in clinical practice for treatment of nonmuscle-invasive bladder cancer, including carcinoma in situ of the bladder. Ther Adv Urol. 2014;6 : 181–191.
18. Laudano MA, Barlow LJ, Murphy AM, et al. Long-term clinical outcomes of a phase I trial of intravesical docetaxel in the management of non-muscle-invasive bladder cancer refractory to standard intravesical therapy. Urology 2010;75 : 134–137.
19. Barlow LJ, McKiernan JM, Benson MC. Long-term survival outcomes with intravesical docetaxel for recurrent non muscle invasive bladder cancer after previous bacillus Calmette-Guérin therapy. J Urol. 2013 Mar;189(3):834−839. doi: 10.1016/j. juro.2012.10.068. Epub 2012 Oct 30. PMID: 23123371.
20. Kim HS, Seo HK. Emerging treatments for bacillus Calmette–Guérin-unresponsive non-muscle-invasive bladder cancer. Investig Clin Urol. 2021 Jul;62(4):361−377.
21. McKiernan JM, Holder DD, Ghandour RA, et al. Phase II trial of intravesical nanoparticle albumin bound paclitaxel for the treatment of non muscle invasive urothelial carcinoma of thebladder after bacillus Calmette-Guérin treatment failure. J Urol. 2014;192 : 1633–1638.
22. Cockerill PA, Knoedler JJ, Frank I, et al. Intravesical gemcitabine in combination with mitomycin C as salvage treatment in recurrent non-muscle-invasive bladder cancer. BJU Int 2016;117 : 456–462.
23. Steinberg RL, Thomas LJ, Brooks N, et al. Multi-institution evaluation of sequential gemcitabine and docetaxel as rescue therapy for non muscle invasive bladder cancer. J Urol. 2020;203 : 902–909.
24. Hendricksen K. Device-assisted intravesical therapy for non-muscle invasive bladder cancer. Transl Androl Urol. 2019;8 : 94 – 100.
25. Chiancone F, Fabiano M, Fedelini M, et al. Outcomes and complications of hyperthermic intravesical chemotherapy using mitomycin C or epirubicin for patients with non-muscleinvasive bladder cancer after bacillus Calmette - Guérin treatment failure. Cent European J Urol. 2020;73(3):287−294. doi:10.5173/ ceju.2020.0148. Epub 2020 Aug 6. PMID: 33133655; PMCID: PMC7587473.
26. Kos B, Vásquez JL, Miklavčič D, et al. Investigation of the mechanisms of action behind Electromotive Drug Administration (EMDA) PeerJ 4:e2309.2016; doi:org/10.7 717/peerj.2309.
27. Kolaříková M. Fotodynamická terapie in vitro na nádorových buněčných liniích. Olomouc, 2020. Diplomová práce. Univerzita Palackého, Olomouc, Přírodovědecká fakulta.
28. Waidelich R, Stepp H, Baumgartner R, et al. Clinical experience with 5-aminolevulinic acid and photodynamic therapy for refractory superficial bladder cancer. J Urol. 2001;165(6 Pt 1):1904–1907.
29. Sathianathen NJ, Regmi S, Gupta S, et al. Immunooncology approaches to salvage treatment for non-muscle invasive bladder cancer. Urol Clin North Am. 2020;47 : 103–110.
30. Darvin P, Toor SM, Sasidharan NV, et al. Immune checkpoint inhibitors: recent progress and potential biomarkers. Exp Mol Med. 2018;50 : 1–11. doi:org10.1038/ s12276-018-0191-1.
31. Kim HS, Seo HK. Immune checkpoint inhibitors for urothelial carcinoma. Investig Clin Urol. 2018;59 : 285–296.
32. Kates M, Matoso A, Choi W, et al. Adaptive immune resistance to intravesical BCG in non-muscle invasive bladder cancer: implications for prospective BCG-unresponsive trials. Clin Cancer Res. 2020;26 : 882 – 891.
33. Wright KM. FDA Approves pembrolizumab for BCG-unresponsive NMIBC. Oncology (Williston Park) 2020 Feb 20;34(2):44. PMID: 32645193.
34. Balar AV, Kulkarni GS, Uchio EM, et al. Keynote 057: Phase II trial of pembrolizumab (pembro) for patients (pts) with highrisk (HR) non muscle invasive bladder cancer (NMIBC) unresponsive to bacillus Calmette-Guérin (BCG). J Clin Oncol. 2019;37(7 Suppl):350.
35. Black PC, Tangen C, Singh P, et al. Phase II trial of atezolizumab in BCG-unresponsive non-muscle invasive bladder cancer: SWOG S1605 (NCT #02844816). J Clin Oncol. 2020;38(15 Suppl):5022.
36. Boorjian SA, Dinney CPN. SUO Clinical Trials Consortium. Safety and efficacy of intravesical nadofaragene firadenovec for patients with high-grade, BCG unresponsive non muscle invasive bladder cancer (NMIBC): results from a phase III trial. J Clin Oncol. 2020;38(6 Suppl):442.
37. Boorjian SA, Alemozaffar M, Konety BR, et al. Intravesical nadofaragene firadenovec gene therapy for BCG-unresponsive non-muscle-invasive bladder cancer: a single-arm, open-label, repeat-dose clinical trial. Lancet Oncol. 2021;22 : 107 – 117.
38. ClinicalTrials.gov Identifier: NCT04452591 https://clinicaltrials.gov/ct2/show/ NCT04452591.
39. Steinberg GD, Palou-Redorta J, Gschwend JE, et al. A randomized phase II study of erdafitinib (ERDA) versus intravesical chemotherapy (IC) in patients with high-risk non muscle invasive bladder cancer (HRNMIBC) with FGFR mutations or fusions, who recurred after bacillus Calmette - Guérin (BCG) therapy. J Clin Oncol. 2020;38(6 Suppl):TPS603.
40. Shore N, O‘Donnell M, Keane T, et al. PD03-02. Phase 3 results of vicinium in BCG-unresponsive non-muscle invasive bladder cancer. Journal of urology [online]. 2020;203(supplement 4) [cit. 2021 - 11-14]. issn 0022-5347 doi:10.1097/ ju.0000000000000823.02.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Amputace penisu pro sarkom
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2022 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Nové trendy v diagnostice karcinomu prostaty
- Selhání intravezikální BCG imunoterapie v terapii svalovinu neinvadujících nádorů močového měchýře – současnost a budoucnost léčby
- Zastoupení nekrózy v histologickém preparátu jako prediktor relapsu po chirurgické léčbě lokalizovaného světlobuněčného renálního karcinomu
- Prognostické faktory v časné opakované transuretrální resekci uroteliálního karcinomu močového měchýře bez invaze detruzoru − 10leté zkušenosti referenčního pracoviště
- Riziko biochemické recidivy u pacientů s pozitivním okrajem po radikální prostatektomii
- Amputace penisu pro sarkom
- Okultní karcinom prsu: kazuistika a současné léčebné postupy
- Vybrané aspekty současné onkourologie
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Riziko biochemické recidivy u pacientů s pozitivním okrajem po radikální prostatektomii
- Nové trendy v diagnostice karcinomu prostaty
- Okultní karcinom prsu: kazuistika a současné léčebné postupy
- Amputace penisu pro sarkom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



