-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaMonitoring vnitřního ovzduší operačních sálů v praxi ve zdravotnickém zařízení terciárního typu
Monitoring of indoor air of operating rooms in practice in a tertiary-type medical facility
Adherence to aseptic conditions in the operating room is a key component in the prevention of healthcare associated infections. The aim of the work was to point out the effect of monitoring and evaluation of established anti-epidemic measures in operating rooms serving as tissue facilities in tertiary-type medical facilities in the order to ensure indoor air quality in preventing serious postoperative complications in patients. The work methodically describes the set monitoring of the indoor air of operating rooms in the periodicity once every six months by measuring the number of particles in the air and microbiological control of indoor air quality by an active method using an aeroscope. The limits applicable to clean rooms in pharmacy and tissue establishments based on good manufacturing practice and the technical standard EN ISO 14644-1: Clean rooms and relevant environmental management are used for evaluation. In the results, the authors present two case reports, which emphasize the importance of monitoring and especially its contribution to the setting of anti-epidemic conditions in operating rooms in the prevention of the spread of healthcare-associated infections, with regards to the presence of staff.
Keywords:
healthcare associated infections – operating rooms – clean rooms – indoor air monitoring – suspended dust particles – microbial flora
Autoři: L. Fedor 1,3,4; O. Holý 2; M. Nakládalová 3; I. Matoušková 4
; L. Štěpánek 3
Působiště autorů: Oddělení nemocniční hygieny FN Olomouc a LF Univerzity Palackého v Olomouci, vedoucí MUDr. Jarmila Kohoutová 1; Centrum vědy a výzkumu FZV Univerzity Palackého v Olomouci, ředitel doc. MUDr. Ondřej Holý, Ph. D. 2; Klinika pracovního lékařství FN Olomouc a LF Univerzity Palackého v Olomouci, přednostka doc. MUDr. Marie Nakládalová, Ph. D. 3; Ústav veřejného zdravotnictví LF Univerzity Palackého v Olomouci, přednostka prof. MUDr. Dagmar Horáková, Ph. D. 4
Vyšlo v časopise: Pracov. Lék., 73, 2021, No. 3-4, s. 61-65.
Kategorie: Původní práce
Souhrn
Dodržování aseptických podmínek v prostoru operačního sálu je klíčovou součástí v prevenci infekcí spojených se zdravotní péčí. Cílem práce bylo poukázat na efekt monitoringu a hodnocení zavedených protiepidemických opatření na operačních sálech sloužících i jako tkáňová zařízení ve zdravotnickém zařízení terciárního typu za účelem zajištění kvality vnitřního ovzduší v prevenci vzniku závažných pooperačních komplikací u pacienta. Práce metodicky popisuje nastavený monitoring vnitřního ovzduší operačních sálů v periodicitě 1krát za šest měsíců pomocí měření počtu částic ve vznosu a mikrobiologickou kontrolou kvality vnitřního ovzduší aktivní metodou pomocí aeroskopu. Pro hodnocení jsou použity limity platné pro čisté prostory ve farmacii a tkáňová zařízení vycházející ze správné výrobní praxe a technickou normu EN ISO 14644-1: Čisté prostory a příslušné řízení prostředí. Ve výsledcích uvádějí autoři dvě kazuistiky, kterými zdůrazňují význam monitoringu a zejména jeho přínos pro nastavení protiepidemických podmínek na operačních sálech v prevenci šíření infekcí spojených se zdravotní péčí, s ohledem na přítomnost personálu.
Klíčová slova:
infekce spojené se zdravotní péčí – operační sály – čisté prostory – monitoring vnitřního ovzduší – prachové částice ve vznosu – mikrobiální flóra
ÚVOD
Operační sály jsou složité systémy vyžadující čisté prostředí s co nejmenším počtem mikroorganismů, které mohou působit vznik infekčních onemocnění. K důležitým faktorům, které mohou mít vliv na čistotu prostředí patří strukturální charakteristika zařízení, stav pacienta, typ prováděného výkonu, chování chirurgického týmu a v neposlední řadě účinnost vzduchotechnického systému (dále jen VZT) [1, 13]. Tyto vnitřní podmínky mohou ovlivnit výsledek operace, bezpečnost pacientů a pohodlí operačního týmu. Nejzávažnější problém představuje kontaminace vnitřního ovzduší různými potenciálně patogenními a patogenními mikroorganismy, především aerobní flórou, stafylokoky a streptokoky [4, 21]. Právě to jsou důvody, proč má kontrola prašnosti a mikrobiální kontaminace vnitřního ovzduší na operačních sálech opodstatnění [24].
V prostředí operačních sálů je přítomnost mikroorganismů spojená s výskytem infekcí vzniklých v místě chirurgického výkonu (Surgical Site Infection – dále jen SSI). Celosvětově 14–20 % všech infekcí spojených se zdravotní péčí (Healhcare-associated Infection, dále jen HAI) jsou SSI, které vedou ke zvýšení mortality a morbidity, spolu s rostoucími náklady na zdravotnický systém v důsledku prodlouženého pobytu v nemocnici [14]. Tyto infekce jsou závažnou příčinou HAI, vyskytují se až u 9,5 % chirurgických výkonů v závislosti na typu operace a přispívají k zátěži týkající se zdravotního postižení, která se přibližně odhaduje 500 případů na 100 000 pacientů [24]. Ročně se objeví 2 600 000 nových případů HAI, z kterých je 800 000 typu SSI a mortalita se denně odhaduje na 58 případů na 100 000 pacientů [20].
Většina mikroorganismů způsobujících SSI má endogenní původ v mikrobiomu pacienta. Příležitostně mohou být příčinou vývoje SSI i mikroorganismy získané z exogenního zdroje, jako je zmíněné vnitřní ovzduší nebo zdravotnický personál. Lidské tělo je holobiont představující domov pro miliardy mikroorganismů a může emitovat až 3,7 x 107 bakteriální a 7,3 x 106 plísňové flóry za hodinu. Tyto mikroorganismy mohou být pro náš život a zdraví prospěšné, ale také mohou zapříčinit negativní dopady a pacientům způsobit až fatální následky. Jak pacienti, tak i sálový personál, může uvolňovat částice kůže (zejména, když je suchá), respirační aerosol, prachové částice a textilní vlákna obsahující životaschopné mikroorganismy v prostředí operačního sálu. Kromě přítomnosti sálového personálu samotného může ke zvýšenému počtu mikroorganismů a prachových částic přispívat také jejich nevhodné chování a zlozvyky [14].
MATERIÁL A METODIKA
Aseptické operační sály FN Olomouc jsou určené zejména pro odběr tkáně v rámci transplantačního programu. Tabulkové parametry kvality vnitřního ovzduší pro tento typ čistého prostředí zajišťuje vzduchotechnika. Systém sálů je kontinuálně nastavený v režimu přetlaku (aseptický režim) s provozní teplotou 20 °C a relativní vlhkostí vzduchu 50–70 %. Výměna vzduchu je zajišťována klimatizační jednotkou GEA. Celkové množství přiváděného vzduchu je 4 200 m3/h, odtah vzduchu 3 800 m3/h. Filtrace vzduchu je třístupňová, tzn. filtr G4 (první stupeň pro záchyt hrubých nečistot), filtr F8 (druhý stupeň) v jednotce VZT a ve vyústkách laminizátoru jako distribuční element HEPA filtr H13 (třetí stupeň).
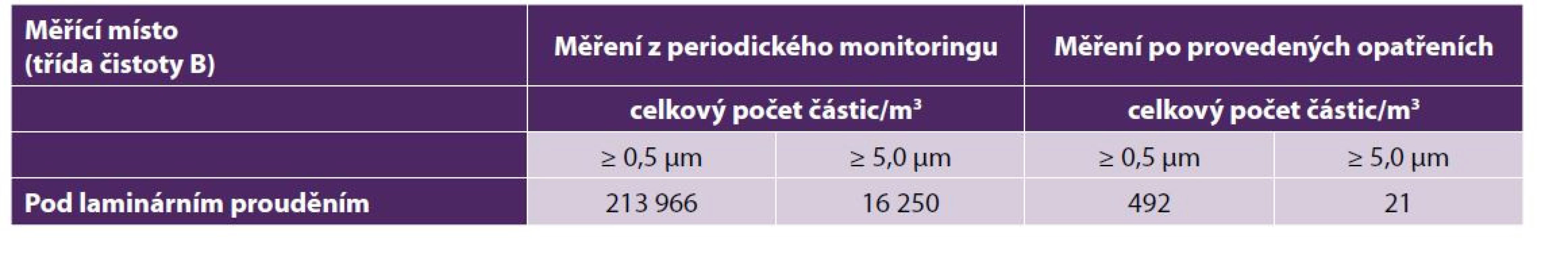
Monitoring kvality vnitřního ovzduší operačních sálů je prováděn dvakrát ročně za provozu, přičemž podle pokynu Státního ústavu pro kontrolu léčiv VYR-36 Čisté prostory (dále jen VYR-36) je akceptovatelný i simulovaný provoz [23]. Pro hodnocení mikrobiální kontaminace operačních sálů byly použity limity určené pro čisté prostory ve farmacii a pro tkáňová zařízení vycházející ze správní výrobní praxe (GMP – Good Manufacturing Practice), které uvádí zmíněný pokyn VYR-36. Pro stanovení limitů prachových částic ve vznosu byla použitá technická norma EN ISO 14644-1 [6]. Pro aseptické sály byly použity limity třídy B pro prostor pod laminárním prouděním (což odpovídá ekvivalentu třídy čistoty ISO 5) a třídy C pro prostor operačního sálu (ekvivalent třídy čistoty ISO 7).
Monitoring kvality vnitřního ovzduší byl realizován dvěma testy: měření počtu částic ve vznosu a mikrobiologická kontrola kvality vnitřního ovzduší. Zpracování a vyhodnocení výsledků bylo provedeno pracovníky zkušební laboratoře Oddělení nemocniční hygieny FN Olomouc akreditované podle normy EN ISO/IEC 17025 [7]. Monitoring mikrobiální kontaminace vnitřního ovzduší probíhal za „provozu“, u stanovení počtu částic potom za simulovaného provozu (tzn. za přítomnosti operačního týmu provádějícího pooperační činnosti po odvezení pacienta ze sálu).
Stanovení počtu částic ve vznosu bylo provedeno prostřednictvím laserového automatického čítače částic APC SmartTouch (Merck KGaA, SRN). Při stanovení počtu odběrových míst a časovém limitu v daném prostoru měření se vycházelo z normy EN ISO 14644-1. Stanovení doby měření bylo odvozené od objemu průtoku vzduchu laserového čítače částic. V tomto případě se jednalo o průtok 28,3 l/min.
Kontrola mikrobiální kontaminace vnitřního ovzduší byla provedena aktivním nasáváním vzorku vnitřního ovzduší (100 l/minuta) aeroskopem MAS-100 ECO (Merck KGaA, SRN) a Petriho misek s kultivační půdou (Trios, Praha, Česká republika). Na každém odběrovém místě byly provedeny 2 odběry: pod laminizátorem (u hlavy a nohou pacienta) a v prostoru operačního sálu (u anesteziologického inhalačního přístroje a u dveří výstupu ze sálu) na Columbia krevní agar a Sabouraudův agar podle metodiky AHEM [22]. Před započetím každého odběru provedl pracovník dezinfekci rukou, následně po vyjmutí aeroskopu z přepravního zařízení provedl jeho dezinfekci (při provádění dezinfekce přístrojové techniky je nevyhnutelné postupovat podle návodu výrobce, tzn. používat vhodný typ dezinfekčního prostředku na základě doporučené aktivní látky; v našem případě byl použitý dezinfekční prostředek s nízkým obsahem alkoholu určený pro citlivé materiály – Meliseptol Wipes Sensitive od B. Braun). Po ukončení odběru a před započetím každého dalšího měření provedl pracovník dezinfekci perforované hlavy aeroskopu. Pro každý jednotlivý odběr byl odebrán vzorek o objemu 1 m3. Odebírá se objem 500 l/5 minut (nejvyšší nastavitelný objem aeroskopu), který se pak přepočte na 1 m3. Přístrojová technika byla umístněná na pracovní ploše instrumentačního stolku (místo odběru bylo ve výšce 100 cm nad podlahou).
Inkubace vzorků vnitřního ovzduší probíhala v inkubátoru při teplotě 30 ± 1 °C po dobu 48–72 hod. při použití krevního agaru a při teplotě 25 ± 1 °C po dobu 3–5 dnů při použití Sabouraudova agaru pro kultivační průkaz mikroskopických vláknitých hub. Stanovení kolonií tvořících jednotku (KTJ) bylo provedeno přepočtením KTJ odečtených ze standardní Petriho misky podle Fellerovy statistické konverzní tabulky a následně byl přepočítán počet mikroorganismů na 1 m3. Závěrem byl výsledek kultivačního vyšetření porovnán s doporučenými limity pro mikrobiologickou kontaminaci čistých prostor „za provozu“.
VÝSLEDKY
První kazuistika z roku 2016 demonstrovala vliv vysokého počtu osob během výkonu na operačním sále určeném pro odběr tkání na kvalitu vnitřního ovzduší. U prvního odběru (dne 21. září, 14 : 15 hod), kdy se na sálu pohybovalo 19 osob (7 osob tvořících operační tým, 1 pracovník provádějící odběr a dále studenti) byly v prostoru operačního pole prokázány hraniční limity (10 KTJ / m3) pro třídu čistoty B, kde byl pozitivní nález podmíněně patogenních bakteriálních kmenů Staphylococcus sp. (koaguláza negativní), Streptococcus sp. (viridující) a mikroskopických vláknitých hub. Osoby přítomné na sále měly oblečené jednorázové operační prádlo z netkané textilie, jednorázovou pokrývku hlavy a chirurgické ústenky. Následně byl po konzultaci s vedením Oddělení centrálních operačních sálů upraven režim vstupu studentů na operační sály, tzn. při odběru tkání byl přítomen pouze operační tým (6 osob) a pracovník provádějící odběr. Následné kontrolní odběry vzduchu (9. října, 10 : 00 hod) neprokázaly v daném místě přítomnost bakteriální a mykotické flóry (tab. 1). Z uvedených výsledků vyplývá, že zvýšený počet osob v prostoru operačního sálu představoval vyšší riziko kontaminace vnitřního ovzduší bakteriální a mykotickou flórou.
Druhá kazuistika z roku 2019 demonstruje nezbytnost provádění monitoringu vnitřního ovzduší stanovením množství prachových částic na odběrových operačních sálech, kdy průkaz překročení limitů byl podkladem pro provedení revizního servisu klimatizace a výměny HEPA filtrů (tab. 2).
DISKUSE
Uvedená práce uvádí rizikové faktory vnitřního prostředí operačního sálu, mezi které patří jak chování operačního personálů, tak i technický stav jeho VZT systému, které mohou svými negativními vlivy zapříčinit kontaminaci vnitřního ovzduší operačních sálů [4].
První kazuistika demonstrovala vliv osob přítomných na operačním sále na jeho vnitřní ovzduší (v našem případě vyšší počet osob na operačním sále z důvodu přítomnosti mediků), kdy kultivační vyšetření vzorků vnitřního ovzduší prokázalo kromě přítomnosti podmíněné bakteriální flóry Staphylococcus sp. (koaguláza negativní) a Streptococcus sp. (viridující) i přítomnost mikroskopických vláknitých hub v prostoru operačního pole (pod laminárním prouděním). Přítomnost mikroskopických vláknitých hub v prostorách operačního sálu může být spojená s několika faktory: přítomností osob, teplota, relativní vlhkost vzduchu (více než 60 %) nebo závada na VZT zařízení [5].
Několik studií prokázalo, že počet osob přítomných během chirurgického výkonu do značné míry ovlivňuje počet vzduchem přenášených prachových částic, jejich pohyb vede k opětovnému rozvíření usazených částic a rychlost otevíraní sálových dveří způsobuje zvýšení počtu mikroorganismů. Snížení počtu bakteriální flóry lze docílit správným používáním osobních ochranných pracovních pomůcek (dále jen OOPP) během chirurgického výkonu (tzn. použití vhodných jednorázových oděvů z netkaných textilií, použití dvojích rukavic, správné nošení chirurgických masek, správné krytí vlasů atd.) a správným provedením chirurgického mytí rukou před vstupem na sál [14]. Na přítomnost mikroskopických vláknitých hub v prostorách operačních sálů poukazuje ve své práci i Macedo, který uvádí lidskou přítomnost jako jednu z hlavních příčin, která významně přispívá k jejich produkci [12]. Beldi ve své studii prokázal, že části hlavy personálu, které mohou zůstat během operace odkryté (vlasy, uši), jsou zodpovědné za výrazně vyšší koncentrace bakteriální flóry, než bakteriální flóra uvolňující se z čela nebo obočí. Demonstroval také uvolňování bakteriální flóry z personálu ve vztahu k různým druhům oblečení (tab. 3) [2]. Snížení limitů lze docílit i správným provedením chirurgického mytí rukou před vstupem na sál, použitím dvojích rukavic, správným nošením chirurgických masek, správným krytím vlasů čepicí a použitím jednorázových oděvů z netkaných textilií během chirurgického výkonu [14].
Tab. 3. Vztah oděvu a bakterií 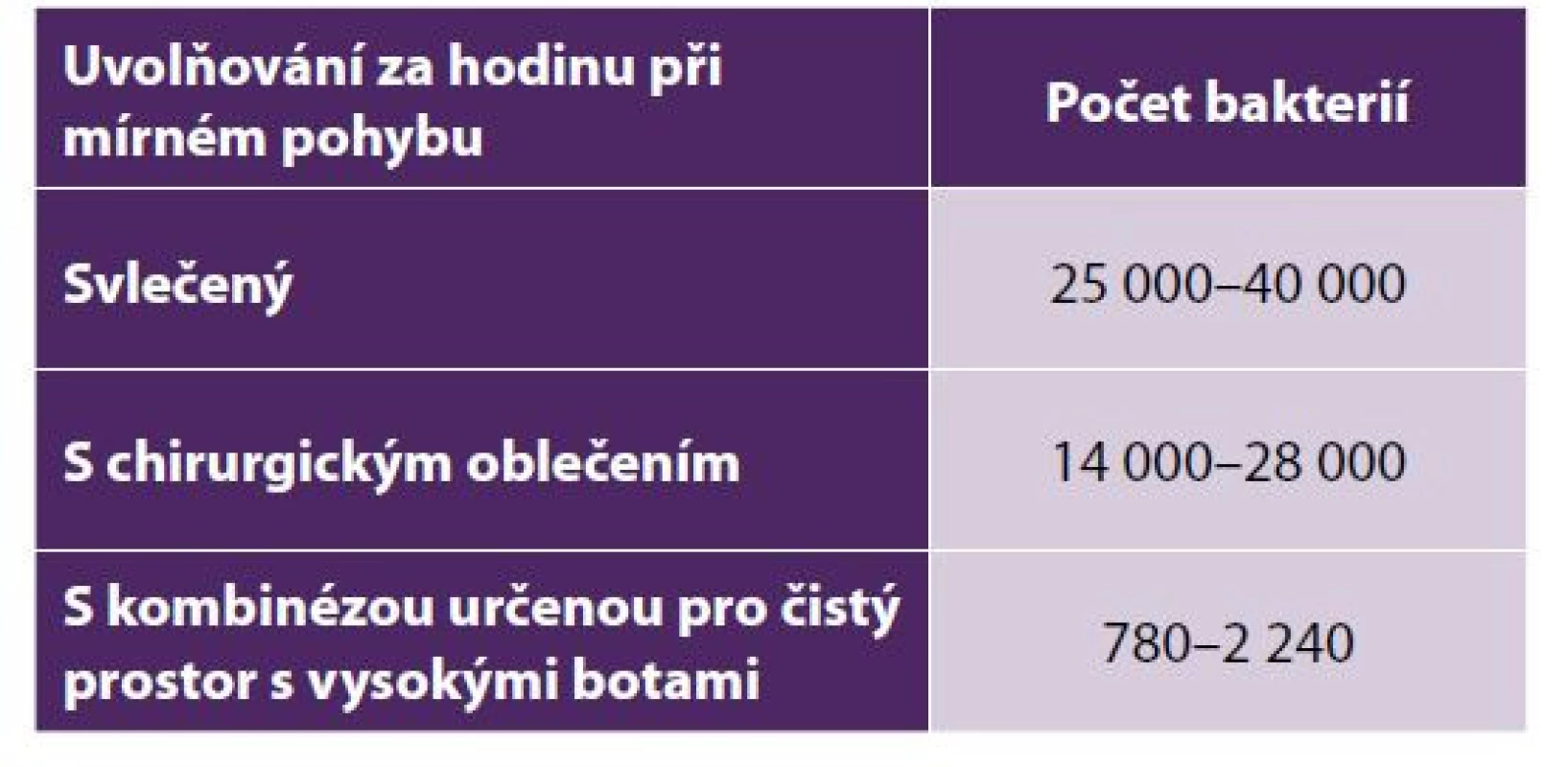
Lze předpokládat, že kontaminace vnitřního ovzduší byla v našem případě zapříčiněná lidskou kontaminací, kterou můžeme připsat nadměrnému počtu osob na operačním sálu. Tomuto jevu je možné se vyhnout systémovým a behaviorálním opatřením, jakým je řádné nošení operačního oděvu a OOPP (operační halena, kalhoty, čepice, chirurgická maska a boty) a omezení zbytečných činností u operačního personálu, které podněcují kontaminaci samotnou, tzn. lidské činnosti, se kterými souvisí i zvýšený pohyb na operačním sálu a zvýšená frekvence otevírání dveří do sálu [8]. Několik studií prokázalo, že zmíněné vnější zásahy, jako je pohyb operačního personálu a otvírání dveří, mohou ovlivnit pole průtoku proudícího filtrovaného vzduchu a objemovou výměnu, což může mít za následek z důvodu přetlaku z přilehlých prostorů, míchání vzduchu a následně může zapříčinit kontaminaci vnitřního ovzduší operačního sálu [3, 9, 15]. Literatura uvádí, že počet otevření dveří se může pohybovat až do 40 otevření jen před započetím chirurgického výkonu (fáze před řezem: dodávky materiálu, papírování, dodatečný příchod personálu) [11, 16, 17]. Je proto nezbytné pochopit, že pohyb dveří má rozsáhly dopad na stávající proudění a čistotu vnitřního ovzduší ve dvou oddělených prostorech [15]. Špatná disciplína chirurgického personálu může výrazně zvýšit riziko vzniku HAI [2].
Kazuistika 2 demonstruje dopad nefunkčnosti filtrů HEPA v laminizátoru operačního sálu, kdy došlo k překročení počtu prachových částic na odběrovém operačním sále. Výměna HEPA filtrů v laminizátoru operačních sálů je prováděná periodicky 1krát za 4 roky, dále podle potřeby (podle funkčnosti filtrů). Pokud během servisu HEPA filtrů, tzn. jejich instalace/ výměny, nebudou dodržována specifická pravidla, která eliminují významnou část kontaminace aerosolem a mikrobiální flórou, může to mít závažný dopad na provoz operačního sálu. Jak ukazují výsledky z dalších různých realizací VZT systému, čistotu daného systému ovlivňuje jak výroba a transport součástí VZT systému, tak i jejich montáž a zejména podmínky této montáže. Opět v tomto procesu sehrává důležitou roli lidský faktor, jehož negativní pracovní návyky a neukázněnost může ovlivnit aseptický režim operačního sálu [19].
Moderní operační sály by měly být vybaveny VZT systémy pro řízení faktorů prostředí sálu, jakými jsou teplota, relativní vlhkost vzduchu a průtok vzduchu. Dále by měly být vybaveny ventilačním systémem (turbulentní proudění s vertikálním nebo horizontálním průtokem a vertikální laminární proudění) se specifickým stupněm filtrace podle definovaných jednotlivých chirurgických výkonů. Většina sálů je vybavena turbulentním prouděním s ventilační filtrací HEPA filtry o účinnosti 80–95 % při odstraňovaní částic ≥ 5 μm. Na operačních sálech používaných pro ortopedické, nitrooční, kostní a kardiochirurgické operace je vnitřní vzduch filtrován HEPA filtry o účinnosti 99,97 % při odstraňovaní částic ≥ 3 μm a větších.
I když doposud neexistuje žádný mezinárodní standard povolené mikrobiální kontaminace vnitřního ovzduší na operačních sálech, přičemž monitorovaní kvality vnitřního ovzduší se doporučuje pro každý operační sál a je často doprovázen i kontrolou počtu částic ve vznosu. Většina evropských zemí má své vlastní standardy: například ve Francii jsou mikrobiologické limity mezi 5 a 20 KTJ/m3, které jsou přísnější než limity ve Velké Británii, tj. 35 KTJ/m3 [14].
Pro měření počtu částic ve vznosu, začalo mnoho zemí využívat technickou normu pro čisté prostory EN ISO 14644: Klasifikace čistoty vzduchu (třídy čistoty ISO 1–9) [6]. Analogicky lze i využít pro hodnocení legislativu Slovenské republiky, tj. limity stanovené v příloze č. 1 k vyhláške č. 553/2007 Z. z., ktorou sa ustanovujú podrobnosti o požiadavkách na prevádzku zdravotníckych zariadení z hľadiska ochrany zdravia [26].
Pro operační sály klasifikované jako tkáňová zařízení (kde dochází k odběru orgánů/tkáně) lze využít vyhlášku č. 422/2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidských tkání a buněk určených k použití u člověka, v návaznosti na požadavky na čisté prostory stanoveny v pokynu VYR-36 a na technickou normu EN ISO 14644-1 [6, 23, 25]. Obdobně tato metodika byla využitá i ve Francii při monitorování vnitřního ovzduší tkáňových zařízení v Montpellier, jak ve své studii poukazuje Louart [10]. V monitoringu kvality vnitřního ovzduší aseptických sálů se využívá limitů GMP (na které odkazuje VYR-36), pro třídu čistoty B (ekvivalent třídy čistoty ISO 5) a C (ekvivalent třídy čistoty ISO 7) [23]. Stejnou klasifikaci tříd čistoty uvádí ve své práci i Rubina [18].
ZÁVĚR
Monitoring vnitřního ovzduší operačních sálů by měl být nezbytnou součástí prevence vzniku a šíření infekcí spojených se zdravotní péčí, podle názoru autorů je potřebné se této oblasti ve zdravotnickém zařízení více věnovat.
Uvedená práce byla prezentovaná pod názvem ,,Monitoring čistých prostor, teorie a praxe“ na Kongresu klinické mikrobiologie, infekčních nemocí a epidemiologie, 14.–16. 11. 2019, Hotel Flora, Olomouc.
Poděkování
Prezentovaná práce byla podpořena fondem Fakultní nemocnice Olomouc (RVO 00098892) a fondem Univerzity Palackého (RVO 61989592).
Do redakce došlo dne 16. 11. 2021.
Do tisku přijato dne 26. 11. 2021.
Adresa pro korespondenci:
Mgr. Lukáš Fedor
Oddělení nemocniční hygieny FNOL
I. P. Pavlova 6
779 00 Olomouc
e-mail: lukas.fedor@fnol.cz
Zdroje
1. Andersen, B. M., Solheim, N. Occlusive scrub suits in operating theaters during cataract surgery: Effect on airborne contamination. Infect. Control Hosp. Epidemiol, 2002, 23, 4, s. 218–220.
2. Beldi, G., Bisch-Knaden, S., Banz, V., Mühlemann, K., Candinas, D. Impact of intraoperative behavior on surgical site infections. Am J Surg, 2009, 198, 2, s. 157–162.
3. Bhattacharya, A., Ghahramani, A., Mousavi, E. The effect of door opening on air-mixing in a positively pressurized room: Implications for operating room air management during the COVID outbreak. J. Build. Eng, 2021, 44, 102900, s. 1–9.
4. Cristina, M. L., Sartini, M., Schinca, E., Ottria, G., Spagnolo, A. M. Operating room environment and surgical site infections in arthroplasty procedures. J. Prev. Med. Hyg, 2016, 57, 3, s. 142 – 148.
5. Dehghani, M., Sorooshian, A., Nazmara, S., Baghani, A. N., Delikhoon, M. Concentration and type of bioaerosols before and after conventional disinfection and sterilization procedures inside hospital operating rooms. Ecotoxicol Environ Saf, 2018, 164, s. 277–282.
6. EN ISO 14644-1 : 1999. Cleanrooms and associated controlled environments – Part 1: Classification of air cleanliness by particle concentration.
7. EN ISO/IEC 17025 : 2005. General requirements for the competence of testing and calibration laboratories.
8. Knobben, B. A. S., Horn, J. R., Mei, H. C., Busscher, H. J. Evaluation of measures to decrease intra-operative bacterial contamination in orthopaedic implant surgery. J Hosp Infect, 2006, 62, 2, s. 174–180.
9. Lee, S., Park, B., Kurabuchi, T. Numerical evaluation of influence of door opening on interzonal air exchange. Build. Environ, 2016, 102, s. 230–242.
10. Louart, B., Charles, C., Nguyen, T. L., Builles, N., Roger, C., Lefrant, J. Y., Vachiery-Lahaye, F., De Vos, J., Couderc, G., Muller, L. Microbial contamination and tissue procurement location: A conventional operating room is not mandatory. An observational study. PloS One, 2019, 14, s. 2–4.
11. Lynch, R. J., Englesbe, M. J., Sturm, L., Bitar, A., Budhiraj, K., Kolla, S., Polyachenko, Y., Duck, M. G., Campbell, D. A. Jr. Measurement of foot traffic in the operating room: implications for infection control. Am. J. Med. Qual, 2009, 24, 1, s. 45–52.
12. Macedo, J. I., Kubota, T. H., Matsumoto, L. S., Giordani, A. T., Takayanagui, A. M. M., Mendes, A. A., et al. Air quality in a hospital environment. Safety and Security Engineering, 2013, 134, s. 737–747.
13. Montagna, M. T., Rutigliano, S., Trerotoli, P., Napoli, C., Apollonio, F., D’Amico, A., De Giglio, O., Diella, G., Lopuzzo, M., Marzella, A., Mascipinto, S., Pousis, C., Albertini, R., Pasquarella, C., D’Alessandro, D., Serio, G., Caggiano G. Evaluation of Air Contamination in Orthopaedic Operating Theatres in Hospitals in Southern Italy: The IMPACT Project. Int J Environ Res Public Health, 2019, 16, 19, s. 1–2.
14. Mora, M., Mahnert, A., Koskinen, K., Pausan, M. R., Oberauner - Wappis, L., Krause, R., Perras, A. K., Gorkiewicz, G., Berg, G., Moissl-Eichinger, Ch. Microorganisms in Confined Habitats: Microbial Monitoring and Control of Intensive Care Units, Operating Rooms, Cleanrooms and the International Space Station. Front. Microbiol, 2016, 7,1573, s. 2–7.
15. Mousavi, E. S., Grosskopf, K. R. Airflow patterns due to door motion and pressurization in hospital isolation rooms. Sci. Technol. Built Environ, 2016, 22, 4, s. 379–384. 16. Mousavi, E. S., Jafarifiroozabadi, R., Bayramzadeh, S., Joseph, A., San, D. An observational study of door motion in operating rooms. Build. Environ, 2018, 144, s. 502–507.
16. Parikh, S. N., Grice, S. S., Schnell, B. M., Salisbury, S. R. Operating room traffic: is there any role of monitoring it? J. Pediatr. Orthoped, 2010, 30, 6, s. 617–623.
17. Rubina, A. Aerosolové a mikrobiální mikroklima čistého prostoru. In Sborník přednášek z konference SNEH, Brno: 2019 [23.10.2021]. Dostupné na www:
18. Rubina, A. Metodika postupu realizace VZT v čistých prostorách [online]. Brno: Ústav TZB, 2019 [2021-08-09]. Dostupné na www: . ISSN 1801-4399.
19. Sartini, M., Spagnolo, A. M., Panatto, D., Perdelli, F., Cristina, M. L. Improving environmental quality in an operating room: clinical outcomes and economic implications. J. Prev. Med. Hyg, 2013, 54, 2, s. 75–79.
20. Spagnolo, A. M., Ottria, G., Amicizia, D., Perdelli, F., Cristina, M. L. Operating theatre quality and prevention of surgical site infections. J. Prev. Med. Hyg, 2013, 54, 3, s. 131–137.
21. Standardní operační postupy pro vyšetřování mikroorganismů v ovzduší a pro hodnocení mikrobiologického znečištění ovzduší ve vnitřním ovzduší. J. SZU, 2002, 1. ISSN 0862-5956.
22. Státní ústav pro kontrolu léčiv. Čisté prostory, VYR-36. J. SUKL, [online] 2008 [2021-08-09]. Dostupné na www: . ISSN 1210-9460.
23. Vonci, N., De Marco, M. F., Grasso, A., Spataro, G., Cevenini, G., Messina, G. Association between air changes and airborne microbialcontamination in operating rooms. J. Infect. Public Health, 2019, 12, 6, s. 827–830.
24. Vyhláška č. 422/2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidských tkání a buněk určených k použití u člověka. Sbírka zákonu České republiky, částka 138.
25. Vyhláška č. 553/2007 Z. z., ktorou sa ustanovujú podrobnosti o požiadavkách na prevádzku zdravotníckych zariadení z hľadiska ochrany zdravia. Zbierka zákonov Slovenskej republiky č. 553/2007, čiastka 231.
Štítky
Hygiena a epidemiologie Hyperbarická medicína Pracovní lékařství
Článek VZDĚLÁVACÍ AKCE IPVZ
Článek vyšel v časopisePracovní lékařství
Nejčtenější tento týden
2021 Číslo 3-4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- V ČR chybí specializovaná péče o pacienty s nervosvalovým onemocněním
- Historický milník v renoprotekci − účinnost kombinace trandolapril + verapamil ve studii BENEDICT
-
Všechny články tohoto čísla
- Bilancování v pracovním lékařství
- Monitoring vnitřního ovzduší operačních sálů v praxi ve zdravotnickém zařízení terciárního typu
- Respiračné ochorenia u pracovníkov exponovaných kovoobrábacím kvapalinám
- Přehled metod tvorby, adaptace, implementace a evaluace doporučených postupů ve veřejném zdravotnictví
- Očkování proti covidu-19 na Klinice pracovního lékařství ve Fakultní nemocnici Plzeň
- Kazuistika – (ne)profesní syndrom karpálního tunelu
- Tularemie jako nemoc z povolání
- VZDĚLÁVACÍ AKCE IPVZ
- Pracovní lékařství
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Monitoring vnitřního ovzduší operačních sálů v praxi ve zdravotnickém zařízení terciárního typu
- Tularemie jako nemoc z povolání
- Kazuistika – (ne)profesní syndrom karpálního tunelu
- Respiračné ochorenia u pracovníkov exponovaných kovoobrábacím kvapalinám
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání