-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaChronická rinosinusitida s nosními polypy a Staphylococcus aureus
Chronic Rhinosinusitis with Nasal Polypi and Staphylococcus aureus
Chronic rhinosinusitis with nasal polypis is a disease of unknown etiology. Bacterial infection is apparently one of etiological factors participating in etiopathogenesis. The information about bacteria helps the clinician to gain a new and interesting view of the chronic rhinosinusitis. Bacteria possess exceptionally good ability of adaptation and, under certain conditions, can create community, where they collaborate and can modify their phenotype; moreover, pathogenic bacteria have various factors of virulence, which affect the host and enable a protection against immune reactions of the host. All these properties participate in the development of chronic bacterial infection caused by Staphylococcus aureus, which has been the most often proved pathogen in patients with chronic rhinosinusitis.
Key words:
Staphylococcus aureus, biofilm, chronic rhinosinusitis.
Autoři: Z. Kuchynková 1; O. Nyč 2; H. Pácová 1,3; Z. Jandová 1
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN Motol, Praha Katedra otorinolaryngologie IPVZ, Praha ; přednosta prof. MUDr. J. Betka, DrSc. Ústav klinické mikrobiologie 2. LF UK, FN Motol, Praha 1; přednosta MUDr. O. Nyč Ústav pro histologii a embryologii 1. LF UK, Praha 2; přednosta doc. MUDr. P. Hach, DrSc. 3
Vyšlo v časopise: Otorinolaryngol Foniatr, 56, 2007, No. 4, pp. 220-226.
Kategorie: Souborné referáty
Souhrn
Chronická rinosinusitida s nosními polypy je onemocnění neznámé etiologie. V etiopatogenezi se asi jako jeden z více faktorů může uplatňovat bakteriální infekce. Poznatky o bakteriích umožňují klinikovi nový a zajímavý pohled na chronickou rinosinusitidu. Bakterie mají vynikající schopnost adaptace, za určitých okolností jsou schopny vytvářet společenství, ve kterém spolupracují, a mohou měnit fenotyp. Patogenní bakterie mají celou řadu faktorů virulence, které poškozují hostitele a umožňují ochranu proti imunitním reakcím. Všechny tyto vlastnosti se podílejí na rozvoji chronické bakteriální infekce způsobené Staphylokokem aureem, který je nejčastěji prokázaným patogenem u nemocných s chronickou rinosinusitidou.
Klíčová slova:
Staphylococcus aureus, biofilm, chronická rinosinusitida.ÚVOD
Chronická rinosinusitida je onemocnění definované jako zánět nosu a vedlejších nosních dutin. Chronické rinosinusitidy (CHRS) dělíme na CHRS bez nosních polypů, s nosními polypy a alergické fungální rinosinusitidy. Etiologie CHRS je neznámá, podle konsenzu z roku 2004 (21) jsou některými možnými příčinami zánětu perzistující infekce vázané na biofilm alergie, dispozice respirační sliznice, Staphylococcus aureus (STA) jako potenciální producent superantigenů, plísně nebo metabolické změny (například syndrom kyseliny acetylsalicylové). Tyto faktory se mohou vzájemně kombinovat.
Klinické projevy bakteriální infekce jsou u ně-kterých nemocných s CHRS a nosními polypy velmi časté nebo i trvalé, stejně tak kultivační nálezy zlatých stafylokoků jsou u těchto nemocných často opakovaně pozitivní. STA se může podílet na zánětu sliznice jako původce chronické infekce s tvorbou biofilmu a/nebo jako zdroj superantigenu/ů. STA nemusí pronikat do sliznice, kolonizuje pouze povrchy a vyvolává slizniční zánět aktivací imunitních mechanismů (reakcí) směřujících k jeho eliminaci.
Znalosti o vlastnostech bakterií obecně a vlastnostech STA nám pomohou lépe porozumět možnému významu STA v etiopatogenezi chronické rinosinusitidy. Náš souborný referát shrnuje základní poznatky o adaptaci bakterií, o mechanismech patogenity, o významu biofilmu především ve vztahu k STA.
BAKTERIE A JEJICH SCHOPNOST ADAPTACE
Bakterie jsou jednobuněčné organismy schopné za vhodných podmínek samostatného růstu a dělení. Z biologického hlediska jsou to prokaryotní organismy, které ve srovnání s eukaryotními buňkami vykazují jisté významné odlišnosti. Jejich buněčné jádro není ohraničeno vůči cytoplazmě jadernou membránou a nedělí se mitoticky, dále cytoplazma neobsahuje mitochondrie ani chloroplasty a sedimentační koeficient ribozomů se liší od eukaryotických buněk (26). Součástí bakteriální buňky je buněčná stěna, která určuje morfologii a současně zvyšuje odolnost vůči zevním vlivům. Bakterie často obsahují extrachromozomální úseky DNA, plazmidy, které mohou být nositeli informace ovlivňující schopnost příslušného mikroorganismu uplatnit se v patogenezi konkrétní infekce. Například kódují produkci různých toxinů, adhezinů a dalších faktorů virulence, stejně jako mechanismy rezistence k antibiotikům (19).
Bakterie jsou sice považovány ve srovnání s mnohobuněčnými organismy za jednoduché, mnohdy primitivní mikroorganismy, ale z jejich dlouhodobé existence na zemském povrchu (podle současných odhadů více než 3,5 miliardy let) a prakticky univerzálního rozšíření pramení jejich téměř neomezená adaptabilita. Jak dlouhodobá evoluční přizpůsobivost, tak i rychlá aktuální adaptace jsou podmíněny jednak mutacemi, kdy krátká generační doba umožňuje rychlé uplatnění mutací zvýhodněných mikroorganismů, jednak ještě efektivnější horizontální směnou genů, umožňující výměnu až 30 % veškerých genetických informací, kterými disponují (7). Podstatný je i vertikální přenos genů, tedy předávání genetické informace dceřiným buňkám. Kromě jiného právě tyto adaptační schopnosti mohou hrát klíčovou roli v etiologii a patogenezi infekcí ve smyslu výměny genů kódujících rozmanité faktory virulence. Také rychlost s jakou se v bakteriálních společenstvech šíří odolnost vůči antibiotikům je dramatickým důkazem vysoké efektivity bakteriální komunikační sítě. Díky těmto vlastnostem jsou bakterie schopny přizpůsobení na podstatné změny v prostředí v průběhu několika let, zatímco vyšší organismy potřebují pro takovouto adaptaci několik tisíc roků (7).
Existence biofilmu, kterému je v posledních letech věnována v medicíně stále větší pozornost v souvislosti s různými typy hlavně chronických infekcí, je příkladem komplexně organizovaného společenství mikroorganismů s vysoce efektivní kooperací, značnou přizpůsobivostí a odolností.
BIOFILM
Biofilm je definován jako organizované heterogenní seskupení bakterií, které jsou v jeho rámci schopné komunikace a efektivní spolupráce. Adheruje k přirozeným nebo pro organismus cizorodým povrchům a vyjma vlastních bakteriálních buněk je až z 98 % tvořen mezibuněčnou matrix, která se skládá z exopolysacharidů, nukleových kyselin a bílkovin. Biofilm představuje vysoce odolný způsob existence mikrobiální populace na rozdíl od planktonické (pohyblivé) formy, kdy jsou mikroorganismy volně přítomny (například v extracelulární tekutině, hostitelské buňce). Organizovanosti celé struktury přispívá komunikační systém, tzv. „quorum sensing“, neboli signalizace mezi bakteriálními druhy na molekulární úrovni. Jeho účelem je výměna informací, které například v závislosti na vnějších podmínkách umožňují aktivovat různé obranné mechanismy, faktory virulence, regulovat metabolismus, rychlost množení apod. (30).
Biofilm se vytvoří za vhodných podmínek na každém povrchu smáčeném tekutinou. Vyskytuje se jak na anorganických tak na organických látkách. Jestliže pohybující se (planktonické) buňky hladovějí, přichytí se svými aktivními molekulami na nějaký pevný povrch, který skýtá dostatečný přísun živin. Podle této funkce se těmto molekulám říká adheziny (29). V lékařství se problém biofilmu stal velmi aktuální zejména v souvislosti s používáním implantátů jako jsou intravenózní katetry, chlopenní náhrady, cévní stenty, shunty a kloubní náhrady. Jakýkoliv implantát tedy představuje riziko tvorby biofilmu a chronické infekce. Kromě tendence formování biofilmu na cizorodém materiálu se biofilm může tvořit i na přirozených površích, kde se pak může uplatnit zejména v etiologii a udržování chronických infekcí. K místům nejčastějšího výskytu biofilmu patří sliznice dýchacích cest, sliznice urogenitálního systému, výjimkou není chronické postižení tkání pohybového aparátu (osteomyelitida a artritida), vegetace na chlopních apod. Biofilm bývá příčinou chronické infekce, jejíž příznaky nejsou tak zřetelně vyjádřeny jako při akutní infekci (29). Podle některých pramenů je více než 50 % všech léčených infekcí v souvislosti s výskytem biofilmu. Medicínsky závažný je fakt, že chronické infekce vázané na biofilm jsou vesměs refrakterní na konzervativní léčbu.
Bakterie tedy existují v zásadě ve dvou formách, z nichž jedna je planktonická a druhá přisedlá. Bakterie v planktonické formě se jednotlivě vznášejí v tekutině, jsou mobilní, ale málo odolné. Bakterie přisedlé žijí ve společenství nazývaném biofilm, jsou přichyceny na nějakém povrchu a jsou odolné proti zevním vlivům. Asi 80 % bakterií se vyskytuje ve formě přisedlé, jen asi 20 % jsou bakterie planktonické. Bakterie přecházejí z jedné formy do druhé podle okolních podmínek. Planktonické bakterie z tekutiny se mohou adhezí reverzibilně přichytit k povrchu. Za vhodných podmínek některé bakterie začnou produkovat polysacharid, který umožňuje intercelulární fixaci. Vznikají vrstvy bakterií fixovaných jak k sobě navzájem, tak k povrchu. Přichycení bakterií k povrchu epitelu je za normálních podmínek velmi obtížné, neboť respirační epitel je pokryt sekretem obsahujícím antimikrobiální látky a je neustále očišťován mukociliární clearencí. Přichycení bakterie je za normálních podmínek zřejmě velmi nepravděpodobné. Vlivem multifaktoriálních vlivů s narušením lokálních obranných mechanismů sliznice, včetně složení bakteriální flóry, dochází k vytváření biofilmu. Dosud není také zcela vyjasněno, jaké jsou spouštěcí mechanismy a regulátory přechodu planktonicky rostoucích bakterií do stadia biofilmu. K mikroorganismům, o kterých je známo, že se mohou podílet na tvorbě biofilmu, patří například Pseudomonas aeruginosa, řada zástupců enterobakterií, legionely, některé druhy ústních streptokoků, listerie, Staphylococcus aureus, některé koaguláza negativní stafylokoky, kandidy a mnoho dalších. Průmyslově se zatím nepodařilo vyrobit látku, jejíž povrch by byl odolnější proti tvorbě biofilmu než jsou zdravé lidské sliznice.
Biofilm je tvořen trojrozměrnými strukturami složenými z matrix a společenství bakterií. Uvnitř biofilmu proudí tekutina, která přináší živiny a odvádí metabolické produkty. Na schématu 1 je biofilm tvořený čtyřmi věžovitými útvary, ve kterých jsou bakterie. Mezi těmito strukturami jsou kanály označené šipkou, kterými proudí tekutina. Velikost struktur je řádově v mikrometrech a lze je sledovat konfokálním mikroskopem nebo elektronovým skenovacím mikroskopem. Obě tyto metody umožňují sledovat 3D obraz, ale konfokální mikroskopie má výhodu v tom, že umožní vyšetření v reálném čase, a to na živých preparátech. U tohoto vyšetřování dochází k prokrájení vzorku nikoliv mechanicky, ale pouze opticky, takže tkáň není nutno před vyšetřením destruovat řezáním.
Schéma 1. Trojdimenzionální struktury biofilmu. 
Biofilm je problematický z hlediska rutinní bakteriologické diagnostiky; jeho kultivační vyšetření může být falešně negativní, protože se při odběru nemusí zdařit získat životaschopné, kultivačně prokazatelné bakterie. Pro vyšší pravděpodobnost průkazu bakterií se proto někdy používá sonifikace cizorodých materiálů, např. umělých kloubů nebo katétrů, s cílem rozrušení biofilmu a uvolnění mikrobů, další možností jsou speciální barvící techniky, případně molekulární metody s průkazem mikrobiální DNA.
Biofilm je tedy společenství bakterií, které můžeme v jistém smyslu přirovnat ke kolonii mravenců nebo roji včel. Všechna takováto společenství projevují swarm inteligenci, což je kolektivní chování nezávislých, poměrně jednoduchých prvků systému, které není centrálně řízeno a vychází z interakcí mezi jednotlivými prvky systému navzájem a mezi těmito prvky a prostředím. Tato společenství představují decentralizovaný systém schopný řešení problémů (6). Od dob Kochova objevu se tradovalo, že bakterie jsou malé, jednoduché a jsou původci infekčních onemocnění. Poměrně nový je poznatek, že bakterie jsou schopny komunikace a koordinace svého chování, takže fungují jako vícebuněčný organismus (2, 20, 31). Tyto schopnosti vyplývají z jejich inteligence (typu swarm intelligence). Inteligenci u bakterií můžeme přirovnat i k sociální inteligenci lidí, což jsou schopnosti, které jim umožňují vést úspěšný sociální život na základě chápání identity sebe a skupiny, chápání společných cílů, schopnosti sociálních interakcí a schopnosti akce pro vlastní a kolektivní dobro (18). Termín sociální inteligence byl dříve užíván pouze v souvislosti s člověkem. Pro ostatní organismy, včetně bakterií, je preferován termín inteligence roje (swarm intelligence).
Pro sociální inteligenci je důležitá schopnost komunikace na základě lingvistických schopností. Lingvistika se zabývá studiem jazyka a ten je definován jako systém signálů, které kódují a dekódují informace. Také lingvistika se dříve zabývala pouze komunikací mezi lidmi, ale od dob dešifrování kódu v DNA se pravidla lingvistiky uplatňují i v biologii. Lingvistické schopnosti mají i bakterie (18, 3), které mezi sebou komunikují, jsou schopny kódovat a dekódovat informace pomocí jednodušších chemických signálů vysílaných do prostředí a pomocí DNA. Bakterie jsou schopny zjistit, kolik jich je. Tato schopnost se nazývá quorum sensing. Bakterie do svého okolí uvolňuje chemickou látku, se stoupajícím počtem bakterií stoupá i koncentrace této látky v prostředí a bakterie jsou potom schopny detekovat koncentraci této látky a tím i počet okolních bakterií. Tuto informaci potom využijí pro kolektivní rozhodování. Bakterie komunikují nebo-li kódují a dekódují informace výměnou DNA, kterou si mohou v biofilmu předávat, a tak mezi sebou šířit například rezistenci na antibiotika.
Kolektivní rozhodování bakterií se projevuje koordinací chování. Ve vhodný okamžik začnou všechny bakterie, které spolu komunikovaly, produkovat extracelulární polymer a z něj vytvářet trojrozměrné struktury biofilmu, nebo všechny začnou exprimovat geny pro faktory virulence.
Biofilm chrání bakterie před imunitními mechanismy makroorganismu i před antibiotiky. Biofilm přichycený k povrchu sliznice nemůže již být eliminován mukociliární clearancí. Mukopolysacharid, který tvoří větší část biofilmu než vlastní bakterie, brání kontaktu s imunitními buňkami i s rozpustnými látkami uplatňujícími se v imunitních reakcích.
Bakterie v biofilmu mají nižší nároky na živiny i kyslík a mají exprimované jiné geny než bakterie planktonické (3). Tím se vysvětluje jejich zvýšená odolnost na antibiotika (17, 32) a fakt, že výsledky antibiotické terapie neodpovídají výsledkům předpokládaným na základě vyšetření bakterií na živných půdách v laboratoři. Je možno in vitro určit minimální biofilm inhibiční koncentrací antibiotika (16), která je mnohdy mnohonásobně vyšší než běžně určovaná minimální inhibiční koncen-trace pro bakterie vyskytující se planktonicky. Biofilm je rovněž vhodným prostředím pro šíření rezistence na antibiotika horizontálním transferem genů (14).
Biofilm může působit jako faktor virulence u chronických infekcí. V horních dýchacích cestách byl biofilm prokázán u chronické otitidy, adenoitidy (22) a chronické rinosinusitidy (13, 24, 27).
V práci týkající se chronické rinosinusitidy s nosními polypy byla zjištěna korelace mezi schopností bakterií tvořit biofilm a nepříznivým průběhem onemocnění po funkční endoskopické chirurgii (4). V 80 % vzorků sliznice odebraných při chirurgii pro chronickou rinosinusitidu byl prokázán biofilm, který nebyl blíže specifikován mikrobiologicky (27). Jedním z nejčastěji s tvorbou biofilmu uváděným bakteriálním druhem je STA (15).
STAPHYLOCOCCUS AUREUS - jeho obecné vlastnosti a vztah k chronické rinosinusitidě s nosními polypy
Staphylococcus aureus je nepohyblivý fakultativně anaerobní gram pozitivní kok. Na krevním agaru vyrůstá v makroskopicky charakteristických žlutavých koloniích s hemolýzou na půdách s obsahem beraní krve (obr. 1). V mikroskopickém obraze se shlukuje do útvarů připomínajících hrozny (staphylé - hrozen). V rodu Staphylococcus je zahrnuto kolem 35 druhů, z nichž v otorinolaryngologii, stejně v jako ostatních medicínských oborech, je nejvýznamnější právě Staphylococcus aureus. Stafylokoky se obecně rozlišují podle produkce plazmakoagulázy na: koagulázu pozitivní, kam v humánní medicíně patří především STA, a koagulázu negativních stafylokoků, z nichž je velká většina z nich kožními a slizničními komenzály. Z této skupiny je nejznámějším druhem Staphylococcus epidermidis. Význam koagulázy negativních stafylokoků narůstá hlavně v souvislosti s infekcemi katetrů a aplikací dalších cizorodých materiálů do makroorganismu.
Obr. 1. Makroskopický obraz kolonií tvořených zlatým stafylokokem. 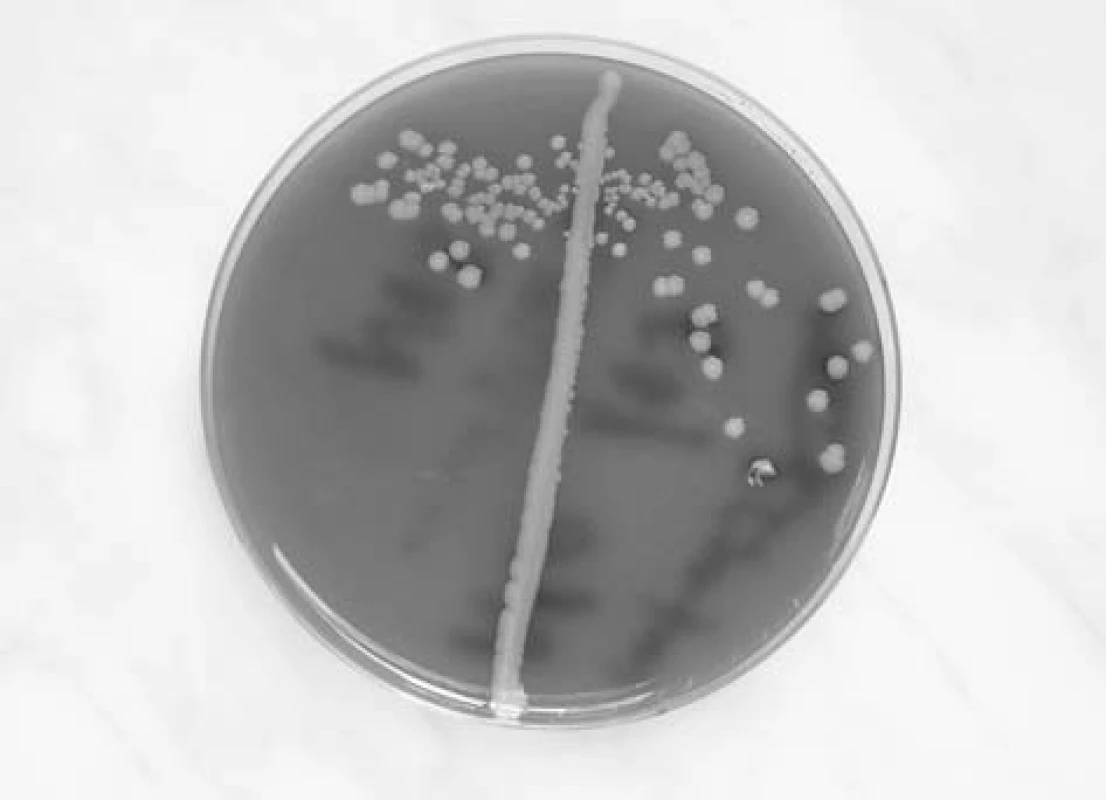
Identifikace stafylokoků pro běžné klinické potřeby je založena na mikroskopickém nálezu, makroskopickém vzhledu kolonií a na biochemických vlastnostech. Přesnější identifikace umožňují molekulární metody, včetně průkazů genů virulence (produkce toxinů, hemolyzinů apod.)
STA je nejvýznamnějším humánním oportunním patogenem právě také pro svoji značnou přizpůsobivost a odolnost vůči zevnímu prostředí, stejně jako díky rozsáhlému arzenálu faktorů patogenity a virulence, které mohou být různou měrou exprimovány. Svůj význam hraje přibývající počet multirezistentích kmenů podstatně limitujících možnosti účinné antibiotické terapie. U jedné konkretní bakterie je možná exprese a represe genů v závislosti na podmínkách zevního i vnitřního prostředí. Exprese genu se projeví ve fenotypu syntézou proteinů, které mohou působit jako faktory virulence (5). U STA byly prokázány exprese jiných genů u planktonických forem a jiných u formy vázané na komplexní strukturu biofilmu (25). U STA začíná tvorba biofilmu expresí speciálních ica (intercellular adhesion) genů, které řídí produkci polysacharidového intercelulárního adhezinu (polysacharid intercellular adhesin, PIA) (11, 12). Většina kmenů STA tyto geny obsahuje (1), ale jen některé bakterie tyto geny exprimuj, a to v závislosti na okolních podmínkách (12, 23).
STA je považován za hlavního původce nemocničních i komunitních infekcí. Jejich spektrum zahrnuje pestrou symptomatologii od benigních kožních forem až po fulminantně probíhající systémové infekce. Relativně časté je také trvalé nebo přechodné bezpříznakové nosičství STA, které je nejčastější v nosním vchodu, perineu, axile a na kůži.
Správná interpretace kultivačního nálezu STA na sliznicích je proto zcela zásadní a musí být vztažena ke konkrétní situaci a pacientovi s tím, že je nutné odlišit klinicky významný nález vyžadující léčbu, od prosté, vesměs klinicky nevýznamné kolonizace.
Mnoho stafylokokových infekcí, včetně osteomyelitidy, endokarditidy a infekcí cizorodého materiálu v organismu, je vázáno právě na produkci biofilmu (33). Existence „quorum sensing“ systému je u STA kódována na akcesorní agr gen, který prokazatelně zvyšuje virulenci sekrecí peptidů kaskádovitě ovlivňujících různé regulační mechanismy jako transkripce promotorů, produkce toxinů, hemolyzinů, povrchových adhezinů a proteinu A (33).
STA má geny pro celou řadu faktorů virulence, které za vhodných podmínek exprimuje, což se projeví syntézou určitých látek. STA je nejčastějí vykultivovaný mikroorganismus u nemocných s chronickou rinosinusitidou (9). Pravděpodobně ne všechny faktory virulence hrají stejně významnou úlohu v rozvoji respirační infekce. Pro její vznik a rozvoj je nutná adherence bakterie na sliznici, která je pokryta sekretem obsahujícím kromě jiného i peptidy s antibakteriálním účinkem a je neustále očišťována kmitavým pohybem řasinek. Dalším předpokladem infekce je schopnost STA uniknout fagocytóze, jako jednomu z hlavních obranných protistafylokokových mechanismů.
Je prokázáno, že Staphylococcus aureus, vykultivovaný z oblasti nosu a VDN, má schopnost vytvářet biofilm (4, 28 ). Bylo zjištěno, že STA může přežívat v nosní sliznici intraepiteliálně a ve žlázách (8). Intracelulárně je STA chráněn před imunitními reakcemi i před ATB a vytváří tak rezervoár, ze kterého se může infekce reaktivovat.
Faktory virulence STA:
- Protizánětlivé molekuly působící proti defenzinům. Defenzivy jsou antimikrobiální látky v sekretu na povrchu epitelu.
- Proteiny umožňující přichycení ke tkáni hostitele a jeho kolonizaci. STA může produkovat proteiny, které se váží na fibronektin epiteliálních a endoteliálních epitelů, fibrinogen v krevním koagulu a obnažený kolagen poškozených tkání.
- Proteiny podporující invazi do tkáně. Mezi tyto proteiny patří leukocidin, staphylokináza a hyaluronidáza.
- Proteiny chránící před imunitními reakcemi. Protein A je povrchový protein STA, který se váže na Fc oblast imunoglobulinu G. Takto obráceně navázaný, a tím neaktivní imunoglobulin, se nemůže zúčastnit imunitních reakcí a tak je STA chráněn před opsonizací a fagocytózou, protože obě tyto reakce vyžadují spolupráci s imunoglobulinem G. Mikrokapsula je tvořena povrchovým polysacharidem, který brání před fagocytózou. Kataláza, superoxid dismutáza zlepšují schopnosti STA přežívat ve fagocytech, protože neutralizují primární destrukční mechanismy uvnitř fagocytu.
- Membrány poškozující toxiny. Mezi tyto toxiny patří hemolyzin, leukotoxin, leukocidin (který poškozuje polymorfonukleární leukocyty), A toxin (poškozuje membrány, především destiček a monocytů, může způsobit septický šok).
- Exotoxiny. Exotoxiny poškozují tkáň hostitele a způsobují příznaky onemocnění; patří mezi ně enterotoxin, TSST-1 a exfoliativní toxin. Enterotoxin existuje v šesti sérotypech, jeho uvolnění v gastrointestinálním traku způsobuje průjem a zvracení, systémové uvolnění je příčinou syndromu toxického šoku (Toxic shock syndrom, TSS) asi u 25 % nemocných s tímto postižením. TSST-1 (Toxic shock syndrom toxin) je příčinou syndromu toxického šoku u zbývajících 75 % nemocných se syndromem. Jak enterotoxin tak TSST mají superantigenní aktivitu. Superantigen (SAg) stimuluje nespecificky T lymfocyty, protože je schopen se navázat přímo na class II major histokompatibilní komplex antigen prezentujících lymfocytů. Tímto způsobem dochází k stimulaci jednoho z pěti T lymfocytů na rozdíl od specifické stimulace, kdy je to pouze jeden z 10 000. Superantigen tak může uvolnit z lymfocytů velké množství cytokinů, které jsou příčinou šoku. V etiopatogenezi CHRS bakteriální SAg způsobí aktivaci T lymfocytů, produkci cytokinů a lokální produkci IgE a je tak příčinou zánětu. STA může syntetizovat exfoliativní toxin. Imunomodulační efekt v patogenezi CHRS podporuje přímá detekce některých stafylokokových SAg přímo v homogenátu postižené sliznice, stejně tak i zvýšené hladiny superantigen specifických IgE u pacientů s nosními polypy (10).
Pro rozvoj a chronicitu infekce má dále význam vrozená nebo získaná rezistence STA na antimikrobiální léky. V posledních letech nabývá stále většího rozšíření a významu STA s rezistencí k stabilním protistafylokokovým penicilinům (methicillin, oxacillin..). Jedná se o tzv. MRSA (methicillin resistant Staphylococcus aureus) kmeny, závažná je skutečnost, že tento fenotyp znamená rezistenci k celé velké skupině beta laktamů a navíc je obvykle sdružen s rezistencí k dalším skupinám antibiotik jako makrolidům, linkosamidům, fluorochinolonům a aminoglykozidům.Obtížná eradikace těchto ať už nosičských nebo klinicky významných kmenů ze sliznic je jedním z faktorů napomáhajících k chronicitě infekce, stejně jako potenciální možnosti tvorby biofilmu a intracelulárního přežívání.
ZÁVĚR
Člověk žije ve složitém ekosystému s mikroorganismy, kterých je v lidském těle více než jeho vlastních buněk. Makroorganismy jsou velice dobře vybaveny na život v prostředí s obrovským množstvím potenciálních mikrobiálních patogenů. Bakterie na druhé straně mají zase celou řadu mechanismů, které jim umožňují v makroorganismu přežít. Chronická stafylokoková infekce dýchacích cest je výsledkem interakce imunitních reakcí hostitele a působení virulentních faktorů STA, kdy rovnováha je v tomto případě porušena ve prospěch STA. Protože STA může být na nosní sliznici komensálem, je příčinou vzniku chronické infekce pravděpodobně oslabení nebo dočasné selhání obranných mechanismů. U imunokompetentních nemocných by to mohla být porušená mukociliární clearence anebo lokálně změněné imunitní reakce.
Vztah mezi infekčními původci a patogenezí chronické rhinosinusitidy s nosními polypy není doposud jednoznačně objasněn, ale narůstající počet informací v imunologii a molekulární biologii bakteriální buňky umožňuje lepší porozumění patogenezi celého procesu s velmi pravděpodobnou účastí STA. Od těchto poznatků se odvíjí i strategie zaměřená na co nejefektivnější léčebné postupy.
Například poznatek o schopnosti bakterií tvořit biofilm může ovlivnit indikaci k chirurgickému řešení u nemocných s chronickou rinosinusitisou a bakteriální infekcí. Biofilm, který lze ovlivnit antibiotiky jen omezeně, je možno chirurgicky odstranit i s postiženou sliznicí.
Nově získané znalosti o bakteriích umožňují stanovení nových potencionálních cílů pro antimikrobiální terapii, například potlačení adhezivních schopností bakterií nebo přerušení jejich komunikace, tedy zablokování některých faktorů virulence umožňujících adaptaci, včetně vytváření biofilmu a produkce toxinů.
Došlo 14. 5. 2007
Práce byla podporována grantem NR8440-3/2005 IGA MZ ČR.
MUDr. Zdenka Kuchynková
Klinika ORL a chirurgie hlavy a krku FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: Z.Kuchynkova@gmail.com
Zdroje
1. Arciola, C., Baldassarri, L., Montanaro, L.: Presence of icaA and icaD genes and slime production in a collection of staphylococcal strains from catheter-associated infections. J. Clin. Microbiol., 39, 2001, 6, s. 2151-2156.
2. Bassler, B. L.: Small talk. Cell-to-cell communication in bacteria. Cell, 17, 2002, 109(4), 2002, pp. 421-424. Review.
3. Becker, P., Hufnagle, W., Peters, G.: Detection of different gene expression in biofilm-forming versus planktonic populations of Staphylococcus aureus using micro-representatial difference analysis. Appl Environ Microbiol., 67, 2001, s. 2958-2965.
4. Bendouah, Z., Barbeau, J., Hamad, W. A., Desrosiers, M.: Biofilm formation by Staphylococcus aureus and Pseudomonas aeruginosa is associated with an unfavorable evolution after surgery for chronic sinusitis and nasal polyposis. Otolaryngol. Head Neck Surg., 134, 2006, 6, s. 991-996.
5. Bera, A., Biswas, R., Herbert, S., Gotz, F.: The presence of peptidoglycan O-acetyltransferase in various staphylococcal species correlates with lysozyme resistance and pathogenicity. Infect Immun., 74, 2006, 8, s. 4598-4604.
6. Bonabeau, E., Dorigo, M., Theraulaz, G.: Swarm inteligence from natural to artificial systems. Oxford University Press, 1999, s. 6, 307 pages.
7. Capra, F.: Tkáň života. ACADEMIA, Praha, 2004.
8. Clement, S., Vaudaux, P., Francois, P., Schrenzel, J., Huggler, E., Kampf, S., Chaponnier, C., Lew, D., Lacroix, J. S.: Evidence of an intracellular reservoir in the nasal mucosa of patients with recurrent Staphylococcus aureus rhinosinusitis. J. Infect. Dis., 15; 192(6), 2005, s. 1023-1028.
9. Coffey, C. S., Sonnenburg, R. E., Melroy, C. T., Dubin, M. G., Senior, B. A.: Endoscopically guided aerobic cultures in postsurgical patients with chronic rhinosinusitis. Am. J. Rhinol., 20, 2006, 1, s. 72-76.
10. Conley, D. B.: Superantgens and chronic rhinosinusitis: Skewing of T-cell receptor V-distributions in polyp-derived CD4 and CD8. American Journal of Rhinolgy, 20, 2006, s. 534-539.
11. Cramton, S. E., Gerke, C., Schnell, N. F., Nichols, W. W., Gotz, F.: The intercellular adhesion (ica) locus is present in Staphylococcus aureus and is required for biofilm formation. Infect. Immun., 67, 1999, 10, s. 5427-5433.
12. Cramton, S. E., Ulrich, M., Gotz, F., Doring, G.: Anaerobic conditions induce expression of polysaccharide intercellular adhesin in Staphylococcus aureus and Staphylococcus epidermidis. Infect Immun., 69, 2001, 6, s.. 4079-4085.
13. Cryer, J., Schipor, I., Perloff, J.: Evidence of bacterial biofilms in human chronic sinusitis. ORL J. Otorhinolaryngo. Relat. Spec., 66, 2004, s. 155-158.
14. Fux, C. A., Costerton, J. W., Stewart, P. S., Stoodley, P.: Survival strategies of infectious biofilms. Trends Microbiol., 13, 2005, 1, s. 34-40. Review.
15. Gotz, F.: Staphylococcus and biofilms. Mol. Microbiol., 43, 2002, 6, s. 1367-1378. Review.
16. Hola, V., Ruzicka, F., Tejkalova, R., Votava, M.: Determination of sensitivity of biofilm-positive forms of microorganisms to antibiotics. Klin. Mikrobiol. Infekc. Lek., 10, 2004, 5, s. 218-222.
17. Hoyle, B., Costeron, J.: Bacterial resistance to antibiotics: the role of biofilms. Prog. Drug. Res., 37, 1991, s. 91-105.
18. Jacob, B. E., Becker, I., Shapira, Y., Levine, H.: Bacterial linguistic communication and social intelligence. Trends Microbiol., 12, 2004, 8, s. 366-372.
19. Lochmann, O.: Základy antimikrobné terapie. TRITON, Praha, 1999.
20. McNab, R., Lamont, R. J.: Microbial dinner-party conversations: the role of LuxS in interspecies communication. J. Med. Microbiol., 52, 2003, (Pt 7), s. 541-545. Review.
21. Meltzer, E. O., Hamilos, D. L., Hadley, J. A., Lanza, D. C., Marple, B. F., Nicklas, R. A., Bachert, C., Baraniuk, J., Baroody, F. M., Benninger, M. S., Brook, I., Chowdhury, B. A., Druce, H. M., Durham, S., Ferguson, B., Gwaltney, J. M., Kaliner, M., Kennedy, D. W., Lund, V., Naclerio, R., Pawankar, R., Piccirillo, J. F., Rohane, P., Simon, R., Slavin, R. G., Togias, A., Wald, E. R., Zinreich, S. J.; American Academy of Allergy, Asthma and Immunology (AAAAI); American Academy of Otolaryngic Allergy (AAOA); American Academy of Otolaryngology--Head and Neck Surgery (AAO-HNS); American College of Allergy, Asthma and Immunology (ACAAI); American Rhinologic Society (ARS): Rhinosinusitis: establishing definitions for clinical research and patient care. J. Allergy Clin. Immunol., 114, 2004, 6, (Suppl), s. 155-212. Review.
22. Post, J., Stoodley, P., Hall-Stoodley, L.: The role of biofilms in otolaryngologic infections. Curr Opin Otolaryngol Head Neck Surg., 12, 2004, s. 185-190.
23. Rachid, S., Ohlsen, K., Wallner, U., Hacker, J., Hecker, M., Ziebuhr, W.: Alternative transcription factor sigma(B) is involved in regulation of biofilm expression in a Staphylococcus aureus mucosal isolate. J. Bacteriol., 182, 2000, 23, s. 6824-6826.
24. Ramadan, H. H., Sanclement, J. A., Thomas, J. G.: Chronic rhinosinusitis and biofilms. Otolaryngol Head Neck Surg., 132, 2005, 3, s. 414-417.
25. Resch, A., Rosenstein, R., Nerz, C., Gotz, F.: Differential gene expression profiling of Staphylococcus aureus cultivated under biofilm and planktonic conditions. Appl Environ Microbiol., 71, 2005, 5, s. 2663-2676.
26. Rosypal, S.: Úvod do molekulární biologie. Čtvrté vydání, Brno.
27. Sanclement, J. A., Webster, P., Thomas, J., Ramadan, H. H.: Bacterial biofilms in surgical specimens of patients with chronic rhinosinusitis. Laryngoskope, 115, 2005, 4, s. 578-582.
28. Sanderson, A. R., Leid, J. G., Hunsaker, D.: Bacterial biofilms on the sinus mucosa of human subjects with chronic rhinosinusitis. Laryngoskope, 116, 2007, 7, s. 1121-1126.
29. Schindler, J. : Mikrobiální biofilm. Vesmír, 80, 2001, 4, s. 203-206.
30. Teresa, R. et al.: Bacterial quorum senzing in pathogenic relationships. Infection and immunity, 68, 2000, s. 4839-4849.
31. Waters, C. M., Bassler, B. L.: Quorum sensing: cell-to-cell communication in bacteria. Annu Rev. Cell Dev. Biol., 21, 2005, s. 319-346. Review.
32. Xu, K., McFeters, G., Stewart, P.: Biofilm resistace to antimicrobial agents. Mikrobiology, 146, 2000, s. 547-549.
33. Yarwood, J. M.: Qourum senzing in Staphylococcus aureus biofilms. Journal of bacteriology, 186, 2004, s. 1838-1850.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2007 Číslo 4- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosine nově bez indikačních a preskripčních omezení
- Klinický obraz cytomegalové infekce
- HPV v dýchacích cestách a papilomatóza hrtanu
-
Všechny články tohoto čísla
- Endonazální dakryocystorinostomie – jak najít slzný vak?
- Beta hemolytické streptokoky sérologické skupiny C a akutní tonzilofaryngitida (Epidemiologická studie)
- Kochleární a kmenová implantace u dospělých – výsledky
- Prognostické faktory chronického středoušního zánětu 1. část - předoperační faktory
- Prognostické faktory chronického středoušního zánětu 2. část - způsob chirurgické léčby
- Chronická rinosinusitida s nosními polypy a Staphylococcus aureus
- Amyloidóza horních dýchacích a polykacích cest
- Bolest v oblasti hlavy a krku - artritidy temporomandibulárního kloubu
- Lucja Freyová – životopis
- Zápis ze schůze výboru ORL společnosti
- K devadesátým narozeninám primáře MUDr. Josefa Maňáka
- MUDr. Luboš Voldřich, DrSc., osmdesátníkem
- AUTORSKÝ REJSTŘÍK
- VĚCNÝ REJSTŘÍK
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Beta hemolytické streptokoky sérologické skupiny C a akutní tonzilofaryngitida (Epidemiologická studie)
- Bolest v oblasti hlavy a krku - artritidy temporomandibulárního kloubu
- Chronická rinosinusitida s nosními polypy a Staphylococcus aureus
- Amyloidóza horních dýchacích a polykacích cest
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



