-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaImplementácia imunoterapie do liečby neuroblastómu – skúsenosti jedného centra s podávaním a manažovaním nežiaducich účinkov dinutuximabu
Implementation of immunotherapy into the treatment of neuroblastoma – single center experience with the administration of dinutuximab and management of its adverse effects
Background: Neuroblastoma is the most common extracranial solid tumour of childhood with extremely heterogeneous biological and clinical behaviour. Despite advances in its treatment, the long-term prognosis of patients with a high-risk and relapsed neuroblastoma remains poor. The implementation of immunotherapy into the treatment protocols has the potential to improve it. Dinutuximab, a chimeric monoclonal antibody, leads to the apoptosis of tumour cells through binding to the GD2 receptor. The article aim is to present the first experience of our centre with dinutuximab treatment.
Patients and methods: In 2018–2019, we administered 31 cycles of dinutuximab to seven patients. Five patients with high-risk neuroblastoma received dinutuximab in the first line, in two patients with relapse, dinutuximab was administered in the second line of treatment. To evaluate the toxicity of the treatment, the nursing records of patients during immunotherapy were retrospectively analysed.
Results: Two patients treated with dinutuximab in the first line are in complete remission, three patients achieved a partial response. Both patients with relapsed neuroblastoma were diagnosed with a second relapse after immunotherapy and died of disease progression. The treatment tolerance was acceptable in most patients – in six patients adverse events were managed with adequate supportive care. These were mainly symptoms of capillary leak syndrome, pain and hypersensitivity reactions. In one patient, the treatment was discontinued due to severe neurotoxicity.
Conclusion: Dinutuximab has a proven benefit in the eradication of the minimal residual disease in the treatment of neuroblastoma. Immunotherapy is currently the standard for first-line treatment of high-risk neuroblastoma. Its role in the treatment of relapsed neuroblastoma is a subject of several ongoing studies as well as the optimization of therapeutic regimens. Dinutuximab administration is associated with a considerable risk of severe adverse reactions, so the treatment belongs to the hands of an experienced paediatric oncology centre.
Keywords:
dinutuximab – anti-GD2 – monoclonal antibody – neuroblastoma – residual disease
Autoři: MUDr. Achbergerová Monika 1; MUDr. Hederová Stanislava 2; MUDr. Mikesková Martina 2; MUDr. Husáková Kristína 2; MUDr. Hrašková Andrea 1; doc. MUDr. Kolenová Alexandra, Ph.D. 2
Působiště autorů: Klinika detskej hematológie a onkológie NÚDCH, Bratislava, Slovenská republika 1; Detská onkologická klinika LF UK a DFNsP, Bratislava, Slovenská republika 2
Vyšlo v časopise: Klin Onkol 2020; 33(5): 372-378
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2020372Souhrn
Východiská: Neuroblastóm je najčastejší solídny extrakraniálny nádor detského veku s extrémne heterogénnym biologickým a klinickým správaním. Napriek pokrokom v liečbe je dlhodobá prognóza pacientov s vysokorizikovým neuroblastómom a s relapsom ochorenia nepriaznivá. Potenciál zlepšiť ju prináša implementácia imunoterapie do liečebných protokolov. Dinutuximab, chimerická monoklonálna protilátka, vedie k apoptóze nádorových buniek prostredníctvom väzby na GD2 receptor. Cieľom článku je prezentácia prvých skúseností nášho centra s liečbou dinutuximabom.
Súbor a metódy: V rokoch 2018–2019 sme podali 7 pacientom 31 cyklov dinutuximabu. Piatim pacientom s vysokorizikovým neuroblastómom bol dinutuximab podávaný v 1. línii, u dvoch pacientov s relapsom ochorenia bol dinutuximab podávaný v rámci 2. línie liečby. Na vyhodnotenie toxicity liečby boli retrospektívne analyzované ošetrovateľské záznamy pacientov počas podávania imunoterapie.
Výsledky: U dvoch pacientov liečených dinutuximabom v 1. línii pretrváva po ukončení imunoterapie kompletná remisia, traja pacienti dosiahli parciálnu odpoveď. Obom pacientom s relapsom neuroblastómu bol po ukončení imunoterapie diagnostikovaný druhý relaps a exitovali na progresiu ochorenia. Tolerancia liečby bola u väčšiny pacientov primeraná – u 6 pacientov boli nežiaduce účinky zvládnuté podpornou liečbou. Išlo najmä o prejavy capillary leak syndrómu, bolesti a hypersenzitívne reakcie. U jedného pacienta bola liečba prerušená pre závažnú neurotoxicitu.
Záver: Dinutuximab má preukázateľný benefit v eradikácii minimálnej reziduálnej choroby pri liečbe neuroblastómu. Imunoterapia je v súčasnosti štandardom prvolíniovej liečby pacientov s vysokorizikovým neuroblastómom. Jej úloha v liečbe pacientov s relapsom ochorenia je predmetom viacerých prebiehajúcich štúdií, rovnako ako aj optimalizácia terapeutických schém v oboch indikáciách. Liečba dinutuximabom je spojená s rizikom rozvoja širokej palety nežiaducich účinkov, preto jeho podávanie patrí do rúk skúseného centra detskej onkológie.
Klíčová slova:
dinutuximab – anti-GD2 – monoklonálna protilátka – neuroblastóm – reziduálna choroba
Úvod
Neuroblastóm je malígny neuroendokrinný nádor vychádzajúci z prekurzorových buniek sympatiku. Ide o najčastejší solídny extrakraniálny nádor detského veku, predstavuje 7–10 % detských malignít a je zodpovedný za 15 % úmrtí v detskej onkológii [1]. Je to ochorenie vyskytujúce sa najmä u malých detí – 90 % prípadov je diagnostikovaných pred 5. rokom života. Medián veku v čase diagnózy je 19 mesiacov, celkové rozmedzie veku v čase diagnózy je však široké – od prípadov in utero až po výnimočné prípady diagnostikované u adolescentov a mladých dospelých [2–4]. Z pohľadu biologického a klinického správania je pre neuroblastómy charakteristická extrémna heterogenita – od nádorov, ktoré spontánne vyzrejú či regredujú aj bez akejkoľvek liečby, až po vysoko agresívne nádory rezistentné na intenzívnu multimodálnu liečbu [1]. Stratifikácia pacientov sa riadi medzinárodným stagingovým systémom (International Neuroblastoma Risk Group Staging System – INRGSS), v ktorom sú zohľadňované faktory, ktoré štatisticky signifikantne ovplyvňujú prognózu pacientov: štádium ochorenia, vek v čase diagnózy, histológia a stupeň diferenciácie nádorových buniek, N-MYC status, DNA ploidia, štrukturálne chromozomálne aberácie [1,5]. Na základe INRGSS sú pacienti zaradení do nízkeho (low risk – LR), stredného (intermediate risk – IR) alebo vysokého rizika (high risk – HR). Od stratifikácie do rizikovej skupiny sa odvíja intenzita liečby a prognóza pacientov [6,7]. Liečba pacientov s HR neuroblastómom patrí k najagresívnejším a najdlhšie trvajúcim liečebným schémam v rámci detskej onkológie. Vzhľadom na nepriaznivú dlhodobú prognózu HR pacientov aj napriek agresívnej multimodálnej liečbe je snaha výskumu zameraná práve na hľadanie nových terapeutických možností a optimalizáciu liečby v tejto skupine pacientov. Modalitou, ktorá sa ukázala ako efektívna v zlepšení prognózy pacientov s HR neuroblastómom, je imunoterapia. Do štandardného klinického používania sa dostala liečba dinutuximabom, monoklonálnou protilátkou namierenou proti GD-2 receptoru. Táto liečba je indikovaná v udržiavacej fáze liečby v 1. línii u tých pacientov s HR neuroblastómom, ktorí po predchádzajúcej multimodálnej liečbe dosiahli aspoň parciálnu odpoveď [8–10]. Liečba dinutuximabom je spojená s rizikom rozvoja širokej palety nežiaducich účinkov rôzneho stupňa závažnosti a jeho podávanie patrí do rúk skúseného a edukovaného centra detskej onkológie. Cieľom nášho článku je retrospektívna analýza prvých skúsenosti s podávaním dinutuximabu a manažovaním nežiadúcich účinkov na Klinike detskej hematológie a onkológie (KDHaO) v Bratislave.
Súbor pacientov
V období rokov 2017–2019 sme na KDHaO v Bratislave diagnostikovali neuroblastóm u 24 pacientov. Kompletnú chirurgickú resekciu bez potreby ďalšej liečby podstúpilo 5 pacientov, 19 pacientov podstúpilo liečbu rôznej intenzity podľa stratifikácie: do nízkeho rizika bolo zaradených 6 pacientov, do stredného rizika 8 pacientov a do vysokého rizika 5 pacientov. Okrem pacientov, ktorí boli diagnostikovaní v našom centre, postúpili časť liečby, vrátane imunoterapie, na KDHaO v Bratislave aj dva pacienti s HR neuroblastómom, ktorí boli iniciálne diagnostikovaní a liečení v Košiciach. V uvedenom období sme diagnostikovali relaps ochorenia u troch pacientov. Liečbu dinutuximabom sme na KDHaO v Bratislave začali podávať v júni roku 2018. Spolu sme v rokoch 2018–2019 podali 7 pacientom 31 cyklov dinutuximabu.
Metodika
Retrospektívna analýza medicínskych a ošetrovateľských záznamov pacientov počas podávania dinutuximabu.
Dinutuximab bol podávaný v dávke 10 mg/m2/deň v kontinuálnej 10-dňovej infúzii, pričom celá liečba u jedného pacienta pozostáva z piatich 28-dňových cyklov. Okrem dinutuximabu bola pacientom podávaná komplexná podporná liečba: hydratácia, profylaktická liečba bolesti (opiátová analgézia, nesteroidné analgetiká-antipyretiká, profylaxia neuropatickej bolesti), antihistaminiká, antiemetická profylaxia. Pacienti boli počas celej liečby intenzívne monitorovaní a pri nekomplikovanom priebehu bola postupne podporná liečba deeskalovaná (redukcia intravenóznej hydratácie, analgetík). Dva týždne pred začiatkom imunoterapie, počas nej a dva týždne po jej skončení bolo kontraindikované podávanie kortikosteroidov, imunoglobulínov a inej imunosupresívnej a imunomodulačnej liečby, tieto boli podávané len pri rozvoji závažnej toxicity s cieľom jej zvládnutia.
Výsledky
Dinutuximab v 1. línii liečby
Piatim pacientom (dvom chlapcom a trom dievčatám) s HR neuroblastómom bol dinutuximab podávaný v postkonsolidačnej fáze 1. línie. Priemerný vek pacientov v čase diagnózy bol 2,4 roka (1,1 – 4,2 roka). Všetci pacienti mali histologicky verifikovaný zle diferencovaný neuroblastóm so štrukturálnymi chromozomálnymi aberáciami, dva pacienti mali amplifikovaný protoonkogén N-MYC. V čase diagnózy mali štyri pacienti diseminované ochorenie, u jedného pacienta išlo o lokalizované štádium ochorenia. Pacienti boli liečení podľa protokolu HR-NBL1.5/SIOPEN. Všetci pacienti pred začiatkom imunoterapie absolvovali multimodálnu liečbu: indukčná chemoterapia, ± second look operácia, myeloablatívna chemoterapia s autológnou transplantáciou periférnych kmeňových buniek, rádioterapia na lôžko primárneho tumoru a ďalšie aktívne ložiská. Po uvedenej liečbe boli dva pacienti v kompletnej remisii, traja pacienti dosiahli veľmi dobrú parciálnu odpoveď. Imunoterapiu ukončili s podaním plných dávok štyri pacienti, u jednej pacientky bola liečba prerušená na 3. deň podávania 1. cyklu pre rozvoj závažnej neurotoxicity. Po ukončení imunoterapie u jedného pacienta pretrváva kompletná remisia, traja pacienti dosiahli parciálnu odpoveď a pokračujú ďalších modalitách liečby. Kompletná remisia pretrváva aj u pacientky, u ktorej bola imunoterapia prerušená pre neurotoxicitu (tab. 1).
Tab. 1. Liečba dinutuximabom v 1. línii u pacientov s vysokorizikovým neuroblastómom. 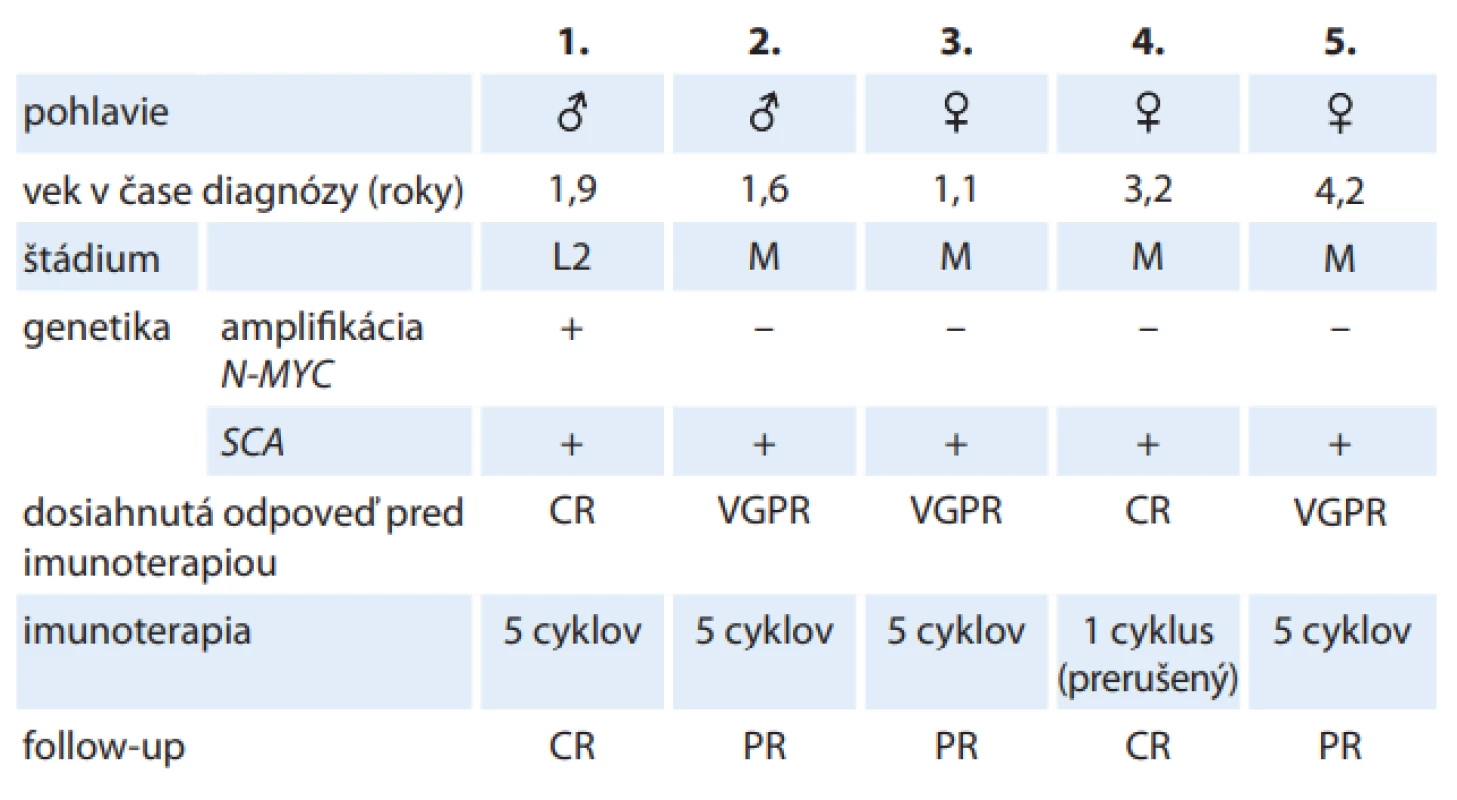
CR – kompletná remisia, L2 – lokalizovaný inoperabilný nádor, M – metastatické štádium, PR – čiastočná odpoveď, SCA – štrukturálne chromozomálne aberácie spojené s agresívnym správaním (strata 1p a 11q, zisk 17q), VGPR – veľmi dobrá čiastočná odpoveď, Dinutuximab v 2. línii liečby
V rámci liečby 2. línie sme dinutuximab podávali dvom pacientom s histologicky verifikovaným zle diferencovaným neuroblastómom, s neamplifikovaným N-MYC. Pacientka č.1 mala v čase diagnózy 3,9 roka a v prvej línii bola stratifikovaná do stredného rizika a liečená podľa protokolu European Low and Intermediate Risk Neuroblastoma, Study Group 8. V čase recidívy mala 5,1 roka, a mala diagnostikované diseminované štádium ochorenia s metastatickým postihnutím skeletu. Pacientka č. 2 mala v čase diagnózy 8,3 roka, bola stratifikovaná do vysokého rizika a liečená podľa protokolu HR-NBL1.5/SIOPEN. V čase recidívy mala 9,8 roka, recidíva bola lokoregionálna s ložiskom v retroperitoneu. V rámci druholíniovej liečby bolo obom pacientkam podaných 6 cyklov chemoterapie (3x ICE – ifosfamid, karboplatina, etoposid; 3× TVD – topotekan, vinkristín, doxorubicin); následne absolvovali 2 cykly terapeutického metajodobenzylguanidínu s podaním rádiosenzitizéru (topotekan) a podporu autológnymi periférnymi kmeňovými bunkami. Pacientke č. 1, ktorá bola v prvej línii liečená ako IR, bola podaná myeloablatívna chemoterapia (režim busulfan/melfalan) s autológnou transplantáciou periférnych kmeňových buniek. Pred začiatkom imunoterapie boli obe pacientky v kompletnej remisii. Dinutuximab bol podaný v plných dávkach. Pacientka č. 1 bola po ukončení imunoterapie v kompletne remisii, avšak 9 mesiacov od ukončenia imunoterapie sa potvrdila 2. recidíva základného ochorenia. U pacientky č. 2 sa potvrdila 2. recidíva už pri prešetrení v čase po ukončení imunoterapie. Obe pacientky zomreli na progresiu ochorenia (tab. 2).
Tab. 2. Liečba dinutuximabom u pacientov s recidívou neuroblastómu 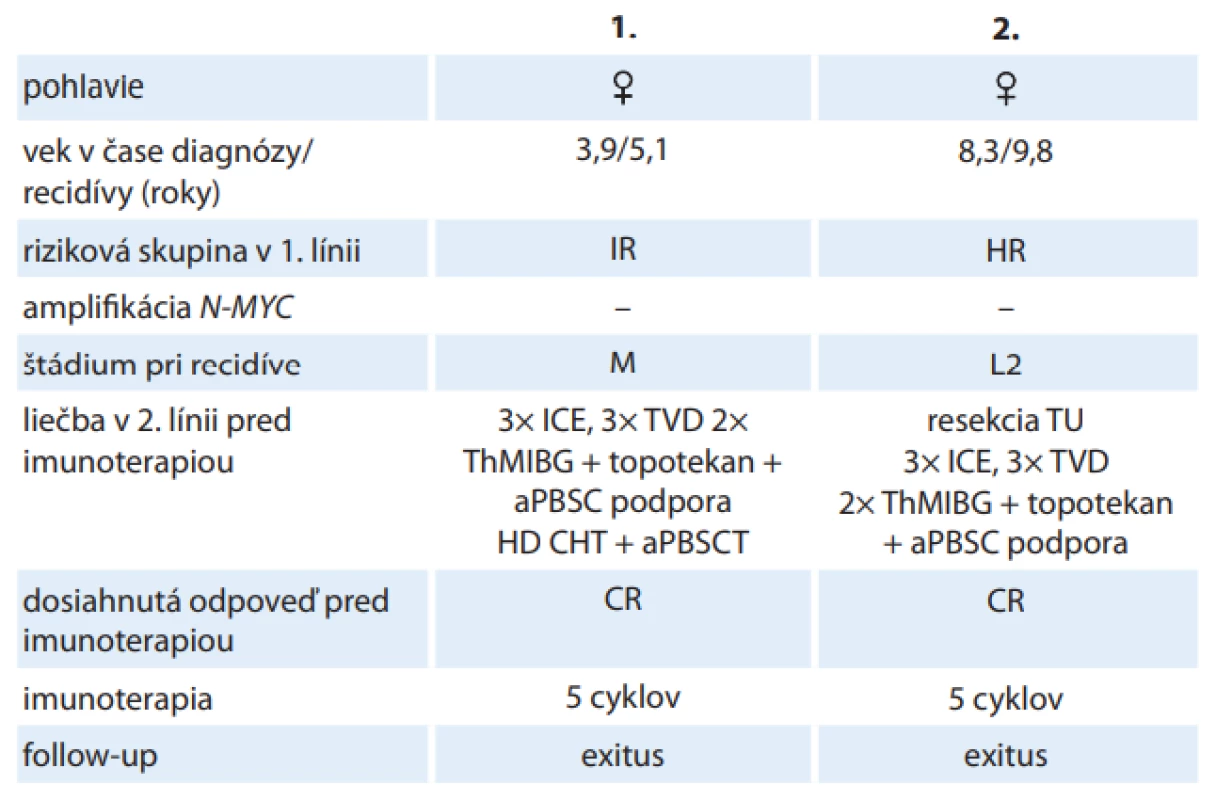
aPBSC – autológne periférne kmeňové bunky, aPBSCT – transplantácia autológnych periférnych kmeňových buniek, CR – kompletná remisia, HD-CHT – vysokodávková chemoterapia, HR – vysoké riziko, ICE – ifosfamid/karboplatina/etoposid, IR – stredné riziko, L2 – lokalizovaný inoperabilný nádor, M – metastatické štádium, MIBG – metajodobenzylguanidín, TVD – topotekan/vinkristín/doxorubicin, ThMIBG – terapeutický MIBG Tolerancia liečby
Tolerancia liečby bola u väčšiny našich pacientov primeraná – u 6 pacientov sa vyskytli vedľajšie účinky, ktoré sme zvládli podpornou liečbou (optimalizácie hydratácie, kyslík, posilnenie analgézie, antihistaminiká). U jednej pacientky bola liečba prerušená pre neurotoxicitu. Najčastejšie sme pozorovali prejavy capillary leak syndrómu, hypersenzitívne reakcie a bolesti. Najzávažnejším toxickým účinkom bola neurotoxicita, ktorá sa rozvinula v priebehu 1. cyklu liečby. V klinickom obraze sa objavil rýchlo progredujúci cerebelárny syndróm, ktorý bol dôvodom pre okamžité prerušenie cyklu a rozhodnutie ďalej v liečbe dinutuximabom nepokračovať. Po liečbe imunoglobulínmi a kortikoidmi došlo k úplnému odozneniu prejavov neurotoxicity. Z laboratórnych prejavov toxicity sme najčastejšie pozorovali eleváciu markerov zápalu, známky hepatopatie, hypoalbuminémiu a pokles parametrov krvného obrazu (tab. 3). Všetci pacienti však boli pred imunoterapiou ako intenzívne predliečení kombináciou liečebných modalít, čo pravdepodobne modifikovalo prejavy toxicity (najmä laboratórne – hepatopatiu, pokles parametrov krvného obrazu). Klinické aj laboratórne prejavy toxicity sa najčastejšie vyskytovali v 1. cykle, s ďalšími cyklami klesal ich výskyt aj závažnosť. U pacientov, u ktorých boli prvé dva podávané cykly bez významnejších komplikácií, sme od 3. cyklu podávali liečbu prostredníctvom elastomerickej pumpy. Vďaka tomu bola u niektorých pacientov možná domáca liečba s dennými kontrolami v nemocnici (obr. 1). Nevyhnutnou podmienkou domácej liečby bola dôsledná edukácia rodičov a zdržiavanie sa na miestach s rýchlou dostupnosťou do nemocnice.
Obr. 1. Podávanie liečby elastomerickou pumpou (umiestnenou v ruksaku) v domácom prostredí. 
Tab. 3. Najčastejšie prejavy toxicity dinutuximabu pozorované na Klinike detskej hematológie a onkológie v Bratislave. 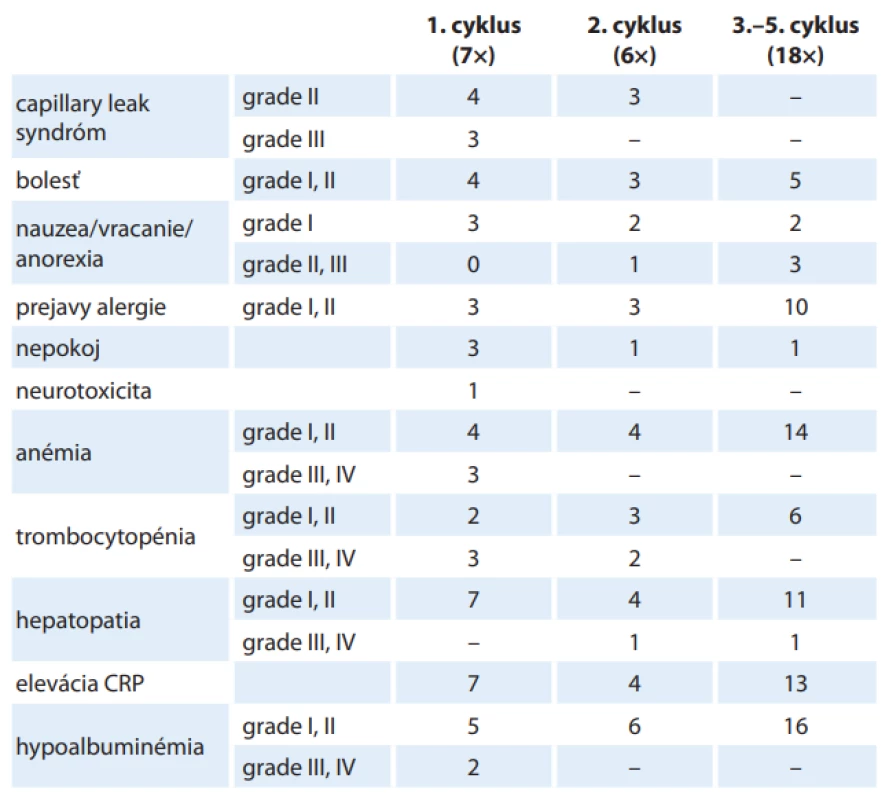
CRP – C-reaktívny proteín Diskusia
Heterogenita klinického správania neuroblastómu je podmienená stupňom diferenciácie nádorových buniek a prítomnosťou špecifických genetických aberácií asociovaných s agresívnym správaním nádoru, rezistenciou na liečbu a potenciálom rekurencie ochorenia (amplifikácia protoonkogénu N-MYC, mutácie v ALK géne, štrukturálne aberácie chromozómov 1p, 11q, 17q) [11,12]. Napriek tomu, že sa skúmali viaceré environmentálne faktory ako možné rizikové faktory vzniku neuroblastómu, priama kauzálna súvislosť nebola potvrdená a etiológia neuroblastómu ostáva, ako u väčšiny detských malignít, neznáma [13–15]. Vo väčšine prípadov ide o sporadický výskyt ochorenia, len v približne 1–2 % prípadov majú pacienti pozitívnu rodinnú anamnézu na výskyt neuroblastómu [16]. Klinický obraz neuroblastómu môže byť veľmi pestrý – v závislosti od lokality primárneho nádoru a rozsahu ochorenia ho tvorí variabilná kombinácia lokálnych a celkových príznakov (tab. 4) [1,2,17]. V liečbe nízkorizikových pacientov sa uplatňuje najmä resekcia nádoru, príp. observácia s ponechaním nádoru alebo jeho rezidua (nádory s priaznivými biologickými charakteristikami nemajú tendenciu metastázovať). Chemoterapia sa podáva pacientom, u ktorých lokalizácia nádoru spôsobuje závažné komplikácie spôsobené lokalitou alebo veľkosťou nádoru (napr. kompresiu miechy pri intraspinálnom prerastaní nádoru, obštrukciu gastrointestinálneho traktu alebo respiračný distres pri výraznej hepatomegálii). Liečba pacientov v strednom riziku pozostáva z kombinácie chemoterapie, resekcie nádoru a v niektorých prípadoch aj rádioterapie a biodiferenciačnej liečby 13-cis-retinovou kyselinou [1,6]. Liečba pacientov s vysokorizikovým neuroblastómom je jednou z najagresívnejších a najdlhších terapeutických schém v detskej onkológie. Pozostáva z intenzívnej indukcie chemoterapiou, konsolidácie myeloablatívnou chemoterapiou s následným prevodom autológnych kmeňových buniek, lokálnej liečby (resekcia, rádioterapia) primárneho ložiska, príp. ďalších ložísk, ktoré po indukcii vykazujú aktivitu, a udržiavacej liečby, ktorej cieľom je eradikovať minimálnu reziduálnu chorobu (biodeferenciačná liečba, imunoterapia) [1,7,18]. Vo všeobecnosti platí, že prognóza sa zhoršuje so stúpajúcim vekom v čase diagnózy (najlepšiu prognózu majú deti diagnostikované v 1. roku života), s prítomnosťou genetických aberácií spojených s agresívnym správaním a pri diseminovanom ochorení. V skupine LR pacientov dosahuje 5-ročné celkové prežívanie (overall survival – OS) > 95 %, pri IR je to 90–95 %; pri HR neuroblastóme 5-ročné OS dosahuje len približne 40 % [12,19]. V čase diagnózy spĺňa kritériá na zaradenie do HR približne polovica pacientov [1].
Tab. 4. Najčastejšie klinické prejavy neuroblastómu. 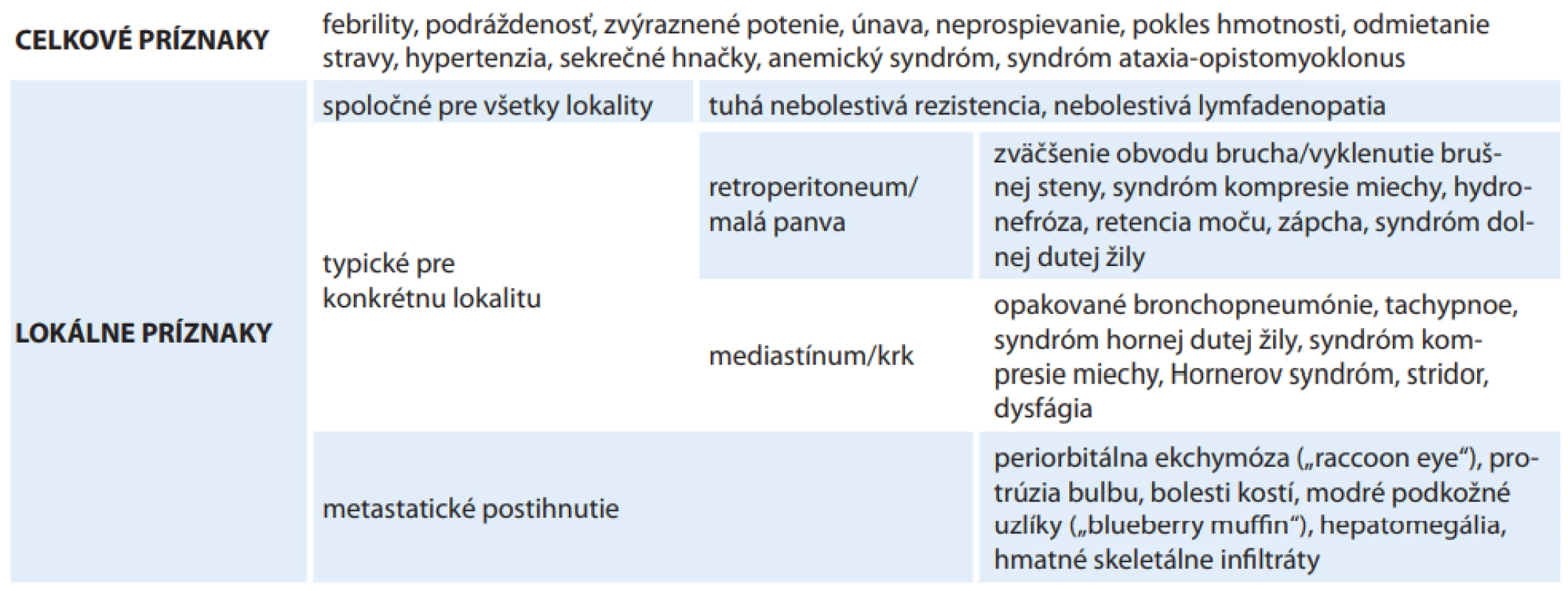
Imunoterapia
Do štandardného klinického používania sa dostala liečba monoklonálnou protilátkou namierenou proti GD-2 receptoru. Ide o membránový disialogangliozid s vysokou expresiou na povrchu neuroblastómových buniek (nachádza sa na povrchu približne 99 % buniek neuroblastómov) a zároveň nízkou expresiou na nenádorových bunkových povrchoch, ktorá je obmedzená na membrány periférnych nervov, melanocyty a neuróny mozočka [8,20]. V roku 1985 popísal N. K. Cheung et al prvé štyri monoklonálne protilátky proti GD-2 receptoru [21,22]. Po publikácií výsledkov potvrdzujúcich benefit anti-GD2 monoklonálnej protilátky v porovnaní so štandardnou liečbou HR neuroblastómov (zlepšenie 2-ročného EFS na 66 ± 5 % zo 46 ± 5 %; p = 0.01, a 2-ročného OS na 86 ± 4 % zo 75 ± 5 %; p = 0.02), bolo v roku 2015 Úradom pre kontrolu potravín a liekov (Food and Druh Administration – FDA) a Európskou agentúrou pre lieky (European Medicines Agency – EMA) schválené použitie dinutuximabu, humánno-murinnej monoklonálnej protilátky ch14.18 cielenej proti GD-2 receptoru [8,10]. Väzbou na GD2 receptor dinutuximab potencuje komplementom sprostredkovanú cytotoxicitu (complement-dependent cytotoxicity – CDC) a protilátkami sprostredkovanú bunkami mediovanú cytotoxicitu (antibody-dependent cellular cytotoxicity – ADCC), ktoré vedú k apoptóze nádorových buniek [23–25]. Vzhľadom na to, že potenciál stimulovať CDC aj ADCC majú interleukín 2 a faktor stimulujúci kolónie granulocytov a makrofágov (GM-CSF), dinutuximab bol pôvodne schválený na konkomitatné podávanie v tejto kombinácii. Podľa publikovaných výsledkov sa však ukazuje, že táto kombinácia neprináša želaný benefit v zlepšení terapeutickej odpovede a prežívania pacientov, naopak, vedie k zvýšenej toxicite, ktorá u časti pacientov vedie až k prerušeniu imunoterapie [26,27]. Okrem pacientov s vysokorizkovým neuroblastómom sú z hľadiska prognózy nepriaznivou skupinou aj pacienti s relapsom ochorenia – 5-ročné OS po prvom relapse je približne 20 %. Prognóza pacientov s relapsom závisí od časového odstupu relapsu od primárnej diagnózy a od štádia v čase diagnózy a relapsu [28–30]. Niektoré štúdie ukazujú, že imunoterapia v kombinácii s inými liečebnými modalitami môže mať priaznivý efekt na prežívanie aj v tejto skupine pacientov [31]. Liečba dinutuximabom je spojená s rizikom rozvoja širokej palety nežiadúcich účinkov rôzneho stupňa závažnosti. Najčastejšie klinicky pozorovateľné vedľajšie účinky sú bolesť (somatická, neuropatická), prejavy capillary leak syndrómu (retencia tekutín, edémy, fluidothorax, dyspnoe, hypotenzia, tachykardia), alergické prejavy (lokalizované, generalizované), gastrointestinálna toxicita (nauzea, vracanie, hnačky), prejavy centrálnej a periférnej neurotoxicity, očné zmeny (poruchy akomodácie, alterácia vízu). Z toxicity pozorovateľnej v laboratórnych parametroch sa môže najčastejšie prejaviť hematologická toxicita (pokles parametrov krvného obrazu), hypoalbumiémia, hepatopatia a elevácia markerov zápalu. Vzhľadom na toto riziko je potrebná komplexná podporná liečba a dôsledný monitoring pacientov. Vo väčšine prípadov sú tieto vedľajšie účinky samolimitujúce a sú zvládnuteľné podpornou liečbou alebo úpravou podávania dinutuximabu. Pri rozvoji závažného stupňa toxicity je nevyhnutné liečbu ukončiť. Najväčšie riziko výskytu a najvyšší stupeň toxicity býva v prvých cykloch liečby, v ďalších cykloch klesá výskyt aj závažnosť toxicity [3,26,32,33]. Na pracovisku KDHaO sme počas podávania dinutuximabu najčastejšie pozorovali prejavy capillary leak syndrómu, nezávažné lokalizované hypersenzitívne reakcie a bolesť. U väčšiny pacientov boli tieto prejavy zvládnuté podpornou liečbou. Najzávažnejším toxickým prejavom bol rozvoj cerebelárneho syndrómu, ktorý viedol k predčasnému ukončeniu imunoterapie. Laboratórne sme u väčšiny pacientov pozorovali eleváciu markerov zápalu, známky hepatopatie, hypoalbuminémiu a pokles parametrov krvného obrazu. Prejavy toxicity boli najčastejšie v prvom cykle, pri ďalších cykloch klesala frekvencia ich výskytu aj závažnosť.
Záver
Dinutuximab má preukázateľný benefit v eradikácii minimálnej reziduálnej choroby pri liečbe neuroblastómu. Imunoterapia je v súčasnosti štandardom prvolíniovej liečby pacientov s vysokorizikovým neuroblastómom. Jej úloha v liečbe pacientov s relapsom ochorenia je predmetom viacerých prebiehajúcich štúdií, rovnako ako aj optimalizácia terapeutických schém v oboch indikáciách [31,34]. Vzhľadom na riziká spojené s podávaním dinutuximabu je potrebné, aby liečba prebiehala v skúsených centrách detskej onkológie s edukovaným personálom pripraveným na zvládanie prípadných nežiaducich účinkov liečby.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
MUDr. Monika Achbergerová
Klinika detskej hematológie a onkológie LF UK a NÚDCH
Limbová 1
833 40 Bratislava
Slovenská republika
e-mail: monika.achbergerova@gmail.com
Obdŕžané/Submitted: 29. 4. 2020
Prijaté/Accepted: 20. 8. 2020
Zdroje
1. Whittle SB, Smith W, Doherty E et al. Overview and recent advances in the treatment of neuroblastoma. Expert Rev Anticancer Ther 2017; 17 (4): 369–386. doi: 10.1080/14737140.2017.1285230.
2. Sharma R, Mer J, Lion A et al. Clinical presentation, evaluation, and management of neuroblastoma. Pediatr Rev 2018; 39 (4): 194–203. doi: 10.1542/pir.2017-0087.
3. McGinty L, Kolesar J. Dinutuximab for maintenance therapy in pediatric neuroblastoma. Am J Health Syst Pharm 2017; 74 (8): 563–567. doi: 10.2146/ajhp160228.
4. London WB, Boni L, Simon T et al. The role of age in neuroblastoma risk stratification: the German, Italian, and children‘s oncology group perspectives. Cancer Lett 2005; 228 (1–2): 257–266. doi: 10.1016/j.canlet.2004.12.054.
5. Cohn SL, Pearson AD, London WB et al. The International Neuroblastoma Risk Group (INRG) Classification System: An INRG Task Force Report. J Clin Oncol 2008; 27 (2): 289–297. doi: 10.1200/JCO.2008.16.6785.
6. International Study Protocol: European Low and Intermediate Risk Neuroblastoma Protocol: A SIOPEN Study Version 3.0. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT01728155.
7. International Study Protocol: High Risk Neuroblastoma Study 1.5 of SIOP-Europe (SIOPEN). [online]. Available from: https: //www.gyermekdaganat.hu/wp-content/uploads/NBL_01_HRNBL1-7-Protocol-R4-randomisation-Juni-2014.pdf.
8. Mora J. Dinutuximab for the treatment of pediatric patients with high risk neuroblastoma. Expert Rev Clin Pharmacol 2016; 9 (5): 647–653. doi: 10.1586/17512433.2016.1160775.
9. Parsons K, Bernhardt, B, Strickland B. Targeted immunotherapy for high-risk neuroblastoma – the role of monoclonal antibodies. Ann Pharmacother 2013; 47 (2): 210–218. doi: 10.1345/aph.1R353.
10. Yu AL, Gilman AL, Ozkaynak MF et al. Anti-GD2 antibody with GM-CSF, interleukin-2, and isotretinoin for neuroblastoma. N Engl J Med 2010; 363 (14): 1324–1334. doi: 10.1056/NEJMoa0911123.
11. Cheung NK, Dyer MA. Neuroblastoma: developmental biology, cancer genomics and immunotherapy. Nat Rev Cancer 2013; 13 (6): 397–411. doi: 10.1038/nrc3526.
12. Matthay KK, Maris JM, Schleiermacher G et al. Neuroblastoma. Nat Rev Dis Primers 2016; 2 : 16078.
13. Cook MN, Olshan AF, Guess HA et al. Maternal medication use and neuroblastoma in offspring. Am J Epidemiol 2004; 159 (8): 721–731. doi: 10.1093/aje/kwh108.
14. Menegaux F, Olshan AF, Neglia JP et al. Day care, childhood infections, and risk of neuroblastoma. Am J Epidemiol 2004; 159 (9): 843–851. doi: 10.1093/aje/kwh111.
15. McDermott S, Salzberg DC, Anderson AP et al. Systematic Review of chromium and nickel exposure during pregnancy and impact on child outcomes. J Toxicol Environ Health A 2015; 78 (21–22): 1348–1368. doi: 10.1080/15287394.2015.1090939.
16. Shojaei-Brosseau T, Chompret A, Abel A et al. Genetic epidemiology of neuroblastoma: a study of 426 cases at the Institut Gustave-Roussy in France. Pediatr Blood Cancer 2004; 42 (1): 99–105. doi: 10.1002/pbc.10381.
17. Papaioannou G, McHugh K. Neuroblastoma in childhood: review and radiological findings. Cancer Imaging 2005; 5 : 116–127. doi: 10.1102/1470-7330.2005.0104.
18. Berthold F, Boos J, Burdach S et al. Myeloablative megatherapy with autologous stem-cell rescue versus oral maintenance chemotherapy as consolidation treatment in patients with high-risk neuroblastoma: a randomised controlled trial. Lancet Oncol 2005; 6 (9): 649–658. doi: 10.1016/S1470-2045 (05) 70291-6.
19. Park JR, Eggert A, Caron H. Neuroblastoma: biology, prognosis, and treatment. Hematol Oncol Clin North Am 2010; 24 (1): 65–86. doi: 10.1016/j.hoc.2009.11.011.
20. Wu ZL, Schawrtz E, Seeger R et al. Expression of GD2 ganglioside by untreated primary human neuroblastomas. Cancer Res 1986; 46 (1): 440–443.
21. Cheung NK, Saarinen U, Neely JE et al. Development of neuroblastoma monoclonal antibodies for potential utilization in diagnosis and therapy. Prog Clin Biol Res 1985; 175 : 501–505.
22. Cheung NK, Saarinen U, Neely JE et al. Monoclonal antibodies to a glycolipid antigen on human neuroblastoma cells. Cancer Res 1985; 45 (6): 2642–2649.
23. Hoy SM. Dinutuximab: A review in high-risk neuroblastoma. Target Oncol 2016; 11 (2): 247–253. doi: 10.1007/s11523-016-0420-2.
24. Barker E, Mueller BM, Handgretinger R et at. Effect of a chimeric anti-ganglioside GD2 antibody on cell-mediated lysis of human neuroblastoma cells. Cancer Res 1991; 51 (1): 144–149.
25. SPC EMA: Unituxin 3.5 mg/mL concentrate for solution for infusion. EU Summary of product characteristics. [online]. Available from: https: //www.ema.europa.eu/en/.
26. Ladenstein R, Potschger U, Valteau-Couanet D et al. Interleukin 2 with anti-GD2 antibody ch14.18/CHO (dinutuximab beta) in patients with high-risk neuroblastoma (HR-NBL1/SIOPEN): a multicentre, randomised, phase 3 trial. Lancet Oncol 2018; 19 (12): 1617–1629. doi: 10.1016/S1470-2045 (18) 30578-3.
27. Matthay KK. Interleukin 2 plus anti-GD2 immunotherapy: helpful or harmful? Lancet Oncol 2018; 19 (12): 1549–1551. doi: 10.1016/S1470-2045 (18) 30627-2.
28. London WB, Castel V, Monclair TW et al. Clinical and biologic features predictive of survival after relapse of neuroblastoma: a report from the International Neuroblastoma Risk Group project. J Clin Oncol 2011; 29 (24): 3286–3292. doi: 10.1200/JCO.2010.34.3392.
29. Lau L, Tai D, Weitzman S et al. Factors influencing survival in children with recurrent neuroblastoma. J Pediatr Hematol Oncol 2004; 26 (4): 227–232. doi: 10.1097/00043426-200404000-00003.
30. Garaventa A, Parodi S, De Bernardi B et al. Outcome of children with neuroblastoma after progression or relapse. A retrospective study of the Italian neuroblastoma registry. Eur J Cancer 2009; 45 (16): 2835–2842. doi: 10.1016/j.ejca.2009.06.010.
31. Mody R, Naranjo A, Van Ryn C et al. Irinotecan-temozolomide with temsirolimus or dinutuximab in children with refractory or relapsed neuroblastoma (COG ANBL1221): an open-label, randomised, phase 2 trial. Lancet Oncol 2018; 18 (7): 946–957. doi: 10.1016/S1470-2045 (17) 30355-8.
32. Bartholomew J, Washington T, Bergeron S et al. Dinutuximab: A novel immunotherapy in the treatment of pediatric patients with high-risk neuroblastoma. J Pediatr Oncol Nurs 2017; 34 (1): 5–12. doi: 10.1177/ 1043454216659448.
33. Greenwood KL, Foster JH. The safety of dinutuximab for the treatment of pediatric patients with high-risk neuroblastoma. Expert Opin Drug Saf 2018; 17 (12): 1257–1262. doi: 10.1080/14740338.2018.1549221.
34. Keyel ME, Reynolds CP. Spotlight on dinutuximab in the treatment of high-risk neuroblastoma: development and place in therapy. Biologics 2019; 13 : 1–12. doi: 10.2147/BTT.S114530.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2020 Číslo 5- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Editorial
- Současný pohled na možnosti léčby BRAF mutovaného kolorektálního karcinomu
- Dlouhé nekódující RNA a karcinom z renálních buněk
- Výzvy a riešenia v manažmente kardiotoxicity checkpoint inhibítorov
- Systémová liečba hepatocelulárneho karcinómu
- Nové trendy v neoadjuvantní léčbě lokálně pokročilého karcinomu rekta z pohledu chirurga – komentář
- Implementácia imunoterapie do liečby neuroblastómu – skúsenosti jedného centra s podávaním a manažovaním nežiaducich účinkov dinutuximabu
- Skvamocelulárny karcinóm hrubého čreva – kazuistika
- Prvý pacient s COVID-19 na Slovensku
- Extravazace (paravazace) cytostatik – aktualizované doporučení (2020) pro standardní péči v rámci České republiky ze spolupráce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, České hematologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry
- Entrektinib – tumor-agnostická léčba penetrující do centrálního nervového systému s prokázanou účinností i u pediatrické populace
- Aktuality z odborného tisku
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nové trendy v neoadjuvantní léčbě lokálně pokročilého karcinomu rekta z pohledu chirurga – komentář
- Současný pohled na možnosti léčby BRAF mutovaného kolorektálního karcinomu
- Extravazace (paravazace) cytostatik – aktualizované doporučení (2020) pro standardní péči v rámci České republiky ze spolupráce Sekce podpůrné léčby České onkologické společnosti ČLS JEP, České hematologické společnosti ČLS JEP, Onkologické sekce České asociace sester a Společnosti pro porty a permanentní katétry
- Systémová liečba hepatocelulárneho karcinómu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



