-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Komplikace intravezikální terapie svalovinu neinfiltrujícího uroteliálního karcinomu močového měchýře vakcínou bacillus Calmette-Guerine (BCG)
Complications of treatment with bacillus calmette-guerin (BCG) in nonmuscle - invasive bladder cancer
Aim:
Patients with non-invasive transitional cell carcinoma (TCC) a high risk of progresion may benefit from intravesical chemotherapy or immunotherapy. Intravesical BCG instillation has better outcomes than Mitomycin instillation in patients with moderate to gross risk of disease progression. However this is accompanied by a higher degree of side effects.Material and methods:
Together 56 patients were included into the study (42 males and 14 females). All of the patients had histologically proven non-muscle invasive bladder TCC with moderate or high risk of progression. BCG was initiated with six weekly doses followed by maintenance therapy including 3 weekly doses at 3, 6, 9, 12, 15, 21 and 30 months. Median time of instillation was 12,2 months (1,5–30 months).Results:
In 24 patients (42%) 26 complications were observed. There were 9 not signigicant complications in 7 patients not requiring cessation of BCG therapy. Five patients had 5 moderate side effects and in these patients treatment was interrupted. In this group we restarted with instillations in 12 weeks (4-16 weeks) following diminishing of side effects. Twelve patients suffered 12 severe side effects necessitating treatment to be stopped.Conclusion:
Intravesical BCG instillation is effective in patients with non-muscle invasive TCC who have moderate or high risk of disease progression. Unfortunately is associated with high degrese of side effects – both local and general. It is possible to decrease the extent of these complications by means of proper indication for treatment, by minimising trauma during catheterisation and by applying sterile technique of catheterisation. Next option is prophylactic use of antibiotics.Key words:
BCG, cystitis, epididymitis, haematuria, intravesical immunotherapy, transurethral tumour resection.
Autoři: Ondřej Havránek; Jan Krhut; David Němec; Roman Král; Zdeněk Häring
Působiště autorů: Urologické oddělení FN, Ostrava – Poruba
Vyšlo v časopise: Ces Urol 2010; 14(2): 92-98
Kategorie: Původní práce
Práce je věnována našemu kolegovi a kamarádovi MUDr. Petru Vališovi, který zemřel náhle dne 26. února 2009 ve věku nedožitých 33 let.
Souhrn
Cíl:
U uroteliálních karcinomů močového měchýře bez invaze do svaloviny s vysokým rizikem progrese je indikována instilační terapie BCG. Tuto léčbu je možno indikovat i u nádorů rizika středního. Intravezikální instilace BCG vakcínou má lepší výsledky než instilace mitomycinem u pacientů s karcinomem středního a vysokého rizika progrese. Je však zatížena větším výskytem vedlejších účinků.Materiál a metodika:
Do studie bylo zařazeno celkem 56 pacientů (42 mužů a 14 žen). U všech pacientů byl histologicky verifikovaný uroteliální karcinom močového měchýře se středním nebo vysokým rizikem progrese. BCG vakcína byla podávána v režimu 6 iniciačních dávek v týdenním intervalu, následně 3 instilace v týdenních intervalech po 3, 6, 9, 12, 15, 21 a 30 měsících. Celkově byla vakcína podávána průměrně 12,2 měsíců (1,5–30 měsíců).Výsledky:
U 24 pacientů (42 %) se vyskytlo 26 komplikací. Celkem bylo zaznamenáno u sedmi pacientů 9 lehkých komplikací, které nevyžadovaly přerušení podávání BCG vakcíny. U pěti pacientů 5 středně závažných komplikací s nutností přerušení podávání BCG. V této skupině jsme opětovně začali podávat BCG v průměru 12 týdnů (4–16 týdnů) po odeznění nežádoucích účinků. U dvanácti pacientů 12 závažných komplikací, které si vyžádaly ukončení léčby BCG.Závěr:
Intravezikální terapie instilací BCG vakcíny je efektivní při terapii uroteliálních karcinomů močového měchýře bez invaze do svaloviny se středním a vysokým rizikem progrese. Bohužel je provázena také velmi četným výskytem vedlejších účinků ať již lokálních, nebo celkových. Snížit výskyt těchto komplikací lze jednak správnou indikací k léčbě jednotlivých pacientů a jednak atraumatickou a sterilní aplikací BCG vakcíny. Další možností je profylaktické podávání antibiotik.Klíčová slova:
BCG, cystitida, epididymiditida, hematurie, intravezikální imunoterapie, transuretrální resekce tumoru.Úvod
Incidence urotelialního karcinomu močového měchýře v České republice byla v roce 2005 24,31 nových případů na 100 000 obyvatel. Svým vysokým počtem recidiv je velmi vážným medicínským i ekonomickým problémem.
Primární léčbou svalovinu neinfiltrujícího karcinomu močového měchýře je transuretrální resekce tumoru (TURT). Až 70 % povrchových karcinomů recidivuje, 30–50 % nádorů stadia T1 (karcinomy invadující do subepiteliální vazivové tkáně) během 5 let progreduje nebo metastazuje (1, 2).
Cílem intravezikální chemoterapie nebo imunoterapie je snížit riziko recidivy či progrese nádoru. První zprávu o intravezikální imunoterapii povrchových nádorů močového měchýře BCG vakcínou u člověka publikoval Morales v roce 1976 (3). Mechanismus účinku BCG není přesně znám. Zvažuje se účinek BCG ovlivňující apoptózu nádorových buněk, vliv sekrece TNF-α (tumor necrosis factor – alfa) do moči aj. (4–6).
Intravezikální instilace BCG vakcíny má lepší výsledky než instilace mitomycinu u pacientů s uroteliálním karcinomem středního a vysokého rizika progrese (7–9).
BCG vakcinace vykazuje lepší výsledky než samotný TURT u svalovinu neinfiltrujícího uroteliálního karcinomu pouze při dlouhodobém podávání udržovacích dávek (8, 10).
Přestože je instilace BCG vakcíny považována za standardní součást léčby u uroteliálních karcinomů močového měchýře středního a vysokého rizika, zatím není standardizována dávka ani časové schéma podávání vakcíny.
Při instilační terapii BCG vakcínou je možné volit mezi několika kmeny, např. Connaught, Pasteur, Tice, Danish SSI 1331 aj. s různým množstvím jednotek schopných tvořit kolonie (colony forming units – CFU). Nicméně nebyl nalezen signifikantní rozdíl mezi jednotlivými kmeny ani v závislosti na dávce ani v závislosti na schématu udržovací terapie (7–9).
Použití BCG vakcíny je limitována poměrně vysokou frekvencí nežádoucích účinků jak lokálních, tak celkových s rizikem TBC infekce vzdálených orgánů (11–15).
Cílem práce je zhodnocení výskytu nežádoucích účinků ve vlastním souboru pacientů.
Materiál a metoda
Do retrospektivní studie bylo zařazeno celkem 56 pacientů, u nichž byla v letech 1998–2008 intravezikálně aplikována BCG vakcína.
V souboru je 42 mužů (24–80 let, medián 59 roků ) a 14 žen (50–76 let, medián 58 roků). U všech pacientů byl histologicky verifikován uroteliální karcinom močového měchýře bez invaze do svalové vrstvy charakterizovaný středním nebo vysokým rizikem progrese (16). Třicet (54 %) pacientů bylo indikováno k terapii již při primozáchytu tumoru. U 23 z nich se jednalo o nádory hodnocené jako T1 G3 (dle novější klasifikace jako T1 high-grade) u sedmi pacientů byla indikována BCG pro nález karcinoma in situ. Dvacet šest (46 %) pacientů pak podstoupilo léčbu pro recidivující nádory. U 19 z nich se jednalo o recidivu spatně diferencovaného uroteliálního karcinomu a u sedmi o recidivující nádor po instilační chemoterapii MMC.
U všech pacientů byla použita BCG vakcína ImmuCyst® – Bacillus Calmette-Guérin (BCG) lyophilisatus, kmen Connaught. Jedna lahvička obsahuje 81 mg ± 9 mg (10,5 ± 8,7 × 108 CFU). K přípravě instilačního roztoku byla jedna lahvička rozpuštěná v 50 ml fyziologického roztoku. Instilační roztok byl aplikován intravezikálně pomocí jednorázového katétru a dezinfekcí zevního ústí uretry. Dle zvyklosti našeho pracoviště byli pacienti po aplikaci v poloze vleže na zádech s občasnou změnou polohy na pravý nebo levý bok tak, aby došlo k maximálnímu kontaktu agens se stěnou močového měchýře. Po 45 minutách se pacienti vymočili. Během terapie jsme nepoužili profylaktického podávání antibiotik ani antituberkulotik. U všech pacientů proběhla intravezikální terapie ambulantně. Instilace byla zahájena v průměru 8 týdnů po primárním TURT. Poměrně dlouhá průměrná doba do zahájení instilace byla dána především kapacitními důvody naší ambulance. Svou úlohu hrálo i to, že několik pacientů bylo k resekci tumoru odesláno z jiného pracoviště a k aplikaci BCG se dostavili až po kontrole u svého urologa. V současnosti je standardně první kontrola u všech pacientů po onkologické operaci provedena na naší ambulanci. V posledních cca 3 letech se odstup mezi výkonem a první instilací pohybuje mezi 3–4 týdny. BCG vakcína byla podávána v následujícím režimu: 6 iniciačních dávek v týdenním intervalu, následně 3 instilace v týdenních intervalech po 3, 6, 9, 15, 21 a 30 měsících od ukončení iniciačního cyklu jako udržovací dávka.
V našem souboru byla vakcína podávána průměrně 12,2 měsíců (1,5–30 měsíců).
Výsledky
U 24 pacientů (42 %) se vyskytlo 26 komplikací. Celkem bylo zaznamenáno u sedmi pacientů 9 lehkých komplikací, které nevyžadovaly přerušení podávání BCG vakcíny. Mezi tyto komplikace patřily intermitentní febrilie (teplotní spičky nad 38 °C přetrvávající 24–48 hodin po aplikaci BCG bez cystitických obtíží), dysurické obtíže a mírné cystalgie. U pěti pacientů 5 středně závažných komplikací s nutností přerušení podávání BCG. Mezi tyto komplikace patřily jednak febrilie nad 38 °C doprovázené příznaky cystitidy a jednak dva případy akutní prostatitidy. V této skupině jsme opětovně začali podávat BCG v průměru 12 týdnů (4–16 týdnů) po odeznění nežádoucích účinků. U dvanácti pacientů 12 závažných komplikací, které si vyžádaly ukončení léčby BCG. Mezi závažné komplikace řadíme granulomatózní balanopostitidu, těžké cystalgie s makroskopickou hematurií, městnání v dutém systému ledviny nejspíše na podkladě zánětlivých změn v močovém měchýři, protože po léčbě isoniazidem došlo k ústupu městnání na horních močových cestách a rozvoj svraštělého močového měchýře (hodnoceno zejména dle klinických symptomů pacientů udávaných před a během léčby, u dvou pacientů byla nízká kapacita okolo 150 prokázána i během kontrolního endoskopického vyšetření v celkové anestezii). Naprostá většina komplikací se objevila již během indukčních 6 dávek útočného cyklu. Počet jednotlivých komplikací i jejich terapie jsou uvedeny v tabulkách 1, 2 a 3.
Tab. 1. Lehké komplikace – bez nutnosti přerušení terapie BCG Table 1. Mild complications – not requiring cessation of BCG therapy 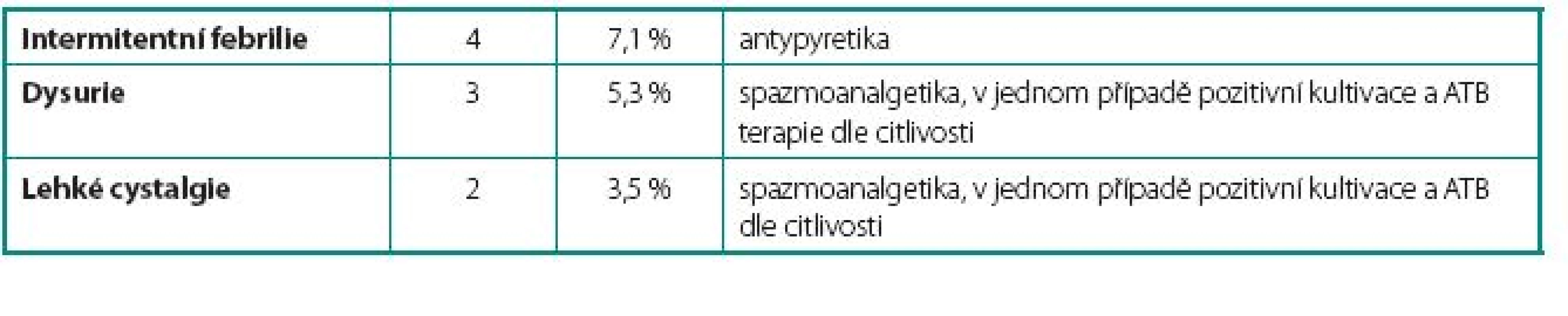
Tab. 2. Středně vážné komplikace – vyžadující přerušení terapie BCG Table 2. Moderate complications – requiring cessation of BCG therapy 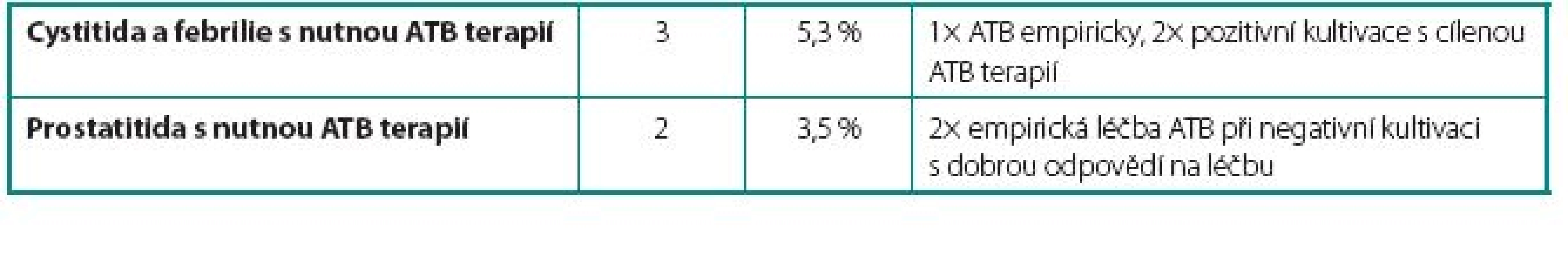
Tab. 3. Závažné komplikace – vyžadující ukončení terapie BCG Table 3. Serious complications – requiring ending BCG therapy 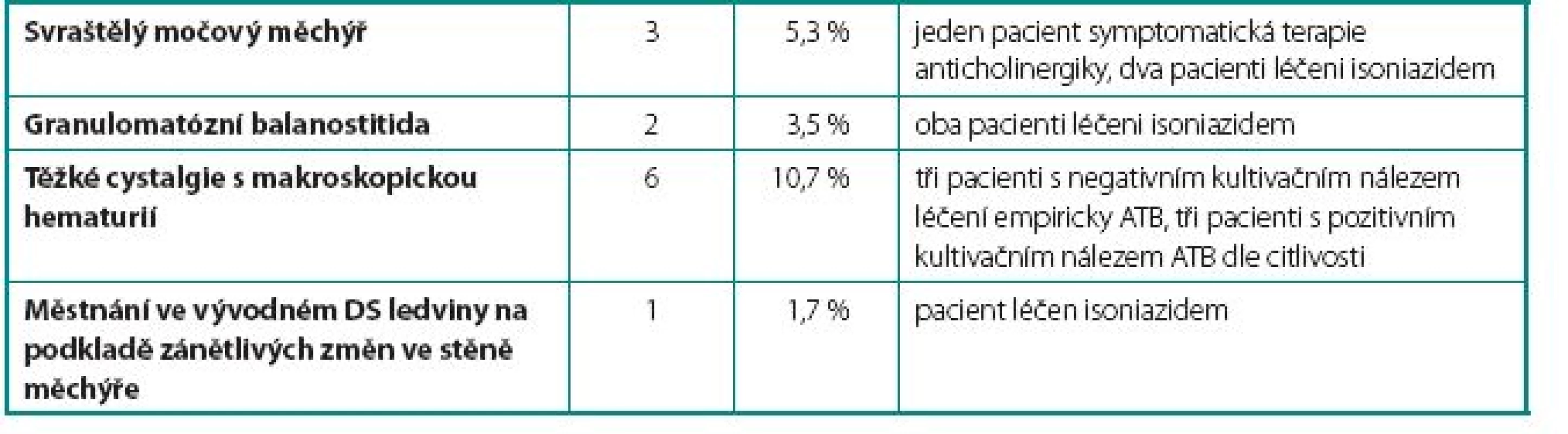
Diskuse
Závažné komplikace v literatuře jsou udávány 5 % (17). V našem souboru se závažné komplikace vyskytly u 12 pacientů (21% případů). I když většina autorů uvádí nižší procento závažných komplikací, existují i práce s frekvencí komplikací stejnou nebo i vyšší (18). Roční instilaci dokončilo 24 pacientů (42 %).
Jako prevence vedlejších účinků provedl Colombel et al. studii s podáváním 200 mg Ofloxacinu společně s BCG instilací. Tento postup vedl ke snížení výskytu vedlejších účinků (19, 20). Nicméně profylaktické podávání ATB zatím není standardním postupem.
Pro snížení toxicity BCG je navrhováno snížení dávky BCG na ⅓ až ¼. Nicméně výskyt závažných a celkových vedlejších účinků je podobný v souborech jak s plnou, tak i redukovanou dávkou BCG (21, 22).
Ačkoliv u uroteliálních karcinomů s vysokým rizikem progrese je imunoterapie BCG účinnější než aplikace chemoterapie, je bohužel také zatížena vyšším výskytem vedlejších účinků ať již lokálními – dysurie, cystitida, frekventurie, hematurie (mitomycin C 30 % vs. BCG 44 %), nebo celkovými – zimnice, horečka, malátnost (mitomycin C 12 % vs. BCG 19 %) (9). Existují údaje o možném snížení výskytu vedlejších účinků BCG v kombinaci s epirubicinem při zachování efektu BCG na progresi tumoru (23). Jiné práce ovšem nenacházejí rozdíl v konsekutivním podávání BCG a mitomycinu (24, 25).
Na rozdíl od některých autorů, kteří hodnotí vedlejší účinky pouze jako lokální a celkové (26–28), jsme hodnotili i to, zda bylo nutné BCG instilaci pouze přerušit, nebo úplně ukončit.
Otázkou je instilace BCG vakcínou u imunosuprimovaných pacientů, což je všeobecně uznávanou kontraindikací pro aplikaci BCG vakcíny. Nicméně ve studii Yossepowitche nebyl prokázán zvýšený výskyt vedlejších účinků u imunosuprimovaných pacientů s uroteliálním karcinomem vysokého rizika progrese (29).
Na rozdíl od intravezikální chemoterapie by instilace BCG neměla proběhnout bezprostředně po endoresekčním výkonu, ale s odstupem nejméně 2 týdnů. Dále by se BCG neměla podávat při makroskopické hematurii, po traumatické katetrizaci a při probíhající infekci urotraktu. Všechny tyto stavy zvyšují riziko vzniku jak lokálních, tak celkových vedlejších účinků BCG.
Závěr
Intravezikální terapie instilací BCG vakcíny je efektivní při terapii svalovinu neinfiltrujících karcinomů močového měchýře s vysokým rizikem progrese. Bohužel je provázena také velmi četným výskytem vedlejších účinků – ať již lokálních, nebo celkových. Snížit výskyt těchto komplikací lze jednak správnou indikací k léčbě jednotlivých pacientů. Jedná se zejména o dodržování indikací podle zařazení nádorů do jednotlivých prognostických skupin. Dále je nutné brát v úvahu některé preexistující abnormality – jako například nízká kapacita močového měchýře, vždy je nutné vyloučit bakteriální infekci močových cest. Stejně tak je nutné dodržovat zásady atraumatické a sterilní aplikaci BCG vakcíny. Další možností je profylaktické podávání antibiotik.
Došlo: 11. 5. 2009
Přijato: 2. 3. 2010
Kontaktní adresa
MUDr. Ondřej Havránek
Urologické oddělení FN
tř. 17. listopadu 1790,
708 52 Ostrava – Poruba
e-mail: ondrejh@email.cz
Zdroje
1. Heney NM, Ahmed S, Flanagan MJ, et al. Superficial bladder cancer: progression and reccurence: J Urol 1983; 130 : 1083–1086.
2. Herr HW, Jakse G, Sheinfeld J. The T1 bladder tumor. Semin Urol 1990; 8 : 254–261.
3. Morales A, Eidinger D, Bruce AW. Intracavitary bacillus Callmete-Guerin regimen in superficial bladder cancer therapy: is it effective? J Urol 1976; 116 : 180–183.
4. Morales A. Evolution of intravesical immunotherapy for bladder cancer: mycobacterial cell wall preparation as a promisinig agent. Expert Opin Investig Drugs 2008; 17 : 1067–1073.
5. Chen F, Zhang G, Cao Y, et al. Bacillus Calmette-Guerine inhibits apoptosis in human urothelial carcinoma cell lines in response to cytotoxic injury: J Urol 2007; 178 : 2166–2170.
6. Shintani Y, Sawada Y, Inagaki T, et al. Intravesical instillation therapy with bacillus Calmette-Guerine for superficial bladder cancer: study of the mechanism of bacillus Calmette-Guerine imunotherapy: Int J Urol 2007; 14 : 140–146.
7. Böhle A, Bock PR. Intravesical bacille Calmette-Guerine versus mitomycin C in superficial bladder cancer: formal meta-analysis of comparative studies on tumor progression: Urology 2004; 63 : 682–687.
8. Han RF, Pan JG. Can intravesical bacillus Calmette-Guerine reduce reccurence in patients with superficial bladder cancer? A meta-analysis of randomized trials: Urology 2006; 67 : 1216–1223.
9. Shelley MD, Wilt TJ, Court J, et al. Intravesical bacillus Calmette-Guerine is superior to mitomycin C in reducing tumour recurrence in high-risk superficial bladder cancer: a meta-analysis of randomized trials: BJU Int 2004; 93 : 485–490.
10. Lamm DL, Blummenstein BA, Crissman JD, et al. Maintenance bacillus Calmette - Guerine immunotherapy for recurent Ta,T1 and carcinoma in situ transitional cell carcinoma of the bladder: a randomized Southwest Oncology Group Study: J Urol 2000; 163 : 1124–1129.
11. Harding GE, Lawlor DK. Ruptured mycotic abdominal aortic aneurysm secondary to Mycobacterium bovis after intravesical treatment with bacillus Calmette-Guérin: J Vasc Surg 2007; 46 : 131–134.
12. Salajka F, Pokorny A, Vomela J, et al. Severe complications following intravesical BCG instillation: Monaldi Arch Chest Dis 2002; 57 : 321–324.
13. Dvořák T, Schraml J, Hynek V, et al. Oboustranná granulomatozní orchiepididymiditis jako komplikace BCG léčby povrchového karcinomu močového měchýře: Urologie pro praxi 2007; 8 : 180–181.
14. Manzanera Escribano MJ, Morales Ruiz E, Odriozola Grijalba M, et al. Acute renal failure due to interstitial nephritis after intravesical instillation of BCG: Clin Exp Nephrol 2007; 11 : 238–240.
15. Fradet V, Gaudreau C, Perrotte P, et al. Management of hepatic granulomatous tuberculosis complicating intravesical BCG for superficial bladder cancer: Can Urol Assoc J 2007; 1 : 269–272.
16. Babjuk M, Oosterlinck W, Sylvester R, et al. Guidelines on TaT1 (non-muscle invasive) Bladder Cancer. In: European Association of Urology. Guidelines 2008 ed. Arnhem 2008 : 8.
17. van der MeijdenaAP, Sylvester AJ, Oosterlinck W, et al. EORTC Genito-urinary Tract Cancer Group. Maintance bacillus Calmette-Guerine for Ta, T1 bladder tumours is not associated with increased toxicity: results from a European Organisation for Research and treatment of Cancer Genito-Urinary Group Phase III Trial: Eur Urol 2003; 44 : 429–434.
18. Suzuki S, Shinohara N, Harabayashi T, et al. Complications of bacillus Calmette - Guerine therapy in superficial urothelial cancer: clinical analysis and implications: Int J Clin Oncol 2002; 7 : 289–293.
19. Colombel M, Saint F, Chopin D, et al. The effect of ofloxacin on bacillus calmette – guerin induced toxicity in pacients with superficial bladder cancer : results of a randomized, prospective, double-blind, placebo controlled, multicenter study: J Urol 2006; 176 : 935–939.
20. Colombel M, Picard A. Prevention of Bacillus Calmette-Guérin immunotherapy complications: Prog Urol. 2008; 18(Suppl 5): 105–110.
21. Martinez-Piniero JA, Martinez-Piniero L, Solsona E, et al. Has a 3-fold decreased dose of bacillus Calmette-Guerine the same efficacy against reccurences and progresion of T1G3 and Tis bladder tumors than the standard dose? Results of a prospective randomized trial: J Urol 2005; 174 : 1242–1247.
22. Martinez–Piniero JA, Flores N, Isorna S, et al. Long-term follow-up of randomized prospective trial comparing a standard 81 mg dose of intravesical bacille Calmette - Guerin with a reduce dose of 27 mg in superficial bladder cancer. BJU 2002; 89 : 671–680.
23. Ali-El-Dein B, Nabeeh A, Ismail EH, et al. Senquential bacillus Calmette-Guerin and epirubicin versus bacillus Calmette-Guerine alone for superficial bladder tumors: a randomized prospective study: J Urol 1999; 162 : 339–342.
24. Witjes JA, Caris CT, Mungan NA, et al. Results of a randomized phase III trial of sequential intravesical therapy with mitomycin C and bacillus Calmette-Guerin versus mitomycin C alone in patients with superficial bladder cancer: J Urol 1998; 160 : 1668–1671.
25. Bilen CY, Ozen H, Aki FT, et al. Clinical experience with BCG alone versus BCG plus epirubicin: Int J Urol 2000; 7 : 206–209.
26. Paterson DL, Patel A. Bacillus Calmette-Guerine (BCG) imunotherapy for bladder cancer: review of complications and their treatment: Aust N Z J surg 1998; 68 : 340–344.
27. Suzuki S, Shinohara N, Harabayashi T, et al. Complications of bacillus Calmette - Guerine therapy in superficial urothelial cancer: clinical analysis and implications: Int J Clin Oncol 200; 27 : 289–293.
28. Koya MP, Simon MA, Soloway MS, et al. Complications of intravesical therapy for urothelial Cancer of the bladder: J Urol 2006; 175 : 2004–2010.
29. Yossepowitch O, Eggener SE, Bochner BH, et al. Safety and efficacy of intravesical bacillus Calmette-Guerine instillations in steroid treated and immunocompromised patients. J Urol 2006; 176 : 482–485.
Štítky
Dětská urologie Nefrologie Urologie
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2010 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Perkutánní radiofrekvenční ablace (RFA) v léčbě nádorů ledvin – vlastní zkušenosti
- Méně časté příčiny dysurie u žen
- Profesor MUDr. Michal Horňák, DrSc. – osmdesátiletý
- Představujeme nové české docenty urologie
- Práce českých urologů publikované v zahraničí v roce 2009
-
Představení monografie
Vladimír Zvára, Michal Horňák - Laparoskopický workshop – Prešov
- Budoucnost urologických lůžkových pracovišť a Grémium primářů a přednostů urologie (GPU)
- Fyzikální základy extrakorporální litotrypse
- Moderní metody zevní radioterapie v léčbě karcinomu prostaty
- Komplikace intravezikální terapie svalovinu neinfiltrujícího uroteliálního karcinomu močového měchýře vakcínou bacillus Calmette-Guerine (BCG)
- Význam stanovení survivinu v moči pro neinvazivní diagnostiku uroteliálních karcinomů močového měchýře
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Méně časté příčiny dysurie u žen
- Perkutánní radiofrekvenční ablace (RFA) v léčbě nádorů ledvin – vlastní zkušenosti
- Moderní metody zevní radioterapie v léčbě karcinomu prostaty
- Komplikace intravezikální terapie svalovinu neinfiltrujícího uroteliálního karcinomu močového měchýře vakcínou bacillus Calmette-Guerine (BCG)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



