-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Terapie glaukomu – aktuální přehled dat a informací
Glaucoma Therapy – Current Overview of Data and Information
The authors submit the overview of the actual situation in the glaucoma therapy. They follow up the trends in antiglaucomatic treatment in the last period including financial aspects of medicament and surgical treatment. Attention is paid especially to medicaments management, actual overview of available antiglaucomatic drugs, function and position of generic drugs and differences among them, the daily dose of benzalconium chloride in glaucoma treatment, actual average of patients’ supplementary payments at the drug purchase in the pharmacy, surgical treatment costs and legal issues. Pharmacologist’s viewpoints and the Czech State Drug Control Authority (SÚKL) opinions complete the professional’s point of the view and facilitate his/her complete orientation in glaucoma therapy issues.
Key words:
glaucoma, prescription, surgical treatment, treatment costs, legal issues
Autoři: P. Výborný 1; S. Sičáková 1; P. Dohnalová 1; M. Feřtek 2; T. Doležal 3
Působiště autorů: Oční klinika 1. LF UK a ÚVN – Vojenská fakultní nemocnice, Praha, přednosta doc. MUDr. Jiří Pašta, CSc., FEBO 1; Státní ústav kontroly léčiv, Praha, ředitel MUDr. Pavel Březovský, MBA 2; Institut pro zdravotní ekonomiku, Farmakologický ústav 2. LF UK, Praha, přednosta MUDr. Martin Votava, PhD. 3
Vyšlo v časopise: Čes. a slov. Oftal., 69, 2013, No. 3, p. 118-126
Kategorie: Původní práce
Souhrn
Autoři podávají přehled o současné situaci v léčbě glaukomu. Sledují trendy v preskripci antiglaukomové léčby za poslední období včetně finanční náročnosti medikamentózní i chirugické léčby. Pozornost je věnována zejména hospodaření s léky, aktuálnímu přehledu dostupných antiglaukomatik, významu a postavení generik a rozdílům mezi nimi, denní dávce benzalkonium-chloridu v léčbě glaukomu, průměrným aktuálním doplatkům pacienta při výdeji léku i nákladům na chirurgickou léčbu glaukomu a příslušné legislativě. Stanoviska farmakologa a SÚKL k této problematice doplňují pohled odborníka a usnadňují mu komplexní orientaci v problematice terapie glaukomu.
Klíčová slova:
glaukom – prekripce – operativa – náklady na léčbu – legislativaÚvod
Glaukom je závažná choroba s významným sociálně ekonomickým dopadem. Nové trendy v diagnostice a léčbě výrazně zlepšují šance nemocného i lékaře v boji s tímto onemocněním a v předcházení jeho následků. Stále však naše úroveň znalostí a možností v této oblasti zůstává za očekáváním. (9)
Cílem tohoto sdělení je napomoci oftalmologovi v rozhodování v moderní terapii glaukomu - podat přehled terapeutických možností, shrnout a komentovat dostupná data pro snazší orientaci v nich a učinit dílčí závěry.
Diagnostické metody a terapeutické postupy v oblasti glaukomu procházejí etapou fascinujícího rozvoje. Základní skupiny úkolů v této oblasti do budoucna lze stanovit do čtyř okruhů: úspěšná diagnostika, časná diagnostika, časná detekce progrese glaukomu, úspěšná intervence zastavení progrese. Korelace informací získaných funkčním vyšetřením (perimetrií) a dat zjištěných při morfologickém vyšetření zobrazovacími technikami je již vyhodnocována a řešena klinickými studiemi, avšak stále chybí exaktní zpracování přímého dopadu do klinické praxe. Na této problematice pracuje řada analytiků a klinických specialistů na různých pracovištích. Výsledky očekáváme v časovém horizontu 5–10 let. Také neuroprotektivní a genová léčba v klinické praxi je záležitostí budoucnosti. Různé možnosti alternativní nebo doplňkové léčby zatím nemají verifikaci účinnosti randomizovanými klinickými studiemi.
Současným doporučeným diagnostickým schématem glaukomatologa tedy zůstává: komplexní oční vyšetření včetně vyšetření centrální ostrosti zrakové nejlépe pomocí ETDRS optotypů, vyšetření zorného pole statickou perimetrií, monitorování nitroočního tlaku Goldmannovou aplanační tonometrií případně dynamickou konturní tonometrií, gonioskopie, exaktní zhodnocení nálezu na terči zrakového nervu a vyšetření některou z dostupných zobrazovacích technik. V terapii stále platí volba ze tří možností: konzervativní, laserová nebo chirurgická léčba, případně jejich kombinace.
Ve snaze poskytnout přehledně aktuální ucelené informace k problematice léčby glaukomu jsme zvolili následující osnovu.
- Hospodaření s léky
- Přehled antiglaukomatik dostupných k 1.6.2013
- Přehled preskripce antiglaukomatik v České republice
- Porovnání preskripce antiglaukomatik v České republice a Slovenské republice
- Význam a postavení generik
- Konzervační činidla – benzalkonium chlorid v očních kapkách snižujících nitrooční tlak
- Další faktory v rozhodování o výběru léčby glaukomu
- Chirurgie glaukomu – náklady a porovnání s konzervativní léčbou
- Závěr
- Literatura
1. Hospodaření s léky
Léky za více než 1,5 miliardy Kč zůstaly v roce 2011 bez reálného využití a lidé je buď odevzdali zpět do lékáren, vyhodili do komunálního odpadu, anebo vrátili zpět do ordinací lékařů. V celkovém měřítku se jedná minimálně o 3,7 % všech dodávek distributorů léků. Vyplynulo to z průzkumu SÚKL „Reálné využití léčiv a jeho finanční dopad na zdravotní systém v ČR“, který realizovala agentura STEM/MARK. (viz http://www.sukl.cz) Audit lékárniček ve 2000 českých domácnostech ukázal, že 20 % tvoří léky nepoužívané a 12 % léky s prošlým datem spotřeby. Průměrný počet balení léků na domácnost je 17, z toho 41 % tvoří léky na recept. Pouze 53 % domácností odevzdává nevyužité léky v lékárně, 29 % vyhazuje léky do popelnice a 15 % domácností léčiva doma hromadí a jejich likvidaci neřeší. Nejčastějším důvodem vyhazování léčiv je prošlá doba použitelnosti a nepřítomnost původního adresáta léku – stěhování, úmrtí, apod. Další stamilióny Kč je třeba vynaložit na ekologickou likvidaci léků, které skončí v odpadu. Kraje za likvidaci 1 tuny tohoto materiálu ve spalovně nebezpečného odpadu platí od 12 do 48 tisíc Kč a celkové finanční náklady na likvidaci 245 tun nepoužitých léků v hodnotě jedné miliardy Kč v roce 2011 činily 7,5 miliónů Kč. Lze zcela jistě najít rezervy, jak se chovat hospodárněji, a to na straně pacientů i lékařů.
2. Přehled antiglaukomatik
V následujícím přehledu je strukturovaný soubor antiglaukomatik dostupných v ČR k 1.6.2013, pro lepší orientaci s uvedením držitele registrace dle SPC nebo distributora.
Adrenergní agonisté – brimonidin
ALPHAGAN (Allergan)
LUXFEN (Jelfa – Valeant Pharma)
Betablokátory
- neselektivní – timolol, levobunolol
- TIMOLOL POS (Ursapharm)
- TIMO COMOD (Ursapharm)
- ARUTIMOL (Chauvin Ankerpharm – Bausch and Lomb)
- TIMOPTOL (Merck Sharp Dohme)
- TIMOHEXAL (Sandoz – Novartis)
- UNITIMOLOL (Unimed Pharma)
- OFTAN TIMOLOL (Santen)
- VISTAGAN (Allergan)
- selektivní – betaxolol
- BETOPTIC, BETOPTIC S (Alcon – Novartis)
- BETALMIC (Unimed Pharma)
- s vnitřní sympatomimetickou aktivitou – carteolol
- CARTEOL LP (Mann – Bausch and Lomb)
- ARTEOPTIC (Laboratoires Thea)
- Cholinergika – pilocarpin
- PILOGEL HS (Alcon – Novartis)
Inhibitory karboanhydrázy
- lokální – brinzolamid 1% AZOPT (Alcon – Novartis)
- dorzolamid 2% TRUSOPT (Merck Sharp Dohme)
- OFTIDOR (Jelfa – Valeant Pharma)
- aplikace per os - acetazolamid DILURAN ( Zentiva)
- aplikace intravenózní – MANITOL 15 % VIAFLO (Baxter)
Analoga prostaglandinů
- latanoprost 0,005% – XALATAN (Pfizer)
- travoprost 0,004% – TRAVATAN (Alcon – Novartis)
- bimatoprost 0,03% – LUMIGAN (Allergan)
- afluprost 0,0015% – TAFLOTAN (Santen)
generika latanoprostu:
- ARULATAN (Chauvin Ankerpharm – Bausch and Lomb)
- GLAUCOTENS (Valeant Czech – Valeant Pharma)
- LATALUX (Glimcare – Valeant Pharma)
- LATANOPROST ACTAVIS (Actavis – Watson)
- LATANOPROST APOTEX (Apotex)
- LATANOPROST POS (Ursapharm)
- LATANOPROST RATIOPHARM (Ratiopharm – TEVA)
- SOLUSIN (Genericon)
- UNILAT (Unimed Pharma)
- XALOPTIC (Polpharma)
- ZELEZA (VULM CZ)
Kombinace s timololem
+ pilokarpin (betablokátor + miotikum)
- FOTIL,FOTIL FORTE (Santen)
+ dorzolamid (betablokátor + ICA) y COSOPT (Merck Sharp Dohme)
- DORZOGEN COMBI (Mylan Generics)
- DORZOLAMID/ TIMOLOL (TEVA)
- DOZOTIMA (Valeant – Valeant Czech)
+ brinzolamid (betablokátor + ICA)
- AZARGA (Alcon – Novartis)
+ latanoprost (betablokátor + PG)
- XALACOM (Pfizer),
- GLAUCOTIMA (Valeant – Glimcare)
- LATANOPROST/ TIMOLOL (Apotex)
+ bimatoprost (betablokátor + PG)
- GANFORT (Allergan)
+ travoprost (betablokátor + PG)
- DUOTRAV (Alcon – Novartis)
+ brimonidin (betablokátor + adrenergní agonista)
- COMBIGAN (Allergan)
3. Přehled preskripce antiglaukomatik v České republice v letech 2011 a 2012
Na trh vstupují nové léky a generika latanoprostu, u nichž ve sledovaném roce z tohoto důvodu není uveden meziroční nárůst (N/A). Latanoprost Ratiopharm, který měl výhodu nástupu jako první, již začíná ztrácet. Ocitáme se na počátku etapy, kdy se počet nemocných, u kterých je indikována léčba glaukomu monoterapií, rozděluje podle rozhodnutí lékaře mezi řádově již desítky možností. Sympatický je nástup Taflotanu. Vzhledem k výhodě, že neobsahuje konzervační činidla, je velmi dobře snášen i tou skupinou pacientů, kde dosud byly s tolerancí léčby a compliance obtíže. Dalším rysem je, že klesají náklady na originální léky této skupiny (Xalatan –13%, Travatan –18%), protože nástup generika vede ke snížení úhrady jak legislativní formou, tak z rozhodnutí distributora s ohledem na lepší schopnost konkurence (tab. 1).
Tab. 1. Preskripce analog prostaglandinu v léčbě glaukomu v České republice v roce 2011 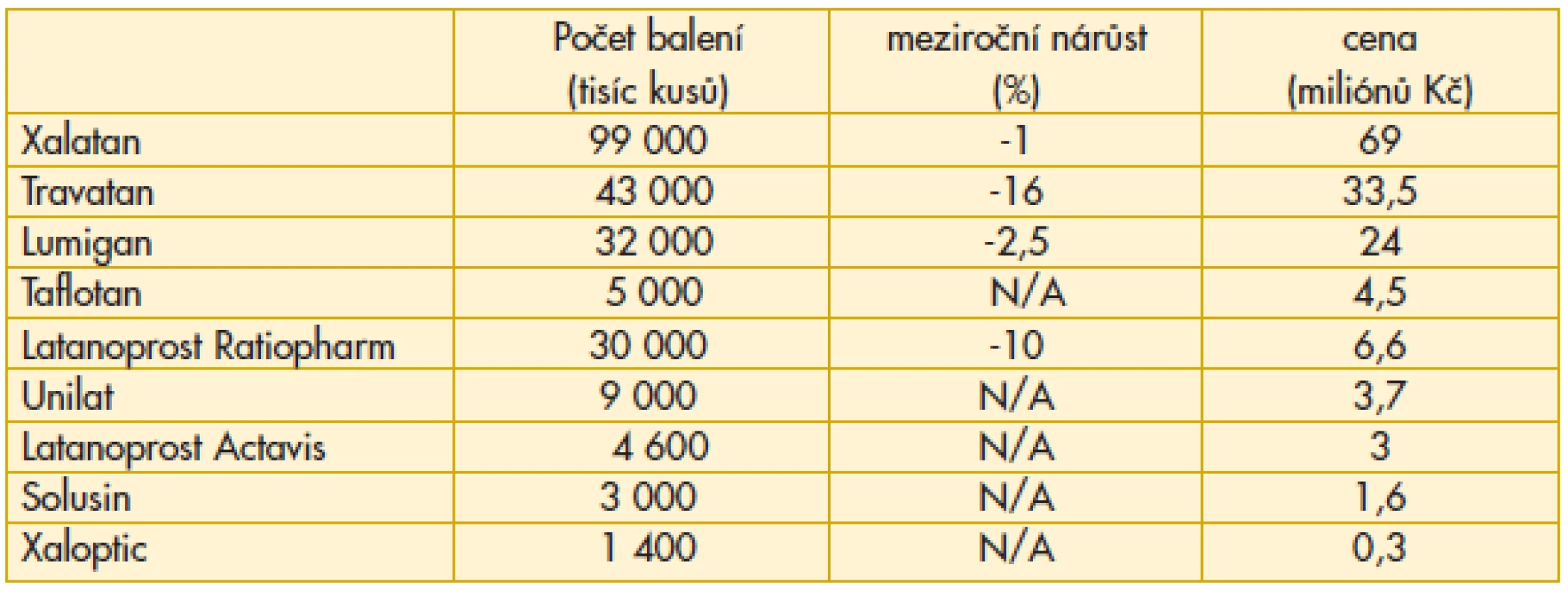
V roce 2011 se zvyšuje preskripce fixních kombinací (tab. 2). Nejvyšší příčku v nákladech obsadil Cosopt, nejvyšší počet balení je u Combiganu.
Tab. 2. Preskripce fixních kombinací v léčbě glaukomu v České republice v roce 2011 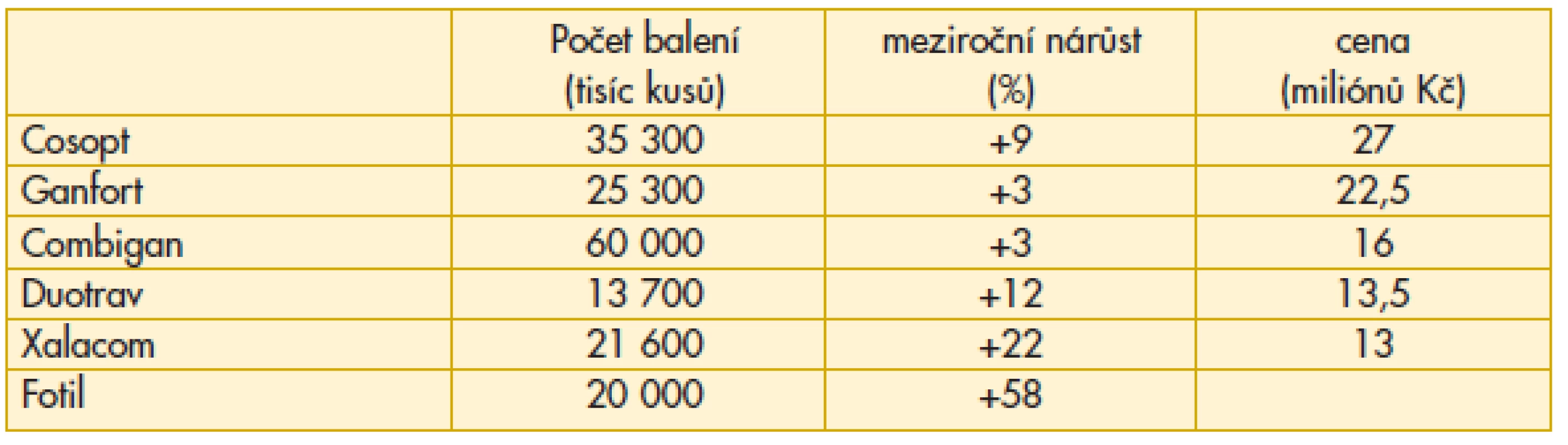
Z léků v tabulce neuvedených se na množství expedovaných balení výrazně podílí Azopt (230 tisíc kusů, meziroční nárůst +7 %, v hodnotě 46 miliónů Kč). Tato čísla jsou velmi ovlivněna reexportem léku (viz dále). Počet balení Trusoptu je 10x nižší. Zajímavá je také relace mezi Alphaganem a Luxfenem – došlo více než k 50% poklesu preskripce Alphaganu (na 16 tisíc balení) v porovnání s dvojnásobným nárůstem preskripce Luxfenu (na 33 tisíc balení). Náklady jsou přitom u obou položek shodné – 3 milióny Kč.
Ve skupině betablokátorů pokračoval sestupný trend – pokles preskripce Timoptolu, Arutimolu, Unitimololu, Oftan Timololu o 10-12 %. O něco méně významný pokles zaznamenal Timolol POS (-6 %) a TimoCOMOD (-5 %). Nejvýznamnější podíl na trhu betablokátorů patří již několik let lékům Betoptic a Betoptic S (dohromady téměř 200 tisíc balení, meziroční pokles -3 %, náklady 13 miliónů Kč).
Přehled preskripce oftalmologik (S01) a antiglaukomatik (S01E2) v roce 2012.
V roce 2012 bylo preskribováno 5 542 355 balení oftalmologik (meziroční pokles -2,6 %) v ceně 647 571,2 tisíc Kč (meziroční nárůst +8,5 %). Ve skupině antiglaukomatik bylo expedováno 1 294,9 tisíc balení (meziroční nárůst +8,4 %) v ceně 390 802,8 tisíc Kč (meziroční nárůst +11,5 %). Tato čísla nejsou však ve srovnání s léčbou jiných chorob nijak závratná, jak by se na první pohled mohlo zdát. Naopak, náklady na skupinu „Smyslové orgány“ jsou poněkud překvapivě až na 11. příčce nákladovosti léčby podle skupin nemocí. Před léčbou smyslových orgánů jsou v žebříčku nákladů léčba kardiovaskulárního systému, CNS, trávicího traktu, respiračního systému, urologických a sexuálních nemocí, náklady na antineoplastickou a imunomodulační léčbu, onemocnění pohybového systému, léčba systémových infekcí, léčba krevních poruch a dermatologická léčba. Nižší náklady jsou pouze na systémovou hormonální léčbu, na nemocniční roztoky, parazitologickou léčbu a diagnostické přípravky. Z uvedeného vyplývá, že léčba očních chorob rozhodně není tak nákladná, jak je nám oftalmologům na různých jednáních mnohdy podsouváno.
Vzestup preskripce Xalatanu o více než 16 % je příznivým rysem a signalizuje návrat k originální molekule. Důvody jsou odborné, navíc facilitované rozhodnutím distributora o snížení nákladů pro ordinaci odborného lékaře (tab. 3).
Tab. 3. Přehled preskripce vybraných antiglaukomatik v České republice v roce 2012 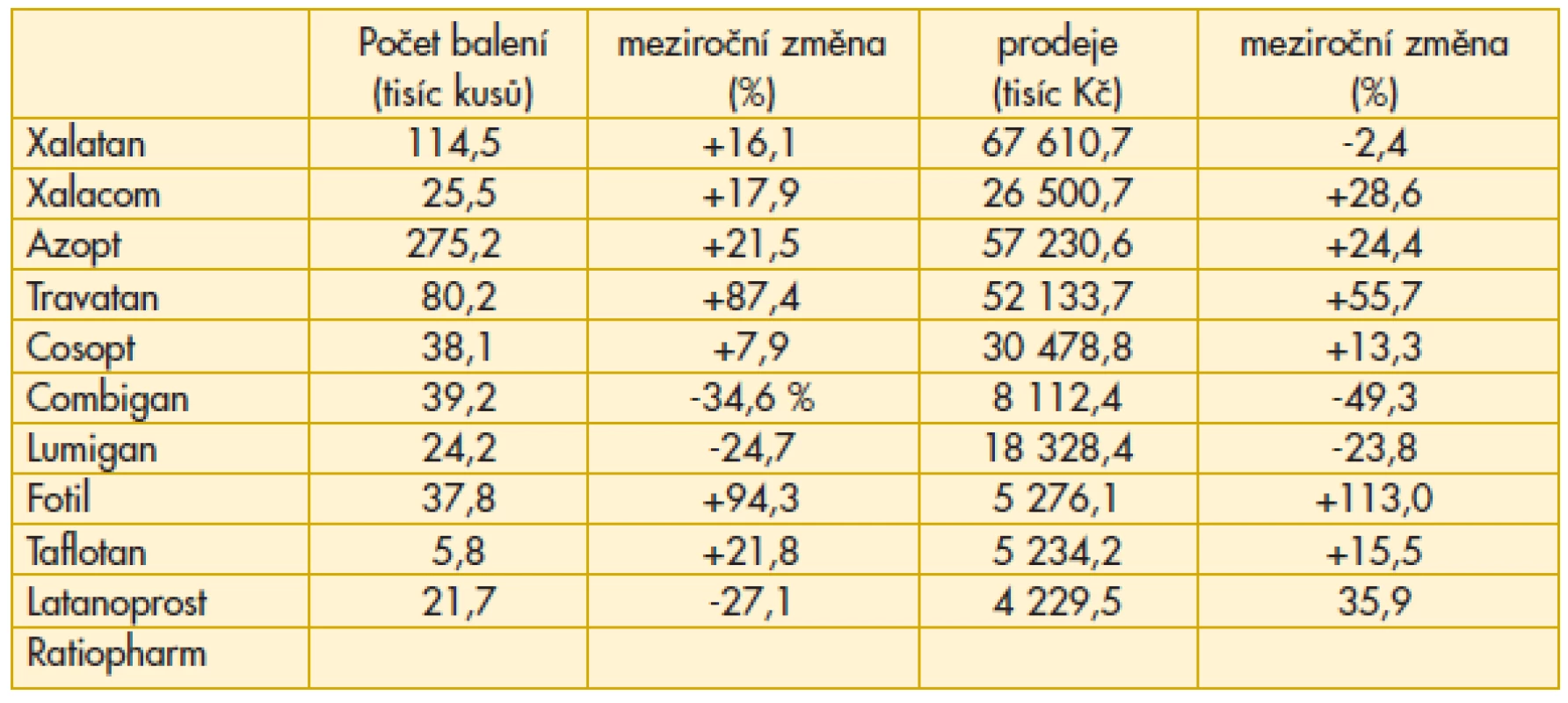
Nelze si nevšimnout výrazného nárůstu expedice Azoptu (+21,5 %), a zvláště Travatanu (+87,4 %). Při hledání zdůvodnění tohoto jevu lze zjistit, že zde není žádná odborná souvislost, která by zdůvodnila vyšší preskripci. Vzhledem k legislativní úpravě je toto číslo výrazně navýšeno tzv. „reexportem“. Některé léky jsou totiž v České republice výrazně levnější než v sousedních zemích Evropské unie, takže pro obchodníky je to jasný signál k nákupu zde. Jedná se tedy pouze o ekonomickou záležitost, která však může mít negativní dopady na dostupnost konkrétního léku pro naše pacienty. Toto se již projevilo v jiných oblastech než v oftalmologii, ale v budoucnosti se můžeme s tímto problémem potýkat i v našem oboru.
Problémem preskripce Combiganu, ale i Cosoptu jsou vysoké doplatky pro pacienta – jak se bude situace vyvíjet dále je spíše otázka pro distributora, protože od státní správy řešení problému neočekávejme.
Pokles preskripce Latanoprostu Ratiopharm (-27 %) souvisí jednak s tím, že se zvýšila možnost volby mezi generiky latanoprostu, ale také se zde naplno projevuje přístup některých generických firem, které zpravidla řeší situaci v časovém horizontu jen několika málo let. Je třeba počítat i s jejich možnou strategií: budeme mít jiné generikum v jiném oboru, prodá se firma nebo distribuční práva k léku.
Preskripce Fotilu vzrostla meziročně o 94,3 %. Vysvětlení je jednoduché, avšak o to více tristní. Vzhledem k přerušení distribuce miotik (pilokarpinu) v originálním balení je oftalmololog nucen řešit situaci buď zajištěním preskripce pilokarpinu magistraliter, a to není vždy a všude jednoduchá záležitost, anebo preskripcí Fotilu, který však kromě miotika obsahuje i betablokátor, který je v řadě konkrétních případů kontraindikován. Veškeré snahy o komunikaci v této mezi odborníky a farmaceutickými firmami zůstaly bohužel bez konkrétní odezvy. Jak stručně a slušnou formou zhodnotit tuto situaci? Obchodní hledisko převážilo nad odbornými zájmy a dokonce i nad mnohaletou spoluprácí. Nic na tom nezměnil ani fakt, že terapeutické portfolio, se kterým obě strany léta společně pracovaly, bylo velmi široké. Aktuálním doporučením je možnost předepsání Pilogelu – jedná se však pouze o jednorázovou dodávku jako výsledek řešení problému nedostatku miotik mezi Českou oftalmologickou společností, Českou glaukomovou společností a distributorem. V budoucnosti nelze na možnost předepsání tohoto léku v České republice spoléhat a je třeba hledat další řešení pro pacienty s glaukomem úzkého úhlu. Podle statistik se jedná přibližně o 10 % pacientů s glaukomem, a to tedy znamená, že problém není zanedbatelný.
Sympatický je meziroční vzestup indikace Taflotanu o více než 1/5 (+21,8 %). Pro nás zásadním hlediskem při jeho hodnocení je vyřešení těch stavů, kdy pacient po vyzkoušení celé palety medikamentózní léčby se konečně zbavil nežádoucích vedlejších účinků konzervačních činidel.
4. Preskripce antiglaukomatik v Slovenské republice
- porovnání s preskripcí v České republice
Při analýze souhrnných dat o kvalitě a kvantitě preskripce antiglaukomatik v SR a ČR v roce 2010 a 2011 byly zjištěny zřetelné rozdíly mezi skladbou preskribovaných léků v obou státech a také v trendech léčby ve sledovaném časovém období (4,8).
V roce 2010 bylo v ČR distribuováno ve skupině antiglaukomatik 1,23 miliónů balení (22 % z balení oftalmologik celkově), s obratem 600 mil. Kč. Největší počet balení: Azopt (211 tisíc, Betoptic (89 tisíc) + Betoptic S (122 tisíc), Xalatan (97 tisíc). V roce 2011 zůstává celkový počet předepsaných antiglaukomatik bez výraznější změny, pouze s mírným nárůstem obratu. Zvýšila se preskripce Azoptu (227 tisíc), Xalatanu (99 tisíc) a Taflotanu na úkor Travatanu a Lumiganu, pouze mírný nárůst byl u Cosoptu, Xalacomu, bez významné změny Combigan a Ganfort, pokles Betopticu.
V SR je nápadným zjištěním meziroční pokles preskripce prostaglandinů v monoterapii a preference kombinované léčby – v roce 2010 Xalatan – 20 %, Travatan – 8 %, Cosopt +14 %, Combigan +4 %, největší počty předepsaných balení: Cosopt (109 tisíc), Xalatan (98 tisíc), Azopt (80 tisíc). V roce 2011 vzrostla preskripce Cosoptu (133 tisíc), Xalatanu (111 tisíc), Azoptu (87 tisíc), Xalacomu (49 tisíc), Unilatu (31 tisíc), Ganfortu (19 tisíc), bez výraznější změny je preskripce Combiganu, další pokles nastal u Travatanu a Lumiganu.
Celkem na antiglaukomatózní medikaci bylo v roce 2012 vynaloženo 7 180 000 EUR. V porovnání s předchozím rokem je zde meziroční nárůst +1,7 %. Tato částka činí 52,6 % z nákladů na všechna oftalmologika.
Popisované trendy pokračují i v roce 2012, avšak nárůst preskripce fixních kombinací je pomalejší (Cosopt, Ganfort) nebo beze změny (Combigan, Xalacom, Duotrav). V monoterapii analogy prostaglandinů zjišťujeme pokles preskripce Xalatanu, Travatanu, Lumiganu, nárůst Unilatu a dále navýšení Azoptu a Pilokarpinu. O své místo na trhu se začíná hlásit Taflotan (3 000 ks, 32 600 EUR) (tab. 4). Aktuální portfolio antiglaukomatik v České a Slovenské republice se samozřejmě liší. Na Slovensku např. není k dispozici Alphagan, ale Brimonal, chybí Timolol POS a Timohexal, běžně k dispozici jsou miotika a také Cosopt free (bez konzervačních činidel).
Tab. 4. Preskripce antiglaukomatik ve Slovenské republice v roce 2012 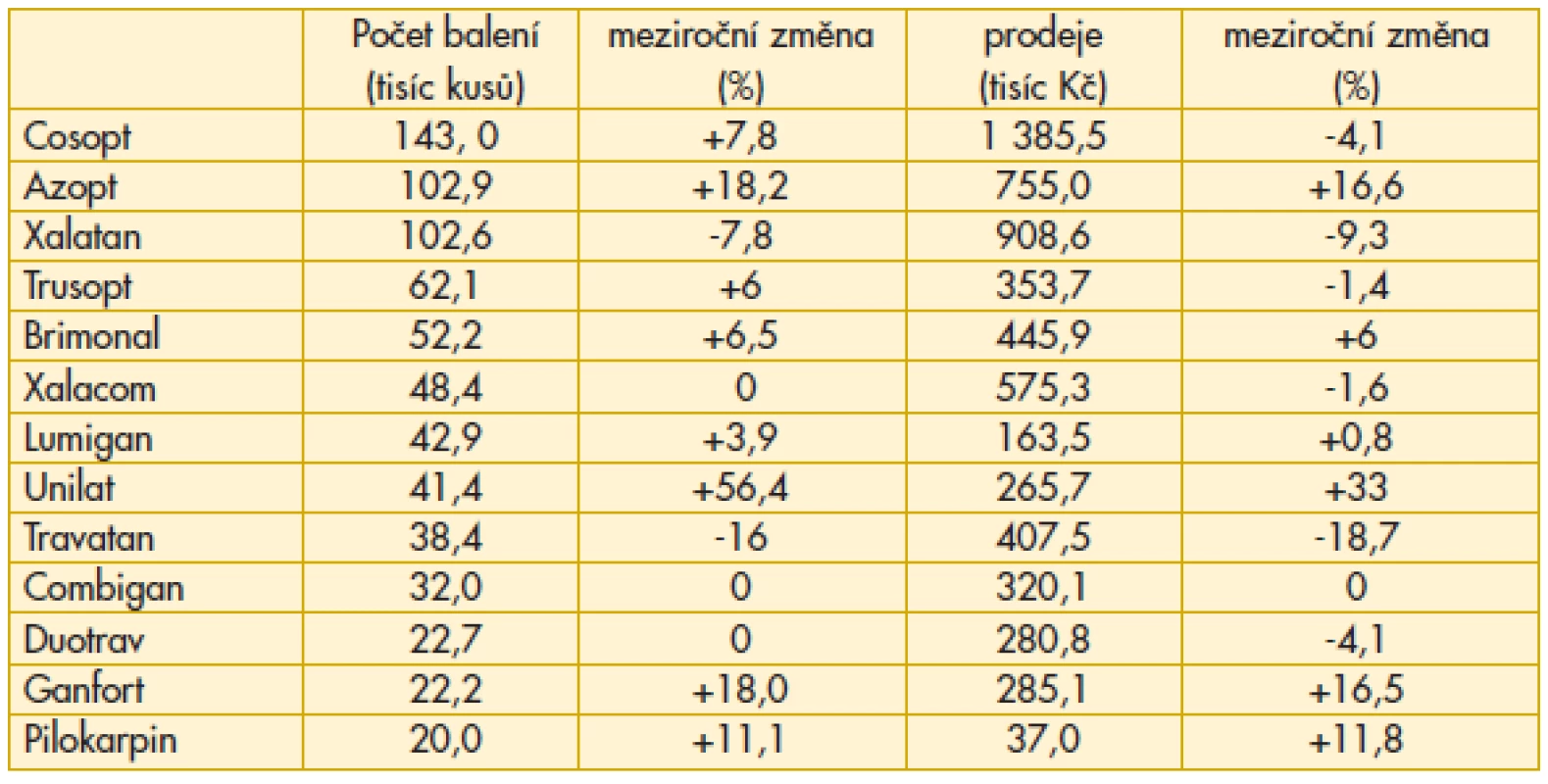
5. Význam a postavení generik
Jak na tuto problematiku nahlíží farmakolog?
Racionálně vedená farmakoterapie má zcela zásadní vliv na očekávanou délku života – vzrostla ze 78,5 na 79,9 roků. Právě přístup k novým léčivům se na tomto navýšení podílel nejméně z jedné třetiny. Tento nárůst byl nejvíce patrný v zemích s vyšší spotřebou léčiv. Zajímavý pohled skýtají statistiky Všeobecné zdravotní pojišťovny, kde se překvapivě – navzdory mediálním proklamacím – náklady na léky významně nezvyšují. V posledních letech naopak lze pozorovat mírný pokles u léčiv na předpis. Naproti tomu však narůstají náklady např. na ambulantní zdravotní péči nebo lázeňskou péči (2).
Jaká je cesta generického léku na trh? Při jejím sledování je třeba nejprve popsat všechny atributy spojené se vznikem léku originálního. Vývoj nového léku je velmi složitý proces. Z původního počtu 5–10 tisíc molekul jich do klinického hodnocení vstoupí asi 10 a do procesu registrace přibližně jedna. Tento proces je přitom velmi zdlouhavý, jeho délka je udávána v rozmezí 10–15 let (3–6 let preklinický výzkum, 5–7 let klinický výzkum, 0,5–2 roky registrace). Klinický výzkum sestává z fází I-IV: v I. fázi je léčivo testováno na malé skupině zdravých dobrovolníků, ve II. fázi na malé skupině nemocných a ve III. a IV. fázi na velkých skupinách nemocných, kdy jde o studie velmi často kontrolované placebem, nebo je účinnost aktivní látky porovnávána s jiným aktivním komparátorem. Patentová ochrana sice činí 20 let, avšak datuje se od okamžiku objevení dané konkrétní molekuly, nikoliv od okamžiku uvedení léku na trh. V posledních letech pozorujeme trend významného nárůstu nákladů spojených s vývojem nového léčiva. Zatímco v roce 1979 byla tato cena odhadována na částku kolem 100 miliónů amerických dolarů, v roce 2005 se jednalo již o více než 1,3 miliardy amerických dolarů. Zdaleka nejnákladnější položkou jsou v rámci vývoje klinické studie (II. fáze). Podle Asociace inovativního farmaceutického průmyslu (AIFP) jsou náklady na vědu a výzkum téměř 8x vyšší, než je průměrný podíl těchto výdajů v České republice, a významně převyšuje i tradiční průmyslové sektory – např. automobilový průmysl. Členské společnosti AIFP přitom zaměstnávají třicetkrát více pracovníků ve vědě a výzkumu, než je průměr v ČR. V roce 2009 náklady na vývoj u nás činily 1,2 miliardy Kč. Na nejrůznějších administrativních poplatcích bylo SÚKL v témže roce odvedeno 156 miliard Kč.
Výzkum a vývoj nového léčiva je velmi složitý proces, přičemž samotná výroba probíhá za přísných podmínek dobré výrobní praxe (GMP – good manufacturing practice). Proces je přísné kontrolovaný na úrovni chemické a analytické. Například přípravek Xalatan byl během svého vývoje a následného postmarketingového sledování testován v 98 klinických studiích, kterých se zúčastnilo celkem 62 670 pacientů.
Protože složení pomocných látek v originálu a v generiku může být výrazně odlišné, mohou se projevit rozdíly ve snášenlivosti nebo výskytu nežádoucích účinků. Může být ovlivněna i rozpustnost, účinnost, penetrace účinné látky. Partikulární částice mohou zvýšit podráždění očí, rozdíly ve viskozitě a napětí mohou vést k neostrému vidění. U generik mnohdy scházejí dostatečné důkazy z klinických studií o bezpečnosti a data z dlouhodobého používání. Podle směrnic Evropské lékové agentury (EMA) je však možné v případě, že generické léčivo je registrováno národní registrační procedurou, bez jakýchkoliv dalších studií pouze na základě prokázání identického složení požádat o tzv. biowaver, výjimku.
Přichází do ordinace reprezentant farmaceutické firmy s výrokem: „Máme studii!“? Ptejte se, kde se tato studie nachází podle hierarchie průkazných fakt. Ta je dána podle následujícího schématu – klinická zkušenost (clinical experience), kazuistika (case report), soubor kazuistik (case series), zkřížená analýza (cross-sectional analysis), case control, cohort, controlled, prospective randomized control trial (RCT). Může se jednat o marketingovou studii, která mnohdy nemusí mít dostatečnou vypovídající hodnotu.
Srovnání účinnosti a bezpečnostního profilu originálu a generik je ve středu zájmu pacientů i lékařů nejen v oblasti glaukomu, ale také při léčbě antibiotiky, steroidy nebo nesteroidními antiflogistiky. V období končící patentové ochrany originální molekuly se vyrojí mnoho žádostí k příslušným státním lékovým registračním úřadům (např. v USA k FDA,v ČR k SÚKL).
Zatímco v USA a dalších zemích je patrný velmi výrazný rozdíl v ceně mezi originálním a generickým přípravkem, v ČR díky systému referenčních úhrad je nižší cena nově zavedeného generika determinující pro cenu originálu. Z hlediska plátce, respektive úspor ve zdravotním systému, zde není tolik vyjádřený tlak po využívání generické alternativy. Přitom vzhledem k odlišnému složení pomocných látek je možné očekávat i odlišnou klinickou účinnost. Z čistě praktického hlediska je tedy možno konstatovat, že vzhledem ke stávajícímu systému cen a úhrad v ČR, kdy úhrada se vztahuje na účinnou látku, je v kontextu výše uvedeného výhodnější volba originálního přípravku, ačkoli platná legislativa jej považuje za zaměnitelný s generickými přípravky.
Jak na tuto problematiku nahlíží oftalmolog?
Jako základní soubor oficiálních informací o přípravku slouží odborníkovi souhrn údajů o výrobku, sledování odborné literatury včetně kazuistik (3), laikovi hlavně příbalová informace o léku. Z pohledu laika však obsahují tyto příbalové informace příliš mnoho zahlcujících údajů, takže odrazují od čtení, anebo s ohledem na velikost písma dokonce nejsou někteří pacienti ani schopni miniaturní text číst. Z právního hlediska však většina informací zde uvedena být musí. Od předepisujícího lékaře, který by měl pacienta seznámit se všemi možnými riziky před zahájením léčby, je očekávána podrobná znalost těchto dokumentů. Co z nich lze vyčíst? Mimo jiné údaje o tom, kde je lék vyroben a kde je registrován. Dále např. fakt, že pediatrická indikace analog prostaglandinu je schválena pouze u Xalatanu a Latanoprostu POS. Celou řadu léků lze indikovat až od 18 let, nikoliv v těhotenství a při kojení. Lék může způsobit rozostřené vidění, oční infekce – konjunktivitidy, snížení citlivosti oka na dotek, ovlivnit schopnost řídit motorové vozidlo a obsluhovat stroje, může způsobit otoky rohovky, sinusitidy, poruchy chuti, epistaxi, vzácně Peyronieho nemoc, u kojících samic potkanů je příčinou pomalejších přírůstků hmotnosti mláďat, je popisován teratogenní účinek u králíků nebo postup při otravě při perorálním použití. Při podrobném studiu příbalové informace je možno zjistit i to, že konkrétní lék je nutno uchovávat po celou dobu užívání v krabičce, a dále že v monoterapii k dosažení účinnosti se aplikuje 3x denně.
6. Konzervační činidla – denní dávka benzalkonium-chloridu v léčbě glaukomu
Přítomnost konzervačních činidel v očních kapkách může mít v závislosti na koncentraci cytotoxický účinek na buňky rohovky a spojivky a také způsobovat pacientům objektivní potíže (1, 5, 7, 9). Velmi zajímavé je proto srovnání koncentrace benzalkonium-chloridu (BAC) v jednotlivých přípravcích používaných v léčbě glaukomu. Nejvýznamnějším kritériem v tomto sledování je kalkulace denní dávky BAC pro jednotlivá antiglaukomatika na základě velikosti kapky a koncentrace BAC. Údaje byly získány metodikou popsanou v naší předchozí práci na toto téma (7). V případech, kde to bylo nutné, byly provedeny kalkulace na základě ověření aktuálního průměrného obsahu v několika baleních. Denní dávka BAC se podle vybrané terapie výrazně liší – od 0 do 10 mikrogramů. Koncentrace BAC je jedním z nejdůležitějších faktorů ovlivňujících compliance pacienta při léčbě primárního glaukomu otevřeného úhlu. Denní dávka BAC u jednotlivých léků používaných v léčbě glaukomu není nevýznamná a možné komplikace související s obsahem tohoto konzervačního činidla je zapotřebí vzít v úvahu při terapeutické rozvaze v zájmu dobré spolupráce nemocného. Frekvence aplikace léčiv byla kalkulována dle SPC. Uvádíme přehled denních dávek BAC u betablokátorů a alfamimetik (tab. 5). Přehled bude doplněn o analoga prostaglandinů, inhibitory karboanhydrázy a fixní kombinace, a poté bude publikován samostatně. Probíhá ještě kalkulace údajů pro všechna generika a jejich ověřování s následnou žádostí o vyjádření příslušných distributorů. U několika nových léků byly totiž kalkulovány vyšší denní dávky BAC ve srovnání s očekáváním.
Tab. 5. Denní dávka benzalkonium chloridu (BAC) v léčbě glaukomu betablokátory a alfamimetiky (ug) 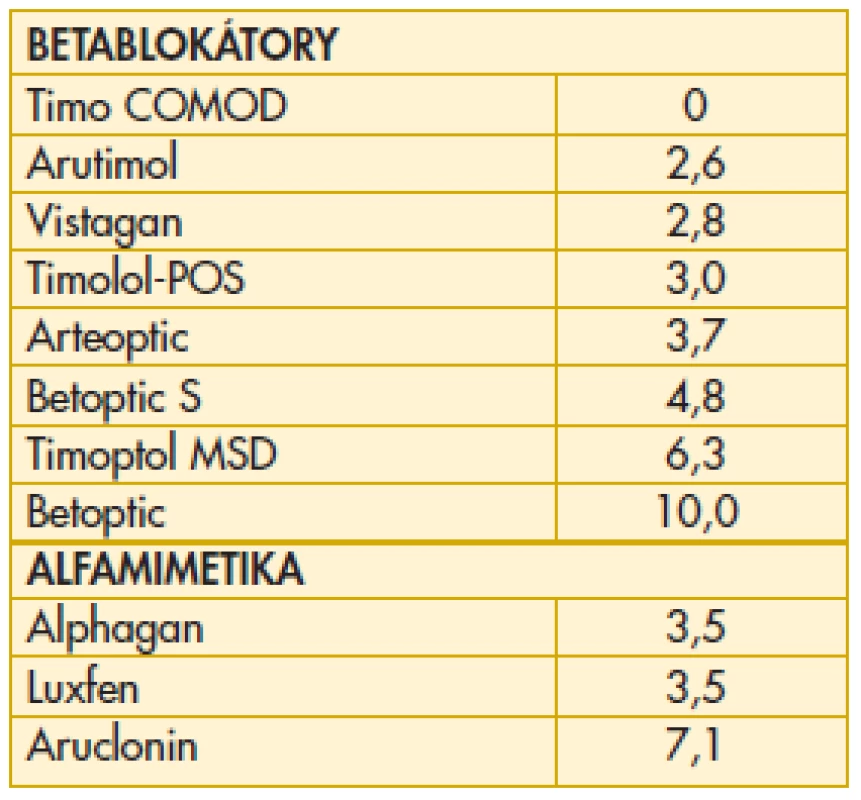
Glaukom a syndrom suchého oka se vyskytují často společně – podle odhadů až 60 % glaukomatiků má syndrom suchého oka. Bylo prokázáno, že BAC používaný jako konzervační činidlo v antiglaukomových kapkách způsobuje a zhoršuje syndrom suchého oka. S cílem zlepšit kvalitu života a compliance glaukomatiků, byly vyvinuty např. kapky BAC-free anebo se začaly využívat nanotechnologie. Cationic oil-in-water nanoemulsions (kationové olejové nanoemulze ve vodě) jsou novým typem bezkonzervačních nosičů očních léků s vlastnostmi chránícími oko. Obsahují pozitivně nabité olejové nanodroplety o velikosti 200 nm disperzované v izo-osmolární až lehce hypo-osmolární vodní fázi. Tyto olejové nanodroplety interakcí s negativně nabitým epitelem povrchu oka pomohou zlepšit působení očních kapek. Tyto interakce přispívají ke stabilizaci slzného filmu – zvýšení BUT u pacientů se syndromem suchého oka léčených Cationormem (Novagali Pharma, Evry, Francie).
Catioprost (Novagali Pharma) je bezkonzervační kationová nanoemulze oleje ve vodě, kde olejové nanodroplety obsahují latanoprost (0,005%). Preklinické studie ukazují, že tato léčba je stejně účinná jako Xalatan na opičím modelu zvýšeného nitroočního tlaku, a je velmi dobře snášena na modelu povrchu králičího oka – 42% snížení incidence hyperémie ve srovnání s Xalatanem. Při postižení rohovek u krysího modelu, po erozi a léčbě po dobu dvakrát denně Catioprostem – je popisováno zhojení rohovky bez jizev, zatímco po Xalatanu a jeho nosičích vznikla významná opákní rohovková jizva pod zhojeným epitelem. Catioprost je lepší u glaukomatiků se syndromem suchého oka než BAC-free antiglaukomová léčba (1, 5).
Při rozhodování o léčbě se však nelze řídit pouze uvedenými čísly nebo plány do budoucna – léčba glaukomu je komplexní, dlouhodobá a vyžaduje individuální přístup.
7. Další faktory v rozhodování o výběru léčby glaukomu
Registrační procedura a poregistrační sledování očních přípravků – jak na tuto problematiku nahlíží SÚKL?
Za registraci léčivých přípravků v ČR zodpovídá Státní ústav pro kontrolu léčiv (SÚKL), který posuzuje kvalitu (složení, množství a druhy nečistot, fyzikálně-chemické vlastnosti přípravku, výrobní postup), účinnost a bezpečnost přípravku prokázanou vědeckými publikacemi, in vitro a in vivo studiemi, klinickými a bioekvivalenčními studiemi provedenými žadatelem.
Většina očních přípravků se v současnosti v ČR registruje jako generika. To znamená, že se musí zásadně podobat referenčnímu přípravku (originálu), u kterého je účinnost a bezpečnost již prokázaná. Vývoj generického očního přípravku se řídí pokynem Note for Guidance on the Clinical Requirements for Locally Acting, Locally Applied Medicinal Products Containing Known Constituents. Oční přípravky spadají do skupiny lokálně působících přípravků, to znamená, že účinkují pouze v místě aplikace a jakékoli systémové působení se považuje za nežádoucí účinek. Pokud existuje podezření na systémové vstřebávání z místa aplikace, musí žadatel doložit výsledky toxikologických a bezpečnostních studií. Toto platí zejména pro přípravky, které obsahují například zatím neznámou pomocnou látku, anebo pro přípravky, jejichž konečná kompozice (směs všech účinných a neúčinných látek) potenciálně způsobuje systémové vstřebání. Také je třeba brát v úvahu fakt, že i samotné onemocnění může ovlivnit vstřebávání látek.
Terapeutická ekvivalence referenčního a testovaného přípravku se může prokazovat dvěma způsoby. Tím prvním je tzv. farmaceutická ekvivalence, což je zásadní podobnost dvou přípravků z hlediska kvality. Referenční a testovaný přípravek musí mít stejné kvalitativní a kvantitativní složení. Malé rozdíly jsou akceptovatelné pod podmínkou, že jsou žadatelem podrobně zdůvodněné, a že není předpokládán vliv na bezpečnost a účinnost přípravku. Příkladem je jiné množství pufrů za účelem dosažení optimální pH přípravku. Dále se hodnotí druh a množství nečistot v přípravku. Nečistoty jsou specifikovány v Evropském lékopise a v Českém lékopise. V testovaném přípravku nesmí uvedené hodnoty přesahovat povolené limity.
Za účelem průkazu farmaceutické ekvivalence provádí žadatel řadu srovnávacích in vitro testů, například stanovení osmolarity, pH, viskozity, velikosti kapky, tj. všech parametrů, které mohou ovlivnit velikost dávky a následně účinnost a bezpečnost. Výsledky těchto testů se u referenčního a testovaného přípravku mohou lišit jen minimálně.
Zásadní podobnost dvou očních přípravků se také může prokázat klinickou studii terapeutické ekvivalence. Tyto studie se podobají klinickým studiím fáze III, a vzhledem k časové a finanční náročnosti se provádějí méně často. Žadatel je obvykle provádí, pokud není schopen prokázat farmaceutickou ekvivalenci dvou přípravků, tj. pokud se složení a fyzikálně-chemické vlastnosti testovaného a referenčního přípravku výrazně liší.
Po ukončení registračního řízení se léčivý přípravek může uvést na trh a začít používat v klinické praxi. Tímto se dostává do poregistrační fáze, kde se sleduje jeho přítomnost na trhu, kvalita a výskyt nežádoucích účinků.
Přítomnost přípravku na trhu je monitorována prostřednictvím hlášení dodávek distributorů každé tři měsíce. Pokud léčivý přípravek není uveden na trh během tří let od udělení rozhodnutí o registraci, registrace zanikne, a není možné jej nadále uvádět na trh. Před zrušením registrace z důvodu nepřítomnosti na trhu se vždy zhodnotí, zda je léčivý přípravek nahraditelný v klinické praxi jiným přípravkem, a zda je nepostradatelný pro ochranu veřejného zdraví. Pokud jsou splněny obě tyto podmínky, léčivému přípravku je udělená tzv. výjimka a na trhu zůstává. Pokud nejsou současně splněné obě podmínky, ruší se rozhodnutí o registraci a lék již nemůže být nadále uváděn na trh.
V současné době se SÚKL často setkává se situací, kdy z různých důvodů dochází k přerušení dodávek léčivého přípravku. Přerušení dodávek může být způsobeno například chybou ve výrobě, (včetně chyb v souhrnu údajů o přípravku, obalu či příbalové informaci) nebo častěji, neschopností smluvních výrobních organizací a dodavatelů účinných a pomocných látek pokrýt poptávku. Držitel v takových případech podle zákona č. 378/2007 Sb. o léčivech a o změnách souvisejících ve znění pozdějších předpisů má povinnost oznámit SÚKL přerušení, včetně data přerušení a data obnovení dodávek. Přerušení dodávek by mělo být nahlášeno nejméně dva měsíce předem, aby SÚKL měl dostatek času na to zhodnotit, zda je přípravek v klinické praxi nahraditelný jiným, a aby popřípadě podnikl kroky k zabezpečení plynulosti dodávek (například povolení dovozu cizojazyčné šarže, či povolení dovozu šarže, která není vázána na stejnou dokumentaci, kterou SÚKL při registračním řízení schválil).
Nástroje SÚKL, jak zamezit výpadkům léčivých přípravků, jsou relativně omezené, a mnohdy záleží na schopnosti držitele najít a dovést do ČR vhodnou šarži přípravku.
Dalším aspektem poregistračního sledování léčivých přípravků je monitoring jakosti a souladu s registrační dokumentací, a informacemi uvedených v souhrnu údajů o přípravku. Podněty týkající se závad v jakosti se přijímají od pacientů, lékařů, držitelů rozhodnutí o registraci, distributorů, výrobců nebo jiných regulačních autorit. V roce 2012 obdržel SÚKL podnět o nesouladu údajů o počtu kapek v mililitru přípravku uvedeného v SPC se skutečným obsahem. Na základě takového hlášení zahájil SÚKL systematickou kontrolu očních přípravků s cílem ověřit, zda počet kapek v mililitru skutečně odpovídá množství uvedenému v souhrnu údajů o přípravku. Z 58 testovaných vzorků vyhovovalo specifikacím 89 %. Držitelé rozhodnutí o registraci těch přípravků, u kterých byl nalezen nesoulad deklarovaného a skutečného množství kapek, musí v souhrnu údajů o přípravku a příbalové informaci tuto skutečnost opravit. Alternativním řešením je stažení z trhu z důvodu závady v jakosti.
Hlášení nežádoucích účinků po registraci léčivého přípravku je nedílnou součásti životního cyklu léčivého přípravku, a přináší velmi cenné informace o charakteristikách přípravku, které nebyly zaznamenány v průběhu klinických hodnocení. Zdravotničtí pracovníci mají zákonnou povinnost hlásit SÚKL všechna podezření na nežádoucí účinky (tab. 14). SÚKL přijímá hlášení podezření na nežádoucí účinek i od pacientů. Dalšími zdroji informací o nežádoucích účincích po uvedení léčivého přípravku na trh jsou jednotlivé případy publikované v odborné literatuře, farmakoepidemiologické studie či poregistrační klinická hodnocení. Všechna hlášení SÚKL zpracovává, a následně předává do Evropské databáze nežádoucích účinků Eudravigilance a Světové zdravotnické organizace (WHO). Příčinnou souvislost mezi užitím léku a nežádoucím účinkem hodnotí experti v oblasti farmakovigilance jako nepravděpodobnou, možnou, pravděpodobnou, nebo jistou. Pokud je podobných hlášení víc, vzniká farmakovigilanční signál. Další ověření farmakovigilančního signálu ukáže, zda byl objeven nový nežádoucí účinek. Pokud je dostatek údajů, určí se frekvence výskytu, a informace je přidána do souhrnu údajů o přípravku a příbalové informace. Také se na základě hodnocení signálů může změnit frekvence anebo závažnost již známého nežádoucího účinku, nebo zrušit registrace léku. V některých případech jsou nežádoucí účinky identifikované po uvedení léčivého přípravku na trh tak významné, že rizika převažují nad přínosy léčby. V takovém případě dojde k zrušení registrace. Informace o nežádoucích účincích jsou publikovány na stránkách SÚKL a EMA.
Zdravotničtí pracovníci by měli hlásit nežádoucí účinky, které jsou život ohrožující, mají za následek smrt, vyžadují hospitalizaci, mají za následek trvalé či významné poškození zdraví nebo omezení schopnosti, nebo se projeví jako vrozená anomálie či vrozená vada u potomků. Dále se hlásí neočekávané nežádoucí účinky, jejichž povaha, závažnost nebo důsledek jsou v rozporu s informacemi uvedenými v souhrnu údajů o přípravku. Měly by se také hlásit nežádoucí účinky, které přinášejí nové vědecké poznatky a jsou zajímavé z klinického pohledu. Konkrétně u očních přípravků nejdůležitější jsou případy, kdy jsou nežádoucí účinky způsobeny systémovou absorpcí léčivé látky. SÚKL může kontaktovat hlásící osobu v případě, že je potřeba něco doplnit nebo ujasnit, ale informace o hlásící osobě nesděluje třetím stranám.
Off-label použití léčivého přípravku je takové použití, které není v souladu s informacemi uvedenými v souhrnu údajů o přípravku. Může to být užívání u jiné populace pacientů (například pediatrické), vyšší nebo nižší než schválená dávka nebo způsob užívání, použití některé vlastnosti léčiva v nelékařských případech (například použití přípravku Lumigan pro podporu růstu řas), atd. Off-label používání není protizákonné, ale zákon č. 378/2007 Sb. o léčivech v §8 specifikuje, za jakých podmínek se může léčivý přípravek používat off -label. Léky se mohou požívat off-label, pokud neexistuje jiný léčivý přípravek se schváleným použitím a pokud je takové použití dostatečně vědecky odůvodněno. Ošetřující lékař je povinnen předem oznámit pacientovi, že jde o off-label užívání. Za případné poškození zdraví odpovídá provozovatel zdravotnického zařízení.
Dalšími významnou kapitolou z pohledu lékaře i pacienta je dostupnost léků.
Zdravotní pojišťovny v Německu platí lékárníkům bonusy za šetření nákupem levnějších léků – například v České republice. Některé léky kvůli nízké ceně u nás dokonce výrobci stáhnou z distribuce. Zároveň však funguje mechanismus, kdy stát hlídá, aby některý lék nebyl v ČR dražší než jinde v Evropě. Z toho plyne významný fakt – v oficiálních přehledech nákladů na léky a v praxi je významným rysem současnosti fenomén tzv. „reexportu“. Kvůli nižší ceně jsou některé léky nakoupeny u nás a vyvezeny do zahraničí. Tento únik do ciziny se aktuálně týká více než 300 léků. V některých případech tato situace zatím příliš nevadí, ale v řadě případů již ano. Výsledkem této situace je, že některé léky nejsou pro naše pacienty k sehnání. Problém špatné dostupnosti na našem trhu vznikl např. u těchto léků: Humalog, Clexan, Berudual, Remicade, Mycardis, Prestance, Asmanex, léčby pro HIV pozitivní, apod.
Některé firmy řeší tuto situaci metodou přímé distribuce do některých lékáren, kdy lék je dodáván již pro konkrétního pacienta. Tento stav samozřejmě zdaleka není ideální, navíc pro firmu tak vznikají další náklady. Z návrhu zákazu reexportů, který by byl řešením problému, zbyla změna odhlasovaná legislativci v únoru 2013: distributoři budou povinni hlásit, co vyvážejí. Omezení vývozu by mohlo být chápáno jako „porušení svobody obchodu“, a tak se problém posunul z odborné roviny na politické kolbiště. Nejde o malé peníze – jde-li odhadem 20 % trhu na reexport, pak se jedná o 10 miliard Kč. Na Slovensku zákaz reexportu možný je, i když údajně v rozporu s evropskou legislativou „volného trhu“. Riskuje se totiž jen „napomenutí“.
Preskripční a indikační omezení
V ČR je uplatňována řada regulačních opatření snižující náklady na zdravotní péči, mezi jinými též opatření, že některé léky budou hrazeny z veřejného zdravotního pojištění, jen pokud budou předepsány určitými specialisty, nebo pouze u pacientů s určitým zdravotním stavem (6). Za období několika let vzrostl počet léčivých přípravků, které jsou takto omezeny, na více než dvojnásobek. V EU nejméně šest zemí omezuje preskripci léků na diagnózu (Švédsko), omezení na odbornost určitou formou však bylo zjištěno pouze v Rakousku a Nizozemsku. Na rozdíl od ČR bývají takto omezeny pouze vysoce specializované léky (nové biologické léky, nová onkologika).
Preskripční a indikační omezení pro léčivé přípravky patří do „podmínek úhrady“, která stanovuje SÚKL spolu s výší úhrady v rámci správních řízení. Preskripční omezení znamená, že léčivý přípravek předepisuje pouze lékař příslušné odbornosti (symbol E) nebo jej může předepisovat jiný lékař, avšak na základě písemného schválení lékaře příslušné odbornosti (symbol L). Symbol P znamená, že SÚKL definoval indikace, u kterých je léčivý přípravek hrazen z veřejného zdravotního pojištění.
Před rokem 2008 byla tato omezení diskutována v rámci kategorizační komise se zástupci odborných společností, tedy lékařů, kteří umějí posoudit účelnost takových opatření. Nyní jsou oponenty SÚKL pouze zdravotní pojišťovny a zástupci farmaceutických firem, není tedy divu, že se pohled klinického lékaře v některých případech vytrácí.
Z uvedeného je zřejmé, že preskripční a indikační omezení jsou někdy spíše dílem právníků než erudovaných regulátorů, kteří jsou dostatečně seznámeni s lékovou problematikou v klinické praxi. Proto úspory deklarované na papíře se pak ve skutečnosti mohou stát ztrátami. K tomu přispívají další byrokratická opatření. Dříve totiž platilo, že lékař musí mít příslušnou odbornost – atestaci. Nyní je příslušnou odborností míněna ta odbornost, kterou má lékař (respektive pracoviště zdravotnického zařízení) uvedenu ve smlouvě se zdravotní pojišťovnou. Prakticky ke každému novému léku (kromě generik) je takové omezení stanoveno, avšak jen málo léků omezení ztrácí.
Není jiný stát, kde by lékař byl automaticky pokutován za překročení omezení preskripce na odbornost lékaře. Vyspělé země upřednostňují systematickou podporu účelné farmakoterapie, pravidelné rozbory preskripce a provádění auditů tam, kde je podezření na suboptimální péči, nejen z hlediska plýtvání, ale i z hlediska kvality zdravotní péče.
Informace o úhradách, cenách a výši případného doplatku léčivých přípravků
Pomocníkem oftalmologovi při rozhodování o léčbě pacienta s glaukomem může být i portál ministerstva zdravotnictví ČR. V sekci „Léky“ lze najít řadu užitečných údajů. Uvádíme výběr ze sledovaných pojmů a také nejzajímavější údaje u některých léků, které mohou sloužit v lepší orientaci v této problematice pro lékaře i pacienta. „Maximální úhrada zdravotní pojišťovny“ - výše úhrady léčivého přípravku zdravotními pojišťovnami z veřejného zdravotního pojištění – promítne se v nákladech zdravotnického zařízení.„Nejvyšší možná cena v lékárně při výdeji na předpis“ - léčivý přípravek podléhá /nepodléhá regulaci maximální cenou (cenový předpis MZ 1/2012/FAR z 12. 12. 2011). Vychází z maximální ceny stanovené SÚKL/výrobcem, navýšena o maximální obchodní přirážku a DPH. „Nejvyšší možný doplatek pacienta při výdeji léčivého přípravku“ je rozdílem mezi nejvyšší možnou cenou v lékárně a maximální úhradou zdravotní pojišťovnou. „Průměrná aktuální cena v lékárně“ odpovídá průměrné ceně v uplynulém období na trhu v ČR – může se lišit v jednotlivých lékárnách. Jedna se o orientační údaj, vycházející z cen v distribuci navýšených o marži a DPH od 1. 1. 2013, s aktualizací vždy po 21. dnu následujícího kalendářního měsíce. „Výše doplatku započitatelného do ročního limitu“ – započítává se do limitu 5000 Kč (do 18 let a nad 65 let 2500 Kč).
„Průměrný aktuální doplatek pacienta“ odpovídá průměrnému doplatku v uplynulém období na trhu v ČR. Doplatky se mohou lišit v jednotlivých lékárnách. Právě tento ukazatel může být velmi užitečný při rozhodování pacienta nebo lékaře, kam zajít k vyzvednutí léku preskribované medikace (tab. 6–11).
Tab. 6. Miotika – maximální úhrada zdravotní pojišťovny, průměrný aktuální doplatek pacienta 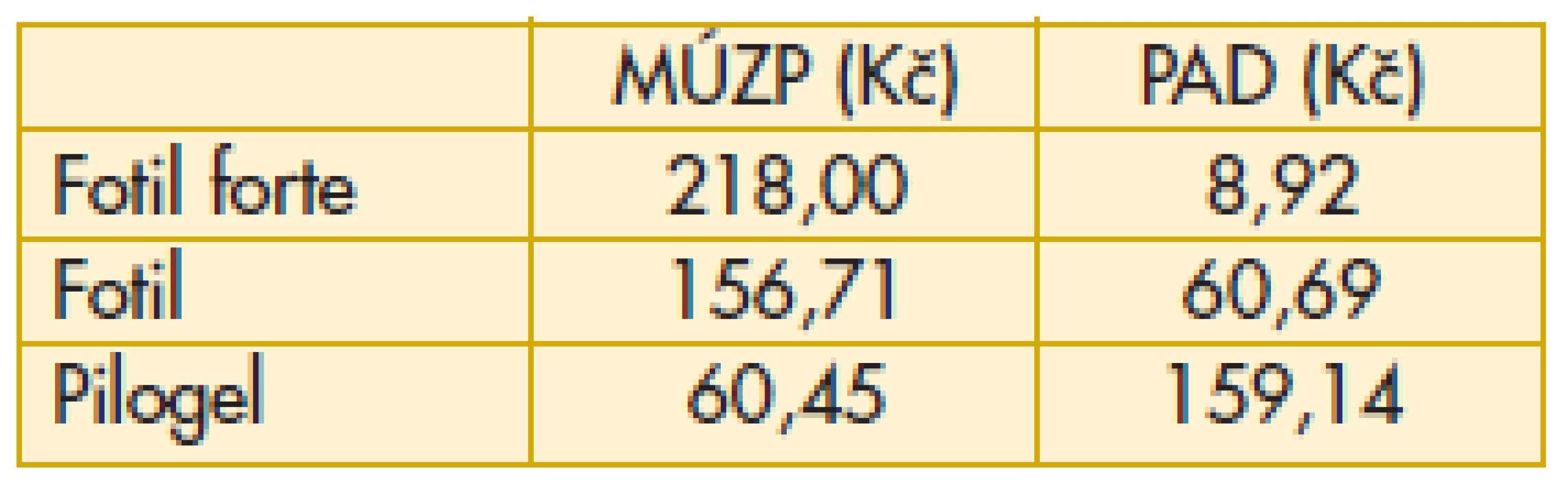
Tab. 7. Betablokátory – maximální úhrada zdravotní pojišťovny, průměrný aktuální doplatek pacienta 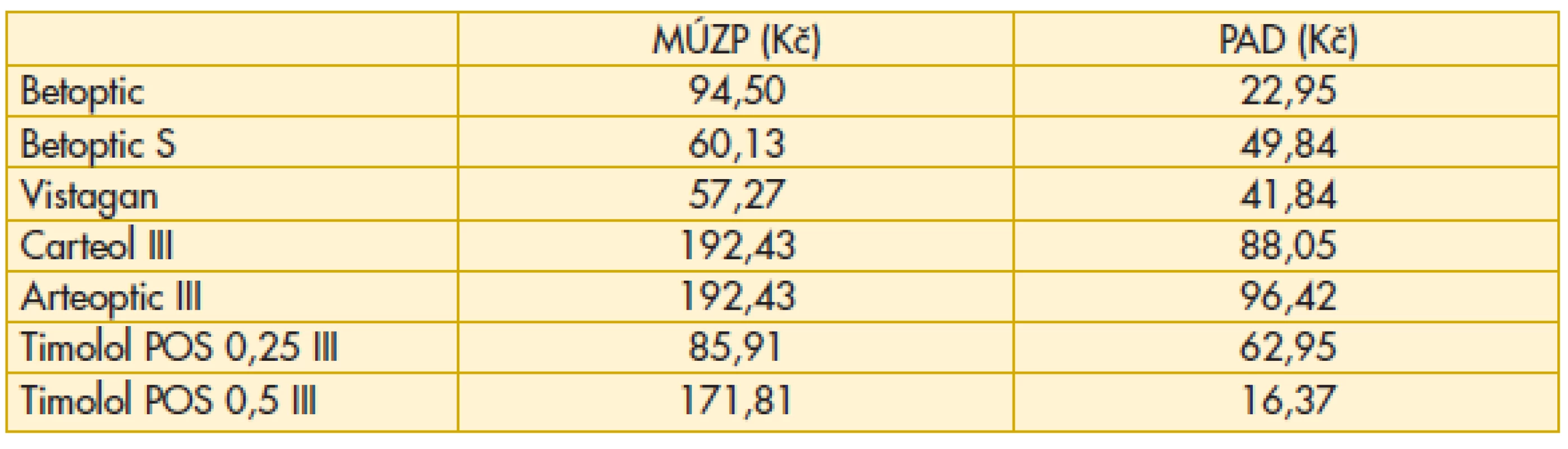
Tab. 8. Adrenergní agonisté – brimonidin – maximální úhrada zdravotní pojišťovny, průměrný aktuální doplatek pacienta 
Tab. 10. Analoga prostaglandinů, prostamidy – maximální úhrada zdravotní pojišťovny, průměrný aktuální doplatek pacienta 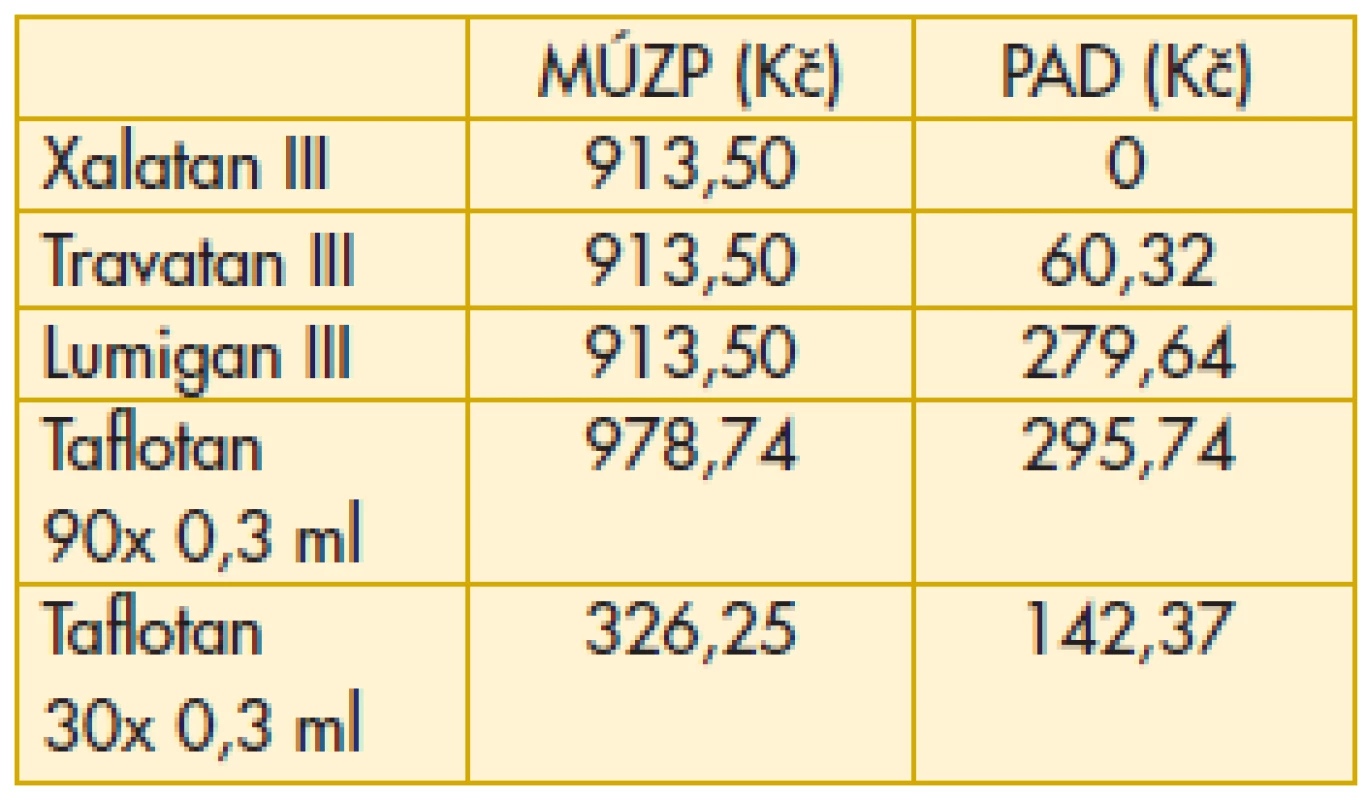
Tab. 11. Fixní kombinace – maximální úhrada zdravotní pojišťovny, průměrný aktuální doplatek pacienta 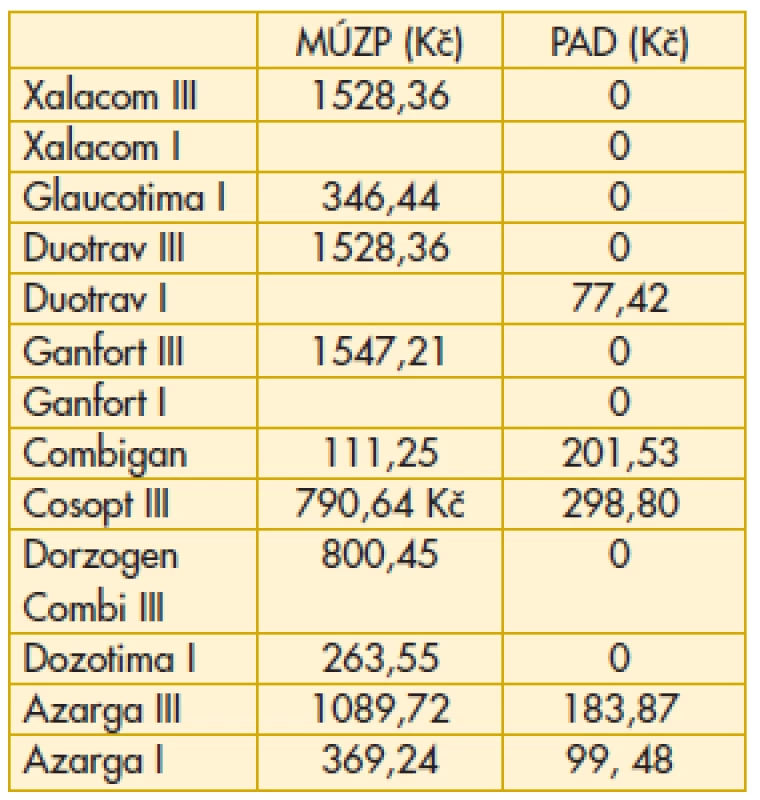
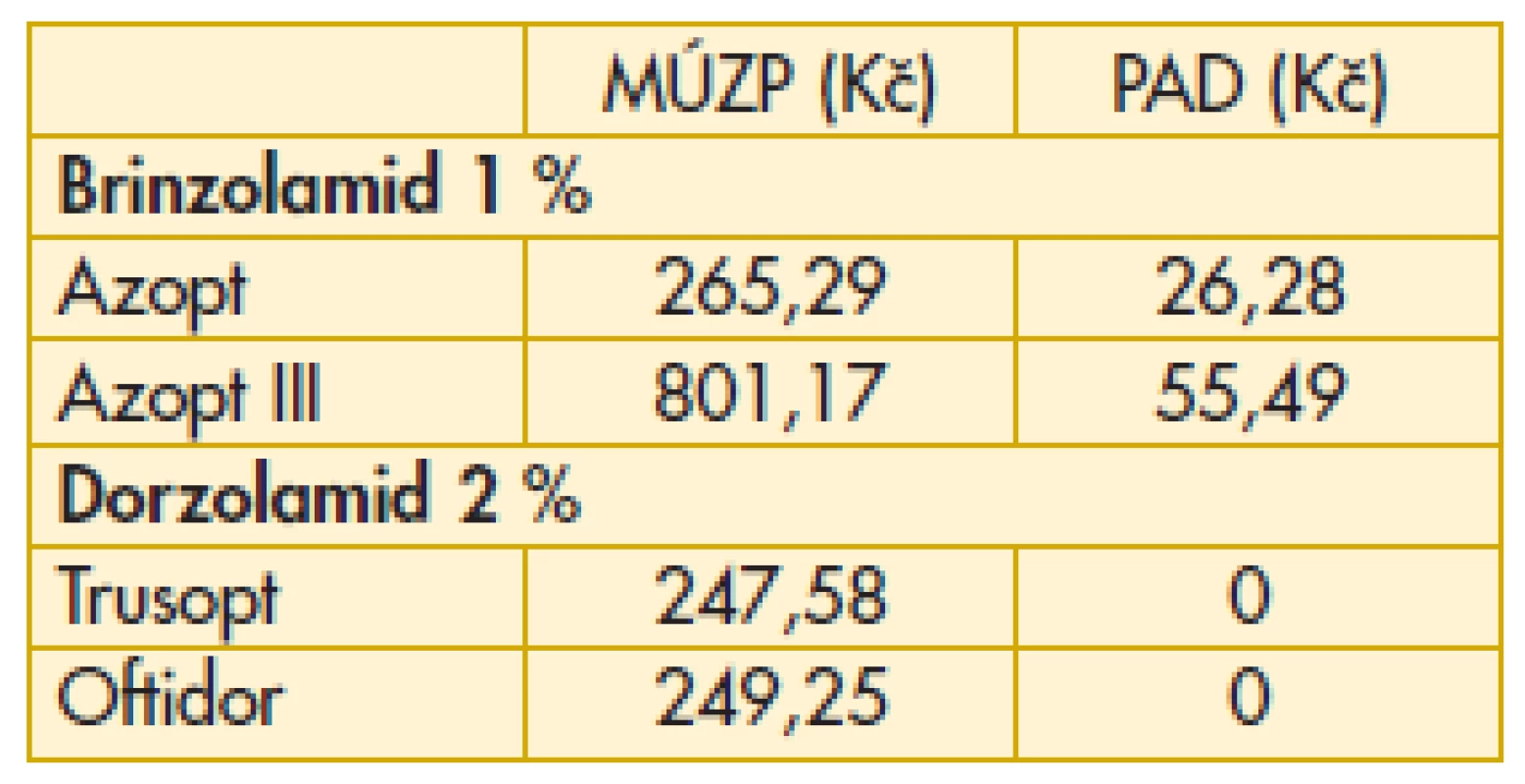
MÚZP – maximální úhrada ze zdravotního pojištění.
PAD – průměrný aktuální doplatek pacienta.
Komentář k nejzajímavějším údajům: Překvapivě z hlediska doplatku pacienta u miotik je nejvýhodnější trojbalení účinnějšího Fotilu forte (tab. 6). Betablokátory v léčbě primárního glaukomu otevřeným úhlem jsou oblíbenou variantou. V aktuálním přehledu doplatků pacienta se jeví finančně nejvýhodnější trojbalení 0,5% Timololu POS (tab. 7). Několikanásobný rozdíl v doplatku pacienta ve skupině adrenergních agonistů je zřetelný z tab. 8. Léčba glaukomu lokálními inhibitory karboanhydrázy je levná, přesto zde najdeme finanční rozdíly v doplatku pacienta (tab. 9). Inhibitor karboanhydrázy pro celkové podání je také s doplatkem pacienta – Diluran – PAD 13,03 Kč. Analoga prostaglandinů jsou z hlediska doplatku pacienta velmi zajímavou skupinou. Sledujme i na výšce průměrného aktuálního doplatku, jak reagují velké farmaceutické firmy na přítomnost generik na trhu (tab. 10). Také situace v PAD u fixních kombinací v léčbě glaukomu pomůže orientaci mezi jednotlivými léky (tab. 11).
8. Chirurgie glaukomu – náklady a porovnání s konzervativní léčbou
Bodové ohodnocení operativy glaukomu (tab. 12) je názorným důkazem naprosto nedostatečného ohodnocení odborné práce oftalmochirurga. I kdyby byla hodnota bodu garantována na 1 Kč, pohybujeme se v cenových relacích za operativu glaukomu, které nedosahují hodnoty ani víkendového nákupu pro rodinu v supermarketu. Adekvátní by situace byla možná až po přijetí EUR, pokud by ovšem zůstalo zachováno i bodové ohodnocení. Pro zdravotní pojišťovny by tak v současné situaci bylo nejvýhodnější všechny glaukomové pacienty nechat levně operovat – další náklady s náročnou medikamentózní léčbou by pak odpadly. Realita je samozřejmě jiná a není předmětem tohoto článku.
Tab. 12. Sazebník výkonů – glaukomové operační kódy 
U určité skupiny pacientů je možné dosáhnout kompenzace až s použitím glaukomových implantátů. Uvádíme jejich aktuální přehled a cenové náklady (tab. 13).
Tab. 13. Oční glaukomové implantáty – ZUM 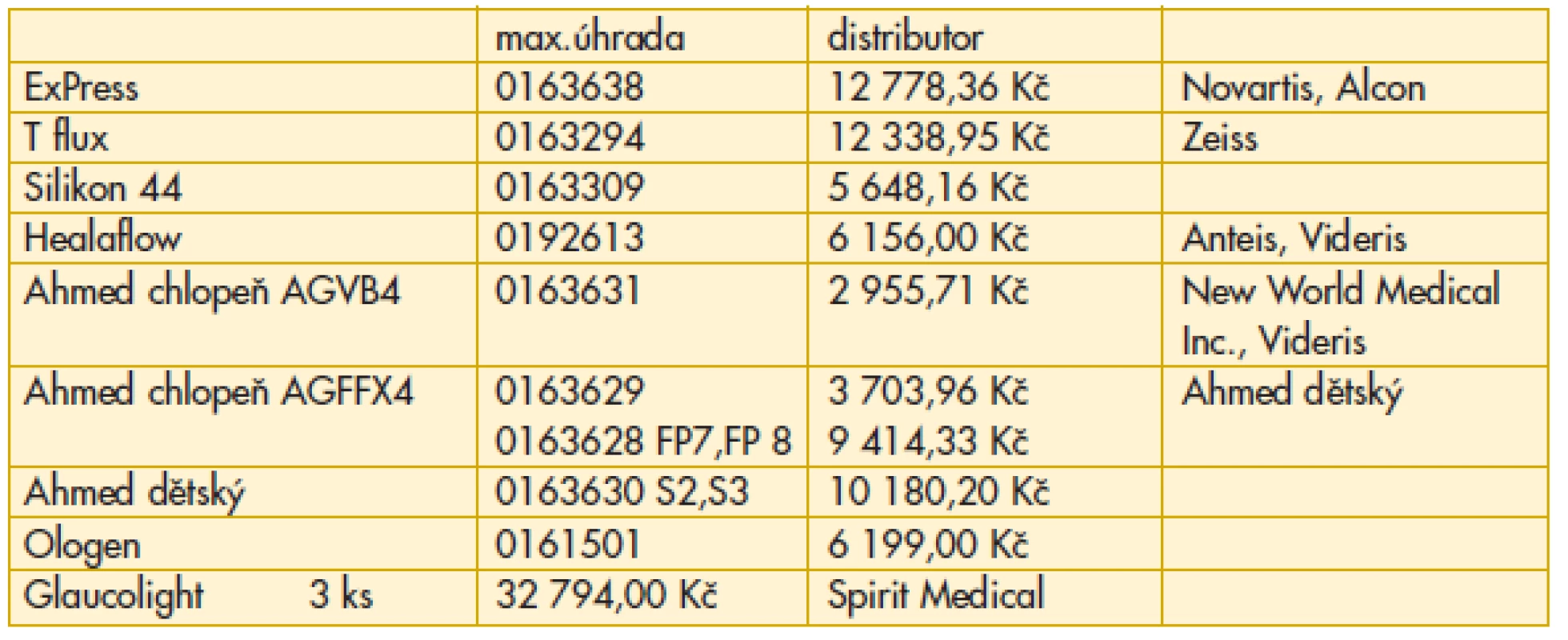
9. Závěr
V současné době jsme svědky výrazného pokroku v diagnostice i terapii glaukomu. Zásadně se zlepšila také informovanost pacienta o této chorobě díky médiím a zvláště internetu. K dispozici je velmi pestrá paleta léků ke konzervativní léčbě a mnoho nových intervenčních postupů. Lékař při rozhodování o léčbě se řídí nejenom zásadami dobré klinické praxe a svou erudicí, ale musí mít také na paměti řadu dalších souvisejících faktorů. Pacient i lékař se pohybují v konkrétním prostředí, kde se uplatňují nikoliv nepodstatné vlivy ekonomické, ale také legislativní. Pro lepší orientaci v této problematice vznikl ve spolupráci s farmakology a státní autoritou (SÚKL) přehled aktuálních dat a informací týkajících se terapie glaukomu.
Tab. 14. Hlášení podezření na nežádoucí účinek léčiva 
Webové stránky s obdobnou tematikou:
http:// www.zeleny-zakal.cz
http://www.sukl.cz – webové stránky SÚKL
http://www.mzcr.cz/léky – webové stránky Ministerstva zdravotnictví ČR – Informace o úhradách, cenách a výši případného doplatku léčivých přípravků hrazených z veřejného zdravotního pojištění
Do redakce doručeno dne 16. 5. 2013
Do tisku přijato dne 15. 7. 2013
MUDr. Petr Výborný, CSc., FEBO
Oční klinika 1. lékařské fakulty Univerzity Karlovy a Ústřední vojenské nemocnice,
U Vojenské nemocnice 1200, 169 02 Praha 6
e-mail: petr.vyborny@uvn.cz
Zdroje
1. Daull, P, Garriguie, J.S.: Preservative-free cationic nano emulsion of latanoprost. Ophthalmology Times Europe, Jan/Feb 2013 : 8–10.
2. Doležal, T.: Od molekuly k dlouhodobé spokojenosti pacienta. Farmakoterapie, 2; 6, 2012 : 4–6.
3. Herndon, L.W, Asrani, S.G., Williams, G. H. et al.: Paradoxial intraocular pressure elevation after combined therapy with latanoprost and bimatoprost. Arch Ophthalmol, 120; 2002 : 847–849.
4. IMS Health – analytická společnost, Praha, Dataview 2010–2012.
5. Liang, H., Baudoin, P., Daull, P. et al: In vitro and in vivo evaluation of preservative-free cationic emulsion of latanoprost in cornal wound healing. Cornea, 31; 2012 : 1319–1329.
6. Prokeš, M.: Prekripční a indikační omezení pro léky v České republice. Farmakoekonomika, 6; 2012 : 2–6.
7. Výborný, P., Sejčková, L.: Antiglaukomatika – obsah konzervačních látek a spolupráce pacienta v léčebném režimu. Čes a Slov Oftal, 62; 2006 : 270–274.
8. Výborný, P., Dohnalová, P., Sičáková, S.: Antiglaukomatika v číslech a tabulkách – trendy v preskripci. In Trendy soudobé oftalmologie, svazek 8, Ed. Rozsíval P., Praha, Galén 2012, 247–255.
9. Výborný, P., Fučík, M., Rozsíval, P.: Glaukom. In. Kuchynka P. et al. Oční lékařství, Praha, Grada 2007, 596–607.
Štítky
Oftalmologie
Článek Oznámení
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2013 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Familiární středomořská horečka
- Kontaktní dermatitida očních víček
-
Všechny články tohoto čísla
- Chirurgická liečba idiopatickej diery makuly naše skúsenosti
- Nové možnosti léčby vrozených chorob sítnice
- Hodnocení efektivnosti léčby neinfekčních uveitid
- Terapie glaukomu – aktuální přehled dat a informací
- Možnosti využitia včelieho medu v oftalmológii
- Neskorý rozvoj metastáz u pacientov s malým melanómom choroidey – 2 kazuistiky
- Devadesátiny primářky MUDr. Vlasty Doležalové, CSc.
- Oznámení
- Dvouleté výsledky léčby vlhké formy věkem podmíněné makulární degenerace s použitím léků proti vaskulárnímu endotelovému růstovému faktoru
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Terapie glaukomu – aktuální přehled dat a informací
- Nové možnosti léčby vrozených chorob sítnice
- Možnosti využitia včelieho medu v oftalmológii
- Chirurgická liečba idiopatickej diery makuly naše skúsenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání