-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Polysomnografické nálezy mužů s narkolepsií typu 1 ve věku nad 55 let
Autoři: P. Kovalská; J. Nepožitek; D. Kemlink; S. Dostálová; P. Peřinová; K. Šonka
Vyšlo v časopise: Cesk Slov Neurol N 2023; 86(6): 397-402
Kategorie: Původní práce
doi: https://doi.org/10.48095/cccsnn2023397Souhrn
Cíl: Srovnání polysomnografických parametrů nočního spánku pacientů mužů s narkolepsií typu 1 ve věku nad 55 let s věkově spárovanými kontrolami. Soubor a metodika: Soubor tvořilo 17 mužů (průměrný věk 66,1 ± 8,3 let) s narkolepsií typu 1, jejichž dříve získané záznamy polysomnografického vyšetření byly porovnány z hlediska základních parametrů makrostruktury spánku a jeho základních poruch s polysomnografickými záznamy věkově spárovaných mužů (průměr 65,0 ± 6,6 let). Výsledky: Pacienti s narkolepsií typu 1 měli oproti kontrolám významně nižší procentuální zastoupení stádia NREM 3 (8 vs. 26 %; p = 0,003) a REM spánku (12 vs. 19 %; p = 0,01) a vyšší zastoupení stádia NREM 1 (17 vs. 10 %; p = 0,01). Zastoupení bdělosti (29 vs. 26 %) a stádia NREM 2 (33 vs. 30 %), průměrná latence usnutí, latence REM spánku, trvání spánku i spánková efektivita (67 ± 14 vs. 72 ± 17 %) se mezi soubory nelišily. Výskyt obstrukčních spánkových apnoí byl srovnatelný (apnoe/hypopnoe index 25 ± 26 vs. 23 ± 18). Index periodických pohybů končetinami ve spánku byl v narkoleptické skupině výrazně vyšší (46 ± 31 vs. 16 ± 22; p = 0,02) a přítomnost poruchy atonie v REM spánku (47 vs. 8 %; p = 0,002) četnější. Závěr: Muži s narkolepsií typu 1 mají signifikantně méně zastoupena stádia NREM 3 a REM, a naopak více stádia NREM 1.
Klíčová slova:
obstrukční spánková apnoe – polysomnografie – spánkové poruchy – narkolepsie s kataplexií – makrostruktura spánku
Úvod
Narkolepsie typ 1 (NT1, starším názvem / alternativně narkolepsie s kataplexií) patří k centrálním hypersomniím [1]. NT1 je chronické onemocnění s obvyklým začátkem v mládí a prevalencí zhruba 20–50/100 000. Patofyziologickým podkladem NT1 je ztráta funkce hypokretinových neuronů v laterálním hypotalamu pravděpodobně na autoimunitním podkladě [2]. K původní charakteristické tetrádě příznaků, tedy nadměrné denní spavosti, kataplexiím, hypnagogickým halucinacím a spánkové obrně [3], byl postupně přidáván ještě pátý symptom – fragmentovaný noční spánek [4].
Pacienti s NT1 obvykle popisují bohatou snovou aktivitu a noční spánek vnímají jako nekvalitní. V subjektivním vnímání zhoršené kvality spánku mohou hrát roli pro NT1 typické projevy disociace REM (rapid eye movement) spánku, tedy spánková obrna a hypnagogické halucinace. Spánek pacientů s NT1 bývá navíc rušen dalšími spánkovými komorbiditami, které nejsou pro NT1 specifické, ale vyskytují se u těchto pacientů pravděpodobně častěji než v běžné populaci. Jedná se zejména o chrápání, obstrukční spánkovou apnoi (OSA), syndrom neklidných nohou, periodické pohyby končetinami ve spánku (periodic limb movements in sleep; PLMS) a poruchu chování v REM spánku (rapid eye movement behavior disorder; RBD). Kvalitu spánku u NT1 v neposlední řadě mohou ovlivňovat psychoaktivní medikace užívaná k léčbě denní spavosti a kataplexií a zvýšený výskyt poruch nálady [2].
Polysomnografické studie spánku se shodují, že pro NT1 je příznačný časný nástup REM spánku (sleep onset REM; SOREM) – objevení se REM spánku v prvních 15 min po usnutí [5]. SOREM byl přítomen asi v 35 % nočních záznamů pacientů s NT1 [5], zatímco v záznamech zdravých lidí bez spánkové deprivace a bez deprese je zcela výjimečný [6]. Zaznamenání nejméně dvou SOREM v nočním spánku a během testu mnohočetné latence usnutí je součástí diagnostických kritérií NT1 [1].
Většina prací srovnávající makrostrukturu spánku u dospělých s NT1 oproti kontrolním subjektům došla k závěru, že bdělost po usnutí a spánkové stádium NREM 1 byly u NT1 více zastoupeny. Naopak podíly stádií spánku NREM 2 a NREM 3 jsou nižší. Podíl REM spánku nebyl signifikantně odlišný [7–12]. OSA je u NT1 přítomna až v 25 % [13]. Index periodických pohybů končetinami ve spánku (periodic leg movement index; PLMI) vyšší než 5 byl zjištěn u 67 % pacientů s NT1 oproti 37 % kontrol, přičemž stoupající PLMI s rostoucím věkem byl zaznamenán jak u pacientů, tak u kontrol [14]. Polysomnografickým diagnostickým kritériem RBD je průkaz REM spánku bez svalové atonie [1,15]. Prevalence RBD v populaci s NT1 se různí dle metodiky, je však řádově vyšší než v běžné populaci – dle recentní metaanalýzy až v 50 % dle prací s polysomnografií (v klinických studiích dokonce až 70 %). Výskyt RBD u NT1 se věkem nemění [16]. Nutno zdůraznit, že většina objektivních studií spánku u narkolepsie byla provedena u nemocných v době stanovení diagnózy, tedy u mladých nemocných.
Stárnutí obecně je spojováno se sníženou schopností navodit a udržet spánek [17]. Spánek ve stáří je navíc negativně ovlivněn častějšími nemocemi a zvyšovanou medikací. V seniorním věku dochází k posunu cirkadiánní preference směrem k rannímu chronotypu – tendenci k dřívějšímu usínání a dřívějšímu vstávání [17].
U seniorů bez poruchy spánku byly polysomnograficky prokázány zhoršená kontinuita spánku, zmnožena bdělost po usnutí a snížená spánková efektivita (podíl celkové doby spánku k celkové době registrace polysomnografického záznamu vyjádřený v procentech). Latence usnutí byla v séniu prodloužená pouze u žen [17]. Během života dochází k postupnému snižování proporce stádia NREM 3 a REM spánku, a naopak prodlužování stádií NREM 1 a NREM 2. Tyto změny makrostruktury spánku jsou v dětství a adolescenci výrazné, v dospělosti je vývoj pozvolný. K další rychlejší změně v proporci stádií NREM spánku dochází až přibližně od věku 55 let. [18] Celková doba spánku (součet trvání všech stádií spánku nikoli bdělosti) klesá od dětství do zhruba 35 let a nadále se již příliš nemění, k mírnému poklesu dochází až po 80. roce věku [18]. Prevalence OSA v obecné populaci ve věku nad 65 let je udávána v širokém rozmezí 8–50 % [19]. OSA je častější u mužů [20,21]. PLMS jsou vzácné do 40 let, v pozdějším věku však jejich výskyt stoupá. Ve věku nad 65 let se prevalence PLMS (PLMI > 5) odhaduje 45 % [1]. Výskyt RBD je odhadován kolem 2–5 % ve věku mezi 50 a 60 lety a 7–8 % u starších jedinců (zjišťováno pomocí dotazníků). Ve studiích založených na polysomnografickém vyšetření byl podíl postižených nižší. V mladém věku je izolovaná RBD výjimečná [22].
Vzhledem k tomu, že téměř chybí objektivní informace o nočním spánku nemocných s NT1 ve vyšším věku, rozhodli jsme se porovnat základní informace z noční polysomnografie spánku u pacientů s NT1 nad 55 let s věkově spárovanými kontrolami. Z důvodu zmíněných pohlavních rozdílů jsme se zaměřili pouze na spánek u mužů.
Tab. 1. Diagnostická kritéria NT1 dle Mezinárodní klasifi kace poruch spánku, 3. vydání [1]. ![Diagnostická kritéria NT1 dle Mezinárodní klasifi kace poruch spánku, 3. vydání [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bcc732c84aa423e9741efd744cbcf3a4.png)
Soubor a metodika
Do studie jsme zařadili dříve konsekutivně získané polysomnografické záznamy 17 mužů ve věku nad 55 let s diagnózou NT1 stanovenou na našem pracovišti. Jednalo se o pacienty, kteří již byli s diagnózou NT1 na pracovišti dlouhodobě sledováni. Hranice 55 let byla zvolena, protože v tomto věku dochází v běžné populaci k akcentaci změn spánkové makrostruktury, jak je popsáno v úvodu. Muži byli vybráni pro známé rozdíly v makrostruktuře spánku i výskytu spánkových komorbidit mezi muži a ženami, jak je popsáno v úvodu. Zahrnuti tedy byli všichni pacienti, kteří v letech 2012–2017 splňovali zvolená kritéria a kteří podstoupili kontrolní polysomnografické vyšetření. Při vyšetření bylo prověřeno, že nemocný v době stanovení diagnózy splnil diagnostická kritéria NT1 dle Mezinárodní klasifikace poruch spánku, 3. vydání (tab. 1) [1]. Hladina hypokretinu v likvoru stanovena nebyla, protože v době získání dat nebyla tato metoda na našem pracovišti k dispozici. Třináct pacientů bylo 14 dní před vyšetřením zcela bez léků ovlivňujících spánek (léčbu buď neužívali, nebo byla vysazena). U čtyř pacientů nebylo možné chronickou medikaci vysadit. Jeden pacient užíval stimulancia (kombinaci modafinil a methylfenidát), dva modafinil a malé dávky antidepresiv (klomipramin, citalopram) a jeden pacient oxybát sodný v kombinaci s modafinilem.
Základní informace o subjektech ve studii shrnuje tab. 2. Kontrolní soubor tvořili dobrovolníci, kteří byli za čas strávený ve studii finančně kompenzováni. U žádného zdravého dobrovolníka nebyla anamnesticky zjištěna porucha spánku ani jiná nemoc, která může poruchu spánku vyvolat. U kontrolních subjektů byly stanoveny hodnoty lipidemie, urikemie, glykemie a hladina hormonů štítné žlázy – u všech s normálním výsledkem. Zdraví dobrovolníci byli zařazeni po neuropsychologickém vyloučení významné deprese či úzkosti a demence a po vyšetření magnetickou rezonancí vylučující strukturální lézi mozku. Všichni členové kontrolní skupiny alespoň 14 dní před vyšetřením neužívali medikaci ovlivňující spánek.
Polysomnografické záznamy pacientů s NT1 byly získány v rámci standardního protokolu zahrnujícího nejdříve noční polysomnografii a následující den Test mnohočetné latence usnutí. Kontrolní subjekty byly vyšetřeny stejným protokolem. Pacienti i zdravé kontroly podstoupili noční polysomnografii v monitorovací jednotce našeho pracoviště. Polysomnografický záznam byl pořízen přístroji RemLogic, verze 3.4.1 (Embla systems, Thorton, CO, USA) a NicoletOne EEG (Natus Medical Inc., Pleasanton, CA, USA). Registrace sestávala ze dvou svodů elektrookulogramu (EOG), šesti svodů elektroencefalogramu (F3-M2, C3-M2, O1-M2, F4-M1, C4-M1, O2-M1), povrchové elektromyografie musculi mentales, flexores digitorum superficiales a tibiales anteriores, dále elektrokardiogramu, intranazálního tlaku, proudu vzduchu před nosem, dechového úsilí hrudníku a břicha, saturace hemoglobinu kyslíkem, zvukových projevů pacienta a digitálně synchronizovaného videa. Monitorování probíhalo v samostatném pokoji od 22.00 do 6.00 hodin. Polysomnografické záznamy byly hodnoceny podle manuálu skórování spánku a spánkových událostí Americké akademie spánkové medicíny, verze 2.2 [15]. Spánková stádia byla standardně skórována ve 30s epochách. Z hlediska spánkové makrostruktury byly porovnávány následující parametry: latence usnutí (doba od začátku registrace – zhasnutí – do začátku prvního stádia spánku), celková doba spánku, latence REM spánku (doba od začátku spánku do začátku první epochy skórované jako REM spánek), spánková efektivita a procentuální zastoupení jednotlivých spánkových stádií a bdělosti po usnutí (wake after sleep onset; WASO).
Z ostatních parametrů, skórovaných taktéž dle pravidel Americké akademie spánkové medicíny [15], byly do statistického zpracování zařazeny následující hodnoty týkající se dýchání ve spánku: apnoe/hypopnoe index (AHI – počet apnoí a hypopnoí za hodinu spánku), počet desaturací za hodinu spánku – oxygen desaturation index (ODI), kdy jsme jako desaturace určovali poklesy saturace hemoglobinu kyslíkem o 3 % a více, podíl doby spánku se saturací krve kyslíkem nižší než 90 % (T90). Dále byl hodnocen PLMI, počet periodických pohybů končetinami ve spánku za 1 h spánku. Pohyb byl určován podle povrchové elektromyografie nad musculi tibiales anteriores oboustranně. Pro zařazení pohybu mezi periodické pohyby končetinami musela být splněna následující kritéria v povrchových elektromyografických svodech nad musculi tibiales anteriores (jednom nebo oběma): zvýšení amplitudy o minimálně 8 µV a trvání 0,5–10 s při minimálním počtu 4 opakujících se pohybů s intervaly 5–90 s. Epocha REM spánku byla označena jako epocha REM spánek bez atonie buď v přítomnosti setrvalé (tonické) aktivita ve svodech brady (alespoň 50 % epochy vyšší než v NREM), nebo přechodně zvýšené (fázické) aktivity v EMG brady či končetin (alespoň 50 % 3s miniepoch v rámci epochy obsahuje 0,1–5 s výboje alespoň 4× zvýšené amplitudy oproti pozadí) [15].
Statistické zpracování dat bylo provedeno pomocí software STATISTICA verze 12 (StatSoft). Zdrojový datový soubor obsahoval nominální, ordinální i škálové proměnné s různými statistickými vlastnostmi, od kterých se odvíjela volba metod použitých pro testování hypotéz. U nominálních proměnných byl použit Pearsonův chí-kvadrát, protože počet případů v jednotlivých podskupinách byl dostatečně vysoký. U spojitých proměnných byl použit neparametrický Mann-Whitneyho U test, neboť rozdělení parametrů získaných při polysomnografii z principu není normální a počet vyšetřených v jednotlivých skupinách není dostatečný pro asymptotní předpoklad normality nutný pro použití parametrického t-testu. Za kritickou hodnotu pravděpodobnosti chyby prvního druhu jsme považovali hladinu významnosti p < 0,05.
Tab. 2. Základní informace o subjektech ve studii. 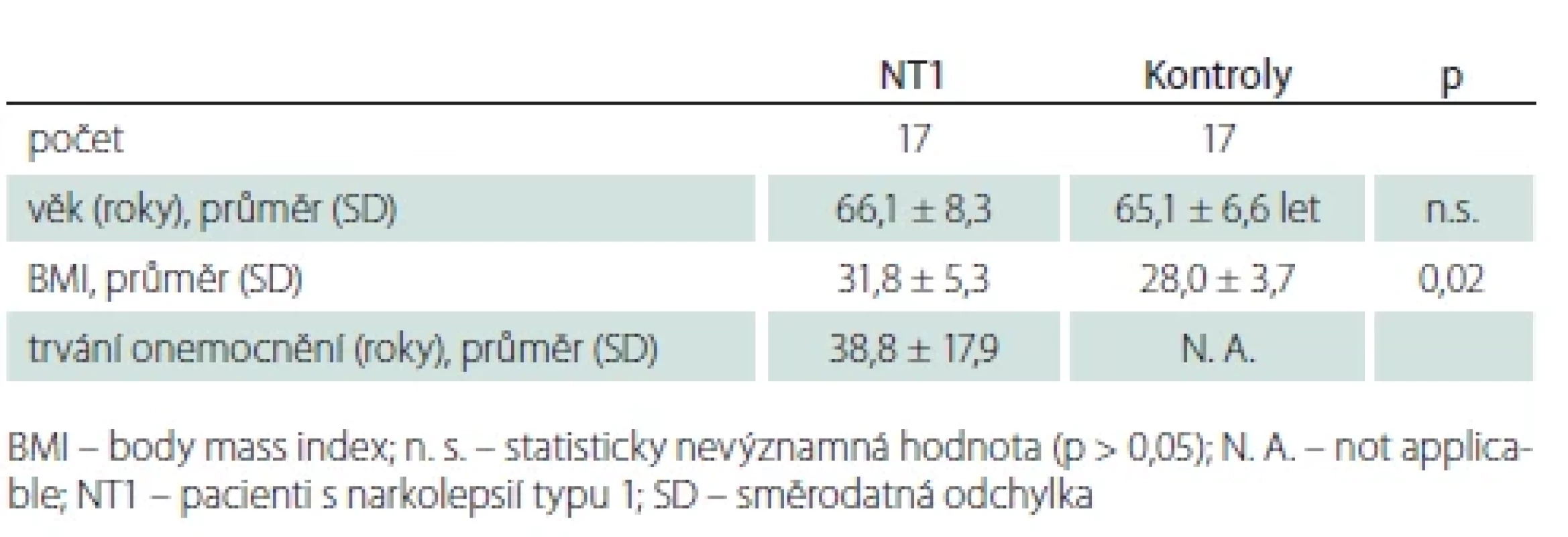
Tab. 3. Makrostrukturální spánkové parametry. 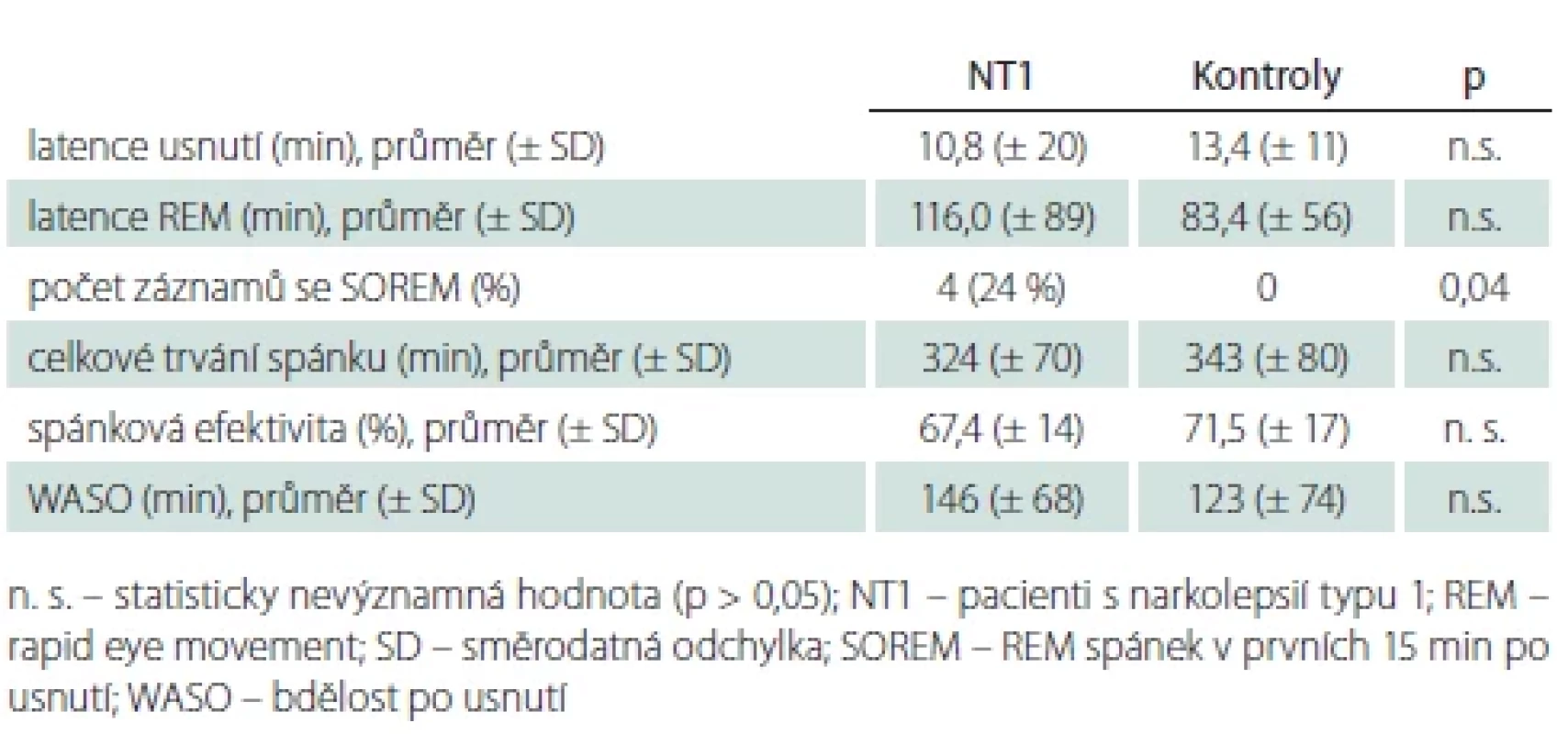
Výsledky
Sledované parametry spánkové makrostruktury udává tab. 3. Mezi skupinami nemocných s NT1 a kontrolními osobami nebyl nalezen významný rozdíl latence usnutí, latence REM spánku, celkového trvání spánku ani spánkové efektivity. SOREM se nevyskytl u žádného kontrolního subjektu, ale byl přítomen u čtyř pacientů.
Procentuální zastoupení spánkových stádií ilustruje obr. 1. Obě skupiny, mají podobnou proporci stádií W a NREM 2. U NT1 je významně kratší stádium NREM 3 a REM spánek a delší stádium NREM 1.
Bylo nalezeno významné množství apnoí a hypopnoí v obou skupinách vyšetřovaných. Obvykle používanou hranici OSA AHI > 5 přesáhlo 16 (94,1 %) pacientů a 14 (82,3 %) kontrolních subjektů (p = 0,56). Hranici pro středně těžkou spánkovou apnoi (AHI > 15) překročilo 10 pacientů a stejný počet kontrol (58,8 %). Průměrné AHI, ODI a T90 se významně nelišily (tab. 4).
Ve skupině s NT1 byl zjištěn vyšší PLMI (tab. 4). PLMI > 5 mělo 13 (76 %) subjektů s NT1 a 9 (53 %) kontrol (p = 0,16), a PLMI > 15 mělo 11 (65 %) subjektů s NT1 a 5 (29 %) kontrol (p = 0,036).
REM spánek bez atonie byl zachycen u jedné kontroly (6 %) oproti 8 (47 %) pacientům s NT1 (p = 0,002).
Obr. 1. Procentuální zastoupení spánkových stadií a bdělosti během spánku.Fig. 1. Percentage representation of sleep stages and wakefulness during sleep. 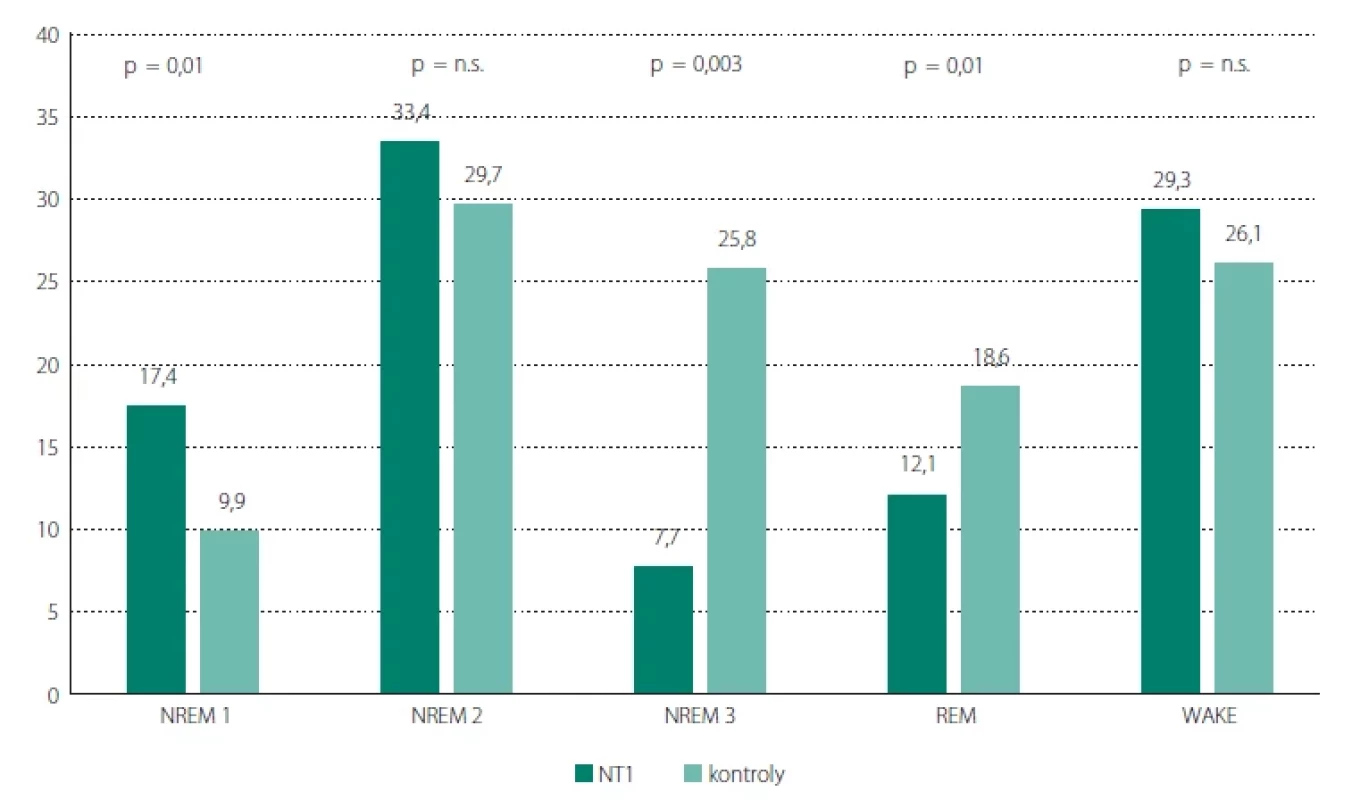
NREM – non-rapid eye movement; n. s. – statisticky nevýznamná hodnota (p > 0,05); NT1 – narkolepsie typ 1; REM – rapid eye movement; WAKE – bdělost NREM – non-rapid eye movement; n. s. – statistically insignifi cant value (p > 0.05); NT1 – narcolepsy type 1; REM – rapid eye movement; WAKE – wakefulness Tab. 4. Výsledky AHI, ODI, T90 a PLMI. 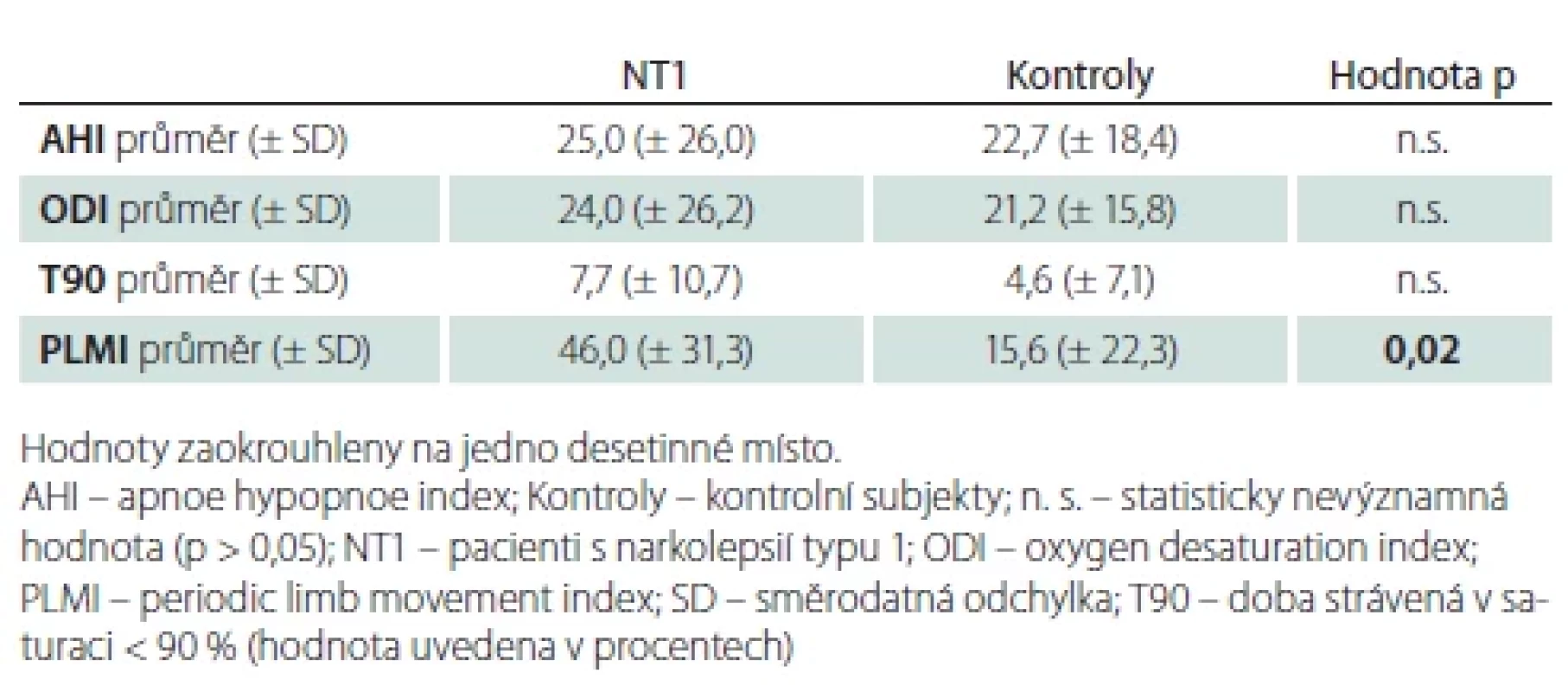
Diskuze
Tato studie se jako první zaměřuje izolovaně na srovnání polysomnografických parametrů nočního spánku mužů s NT1 a spánku kontrolních subjektů v séniu. Z pohledu spánkové makrostruktury měli pacienti s NT1 oproti kontrolám významně nižší procentuální zastoupení stádií NREM 3 a REM spánku a vyšší proporci stádia NREM1. Průměrná latence usnutí, latence REM spánku, trvání spánku, zastoupení bdělosti po usnutí i spánková efektivita se mezi soubory nelišily. Výskyt OSA byl v obou skupinách srovnatelný. PLMI byl v NT1 skupině výrazně vyšší a přítomnost REM spánku bez atonie byla u NT1 četnější.
Latence usnutí zdravých mužů věku 50–80 let je dle rozsáhlé populační studie (15,3 ± 17 min) [17] blízká hodnotám našich zdravých kontrol (13,4 ± 11 min). Dle této práce se latence usnutí u mužů s věkem příliš nemění. Latence usnutí našich pacientů s NT1 (10,8 ± 20 min) je velmi podobná latenci usnutí mužů s NT1 průměrného věku 37 let z Evropské databáze narkolepsie (EU-NN databáze) (11,9 ± 28 min) [5]. Naše výsledky jsou v souladu s nálezem u běžné populace, tedy že se latence usnutí u mužů s věkem výrazně nemění. V práci italských autorů, kteří prezentovali polysomnografické výsledky nemocných s NT1 ve věkových skupinách 0–10, 11–18, 19–44, 45–64, > 64 roků po zhruba 20 neléčených pacientech, byl průměr latence usnutí pacientů s NT1 > 64 let 7,4 ± 6,6 min. To je méně než v naší studii. Přitom se dle této studie latence usnutí u narkolepsie s věkem prodlužovala (jednalo se však o muže i ženy) [23]. Latence usnutí a jiné makrostrukturní parametry jsou ovlivněny podmínkami registrace, takže srovnání s cizími výsledky je pouze orientační.
SOREM se vyskytl u čtyř (24 %) našich pacientů s NT1 a průměrná latence REM spánku našich pacientů byla 116,0 ± 89,1 min, což je blízké hodnotám zdravé populace. Dle EU-NN databáze je latence REM spánku u dospělých mužů s NT1 55,0 ± 67,4 min a SOREM v nočním spánku pacientů s NT1 se vyskytl u 35 % [5]. Lze uvažovat o vlivu medikace, ale významný vliv farmak v našich datech nenacházíme. Ze třech pacientů užívajících stimulancia měli dva pacienti SOREM (jeden z nich užíval navíc oxybát sodný). Dva pacienti, kteří užívali antidepresiva, SOREM neměli, latence jejich REM spánku byla 74,5, a 67,5 min. Dle našich výsledků by bylo možné usuzovat, že v pozdějším věku se latence REM spánku u NT1 prodlužuje, a tedy přibližuje běžné populaci. Počet našich zkoumaných je ovšem malý. Italská studie významný rozdíl latence REM spánku v jednotlivých věkových skupinách nemocných s NT1 neodhalila [23].
Naši pacienti s NT1 mají oproti kontrolám nižší procentuální zastoupení stádia NREM 3 (8 vs. 26 %) a REM spánku (12 vs. 19 %) a vyšší zastoupení stádia NREM 1 (17 vs. 10 %). Někteří autoři nacházejí nižší podíl stádia NREM 3 při srovnání se zdravými mladšími subjekty s NT1 obou pohlaví [7,11,12], v ostatních pracích není rozdíl signifikantní [8–10]. Podíl NREM 3 klesá s věkem i u zdravé populace [17,18]. Vyšší podíl stádia NREM 1 u NT1 obecně byl zaznamenán množstvím prací [7,9–12] a v současnosti je považován za typický, byť velmi nespecifický pro NT1. Dle našich výsledků toto můžeme potvrdit i u mužů s NT1 v séniu. Prodlužování stádia NREM 1 je však fenomén typický také pro stárnutí spánku zdravých lidí. Kratší trvání spánku REM u pacientů s NT1 oproti kontrolním subjektům, jak je tomu v naší studii, neukázala žádná jiná práce s mladšími pacienty [7–12].
Téměř všechny studie, které nezohledňují věk nemocných, se shodují na vyšší proporci bdělosti po usnutí u NT1 oproti kontrolám [7,9–12], což z našeho srovnání u starších mužů nevychází, protože i naše kontrolní subjekty mají zvýšenou proporci WASO. WASO se prodlužuje s věkem i u zdravých lidí. Zdá se tedy, že ve stáří se u běžné populace zhoršením kontinuity spánku podíl WASO může s NT1 vyrovnávat. Spánková efektivita se v našich souborech podobně jako WASO oproti srovnáním na mladších jedincích významně neliší [8–10]. Průměr spánkové efektivity u obou našich souborech je výrazně pod orientační hranicí normální hodnoty (< 85 %) pro celý dospělý věk [24]. Podobně jako WASO se spánková efektivita zdravých lidí s věkem snižuje. Celková doba spánku je v obou našich souborech taktéž srovnatelná, což ovšem popisují i některá porovnání mladších pacientů s NT1 s kontrolami [7,8,11,12]. Všechny známky zhoršené spánkové makrostruktury lze částečně vysvětlit vysokou mírou OSA u obou našich vyšetřovaných skupin.
Podíly spánkových stádií u našich 17 mužů s NT1 lze konfrontovat s výsledky mužů s NT1 v rozsáhlé Evropské narkoleptické databázi (EU-NN) ve věku 36,9 ± 17,1 let [5]. Podíl stádia NREM 1 17,4 % u našich pacientů se téměř shoduje s výsledky v EU-NN, kde hodnota dosahuje 16,5 %. Podíl stádia NREM 2 je u našich nemocných v průměru o 10 % kratší (33,4 vs. 43,0 %), čemuž nelze přikládat velký význam. Podíl stádia NREM 3 je však v podstatě poloviční oproti průměru EU-NN (7,7 vs. 16,4 %) a také stádium REM je v našem souboru kratší (12,1 vs. 19,3 %) [5]. Srovnáním hodnot našich pacientů s NT1 s výsledky EU-NN by se dalo vyvodit prodloužení podílu bdělosti po usnutí a redukce všech spánkových stádií pacientů s NT1 ve stáří. Redukci REM spánku a stádia NREM 2 ve věku nad 64 let nalezli i autoři italské studie [23]. Podíl stádia NREM 3 a stádia NREM 1 u starších pacientů však v této italské studii roste. Nárůst podílu stádia NREM 1 je v souladu s našimi výsledky a je vysvětlitelný také jako obecný fenomén stárnutí spánku [18]. Zvýšená proporce spánku NREM 3 u nejstarší skupiny pacientů věku > 64 let v italské studii [23] je obtížně vysvětlitelná, protože nemá teoretické vysvětlení a nepodporuje ji klinická zkušenost.
Obstrukční spánková apnoe je hojně zastoupena u obou skupin vyšetřovaných mužů, našich pacientů i kontrolních, a to i přes to, že muži v kontrolní skupině neměli subjektivní obtíže se spánkem a měli nižší body mass indexu (BMI). Hodnoty AHI našich pacientů s NT1 jsou vyšší než u jiných prací, ve kterých ale byli zařazeni mladší nemocní a byly zapojeny i ženy. Dle Sasai-Sakuma et al. byl AHI ≥ 5 přítomen u 14,4 % nemocných s NT1 a průměrným věkem 28,2 ± 10,9 let [25], a dle Pizza et al. AHI ≥ 5 u 31 % nemocných NT1 s průměrným věkem 40,0 ± 16,0 let [26]. V souboru 20 neléčených pacientů s NT1 > 64 let věku (BMI > 25 u 90 %) byla hodnota AHI 17,2 ± 16,8, což je také méně než v našem souboru [23]. Nicméně literatura a naše výsledky naznačují, že i u narkolepsie prevalence OSA s vyšším věkem roste jako u běžné populace. Lze usuzovat, že vyšší podíl OSA u pacientů s NT1 oproti běžné populaci je přítomný v nižších věkových kategoriích. Důvodem by mohl být zvýšený BMI u NT1 v mladším věku [27] a fakt, že později se rozdíl BMI u NT1 oproti populaci nezvyšuje [28].
Zjistili jsme významně vyšší PLMI u pacientů s NT1 proti kontrolám, což je v souladu s předchozími publikacemi u nemocných a kontrol dospělého věku, jejichž výsledky jsou shrnuty metaanalýzou [29]. U skupiny dvaceti neléčených pacientů s NT1 > 64 let byl PLMI 26,2 ± 18,1 [23], což je méně než námi zjištěná průměrná hodnota. Dle EU-NN databáze byl podíl nemocných s PLMI > 5 49,4 % a podíl nemocných PLMI > 15 30,4 % [5]. Je tedy možné předpokládat, že ve stáří tento podíl stoupá, neboť PLMI > 5 mělo 76 % našich pacientů s NT1 a PLMI > 15 mělo 53 % našich subjektů s NT1. To je v souladu s výsledky z Francie, dle kterých PLMI u NT1 stoupá s věkem, zejména ve věku nad 50 let [14]. V obecné populaci nad 60 let je výskyt PLM častý, náš výsledek PLMI > 15 u 29 % kontrol se neodlišuje od nálezů jiných větších populací u jinak zdravých lidí [30].
Frekvence RBD je u dospělých s NT1 oproti zdravé populaci poměrně vysoká [16]. Dle dat EU-NN databáze je výskyt RBD u mužů s NT1 mírně nižší (46 % u mužů s NT1 vs. 54 % u žen s NT1) [5]. Náš výsledek 47 % pacientů s polysomnograficky potvrzeným REM spánkem s poruchou atonie je podobný průměru u mladších nemocných s NT1. To se shoduje s již publikovaným názorem, že podíl nemocných s RBD se u NT1 v seniorském věku dále nezvyšuje [31] na rozdíl od běžné populace [22]. Výskyt epoch REM spánku s poruchou atonie je nicméně i ve věku nad 55 let u nemocných s NT1 oproti zdravým kontrolám výrazně četnější.
K nedostatkům této práce patří malý počet zkoumaných subjektů a zařazení čtyř nemocných na medikaci. Výsledky porovnávající soubor NT1 bez medikovaných nemocných však nebyly odlišné. Do studie mohly být zařazeny jen celkově zdravější a motivovanější osoby, a tedy studie nepostihuje nemocné nebo kontroly, kteří se ze zdravotních nebo technických důvodů nemohli zúčastnit. To je však neodstranitelný problém všech studií týkajících se osob v pokročilém věku, které se uskutečňují mimo domov zkoumaného subjektu. Hojný výskyt OSA u kontrol i u nemocných zkresluje změny spánku přímo související se základní patofyziologií NT1.
Závěr
Makrostrukturální charakteristiky kvality spánku u mužů s NT1 ve věku nad 55 let jsou oproti kontrolní skupině horší jen částečně, zatímco dle publikovaných studií týkajících se mladších nemocných je rozdíl podstatnější. To naznačuje, že spánek se u NT1 zhoršuje skokově v prvních letech nemoci, zatímco u zdravých lidí se spánek s věkem zhoršuje kontinuálně. Tuto studii lze zároveň považovat za potvrzení anamnestických studií, že i v séniu nemocných s NT1 je noční spánek horší než u běžné populace.
Etické aspekty
Práce byla provedena ve shodě s Helsinskou deklarací z roku 1975 a jejími revizemi v letech 2004 a 2008. Studie byla schválena Etickou komisí Všeobecné fakultní nemocnice (datum schválení: 18. 9. 2014, čísla schválení 1812/14 IS a 85/21 Grant GIP). Účastníci podepsali před vstupem do studie informovaný souhlas.
Grantová podpora
Studie byla podpořena grantem MZČR AZV NU20-04-00088, Interním grantem Všeobecné fakultní nemocnice v Praze GIP-21-SL-04-212 a grantem Karlovy University Cooperatio Neuroscience
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Zdroje
1. Sateria MJ. International classification of sleep disorders – third edition: highlights and modifications. Chest 2014; 146 (5): 1387–1394. doi: 10.1378/chest.14-0970.
2. Bassetti CLA, Adamantidis A, Burdakov D et al. Narcolepsy – clinical spectrum, aetiopathophysiology, diagnosis and treatment. Nat Rev Neurol 2019; 15 (9): 519–539. doi: 10.1038/s41582-019-0226-9.
3. Yoss RE, Daly DD. Narcolepsy. Med Clin North Am 1960; 44 : 953–968. doi: 10.1016/s0025-7125 (16) 33982-7.
4. Roth B. Narcolepsy and hypersomnia: review and classification of 642 personally observed cases. Schweiz Arch Neurol Neurochir Psychiatr 1976; 119 (1): 31–41.
5. Luca G, Haba-Rubio J, Dauvilliers Y et al. Clinical, polysomnographic and genome-wide association analyses of narcolepsy with cataplexy: a European Narcolepsy Network study. J Sleep Res 2013; 22 (5): 482–495. doi: 10.1111/jsr.12044.
6. Andlauer O, Moore H, Jouhier L et al. Nocturnal rapid eye movement sleep latency for identifying patients with narcolepsy/hypocretin deficiency. JAMA Neurol 2013; 70 (7): 891–902. doi: 10.1001/jamaneurol.2013.1589.
7. Mukai J, Uchida S, Miyazaki S et al. Spectral analysis of all-night human sleep EEG in narcoleptic patients and normal subjects. J Sleep Res 2003; 12 (1): 63–71. doi: 10.1046/j.1365-2869.2003.00331.x.
8. Dauvilliers Y, Rompre S, Gagnon JF et al. REM sleep characteristics in narcolepsy and REM sleep behavior disorder. Sleep 2007; 30 (7): 844–849. doi: 10.1093/sleep/30.7.844.
9. Khatami R, Landolt HP, Achermann P et al. Insufficient non-REM sleep intensity in narcolepsy-cataplexy. Sleep 2007; 30 (8): 980–989. doi: 10.1093/sleep/30.8.980.
10. Khatami R, Landolt HP, Achermann P et al. Challenging sleep homeostasis in narcolepsy-cataplexy: implications for non-REM and REM sleep regulation. Sleep 2008; 31 (6): 859–867. doi: 10.1093/sleep/31.6.859.
11. Pizza F, Vandi S, Iloti M et al. Nocturnal sleep dynamics identify narcolepsy type 1. Sleep 2015; 38 (8): 1277–1284. doi: 10.5665/sleep.4908.
12. Walacik-Ufnal E, Piotrowska AJ, Wolynczyk-Gmaj D et al. Narcolepsy type 1 and hypersomnia associated with a psychiatric disorder show different slow wave activity dynamics. Acta Neurobiol Exp (Wars) 2017; 77 (2): 147–156. doi: 10.21307/ane-2017-047.
13. Pataka AD, Frangulyan RR, Mackay TW et al. Narcolepsy and sleep-disordered breathing. Eur J Neurol 2012; 19 (5): 696–702. doi: 10.1111/j.1468-1331.2011.03610.x.
14. Dauvilliers Y, Pennestri MH, Petit D et al. Periodic leg movements during sleep and wakefulness in narcolepsy. J Sleep Res 2007; 16 (3): 333–339. doi: 10.1111/j.1365-2869.2007.00601.x.
15. Berry RB, Brooks R, Gamaldo CE et al. The AASM manual for the scoring of sleep and associated events. [online]. Available from: https: //aasm.org/resources/pdf/scoring-manual-preface.pdf.
16. Antelmi E, Pizza F, Franceschini C et al. REM sleep behavior disorder in narcolepsy: a secondary form or an intrinsic feature? Sleep Med Rev 2020; 50 : 101254. doi: 10.1016/j.smrv.2019.101254.
17. Luca G, Haba Rubio J, Andries D et al. Age and gender variations of sleep in subjects without sleep disorders. Ann Med 2015; 47 (6): 482–491. doi: 10.3109/07853890. 2015.1074271.
18. Ohayon MM, Carskadon MA, Guilleminault C et al. Meta-analysis of quantitative sleep parameters from childhood to old age in healthy individuals: developing normative sleep values across the human lifespan. Sleep 2004; 27 (7): 1255–1273. doi: 10.1093/sleep/27.7.1255.
19. Punjabi NM, Newman AB, Young TB et al. Sleep-disordered breathing and cardiovascular disease: an outcome-based definition of hypopneas. Am J Respir Crit Care Med 2008; 177 (10): 1150–1155. doi: 10.1164/rccm.200712-1884OC.
20. Young T, Peppard PE, Gottlieb DJ. Epidemiology of obstructive sleep apnea: a population health perspective. Am J Respir Crit Care Med 2002; 165 (9): 1217–1239. doi: 10.1164/rccm.2109080.
21. Duran J, Esnaola S, Rubio R et al. Obstructive sleep apnea-hypopnea and related clinical features in a population-based sample of subjects aged 30 to 70 yr. Am J Respir Crit Care Med 2001; 163 (3 Pt 1): 685–689. doi: 10.1164/ajrccm.163.3.2005065.
22. Haba-Rubio J, Frauscher B, Marques-Vidal P et al. Prevalence and determinants of rapid eye movement sleep behavior disorder in the general population. Sleep 2018; 41 (2): zsx197. doi: 10.1093/sleep/zsx197.
23. Lividini A, Pizza F, Filardi M et al. Narcolepsy type 1 features across the life span: age impact on clinical and polysomnographic phenotype. J Clin Sleep Med 2021; 17 (7): 1363–1370. doi: 10.5664/jcsm.9198.
24. Kryger MH, Roth T, Dement WC. Principles and practice of sleep medicine. Philadelphia: Elsevier 2017.
25. Sasai-Sakuma T, Kinoshita A, Inoue Y. Polysomnographic assessment of sleep comorbidities in drug-naive narcolepsy-spectrum disorders – a Japanese cross-sectional study. PLoS One 2015; 10 (8): e0136988. doi: 10.1371/journal.pone.0136988.
26. Pizza F, Tartarotti S, Poryazova R et al. Sleep-disordered breathing and periodic limb movements in narcolepsy with cataplexy: a systematic analysis of 35 consecutive patients. Eur Neurol 2013; 70 (1–2): 22–26. doi: 10.1159/000348719.
27. Wang Z, Wu H, Stone WS et al. Body weight and basal metabolic rate in childhood narcolepsy: a longitudinal study. Sleep Med 2016; 25 : 139–144. doi: 10.1016/ j.sleep.2016.06.019.
28. Kovalska P, Kemlink D, Topinkova E et al. Higher body mass index in narcolepsy with cataplexy: life-long experience. Sleep Med 2017; 32 : 277. doi: 10.1016/ j.sleep.2016.11.010.
29. Zhang Y, Ren R, Yang L et al. Polysomnographic nighttime features of narcolepsy: a systematic review and meta-analysis. Sleep Med Rev 2021; 58 : 101488. doi: 10.1016/j.smrv.2021.101488.
30. Vaz Fragoso CA, Van Ness PH, Araujo KL et al. Age-related differences in sleep-wake symptoms of adults undergoing polysomnography. J Am Geriatr Soc 2015; 63 (9): 1845–1851. doi: 10.1111/jgs.13632.
31. Nevsimalova S, Pisko J, Buskova J et al. Narcolepsy: clinical differences and association with other sleep disorders in different age groups. J Neurol 2013; 260 (3): 767–775. doi: 10.1007/s00415-012-6702-4.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2023 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Chirurgická léčba recidivy intrakraniálních aneuryzmat po ošetření klipem
- Přehled difuzních gliomů dle WHO klasifikace 2021 1. část – difuzní gliomy dospělého typu
- Vliv chemoterapeutické léčby na kognitivní funkce dětí s leukemií
- Repetitivní transkraniální magnetická stimulace v léčbě poruch spánku
- Efekt psychoedukačního programu u pacientů s CMP v postakutní péči
- Paměťová rezerva a údržba paměti u superúspěšně stárnoucích osmdesátníků
- Polysomnografické nálezy mužů s narkolepsií typu 1 ve věku nad 55 let
- Atypické případy cycloplegie způsobené durmanem obecným
- Nečekaně abnormální test POBAV a SPECT mozku dokonce u vnuka pacientky s demencí
- Z. Adam et al. Monoklonální gamapatie klinického významu a další nemoci
- Zpráva o výročním sjezdu České neurochirurgické společnosti ČLS JEP v Hradci Králové
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přehled difuzních gliomů dle WHO klasifikace 2021 1. část – difuzní gliomy dospělého typu
- Repetitivní transkraniální magnetická stimulace v léčbě poruch spánku
- Efekt psychoedukačního programu u pacientů s CMP v postakutní péči
- Chirurgická léčba recidivy intrakraniálních aneuryzmat po ošetření klipem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



