-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKožní vaskulitida u SLE – léčit či neléčit?
Cutaneou vasculitis in SLE – to treat or not to treat?
Systemic lupus erythematosus (SLE) is a disease with large variability in clinical manifestations. In present work we describe case of a young woman with SLE with multiple skin vasculitic lesions. We show how difficult can the treatment of cutaneous vasculitis be. Skin lesions have often necrotic bed, that attenuates bacterial superinfection and the decision on systemic immunosuppressive treatment accompanies mayor dilemma. Combination immunosuppressive therapy is also hazardous due to possible serious adverse effects; the therapy may worsen underlining hematologic abnormalities that often accompany SLE. Nevertheless vasculitis is manifesta - tion of systemic disease activity and therefor only adequate therapy leads to resolution of cutaneous vasculitic lesion.
Keywords:
Cyclophosphamide – Systemic lupus erythematosus – cutaneous vasculitis – leucopenia
Autoři: M. Gregová
Působiště autorů: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 28, 2020, No. 2, p. 110-115.
Kategorie: Kazuistiky
Souhrn
Systémový lupus erytematodes (SLE) je onemocnění s velice pestrým klinickým obrazem. V kazuistice popisujeme případ mladé ženy se SLE s rozsáhlými vaskulitickými kožními lézemi. Případ demonstruje, jak obtížná může být léčba kožní vaskulitidy. Kožní léze mají často nekrotickou spodinu, která predisponuje k bakteriální superinfekci a rozhodnutí o systémové imunosupresivní terapii pak doprovází rozpaky. Kombinovaná imunosupresivní léčba je navíc riziková z hlediska závažných nežádoucích účinků, prohloubeny mohou být také hematologické abnormality, které často doprovází SLE. Vaskulitida je však projevem aktivity systémového onemocnění a pouze adekvátní terapie vede ke zhojení kožních vaskulitických lézí.
Klíčová slova:
systémový lupus erytematodes – kožní vaskulitida – leukopenie – cyklofosfamid
ÚVOD
Systémový lupus erytematodes (SLE) je nemoc s velice pestrým klinickým obrazem. SLE je komplexní a zároveň velmi heterogenní autoimunitní onemocnění, charakteristické je multiorgánové postižení a významná variabilita projevů u jednotlivého pacienta. Kůže je v rámci systémového onemocnění postižena velice často, popsána je celá řada kožních syndromů charakteristických pro SLE. Mezi projevy nespecifické patří vaskulární abnormality jako je livedo reticularis, Raynaudův fenomén a vaskulitické kožní změny. Vaskulitida se vyskytuje asi u 11–36 % jedinců se SLE (1). V rámci vaskulitidy mohou být zánětem zasaženy cévy různého kalibru, nejčastěji jsou postiženy cévy malé s charakteristickou tvorbou kožních lézí. Nejběžnějším typem kožní vaskulitidy u SLE je urtikariální vaskulitida, nezřídka jsou přítomné petechie nebo splývající erytematózní ložiska. Vzácněji se vyskytují ulcerace zasahující hluboko do podkoží. Tvorba kožních ulcerací v mnoha případech doprovází vzplanutí onemocnění, jedná se projev aktivity nemoci. Výskyt vaskulitidy u SLE ovlivňuje prognózu pacientů. Již historická práce z roku 1983 poukazuje na vaskulitidu jako negativní prognostický faktor u nemocných se SLE (2). I recentní studie ukazují, že pacienti s kožní vaskulitidou jsou ve větším riziku rozvoje dalších, potenciálně závažných, orgánových manifestací, jako je lupusová nefritida (3). Léčba kožní vaskulitidy může být komplikovaná. Nezřídka je nutná kombinovaná imunosupresivní terapie, která je ale často vzhledem k infekčním a dalším komplikacím riziková. Rozhodnutí o léčbě pak doprovází rozpaky a kontroverze. V následující kazuistice popisujeme případ pacientky se SLE s komplikovanou léčbou kožních vaskulitických lézí.
KAZUISTIKA
Žena, ročník 1978, byla léčena od 18 let pro vředovou chorobu gastroduodenální, v minulosti prodělala několik závažnějších infektů včetně septické tonzilitidy. U pacientky se v roce 2009 objevila fotosenzitivita a exantém v obličeji v charakteristické malární distribuci. V následujícím roce byl diagnostikován systémový lupus erytematodes. Diagnóza onemocnění byla stanovena na podkladě přítomnosti motýlovitého exantému, fotosenzitvitiy, pozitvity antinukleárních (ANA) a protilátek proti dvouvláknové deoxyribonukleové kyselině (anti-dsDNA), imunitně podmíněných hematologických abnormit – leukopenie, trombocytopenie a hemolytické anemie. Následně se objevila i polyartritida, splněna byla jak SLICC (Systemic Lupus International Collaborating Clinics) (tab. 1) (4), tak aktuální klasifikační kritéria Evropské ligy proti revmatismu (European League againts Rheumatism – EULAR) a Americké koleje revmatologů (American College of Rheumatology – ACR) pro SLE (tab. 2) (5, 6). Pacientka byla v úvodu onemocnění léčena glukokortikoidy (GK), hydroxychlorochinem a cyklosporinem v dávce 200 mg za den (tj. 3,8 mg/kg/den). V roce 2015 došlo ke zhoršení kožních projevů. Stav postupně progredoval, koncem téhož roku se objevily až nekrotické kožní eflorescence v oblasti obou předloktí. Pacientka byla odeslána ke konzultaci do Revmatologického ústavu (RÚ). Při přijetí na lůžkové oddělení RÚ bylo objektivně přítomno livedo reticularis, na obou pažích a dolních končetinách byly četné kožní ulcerace s nekrotickou spodinou. V laboratoři byla významná leukopenie (Leu 2.1 109/l), anemie s hodnotou hemoglobinu (Hb) 103 g/l a hraniční trombocytopenie (Plt 141 109/l). Byla snížena i hladina C3 komplementu, v imunologii byly pozitivní ANA protilátky, anti-dsDNA, anti-Ro a anti-P protein. Antifosfolipidové protilátky včetně lupus antikoagulans byly negativní, stejně jako kryoglobuliny. U pacientky byla doplněna transezofageální echokardiografie, která vyloučila infekční endokarditidu, imunologické vyšetření neprokázalo primární imunodeficit. Následně byla provedena kožní biopsie z eflorescencí předloktí. Závěr však nebyl zcela konkluzivní, připouštěl možnost erytematodu, známky vaskulitidy nebyly zachyceny. Systémové onemocnění bylo hodnoceno jako aktivní, byla navýšena dávka GK. Úprava terapie vedla ke zlepšení parametrů krevního obrazu a k plnému zhojení kožních lézí. Následně byla doporučena opatrná detrakce GK, vzhledem ke koncepčním plánům pacientky byla také provedena výměna cyklosporinu za azathioprin a pacientka byla předána do péče revmatologa v místě bydliště. Stav byl stabilizován do jara 2017, kdy začalo opět docházet ke zhoršování kožního nálezu. V oblasti hýždí a obou DK se tvořily rozsáhlé ulcerace, stav si v listopadu 2017 vyžádal hospitalizaci na interním oddělení ve FN Ostrava. Zde byly pozorovány hluboké ulcerace dolních končetin s bakteriální superinfekcí, pro kterou byla nutná antibiotická (ATB) léčba. Vaskulární ultrazvuk dolních končetin neprokázal poruchu perfuze. Na základě doporučení angiologa byly zkoušeny vazodilatační infuze s Agapurinem. Podány byly i tři dávky intravenózních imunoglobulinů v dávce 1 g/kg tělesné hmotnosti, veškerá terapie však byla bez efektu. Pacientka byla následně přeložena do RÚ. Při překladu byly přítomny hluboké kožní defekty zasahující ke svalům a šlachám DK. V krevním obraze byla opět významná leukopenie s Leu 1.9 109/l, v dalším nálezu i hypokomplementemie. Byla doplněna CT angiografie tepen dolních končetin, která neprokázala vaskulitické změny velkých tepen, popsány byly jen drobné nerovnosti cévní stěny při incipientní ateroskleróze. Defekty byly hodnoceny jako vaskulitické léze při SLE s nutností eskalace imunosupresivní terapie. V první linii léčby byla indikována pulzní terapie cyklofosfamidem (CFA) spolu se zvýšením dávky GK, do rezervy při selhání této léčby byl zvažován rituximab. První pulz cyklofosfamidu v dávce 10 mg/kg byl podán během hospitalizace v RÚ, další podání v měsíčních intervalech pacientka preferovala v místě bydliště. V červnu 2018 byla nemocná přijata ke zhodnocení efektu dosavadní terapie. V mezidobí však byly pro recidivující infekce podány jen tři pulzy CFA. Při terapii došlo ke zhojení defektu v oblasti hýždě, ulcerace na dolních končetinách přetrvávaly. Rentgenové vyšetření vyloučilo osteomyelitidu v místě defektů. Přítomna byla opět bakteriální superinfekce ulcerací (kultivačně Pseudomonas aeruginosa masivně) s nutností ATB léčby. V krevním obraze byla jen lehká anemie s Hb 114 g/l a hraniční trombocytopenie, počet leukocytů byl v normě. U pacientky jsme dále indikovali terapii cyklofosfamidem 10 mg/kg á měsíc, pacientka opět preferovala podávání v místě bydliště. Kontrolní hospitalizace však byla naplánována již za 3 měsíce. Při přijetí v říjnu 2018 došlo k objektivní významné progresi defektů obou dolních končetin (obr. 1), doporučená terapie CFA nebyla podávána pro obavy z prohloubení opakovaně zjištěné leukopenie. Stav se však zhoršil natolik, že v mezidobí byla nutná další hospitalizace, tentokrát na dermatologii FN Ostrava. Zde byla opět indikována ATB terapie pro masivní bakteriální infekci v nekrotickém terénu ulcerací. V RÚ byly stěry z defektů kultivačně negativní, v laboratoři dominovala anemie s Hb 88 g/l, ostatní nález byl v normě. Po dohodě s pacientkou byla domluvena pulzní terapie CFA á měsíc v RÚ. Celkem bylo podáno šest pulzů CFA, v průběhu léčby byla nutná mírná redukce dávky pro prohloubení leukopenie a trombocytopenie. Při terapii nicméně došlo k postupnému zlepšení lokálního nálezu DK. Při poslední hospitalizaci v RÚ v květnu 2019 jsme konstatovali plné zhojení vaskulitických defektů (obr. 2). Pro významnou leukopenii (Leu 1.9 109/l) nejspíš kombinované etiologie při SLE a v důsledku terapie CFA, jsme v terapii ponechali pouze GK v malé dávce a antimalarika. Dle posledních zpráv je stav pacientky stabilizovaný, nedochází k tvorbě nových kožních lézí, nejsou přítomny ani jiné orgánové manifestace SLE.
Tab. 1. SLICC klasifikační kritéria pro SLE 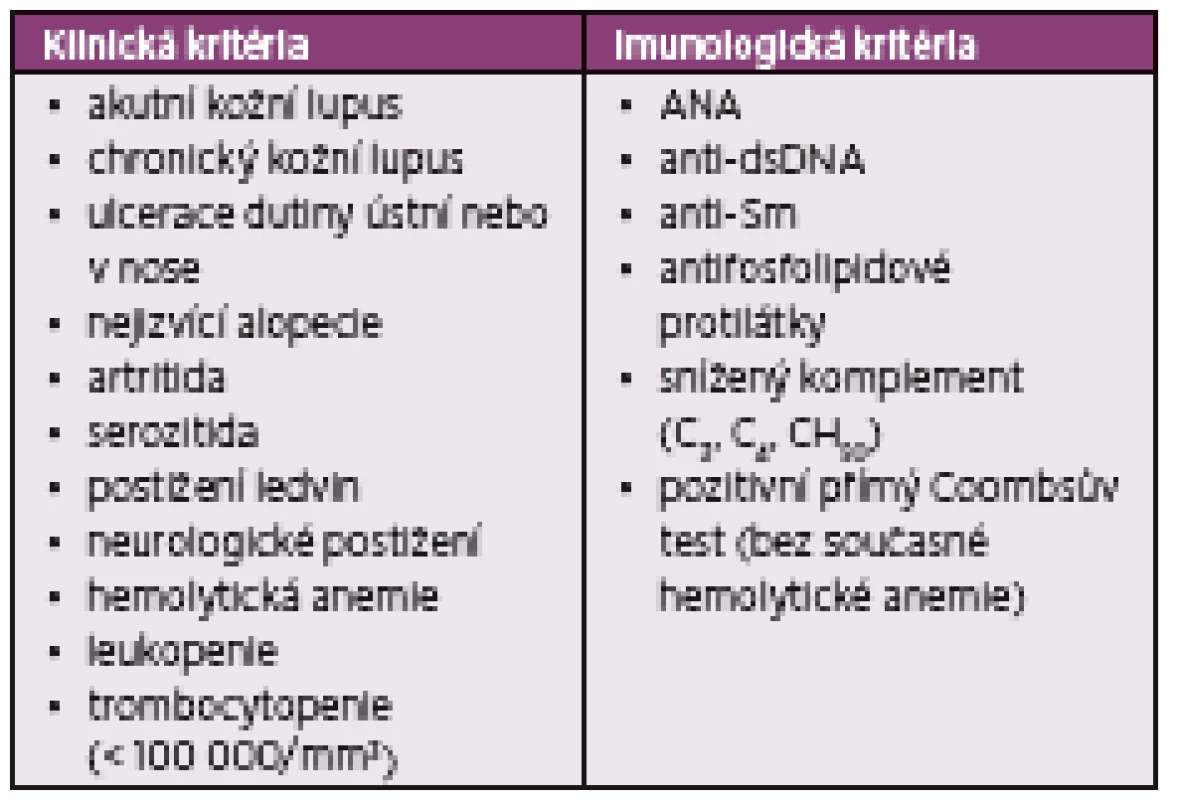
Klasifikační kritéria Systemic Lupus International Collaborating Clinics (SLICC) z roku 2012 (4). Onemocnění je klasifikováno jako systémový lupus erytematodes, pokud jsou splněna alespoň čtyři ze 17 kritérií. Splněno musí být vždy alespoň jedno z jedenácti klinických kritérií a jedno ze šesti imunologických kritérií. Alternativně jsou kritéria splněna při biopticky verifikované nefritidě při pozitivitě ANA nebo anti-dsDNA.
ANA – antinukleární protilátky, anti-dsDNA – protilátky proti dvouvláknové deoxyribonukleové kyselině, anti-Sm – protilátky proti antigenu Smith, SLE – systémový lupus erytematodesTab. 2. EULAR/ACR klasifikační kritéria pro SLE 2019 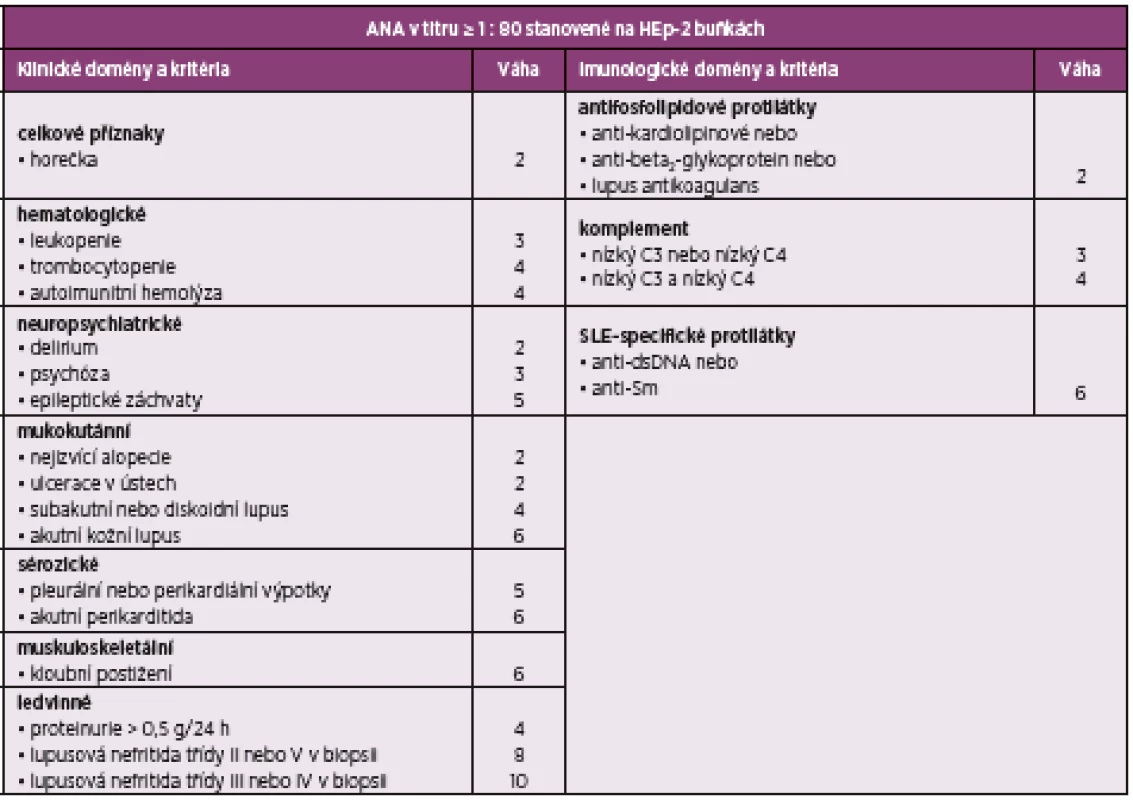
Klasifikační kritéria pro systémový lupus erytematodes (SLE) dle Evropské ligy proti revmatismu (EULAR) a Americké koleje revmatologů (ACR) z roku 2019 (5, 6). Vstupním kritériem ke klasifikaci onemocnění jako SLE je pozitivita antinukleárních protilátek v titru minimálně 1 : 80. Kritéria jsou dále rozdělena na sedm klinických a tři imunologické kategorie s různou bodovou hodnotou od 2 do 10. Onemocnění je klasifikováno jako SLE při celkovém skóre 10 a více.
ANA – antinukleární protilátky, anti-dsDNA – protilátky proti dvouvláknové deoxyribonukleové kyselině, anti-Sm – protilátky proti antigenu Smith, EULAR – Evropská liga proti revmatismu, ACR – Americká kolej revmatologů, SLE – systémový lupus erytematodesObr. 1. Stav kožních ulcerací v říjnu 2018. Došlo k významné progresi stávajících defektů, ulcerace zasahovaly hluboko k šlachám a svalům DK. 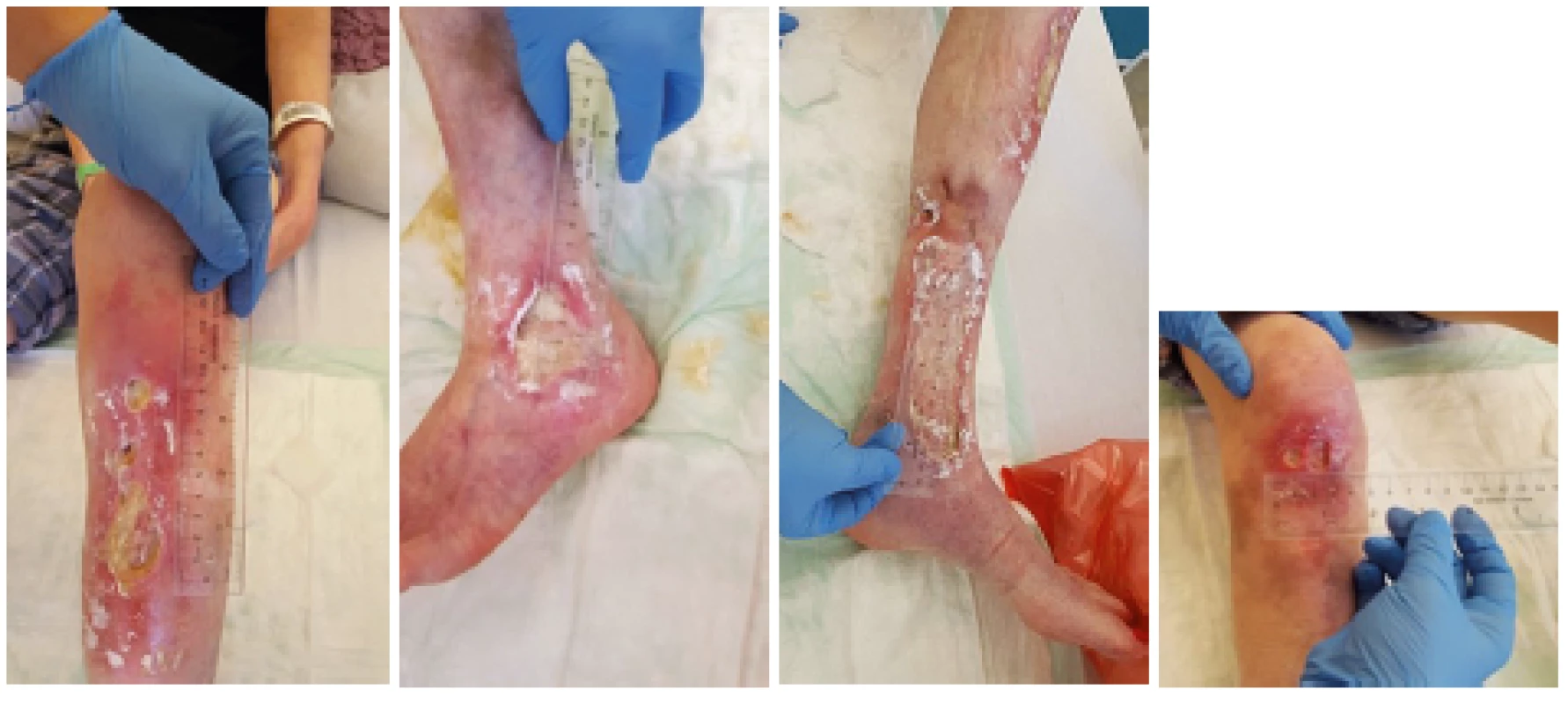
Obr. 2. Definitivní zhojení kožní vaskulitidy v květnu 2019 při poslední hospitalizaci v RÚ. Celkem bylo podáno od 11/2017 deset pulzů cyklofosfamidu v kumulativní dávce 4,1 g. 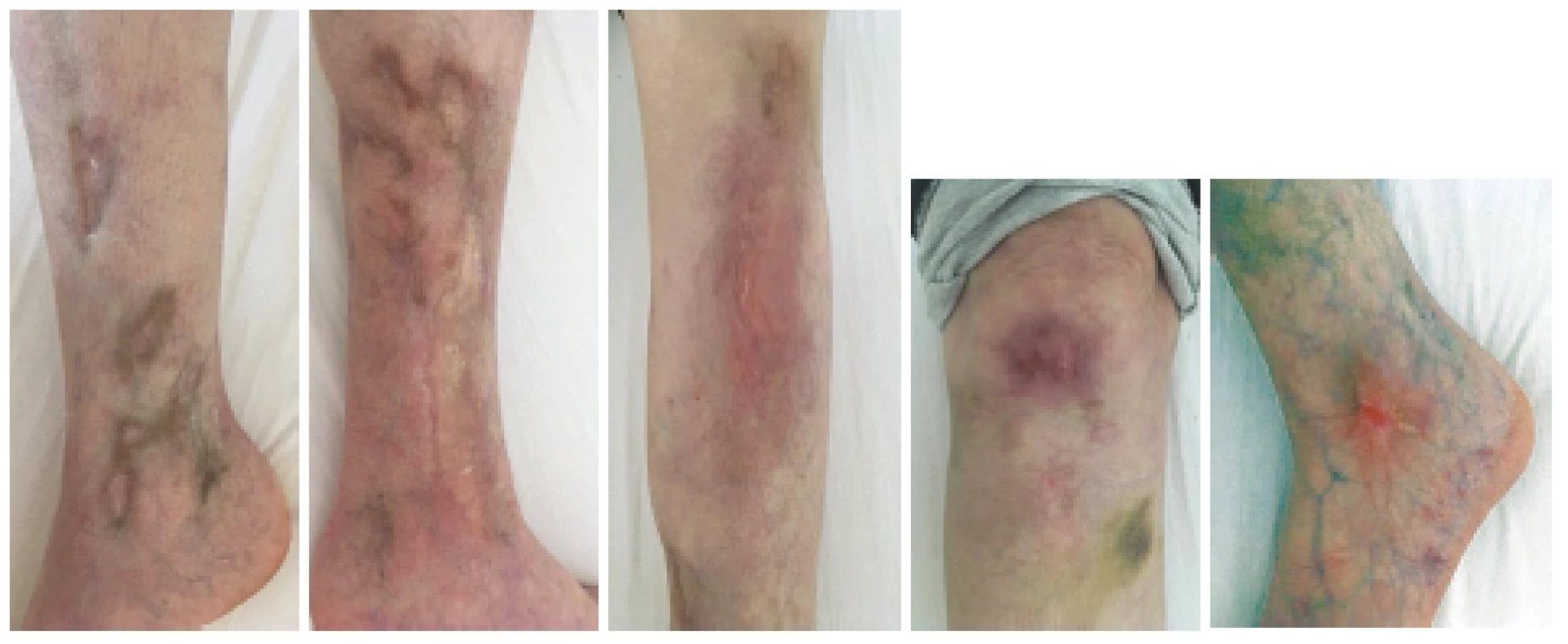
DISKUZE
Kožní vaskulitida je relativně častým projevem systémových onemocnění pojiva. Její závažnost se však významně liší, může se manifestovat jako drobné pomfy, které spíše pálí a bolí, než svědí, přetrvávají více jak 24 hodin, nemizí zcela „ad integrum“ (urtikariální vaskulitida). Typická je palpovatelná purpura, livedo racemosa, splývající sufuze s tvorbou nekróz, rozsáhlé hluboké defekty až gangrenózní změny s nutností amputace.
Je odhadováno, že až třetina pacientů se SLE vyvine v průběhu onemocnění vaskulitidu, přičemž drobné kožní cévy jsou postiženy nejběžněji. V jedné ze starších studií na velké kohortě 540 pacientů se SLE se vaskulitida objevila v průběhu 10letého pozorování až u 194 jedinců. Kožní vaskulitida byla přitom popsána u 160 pacientů (82,4 %), viscerální u 24 jedinců (12,3 %), postižení kožní a viscerální se vyskytlo pouze u 10 nemocných (5,1 %). V této studii vyvinuli vaskulitidu častěji jedinci s dlouhým průběhem onemocnění, u nichž byla diagnóza stanovena v mladém věku, a byli to častěji muži (7). Dle některých autorů je vznik vaskulitidy u SLE asociován s přítomností specifických autoprotilátek. Předpokládá se, že protilátky anti-dsDNA, anti-Ro a anti-kardiolipinové protilátky mají přímou souvislost se vznikem kožních vaskulitických lézí (8). Protilátky aktivují inflamatorní odpověď zprostředkovanou monocyty, což vede k místním zánětlivým změnám cévního endotelu. Další z protilátek, které mohou mít přímou patofyziologickou souvislost se vznikem zánětu cévní stěny, jsou protilátky proti cytoplazmě neutrofilů (ANCA protilátky). ANCA protilátky jsou patognomické pro samostatný typ vaskulitidy, ale vyskytují se až u 20 % pacientů se SLE (9, 10). U nemocných s kožní vaskulitidou a SLE jsou také velice často snížené hladiny komplementu (3). Terapie kožní vaskulitidy asociované se systémovým onemocněním pojiva může být v závislosti na rozsahu změn velice komplikovaná. U ojedinělých drobných kožních změn si vystačíme se základními imunosupresivy. Rozsáhlé nekrotické léze jsou spíše výrazem postižení malých až středně velkých cév, vyžadují komplexní terapeutický přístup, který je kombinací imunosupresivní léčby, lokální podpůrné terapie, nezřídka jsou nutná i ATB. V rozhodování o výběru vhodné imunosupresivní léčby můžeme vycházet ze starších, ale podrobných doporučení ACR z roku 2017 (11). Vhodná léčba je vybírána dle tíže kožního postižení, u nekomplikované kožní vaskulitidy jsou v první linii léčby doporučeny glukokortikoidy, eventuálně v kombinaci s hydroxychlorochinem nebo methotrexátem. Po selhání léčby je doporučen azathioprin nebo mykofenolát mofetil (MMF). U závažné gangrenózní kožní vaskulitidy je v první linii kombinace glukokortikoidů s intravenózně podávaným cyklofosfamidem, ve druhé linii je pak doporučen rituximab nebo plazmaferézy. Aktuální doporučení EULAR pro léčbu SLE bez renálního postižení rozdělují léčbu dle tíže projevů onemocnění u individuálního pacienta (12). Kožní vaskulitida postihující méně než 18 % tělesného povrchu je řazena mezi středně závažné manifestace onemocnění. Kromě běžných imunosupresiv je nově dle těchto doporučení u refrakterních případů ke zvážení nasazení belimumabu nebo kalcineurinových inhibitorů. Terapie cyklofosfamidem nebo rituximabem je rezervována pro nejtěžší projevy SLE včetně vaskulitických lézí postihující více než 18 % tělesného povrchu (obr. 3). I výše uvedená kazuistika ukazuje, jak komplikovaná a nelehká je léčba kožních vaskulitických projevů u SLE. Je také zřejmé, že bez adekvátní imunosupresivní terapie nedojde ke zlepšení klinického stavu se zhojením ulcerací.
Obr. 3. Aktuální doporučení pro léčbu SLE bez postižení ledvin (upraveno dle Fanouriakis et al. 2019). Terapie je volena dle tíže manifestací onemocnění u individuálního pacienta. Kožní vaskulitida postihující ≤ 18 % tělesného povrchu je řazena mezi středně těžké projevy SLE. 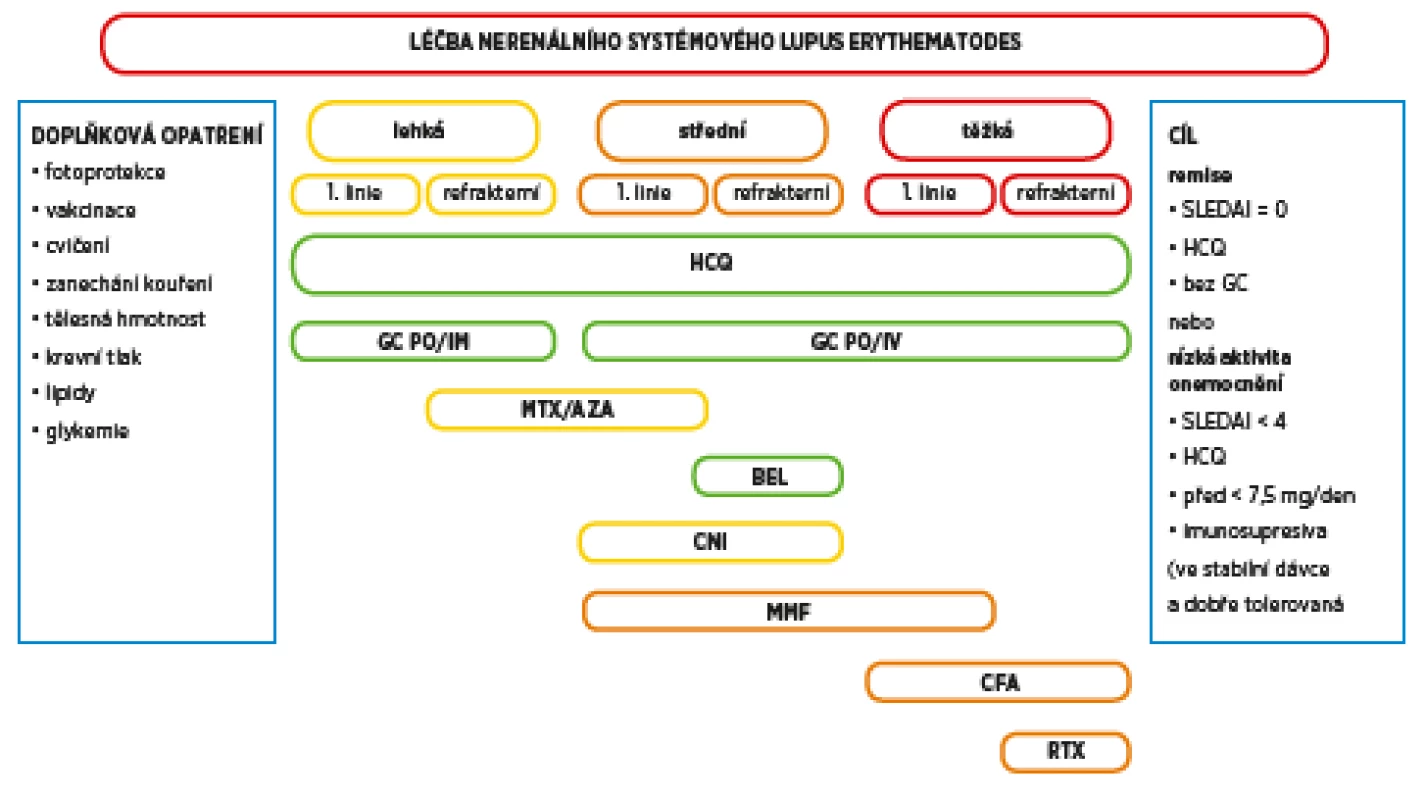
HCQ – hydroxychlorochin, GC – glukokortikoidy, PO – per os, IM – intramuskulárně, IV – intravenózně, MTX – methotrexát, AZA – azatioprin, BEL – belimumab,
CNI – kalcin eurinové inhibitory, MMF – mykofenolát mofetil, CFA – cyklofosfamid, RTX – rituximab, SLEDAI – index aktivity systémového lupus erytematodes (SLE diasease activity index), Pred – prednisonZÁVĚR
Systémový lupus erytematodes je onemocnění s velmi pestrými klinickými projevy a četnými orgánovými komplikacemi. Tíže onemocnění je dána průběhem a rozsahem orgánových změn. Avšak i jedinci, kteří nemají postižení hlavních orgánů, jako jsou plíce, ledviny nebo CNS mohou mít velmi závažný průběh onemocnění. V této kazuistice je jasně ukázáno, že i kožní vaskulitida může významně ovlivňovat morbiditu pacienta. Léčba takto rozsáhlých kožních ulcerací vyžaduje komplexní terapeutický přístup. Hlavní roli však hraje adekvátní imunosupresivní terapie, a to i přes její četná rizika a negativa. Kožní vaskulitida je závažným projevem aktivity nemoci, je považována za negativní prognostický faktor dalšího průběhu onemocnění. Proto je zásadní její časné rozpoznání a důsledné zaléčení.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Monika Gregová, Ph.D.
Revmatologický ústav Praha
Na Slupi 4, 128 50 Praha 2
e-mail: gregova@revma.cz
Zdroje
1. Ramos-Casals M, Nardi N, Lagrutta M, Brito-Zerón P, Bové A, Delgado G, et al. Vasculitis in systemic lupus erythematosus: Prevalence and Clinical Characteristics in 670 patients. Medicine 2006; 85 : 95–104.
2. Callen JP, Kingman J. Cutaneous vasculitis in systemic lupus erythematosus. A poor prognostic indicator. Cutis 1983; 32 : 433–436.
3. Gheita TA, Abaza NM, Sayed S, El-Azkalany GS, Fishawy HS, Eissa AH. Cutaneous vasculitis in systemic lupus erythematosus patients: potential key player and implications. Lupus 2017; 1 : 1–6.
4. Petri M, Orbai AM, Alarcón GS, Gordon C, Merrill JT, Fortin PR, et al. Derivation and validation of the Systemic Lupus International Collaborating Clinics criteria for systemic lupus erythematosus. Arthritis Rheumatol 2012; 64 : 2677–2686.
5. Aringer M, Costenbader K, Daikh D, Brinks R, Mosca M, Ramsey-Goldman R, et al. 2019 European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus. Ann Rheum Dis 2019; 78 : 1151–1159.
6. Aringer M, Costenbader K, Daikh D, Brinks R, Mosca M, Ramsey-Goldman R, et al. 2019 European League Against Rheumatism/American College of Rheumatology classification criteria for systemic lupus erythematosus. Arthritis Rheumatol 2019; 71 : 1400–1412.
7. Drenkard C, Villa AR, Reyes E, Abello M, Alarcón-Segovia D. Vasculitis in systemic lupus erythematosus. Lupus 1997; 6 : 235–242.
8. Praprotnik S, Blank M, Meroni PL, Rozman B, Eldor A, Shoenfeld Y. Classification of anti-endothelial cell antibodies into antibodies against microvascular and macrovascular endothelial cells. Arthritis Rheum 2001; 44 : 1484–1494.
9. Galeazzi M, Morozzi G, Sebastiani GD, Bellisai F, Marcolongo R, Cerveraet R, et al. Antineutrophil cytoplasmatic antibodies in 566 European patients with systemic lupus erythematosus: prevalence, clinical associations and correlation with other autoantibodies. Clin Exp Rheumatol 1998; 16 : 541–546.
10. Mansi IA, Opran A, Rosner F. ANCA-associated small vessel vasculitis. Am Fam Physician 2002; 65 : 1615–1620.
11. Muangchan Ch, van Vollenhoven RF, Bernatsky RS, Douglas Smith C, Hudson M, Inanc M, et al. Treatment algorithms in systemic lupus erythematosus. Arthritis Care Res 2015; 67 : 1237–1245.
12. Fanouriakis A, Kostopoulou M, Alunno A, Aringer M, Bajema I, Cervera R, et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Ann Rheum Dis 2019; 78 : 736–745.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2020 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Stillova choroba: vzácné a závažné systémové onemocnění
Nejčtenější v tomto čísle- Léky indukovaný lupus
- Kožní vaskulitida u SLE – léčit či neléčit?
- Polyarteritis nodosa s disekcí iliackých tepen
- Příznaky deprese a úzkosti u nemocných s axiální spondyloartritidou: pilotní studie u nemocných s aktivním přístupem k pohybové terapii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



