-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Aktivní sledování malých tumorů ledviny
ACTIVE SURVEILLANCE OF THE SMALL RENAL MASS
With the continued, routine use of cross-sectional imaging for unrelated reasons, the incidental diagnosis of small renal masses (< 4 cm) continues to rise. Yet, despite this fact, the overall mortality rate for renal cell carcinoma remains unchanged. Active surveillance of small renal masses has emerged as a viable option for patients, especially those who are older and/or co-morbid. In this article, we review the existing world literature regarding small renal masses with specific interest in growth kinetics and rates of progression/metastases.
Key words:
renal cell carcinoma, small renal mass, active surveillance
Autoři: M. C. Smaldone; D. Canter; J. Simhan; A. Kutikov; R. G. Uzzo *
Působiště autorů: Department of Surgery, Division of Urologic Oncology, Fox Chase Cancer Center, Philadelphia, Pennsylvania *
Vyšlo v časopise: Urol List 2012; 10(1): 26-30
Souhrn
Díky rozšířenému rutinnímu provádění moderních zobrazovacích vyšetření nesouvisejících lézí náhodná míra detekce malých tumorů ledviny (< 4 cm) neustále stoupá. Tato skutečnost však nemá žádný vliv na celkovou míru mortality na karcinom z renálních buněk. Aktivní sledování malých tumorů ledviny představuje schůdnou alternativu, zejména pro starší pacienty a/nebo pacienty s dalšími komorbiditami. Autoři článku hodnotí dostupné publikace zabývající se léčbou malých tumorů ledviny s přihlédnutím ke kinetice růstu tumoru a míře progrese/šíření metastáz.
Klíčová slova:
karcinom z renálních buněk, malé tumory ledviny, aktivní sledování
Karcinom z renálních buněk (RCC) je ze všech urologických maligních onemocnění spojen s nejvyšší mortalitou. V roce 2010 v USA tomuto onemocnění podlehlo přibližně 22,4 % pacientů [1]. V důsledku častějšího provádění vyšetření břicha pomocí moderních zobrazovacích vyšetření v uplynulých několika desetiletích [2,3] tvoří náhodně detekované asymptomatické léze více než polovinu odhalených tumorů ledviny [4]. Spolu se zvyšující se incidencí malých renálních tumorů (SRM) se odpovídající rychlostí zvyšuje i počet operací ledviny, ke zlepšení míry mortality na RCC však dosud nedošlo [3]. Tyto údaje svědčí o tom, že určité procento SRM představuje indolentní onemocnění, díky čemuž se možnost aktivního sledování (AS) stala schůdnou terapeutickou modalitou u vybraných pacientů se SRM a významnými komorbiditami. Autoři tohoto článku představují přístupy pro léčbu pacientů se SRM a uvádí přehled dostupných publikací zabývajících se přirozeným vývojem tohoto onemocnění a metastazujícím potenciálem SRM u pacientů podstupujících AS.
INDIKACE PRO SLEDOVÁNÍ A V SOUČASNÉ DOBĚ UŽÍVANÉ PROTOKOLY
Potenciální kandidáty pro AS klasifikujeme podle indikace do následujících skupin: absolutní, relativní nebo volitelná indikace. Absolutní indikace platí pro ty pacienty, u nichž operační léčba představuje okamžité a nepřijatelné riziko mortality. Relativní indikace platí pro pacienty se sdruženými onemocněními, jako například další maligní onemocnění, pacienty, kteří jsou potenciálními kandidáty pro transplantaci ledviny a pacienty s významnými, ačkoli nikoli prvořadými komorbiditami. Volitelná indikace zahrnuje ty pacienty, kteří si zvolí AS navzdory tomu, že je u nich operace spojena s nízkým rizikem [5].
Při zvažování možností léčby je lékař povinen uvážit faktory ovlivňující očekávanou délku života pacienta a srovnat tyto faktory s rizikem morbidity a mortality neléčeného lokalizovaného RCC. Je nutné uvážit skutečnost, že pacient může po výkonu vyžadovat transplantaci ledviny, zejména pokud uvážíme souvislost mezi onemocněním ledviny v konečném stadiu a nepříznivými příhodami souvisejícími s morbiditou a mortalitou [6]. Rovněž je třeba počítat s rizikem chronického onemocnění ledviny vzhledem k tomu, že nejnovější data ukazují, že nižší rychlost glomerulární filtrace (eGFR) souvisí s vyšším rizikem úmrtí, kardiovaskulární příhodou a hospitalizací pacienta [7]. Primárním cílem AS je v každém případě najít rovnováhu mezi riziky s léčbou spojenými, zdravotními riziky a riziky progrese onemocnění a vznikem metastáz.
HODNOCENÍ SOUVISEJÍCÍCH RIZIK U PACIENTŮ S LOKALIZOVANÝM KARCINOMEM LEDVINY
Ačkoli u mladých, jinak zdravých pacientů představuje chirurgická resekce malých renálních tumorů v současné době standardní metodu léčby [8], léčba lokalizovaného RCC u starších pacientů a pacientů v celkově horším zdravotním stavu s četnými komorbiditami představuje neobvyklou výzvu. Nejnovější studie poukazují na rozdíly mezi rizikem úmrtí na karcinom a rizikem úmrtí v důsledku jiné komorbidity. Analýza rizik zahrnující 26 618 pacientů, kteří podstoupili operační léčbu lokalizovaného RCC (na základě údajů databáze SEER – Surveillance, Epidemiology and End Results), prokázala, že pacienti s nejmenšími tumory dosahují nejdelší doby přežití specifické pro karcinom a že spolu se zvyšujícím se věkem se zvyšuje i mortalita [9]. Autoři uvádí, že bez ohledu na velikost tumoru činí mortalita na ostatní příčiny po pěti letech u pacientů ≥ 70 let 28,2 %.
Kutikov et al vyvinuli podrobný nomogram (na základě předoperačních a demografických proměnných) pro predikci rizika úmrtí na karcinom ledviny po pěti letech, úmrtí na jiná maligní onemocnění a úmrtí na jiné příčiny, než je karcinom [10]. Na základě tohoto nomogramu bude mít 75letý běloch s tumorem o velikosti 4 cm 5% riziko mortality specifické pro karcinom, 4,5% riziko úmrtí na ostatní maligní onemocnění a 14% riziko na nekarcinomatózní příčiny (po pěti letech). Tento nomogram spolu s dalšími prediktivními modely pro onkologická onemocnění močopohlavního systému jsou k dispozici bezplatně na webových stránkách www.cancernomograms.com. Tyto údaje jasně zdůrazňují význam kalkulace rizik a benefitů před indikací chirurgické léčby SRM.
VÝZNAM PERKUTÁNNÍ BIOPSIE A PREDIKCE MALIGNÍHO POTENCIÁLU BEZ EXSTIRPACE NÁDORU
Využití biopsie tumoru ledviny, který vykazuje „enhancement“, má svá omezení v podobě nejrůznějších rizik, chyb při odběru vzorku a klinicky irelevantních výsledků [11]. V současné době je význam perkutánní biopsie ledviny znovu přezkoumáván. Moderní studie využívající 18G biopsii a moderní imunohistologické techniky dosahují přesnější diferenciace mezi benigním a maligním histologickým typem (> 90 %) s minimálním výskytem komplikací [12]. Pakliže biopsie prokáže přítomnost maligního onemocnění, přesahuje pozitivní predikční hodnota 95 %, a uváděná rizika výskytu drobných komplikací (< 5 %) nebo rozsevu tumoru (< 0,01 %) jsou extrémně nízká [11]. Ačkoli se provádění biopsie rozšiřuje, v současné době se biopsie využívá selektivně u pacientů s absolutními nebo relativními indikacemi nebo za specifických okolností, jako je např. současný výskyt bilaterálních lézí [13].
Stále větší množství důkazů nasvědčuje tomu, že mezi anatomickými parametry a patologií tumoru ledviny může existovat potenciální souvislost, ovšem teprve v nedávné době byly popsány objektivní metody pro měření tumoru ledviny [14–16]. Skóre R.E.N.A.L. (je první hodnoticí škálou umožňující naměřit reprodukovatelné a přesné anatomické parametry a jejich souvislost k možnosti chirurgického odstranění [17]. Dále jsou k dispozici hodnotící systémy P.A.D.U.A [18] a C-Index [19]. Kutikov et al prokázali, že celkové skóre R.E.N.A.L. odpovídá histologické charakteristice tumoru, tj. papilární a chromofóbní tumory mají nízké skóre, což svědčí o tom, že se jedná o exofytické tumory malé velikosti lokalizované v pólu ledviny. Na základě jejich údajů byly predikční nomogramy sestaveny s cílem umožnit lékaři predikovat maligní histologický potenciál tumoru (AUC 0,76) před operací a parametry indikující přítomnost tumoru o vysokém grade (AUC 0,73) [20]. Pakliže budou dále modifikovány, nabízí tyto (a další) predikční modely významný potenciál jako instrument pro volbu léčby u pacientů s nově diagnostikovaným SRM.
PŘIROZENÝ VÝVOJ SLEDOVANÉHO TUMORU LEDVINY
Ve snaze sjednotit údaje malých studií jednotlivých center zabývajících se AS u pacientů se SRM (tab. 1) a identifikovat tendence růstu/kinetiky SRM provedli Chawla et al metaanalýzu devíti retrospektivních studií z devíti center. Metaanalýza zahrnuje celkem 234 tumorů sledovaných po průměrně 34 měsíců. Průměrná velikost tumoru v průměru (na počátku sledování) činila 2,6 cm (rozmezí 1,73–4,08), průměrná rychlost růstu 0,28 cm/rok a míra potvrzení při patologickém vyšetření činila 46 % (92% RCC nebo varianta RCC) [21]. Tato zjištění byla v nedávné době aktualizována v systémovém přehledu 18 studií, který zahrnoval 880 pacientů s celkem 936 SRM [22]. Průměrná velikost tumoru v průměru se (na počátku sledování) u 586 pacientů pohybovala v rozmezí 1,73–7,2 cm [5,23–35]; počáteční objem tumoru v době diagnostikování onemocnění u 284 pacientů byl odhadován na 6,0–83,5 cm3 [5,26,28,33,34]. Průměrná změna maximální hodnoty průměru tumoru za rok se pohybovala v rozmezí 0,1–0,7 cm/rok [5,23–35], změna v odhadovaném objemu za rok se pohybovala v rozmezí 2,7–26,8 cm3/rok [5,25–28,33,34].
Tab. 1. Klinické parametry a parametry zobrazovacího vyšetření malých tumorů ledviny u pacientů zařazených do programu aktivního sledování. 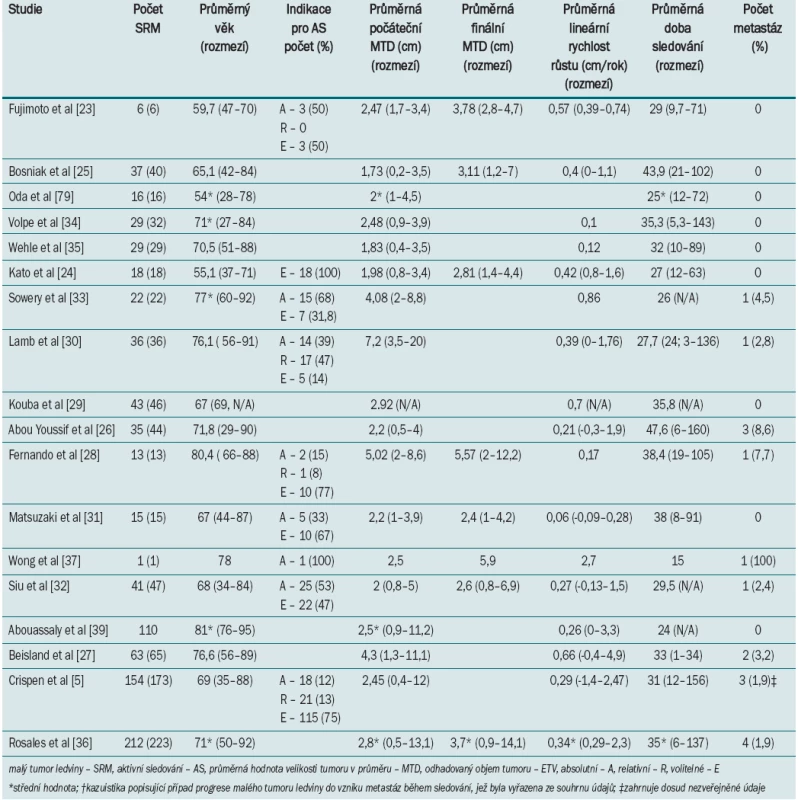
Smaldone et al ve své analýze uvádí souhrn dostupných informací 275 pacientů (299 SRM), kteří splňovali vstupní kritéria [22]. Průměrná maximální velikost tumoru v průměru (n = 297) v době diagnózy činila 2,4 ± 1,4 cm (medián 2; rozmezí 0,2–12) a odhadovaný objem tumoru (n = 297) v době diagnózy 17,8 ± 63,9 cm3 (medián 4,3; rozmezí 0,004 – –903,7). Během sledování (n = 298) o průměrné délce 33,6 ± 23,1 měsíců (medián 27,1; rozmezí 5,3–156), činila průměrná změna maximální velikosti tumoru v průměru (lineární rychlost růstu; n = 263) 0,33 ± 0,41 cm/rok (medián 0,26; rozmezí –1,4–2,7) a odhadovaný objem tumoru (rychlost růstu objemu tumoru; n = 295) 7,3 ± 27,9 cm3/rok (medián 1,9; rozmezí –20,0–430,7). U 18 pacientů (2,1) se během průměrné doby sledování 40,2 mě-síců vyvinuly metastázy.
MALÉ TUMORY LEDVINY PROGREDUJÍCÍ DO METASTAZUJÍCÍHO STADIA U PACIENTŮ PODSTUPUJÍCÍCH SLEDOVÁNÍ
Při volbě pacientů do AS protokolu představuje nejvýznamnější kritérium progrese onemocnění do metastazujícího stadia (tab. 2). V našem systematickém přehledu jsme z celkem 880 pacientů se SRM, kteří podstoupili AS, odhalili 18 pacientů, u nichž došlo ke vzniku metastáz (2,1 %) [5,26–28,30,32,33,36–38]. Co je třeba zdůraznit, ke vzniku metastáz došlo až v pozdější fázi (průměr 40,2 měsíců, rozmezí 12–132 měsíců). Pacienti, u nichž došlo ke vzniku metastáz, měli obvykle větší tumor (4,1 vs 2,3 cm; p < 0,0001) i odhadovaný objem tumoru (66,4 vs 15,1 cm3; p < 0,0001) v době diagnostikování onemocnění, vyšší průměrnou lineární rychlost růstu (0,80 vs 0,30 cm/rok; p = 0,0001) i vyšší rychlost růstu objemu tumoru (27,1 vs 6,2 cm3/rok; p < 0,0001) [22]. Ačkoli výsledky našeho přehledu nasvědčují tomu, že progredující léze představují pouze malé procento všech tumorů (2,1 %), vykazují tyto léze rychlý růst (0,8 cm/rok)a v době diagnostikování byly ve sta-diu > cT1b (38 % > 4 cm) [22]. Skupina pacientů s progredujícím onemocněním také častěji zahrnovala pacienty s absolutní indikací pro AS, což svědčí o tom, že pacienti nebyli vhodnými kandidáty pro operační léčbu (navzdory závažným radiografických charakteristikám).
Tab. 2. Klinické a radiografické parametry malých tumorů ledviny, u nichž došlo během sledování k progresi do vzniku metastáz. 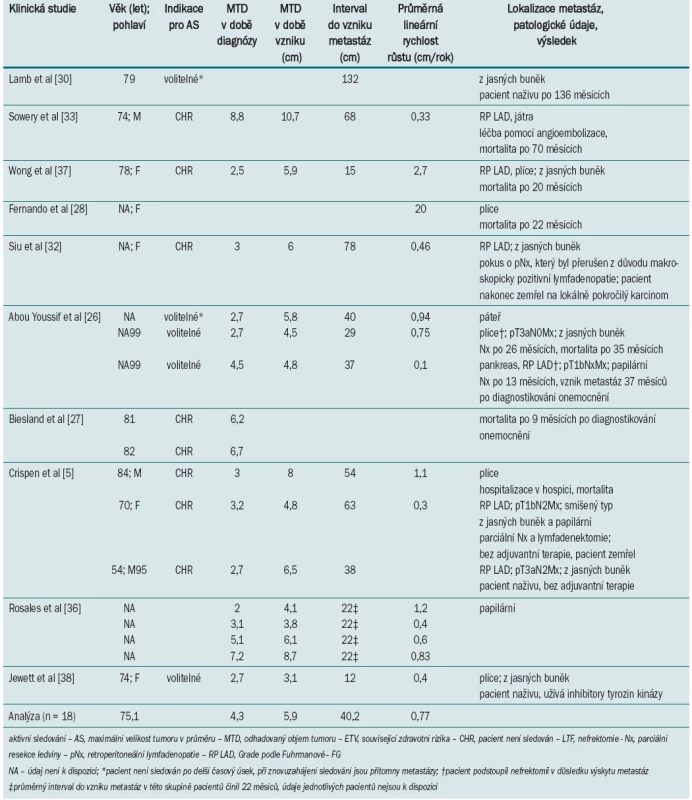
ZÁVĚR
Spolu s častějším užíváním moderních zobrazovacích vyšetření břicha došlo k významnému posunu stadia onemocnění směrem k náhodné detekci malých lokalizovaných tumorů ledviny o velikosti < 4 cm. Navzdory nedostatku moderních publikací zabývajících se přirozeným vývojem neléčených malých tumorů ledviny ukazují nejnovější údaje, že většina tumorů vykazuje pomalý růst s velmi nízkým procentem progrese do metastazujícího stadia. Analýza lézí progredujících do metastazujícího stadia u pacientů podstupujících sledování ukazuje, že tyto tumory mají v době diagnostikování tendenci mít větší velikost, vyšší jaderný grade a významně rychlejší charakter růstu.
Robert G. Uzzo, MD
Chairman, Department of Surgery
Division of Urologic Oncology
Fox Chase Cancer Center
333 Cottman Avenue
Philadelphia, Pennsylvania, 19111
RUzzo@fccc.edu
Zdroje
1. Jemal A, Siegel R, Xu J et al. Cancer statistics, 2010. CA Cancer J Clin 2010; 60(5): 277–300.
2. Chow WH, Devesa SS, Warren JL et al. Rising incidence of renal cell cancer in the United States. JAMA 1999; 281(17): 1628–1631.
3. Hollingsworth JM, Miller DC, Daignault S et al. Rising incidence of small renal masses: a need to reassess treatment effect. J Natl Cancer Inst 2006; 98(18): 1331–1334.
4. Jayson M, Sanders H. Increased incidence of serendipitously discovered renal cell carcinoma. Urology 1998; 51(2): 203–205.
5. Crispen PL, Viterbo R, Boorjian SA et al. Natural history, growth kinetics, and outcomes of untreated clinically localized renal tumors under active surveillance. Cancer 2009; 115(13): 2844–2852.
6. Letourneau I, Ouimet D, Dumont M et al. Renal replacement in end-stage renal disease patients over 75 years old. Am J Nephrol 2003; 23(2): 71–77.
7. Go AS, Chertow GM, Fan D et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351(13): 1296–1305.
8. Campbell SC, Novick AC, Belldegrun A et al. Guideline for management of the clinical T1 renal mass. J Urol. 2009; 182(4): 1271–1279.
9. Hollingsworth JM, Miller DC, Daignault S et al. Five-year survival after surgical treatment for kidney cancer: a population-based competing risk analysis. Cancer 2007; 109(9): 1763–1768.
10. Kutikov A, Egleston BL, Wong YN et al. Evaluating overall survival and competing risks of death in patients with localized renal cell carcinoma using a comprehensive nomogram. J Clin Oncol 2010; 28(2): 311–317.
11. Lane BR, Samplaski MK, Herts BR et al. Renal mass biopsy--a renaissance? J Urol 2008; 179(1): 20–27.
12. Wang R, Wolf JS Jr., Wood DP Jr. et al. Accuracy of percutaneous core biopsy in management of small renal masses. Urology 2009; 73(3): 586–590.
13. Rothman J, Crispen PL, Wong YN et al. Pathologic concordance of sporadic synchronous bilateral renal masses. Urology 2008; 72(1): 138–142.
14. Schachter LR, Bach AM, Snyder ME et al. The impact of tumour location on the histological subtype of renal cortical tumours. BJU Int 2006; 98(1): 63–66.
15. Venkatesh R, Weld K, Ames CD et al. Laparoscopic partial nephrectomy for renal masses: effect of tumor location. Urology 2006; 67(6): 1169–1174.
16. Weizer AZ, Gilbert SM, Roberts WW et al. Tailoring technique of laparoscopic partial nephrectomy to tumor characteristics. J Urol 2008; 180(4): 1273–1278.
17. Kutikov A, Uzzo RG. The R.E.N.A.L. nephrometry score: a comprehensive standardized system for quantitating renal tumor size, location and depth. J Urol 2009; 182(3): 844–853.
18. Ficarra V, Novara G, Secco S et al. Preoperative aspects and dimensions used for an anatomical (PADUA) classification of renal tumours in patients who are candidates for nephron-sparing surgery. Eur Urol 2009; 56(5): 786–793.
19. Simmons MN, Ching CB, Samplaski MK et al. Kidney tumor location measurement using the C index method. J Urol 2010; 183(5): 1708–1713.
20. Kutikov A, Manley BJ, Canter DJ et al. Anatomical features of enhancing renal masses predict histology and grade – an analysis using nephrometry (AUA abstract no. 1238). J Urol 2010; 183(4): e479.
21. Chawla SN, Crispen PL, Hanlon AL et al. The natural history of observed enhancing renal masses: meta-analysis and review of the world literature. J Urol 2006; 175(2): 425–431.
22. Smaldone MC, Kutikov A, Canter DJ et al. A Critical Analysis of Active Surveillance with Delayed Curative Intent for the Treatment of Small Renal Masses. Podium presentation (#11); presented at the Society of Urologic Oncology. 2010.
23. Fujimoto N, Sugita A, Terasawa Y et al. Observations on the growth rate of renal cell carcinoma. Int J Urol 1995; 2(2): 71–76.
24. Kato M, Suzuki T, Suzuki Y et al. Natural history of small renal cell carcinoma: evaluation of growth rate, histological grade, cell proliferation and apoptosis. J Urol 2004; 172(3): 863–866.
25. Bosniak MA, Birnbaum BA, Krinsky GA et al. Small renal parenchymal neoplasms: further observations on growth. Radiology 1995; 197(3): 589–597.
26. Abou Youssif T, Kassouf W, Steinberg J et al. Active surveillance for selected patients with renal masses: updated results with long-term follow-up. Cancer 2007; 110(5): 1010–1014.
27. Beisland C, Hjelle KM, Reisaeter LA et al. Observation should be considered as an alternative in management of renal masses in older and comorbid patients. Eur Urol 2009; 55(6): 1419–1427.
28. Fernando HS, Duvuru S, Hawkyard SJ. Conservative management of renal masses in the elderly: our experience. Int Urol Nephrol 2007; 39(1): 203–207.
29. Kouba E, Smith A, McRackan D et al. Watchful waiting for solid renal masses: insight into the natural history and results of delayed intervention. J Urol 2007; 177(2): 466–470.
30. Lamb GW, Bromwich EJ, Vasey P et al. Management of renal masses in patients medically unsuitable for nephrectomy--natural history, complications, and outcome. Urology 2004; 64(5): 909–913.
31. Matsuzaki M, Kawano Y, Morikawa H et al. Conservative management of small renal tumors. Hinyokika Kiyo 2007; 53(4): 207–211.
32. Siu W, Hafez KS, Johnston WK 3rd et al. Growth rates of renal cell carcinoma and oncocytoma under surveillance are similar. Urol Oncol 2007; 25(2): 115–119.
33. Sowery RD, Siemens DR. Growth characteristics of renal cortical tumors in patients managed by watchful waiting. Can J Urol 2004; 11(5): 2407–2410.
34. Volpe A, Panzarella T, Rendon RA et al. The natural history of incidentally detected small renal masses. Cancer. 2004; 100(4): 738–745.
35. Wehle MJ, Thiel DD, Petrou SP et al. Conservative management of incidental contrast-enhancing renal masses as safe alternative to invasive therapy. Urology 2004; 64(1): 49–52.
36. Rosales JC, Haramis G, Moreno J et al. Active surveillance for renal cortical neoplasms. J Urol 2010; 183(5): 1698–1702.
37. Wong JA, Rendon RA. Progression to metastatic disease from a small renal cell carcinoma prospectively followed with an active surveillance protocol. Can Urol Assoc J 2007; 1(2): 120–122.
38. Jewett MA, Finelli A, Morash C et al. Active Surveillance of Small Renal Masses: A Prospective Multi-Center Canadian Uro-Oncology Group Trial: Abstract No. 896. J Urol 2009; 181 (4 Suppl): 320.
39. Abouassaly R, Lane BR, Novick AC. Active surveillance of renal masses in elderly patients. J Urol 2008; 180(2): 505–508.
Štítky
Dětská urologie Urologie
Článek Slovo úvodem
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Slovo úvodem
- Souvislost mezi testosteronem a karcinomem prostaty
- Nádory prostaty a varlat u české a světové populace
- Aktivní sledování malých tumorů ledviny
- Radiofrekvenční ablace nádorů ledvin
- Současné principy a terapeutické koncepty pro retrográdní intrarenální odstranění urolitiázy
- Role profylaxe antibiotiky při léčbě vezikoureterálního refluxu
-
Laparoskopická operace pánevního dna
Část I – laparoskopická kolposuspenze
Část II – laparoskopická kolpopexe - Roztroušená skleróza a dysfunkce dolních močových cest. Možnosti diagnostiky, potřeba léčby a sledování
- Jaká je skutečnost srovnání konvenčního a roboticky asistovaného přístupu k radikální prostatektomii? Je oprávněné platit vyšší cenu?
- Nykturie u geriatrické populace a její důsledky, jaké jsou možnosti jejího ovlivnění, co je možné, co reálné a co smysluplné?
- Nežádoucí účinky antimuskarinik na centrální nervový systém
- Popis a klasifikace komplikací po urologických chirurgických výkonech:Ad hoc hodnocení a doporučení EAU Guidelines
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Souvislost mezi testosteronem a karcinomem prostaty
- Nežádoucí účinky antimuskarinik na centrální nervový systém
-
Laparoskopická operace pánevního dna
Část I – laparoskopická kolposuspenze
Část II – laparoskopická kolpopexe - Radiofrekvenční ablace nádorů ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



