-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Důsledek akutního nedostatku pohybu: „detraining“ a celkový pokles funkční kapacity
Consequence of acute lack of exercise: detraining and overall decrease in functional capacity
Almost everyone will experience a short-term lack of physical activity during their lifetime. In athletes who train regularly, the reason is most often an acute illness or injury. In the untrained population, restrictions on physical activity at any age are most often linked to health problems, but may also be related to anti-pandemic measures, as we have recently seen in the global fight against the COVID-19 pandemic. As "detraining" we mean a condition that occurs with such an extraordinary reducing of physical activity. It is manifested mainly by a decrease or loss of adaptive abilities, achieved by previous training or previous normal daily physical activity. In athletes there is a decrease in performance, in average fit people there is a weakening of the state of health, which requires convalescence. For people who have previously suffered from health problems, "detraining" can lead to loss of independence and deepening of their frailty to complete dependence on the environment. In the prevention of these negative consequences, it is necessary to reduce the period of restriction of movement to a minimum, ensure sufficient protein in the diet, minimize time spent in bed or sedentary and use online instruction on how to exercise at home. Otherwise, only a few weeks without optimal movement leads to a very significant reduction in physical condition, manifested in particular by a very significant decrease of adaptations earned from training especialy of cardiorespiratory capacity.
Keywords:
VO2max – COVID-19 – acute lack of exercise – detraining – bed-rest – cardiorespiratory capacity
Autoři: J. Novák
Působiště autorů: Vedoucí: doc. MUDr. Aleš Kroužecký, Ph. D. ; Ústav sportovní medicíny a aktivního zdraví LF UK, Plzeň
Vyšlo v časopise: Prakt. Lék. 2021; 101(5): 251-257
Kategorie: Přehledy
Souhrn
S krátkodobým nedostatkem pohybové aktivity se v průběhu života setká téměř každý. U pravidelně trénujících sportovců je důvodem nejčastěji akutní onemocnění nebo úraz. U nesportující populace souvisí omezení pohybové aktivity v jakémkoliv věku nejčastěji se zdravotními problémy, může však souviset i s nařízenými protipandemickými opatřeními, jak jsme nedávno zažili v souvislosti s celosvětovým bojem s pandemií COVID-19. Jako „detraining“ pak označujeme stav, který s takovýmto mimořádným omezením pohybové aktivity nastává. Projevuje se především úbytkem či ztrátou adaptačních schopností dosažených předchozím tréninkem, příp. předchozí běžnou každodenní pohybovou aktivitou. U sportovců dochází k poklesu výkonnosti, u průměrně zdatných osob k oslabení zdravotního stavu, vyžadujícího rekonvalescenci. U osob, které již dříve trpěly zdravotními potížemi, může „detraining“ vést ke ztrátě samostatnosti a prohloubení jejich křehkosti až k úplné závislosti na okolí. V prevenci těchto negativních důsledků je třeba jednak zkrátit období nutného omezení pohybu na minimum, ve stravě zajistit dostatek bílkovin, minimalizovat čas strávený na lůžku či sedavým způsobem a využívat v praxi online instruktáží, jak si zacvičit i v domácím prostředí. V opačném případě jen několik málo týdnů bez pohybu vede k velmi výraznému snížení tělesné kondice, projevující se zejména velmi významným poklesem kardiorespirační kapacity.
Klíčová slova:
kardiorespirační kapacita – VO2max – COVID-19 – akutní nedostatek pohybu – detraining – pobyt na lůžku
ÚVOD
V průběhu života nás různé okolnosti občas donutí uchýlit se na několik dnů i delší dobu na lůžko. Většinou to jsou zdravotní důvody, stále častěji však se tato poloha, označovaná jako „bed-rest“, stává součástí životního stylu dospělého člověka. V závěrech kongresu Americké společnosti sportovní medicíny ACSM v roce 2014 se dokonce uvádělo: Svět se přestal hýbat. Koncem této dekády většina Američanů bude týdně vydávat jen o něco málo více energie, než kdyby spali 24 hodin denně. („The world has stopped moving. By the end of this decade, most Americans will exert slightly more energy per week than if they slept 24 hours per day.“) Málokdo si však uvědomuje, že i poměrně krátkodobý pobyt na lůžku velmi výrazně zhoršuje celkovou funkční kapacitu diagnostikovatelnou poměrně jednoduchým zátěžovým testem při spiroergometrii a že naopak trvá poměrně dlouho, než se původní funkční potenciál obnoví. Trénovaní sportovci to dobře znají, výpadek z náročného tréninku z jakýchkoliv příčin vede ke ztrátě sportovní formy v důsledku tzv. „detrainingu“. Zatímco u trénovaných osob se tento detraining projeví „jen“ ztrátou sportovní formy bez nějakých dalších závažnějších zdravotních dopadů, u osob průměrné zdatnosti, jakými jsou rekreační sportovci, nebo u osob se sníženou tělesnou zdatností, jejichž zdravotní stav je zatížen některou z neinfekčních chorob hromadného výskytu (noncommunicable diseases), či jen osob vyššího věku, u nichž pokles tělesné zdatnosti je projevem přirozeného procesu stárnutí, může krátkodobá imobilizace vést k takovému stupni oslabení, že se postižený stane zcela závislým na svém okolí. Takových osob bychom v naší populaci našli statisíce, možná miliony. Nedávná restrikční opatření v souvislosti s celospolečenským úsilím o zvládnutí pandemie a samozřejmě léčba a rekonvalescence po již proběhlé infekci takové riziko výrazně zvyšují.
KLID NA LŮŽKU („BED-REST“)
Klasickou studii o vlivu krátkodobého pobytu na lůžku publikovali Saltin et al. v roce 1968 (48). V této studii pět zdravých 20letých dobrovolníků strávilo bez přerušení 3 týdny vleže na lůžku. Napodobili tak tehdy všeobecně používanou doktrínu přísného třítýdenního klidu na lůžku po přestálém akutním infarktu myokardu. Následně poté skupina podstoupila 8 týdnů poměrně náročného vytrvalostního tréninku v rozsahu 250 minut (tj. 5krát 50 minut) týdně. Kardiorespirační kapacita byla hodnocena podle maximální spotřeby kyslíku (VO2max), stanovené při standardním zátěžovém testu na ergometru se zátěží stupňovanou do maxima. Zátěžový test byl proveden před začátkem experimentu, po 3 týdnech bed-rest a nakonec po 8 týdnech tréninku. Stejnou metodikou byli tito muži vyšetření o 30 let později, kdy rovněž po bed-restu absolvovali osmitýdenní trénink v poněkud mírnější formě než v mladším věku (25, 26). Výchozí úroveň VO2max uvedené skupiny byla 3,3 ± 1,1 l/min. V kontrastu s 27% poklesem VO2max po třítýdenním bed-restu ve studii z roku 1966 (48) se VO2max po dalších 30 letech (2,9 ± 0,9 l/min) snížila pouze o 12 % (obr. 1).
Obr. 1. Tři týdny pobytu na lůžku ve věku 20 let mělo na kardiorespirační kapacitu pěti mužů hlubší dopad než tři dekády stárnutí. Písmeny A, B, C, D a E jsou označeny hodnoty maximální spotřeby kyslíku VO2max jednotlivých probandů (podle McGuire et al.) (35, 36). 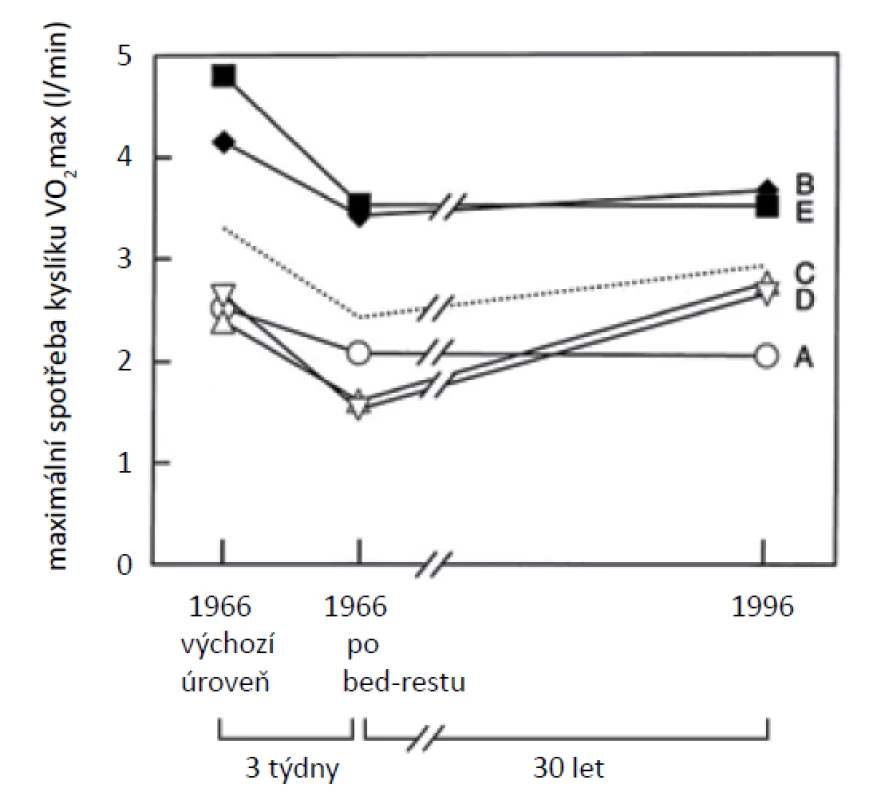
Tréninkem se ve studii z roku 1966 VO2max zvýšila ve srovnání s výchozí hodnotou před bed-restem o 18 % (na 3,9 l/min). V 30letém sledování se VO2max po tréninku zvýšila o 14 % a dosáhla úrovně srovnatelné s výchozí úrovní z roku 1966 (3,3 l/min). Přiměřený vytrvalostní trénink u mužů středního věku tak účinně zvrátil vliv tří dekád stárnutí na kardiovaskulární kapacitu. Dosažená hodnota VO2max po osmitýdenním tréninku však byla u „starší“ skupiny ve srovnání s potréninkovou hodnotou před 30 léty o 15 % nižší (35, 36).
Stejných pět dobrovolníků bylo znovu studováno o dalších 10 let později – v roce 2006 (34). Ve věku 60 let se u nich vyvinuly komorbidity typické pro stárnoucí populaci. U tří z nich byla přítomna hypertenze, dva měli paroxyzmální fibrilaci síní a jeden měl invalidizující bolest zad, omezující jeho pohybové schopnosti. Jako příčina se nakonec ukázal metastazující karcinom ledvin. V rámci tohoto vyšetření bylo provedeno pouze základní funkční vyšetření bez navazujícího tréninkového cyklu. Průměrný VO2max poklesl za tento desetiletý interval o dalších 17 %, celkem za 40 let o 27 %. Rychlost poklesu VO2max se zvýšila z 13 ml/min/rok během prvních 30 let, na 50 ml/min/ rok v průběhu posledních 10 let. Jedním ze závěrů této studie bylo, že průměrná hodnota VO2max byla po třítýdenním bed-restu na lůžku v roce 1966 stejná jako po 40 letech v rámci hodnocení standardního zátěžového testu. Bed-rest sledovaných mužů ve věku 20 let negativně ovlivnil kardiorespirační kapacitu stejně výrazně jako dalších 40 let života, jinými slovy, bed-rest v mladém věku 20 let byl stejně „škodlivý“ jako 40 let stárnutí. Hlavním faktorem ovlivňujícím pokles kardiorespirační kapacity byla vedle sníženého tepového objemu také horší arteriovenózní diference kyslíku. Přiměřený pravidelný trénink může ve vyšším věku zpomalit věkově závislou sarkopenii a tím ovlivnit právě tento faktor využití kyslíku v zatěžovaných svalech (34).
Dočasný funkční pokles u starších osob v důsledku snížené fyzické aktivity je častým vedlejším důsledkem hospitalizace nebo většího chirurgického zákroku (50). Pokles funkční kapacity bývá přítomen až u 50 % starších pacientů ještě před přijetím do nemocnice. Někteří hospitalizovaní pacienti tráví přibližně 80 % pobytu v nemocnici ležením v posteli, ačkoliv k tomu z lékařského hlediska není důvod (7). Tento bed-rest vede k výrazné a rychlé ztrátě síly svalstva dolních končetin a aerobní kapacity (8). Kromě snížené pohybové aktivity hospitalizovaných pacientů a dočasného sedavého chování je dalším fyziologickým faktorem funkčního poklesu pooperační stresová reakce, zahrnující širokou škálu fyziologických změn, které negativně ovlivňují kardiorespirační, svalové a neurologické funkce (11, 37) a přispívají ke zrychlenému úbytku svalové tkáně (30). Tyto důsledky hospitalizace a chirurgického zákroku, vedoucí k dlouhodobému funkčnímu poklesu, lze považovat u starších pacientů za iatrogenní proces, který zvyšuje riziko pooperačních komplikací a úmrtnosti, prodlužuje pobyt v nemocnici a vede k trvalému poklesu či ztrátě mobility, takže nemocný již přestává být samostatně schopen vykonávat činnosti každodenního života (1).
POÚRAZOVÉ ZNEHYBNĚNÍ
U zdravého člověka probíhá nepřetržitá každodenní přestavba svalové tkáně – částečně se odbourává a částečně se stejnou měrou obnovuje. Za běžných okolností jsou tyto procesy v rovnováze. Dojde-li v důsledku úrazu ke znehybnění, svalová tkáň degraduje rychleji a její obnova se zpomaluje. Ve srovnání se svalem jsou strukturální změny šlachy a kosti pomalejší.
Poranění kolenních kloubů je jedním z nejčastějších sportovních úrazů, často vyžaduje imobilizaci kloubů po dobu nejméně 1–2 týdnů po chirurgickém zákroku. Výsledkem imobilizace je pokles svalové hmoty, svalové síly, lokálního metabolismu, pokles citlivosti tkáně na inzulín a také zvýšený podíl tuku ve svalu náhradou za ubývající svalovou hmotu (55). I když je to pro průběh hojení nezbytné, během tohoto imobilizačního období dochází velmi rychle ke svalové atrofii. Rychlost úbytku svalové hmoty je zhruba 0,5 % denně. Na tuto míru však má vliv mnoho faktorů, včetně původní silové výkonnosti, pohlaví, věku a konkrétních zatěžovaných svalových skupin (55).
Funkční změny v souvislosti se znehybněním dokumentuje studie Walla et al. (56). Dvanáct zdravých mladých mužů (věk 24 ± 1 rok) podstoupilo pro úraz 14denní jednostrannou imobilizaci kolenního kloubu s fixací celé dolní končetiny. Měření před imobilizací a po jejím skončení ukázalo, že imobilizace vedla k 8,4% snížení plochy průřezu čtyřhlavého svalu, k 22,9% poklesu svalové síly a k 31% snížení rychlosti syntézy postprandiálních svalových proteinů. I krátké období nedostatečného zatížení svalů zhoršuje syntézu svalových bílkovin z bílkovin, přijatých v potravě. Ke ztrátě svalové hmoty při znehybnění končetiny významně přispívá také anabolická rezistence na požití bílkovin (56).
Podobně popisuje důsledky znehybnění ve své kazuistice Grosset (21). Zdravá mladá žena (29 let) utrpěla zlomeninu pátého metatarzu pravé nohy. MR skenování jejích pravostranných stehenních a lýtkových svalů bylo provedeno 1 měsíc před zraněním (Pre), původně plánováno jako učební pomůcka. Další vyšetření následovalo 2 dny po čtyřtýdenní imobilizaci a po dvouměsíční rekonvalescenci. Došlo ke snížení svalového objemu m. triceps surae (TS) o 21,9 %, m. quadriceps femoris (Quad) o 24,1 % a flexorů kolenního kloubu o 6,5 %. I po dvouměsíční rekondici byl objem Quad o 5,2 % a TS o 9,5 % nižší. Došlo rovněž k významnému poklesu podkožní tukové tkáně, který přetrvával i po 2 měsících (21).
Podobně i Glover et al. (20) upozornili, že již dvoutýdenní imobilizace významně snižuje myofibrilární syntézu proteinů (MPS) a nezabrání tomu ani výrazněji zvýšený přísun aminokyselin. Pokles MPS, vyvolaný imobilizací s následnou „anabolickou rezistencí“ vůči aminokyselinám, má významný podíl na svalové atrofii vyvolané imobilizací.
Jak snížit riziko této anabolické rezistence svalové tkáně a jak se vyhnout vzestupu reaktivních radikálů dusíku a kyslíku, podílejících se na proteolýze kosterního svalu, uvádí Quintero et al. (45). Doporučují zvýšit příjem bílkovin u zraněného sportovce z 1,6 g/kg/den na 2,5 g/kg/den (ve vztahu k tělesné hmotnosti). Tento příjem by měl být zaručen v podobě čtyř až šesti jídel denně, obsahujících 20–35 g rychle stravitelných bílkovin z vysoce kvalitních zdrojů a potravin s vysokým obsahem leucinu, jako jsou mléčné výrobky, maso, vejce, syrovátková bílkovina a sója. Zraněný sportovec musí udržovat vyváženou stravu s dostatečným přísunem antioxidantů a protizánětlivých látek, strava by měla obsahovat dostatek ovoce, zeleniny a potravinových zdrojů omega-3 mastných kyselin. Vhodná jsou i základní probiotika s obsahem kmenů Lactobacillus a Bifidobacterium v denní dávce ≥ 1010 CFU (45).
CHOROBNÝ STAV
Během 20. století se průměrná délka lidského života zdvojnásobila. Celosvětový podíl lidí ve věku 65 let a starších v roce 2019 byl 8 % a bude nadále růst. V roce 2050 dosáhne 16–20 % (44). V Evropě tento vývoj již dávno nastal. V roce 2019 byla více než jedna pětina (20,3 %) obyvatel EU ve věku 65 let a více. V ČR tvořila v roce 2019 poproduktivní složka populace (tj. 65 a více let) 19,9 %. Globálně lze očekávat, že se počet starších osob v příštích několika desetiletích více než zdvojnásobí, z 841 milionů lidí v roce 2013 na více než 2 miliardy v roce 2050. Do roku 2047 se předpokládá, že počet starších osob poprvé překročí počet dětí. Zatímco lidé žijí déle téměř všude, prevalence nepřenosných nemocí a zdravotního postižení se stárnutím populace zvyšuje. Tato lidská transformace vytváří nové výzvy téměř ve všech aspektech života (sociálních, politických a ekonomických) s důsledky pro zdravotní péči, které nikdy dříve neexistovaly (15, 23, 24, 43, 53).
Starší dospělí, pokud jde o jejich zdraví, jsou považováni za zranitelné členy společnosti. Počet hospitalizovaných starších lidí na celém světě neustále roste. Starší dospělí představují hlavní populaci, která potřebuje nemocniční služby (8).
Jak lidé stárnou, je hlavním cílem zdravotní péče prodloužit roky, které lze prožít s vysokou kvalitou života s minimálními zdravotními problémy. K funkčnímu postižení ve vyšším věku přispívá mnoho faktorů (9, 19). Jedním z nejvýznamnějších těchto faktorů je akutní hospitalizace (7, 50). Na nemocné starší 65 let v ČR v roce 2018 připadalo 39 % ze všech hospitalizací (23). Někteří pacienti jsou přijímáni do nemocnice s diagnózou, která přímo nevede k funkčnímu zhoršení, přesto u nich po pobytu v nemocnici dochází k výraznému poklesu funkční kapacity (10, 11, 18, 39). Řada studií ukazuje, že pokles funkčních rezerv je jedním z nejčastějších negativních důsledků hospitalizace s dalekosáhlými důsledky pro pacienta, rodinu a zdravotní péči (11, 30, 47).
Negativní dopady hospitalizace na zdravotní stav starších dospělých byly popsány již v osmdesátých letech 20. století. McVey et a. (37) uvedli, že u přibližně 30 % starších dospělých se během hospitalizace vyvinulo další postižení ve vztahu k činnostem spojeným s každodenním životem (Activities of daily living – ADL). Po hospitalizaci potřebovala pomoc s každodenními aktivitami více než polovina pacientů ve věku 75 let a starších (58). O 10 let později prospektivní studie mezi 1279 pacienty na akutních lékařských odděleních pěti nemocnic ve Spojených státech ukázala, že 32 % zaznamenalo funkční pokles ADL a 41 % zaznamenalo pokles instrumentální ADL (IADL) ve srovnání se schopnostmi 2 týdny před hospitalizací. Pouze polovina z těch, kteří zažili post-hospitalizační funkční pokles, se vrátila k původní úrovni 3 měsíce po propuštění (32). Podle dalších autorů však funkční poruchy v souvislosti s hospitalizací postihují až 60 % starších pacientů (17, 22). I další studie podporují tyto údaje, které ukazují, že pacienti ve věku 65 let a starší během hospitalizace a po ní často trpí funkčním poklesem (10, 31, 49).
Jak předejít těmto negativním změnám v souvislosti s hospitalizací uvádějí podrobně Chaloupka et al. (25, 26). Jejich pokyny se zaměřují na nemocné po infarktu myokardu, jsou však platné pro nemocné s řadou dalších diagnóz. Vedle režimových a terapeutických opatření se zdůrazňuje význam jednotlivých fází individuálně dávkované pohybové rehabilitace, opírající se o výsledky zátěžového testu na ergometru (26).
PREVENCE
O tom, jaké míry dosáhne oslabení postižené osoby v důsledku vynuceného omezení pohybové aktivity, rozhoduje několik faktorů (16). Lze-li předpokládat, že zejména u sportovce (týká se však i nesportující populace) dojde v důsledku plánovaného ošetření s následnou imobilizací během krátké doby ke ztrátě svalové hmoty a síly, má smysl před operací co nejvíce posílit budoucím zákrokem postižené svalové skupiny v rámci tzv. prerehabilitace.
V potravě osob s imobilizací by měly být výrazněji zastoupeny bílkoviny. Jejich zvýšený přívod může pomoci překonat zmíněnou anabolickou rezistenci, provázenou významným poklesem svalové hmoty. U zdravých dospělých a trénovaných jedinců doporučuje Wall (55, 57) denní suplementaci ve výši 1,6–2,5 g/kg rozdělit do čtyř až šesti porcí o 20–35 g bílkovin. Každá z nich by měla obsahovat 2,5–3 g leucinu. U seniorů nad 65 let by to mělo být 35–40 g bílkovin v jednotlivých denních porcích. Vhodné je zařadit takové porce ke snídani a také navečer před spaním.
Za optimální zdroj doplňkových dávek bílkovin je pokládána syrovátková bílkovina v práškové formě. Výhodou této bílkoviny je vysoký obsah aminokyseliny leucinu, který jednak přispívá k tvorbě svalových bílkovin, jednak se metabolizuje na β-hydroxy-β-methylbutyrát, který podporuje tvorbu svalových bílkovin a brání jejich rozpadu. K překonání anabolické rezistence napomáhají omega-3 mastné kyseliny a kreatin (29).
V prevenci svalové atrofie se uplatňuje také neuromuskulární elektrická stimulace jako metoda volby boje proti ztrátám svalové hmoty. Experimentálně u laboratorních zvířat i v klinické praxi se prokázalo, že každodenní stimulace ve vhodném dávkování významně snižuje atrofii stimulovaných svalů (5, 40, 54).
Samo zranění a imobilizace neznamená, že postižený nemůže cvičit vůbec. V prevenci svalové atrofie se uplatňují posilovací cvičení zdravou kontralaterální končetinou, případně asistovaná cvičení ve vodním prostředí s vyloučením gravitace. Lze tak zmírnit nejen předpokládaný pokles svalové síly, ale také ztrátu celkové kondice a kardiorespirační kapacity.
U starších hospitalizovaných osob je třeba s respektem k jejich zdravotnímu stavu podporovat aktivity každodenního života, zařazovat denně přiměřenou pohybovou aktivitu a aktivity spojené s péčí o sebe, aby se předešlo úpadku funkčních schopností (6, 60). Senzorickou stimulaci lze zvýšit vhodným osvětlením a designem prostředí, používáním brýlí a sluchadel a poskytováním vhodných materiálů ke čtení. Sociální aktivity, účast rodiny a pečující empatický lékařský a ošetřovatelský tým pomáhají zmírnit poměrně nevlídné nemocniční prostředí plné špičkových technologií (1).
COVID-19 A POHYBOVÁ AKTIVITA
Dne 11. března 2020 Světová zdravotnická organizace prohlásila koronavirovou chorobu 2019 (COVID-19) za globální pandemii (59). Pandemie COVID-19 ovlivnila různé aspekty životního stylu, včetně pohybové aktivity. Řada studií ukázala, že fyzická aktivita se během pandemie významně snížila (2, 3). V mnoha zemích vlády přijaly omezující opatření, která známe i u nás, např. karanténa, sociální distancování, pozastavení jakýchkoliv společenských akcí, uzavření škol, univerzit, tělocvičen, sportovních center, bazénů, lyžařských areálů a veřejných parků a přerušení většiny sportovních soutěží. Všechna tato omezení snížila přístup veřejnosti k nejrůznějším formám pohybové aktivity.
Omezení vyvolaná pandemií často přímo nutí lidi, aby zůstali doma a vůbec ani nevycházeli mimo svůj byt. S tím přímo souvisí prodloužení doby strávené pasivním sledováním televize, trávením času u počítačových her a jednoznačnou převahou sedavého chování. Vzhledem k trvání pandemie se tento sedavý životní styl může stát trvalým životním návykem, který ohrožuje nejen dospělé, ale zejména děti a dospívající.
V brazilské studii uvedlo 79,4 % dospělých, že úroveň jejich fyzické aktivity se během pandemie COVID-19 snížila (33). U účastníků, kteří pocítili výraznější dopad karantény na své pohybové aktivity, byl také častější výskyt depresivních a úzkostných symptomů.
Barkley et al. (5) sledovali fyzickou aktivitu a sedavé chování na vzorku vysokoškolských studentů a zaměstnanců před zrušením prezenční výuky a po jejím zavedení a uzavření univerzitního areálu. Došlo k významnému nárůstu sedavého chování a k poklesu pohybové aktivity. Tento pokles byl výraznější u těch osob, které byly před zavedením restrikčních opatření nejaktivnější.
Také u dětí Dunton et al. (13) zjistili, že se pohybová aktivita během pandemie COVID-19 snížila, a tento pokles byl mnohem výraznější u starších dětí (věk 9–13) ve srovnání s mladšími ve věku 5–8 let.
Celosvětový průzkum poklesu pohybové aktivity podle počtu kroků zaznamenaných pomocí krokoměrů publikovali Tison et al. (51). Celkem 19 144 639 denních měření počtu kroků poskytlo 455 404 jednotlivých účastníků ze 187 zemí. Celosvětově došlo do 10 dnů od vyhlášení pandemie k poklesu průměrného počtu kroků za den o 5,5 % (tj. o 287 kroků) a do 30 dnů o 27,3 % (tj. o 1432 kroků). Při tom již výchozí hodnota počtu kroků za den (mírně nad 5200 kroků) byla výrazně nižší, než je doporučovaných 10 000 kroků denně (41). V načasování a rychlosti této změny existovaly velké regionální rozdíly. Například Itálie vyhlásila celostátní uzavření dne 9. března 2020 a vykázala maximální pokles o 48,7 %, zatímco Švédsko, kde se dlouho prosazovalo jen sociální distancování a omezení shromažďování, ukázalo maximální pokles jen o 6,9 %. Značně se v různých zemích lišil údaj o počtu dní, za něž po vyhlášení pandemie došlo k poklesu počtu kroků o 15 %: v Itálii to bylo 5 dní, ve Španělsku 9 dní, ve Francii 12 dní, v Indii 14 dní, v USA 15 dní, ve Velké Británii 17 dní, v Austrálii 19 dní a v Japonsku 24 dní.
Ve studii zaměřené na dopad na pohybovou aktivitu děti (52) vyplnili rodiče, příp. pečovatelé elektronický dotazník ve 2 měsících – od června do července 2020, týkající se pohybové aktivity a duševního zdraví jejich dítěte, přístupu k tělovýchovným zařízením a podobné výbavě a dlouhodobých obav souvisejících s restrikčními opatřeními. Respondenti obecně uváděli negativní vlivy těchto opatření, 61 % uvedlo snížení úrovně pohybové aktivity a více než 90 % vyjádřilo obavy z negativního dopadu na duševní zdraví (včetně horšího chování, nálady a sociální regrese).
ZÁVĚRY
I krátkodobý pobyt na lůžku (bed-rest) vede k velmi výraznému poklesu kardiorespirační kapacity a dalších adaptačních schopností. Jak uvádí Saltin a McGuire, 3 týdny bed-restu u stejných mužů ve věku 20 let (1966) měly hlubší dopad na fyzickou pracovní kapacitu než tři desetiletí stárnutí (35, 48). Uvedená studie nejen prokázala výrazně nepříznivé účinky sedavého chování a následně vysokou adaptační schopnost kardiovaskulárního systému, ale měla také okamžitý, dodnes respektovaný klinický dopad, minimalizující čas strávený na lůžku při léčbě akutních a chronických zdravotních poruch (38).
Kardiovaskulární kapacita v dospělém věku s přibývajícími životními decenii klesá, jak dosvědčuje věkový pokles aerobní kapacity (VO2max). Pravidelnou pohybovou aktivitou lze tento proces zpomalit. Nedostatek pohybové aktivity naopak pokles funkční kapacity urychlí. Tzv. zdatnostní věk (fitness age) může být ve srovnání s kalendářním věkem buď nižší (u trénovaných osob), nebo i výrazně vyšší v důsledku sedavého životního stylu (42). K nejrychlejšímu poklesu funkční kapacity dochází při celkovém znehybnění v důsledku pobytu na lůžku.
Současná pandemie COVID-19 ohrožuje v důsledku jednak restrikčních protipandemických opatření, jednak léčebného režimu u mnoha vážně nemocných osob prakticky každého poklesem pohybové aktivity. Je správné, že si rizika s tím spojená stále více uvědomujeme a že i pro nejširší veřejnost jsou k dispozici mediálně dostupné návody domácích cvičení, k nimž není zapotřebí žádných náročnějších cvičebních prostředků (27, 28).
Studie bed-restu a následně tréninku v Dallasu (34, 35, 48), spočívající ve sledování změn kardiorespirační kapacity (VO2max) k hodnocení vlivu extrémní pohybové inaktivity a naopak aktivity a věku na tělesnou zdatnost ukázaly, jak i poměrně krátkodobý pobyt v posteli (bed-rest) je výrazně škodlivý a jak je vytrvalostní trénink naopak výrazně prospěšný napříč věkovým spektrem. Původní studie nejen prokázala nepříznivé důsledky sedavého chování a mimořádnou adaptační schopnost kardiorespiračního systému, ale měla také okamžitý klinický dopad, uplatňovaný dodnes. Pro každého hospitalizovaného pacienta je výhodné minimalizovat čas strávený na lůžku či sedavým způsobem (38). Řada dalších studií zabývajících se vlivem bed-restu na funkční kapacitu sledovaných osob tyto výsledky potvrdila (12, 14, 46).
Střet zájmů: žádný.
adresa pro korespondenci:
MUDr. Jaroslav Novák, Ph.D.
Ústav sportovní medicíny a aktivního zdraví
Lidická 6,
301 00 Plzeň
e-mail: jaroslav.novak@lfp.cuni.cz
Zdroje
1. Admi H, Shadmi E, Baruch H, et al. From research to reality: minimizing the effects of hospitalization on older adults. Rambam Maimonides Med J 2015; 6(2): e0017.
2. Amini H, Isanejad A, Chamani N, et al. Physical activity during COVID-19 pandemic in the Iranian population: A brief report. Heliyon 2020: e05411.
3. Amini H, Habibi S, Islamoglu AH, et al. COVID-19 pandemic-induced physical inactivity: the necessity of updating the Global Action Plan on Physical Activity 2018–2030. Environ Health Prev Med 2021; 26(1): 32.
4. Barber-Westin SD, Noyes FR. Scientific basis of rehabilitation after anterior cruciate ligament autogenous reconstruction. In: Noyes FR, Barber-Westin SD. (eds.). Noyes’ Knee Disorders: Surgery, Rehabilitation, Clinical Outcomes. 2nd edition. Philadelphia: Saunders Elsevier 2017.
5. Barkley JE, Lepp A, Glickman E, et al. The acute effects of the COVID-19 pandemic on physical activity and sedentary behavior in university students and employees. Int J Exerc Sci 2020; 13(5): 1326–1339.
6. Boltz M, Resnick B, Capezuti E, et al. Functional decline in hospitalized older adults: can nursing make a difference? Geriatr Nurs 2012; 33 : 272–279.
7. Boyd CM, Landefeld CS, Counsell SR, et al. Recovery of activities of daily living in older adults after hospitalization for acute medical illness. J Am Geriatr Soc 2008; 56 : 2171–2179.
8. Colón-Emeric CS, Whitson HE, Pavon J, et al. Functional decline in older adults. Am Fam Physician 2013; 88 : 388–394.
9. Conroy SP, Stevens T, Parker SG, et al. A systematic review of comprehensive geriatric assessment to improve outcomes for frail older people being rapidly discharged from acute hospital: ‘interface geriatrics’. Age Ageing 2011; 40 : 436–443.
10. Covinsky KE, Palmer RM, Fortinsky RH, et al. Loss of independence in activities of daily living in older adults hospitalized with medical illnesses: increased vulnerability with age. J Am Geriatr Soc 2003; 51 : 451–458.
11. Covinsky KE, Pierluissi E, Johnston CB. Hospitalization–associated disability: She was probably able to ambulate, but I’m not sure. JAMA 2011; 306 : 1782–1793.
12. Dirks ML, Wall BT, van de Valk B, et al. One week of bed rest leads to substantial muscle atrophy and induces whole–body insulin resistance in the absence of skeletal muscle lipid accumulation. Diabetes 2016; 65(10): 2862–2875.
13. Dunton GF, Do B, Wang SD. Early effects of the COVID-19 pandemic on physical activity and sedentary behavior in children living in the U.S. BMC Public Health 2020; 20(1): 1351.
14. English KL, Paddon-Jones D. Protecting muscle mass and function in older adults during bed rest. Curr Opin Clin Nutr Metab Care 2010; 13(1): 34–39.
15. Eurydice. Česká republika: Obyvatelstvo: Demografická situace, jazyky a náboženství. 2. 3. 2021.
16. Filley A. 5 ways to reduce muscle loss while injured. Email Newsletters [online]. Dostupné z: https://www.sportsinjurybulletin. com/5-ways-to-reduce-muscle-loss-while-injured/ [cit. 2021–04–10].
17. Fortinsky RH, Covinsky KE, Palmer RM, et al. Effects of functional status changes before and during hospitalization on nursing home admission of older adults. J Gerontol A Biol Sci Med Sci 1999; 54: M521–M526.
18. Gill TM, Allore HG, Holford TR, et al. Hospitalization, restricted activity, and the development of disability among older persons. JAMA 2004; 292 : 2115–2124.
19. Gill TM, Gahbauer EA, Han L, et al. Trajectories of disability in the last year of life. N Engl J Med 2010; 362 : 1173–1180.
20. Glover EI, Phillips SM, Oates BR, et al. Immobilization induces anabolic resistance in human myofibrillar protein synthesis with low and high dose amino acid infusion. J Physiol 2008; 586(24): 6049–6061.
21. Grosset J-F, Onambele‐Pearson G. Effect of foot and ankle immobilization on leg and thigh muscles’ volume and morphology: a case study using magnetic resonance imaging. Anat Rec (Hoboken) 2008; 291(12): 1673–1683.
22. Hansen FR, Poulsen H, Sørensen KH. A model of regular geriatric follow-up by home visits to selected patients discharged from a geriatric ward: a randomized controlled trial. Aging (Milano) 1995; 7 : 202–206.
23. He W, Goodkind D, Kowal P. World’s older population grows dramatically. National Institutes of Health, 28. 3. 2016 [online]. Dostupné z: https://www.nih.gov/news-events/ news-releases/worlds-older-population-grows-dramatically [cit. 2021-04-10].
24. ÚZIS. Hospitalizovaní v nemocnicích ČR 2018 [online]. Dostupné z: https://www.uzis.cz/res/f/008313/hospit2018.pdf [cit. 2021-04 - 10].
25. Chaloupka V, Elbl L. Rehabilitace po infarktu myokardu. Kardiol Rev Int Med 2005; 7(1): 5–9.
26. Chaloupka V, J. Siegelová L. Špinarová H, a kol. Doporučení pro rehabilitaci u nemocných s kardiovaskulárním onemocněním. Cor Vasa 2006; 48(7–8): K127–K145.
27. iDnes.cz. Sedíte hodně u počítače nebo v kanceláři? Cvičení pro sedavá zaměstnání zdarma. 22. 3. 2021.
28. ISPV. Jak rozdýchat plíce po COVID-19: Návod k cvičení a rehabilitaci. 4. 3. 2021. [online]. Dostupné z: https://socialnipolitika. eu/2021/03/jak-rozdychat-plice-po-COVID-19-navod-k-cvicenia - rehabilitaci/ [cit. 2021–04–10].
29. Johnston APW, Burke DG, MacNeil LG, et al. Effect of creatine supplementation during cast–induced immobilization on the preservation of muscle mass, strength, and endurance. J Strength Cond Res 2009; 23(1): 116–120.
30. King BD. Functional decline in hospitalized elders. Medsurg Nurs 2006; 15 : 265–272.
31. Lakhan P, Jones M, Wilson A, et al. A prospective cohort study of geriatric syndromes among older medical patients admitted to acute care hospitals. J Am Geriatr Soc 2011; 59 : 2001–2008.
32. Margitić S, Inouye S, Thomas JL, et al. Hospital Outcomes Project for the Elderly (HOPE): rationale and design for a prospective pooled analysis. J Am Geriatr Soc 1993; 41 : 258–267.
33. Martinez EZ, Silva FM, Morigi TZ, et al. Physical activity in periods of social distancing due to COVID-19: a cross-sectional survey. Cien Saude Colet 2020; 25 : 4157–4168.
34. McGavock JM, Hastings JL, Snell PG, et al. A forty-year follow-up of the Dallas Bed Rest and Training Study: the effect of age on the cardiovascular response to exercise in men. J Gerontol A Biol Sci Med Sci 2009; 64 : 293–299.
35. McGuire DK, Levine BD, Williamson JW, et al. A 30-year follow - up of the Dallas Bedrest and Training Study: I. Effect of age on the cardiovascular response to exercise. Circulation 2001; 104 : 1350–1357.
36. McGuire DK, Levine BD, Williamson JW, et al. A 30-year follow - up of the Dallas Bedrest and Training Study: II. Effect of age on cardiovascular adaptation to exercise training. Circulation 2001; 104 : 1358–1366.
37. McVey L, Becker P, Saltz CC, et al. Effect of a geriatric consultation team on functional status of elderly hospitalized patients. A randomized, controlled clinical trial. Ann Intern Med 1989; 110 : 79–84.
38. Mitchell JH, Levine BD, McGuire DK. The Dallas bed rest and training study. Revisited after 50 Years. Circulation 2019; 140(16): 1293–1295.
39. Mudge AM, O’Rourke P, Denaro CP. Timing and risk factors for functional changes associated with medical hospitalization in older patients. J Gerontol A Biol Sci Med Sci 2010; 65 : 866–872.
40. Nitz AJ, Dobner JJ. High intensity electrical stimulation effect on thigh musculature during immobilization for knee sprain. A case report. Phys Ther 1987; 67(2): 219–222.
41. Novák J. Význam chůze jako nejpřirozenější pohybové aktivity v životním stylu člověka. Prakt. Lék. 2018; 98(4): 158–165.
42. Novák J. Kalendářní věk a zdatnostní věk (fitness age). Prakt. Lék. 2019; 99(3): 95–101.
43. Ortman JM, Velkoff VA, Hogan H. An aging nation: the older population in the United States. United States Census Bureau; 2014. Current Population Reports [online]. Dostupné z: https:// www.census.gov/prod/2014pubs/p25-1140.pdf [cit. 2021-04-10].
44. United Nations. Department of Economic and Social Affairs. Percentage of the world population over 65, 1950–2050. UN World Population Prospect 2008.
45. Quintero KJ, Resende A, Leite GSF, Lancha AH Jr. An overview of nutritional strategies for recovery process in sports-related muscle injuries. Nutrire 2018; 43 : 27 [online]. Dostupné z: https:// link.springer.com/content/pdf/10.1186/s41110-018-0084-z.pdf [cit. 2021-04-10].
46. Ried-Larsen M, Aarts HM, Joyner MJ. Effects of strict prolonged bed rest on cardiorespiratory fitness: systematic review and meta-analysis. J Appl Physiol 2017; 123(4): 790–799.
47. Rozzini R, Sabatini T, Cassinadri A, et al. Relationship between functional loss before hospital admission and mortality in elderly persons with medical illness. J Gerontol A Biol Sci Med Sci 2005; 60 : 1180–1183.
48. Saltin B, Blomqvist G, Mitchell JH, et al. Response to exercise after bed rest and after training. Circulation 1968; (5 Suppl) VII: 1–78.
49. Sleiman I, Rozzini R, Barbisoni P, et al. Functional trajectories during hospitalization: a prognostic sign for elderly patients. J Gerontol A Biol Sci Med Sci 2009; 64 : 659–663.
50. Stuck AE, Walthert JM, Nikolaus T, et al. Risk factors for functional status decline in community-living elderly people: a systematic literature review. Soc Sci Med 1999; 48 : 445–469.
51. Tison GH, Avram R, Kuhar P, et al. Worldwide effect of COVID-19 on physical activity: a descriptive study. Ann Intern Med 2020; 173(9): 767–770.
52. Theis N, Campbell N, De Leeuw J, et al. The effects of COVID-19 restrictions on physical activity and mental health of children and young adults with physical and/or intellectual disabilities. Disabil Health J 2021; 1 : 101064.
53. United Nations. Department of Economic and Social Affairs. Population Division: World Population Ageing 2013. New York: United Nations, 2013 [online]. Dostupné z: http://tinyurl.com/ mx5cyyp [cit. 2021-04-10].
54. Valenzuela PL, de Melo Aroeira AE, Torrella JR, et al. The effect of high-frequency neuromuscular electrical stimulation training on skeletal muscle properties in mice. Arc Biol Sci 2017; 69(3): 391–397.
55. Wall BT, Morton JP, van Loon LJC. Strategies to maintain skeletal muscle mass in the injured athlete: nutritional considerations and exercise mimetics. Eur J Sport Sci 2015; 15(1): 53–62.
56. Wall BT, Snijders T, Senden JMG, et al. Disuse impairs the muscle protein synthetic response to protein ingestion in healthy men. J Clin Endocrinol Metab 2013; 98(12): 4872 – 4881.
57. Wall BT, van Loon LJ. Nutritional strategies to attenuate muscle disuse atrophy. Nutr Rev 2013; 71(4): 195–208.
58. Warshaw GA, Moore JT, Friedman SW, et al. Functional disability in the hospitalized elderly. JAMA 1982; 248(7): 847–850.
59. WHO. WHO Director-General’s opening remarks at the media briefing on COVID-19. 11. 3. 2020 [online]. Dostupné z: https:// www.who.int/director-general/speeches/detail/who-directorgeneral - s-opening-remarks-at-the-media-briefing-on-COVID - 19-11-march-2020 [cit. 2021-04-10].
60. Zisberg A, Shadmi E, Sinoff G, et al. Low mobility during hospitalization and functional decline in older adults. J Am Geriatr Soc 2011; 59(2): 266–273.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2021 Číslo 5- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Bezkrevní klinické postupy pro zvládnutí závažné anemie a krvácení
- Důsledek akutního nedostatku pohybu: „detraining“ a celkový pokles funkční kapacity
- Hyaluronát ve světle nových studií
- Názory občanů České republiky na vybrané aspekty činnosti všeobecných praktických lékařů – 2020
- Je veřejnost dostatečně informována o významu očkování proti pertusi v dospělosti?
- Vybrané rizikové faktory cévní mozkové příhody
- Akromegália – poddiagnostikované ochorenie s vážnymi komplikáciami
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vybrané rizikové faktory cévní mozkové příhody
- Bezkrevní klinické postupy pro zvládnutí závažné anemie a krvácení
- Je veřejnost dostatečně informována o významu očkování proti pertusi v dospělosti?
- Akromegália – poddiagnostikované ochorenie s vážnymi komplikáciami
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



