-
Články
- Vzdělávání
- Časopisy
Top články
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinický registr GIST
Autoři: A. Jurečková; I. Kocáková; R. Vyzula
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2012; 25(2): 135-138
Kategorie: Aktuality z registrů
Úvod
Gastrointestinální stromální tumory (GIST) představují vzácné mezenchymální nádory. Incidence činí asi 11–15 případů/milion obyvatel. Jsou charakteristické silnou expresí tyrozinkinázového receptoru c-KIT (CD 117), který je pokládán za jejich nejdůležitější imunohistochemický marker. Přibližně 5–10 % GIST membránový protein c-KIT neexprimuje, často je pak zachycena mutace v genu PDGFRA (platelet-derived growth fractor receptor, alpha-peptide), který také kóduje příbuzný tyrozinkinázový receptor typu III. Uvedené charakteristiky umožňují tyto tumory imunohistochemicky velmi dobře odlišit od jiných nádorů GIT.
Léčba GIST je v prvé řadě založena na primární resekci, která je u nádorů s vysokým rizikem zatížena značnou mírou rekurence s mediánem cca dva roky od operace. Metastatická choroba postihuje zejména játra, omentum, peritoneum, méně často pánevní a nitrobřišní uzliny. Tento typ onemocnění je rezistentní vůči systémové chemoterapii, proto byla prognóza pacientů s inoperabilními a/nebo metastatickými nádory GIST před zavedením biologické léčby do klinické praxe infaustní. První efektivní terapií lokálně pokročilého, inoperabilního nebo metastatického onemocnění je imatinib (Glivec). Jedná se o inhibitor receptorů tyrozinkinázy pro růstový faktor destiček PDGF, faktor kmenových buněk – stem cell factor (SCF) a c-Kit. Imatinib inhibuje signalizaci a proliferaci buněk ovlivňovaných porušenou regulací aktivity PDGFR a Abl kinázy.
Imatinib je indikován k léčbě dospělých pacientů s Kit (CD117) pozitivními inoperabilními a/nebo metastatickými maligními GIST. Je také určen k adjuvantní léčbě dospělých pacientů s významným rizikem recidivy po resekci Kit (CD117) pozitivního GIST nádoru (o úhradě léku v této indikaci ze zdravotního pojištění nebylo k 1. 2. 2012 rozhodnuto).
Sunitinib působí jako inhibitor mnoha receptorových tyrozinkináz, které se podílejí na růstu, patologické angiogenezi a metastatické progresi tumoru (např. PDGFRA, KIT, receptor pro vaskulární endoteliální růstový faktor VEGF). Je indikován k léčbě neresekovatelného a/nebo metastatického maligního GIST po selhání léčby imatinib-mesylátem v důsledku rezistence nebo intolerance.
Počty a charakteristiky pacientů
Klinický registr reGISTer je určen k zadávání údajů o pacientech s gastrointestinálním stromálním tumorem. Funguje od prosince 2006 v rámci České a Slovenské republiky.
Pacienti jsou léčeni v celkem 11 komplexních onkologických centrech – v říjnu 2011 se připojilo i Onkologické centrum FN Olomouc (tab. 1).
Údaje byly získány z klinického registru reGISTer a jsou hodnoceny retrospektivně. V registru je k datu 6. 12. 2011 zadáno 992 nemocných, přitom u 728 z nich jsou záznamy hodnotitelné. Medián věku v době diagnózy činil 61 let (14–90 let). V souboru bylo 52,6 % mužů a 47,4 % žen. Symptomy byly v době diagnózy přítomny u 74,4 % nemocných – dominovaly bolesti břicha (64 %), anémie (36 %) a krvácení (31 %). Lokalizace primárního nádoru je uvedena na obr. 1.
Obr. 1. Lokalizace primárního nádoru. 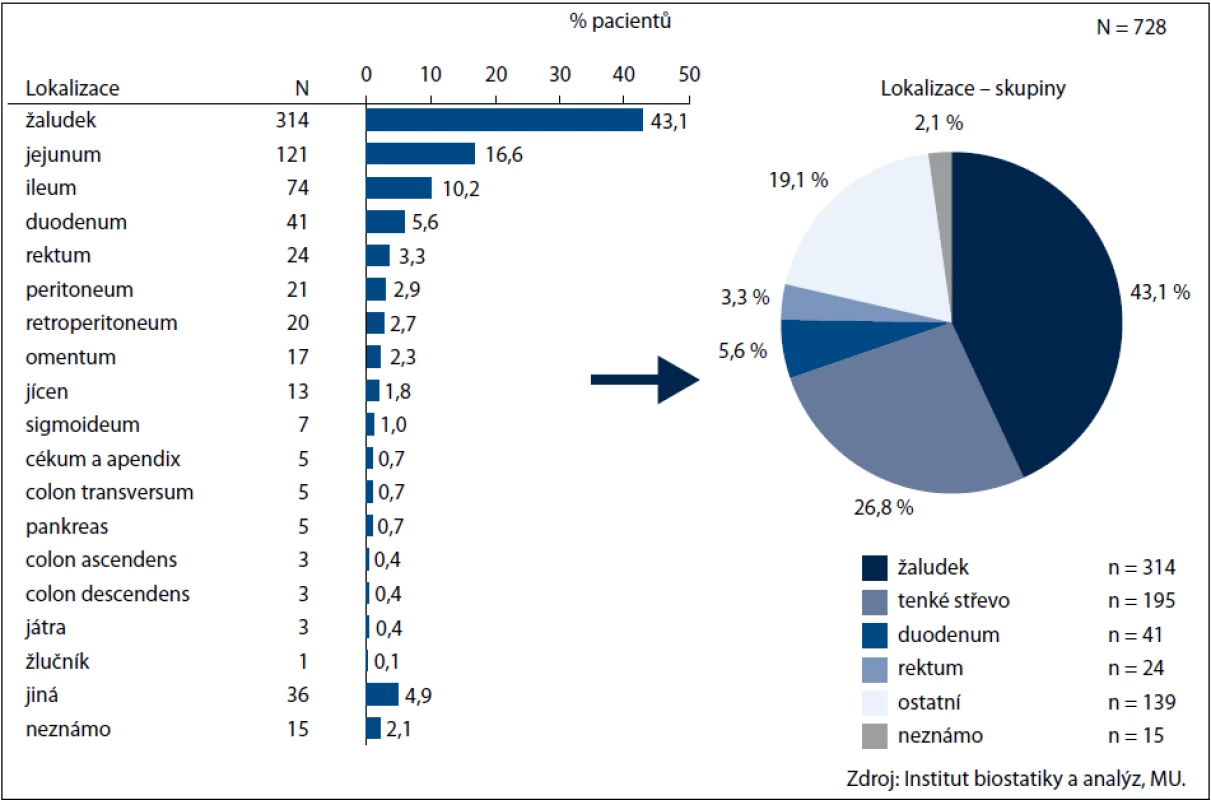
V době diagnózy mělo 508 pacientů (69,8 %) lokalizované resekabilní onemocnění, lokálně pokročilý inoperabilní tumor byl zjištěn u 50 nemocných (7 %) a metastatická choroba u 168 pacientů (23 %). Více než polovina nádorů byla větší než 5 cm. V 68 % případů se jednalo o vřetenobuněčnou morfologii nádoru, ve 20 % o smíšenou a v 9 % o epiteloidní variantu tumoru; ve 3 % nebyl histologický nález uveden. S ohledem na mitotický index bylo 510 pacientů (70 %) zařazeno do skupiny se středním až vysokým rizikem, přitom největší počet nemocných (370/51 %) spadal do vysoce rizikové skupiny. Genetické vyšetření bylo provedeno u 212 ze 728 pacientů (29 %). Nejčastěji se dle očekávání vyskytovala mutace c-KIT v exonu 11 (61 %), dále v exonu 9 (6,6 %) a exonu 13 (1,4 %). Mutace PDGFR alfa byla zachycena v exonu 12 u 5 % případů a v exonu 18 u 4 % případů. Bez zachycené mutace bylo 10 % pacientů.
Léčba
Celkem 690 pacientů (94,8 %) absolvovalo operační výkon a 381 nemocných (52,3 %) se podrobilo systémové léčbě. U 375 pacientů (51,5 %) byl podáván imatinib, iniciální dávka činila 400 mg/den. Po předléčení imatinibem byl u 103 nemocných aplikován sunitinib (14,1 %), u 20 (2,7 %) v další linii nilotinib nebo jiný, blíže nespecifikovaný druh biologické terapie. Ve 4 % případů (29) byli pacienti nejprve léčeni chemoterapií a až následně jim byla poskytnuta biologická léčba. Při zahájení léčby se jednalo o lokalizované onemocnění u 86 nemocných (23 %) a o metastatickou chorobu u 289 pacientů (77 %).
Imatinib
K datu analýzy ukončilo léčbu 231/375 pacientů (61,6 %). Důvodem k ukončení léčby byla v 58,9 % progrese onemocnění (136 nemocných), v 7,4 % (17 pacientů) úmrtí, v 7,4 % nežádoucí účinky (17 pacientů), R0 resekce ve 4,3 % (10 nemocných) a dosažení CR v 1,3 % případů (3 nemocní). Celkem 10 pacientů léčbu odmítlo a předčasně ukončilo (4,3 %). Medián délky terapie imatinibem odpovídá 18 měsícům (0,2–92 měsíců). Tento údaj se však zásadně liší, zohledníme-li rozsah nemoci: v případě lokalizovaného onemocnění byl medián léčby 12 měsíců, zatímco u metastatické choroby 21,2 měsíce.
Sunitinib
Všichni nemocní (n = 103), kteří užívali sunitinib, byli předléčeni imatinibem. Terapie byla v 91,3 % zahájena dávkou 50 mg/den. Dosud ukončilo léčbu 88 pacientů (85,4 %). Důvodem ukončení léčby byla ve většině případů (70 nemocných/80 %) progrese onemocnění, dále se jednalo o úmrtí u 3 pacientů (3,4 %), nežádoucí účinky u 3 nemocných (3,4 %), popřípadě o R0 resekci či odmítnutí léčby. Medián délky léčby činí 5,5 měsíců (0,2–35 měsíců), z toho 39 % pacientů ukončilo terapii v prvních 3 měsících.
Mezi nejběžnější nežádoucí účinky v souvislosti s léčbou imatinibem se uvádí hematologická toxicita, nevolnosti, zvracení, otoky, bolesti kloubů a svalů. V případě sunitinibu je udávána stomatitida, nevolnost, zvracení, průjem, astenie, anorexie, trombocytopenie, hypotyreóza.
Výsledky léčby
Imatinib
Léčebná odpověď (tj.CR+PR+SD) byla zaznamenána u 310/375 pacientů (82,6 %). Kompletní remise dosáhlo 34 pacientů (39,5 %) ve skupině s lokalizovaným onemocněním a 53 nemocných (18,3 %) s metastatickou chorobou. Parciální remise, resp. stabilizace byla zjištěna u 23 (26,7 %), resp. 14 (16,3 %) pacientů s lokalizovaným onemocněním a v případě metastatického onemocnění u 128 (44,3 %), resp. 58 (20 %) nemocných. Medián celkového přežití (OS) byl 65,2 měsíce, doba do progrese (PFS) 32,6 měsíce.
Křivka přežití pacientů léčených imatinibem dle rozsahu onemocnění je uvedena na obr. 2.
Obr. 2. Přežití pacientů léčených imatinibem dle rozsahu onemocnění v době zahájení léčby imatinibem. 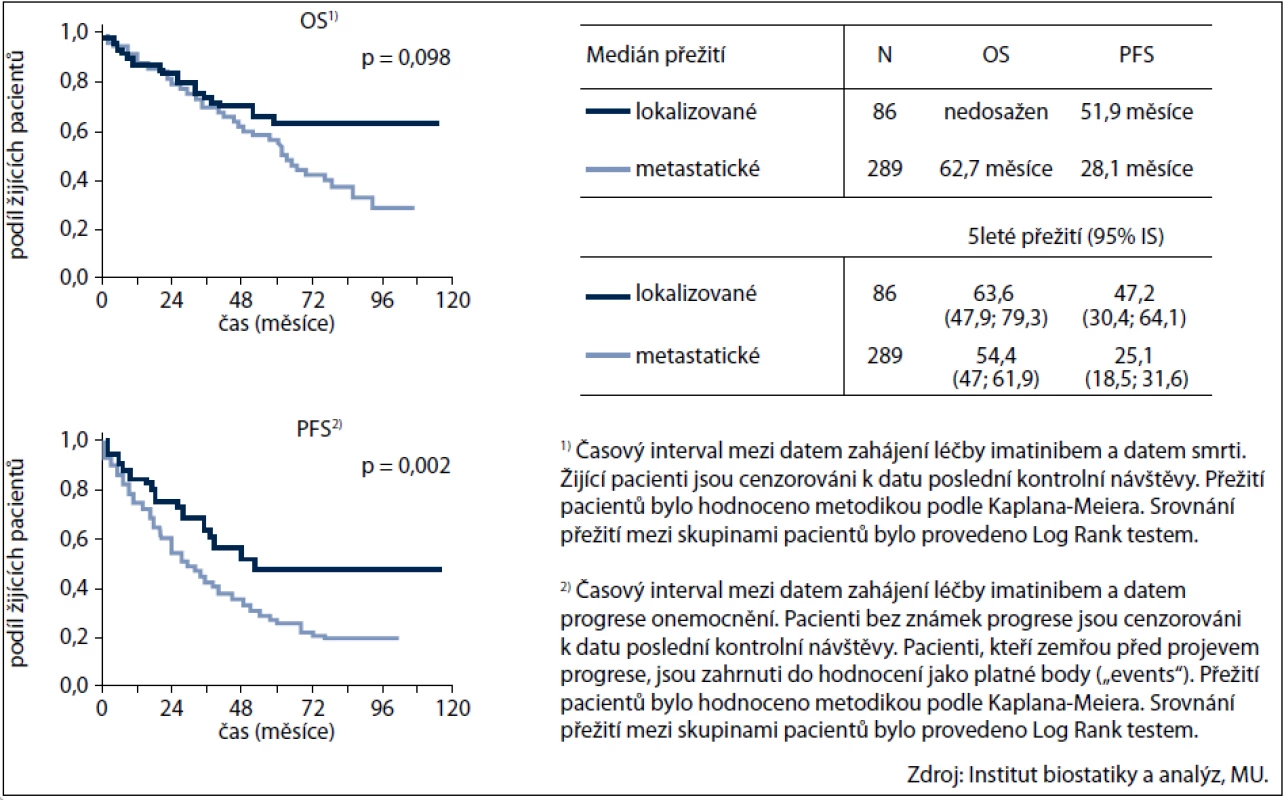
Sunitinib
Prospěch z léčby (tj. CR+PR+SD) mělo celkem 57 nemocných (55 %), z toho kompletní remise dosáhli 3 pacienti (3 %), parciální remise 21 (20 %) a stabilizace onemocnění 33 (32 %) pacientů. Údaje o přežití od zahájení léčby sunitinibem jsou znázorněny na obr. 3.
Obr. 3. Přežití pacientů od zahájení léčby sunitinibem. 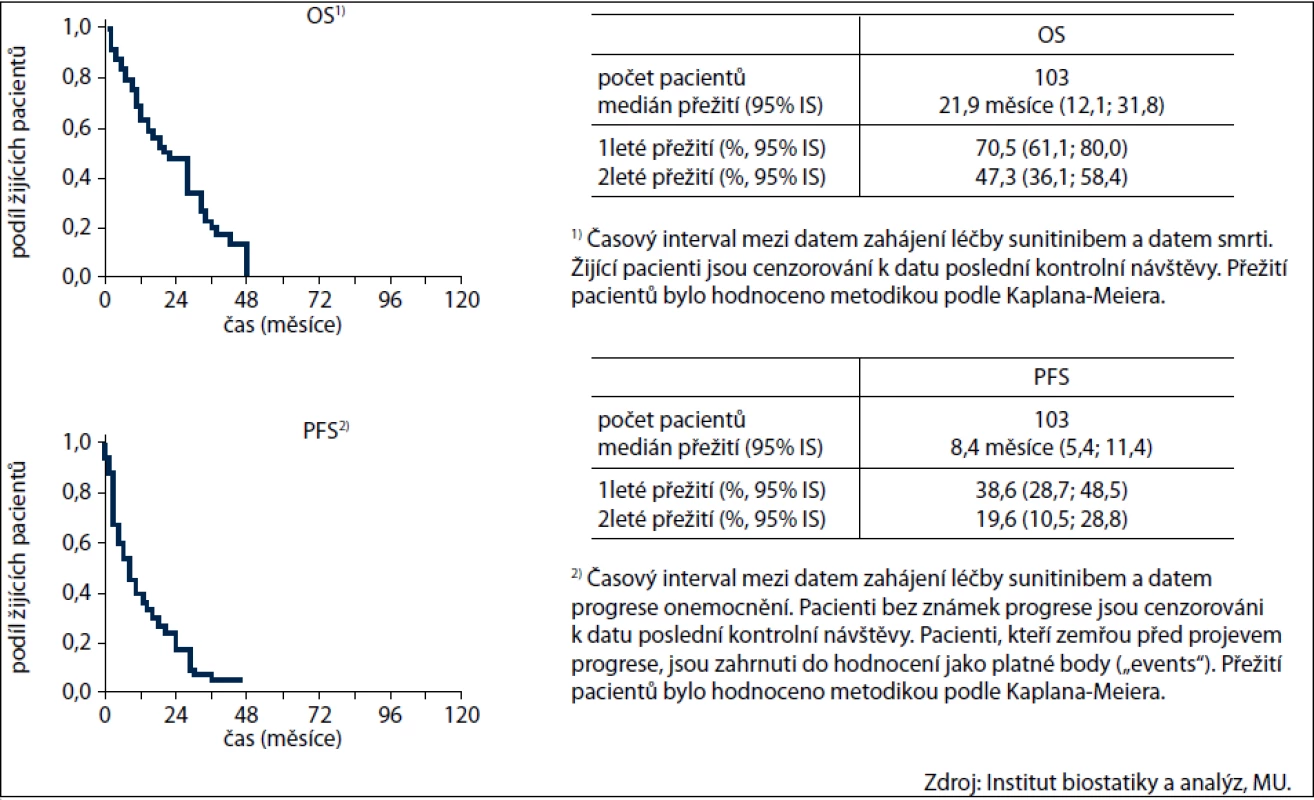
Celkem zemřelo 163 pacientů, z toho 100 nemocných (61,3 %) v důsledku progrese choroby, 2 nemocní zemřeli na nežádoucí účinky léčby GIST a 2 na pooperační komplikace. Ostatní zemřeli z jiných příčin. Medián přežití je 102,6 měsíců.
Diskuze
V České republice jsou pro léčbu inoperabilního nebo metastatického GIST schváleny dvě látky: imatinib (Glivec) a sunitinib (Sutent). Jejich účinnost u tohoto chemo - i radiorezistentního onemocnění byla prokázána v klinických studiích fáze II a III. Příkladem je velká klinická studie CSTI571 (protokol B2222), která prokázala benefit léčby u 84 % pacientů, medián přežití činil 57 měsíců. Další prací byla Severoamerická studie fáze III SWOG S0033/CALGB 150105. Efektivita léčby se lišila dle typu mutace; přítomnost mutace c-KIT v exonu 11 korelovala s lepším efektem léčby oproti mutaci v exonu 9 či nemutované formě genu [1].
V klinických studiích fáze I/II byla potvrzena účinnost sunitinibu oproti placebu u GIST rezistentních na imatinib. V rámci dvojitě zaslepené studie fáze III bylo odpovědi na léčbu v případě sunitinibu oproti placebu dosaženo u 57 % nemocných. Ve větvi se sunitinibem došlo také k výraznému prodloužení doby do progrese (PFS) [2].
Výsledky léčby preparáty imatinibem a sunitibem zjištěné v rámci registru reGISTer jsou plně srovnatelné s výsledky velkých klinických studií, resp. dokonce lepší. Údaje pocházejí z klinických pracovišť v České a Slovenské republice, máme tedy možnost získat aktuální klinická data vycházející přímo z praxe.
Poděkování
Autorka článku děkuje za přípravu podkladů všem lékařům, kteří se podílejí na zadávání dat do registru, a pracovníkům Institutu biostatistiky a analýz MU v Brně za zpracování dat.
MUDr. Andrea Jurečková
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: jureckova@mou.cz
Zdroje
1. Demetri GD, Benjamin R, Blanke CD et al. NCCN Task Force Report : Optimal management of patients with gastrointestinal stromal tumor (GIST). Expansion and Update of NCCN Clinical Practice Guidelines. J Natl Compr Canc Netw 2004; 2: S1–S26.
2. Demetri G, van Oosterom A, Garrett C et al. Improved survival and sustained clinical benefit with SU11248 (SU) in pts with GIST after failure of imatinib mesylate (IM) therapy in a phase III trial. Gastrointestinal Cancers Symposium 2006.
3. Casali PG, Garrett CR, Blackstein ME et al. Updated results from a phase III trial of sunitinib in GIST patients (pts) for whom imatinib (IM) therapy has failed due to resistance or intolerance. J Clin Oncol 2006; 24(18 Suppl): 9513.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2012 Číslo 2- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Vliv pH-pufrovací technologie na snížení výskytu peristomálních komplikací a bolesti
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Prognostický význam morfologického hodnocení u mnohočetného myelomu
- Ionizujúcim žiarením indukované dlhodobé zmeny v hipokampe za experimentálnych podmienok
- Paliativní chirurgická léčba nádorů pankreatu a periampulární oblasti
- Tyreopatie u žien s karcinómom prsníka
- Gastrointestinální stromální tumor duodena projevující se akutním krvácením do horního zažívacího traktu a léčený klínovitou resekcí
- Klinický registr GIST
- MikroRNA vstupují do klinického testování
- Informace z České onkologické společnosti
- Novinky v diagnostice a léčbě primárních nádorů mozku – závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2012
- Editorial
- Agresívna fibromatóza: geneticko-biologické korelácie
- Agresívna fibromatóza: klinické aspekty
- Změny imunologické reaktivity u onkologických pacientů
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Agresívna fibromatóza: geneticko-biologické korelácie
- Agresívna fibromatóza: klinické aspekty
- Paliativní chirurgická léčba nádorů pankreatu a periampulární oblasti
- Tyreopatie u žien s karcinómom prsníka
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




