-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Možnosti a postavení aceklofenaku mezi ostatními nesteroidními antiflogistiky
20. 10. 2025
Spolehlivé mírnění intenzity bolesti je bez ohledu na její etiologii naprosto klíčové pro zachování, případně zlepšení kvality života nemocných. Za tímto účelem je podávána řada látek řazených mezi nesteroidní antiflogistika (NSA) s dobře známým profilem účinnosti i případných nežádoucích účinků. Následující článek pojednává o postavení a úloze aceklofenaku v léčbě bolesti se zaměřením na jeho gastrointestinálně příznivý bezpečnostní profil.
Historické ohlédnutí za vývojem NSA
V celosvětovém měřítku patří látky ze skupiny nesteroidních antiflogistik (NSA) mezi nejčastěji využívaná léčiva. Platí přitom, že vedle protizánětlivého účinku disponují rovněž účinkem analgetickým a antipyretickým, což vede k širokému spektru jejich indikací a možností použití. Mezi nejvýznamnější patří onemocnění muskuloskeletálního aparátu různé etiologie, poúrazové stavy, dysmenorea či bolest/zánět jiné etiologie (bolesti hlavy, zubů apod.). Své uplatnění nacházejí v léčbě akutní i chronické bolesti, a to u nemocných všech věkových skupin.
Do širšího klinického využití se látky ze skupiny NSA ve větší míře dostávají teprve ve 2. polovině 20. století. Ostatně mechanismus účinku popisuje John Robert Vane v roce 1970 – inhibice katabolismu dvacetiuhlíkaté omega-6 polynenasycené kyseliny arachidonové (20 : 4), a tedy zabránění vzniku prozánětlivých eikosanoidů, v čele s prostaglandiny.1 O významu tohoto objevu ostatně svědčí i Nobelova cena, kterou za tento svůj objev roku 1982 Vane obdržel. Přibližně před čtyřmi dekádami byla zjištěna existence dvou izoforem cyklooxygenáz – cyklooxygenáza 1 (COX-1) a cyklooxygenáza 2 (COX-2), což vedlo ke snaze o urychlený vývoj látek se selektivnějším působením právě na COX-2, tj. izoformu důležitou z pohledu patogeneze zánětu na periferní i centrální úrovni.
InzerceZatímco COX-1 byla přisuzována tvorba prostaglandinů nutných pro fyziologické procesy (optimální glomerulární filtrace, agregabilita trombocytů, protekce žaludeční sliznice vůči kyselému pH atd.), COX-2 zodpovídá především za tvorbu prostaglandinů účastných v patogenezi bolesti a zánětu. Na přelomu století se toto paradigma zbořilo tím, že byla zjištěna zvýšená genová exprese pro COX-1 (včetně zvýšení odpovídajícího proteinu) u jiných typů než zánětlivé bolesti, čímž se vysvětluje v zásadě srovnatelná analgetická účinnost neselektivně působících zástupců NSA a specificky působících koxibů. Vedle tohoto hlavního mechanismu účinku bývá diskutováno ovlivnění i řady jiných systémů (kanabinoidního, serotonergního, bradykininergního ad.).
Klasifikace NSA
NSA lze jistě klasifikovat dle jejich základní chemické struktury, v běžné klinické praxi se nicméně již řadu let osvědčuje jednoduché dělení na neselektivní NSA (inhibující stejně intenzivně obě izoformy cyklooxygenázy, tj. COX-1 a COX-2) a selektivně působící NSA (preferenčně či specificky inhibující COX-2).
Nesteroidní antiflogistika lze nicméně dělit i na základě řady dalších aspektů, přičemž opět z pohledu klinického užití je užitečné rozdělení dle délky biologického poločasu na látky s krátkým (< 4 hod), středně dlouhým (4–12 hod) a dlouhým (> 12 hod) poločasem.2
Rizika spojená s užíváním NSA a jejich management
Užívání (zejména dlouhodobé) nesteroidních antiflogistik je provázeno rizikem gastrointestinální toxicity (gastro - i enterotoxicita), neméně významné je též riziko kardiovaskulárních komplikací, hepatotoxicity a nefrotoxicity. Obecně tak platí doporučení užívat co možná nejnižší dávky po co nejkratší možnou dobu. U rizikových nemocných lze často sáhnout po topických lékových formách (gel, krém, emulgel, sprej, pěna, náplast apod.).3, 4
Při nutnosti systémového podání je třeba sáhnout k látkám šetrnějším vůči gastrointestinálnímu traktu, tj. působícím výraznější inhibici COX-2, a/nebo jsou NSA podávána společně s gastroprotektivně působícími látkami, a sice inhibitory protonové pumpy, analogy prostaglandinů či v tomto směru s méně účinnými antagonisty histaminových receptorů H2 (aktuálně jsou dostupné pouze léčivé přípravky s obsahem famotidinu).
Bohužel však ani zmíněná konkomitantní gastroprotekce či preference COX-2 selektivních zástupců není zárukou stoprocentní gastrointestinální bezpečnosti. Totéž platí i pro všechny ostatní systémově působící léčivé přípravky podávané jinou než perorální cestou (např. rektálně). V uvedeném duchu vyznívají veškerá mezinárodní doporučení (OARSI, EULAR, NICE aj.) pro léčbu bolesti u vybraných stavů, včetně osteoartrózy, kde jsou nesteroidní antiflogistika rovněž nezřídka využívána.5–7
Jednotliví zástupci se však vzájemně – mnohdy velmi významně – liší z hlediska spektra svých nežádoucích účinků. Při volbě NSA je proto nezbytné snažit se maximálně zohlednit veškeré komorbidity a komedikace nemocného, stejně tak i veškeré možné rizikové faktory, zejména pak v populaci seniorů.
Inovace mezi NSA a bližší pohled na aceklofenak
Vedle pokroků v možnostech topické léčby se dnes nově setkáváme kupříkladu s eutomery, tj. aktivně působícími optickými izomery racemických sloučenin ibuprofenu (dexibuprofenu) či ketoprofenu (dexketoprofen), modifikací již osvědčených chemických struktur s předpokladem lepšího účinnostně-bezpečnostního profilu (aceklofenak vs. diklofenak), vývojem fixních kombinací NSA + slabého opioidního analgetika (dexketoprofen + tramadol) aj. Výsledkem nastíněných přístupů je dosažení stejné či vyšší účinnosti při často redukované velikosti dávky, a to za současně příznivějšího bezpečnostního profilu.
Jako příklad uvedeného se blíže zaměřme na léčivou látku aceklofenak. Ten je podobně jako diklofenak derivátem kyseliny fenyloctové a svým účinkem se řadí mezi neselektivně působící NSA, tedy blokuje obě známé izoformy cyklooxygenázy (COX-1 i COX-2), a tak i syntézu příslušných eikosanoidů v čele s prostaglandiny. Mimo to však jeho podávání vede ke snížené tvorbě nejrůznějších prozánětlivých cytokinů, mezi nimiž dominují interleukin IL-1 a tumor nekrotizující faktor alfa (TNF-α). Navíc omezuje tvorbu kyslíkových radikálů a ovlivňuje adhezi migrujících neutrofilů. Ve studiích in vitro společně se svým hlavním metabolitem, 4-hydroxy-aceklofenakem (vznik prostřednictvím izoenzymu CYP2C9 cytochromu P450), vykazuje příznivé působení na anabolismus tkáně chrupavky v kombinaci s ovlivněním odbourávání její matrix.8
Ve studiích in vitro byla dále potlačena syntéza IL-6, žádný vliv však nebyl zaznamenán ve smyslu ovlivnění tvorby IL-8 či oxidu dusnatého (NO). Zajímavé je porovnání inhibičních koncentrací (IC50) pro obě cyklooxygenázy se strukturně blízkým diklofenakem. Zatímco aceklofenak a 4-hydroxy-aceklofenak inhiboval aktivitu COX-1 při hodnotách IC50 nad 100 µM, pro aktivitu COX-2 byly odpovídající hodnoty 0,77 µM. Naproti tomu diklofenak výrazně inhiboval obě izoformy s hodnotami IC50 0,6 µM (COX-1) a 0,04 µM (COX-2).9
Stran farmakokinetiky se aceklofenak vyznačuje biologickou dostupností v rozmezí 70–100 % po perorálním podání. Maximální plazmatické koncentrace (Cmax) je dosahováno s odstupem 75 minut až 2 hodin od užití. V lidském těle je poměrně významně metabolizován (minoritně též na diklofenak), přičemž hlavním metabolitem je 4-hydroxy-aceklofenak. Tento metabolit pak mimo jiné významně potlačuje aktivitu metaloproteináz a podporuje syntézu glykosaminoglykanů (GAG; např. ibuprofen či naproxen inhibují tvorbu mezibuněčné matrix).8, 9 Délka biologického poločasu eliminace odpovídá 4 hodinám.
Vedle kladného působení aceklofenaku na mezibuněčnou matrix je klinicky velmi významný jeho vliv na gastrointestinální trakt vycházející především z jeho preferenčního vlivu na COX-2. To jej dlouhodobě řadí mezi látky s nejnižším rizikem gastrointestinálního postižení, respektive rizikem krvácení do GIT.10, 11
Dobrý bezpečnostní profil společně s příznivými farmakologickými vlastnostmi definuje aceklofenak na pozadí dostatečně prokázané terapeutické účinnosti v mnoha klinických studiích zahrnujících nemocné s revmatoidní artritidou, osteoartrózou či ankylozující spondylitidou jako velice přínosnou léčivou látku.12, 13 V uvedených indikacích jej lze užívat v maximální doporučené dávce 2× 100 mg denně. Vhodný je i pro starší nemocné. Kontraindikovaný je obdobně jako jiná NSA u závažných kardiálních, renálních či jaterních onemocnění.
Z pohledu účinnosti ve schválené indikaci je poukazováno na jeho přinejmenším srovnatelnou účinnost s ostatními zástupci NSA. Jde například o porovnání s diklofenakem v multicentrické dvojitě zaslepené RCT, ve které byli nemocní s gonartrózou léčeni aceklofenakem (n = 200) v dávce 100 mg 2× denně nebo právě diklofenakem (n = 197) v dávce 50 mg 3× denně. S odstupem 12 týdnů byl v obou ramenech studie zřejmý pokles intenzity bolesti (p = 0,0001). Více nemocných (71 vs. 59 %) ve skupině s aceklofenakem uvádělo výrazné zmírnění bolesti (p = 0,005). V žádné ze sledovaných ukazatelů nebyl mezi oběma látkami zaznamenán jakkoliv významný rozdíl, byť při léčbě aceklofenakem autoři poukazují na trend lepší pohyblivosti kolene. Podávání aceklofenaku bylo lépe snášeno, a to především ve výskytu zažívacích potíží.15 K obdobným závěrům dospěli též autoři srovnávací dvojitě zaslepené studie s 247 nemocnými a 8týdenním sledováním.16 Analogicky vyznívá i 3měsíční srovnání s derivátem kyseliny propionové, ketoprofenem, u celkem 169 nemocných.17
Z klinického hlediska velmi zajímavě vyznívá srovnání s naproxenem či piroxikamem, a to ve studiích primárně hodnotících jejich bezpečnostní profil. Srovnání s naproxenem 500 mg 2× denně (n = 184) probíhalo v multicentrické 12týdenní dvojitě zaslepené RCT oproti aceklofenaku 100 mg 2× denně (n = 190) u nemocných s gonartrózou. Účinnost byla u obou látek srovnatelná nejen ve smyslu signifikantního snížení klidové bolesti, ale i bolesti při pohybu a bolesti při tlaku na postižený kloub. Patrné bylo též zmírnění otoku a ztuhlosti kloubu, a to srovnatelně u obou látek. Aceklofenak měl poněkud nižší výskyt nežádoucích účinků (12,6 vs. 16,3 %).18
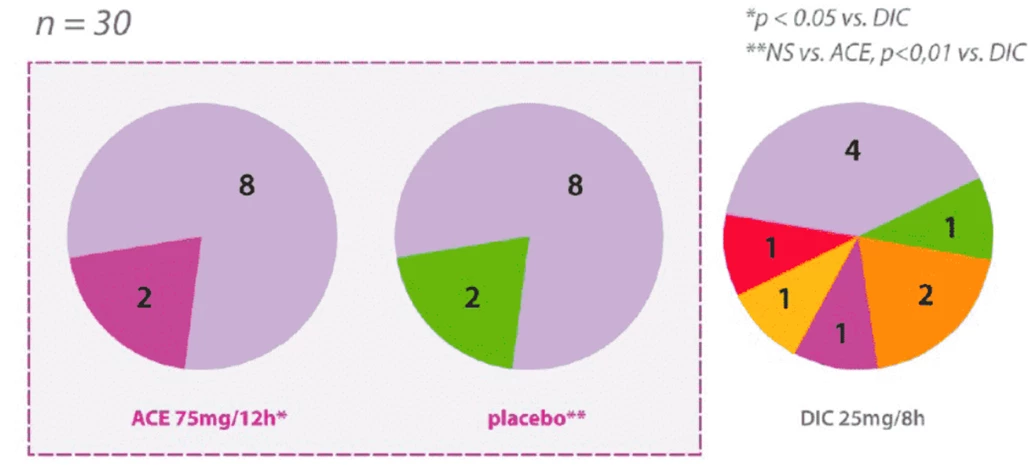
V případě piroxikamu jde rovněž o dvojitě zaslepenou randomizovanou studii u nemocných s gonartrózou, kde byl podáván buď aceklofenak v dávce 100 mg 2× denně (n = 123), nebo piroxikam 20 mg 1× denně + placebo 1× denně (n = 117). S odstupem 2 měsíců bylo zlepšení zjištěno srovnatelnou měrou v obou ramenech, a to ve všech sledovaných parametrech. Při užívání aceklofenaku bylo zaznamenáno výrazně méně zažívacích potíží (24 vs. 33) a méně případů přerušení léčby z důvodu závažného krvácení do zažívacího traktu (1 vs. 7); při užívání aceklofenaku bylo zjištěno 2× méně případů krvácení do stolice oproti piroxikamu.19
Příznivý bezpečnostní profil, především z pohledu gastrointestinální snášenlivosti, dále dokumentuje metaanalýza observačních studií vycházející z celkem 28 prací. Pravděpodobnost zažívacích potíží byla nejnižší při užívání aceklofenaku (relativní riziko [RR] 1,43; 95% interval spolehlivosti [CI] 0,65‒3,15), což bylo dokonce nepatrně méně než u celekoxibu (RR 1,45; 95% CI 1,17‒1,81) (viz obr. 1).11
Obr. 1 Porovnání rizika gastrointestinálních komplikací při užívání různých NSA11
Obr. 2 Porovnání rizika výskytu gastropatií mezi aceklofenakem a diklofenakem na základě endoskopického vyšetření12

Závěr
Aceklofenak je v Česku dostupný ve formě potahovaných tablet a též prášku pro perorální suspenzi k léčbě zánětu a bolesti u nemocných s revmatickým onemocněním postihujícím muskuloskeletální systém, a sice u revmatoidní artritidy, osteoartrózy či ankylozující spondylitidy. Vedle dostatečně prokázané účinnosti v dávkách 100 mg 2× denně, přinejmenším srovnatelné s ostatními zástupci nesteroidních antiflogistik, se vyznačuje především nižším výskytem nežádoucích účinků, zejména v kontextu NÚ postihujících trávicí trakt.
doc. MUDr. Jiří Slíva, Ph.D., MBA
Ústav farmakologie 3. LF UK, PrahaZdroje:
1. Vane JR. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. Nat New Biol 1971; 231 (25): 232–235.
2. Rao P, Knaus EE. Evolution of nonsteroidal anti-inflammatory drugs (NSAIDs): cyclooxygenase (COX) inhibition and beyond. J Pharm Pharm Sci 2008; 11 (2): 81s–110s.
3. Derry S, Moore RA, Gaskell H et al. Topical NSAIDs for acute musculoskeletal pain in adults. Cochrane Database Syst Rev 2015; 6: CD007402.
4. Derry S, Wiffen PJ, Kalso EA et al. Topical analgesics for acute and chronic pain in adults – an overview of Cochrane Reviews. Cochrane Database Syst Rev 2017; 5 (5): CD008609.
5. Bannuru RR, Osani MC, Vaysbrot EE et al. OARSI guidelines for the non-surgical management of knee, hip, and polyarticular osteoarthritis. Osteoarthritis Cartilage 2019; 27 (11): 1578–1589.
6. Kloppenburg M, Kroon FP, Blanco FJ et al. 2018 update of the EULAR recommendations for the management of hand osteoarthritis. Ann Rheum Dis 2019; 78 (1): 16–24.
7. Management of osteoarthritis. NICE, 2020. Dostupné na: https://pathways.nice.org.uk/pathways/osteoarthritis
8. Reginster JY, Paul I, Henrotin Y. [What is the role of aceclofenac in the therapeutic arsenal against chronic osteoarthritis pathologies?] Rev Med Liege 2001; 56 : 484–488.
9. Henrotin Y, de Leval X, Mathy-Hartet M et al. In vitro effects of aceclofenac and its metabolites on the production by chondrocytes of inflammatory mediators. Inflamm Res 2001; 50 : 391–399.
10. Lanas A, García-Rodríguez LA, Arroyo MT et al. Risk of upper gastrointestinal ulcer bleeding associated with selective cyclo-oxygenase-2 inhibitors, traditional non-aspirin non-steroidal anti-inflammatory drugs, aspirin and combinations. Gut 2006; 55 (12): 1731–1738.
11. Castellsague J, Riera-Guardia N, Calingaert B et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project). Drug Saf 2012; 35 (12): 1127–1146.
12. Yanagawa A, Endo T, Kusakari K et al. Endoscopic evaluation of aceclofenac-induced gastroduodenal mucosal damage: a double-blind comparison with sodium diclofenac and placebo. Jap J Rheumatol 1998; 8 (3): 249–259.
13. Ward DE, Veys EM, Bowdler JM, Roma J. Comparison of aceclofenac with diclofenac in the treatment of osteoarthritis. Clin Rheumatol 1995; 14 (6): 656–662.
14. Iolascon G, Giménez S, Mogyorósi D. A review of aceclofenac: analgesic and anti-inflammatory effects on musculoskeletal disorders. J Pain Res 2021; 14 : 3651–3663.
15. Ward DE, Veys EM, Bowdler JM, Roma J. Comparison of aceclofenac with diclofenac in the treatment of osteoarthritis. Clin Rheumatol 1995; 14 : 656–662.
16. Pareek A, Chandanwale AS, Oak J et al. Efficacy and safety of aceclofenac in the treatment of osteoarthritis: a randomized double-blind comparative clinical trial versus diclofenac – an Indian experience. Curr Med Res Opin 2006; 22 : 977–988.
17. Martin-Mola E, Gijon-Banos J, Ansoleaga JJ. Aceclofenac in comparison to ketoprofen in the treatment of rheumatoid arthritis. Rheumatol Int 1995; 15 : 111–116.
18. Kornasoff D, Frerick H, Bowdler J, Montull E. Aceclofenac is a well-tolerated alternative to naproxen in the treatment of osteoarthritis. Clin Rheumatol 1997; 16 : 32–38.
19. Perez BM, Calero E, Rodriguez M et al. Comparison of aceclofenac with piroxicam in the treatment of osteoarthritis. Clin Rheumatol 1997; 16 : 154–159.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Revmatologie Osteologie
Nejčtenější tento týden- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Původní český test ALBA pro odhalení mírných kognitivních deficitů získal certifikaci MZ ČR
- Koordinátoři onkologické péče zkrátí pacientům cestu systémem. Jak to bude fungovat v praxi?
- AUDIO: (Jak) je možné prodloužit si život?
- INFOGRAFIKA: Světový den boje proti rakovině... aneb jaké výzvy stojí před českou onkologií?
Mohlo by vás zajímat- Léčba protilátkami proti TNF a riziko infekcí a nádorových onemocnění
- Etanercept v terapii psoriázy nehtů
- Pacienti s revmatoidní artritidou podléhají častěji revmatoidní kachexii
- Genová terapie revmatoidní artritidy
- Léčba psoriázy – terapie etanerceptem a úzkospektrým UVB světlem
- Kortikoidy v terapii revmatoidní artritidy
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




