-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaJe přesná předoperační diagnostika cystických lézí pankreatu možná?
Is accurate preoperative assessment of pancreatic cystic lesions possible?
Introduction:
Cystic lesions of the pancreas (CLP) are of different origin and behaviour. Mucinous lesions with the risk of invasive cancer represent an important subgroup. The key point in differential diagnosis of CLP is to distinguish malignant and benign lesions and also correct indication for surgery in order to minimize the impact of serious complications after resection. Different and unsatisfying predictive values of each of the examinations make proper diagnosis challenging. We focused on overall diagnostic accuracy of preoperative imaging and analytic studies. We studied the accuracy of distinguishing between non-neoplastic vs. neoplastic and bening vs. malignant lesions.Material and methods:
We retrospectively analyzed all of the patients (N=72) with CLP (median of age 58 years, range 22–79) recommended for surgery. CT, EUS, ERCP, MRCP findings, cytology and aspirate analysis were used to establish preoperative diagnosis. Finally, preoperative diagnoses were compared with postoperative pathological findings to establish overall accuracy of preoperative assessment.Results:
During 5 years, 72 patients underwent resection for CLP. We performed 66 (92%) resection and 6 (8%) palliative procedures with 32% morbidity and 7% of one hospital stay mortality. All the patients were examined by CT and EUS. FNA was performed in 44 (61%) patients. Cytology was evaluable in 39 (88%) cases. ERCP was done in 40 (55%) patients. Pathology revealed non-neoplastic CLP in 25 (35%) and neoplastic lesions in 47 (65%) specimens. Mucinous lesions accounted for 25%. Malignant or potentially malignant CLP were found in 37 (51%) patients. Sensitivity, specificity and diagnostic accuracy of preoperative diagnosis for distinguishing between inflammatory and neoplastic, and benign and malignant was 100%, 46%, 85% and 61%, 61%, 44%, respectively.Conclusion:
Correct and accurate preoperative assessment of CLP remains challenging. Despite the wide range of diagnostic modalities, the definitive preoperative identification of malignant or high-risk CLP is inaccurate. Because of this, a significant portion of the patients undergo pancreatic resection for benign or inflammatory lesions that are not potentially life-threatening. Possible serious complications after pancreatic surgery are the main reason for precise selection of patients with cystic affections recommended for surgery.Key words:
cystic lesion – tumour – pancreas
Autoři: P. Záruba 1
; T. Dvořáková 2; F. Závada 3; F. Bělina 1; M. Ryska 1
Působiště autorů: Chirurgická klinika 2. LF UK a ÚVN, Praha, přednosta: prof. MUDr. M. Ryska, CSc. 1; Oddělení gastroenterologie, hepatologie a metabolismu, Interní klinika 1. LF UK a ÚVN, Praha přednosta: Prof. MUDr. M. Zavoral Ph. D. 2; Interní oddělení, Oblastní nemocnice Příbram, a. s., primář: MUDr., Ing. F. Závada PhD. 3
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 12, s. 708-714.
Kategorie: Původní práce
Souhrn
Úvod:
Cystické léze pankreatu (CLP) mají různou etiologii a biologické vlastnosti. Důležitou podskupinou jsou mucinózní cystické léze s maligním potenciálem. Správná diferenciální diagnostika a indikace k chirurgickému výkonu jsou hlavním úskalím léčby. Naše práce hodnotí celkovou diagnostickou přesnost předoperačních vyšetření v porovnání s definitivním nálezem v resekátu. Zaměřili jsme se na přesnost rozlišení zánětlivé léze od neoplastické a léze benigní od maligní.Materiál a metodika:
Retrospektivně jsme analyzovali soubor pacientů (N=72) s CLP (medián stáří 58 let, 22–79) indikovaných k resekci. Ke stanovení předoperační diagnózy byly použity nálezy CT, EUS, ERCP, MRCP a cytologické a biochemické vyšetření aspirátu. Porovnáním předoperační diagnózy a histologického nálezu v resekátu jsme hodnotili diagnostickou přesnost předoperačního vyšetření vyjádřenou pomocí hodnot deskriptivní statistiky.Výsledky:
V průběhu 5 let podstoupilo 72 pacientů resekční výkon pro CLP. Bylo provedeno 66 (92 %) resekčních výkonů a 6 (8 %) paliativních nebo explorativních výkonů s celkovou morbiditou a mortalitou 32 %, resp. 7 %. Všichni pacienti podstoupili CT a EUS vyšetření. FNA doplnila EUS vyšetření ve 44 (61 %) případech. Cytologicky byl aspirát hodnotitelný u 39 (88 %) pacientů. ERCP podstoupilo 40 (55 %) pacientů. Bylo nalezeno 25 (35 %) zánětlivých a 47 (65 %) neoplastických lézí. Mucinózní léze tvořily 25 %, maligní nebo potenciálně maligní léze 51 %. Senzitivita, specificita a diagnostická přesnost předoperační diagnózy v rozlišení mezi zánětlivou vs. neoplastickou a benigní vs. maligní CLP byla 100 %, 46 %, 85 %, resp. 61 %, 61 %, 44 %.Závěr:
Správné předoperační určení cystických lézí pankreatu je obtížné. Přes širokou škálu dostupných vyšetření je odlišení maligních a potenciálně maligních lézí nepřesné. Část pacientů je tak indikována k resekci pro cystickou lézi benigní nebo zánětlivou. Přetrvávající vysoká pooperační morbidita a mortalita u resekcí pankreatu jsou hlavním argumentem pro co nejpřesnější předoperační diagnózu a indikaci k chirurgickému výkonu.Kíčová slova:
cystické tumory – léze – pankreasÚvod
Cystické léze pankreatu (CLP) patří spolu se solidními tumory, chronickou a akutní pankreatitidou mezi nejčastější patologie slinivky břišní. Je pro ně charakteristická absence specifických symptomů nebo absence symptomů vůbec. Často se jedná o incidentální nálezy.
Pod CLP řadíme širokou skupinu patologicko-anatomických jednotek s různými biologickými vlastnostmi. Ty sahají od benigních přes hraniční („border line“) až po léze s maligním chováním. Termín cystický tumor užíváme pro specifickou skupinu cystických lézí slinivky, kam patří serózní cystadenom (SCA), mucinózní cystadenom (MCN) / karcinom, intraduktální mucinózní neoplázie (IPMN) / karcinom a solidní pseudopapilární neoplázie (SPN). Odhad biologických vlastností CLP a indikační rozvaha jsou i přes škálu předoperačně užívaných vyšetření obtížné.
Práce hodnotí celkovou shodu předoperačního závěru s definitivním nálezem v resekátu. Zaměřili jsme se na přesnost rozlišení zánětlivé léze od neoplastické a léze benigní od maligní.
Materiál a metodika
Retrospektivně jsme analyzovali soubor 72 pacientů indikovaných k resekci slinivky břišní na základě nálezu cystické léze pankreatu a rozvahy multioborové indikační skupiny. Sledovali jsme základní charakteristiky souboru a četnost využití jednotlivých vyšetřovacích modalit (CT, EUS, FNA, ERCP). Porovnáním předoperační klasifikace CLP získané na základě syntézy všech provedených vyšetření a definitivního histopatologického nálezu jsme pomocí deskriptivní statistiky hodnotili senzitivitu, specificitu, pozitivní prediktivní hodnotu (PPV), negativní prediktivní hodnotu (NPV), celkovou a předoperační diagnostickou přesnost. Nehodnotili jsme celkovou úspěšnost přesné předoperační klasifikace CL, ale pouze rozlišení mezi zánětlivým a neoplastickým původem včetně posouzení maligního potenciálu léze.
Výsledky
V období let 2008–2012 bylo na Chirurgické klinice 2. LF UK a ÚVN Praha operováno 72 pacientů s nálezem CLP. V souboru bylo 30 mužů, 42 žen, celkový průměrný věk byl 55 let (22–79), medián 58 let. Ve skupině mužů byl průměrný věk 55 let, u žen 54 let.
Graf 1 zachycuje četnost jednotlivých symptomů. U části pacientů se objevilo několik příznaků současně. V položce „ostatní“ se jako hlavní příznak objevilo krvácení do trávicí trubice, váhový úbytek nebo hmatná rezistence s mechanickým syndromem. U části pacientů se příznaky nebo důvod úvodního vyšetření nepodařilo zjistit. Ti byli zařazeni do skupiny „ostatní“. Nejčastějšími obtížemi byla dyspepsie. U druhé největší části nemocných byl nález CLP náhodný.
Graf 1. Četnost symptomů v souboru (N=72) Graph 1: Frequency of symptoms in the group (N=72) 
U 31 (45 %) pacientů byla CLP lokalizována dle popisu EUS v hlavě pankreatu, u 15 (20 %) v těle, u 14 (19 %) v kaudě, u 2 (2 %) v krčku a u 10 (14 %) v uncinátním výběžku. Průměrná velikost CL byla 38,6 mm (10–140 mm), medián 35 mm. Větších než 20 mm (makrocystická léze) bylo 62 nálezů (86 %). Všichni pacienti podstoupili CT vyšetření a EUS. FNA byla provedena u 44 (61 %) pacientů. U 39 (88 %) aspirátů odeslaných k cytologickému vyšetření byl učiněn morfologický závěr. Vzorek tak obsahoval dostatečné množství buněčného materiálu k hodnocení. Zbývajících 12 % bylo hodnoceno jako nejisté nebo nehodnotitelné pro nedostatečný počet buněk ve vzorku. V 19 případech (49 % z hodnotitelných odběrů) souhlasila biologická povaha CLP stanovená cytologickým vyšetřením s definitivním histopatologickým vyšetřením léze. Jen u 10 (23 %) vzorků odebraných při FNA byla hodnocena aktivita amyláz. Ve 4 případech jsme nalezli zvýšenou hodnotu nad 100 μkat/l. Tato patologická hodnota ale neovlivnila stanovení předoperační diagnózy. V 18 (41 %) vzorcích byla stanovena koncentrace CEA. Jen u 5 byla hodnota větší než 192 μg/ml, pouze v jednom případě souhlasila s přítomností mucinózní léze. V ostatních případech šlo o benigní a zánětlivé afekce. Použijeme-li pro hodnocení běžnou, sérovou cut off koncentraci 5 μg/ml, pak byla patologická hodnota nalezena u 12 (67 %) punktátů. U 4 tato hodnota odpovídala mucinózní lézi. Přítomnost mucinu v cytologickém nátěru byla vyšetřena u 24 (54 %) vzorků. 13krát byl nález pozitivní a 10 pozitivních vyšetření na přítomnost mucinu odpovídalo nálezu mucinózní CL v definitivním histopatologickém vyšetření.
ERCP bylo provedeno 40krát. 25 (62 %) pankreatikogramů vykazovalo patologický nález: stenózu, deviaci pankreatického vývodu, stop v náplni, komunikaci s cystickým ložiskem. U 17 pacientů byla provedena endoskopická intervence se zavedením duodenobiliárního stentu.
Všichni pacienti ze souboru byli indikováni k chirurgickému výkonu pro přítomnost CLP s podezřením na neoplastický charakter nebo závažnou symptomatologii (ikterus, mechanický syndrom).
Četnost jednotlivých operačních výkonů zachycuje Graf 2. Celková pooperační morbidita v souboru byla 32 %. Ve 12 % byla příčinou insuficience pankreatiko-jejunoanastomózy. Celková mortalita spojená s chirurgickým výkonem byla 7 %.
Graf 2. Četnost typů resekčních výkonů na pankreatu v souboru (N=72) Graph 2: Frequency of types of pancreatic resection procedures in the group (N=72) 
Tab. 1 ukazuje četnost jednotlivých histopatologických nálezů v resekátu. Ve 35 % se jednalo o non-neoplastickou lézi a v našem souboru mimo dvou nálezů lymfoepiteliální cysty vždy šlo o zánětlivou CL v rámci regresivních a přestavbových změn u chronické pankreatitidy (CHP). 65 % lézí bylo neoplastického typu vzniklých proliferací žlázového nebo duktálního epitelu. 25 % z této skupiny tvořily maligní nálezy duktálního adenokarcinomu (DAC) a malignizovaných vlastních cystických tumorů. 65 % tvořily cystické tumory zastoupené v polovině případů mucinózními cystickými tumory s potenciálem malignizace. U zbývajících 10 % ukázal nález v resekátu neuroendokrinní tumor (NET). Grafy 3 a 4 dokreslují procentuální rozložení podskupin CLP v souboru.
Tab. 1. Zastoupení jednotlivých cystických lézí Tab. 1: Types of cystic lesions presented 
Graf 3. Rozložení CL (non-neoplastické vs. neoplastické) Graph 3: Distribution of CLP (non-neoplastic vs. neoplastic) 
Graf 4. Rozložení ve skupině neoplastických CL Graph 4: Distribution in the subgroup of neoplastic CLP 
Kontingenční tabulky s výslednými hodnotami v Tab. 2 a 3 demonstrují senzitivitu, specificitu, pozitivní a negativní prediktivní hodnotu (PPV, NPV) a celkovou diagnostickou přesnost syntézy předoperačních nálezů při rozlišení mezi zánětlivou a neoplastickou CLP a mezi benigní a maligní afekcí.
Tab. 2. Efektivita rozlišení zánětlivé vs. neoplastické CL Tab. 2: Efficiency of distinguishing between inflammatory and neoplastic CLP 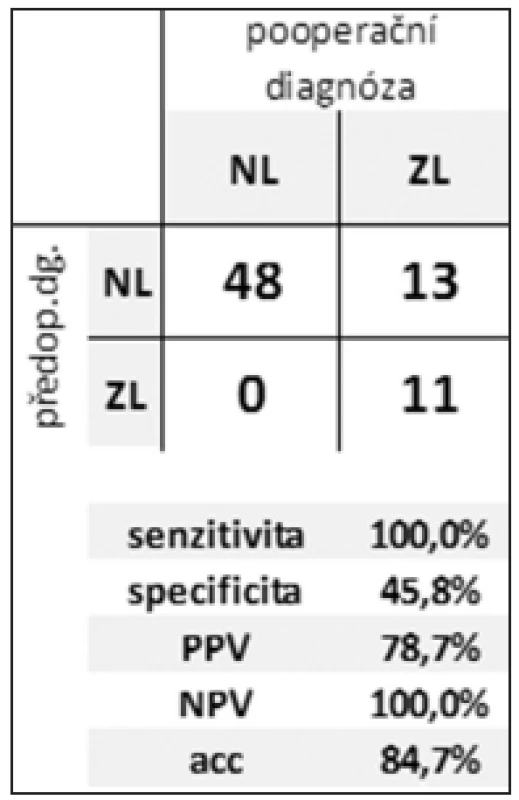
Tab. 3. Efektivita rozlišení benigní vs. maligní CL Tab. 3: Efficiency of distinguishing between benign and malignant CLP 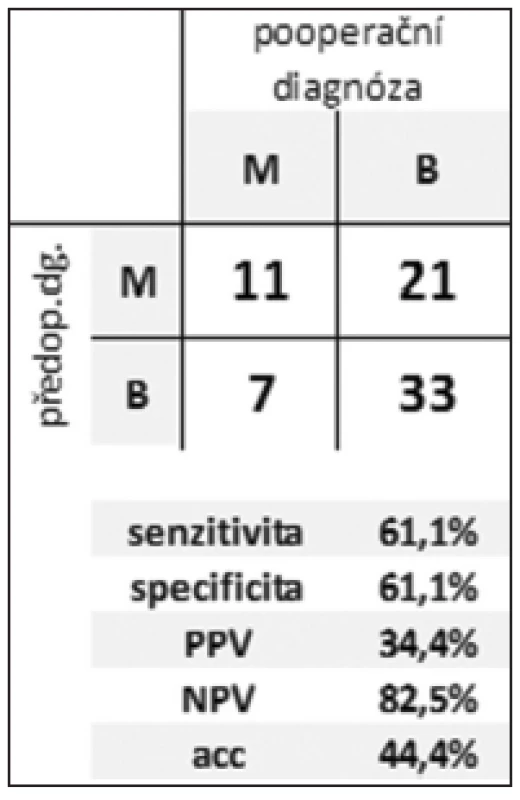
Diskuze
Cystické léze pankreatu patří spolu se solidními tumory, chronickou a akutní pankreatitidou mezi nejčastěji diagnostikované patologické změny pankreatické tkáně. Je pro ně charakteristická obtížná diferenciální diagnostika.
Prevalence cystických lézí se pohybuje mezi 2–15 %. Studie Laffana et al. hodnotila retrospektivně 2832 CT vyšetření u pacientů bez anamnézy pankreatopatie [1]. Prevalence CLP v této studii byla 2,6 %. Prevalenci 19,6 % uvádí studie Zhanga et al., která retrospektivně analyzovala vyšetření magnetickou rezonancí (MR) u 1444 pacientů [2]. Z této studie nebyli vyřazeni pacienti s anamnézou onemocnění slinivky břišní. Podle obou studií roste incidence s věkem.
Prevalence CLP se bude zvyšovat s rostoucí dostupností UZ a CT vyšetření. Vstupem komerční sféry do zdravotní péče vzroste i objem screeningových preventivních zobrazovacích vyšetření u asymptomatických pacientů a tím i incidence CLP [3].
Jediným kritériem CLP je nález defektu homogenity tkáně při zobrazení pankreatu. CLP vznikají regresivními – zánětlivými – změnami tkáně, traumatem nebo mohou být vrozené. Jde pak o non-neoplastické CLP, které nemají proliferativní potenciál. Stojí-li za vznikem CLP proliferace parenchymu nebo epitelu vývodného systému, hovoříme o neoplastických lézích. Ty mají různé biologické chování. Některé považujeme za prekancerózy. U části z nich dojde k maligní transformaci a patologem je pak karcinom in situ nebo invazivní karcinom nalezen v resekátu. To platí ponejvíce pro mucinózní cystické tumory, kam řadíme MCN a IPMN (4). Mucinózní CLP s maligním potenciálem jsou jasnou indikací k chirurgickému výkonu. Odlišení těchto lézí od ostatních je někdy obtížné a diferenciální diagnostika CLP není tak přesná, jak vzhledem k riziku resekčního výkonu požadujeme [5]. V současné době i při použití všech běžně dostupných vyšetřovacích metod indikujeme část nemocných k chirurgickému řešení léze bez rizika malignizace.
Pro diagnostiku CLP není abdominální UZ vhodné. Je nejen výrazně závislé na zkušenostech a schopnostech vyšetřujícího, ale přehlednost je ovlivněna i habitem pacienta, přítomností plynu ve střevech a artefakty okolních tkání. Ne vždy se daří při UZ zobrazit celý parenchym pankreatu. Nejpřínosnějším vyšetřením pro hodnocení morfologie pankreatické tkáně je počítačová tomografie s intravenózně podanou kontrastní látkou (CECT). Dobře zobrazí lokalizaci cysty, velikost, charakter cysty (makrocystické vs. mikrocystické ložisko), intramurální noduly, kalcifikace, dilataci vývodného systému a cévní struktury přilehlé k pankreatu [6]. I tak se diagnostická přesnost vyšetření pohybuje v širokém rozmezí 20–90 % v závislosti na posuzovaném kritériu [7]. MR a cholangiopankreatikografie magnetickou rezonancí (MRCP) umožňuje podrobnější charakteristiku cystické léze, navíc dává informaci o pankreatickém a žlučovém vývodném systému a případné komunikaci léze s pankreatickým vývodem [8,9]. V tomto směru je alternativou invazivního ERCP. To je indikováno tam, kde je nutné zajistit drenáž žlučových cest nebo pankreatického vývodu. Na druhou stranu obraz Vaterské papily může být patognomický pro IPMN. Pro posouzení morfologie vývodných systémů je MRCP bezpečnější alternativou. Podmínkou je ale správně technicky provedené vyšetření. ERCP je oproti tomu senzitivnější v rozlišení patologické komunikace ložiska s vývodným systémem [10].
Nezastupitelným vyšetřením v diagnostice CLP je endosonografie postavená na ultrazvukovém vyšetření tkáně slinivky transgastricky a transduodenálně z definovaných pozic. Dává informaci o parenchymu slinivky, přítomnosti chronické pankreatitidy, dobře popisuje velikost, charakter cystické léze, přítomnost sept, nodulů a kalcifikací. Rozšířením této diagnostické metody je možnost odběru tkáňových vzorků a obsahu cysty tenkojehlovou aspirací. Získaný aspirát je vyšetřován cytologicky k posouzení biologické aktivity léze, eventuálně i typu léze. Dále na přítomnost mucinu, jehož pozitivita je typická pro mucinózní cystické léze. V aspirátu se stanovuje aktivita amyláz a koncentrace CEA [10]. Experimentálně byl hodnocen přínos stanovení Ca 19-9, Ca 125, K-ras mutace nebo DNA analýzy. Ta ale, přes slibné výsledky, není zatím pro ekonomickou náročnost klinicky užívána [12].
Hlavním úkolem diferenciální diagnostiky cystických lézí pankreatu je odlišení non-neoplastických a neoplastických lézí. V další úrovni pak odlišení cystických mucinózních lézí, SPN, NET a cysticky změněného DAC od serózních lézí. Podstatou je identifikovat léze s rizikovým potenciálem [13]. A ty indikovat k chirurgické terapii nebo k dispenzarizaci [7]. V práci Fernandeze et al. dosahuje výskyt mucinózní léze až 58 % [14].
Onemocnění pankreatu v rodině (hereditární a autoimunitní CHP, kolagenózy), v osobní anamnéze (akutní pankreatitida, CHP) a anamnestický abusus alkoholu svědčí často pro chronické zánětlivé postižení parenchymu a ve většině případů i pro zánětlivou CLP. Incidence pseudocyst u chronické pankreatitidy se pohybuje mezi 20 % a 40 % [15]. V našem souboru byly zánětlivé léze v terénu CHP zastoupeny téměř jednou třetinou (32 %). U 13 (56 %) z 23 pacientů byl v osobní anamnéze zaznamenán údaj o AP nebo CHP. U ostatních nemocných byla zánětlivá etiologie potvrzena až histologickým vyšetřením. Zánětlivé CLP se na celkovém počtu podílejí 75–80 %. Tato výrazná převaha zánětlivých lézí platí pro celkovou incidenci CLP. V souborech pacientů operovaných je tento poměr pouze 10–30 %. Jde o pacienty, kteří jsou k chirurgickému výkonu indikováni buď pro výraznou symptomatologii CHP, nebo pro podezření na cystickou neoplázii. Většina nemocných s diagnostikovanou zánětlivou CLP je léčena konzervativně. Až 60 % pseudocyst spontánně regreduje. Zánětlivé léze jsou často velké 3–20 cm, s dobře ohraničenou stěnou, která je tvořena zánětlivou tkání a bez vlastní epitelové výstelky [16]. Velké ohraničené pankreatické nekrózy (WOPN) a pseudocysty vznikající nekrózou pankreatické nebo peripankreatické tkáně či disrupcí vývodu nepůsobí diagnostické obtíže. Problémy s určením léze mohou nastat u menších lézí uvnitř parenchymu slinivky (retenční a postnekrotická pseudocysta) nebo v případě komunikace s vývodným systémem slinivky, jež je typická pro IPMN.
V rozlišení CLP mohou napovědět i údaje o věku, pohlaví a lokalizaci léze. Serózní cystadenom se častěji vyskytuje u žen středního věku a nemá predilekci v lokalizaci [17]. V naší sestavě tvořil SCA 14 % všech cystických lézí. Z 10 pacientů byli jen dva muži. Častěji jsme jej nalezli v hlavě slinivky. Průměrná velikost byla 30 mm. SCA je benigní cystická léze prakticky bez maligního potenciálu, i když kazuistická sdělení o maligním charakteru existují (18). Jejich benigní charakter dovoluje konzervativní postup. I tak se ve většině sestav resekce pro CL objevuje pravidelně ve významném počtu. Indikací je zpravidla velikostní progrese, obava z mucinózní afekce nebo závažná symptomatologie [19].
MCA jako zástupce mucinózních CLP nalézáme typicky u žen středního věku s predilekcí lokalizace v těle a ocasu slinivky [20]. V našem souboru se MCA objevil u 12 nemocných. Z toho deset bylo žen. U jedné pacientky se jednalo o maligní variantu. Průměrný věk byl 58 let a průměrná velikost léze 59 mm. Jen ve dvou případech byl MCA lokalizovaný v hlavě.
IMPN je častější u mužů vyššího věku a je častěji lokalizována v hlavě [21]. My jsme ji nalezli u 6 pacientů. U dvou se jednalo o maligní variantu a u dalších dvou o „borderline“ lézi. Pět bylo mužů a 1 žena. Průměrný věk 66 let a průměrná velikost léze byla 27 mm. Vždy byla lokalizována v hlavě slinivky.
Solidní pseudopapilární neoplázie je vzácný cystický tumor postihující ženy mladého věku (medián 30 let). Může dosahovat i velkých rozměrů a nemá typickou predilekci lokalizace [22]. SPN roste nejprve jako solidní tkáňová expanze, během růstu dochází k sekundární cystické degeneraci a tumor získává charakter cystické léze. Maligní transformace se objevuje asi u 15 % nemocných [23]. My jsme identifikovali 5 těchto nálezů. Jednou šlo o maligní formu. Onemocněním trpělo 5 žen o průměrném věku 35 let. Průměrná velikost léze byla 60 mm.
Některá anamnestická data, charakteristiky pacienta a léze mohou pomoci v orientaci. Podrobnější pohled na diferenciální diagnostiku by měla nabídnout zobrazovací vyšetření a analýza aspirátu léze.
CECT a EUS vyšetření podstoupili v našem souboru všichni pacienti. Tam, kde klinická symptomatologie (ikterus, obstrukce GIT, recidivující AP) nebo závažný nález na CT (invazivní růst, „double duct sign“, kalcifikace ve stěně) či EUS (velikost cysty, přítomnost solidní tkáně, intramurální noduly) vedly k rozhodnutí o chirurgickém výkonu, jsme FNA neindikovali. V opačném případě doplnila EUS vyšetření. FNA byla v souboru součástí téměř 2/3 (61 %) EUS. Přestože má FNA potenciál přesně stanovit diagnózu, představuje také celou řadu úskalí. V práci De Jonga et al. bylo možné punktovat pouze 90 % CLP (příliš malá léze, nepříznivá lokalizace) [24]. Ze 128 provedených FNA jen 31 % cytologických nátěrů mělo dostatečnou kvalitu. U poloviny bylo možné stanovit CEA. Senzitivita a specificita vyšetření CEA v punktátu při rozlišení mucinózní a non-mucinózní léze je 73 %, respektive 84 %. Až 25 % mucinózních lézí má koncentraci CEA nižší než 192 μg/ml [17]. Koncentraci používanou pro potvrzení mucinózní léze s výše zmíněnou přesností. Stanovení aktivity amyláz a koncentrace CEA bylo v našem souboru provedeno ve 23 %, respektive v 41 %. Přínos těchto vyšetření byl pro diagnostickou rozvahu prakticky nulový. Podstatně přínosnější bylo vyšetření cytologické a stanovení mucinu, kde přítomnost mucinu odpovídala ve všech případech mucinózní lézi. Ne u všech mucinózních lézí byl ale mucin nalezen.
Základ zobrazení cystické léze na našem pracovišti tvoří CECT a EUS. FNA s analýzou aspirátu provádíme tam, kde není jasná symptomatologie nebo jiná indikace k chirurgickému výkonu. ERCP vyžadujeme tam, kde je nutná instrumentace v oblasti vývodného systému jater a/nebo pankreatu. Dříve jsme jej indikovali i pro zobrazení vývodného systému. To se v poslední době snažíme nahradit neinvazivním vyšetřením MR/MRCP. U nejasných nálezů v souladu s literárními zkušenostmi doplňujeme ERCP pro její větší přesnost [9].
EUS s FNA mohou vnést světlo do odlišení jednotlivých cystických neoplázií. Ale obtíže spojené s odběrem, jeho kvalitou, objemem získaného aspirátu a s nároky kladenými na endoskopistu a cytologa snižují efektivitu a přesnost vyšetření. To vede k nepříznivým hodnotám senzitivity a specificity.
Z výsledků uvedených v Tab. 1 a 2 plyne příznivá hodnota senzitivity pro odlišení zánětlivé a neoplastické léze. Senzitivita v posouzení biologického chování CL byla výrazně nižší. Nízká specificita v obou případech je zřejmě důsledkem tendence nadhodnocovat nálezy. V obou případech je vysoká efektivita negativní predikce.
Závěr
CLP jsou při koncentrování pacientů s nemocemi slinivky častým nálezem. Jde o různorodou skupinu histologických nálezů, z nichž některé považujeme za prekancerózy a jsou indikovány k chirurgické léčbě. Jejich odlišení je klíčovým úkolem diferenciální diagnostiky. Existence rizikových lézí je důvodem pro důkladné vyšetření každého nemocného s nálezem CLP. Běžně používaná vyšetření nemají potřebnou přesnost, jak dokumentuje naše práce. Nízké počty falešně negativních nálezů jsou způsobeny přirozenou tendencí nálezy nadhodnotit a vyvarovat se ohrožení pacienta. Efektivita vyšetření používaných u CLP se dá charakterizovat vyšší senzitivitou a nízkou specificitou. Proto část pacientů indikovaných k chirurgické léčbě ji podstupuje pro CLP benigních vlastností, které nepředstavují riziko. Nemocní této skupiny jsou tak ohroženi riziky resekčního výkonu. Proto by hodnocení CLP mělo být provedeno na základě všech potřebných a dostupných vyšetření, a to v místě, které se touto problematikou zabývá.
Zkratky:
CT – počítačová tomografie
EUS – endosonografie
MR – magnetická rezonance
MRCP – cholangiopankreatografie magnetickou rezonancí
ERCP – endoskopická retrográdní cholangiopankreatografie
SCA – serózní cystadenom
MCA – mucinózní cystadenom
IPMN – intraduktální papilární mucinózní neoplázie
SPN – solidní pseudopapilární neoplázie
NET – neuroendokrinní tumor
WOPN – walled of pancreatic necrosis
AMS – amylázy
CEA – karcino-embryonální antigen
Práce byla podpořena grantem IGA NT 13 263.
MUDr. Pavel Záruba
Chirurgická klinika 2. LF UK a ÚVN
U vojenské nemocnice 1200
162 00 Praha 6
e-mail: pavel.zaruba@uvn.cz
Zdroje
1. Laffan TA, Horton KM, Klein AP, Berlanstein B, Siegelman SS, et al. Prevalence of unsuspected pancreatic cysts on MDCT. AJR Am J Roentgenol 2008;191 : 802–7.
2. Zhang XM, Mitchell DG, Dohke M, Holland GA, Parker L. Pancreatic cysts: depiction on single-shot fast spin-echo MR images. Radiology 2002;223 : 547–53.
3. Spinelli KS, Fromwiller TE, Daniel RA, Kiely JM, Nakeeb A, et al. Komorowski RA,Wilson SD, Pitt HA. Cystic pancreatic neoplasms: observe or operate. Ann Surg 2004;239 : 651–7;
4. Tanaka M, Chari S, Adsay V, Fernandez-del Castillo C, et al. International Association of Pancreatology. International consensus guidelines for management of intraductal papillary mucinous neoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology 2006;6 : 17–32.
5. Kim CB, Ahmed S, Hsueh EC. Current surgical management of pancreatic cancer. J Gastrointest Oncol 2011;2 : 126–35.
6. Procacci C, Biasiutti C, Carbognin G, Accordini S, Bicego E, Guarise A, et al. Characterization of cystic tumors of the pancreas: CT accuracy. J Comput Assist Tomogr 1999;23 : 906–12.
7. Oh HC, Kim MH, Hwang CY, Lee TY, Lee SS, et al. Cystic lesions of the pancreas: challenging issues in clinical practice. Am J Gastroenterol 2008;103 : 229–39; quiz 228, 240. Epub 2007 Dec 11. Review.
8. Minami M, Itai Y, Ohtomo K, Yoshida H, Yoshikawa K, et al. Cystic neoplasms of the pancreas: comparison of MR imaging with CT. Radiology 1989;171 : 53–6.
9. Koito K, Namieno T, Ichimura T, Yama N, Hareyama M, et al. Mucin-producing pancreatic tumors: comparison of MR cholangiopancreatography with endoscopic retrograde cholangiopancreatography. Radiology 1998;208 : 231–7.
10. Yamao K, Nakamura T, Suzuki T, Sawaki A, Hara K, et al. Endoscopic diagnosis and staging of mucinous cystic neoplasms and intraductal papillary-mucinous tumors. J Hepatobiliary Pancreat Surg 2003;10 : 142–6.
11. Morris-Stiff G, Lentz G, Chalikonda S, Johnson M, Biscotti C, et al. Pancreatic cyst aspiration analysis for cystic neoplasms: mucin or carcinoembryonic antigen—which is better? Surgery 2010;148 : 638–44.
12. Sawhney MS, Devarajan S, O’Farrel P, Cury MS, Kundu R, et al. Comparison of carcinoembryonic antigen and molecular analysis in pancreatic cyst fluid. Gastrointest Endosc 2009;69 : 1106–10.
13. Farrell JJ, Fernández-del Castillo C. Pancreatic cystic neoplasms: management and unanswered questions. Gastroenterology 2013;144 : 1303–15.
14. Fernández-del Castillo C, Targarona J, Thayer SP, Rattner DW, Brugge WR, et al. . Incidental pancreatic cysts: clinicopathologic characteristics and comparison with symptomatic patients. Arch Surg 2003;138 : 427–3.
15. Warshaw AL, Rutledge PL. Cystic tumors mistaken for pancreatic pseudocysts. Ann Surg 1987;205 : 393–8.
16. Habashi S, Draganov PV. Pancreatic pseudocyst. World J Gastroenterol 2009;15 : 38–47. Review. PubMed PMID: 19115466.
17. Hutchins GF, Draganov PV. Cystic neoplasms of the pancreas: a diagnostic challenge. World J Gastroenterol 2009;15 : 48–54.
18. Zhu H, Qin L, Zhong M, Gordon R, Raoufi M, et al. Carcinoma ex microcystic adenoma of the pancreas: a report of a novel form of malignancy in serous neoplasms. Am J Surg Pathol 2012;36 : 305–10.
19. Khalpey Z, Rajab TK, Ashley SW. Serous cystadenoma causing the double duct sign. J Gastrointest Surg 2012;16 : 1282–3.
20. Thompson LD, Becker RC, Przygodzki RM, Adair CF, Heffess CS. Mucinous cystic neoplasm (mucinous cystadenocarcinoma of low-grade malignant potential) of the pancreas: a clinicopathologic study of 130 cases. Am J Surg Pathol 1999;23 : 1–16.
21. Azar C, Van de Stadt J, Rickaert F, DeviŹre M, Baize M, et al. Intraductal papillary mucinous tumours of the pancreas. Clinical and therapeutic issues in 32 patients. Gut 1996;39 : 457–64.
22. Brugge WR, Lewandrowski K, Lee-Lewandrowski E, Centeno BA, Szydlo T, et al. Diagnosis of pancreatic cystic neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology 2004;126 : 1330–6.
23. de Jong K, Bruno MJ, Fockens P. Epidemiology, diagnosis, and management of cystic lesions of the pancreas. Gastroenterol Res Pract 2012;2012 : 1-8.
24. de Jong K, Poley JW, van Hooft JE, Visser M, Bruno MJ, et al. Endoscopic ultrasound-guided fine-needle aspiration of pancreatic cystic lesions provils inadequate material for cytology and laboratory analysis: initial results from a prospective study. Endoscopy 2011;43 : 585–90.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2013 Číslo 12- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci?
- Je celkové přežití objektivním kritériem kvality chirurgické léčby kolorektálního karcinomu?
- K 80. narozeninám prim. MUDr. Vojtecha Blaška
- Opakované plicní resekce v chirurgii plicních metastáz
- Miniinvazivní videoasistovaná paratyreoidektomie (MIVAP) v terapii primární hyperparatyreózy (pHPT)
- Zvýšení kvality histopatologického hodnocení preparátů kolorektálního karcinomu prostřednictvím zavedení standardního protokolu
- Zemřel primář MUDr. Jiří Hamous
- Je přesná předoperační diagnostika cystických lézí pankreatu možná?
- K životnímu jubileu docenta Vladimíra Visokaie
- Retrospektívna analýza krátkodobých a strednodobých výsledkov perkutánnej endovaskulárnej liečby pacientov s aneuryzmou abdominálnej aorty
- Zdvojení žlučníku a duktus cystikus jako raritní nález při cholecystektomii – kazuistika
- Epiteliální cysta intrapankreaticky uložené akcesorní sleziny – kazuistika
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci?
- Epiteliální cysta intrapankreaticky uložené akcesorní sleziny – kazuistika
- Miniinvazivní videoasistovaná paratyreoidektomie (MIVAP) v terapii primární hyperparatyreózy (pHPT)
- Zdvojení žlučníku a duktus cystikus jako raritní nález při cholecystektomii – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



