-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaFarmakogenetika dabigatranu a sekundární prevence ischemické cévní mozkové příhody
Dabigatran pharmacogenetics and secondary prevention of ischemic stroke
Due to its proven safety and efficacy, the direct anticoagulant dabigatran is often the first choice in the secondary prevention of cardioembolic stroke in atrial fibrillation. The recommended dosage of 110 and 150 mg twice daily creates a variation in plasma levels within the therapeutic range in the treatment population. The inter-individual variability of these levels may be caused by polymorphisms of genes involved in drug transport and metabolism. Although the pharmacogenetic examination of some gene polymorphisms in the selection of drugs is currently implemented in routine clinical practice, the use of the genetic profile of patients treated with dabigatran in order to increase the safety of anticoagulant therapy is not yet part of the recommended procedures. We searched for published studies investigating polymorphisms of the CES1 and ABCB1 genes, which are involved in the absorption and metabolism of dabigatran. The most promising for clinical relevance is the rs2244613 polymorphism in the CES1 gene, which is associated with a decrease in dabigatran concentration and a lower risk of bleeding without a simultaneous increased risk of recurrence of ischemia. Carriers of the rs2244613 variant may significantly benefit from dabigatran treatment. The pharmacogenetics of dabigatran may be clinically beneficial for safer and more effective secondary prevention of cardioembolic stroke, but further clinical studies are required.
Keywords:
ischemic stroke – SNP – bleeding – personalized medicine – thrombosis – dabigatran – direct oral anticoagulants – Pharmacogenetics – embolism – ABCB1 – CES1
Autoři: A. Olšerová; P. Janský; T. Šrámková; A. Tomek
Působiště autorů: Neurologická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Cesk Slov Neurol N 2022; 85(4): 281-286
Kategorie: Přehledný referát
doi: https://doi.org/10.48095/cccsnn2022281Souhrn
Přímé antikoagulans dabigatran je vzhledem ke své prokázané bezpečnosti a účinnosti častou první volbou v sekundární prevenci kardioembolické CMP při fibrilaci síní. Vzhledem k používání pouze dvou fixních dávek (110 a 150 mg) dvakrát denně existuje v léčené populaci rozptyl plazmatických hladin v terapeutickém rozmezí. Právě tato interindividuální variabilita hladin může být zapříčiněna polymorfizmy genů účastnících se transportu a metabolizmu léčiva. Přestože je v současné době farmakogenetické vyšetření některých genových polymorfizmů při výběru léčiv implementováno do rutinní klinické praxe, využití genetického profilu pacientů léčených dabigatranem za účelem zvýšení bezpečnosti antikoagulační terapie zatím není součástí doporučených postupů. Vyhledali jsme dosud publikované studie zkoumající polymorfizmy genů CES1 a ABCB1, které se podílí na absorpci a metabolizmu dabigatranu. Pro současnou klinickou praxi je nejperspektivnější polymorfizmus rs2244613 v genu CES1, který je asociován s poklesem koncentrace dabigatranu a snížením rizika krvácení, bez současného zvýšení rizika recidivy ischemie. Nosiči varianty rs2244613 mohou výrazněji profitovat z léčby dabigatranem. Farmakogenetika dabigatranu může být klinicky přínosnou pro bezpečnější a efektivnější sekundární prevenci kardioembolické CMP, ale vyžaduje další klinické studie.
Klíčová slova:
trombóza – farmakogenetika – dabigatran – přímá perorální antikoagulancia – SNP – ischemická cévní mozková příhoda – hemoragie – embolizmus - personalizovaná terapie – ABCB1 – CES1
Úvod
Přímá perorální antikoagulancia (direct oral anticoagulants; DOAC) jsou v současnosti pilířem sekundární prevence kardioembolické ischemické CMP (iCMP) při prokázané nevalvulární fibrilaci síní (FiS). Mezi DOAC se řadí gatrany (dabigatran) a xabany (apixaban, rivaroxaban, edoxaban a betrixaban). Jejich mechanizmus účinku spočívá v přímé inhibici faktorů v koagulační kaskádě – u gatranů jde o přímou inhibici faktoru IIa (trombinu), u xabanů jde o faktor Xa (Stuartův faktor).
Dabigatran prokázal efektivitu v prevenci CMP a systémové embolizace ve studii RE-LY, kdy byl porovnáván s warfarinem. Celkem bylo do studie zařazeno 18 113 pacientů ve třech skupinách léčených warfarinem a dabigatranem v dávce 110 mg nebo 150 mg dvakrát denně [1]. Nižší dávka 110 mg ve studii RE-LY prokázala noninferioritu v prevenci CMP a systémové embolizace se současnou významnou redukcí intrakraniálních krvácení oproti warfarinu (0,38 % pacientů ročně zakrvácelo při léčbě warfarinem oproti 0,12 % krvácení na dabigatranu 110 mg; p < 0,001). Vyšší dávka 150 mg dabigatranu prokázala oproti warfarinu superioritu s redukcí relativního rizika dokonce na 66 % (95 % CI 0,53–0,82; p < 0,001) [1]. V současné době je dabigatran dle preskripčních omezení indikován v primární i sekundární prevenci kardioembolické iCMP u FiS v terapii nebo prevenci plicní embolie a hluboké žilní trombózy vč. trombózy mozkových splavů na základě výsledků studie RE-SPECT CVT [2,3]. Mimo hrazené indikace jsou ještě pozitivní data o dabigatranu u léčby u pacientů po bioprotetické náhradě chlopně [4] a při prevenci embolizace z intrakardiálních trombů [5].
U dabigatranu není na rozdíl od warfarinu nutná specifická titrace dávky za kontinuální monitorace jeho efektu. Na základě studií je v prevenci CMP používána pouze plná nebo redukovaná dávka. Otázkou stále zůstává, zda by výsledky dabigatranu ve studiích nebyly ještě lepší než ve studiích, kdyby se titrovala denní dávka na míru pro individuálního pacienta. Měření hladiny je v současnosti doporučeno pouze v případě komplikací léčby (krvácení, podezření na předávkování), nebo při selhání léčby (před aplikací intravenózní trombolýzy pro iCMP, při nutnosti akutního operačního výkonu nebo při podezření na non-compliance) [6].
Farmakogeneticky podmíněná interindividuální variabilita metabolizmu dabigatranu může způsobovat rozdíly v individuální hladině léku. Nižší hladina pak zvyšuje riziko ischemických příhod vč. iCMP, abnormálně zvýšená hladina naopak predisponuje ke krvácivým komplikacím. Tento článek shrnuje současné poznatky o nejdůležitějších genech účastnících se v metabolizmu dabigatranu (CES1 a ABCB1) a možnostech farmakogenetického vyšetření v klinické praxi cerebrovaskulárních poraden.
Metodika
Data a publikované články použité jako podklady pro sepsání tohoto přehledového článku byly v PubMed vyhledávány pod výrazy „dabigatran“, „farmacogenetics“, „polymorfism”. „CES1“, „ABCB1“, „direct oral anticoagulants”, všechny publikované do 30. 6. 2022. Do článku byly zařazeny studie, které současně vyšetřovaly farmakogenetiku a plazmatickou hladinu nebo klinický outcome. Všechny nalezené články s výše uvedenými daty jsou prezentovány v tab. 1 [7–17], žádný článek s klinickými daty nebyl vyloučen.
Tab. 1. Přehled základních charakteristik klinických studií farmakogenetiky dabigatranu. 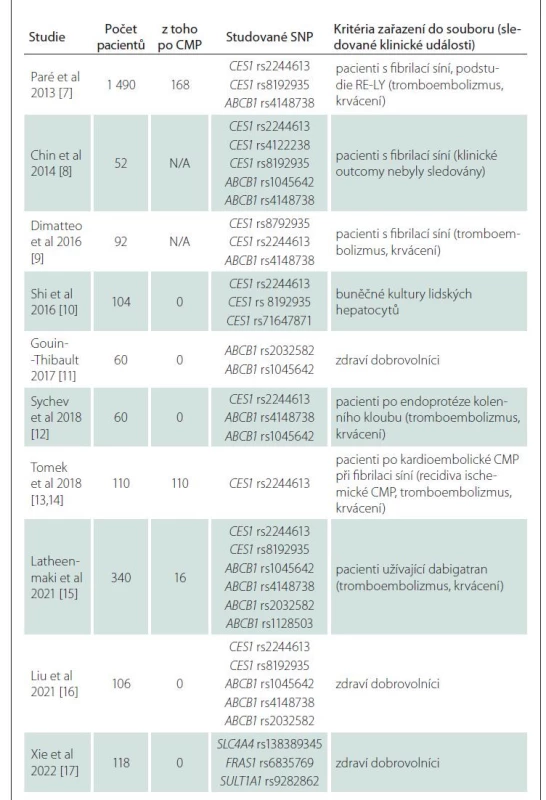
SNP – single nucleotide polymorphism Farmakokinetika a farmakodynamika dabigatranu
Dabigatran je přímý inhibitor trombinu podávaný perorálně ve formě proléčiva dabigatran etexilátu. Toto proléčivo je substrátem pro ATP dependentní efluxní transportérový membránový protein (pumpa), který je kódován genem ABCB1 (ATP Binding Cassette Subfamily B Member 1). V metabolizmu dabigatran etexilátu se podílí na jeho intestinální absorpci [7]. Poté je dabigatran etexilát zpracován hepatálními a střevními karboxylesterázami (izoforma CES1 a CES2, obě kódovány stejnojmennými geny – CES1, CES2), a to ve dvou krocích. Nejprve probíhá metabolizace intestinálním enzymem a následně enzymem hepatálním. CES2 je nejvíce zastoupen v tenkém střevě a menší míře v játrech, proto se tento protein více účastní prvního kroku zpracování [18]. Hepatální karboxylesteráza 1 (CES1) je enzym uložený v endoplazmatickém retikulu hepatocytů účastnící se detoxifikace xenobiotik hydrolýzou esterových a amidových proléčiv a v případě dabigatranu etexilátu jej zpracovává za vzniku metabolitů BIBR 951 a BIBR 1087 [18]. Tyto metabolity jsou poté hydrolýzou přeměněny na aktivní dabigatran [19,20].
Kromě CES1 a ABCB1 se metabolizmu dabigatranu v malé míře (< 10 %) účastní i UDP-glukuronyltransferázy (UGTs), přesněji UGT1A9, UGT2B7 a UGT2B15 [20].
Antikoagulační účinky dabigatranu vznikají díky reverzibilní blokádě volného trombinu, trombinu vázaného na fibrin a trombinem indukované agregace trombocytů. Jeho biologická dostupnost je 7 %, vazba dabigatranu na plazmatické proteiny je 35 % [21]. Maximální plazmatické koncentrace aktivního léčiva je dosaženo za 1–3 h po orálním příjmu proléčiva, plazmatický eliminační poločas je 12–17 h. Dabigatran a jeho metabolity jsou vylučovány převážně renálně (80–90 %), zbylá část žlučí [22,23].
Farmakogenetika CES1 a ABCB1
Polymorfizmy genů intestinálního transportního systému ABCB1 a hepatální esterázy CES1 metabolizující proléčivo na aktivní metabolit jsou dle současných poznatků jediné genetické varianty mající vliv na farmakokinetiku léčiva a následně ovlivňující plazmatickou hladinu dabigatranu [7].
Gen CES1 je umístěn na 16. chromozomu [24]. Pro CES1 bylo popsáno 2 000 polymorfizmů (single nucleotide polymorphism; SNP). V současné době existují rozporuplné výsledky studií zkoumající polymorfizmy tohoto genu [7–9].
Gen ABCB1 se nachází na chromozomu 7 a obsahuje 29 exonů [25]. Vliv variant v genu ABCB1 je většinou hodnocen jako méně významný proti variantám genu CES1 [26]. Nejběžnějšími polymorfizmy jsou rs1128503, rs2032582, rs1045642 a rs4148738 [27]. Několik z těchto zmíněných polymorfizmů se nachází ve vazbách a tvoří tak haplotypy [28]. Jedním z těchto variantních haplotypů, který se zdá být nejvýznamnějším pro evropskou populaci, je vazba polymorfizmů rs2032582 (G2677T/A) v exonu 21 a rs1045642 (C3435T) v exonu 26 [11].
Polymorfizmy a hladiny dabigatranu
První testování interindividuální variability dabigatranu publikovali Paré et al v roce 2013 v rámci studie RE-LY, kde podrobili 1 490 pacientů evropského původu celogenomové analýze (zahrnující 551 203 SNP), kterou následovala analýza polymorfizmů genu CES1 a ABCB1. Nejvlivnějším detekovaným SNP byl rs2244613 v intronové oblasti genu CES1 (transverze G > T), kdy heterozygoti pro variantu měli o 15 % a homozygoti o 28 % nižší minimální plazmatickou hladinu oproti wild type pacientům. Další polymorfizmus v genu CES1 s významným vlivem na koncentraci dabigatranu je rs8192935. V případě tohoto polymorfizmu se však jedná o plazmatickou koncentraci maximální, která se u nosičů této alely vyskytuje s poklesem o 12 % [7].
Dále se studiu polymorfizmů věnovala i novozélandská studie s 52 pacienty v roce 2014, zkoumající polymorfizmy rs2244613, rs4122238 a rs8192935 v genu CES1 a jejich využití při predikci hladiny a následně úpravy dávky léčiva. Dle výsledků studie se však žádný polymorfizmus jako prediktivní marker nepotvrdil [8]. O dva roky později, v roce 2016, publikovali Shi et al výsledky in vitro studie na vzorcích lidských jater s cílem zjištění loss-of-function CES1 na základě jednotlivých SNP genu CES1. SNP rs2244613 ani rs8192935 významně neměnily hladinu aktivního metabolitu, nicméně SNP rs71647871, díky kterému CES1 svou funkci ztrácí, je v konečném důsledku spojen s poklesem hladiny dabigatranu [10]. Ve stejném roce byl v italské studii, čítající 92 pacientů, pozorován vliv SNP rs8192935 na snížení minimální hladiny dabigatranu [9].
Přestože i v předchozích studiích byly testovány polymorfizmy genu ABCB1 (tab. 2) [7,9,11–16], až v roce 2016 byl studován izolovaně bez SNPs CES1. Studie pracovala s údaji 60 zdravých dobrovolníků, kteří byli na rozdíl od ostatních studií vyselektováni podle nosičství variantního genotypu polymorfizmů rs2032582 a rs1045642 (studovány jako jeden variantní haplotyp) – 20 wild type, 20 heterozygotů a 20 homozygotů. Oproti wild type pacientům měli variantní heterozygoti o 13 % a variantní homozygoti o 33 % vyšší plazmatické koncentrace [11]. Tento vliv potvrdila metaanalýza Xie et al v roce 2018, která zahrnovala 13 klinických studií s celkovým počtem 3 144 pacientů. Maximální koncentrace dabigatranu u wild type homozygotních přenašečů pro rs1045642 a rs2032582 ABCB1 byly nižší než u homozygotních mutantních přenašečů [29]. Předpokládaný vliv rs4148738, který byl diskutován v minulosti, nebyl v této metaanalýze potvrzen [7,29].
Tab. 2. Přehled frekvencí SNP, ovlivnění hladiny a klinických událostí.
Statisticky významné výsledky p <0,05 jsou označeny *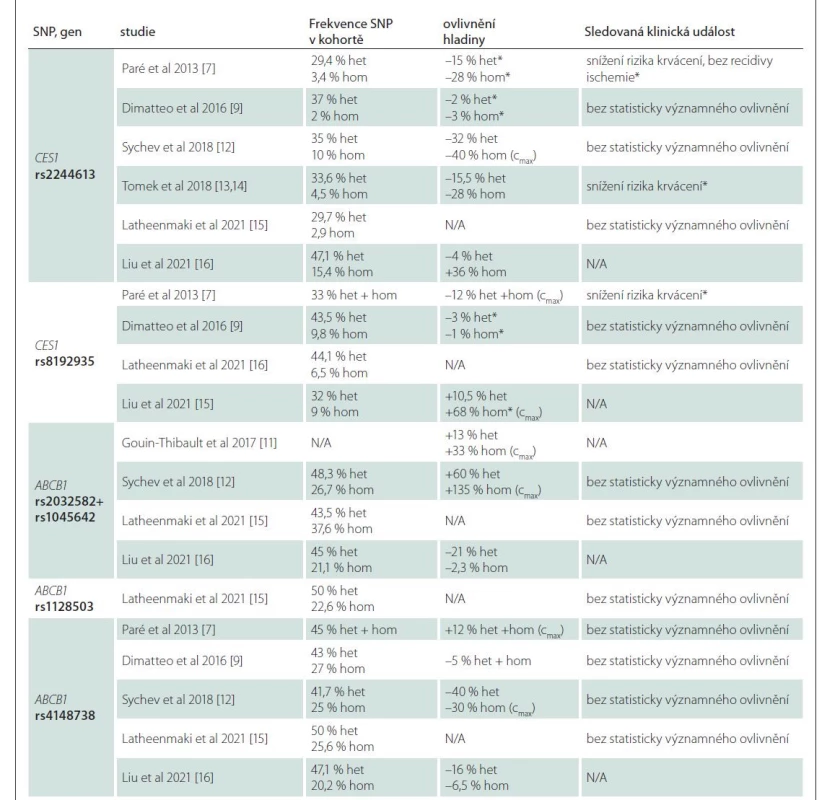
(cmax) – vrcholová hladina (pokud není označeno, byla hodnocena hladina minimální); het – heterozygot pro sledovanou alelu; hom – homozygot pro sledovanou alelu; N/A – nedostupné; SNP – single nucleotide polymorphism Z recentních studií lze zmínit např. práci Liu et al z roku 2021, která porovnávala rozdíly mezi čínskou a kavkazskou populací. Kromě faktu, že existují rozdíly v četnosti polymorfizmů genu CES1, bylo na vzorku oproti předchozím výzkumům překvapivě zjištěno, že polymorfizmus CES1 rs8192935 je spojen s vyšší hladinou dabigatranu [15].
V roce 2021 byl testován rozsáhlý vzorek finských pacientů (celkový počet 1 806, z toho 340 pacientů užívajících dabigatran) na genetické varianty genů ABCG2, ABCB1, CES1 a CYP3A5. Statisticky významné zvýšení či snížení hladiny dabigatranu na podkladě jednotlivých polymorfizmů však zjištěno nebylo, stejně tak nebyl potvrzen ani klinický efekt stran zvýšení bezpečnosti či rizika [16].
V malé čínské studii Xie et al z roku 2022 byly u 118 zdravých dobrovolníků po požití jedné dávky dabigatranu identifikovány další možné polymorfizmy nových kandidátních genů, které mohou ovlivňovat hladinu dabigatranu – SLC4A4 SNP rs138389345, FRAS1 SNP rs6835769 a SULT1A1 SNP rs9282862. Jejich klinický význam ale zatím studován nebyl [17].
Farmakogenetika dabigatranu a komplikace léčby
Jasná shoda panuje ve skutečnosti, že vyšší hladina dabigatranu zvyšuje riziko krvácení, a naopak nižší hladina zvyšuje riziko ischemických událostí [7]. V datech ze studie RE-LY byla tato závislost demonstrována již v roce 2014 [30]. Jak jsme ukázali výše, farmakogenetika ovlivňuje individuální hladinu léku. To by znamenalo, že s použitím farmakogenetiky můžeme optimalizovat hladinu léku přesně na míru individuálnímu pacientovi a snížit tak riziko komplikací léčby. Zatím však máme relativně málo dat, která se tuto hypotézu snažila ověřit. Přehled základních charakteristik všech publikovaných studií je uveden v tab 1. Pouze pět z nich se věnovalo korelacím klinických outcomů pacientů, hladin léčiva a jednotlivých polymorfizmů (tab. 2).
V genetické substudii RE-LY byl pozorován pouze nevýznamný trend k poklesu výskytu iCMP a systémové embolizace u SNP rs4148738 v genu ABCB1 a SNP rs2244613 a rs8192935 v genu CES1. Tato studie poskytla významné výsledky pro redukci celkového rizika krvácení (významného i nevýznamného) u nosičů rs2244613 v genu CES1 (OR = 0,67, 95 % CI 0,55–0,82; p < 0,00001) [7]. Tento výsledek jsme potvrdili i v naší pilotní studii, kde jsme analyzovali data 110 pacientů léčených dabigatranem po kardioembolické CMP. Nosiči protektivního polymorfizmu rs2244613 v genu CES1 měli významně nižší pravděpodobnost, že u nich dojde při léčbě k rozvoji krvácivých komplikací nebo předávkování dabigatranem s minimální plazmatickou koncentrací (12 h po podání léku) vyšší než 300 ng/ml (HR 0,124; 95 % CI 0,02–0,96; p = 0,046). Stejně jako Paré et al jsme nenašli rozdíl ve výskytu iCMP [13,14].
Kromě těchto zmíněných studií se vlivu polymorfizmu rs4148738 a rs1045642 ABCB1 a rs2244613 genu CES1 věnovali v roce 2018 Sychev et al na vzorku 60 pacientů léčených dabigatranem v profylaxi hluboké žilní trombózy po náhradě kolenního kloubu. U homozygotních přenašečů polymorfizmu rs1045642 genu ABCB1 byla zjištěna vyšší maximální koncentrace dabigatranu, která byla spojena s vyšším rizikem krvácení. U ostatních polymorfizmů žádné statisticky významné změny v hladinách zjištěny nebyly [12]. Další tři studie nenašly významné změny v efektivitě a komplikacích léčby [9,16]. Detaily jsou uvedeny v tab. 2.
Diskuze
Farmakogenetika je jen jednou z mnoha možných příčin variability. Jednou z možných příčin jsou lékové interakce při podávání induktorů či inhibitorů cytochromu 450 nebo P-glykoproteinu. Dabigatran je substrátem pro P-glykoprotein, lze očekávat ovlivnění koncentrace při konkomitantním užíváním jejich induktorů a inhibitorů [2,10,22]. Přestože se CYP450 metabolizmu dabigatranu neúčastní, v supraterapeutických koncentracích může být dabigatranem inhibován (in vitro při 100 µm: inhibice CYP3A4 a CYP2E1) [21,22]. Toto ovlivnění je nutné brát v potaz při hodnocení sérových hladin léčiv.
Dalším faktorem, který velmi významně ovlivňuje hladinu a efekt léčiva, je compliance pacienta. Špatná compliance byla pozorována po jednom roce léčby dabigatranem u 28 % pacientů [31], velikost efektu noncompliance pak může maskovat eventuální slabší vliv farmakogenetiky u konkrétního pacienta.
Zajímavým fenoménem publikovaných studií může být relativně odlišná skladba zkoumaných souborů z pohledu míry rizika nežádoucích událostí. Pacienti po kardioembolické iCMP při fibrilaci síní jsou typickou skupinou s nejvyšším rizikem ischemických i krvácivých komplikací. Studie, které měly nejvyšší zastoupení těchto pacientů, měly relativně nejvýznamnější klinické výsledky [7,13,14].
Významným faktorem absence dostatečně významných dat z klinických studií může být neexistence podpory, nebo dokonce povinnosti poregistračních farmakogenetických studií. Firma, která vyvíjí a následně registruje nové léčivo, je povinna provést základní farmakogenetickou studii. Ta byla v případě dabigatranu publikována Parém už v roce 2013 [7]. Od té doby máme k dispozici už jen velmi malé akademické studie, které se tímto fenoménem zabývají. Pokud by byl Parého et al nález protektivního polymorfizmu rs2244613 v genu CES1 potvrzen, umožnil by selekci podskupiny pacientů, která by z léčby profitovala ještě více než neselektovaná populace léčená v současnosti.
Návrh praktického postupu na základě současných dat
Vzhledem k malému počtu provedených case-control studií stále neexistují dostatečná data podporující klinické využití polymorfizmů, a proto mají tyto SNPs v databázi PharmGKB označení úrovní s nízkou hladinou důkazů (level 3 – low evidence) [32]. Jediným polymorfizmem, jehož vyšetření by bylo možné v klinické praxi využít, je tedy v současnosti rs2244613 v genu CES1, a to na základě práce využívající metodu AGREE (Appraisal of Guidelines, Research, and Evaluation) z roku 2015, která sledovala korelaci farmakogenetických variant a klinických výstupů [33].
Na základě současných znalostí vyšetřujeme na našem pracovišti všechny pacienty indikované k zahájení léčby DOAC na přítomnost polymorfizmu rs2244613 genu CES1. Přítomnost polymorfizmu pak vede k preferenci dabigatranu. Pokud není přítomen, můžeme zvolit jakékoli přímé antikoagulans. Samozřejmě vždy zvažujeme další individuální faktory daného pacienta, jako jsou přítomnost a významnost renální insuficience, zvýšené riziko gastrointestinálního krvácení a individuální historie tolerance jednotlivých DOAC.
Závěr
Ačkoli se dabigatran vyznačuje předvídatelnou farmakodynamikou a farmakokinetikou, vykazuje určitý stupeň interindividuální variability. Výsledky dosud provedených studií naznačují nepopiratelný vliv individuální genetické výbavy na farmakokinetiku dabigatranu, nicméně zatím neexistuje odborné doporučení k vyšetřování polymorfizmů genů CES1 a ABCB1 k následné optimalizaci terapie.
Jediným polymorfizmem, jehož vyšetření je možné v klinické praxi využít, je CES1 rs2244613. Vyšetřování jiných genetických polymorfizmů má zatím nedostatečnou úroveň důkazů na to, aby byla umožněna implementace farmakogenetického testování v klinické praxi. Proto je nutné ve studiích pokračovat, a to zejména napříč různými etnickými skupinami s dostatečným počtem pacientů ve všech testovaných skupinách. Výsledkem by mohla být ještě větší bezpečnost léčby našich pacientů po CMP.
doc. MUDr. Aleš Tomek, Ph.D., FESO
Neurologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: ales.tomek@gmail.com
Přijato k recenzi: 9. 7. 2022
Přijato do tisku: 18. 8. 2022
Zdroje
1. Connolly SJ, Ezekowitz MD, Yusuf S et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361 (12): 1139–1151. doi: 10.1056/NEJM - oa0905561.
2. Ferro JM, Coutinho JM, Dentali F et al. RE-SPECT CVS Study Group. Safety and efficacy of dabigatran etexilate vs dose-adjusted warfarin in patients with cerebral venous thrombosis: a randomized clinical trial. JAMA Neurol 2019; 76 (12): 1457–1465. doi: 10.1001/jamaneurol.2019.2764.
3. Wang D, Johnson AD, Papp AC et al. Multidrug resistance polypeptide 1 (MDR1, ABCB1) variant 3435C>T affects mRNA stability. Pharm Genom 2005; 15 : 693–704. doi: 10.1097/01.fpc.0000178311.02878.83.
4. Durães AR, de Souza Roriz P, de Almeida Nunes B et al. Dabigatran versus warfarin after bioprosthesis valve replacement for the management of atrial fibrillation postoperatively. Drugs R D 2016; 16 (2): 149–154. doi: 10.1007/s40268-016-0124-1.
5. Robinson AA, Trankle CR, Eubanks G et al. Off-label use of direct Oral anticoagulants compared with warfarin for left ventricular thrombi. JAMA Cardiol 2020; 5 (6): 685–692. doi: 10.1001/jamacardio.2020.0652.
6. Pradaxa: summary of product characteristics. [online]. Available from URL: https: //www.ema.europa.eu/en/documents/productinformation/pradaxa-epar-product-information_en.pdf.
7. Paré G, Eriksson N, Lehr T et al. Genetic determinants of dabigatran plasma levels and their relation to bleeding. Circulation 2013; 127 (13): 1404–1412. doi: 10.1161/CIRCULATIONAHA.112.001233.
8. Chin PK, Wright DF, Zhang M et al. Correlation between trough plasma dabigatran concentrations and estimates of glomerular filtration rate based on creatinine and cystatin C. Drugs in R&D 2014; 14 (2): 113–123. doi: 10.1007/s40268-014-0045-9.
9. Dimatteo C, Andrea G, Vecchione G et al. Pharmacogenetics of dabigatran etexilate interindividual variability. Thromb Res 2016; 144 : 1–5. doi: 10.1016/j.thromres.2016.05.025.
10. Shi J, Wang X, Nguyen JH et al. Dabigatran etexilate activation is affected by the CES1 genetic polymorphism G143E (rs71647871) and gender. Biochem Pharmacol 2016; 119 : 76–84. doi: 10.1016/j.bcp.2016.09. 003.
11. Gouin-Thibault I, Delavenne X, Blanchard A et al. Interindividual variability in dabigatran and rivaroxaban exposure: contribution of ABCB1 genetic polymorphisms and interaction with clarithromycin. J Thromb Haemost 2017; 15 (2): 273–283. doi: 10.1111/jth.13577.
12. Sychev DA, Levanov AN, Shelekhova TV et al. The impact of ABCB1 (rs1045642 and rs4148738) and CES1 (rs2244613) gene polymorphisms on dabigatran equilibrium peak concentration in patients after total knee arthroplasty. Pharmgenomics Pers Med 2018; 11 : 127–137. doi: 10.2147/PGPM.S169277.
13. Tomek A, Olšerová A, Boudníková A et al. The correlation of through plasmatic concentration of dabigatran and CES1 genotype with major bleeding complications in stroke patients [abstract]. Stroke 2018; 49 (Suppl_1): TMP110. doi: 10.1161/str.49.suppl_1.TMP110.
14. Tomek A, Olšerová A, Janský P et al. Predictors of clinically relevant bleeding and overdose in prospectively followed cohort of dabigatran treated stroke patients [abstract]. Eur Stroke J 2018; 3 (1S): 535.
15. Lähteenmäki J, Vuorinen AL, Pajula J et al. Pharmacogenetics of bleeding and thromboembolic events in direct oral anticoagulant users. Clin Pharmacol Ther 2021; 110 (3): 768–776. doi: 10.1002/cpt.2316.
16. Liu Y, Yang C, Qi W et al. The impact of ABCB1 and CES1 polymorphisms on dabigatran pharmacokinetics in healthy chinese subjects. Pharmacogenomics Pers Med 2021; 14 : 477–485. doi: 10.2147/PGPM.S291 723.
17. Xie Q, Li Y, Liu Z et al. SLC4A4, FRAS1, and SULT1A1 genetic variations associated with dabigatran metabolism in a healthy chinese population. Front Genet 2022; 13 : 873031. doi: 10.3389/fgene.2022.873031.
18. Laizure SC, Parker RB, Herring VL et al. Identification of carboxylesterase-dependent dabigatran etexilate hydrolysis. Drug Metab Dispos 2013; 42 (2): 201–206. doi: 10.1124/dmd.113.054353.
19. Ganetsky M, Babu KM, Salhanick SD et al. Dabigatran: review of pharmacology and management of bleeding complications of this novel oral anticoagulant. J Med Toxicol 2011; 7 (4): 281–287. doi: 10.1007/s13181-011-0178-y.
20. Ishiguro N, Kishimoto W, Volz A et al. Impact of endogenous esterase activity on in vitro p-glycoprotein profiling of dabigatran etexilate in Caco-2 monolayers. Drug Metab Dispos 2014; 42 (2): 250–256. doi: 10.1124/dmd.113.053561.
21. Blech S, Ebner T, Ludwig-Schwellinger E et al. The metabolism and disposition of the oral direct thrombin inhibitor, dabigatran, in humans. Drug Metab Dispos 2008; 36 (2): 386–399. doi: 10.1124/dmd.107.019 083.
22. Ufer M. Comparative efficacy and safety of the novel oral anticoagulants dabigatran, rivaroxaban and apixaban in preclinical and clinical development. Thromb Haemost 2010; 103 (3): 572–585. doi: 10.1160/TH09-09 - 0659.
23. Stangier J, Clemens A. Pharmacology, pharmacokinetics, and pharmacodynamics of dabigatran ete - xilate, an oral direct thrombin inhibitor. Clin Appl Thromb Hemost 2009; 15 (Suppl 1): 9S–16S. doi: 10.1177/1076029 609343004.
24. Merali Z, Ross S, Paré G. The pharmacogenetics of carboxylesterases: CES1 and CES2 genetic variants and their clinical effect. Drug Metabol Drug Interact 2014; 29 (3): 143–151. doi: 10.1515/dmdi-2014-0009.
25. Bodor M, Kelly EJ, Ho RJ et al. Characterization of the human MDR1 gene. AAPS J 2005; 7 (1): E1–E5. doi: 10.1208/aapsj070101.
26. Clinical pharmacology and biopharmaceutics review of Pradaxa. [online]. Available form URL: https: // www.accessdata.fda.gov/drugsatfda_docs/nda/2010/ 022512Orig1s000ClinPharmR_Corrrected%203.11.2011.pdf.
27. Sherry ST, Ward MH, Kholodov M et al. dbSNP: The NCBI database of genetic variation. Nucleic Acids Res 2001; 29 (1): 308–311. doi: 10.1093/nar/29.1.308.
28. Kim RB, Leake BF, Choo EF. et al. Identification of functionally variant MDR1 alleles among European Americans and African Americans. Clin Pharmacol Ther 2001; 70 (2): 189–199. doi: 10.1067/mcp.2001.117412.
29. Xie Q, Xiang Q, Mu G et al. Effect of ABCB1 genotypes on the pharmacokinetics and clinical outcomes of new oral anticoagulants: a systematic review and meta-analysis. Curr Pharm Des 2018; 24 (30): 3558–3565. doi: 10.2174/1381612824666181018153641.
30. Reilly PA, Lehr T, Haertter S et al. The effect of dabigatran plasma concentrations and patient characteristics on the frequency of ischemic stroke and major bleeding in atrial fibrillation patients: the RE-LY Trial (Randomized Evaluation of Long-Term Anticoagulation Therapy). J Am Coll Cardiol 2014; 63 (4): 321–328. doi: 10.1016/j.jacc.2013.07.104.
31. Shore S, Carey EP, Turakhia MP et al. Adherence to dabigatran therapy and longitudinal patient outcomes: insights from the veterans health administration. Am Heart J 2014; 167 (6): 810–817. doi: 10.1016/j.ahj.2014. 03.023.
32. Pharmacogenomics Knowledgebase (PharmGKB). [online]. Available from URL: https: //www.pharmgkb.org/chemical/PA165110351/clinicalAnnotation.
33. Kaufman AL, Spitz J, Jacobs M et al. evidence for clinical implementation of pharmacogenomics in cardiac drugs. Mayo Clin Proc 2015; 90 (6): 716–729. doi: 10.1016/j.mayocp.2015.03.016.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2022 Číslo 4- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Editorial
- Farmakogenetika dabigatranu a sekundární prevence ischemické cévní mozkové příhody
- Validace dotazníku pro hodnocení dopadu cévní mozkové příhody – česká verze Stroke Impact Scale 3.0
- Telemedicínské vyšetření kognitivními testy ALBA, POBAV a ACE-III
- Účinky výtažku Ditan Tongmai v kombinaci s akupunkturou na rekonvalescenci po cévní mozkové příhodě hodnocené na základě elektroencefalogramu
- Analýza variability srdeční frekvence během head-up tilt testu v diagnostice reflexních synkop – přehled problematiky a vlastní zkušenosti
- Management deliria v neurointenzivní péči v České republice – dotazníková studie
- Patologické nálezy na zobrazení pomocí magnetické rezonance u onemocnění asociovaného s pozitivními protilátkami proti myelinovému oligodendrocytárnímu glykoproteinu
- Post-COVID-19 vývoj chronické zánětlivé demyelinizační polyneuropatie s akutním začátkem léčené rituximabem
- Zemřel profesor Zdeněk Mraček
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Validace dotazníku pro hodnocení dopadu cévní mozkové příhody – česká verze Stroke Impact Scale 3.0
- Telemedicínské vyšetření kognitivními testy ALBA, POBAV a ACE-III
- Patologické nálezy na zobrazení pomocí magnetické rezonance u onemocnění asociovaného s pozitivními protilátkami proti myelinovému oligodendrocytárnímu glykoproteinu
- Management deliria v neurointenzivní péči v České republice – dotazníková studie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



